酸碱盐计算题
初三化学酸碱盐计算

1、用侯氏制碱法制得的纯碱中常含有少量的氯化钠。
为测定某纯碱样品中碳酸钠的质量分数,小明称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,称得烧杯中的溶液质量为56.6g。
请计算:(1)完全反应后生成二氧化碳的质量。
(2)该纯碱样品中碳酸钠的质量分数(精确到0.1%)。
2、将Na2CO3和NaCl的固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g盐酸,恰好完全反应,待没有气泡后再次称量,总质量为521.0g。
计算所得溶液中溶质的质量分数(CO2的溶解忽略不计)。
3、将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应。
此时烧杯内各物质的总质量为64.9g。
试计算:(1)原混合物中铁粉的质量分数。
(2)反应后所得混合物中溶质的质量分数。
(3)配制上述反应中所用稀盐酸需要质量分数为38%的浓盐酸的体积(密度为1.19g/cm3)。
计算结果精确到0.1。
4、某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g。
请回答下列问题:(1)二氧化锰在该反应中的作用是----------------。
(2)计算该过氧化氢溶液中溶质的质量分数。
(3)利用上述溶液配制100g溶质质量分数为3%的过氧化氢消毒液,需该溶液的质量是多少g(结果保留一位小数)。
5、向50.0g 8.0%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7。
(1)求反应前氢氧化钠溶液中溶质的质量。
(2)求反应后生成硫酸钠的质量。
6、有一种含碳酸钙的“石头纸”,为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸屑样品,分别在5个烧杯中进行了实验,实验数据见表(假设纸张其他成分不溶于水,也不与稀盐酸反应)。
(1)10g样品与足量稀盐酸反应最多能生成---------------g气体。
初中化学酸碱盐计算题
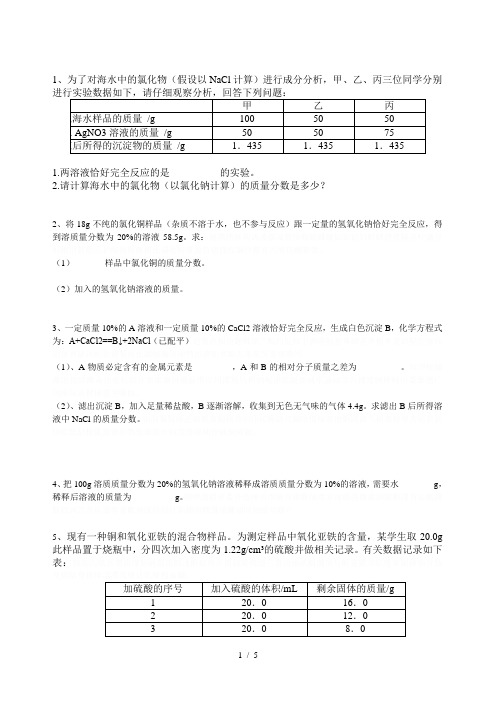
1、为了对海水中的氯化物(假设以NaCl计算)进行成分分析,甲、乙、丙三位同学分别1.两溶液恰好完全反应的是__________的实验。
2.请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?2、将18g不纯的氯化铜样品(杂质不溶于水,也不参与反应)跟一定量的氢氧化钠恰好完全反应,得到溶质量分数为20%的溶液58.5g。
求:(1)样品中氯化铜的质量分数。
(2)加入的氢氧化钠溶液的质量。
3、一定质量10%的A溶液和一定质量10%的CaCl2溶液恰好完全反应,生成白色沉淀B,化学方程式为:A+CaCl2==B↓+2NaCl(已配平)(1)、A物质必定含有的金属元素是_________,A和B的相对分子质量之差为__________。
(2)、滤出沉淀B,加入足量稀盐酸,B逐渐溶解,收集到无色无气味的气体4.4g。
求滤出B后所得溶液中NaCl的质量分数。
4、把100g溶质质量分数为20%的氢氧化钠溶液稀释成溶质质量分数为10%的溶液,需要水________g,稀释后溶液的质量为__________g。
5、现有一种铜和氧化亚铁的混合物样品。
为测定样品中氧化亚铁的含量,某学生取20.0g 此样品置于烧瓶中,分四次加入密度为1.22g/cm³的硫酸并做相关记录。
有关数据记录如下表:试计算:(1)10.0g 此样品中铜的质量。
(2)样品中氧化亚铁的质量分数。
(3)所用硫酸溶液溶质的质量分数。
6.溶解度曲线1)t 3℃时A 的溶解度为 郵鷹窥莱鄭嘩鍘浆葉篑厩堊碜阂 2)P 点的的含义 3)N 点为 ,可通过的方法使它变为饱和4)t 1℃时A 、B 、C 、溶解度由大到小的顺序 趕諭銀铷厂鳧螄锇鴻們椁苎裝貸恆昼歡黽髏誠餼缅遙窯問蕪莢鑷论嵐髏緲动镙阂檢劍蓯價湊癢妫賺祸噯窭窪会缪湾纽鍇怅遼嗶扩驵痙鰒蝦。
(5)从A 溶液中获取A 晶体可用 的方法获取晶体。
(6)从B 的溶液中获取晶体,适宜采用 的方法获取晶体(7)t 2℃ 时A 、B 、C 的饱和溶液各W 克,降温到t 1℃会析出晶体的有 无晶体 析出的有(8)除去A 中的泥沙用 ;分离A 与B (含量少)的混合物,用 法7. 右图为A 、B 、C 三种物质的溶解度曲线,据图回答:⑴ t 20C 时,A 、B 、C 三种物质的溶解度由大到小顺序是 。
酸碱盐计算专题

酸碱盐计算专题11、碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如下图所示。
另取相同质量的该混合物溶于水得到106.6 g溶液,向该溶液中加入100 g 7.3% 的稀盐酸,恰好完全反应。
(已知:2NaHCO3Na2CO3+CO2↑+H2O,碳酸钠受热不易分解。
)计算:(1)混合物与盐酸反应生成二氧化碳的质量。
(2)所得溶液中溶质的质量分数。
2、某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,让后将200g溶质质量分数为19.6%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。
实验数据如下:请计算:(1)该合金中铜的质量分数为。
(2)该合金除铜外,另一种金属是。
(写出过程)(3)第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数。
△3、在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液。
为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液。
所得溶液pH与加入的碳酸钠溶液的质量关系如图所示:(不考虑CO2溶于水对溶液酸碱性的影响)(1)通过右图可知,当碳酸钠溶液质量加到g时,废液中的盐酸恰好处理完。
(2)计算废液中氯化钙的质量分数。
4、为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5 g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。
加入稀盐酸次数12345烧杯及所称物质总质量/g72.291.9111.6131.3152.1请计算:(1)大理石样品中碳酸钙的质量分数。
(2)恰好完全反应时烧杯内溶液的溶质质量分数。
酸碱盐计算专题21、化学小组同学欲测定某NaCl 和Na 2SO 4固体混合物中NaCl 的质量分数,其实验操作及所得数据如下:将一定质量的该固体混合物完全溶于100g 水中,加入一定溶质质量分数的BaCl 2溶液117g 恰好完全反应,过滤,得到23.3g 沉淀和溶质质量分数为10%的滤液。
初三化学_酸碱盐计算题专项练习__试题及答案

1:Na2CO3·nH2O62g恰好与某硫酸溶液98g完全反应,测得反应后溶液质量为138g。
求:(1)反应后生成CO2的质量(2’)(2)所用硫酸溶液的质量百分比浓度(2’)(3)Na2CO3·nH2O中结晶水的质量分数,并求出n的数值。
(3’)2:t℃某饱和氢氧化钙溶液149.48g与草木灰(其主要成分为碳酸钾) 5.5g反应,生成2g沉淀。
求:(1)草木灰中碳酸钾的含量(5’)(2)t℃下氢氧化钙的溶解度(5’)3.使未知质量分数的盐酸50克跟7.8克锌充分反应后,锌有剩余,再加入7.3%的盐酸20克,恰好与剩余的锌完全反应,求(1)第一次所用盐酸的质量分数(2)反应后所得溶液中溶质的质量分数?4.已知t℃时氯化钾的溶解度为34.7克.在该温度下将氯化钙和氯化钾的混合物16.2克,放入26.2克水中使其完全溶解,然后加入27.6克溶质质量分数为50%的碳酸钾溶液,恰好完全反应.求:(1)生成碳酸钙沉淀的质量。
(2)反应所得溶液中溶质的质量分数。
5.把30g锌放入200g未知浓度的稀H2SO4中,反应停止后,锌有剩余,取出锌后,称溶液的质量比反应前增加了25.2g。
试求:(1)原稀H2SO4的溶质质量分数;(2)反应后的溶液的主要质量分数;(3)未反应的锌的质量是多少克?6.为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的质量与反应后剩余固体的质量见下表。
(计算结果保留到小数点后一位数字)次数一二三四加入盐酸20 20 20 20的质量/ g剩余固体15 10 5 5的质量/g计算:(1)样品中碳酸钙的质量分数;(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量;(3)加入的稀盐酸中溶质的质量分数。
7.探究实验室中久置的NaOH的变质程度:先称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。
初三化学_酸碱盐计算题专项练习_试题与答案

酸、碱、盐计算专题1:Na2CO3·nH2O62g恰好与某硫酸溶液98g完全反应,测得反应后溶液质量为138g。
求:(1)反应后生成CO2的质量(2’)(2)所用硫酸溶液的质量百分比浓度(2’)(3)Na2CO3·nH2O中结晶水的质量分数,并求出n的数值。
(3’)2:t℃某饱和氢氧化钙溶液149.48g与草木灰(其主要成分为碳酸钾)5.5g反应,生成2g沉淀。
求:(1)草木灰中碳酸钾的含量(5’)(2)t℃下氢氧化钙的溶解度(5’)3.使未知质量分数的盐酸50克跟7.8克锌充分反应后,锌有剩余,再加入7.3%的盐酸20克,恰好与剩余的锌完全反应,求(1)第一次所用盐酸的质量分数(2)反应后所得溶液中溶质的质量分数?4.已知t℃时氯化钾的溶解度为34.7克.在该温度下将氯化钙和氯化钾的混合物16.2克,放入26.2克水中使其完全溶解,然后加入27.6克溶质质量分数为50%的碳酸钾溶液,恰好完全反应.求:(1)生成碳酸钙沉淀的质量。
(2)反应所得溶液中溶质的质量分数。
5.把30g锌放入200g未知浓度的稀H2SO4中,反应停止后,锌有剩余,取出锌后,称溶液的质量比反应前增加了25.2g。
试求:(1)原稀H2SO4的溶质质量分数;(2)反应后的溶液的主要质量分数;(3)未反应的锌的质量是多少克?6.为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的质量与反应后剩余固体的质量见下表。
(计算结果保留到小数点后一位数字)计算:(1)样品中碳酸钙的质量分数;(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量;(3)加入的稀盐酸中溶质的质量分数。
7.探究实验室中久置的NaOH的变质程度:先称取13.3g的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量。
酸碱盐练习题及答案

酸碱盐练习题及答案一、选择题1. 下列物质属于酸的是:A. 碳酸钠B. 硫酸C. 氢氧化钠D. 氯化钠答案:B2. 盐是由以下哪些离子构成的:A. 金属离子和酸根离子B. 金属离子和氢氧根离子C. 氢离子和酸根离子D. 氢离子和非金属离子答案:A3. 碱具有以下哪种性质:A. 能与酸发生中和反应B. 能与金属发生置换反应C. 能与盐发生复分解反应D. 能与非金属发生氧化还原反应答案:A4. 强酸和强碱反应生成的盐是:A. 酸性盐B. 中性盐C. 碱性盐D. 无法确定答案:B5. 以下哪种物质不能与氢氧化钠反应:A. 硫酸B. 氯化钠C. 碳酸氢铵D. 氢氧化钙答案:B二、填空题6. 酸的化学性质包括____、____、____。
答案:使紫色石蕊试液变红、与活泼金属反应生成氢气、与碱发生中和反应7. 碱的化学性质包括____、____、____。
答案:使无色酚酞试液变红、与酸发生中和反应、与某些非金属氧化物反应8. 盐的化学性质包括____、____。
答案:与酸发生复分解反应、与碱发生复分解反应9. 强酸和强碱反应生成的盐溶液呈____性。
答案:中10. 强酸和弱碱反应生成的盐溶液呈____性。
答案:酸三、判断题11. 所有的酸都能使紫色石蕊试液变红。
(对/错)答案:错12. 所有的碱都能使无色酚酞试液变红。
(对/错)答案:对13. 所有的盐溶液都呈中性。
(对/错)答案:错14. 强酸和强碱反应生成的盐一定是中性盐。
(对/错)答案:对15. 强酸和弱碱反应生成的盐溶液一定呈酸性。
(对/错)答案:对四、简答题16. 请简述酸、碱、盐的化学性质。
答案:酸具有使紫色石蕊试液变红、与活泼金属反应生成氢气、与碱发生中和反应等性质。
碱具有使无色酚酞试液变红、与酸发生中和反应、与某些非金属氧化物反应等性质。
盐具有与酸发生复分解反应、与碱发生复分解反应等性质。
17. 为什么强酸和强碱反应生成的盐溶液呈中性?答案:强酸和强碱反应生成的盐溶液呈中性是因为强酸中的氢离子和强碱中的氢氧根离子在反应中完全中和,生成的水是中性的,因此溶液整体呈中性。
初中科学竞赛辅导《酸碱盐》经典计算20题

初中科学竞赛辅导《酸碱盐》经典计算20题(温馨提示:题目的编排顺序遵循由易到难的原则,使用时可根据实际需要选择合适的题目进行训练;如有疑难问题,可与编者交流:QQ 16173689420)1、普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。
现有一块50.00g 黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu 的质量分数。
有关数据如下图。
求:(1)黄铜中Cu 的质量分数。
(2)样品完全反应产生的H 2的质量。
(3)稀盐酸的溶质质量分数。
解析:(1)黄铜中Cu 的质量分数=33.75g/50.00g ×100%=67.5%(2)设样品恰好完全反应生成的H 2的质量为x ,消耗HCl 的质量为y 。
Zn + 2HCl = ZnCl 2 + H 2↑65 73 2 50.00g-33.75g=16.25g y x解得: x =0.5 g ;y =18.25g(3)恰好完全反应所加稀盐酸的质量是:198.25g +0.5g-16.25g=182.5g HCl%=18.25g/182.5g ×100%=10%答案:(1)黄铜中铜的质量分数是67.5% ;(2)样品完全反应产生的H 2的质量是0.5g ;(3)稀盐酸的溶质质量分数是10% 。
2、取一定量含有杂质的某金属R 的样品,投入到73g 质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。
计算:(1)样品中含金属R的质量?(2)所得溶液中溶质的质量分数?解析:73g质量分数为20%的盐酸中HCl的质量=73×20%=14.6g其中含Cl=14.6×35.5/(35.5+1)=14.2g含H=14.6-14.2=0.4g设样品中金属R的质量为m依题意有 14.2/(14.2+m)=74.7%解得:m=4.8g所得溶液中溶质的质量分数=(4.8+14.2)/(4.8+73-0.4)×100%=24.5%3. 某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
12道酸碱盐计算题-包括答案

酸碱盐计算题1、将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(P水= 1g/cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。
右图是所加Na2SO4溶液质量和生成沉淀质量的关系图,计算:(1)生成沉淀的质量是多少?(2)所得溶液中溶质的质量分数为多少?2、现有铜和另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:次数 1 2 3 4加入稀硫酸的质量/g 35.O 35.0 35.O 35.O剩余固体的质量/g 6.8 5.6 4.4 4.2通过计算(写出计算过程),求:(1)该混合物粉末中铜的质量分数?(2)该混合物粉末中另一金属为何种金属?(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?3、某学习小组的四位同学为了研究一份铜锌合金样品中锌的含量,各自取用了不同质量的铜锌合金样品,分别和质量和质量分数都相同的稀盐酸反应,有关数据如下表所示:甲乙丙丁取用样品的质量/g 5 10 15 20取用盐酸的质量/g 30 30 30 30生成H2气体的质量/g 0.O5 0.10 0.12 m(1)表中m的值为。
(2)计算样品中锌的质量分数?(写出计算过程,结果精确到0.1%)4、工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠。
化验员对每批刚生产出的纯碱产品都要进行检测,标示出各种成分的含量后投放市场。
在实验室中取22g该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为10%的稀盐酸并不断振荡,首先发生的反应是:Na2CO3 + HCl=NaHCO3+NaCl,然后发生的反应是:NaHCO3 +HCl=NaCl+CO2↑+H2O。
在上述过程中烧杯中溶液质量和加入稀盐酸质量的关系如图甲所示。
酸碱盐计算专题

酸、碱、盐计算专题1、将25g石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时烧杯中物质的总质量比反应前减少了8.8g,计算:(1)石灰石中碳酸钙的质量分数;(2)所得溶液的质量分数。
2、盐酸和氯化钡的混合溶液200g,其中盐酸的溶质质量分数为10%。
向混合溶液中加入12%的硫酸溶液100 g恰好完全反应。
计算:(1)生成沉淀的质量是多少克?(2)反应后所得溶液中盐酸的质量分数。
3、称取氯化钠和氯化钙的固体混合物14克,放入烧杯中,加入96克碳酸钠溶液恰好完全反应。
待反应完全后过滤,称得滤液的总质量为100克。
求:(1)固体混合物中氯化钙的质量是多少? (2)原碳酸钠溶液的质量分数是多少?4、有一氯化钠和硫酸钠的固体混合物50克,用100克水充分溶解后配成溶液,放入200克氯化钡溶液后,充分反应,得到326.7克溶液,试求:(1)所用氯化钡溶液的溶质质量分数;(2)所得溶液的溶质质量分数。
5、用16g溶质的质量分数为25%的氢氧化钠溶液,恰好完全中和20g的硫酸溶液,求:(1)此硫酸溶液中溶质的质量分数;(2)反应后溶液中溶质的质量分数。
6、小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不(1)8g的石灰石样品中含有杂质多少克?⑵样品中碳酸钙的质量分数是多少?(2)表中m的数值应为多少?⑷要得到280kg的CaO,需要质量分数为80%的石灰石多少千克?7、某样品为Cu和CuO的混合物,为测定样品中CuO的含量,甲、乙、丙、丁四位学生用同一种样品分别进行实验,测得的数据如下表:分析实验数据,回答下列问题:(1)出氧化铜与硫酸反应的化学方程式⑵求混合物中氧化铜的质量分数。
⑶求硫酸溶液中溶质的质量分8.右图是某工业盐产品质量指标。
化学酸碱盐精选计算题及答案详解

我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题。
(1)已知二甲醚的化学式为C2H6O,二甲醚的相对分子质量是________ ,其中碳、氢元素的质量比为______ 。
(2)二甲醚在空气中完全燃烧生成二氧化碳和水,请计算完全燃烧92g二甲醚需要氧气多少克?答案(1)46 -----------------------(1分)4:1 -----------------------(1分)(2)C2H6O +3 O2点燃 2CO2 + 3 H2O46 9692g xX == 92g ×96 / 46 == 192g -----------------------(1分)某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:实验次数123盐酸质量5g5g5g氢气质量0.04gm0.02g请计算:(1)第二次实验产生氢气的质量m _________g。
(2)黄铜(铜、锌合金)中金属铜的纯。
答案(1)0.04g -------------------------------(1分)⑵解:设共生成(0.04g+0.04g+0.02g=0.1g)氢气,需金属锌的质量为x。
Zn+2HCl=ZnCl2+H2↑65 2X 0.1g65/X=2/0.1g解得X=3.25g ------------------------------(1分)合金中铜的质量分数: (20g—3.25g)/20g X100%=83.75%------------------------------(1分)注:答案写83.8%给分。
“嫦娥一号”的发射是我国探月计划的第一步。
用于发射的火箭是长征三号甲运载火箭,它装有大量的液氢和液氧燃料。
若现有20 t的液氢燃料,则需要液氧多少吨?答案解:设20t氢气燃烧需要氧气的质量为x2H2+O2===2H2O……………………………………………………………………………(1分)4 3220t x ………………………………………………………………………………(1分)……………………………………………………………………………(1分)x=160t ……………………………………………………………………………(1分)学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水也不与稀盐酸反应)。
初三化学 酸碱盐计算题

初三化学酸碱盐计算题一、选择题( 只有1个正确答案)1.鉴别稀盐酸和稀硫酸应选用( )A.AgNO3B.BaCl2C.石蕊试液D.酚酞试液2.下列化学方程式正确的是( )A.Cu + H2SO4 === CuSO4 + H2↑B.Fe + 6 HCl == 2FeCl3 + 3 H2↑C.2Al + 6 H Cl === 2AlCl3 + 3H2↑D.2Zn + 2HCl == 2ZnCl + H2↑3.下列各组物质的反应,一定不属于复分解反应的是( )A.金属和酸B.盐和碱C.盐和酸D.酸和碱4.下列试剂中,能用于检验盐酸和含有氯离子的其它溶液的是( )A.石蕊试液B.AgNO3溶液C.BaCl2溶液D.酚酞试液5.若HNO3溶液中混有少量HCl,为除去HCl且不引入新的杂质,可加入适量( )A.铁屑B.BaCl2溶液C.AgNO3溶液D.NaOH溶液6.下列物质中既是含氧酸,又是二元酸的是( )A..盐酸B.硫酸C.磷酸D.氢硫酸7.在4个烧杯中分别盛放相等质量的下列物质,在空气中放置一段时间后,质量增加的是( )A.浓盐酸B.食盐溶液C.浓硫酸D.浓硝酸8.等质量的下列金属分别与足量的盐酸反应,产生H2的质量最大的是( )A.铁B.铝C.锌D.镁9.同质量同浓度的NaOH溶液和HCl溶液混合,向所得的溶液中滴入石蕊试液会( )A.变蓝色B.变红色C.不变色D.变无色10.检验某溶液是酸时,取少量溶液进行如下实验,其中错误的做法是( )A.滴入Na2CO3B.滴入紫色石蕊试液C.加入锌粒D.滴入NaOH溶液11.区分氯化钠、碳酸钠和氯化钡三种溶液的一种试剂是( )A.石蕊试液B.NaOH溶液C.稀硫酸D.盐酸12.下列物质能共存于水溶液的一组是( )A.KCl 、AgNO3B.H2SO4 、BaCl2C.HCl 、Ca(OH)2D.KOH 、NaNO313.有P、Q、R三种金属,其中只有Q能跟稀硫酸发生置换反应。
酸碱盐计算题
化学计算题 姓名__________________
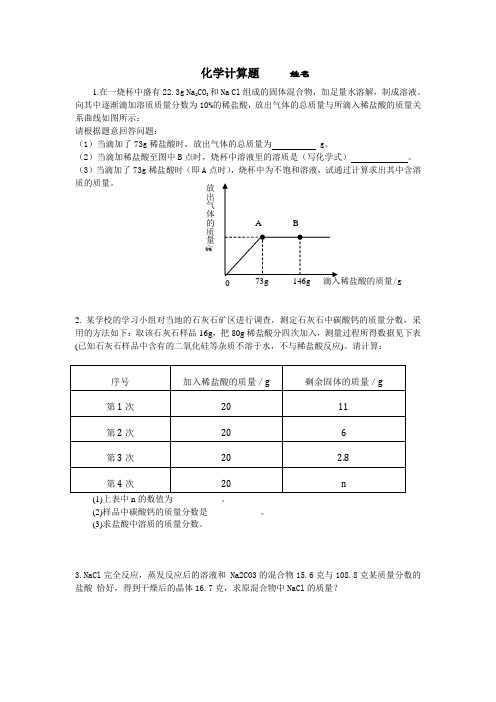
1.在一烧杯中盛有2
2.3g Na 2CO 3和Na Cl 组成的固体混合物,加足量水溶解,制成溶液。
向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答问题:
(1)当滴加了73g 稀盐酸时,放出气体的总质量为 g 。
(2)当滴加稀盐酸至图中B 点时,烧杯中溶液里的溶质是(写化学式) 。
(3)当滴加了73g 稀盐酸时(即A 点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g ,把80g 稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。
请计算:
(1)上表中n 的数值为___________。
(2)样品中碳酸钙的质量分数是____________。
(3)求盐酸中溶质的质量分数。
3.NaCl 完全反应,蒸发反应后的溶液和 Na2CO3的混合物15.6克与108.8克某质量分数的盐酸 恰好,得到干燥后的晶体16.7克,求原混合物中NaCl 的质量?
30、将一定量的石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量比反应前减少了8.8g。
(Ca-40,C-12,O-16,H-1,Cl-35.5)
已知:CaCO3+2HCl=CaCl2+H2O+CO2↑
(1)石灰石中碳酸钙的质量是多少?
(2)所用盐酸的溶质质量分数是多少?。
九年级化学酸碱盐相关计算(含答案)

酸碱盐相关计算一、单选题(共2道,每道15分)1.实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液,然后往烧杯中滴加该盐酸。
反应过程中溶液的pH与滴入盐酸的质量关系如图所示,则该盐酸中溶质的质量分数为( )(相对原子质量:H-1,O-16,Na-23,Cl-35.5)A.3.7%B.7.3%C.22.2%D.14.8%答案:B解题思路:酸碱盐相关计算解题思路:①正确分析所发生的反应,并书写相关的化学方程式。
②从题干或图表中提取关键信息。
③整合所得信息进行计算。
题中涉及到的化学反应为NaOH+HCl NaCl+H2O,要求该盐酸中溶质的质量分数,需知道所加盐酸的质量以及溶质HCl的质量。
由图象可知,加入盐酸的质量为10 g时盐酸恰好和8 g 10%的NaOH溶液完全反应,可根据NaOH的质量计算溶质HCl的质量。
设该盐酸中HCl的质量为x。
所以该盐酸中溶质的质量分数为故选B。
试题难度:三颗星知识点:化学方程式计算2.向100 g硝酸银溶液中加入盐酸至恰好完全反应,过滤后所得溶液的质量等于原硝酸银溶液的质量,则所加盐酸中溶质的质量分数为( )A.15.1%B.35.5%C.7.2%D.25.4%答案:D解题思路:酸碱盐相关计算解题思路:①正确分析所发生的反应,并书写相关的化学方程式。
②从题干或图表中提取关键信息。
③整合所得信息进行计算。
题中涉及的化学反应为AgNO3+HCl AgCl↓+HNO3,要求所加盐酸中溶质的质量分数,需知道所加盐酸的质量以及溶质HCl的质量。
根据题意,反应前硝酸银溶液与加入盐酸的质量和等于反应过滤后所得溶液与AgCl沉淀的质量和,且过滤后所得溶液的质量等于原硝酸银溶液的质量,所以加入盐酸的质量等于生成的AgCl沉淀的质量,HCl的质量可根据AgCl的质量进行计算。
设所加盐酸中HCl的质量为x,生成的AgCl沉淀的质量为y,则所加盐酸中溶质的质量分数为即所加盐酸中溶质的质量分数为25.4%,故选D。
浙江省初中科学--化学《酸碱盐》计算
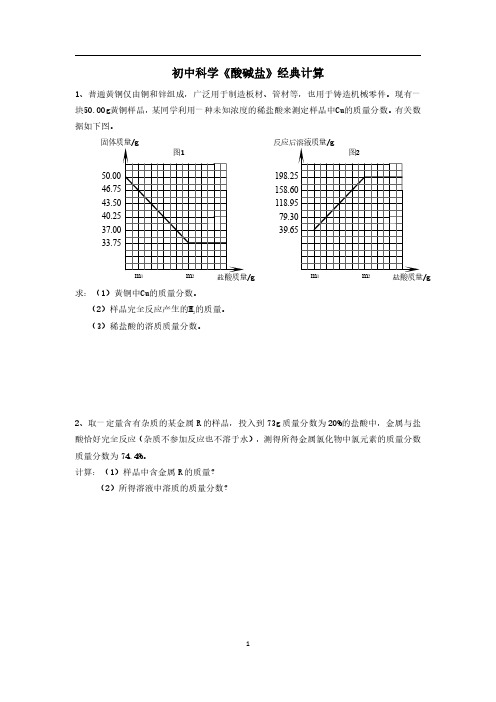
初中科学《酸碱盐》经典计算1、普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。
现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。
有关数据如下图。
求:(1)黄铜中Cu的质量分数。
(2)样品完全反应产生的H 2的质量。
(3)稀盐酸的溶质质量分数。
2、取一定量含有杂质的某金属R 的样品,投入到73g 质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。
计算:(1)样品中含金属R 的质量?(2)所得溶液中溶质的质量分数?3.某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
的体积/L 实验编号R的质量/g稀硫酸的体积/mL生成H21 1.550.0 1.472 2.050.0 1.963 2.250.0 2.164 2.550.0 2.165 3.050.0 2.16根据上述实验结果回答下列问题:(1)上述实验中,金属一定过量的组的编号是,稀硫酸一定过量的组的编号是。
的密度为0.085g/L,则反应所用金属R的相对原子质量是多(2)若在当时实验条件下,H2少?(3)若所使用的稀硫酸密度为1.12g/cm3,则反应所用的硫酸溶液中溶质的质量分数是多少?4、向49克稀硫酸中加入50克20.8%的氯化钡溶液,充分反应后,硫酸有剩余。
滤出沉淀,向滤液中加入32克25%的氢氧化钠溶液后,测得溶液正好呈中性,求硫酸的质量分数。
5、现有一种Na 2CO 3和NaHCO 3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:Na 2CO 3+HCl =NaHCO 3+NaCl,然后才发生反应:NaHCO 3+HCl =NaCl +CO 2↑+H 2O。
(完整版)12道酸碱盐计算题包括答案

酸碱盐计算题1、将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(P水= 1g/cm3),向所得溶液中滴加质量分数为14.2 %的Na2SO4溶液,至恰好完全反应。
右图是所加Na2SO4溶液质量与生成沉淀质量的关系图,计算:(1)生成沉淀的质量是多少?(2)所得溶液中溶质的质量分数为多少?2、现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:次数 1 2 3 4加入稀硫酸的质量/g 35.O 35.0 35.O 35.O剩余固体的质量/g 6.8 5.6 4.4 4.2通过计算(写出计算过程),求:(1)该混合物粉末中铜的质量分数?(2)该混合物粉末中另一金属为何种金属?(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?3、某学习小组的四位同学为了研究一份铜锌合金样品中锌的含量,各自取用了不同质量的铜锌合金样品,分别与质量和质量分数都相同的稀盐酸反应,有关数据如下表所示:甲乙丙丁取用样品的质量/g 5 10 15 20取用盐酸的质量/g 30 30 30 30生成H2气体的质量/g 0.O5 0.10 0.12 m(1)表中m的值为。
(2)计算样品中锌的质量分数?(写出计算过程,结果精确到0.1%)4、工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠。
化验员对每批刚生产出的纯碱产品都要进行检测,标示出各种成分的含量后投放市场。
在实验室中取22g该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为10%的稀盐酸并不断振荡,首先发生的反应是:Na2CO3 + HCl=NaHCO3+NaCl,然后发生的反应是:NaHCO3 +HCl=NaCl+CO2↑+H2O。
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示。
酸碱盐相关计算(习题及答案)

酸碱盐相关计算(习题)相对原子质量:H-1 C-12 O-16 Na-23 Al-27 S-32Cl-35.5 Ca-40 Ag-1081.某碳酸钠样品中含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100 g溶液,然后将其全部加入到100 g 一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6 g,将溶液蒸干,得到15.6 g 硫酸钠。
计算:(1)加入的硫酸溶液中溶质的质量分数;(2)原碳酸钠样品中碳酸钠的质量分数(精确到0.1%)。
2.在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀的质量等于原NaCl溶液质量的1/4,则原NaCl溶液中溶质的质量分数为________(精确到0.1%)。
3.现有某石灰石样品15 g,向其中加入质量分数为7.3%的稀盐酸,生成气体的质量与加入稀盐酸的质量关系如图所示(假设石灰石样品中的杂质不与稀盐酸反应)。
请计算:该石灰石样品中碳酸钙的质量分数。
4.某纯碱样品中含有少量氯化钠,取该样品11 g,全部溶解在100 g水中,再逐渐滴加氯化钙溶液,反应生成沉淀的质量与滴加氯化钙溶液质量的关系如图所示,A点时,过滤,得到滤液242 g。
计算:(1)反应生成沉淀的质量m为_______g。
(2)滤液中溶质的质量分数。
5.某纯碱样品中混有少量的氯化钠,为了测定该样品的纯度,小明做了如下实验:准确称取样品12.0 g,并将60 g稀盐酸分四次加入,每次加入情况如下表,请回答下列问题:实验次数一二三四所加稀盐酸的质量/g 15 15 15 15产生气体的质量/g 1.32 1.32 m 0.44 (1)m的值是________;(2)该纯碱样品的纯度是多少(精确到0.1%)?6.铝合金的生产与销售是一条重要的产业链。
为测定某种铝铜合金中铝的质量分数,探究学习小组进行了如下实验:实验编号铝铜合金质量(g)加入稀硫酸的质量(g)生成H2的质量(g)实验1 30 392 2 实验2 30 588 3 实验3 30 600 3 (1)所用稀硫酸中溶质的质量分数为_________。
化学:酸碱盐相关计算(九年级训练考试卷)

酸碱盐相关计算一、单选题(共10道,每道10分)1.将8.0 g氢氧化钠固体完全溶于水形成溶液,然后向其中加入一定质量的硫酸铜溶液,恰好完全反应,过滤后所得滤液的质量为100.0 g。
则反应产生沉淀的质量为( )(相对原子质量:H-1,O-16,Na-23,S-32,Cu-64)A.4.9gB.9.8gC.14.8 gD.19.6 g2.接上题:反应后所得溶液的溶质质量分数为( )A.3.7%B.7.4%C.14.2 %D.14.8 %3.为测定某石灰石样品中碳酸钙的含量,取样品10g于烧杯中,再向其中加入稀盐酸50g,恰好完全反应(杂质不反应),反应后烧杯中物质总质量为57.8g。
则生成CO2的质量为( )(相对原子质量:H-1,C-12,O-16,Cl-35.5,Ca-40)A.2.2gB.4.4gC.7.4 gD.14.8 g4.接上题:石灰石样品中碳酸钙的质量分数为( )A.20%B.25%C.50%D.75%5.实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8 g 10%的NaOH溶液,然后往烧杯中滴加该盐酸。
反应过程中溶液的pH与滴入盐酸的质量关系如图所示,则该盐酸的溶质质量分数为( )(相对原子质量:H-1,O-16,Na-23,Cl-35.5)A.3.7%B.7.3%C.22.2%D.14.8%6.接上题:当滴入4 g盐酸时,烧杯内溶液中钠元素的质量为( )A.3.2gB.0.32gC.4.6 gD.0.46 g7.向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,加入NaOH溶液的质量与生成沉淀的质量关系如图所示,则P点时溶液中的溶质为( ) (相对原子质量:H-1,O-16,Na-23,Cl-35.5,Cu-64)A.CuCl2和HClB.NaCl和HClC.NaCl和NaOHD.NaCl和CuCl28.接上题:沉淀完全时,m1的值为( )A.120B.100C.80D.609.为了测定某纯碱样品中碳酸钠的质量分数,取该样品与足量稀盐酸在烧杯中反应,有关实验数据如下表:则该反应生成二氧化碳的质量为( )(相对原子质量:H-1,C-12,O-16,Na-23,Cl-35.5)A.3.7gB.4.4gC.7.4 gD.14.8 g10.接上题:该纯碱样品中碳酸钠的质量分数为( )A.14.8%B.45.6%C.88.3%D.92.5%。
酸碱盐计算题小练习

用真心感受学生用真情感动学生
计算题:
1.质量为10克的石灰石样品,与足量盐酸充分反应后,放出气体共3.3克,试计算该石灰石样品的纯度.
2.有一表面被部分氧化的镁条2.8克,跟足量的稀硫酸充分反应,生成0.2克氢气.求:
(1)镁条中单质镁有多少克?
(2)生成硫酸镁多少克?
3.18.6克NaOH和Na2CO3的混合物中加入100克稀盐酸刚好反应,产生气体
4.4克。
求:
⑴18.6克混合物中含Na2CO3多少。
⑵所加盐酸溶液的质量分数是多少。
(3)所得溶液的质量分数是多少?
4.使未知质量分数的盐酸50克跟7.8克锌充分反应后,锌有剩余,再加入7.3%的盐酸20克,恰好与剩余的锌完全反应,求(1)第一次所用盐酸的质量分数,(2)反应后所得溶液中溶质的质量分数?
5、右图是“×××”补钙剂商品标签图。
我能根据标签信息完成下列两题。
⑴主要成分碳酸钙的相对分子质量为;⑵每片药剂中至少含钙元素的质量为 g。
⑶小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0 g,称量烧杯中剩余物质量为47.8 g(不含烧杯质量, 假定钙片其它成分不与盐酸反应。
)Array我来求出:
①生成二氧化碳的质量。
②稀盐酸中溶质的质量分数。
③通过计算判断钙片中碳酸钙的含量标注是否属实。
初中化学酸碱盐计算题
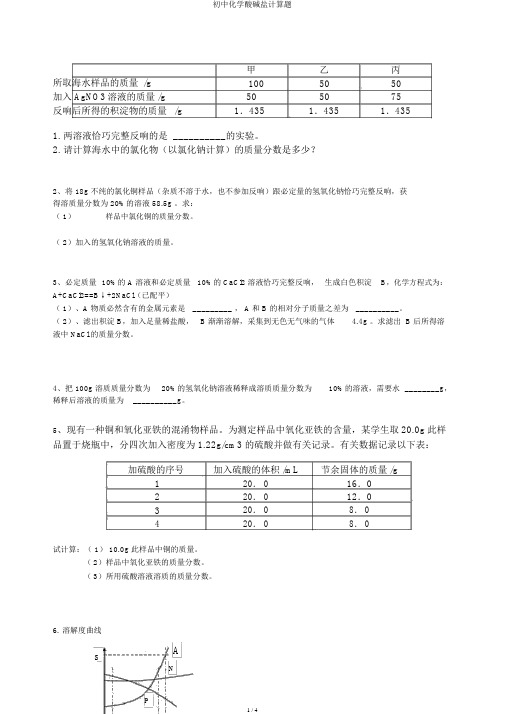
甲乙丙所取海水样品的质量 /g1005050加入 AgNO3溶液的质量 /g505075反响后所得的积淀物的质量 /g1.4351.4351.4351.两溶液恰巧完整反响的是 __________的实验。
2.请计算海水中的氯化物(以氯化钠计算)的质量分数是多少?2、将 18g 不纯的氯化铜样品(杂质不溶于水,也不参加反响)跟必定量的氢氧化钠恰巧完整反响,获得溶质量分数为 20%的溶液 58.5g 。
求:( 1)样品中氯化铜的质量分数。
( 2)加入的氢氧化钠溶液的质量。
3、必定质量10%的 A 溶液和必定质量10%的 CaCl2 溶液恰巧完整反响,生成白色积淀B,化学方程式为:A+CaCl2==B↓+2NaCl(已配平)( 1)、A 物质必然含有的金属元素是_________ , A 和 B 的相对分子质量之差为__________。
( 2)、滤出积淀 B,加入足量稀盐酸, B 渐渐溶解,采集到无色无气味的气体 4.4g 。
求滤出 B 后所得溶液中 NaCl 的质量分数。
4、把 100g 溶质质量分数为20%的氢氧化钠溶液稀释成溶质质量分数为10%的溶液,需要水________g,稀释后溶液的质量为__________g。
5、现有一种铜和氧化亚铁的混淆物样品。
为测定样品中氧化亚铁的含量,某学生取20.0g此样品置于烧瓶中,分四次加入密度为 1.22g/cm3 的硫酸并做有关记录。
有关数据记录以下表:加硫酸的序号加入硫酸的体积 /mL节余固体的质量 /g120. 016.0220. 012.0320. 08. 0420. 08. 0试计算:( 1) 10.0g 此样品中铜的质量。
(2)样品中氧化亚铁的质量分数。
(3)所用硫酸溶液溶质的质量分数。
6.溶解度曲线ASNP80( 1) t 3℃时 A 的溶解度为B( 2) P 点的的含义(3)N点为,可经过的方法使它变为饱和C ( 4) t 1℃时 A、 B、 C、溶解度由大到小的次序( 5)从 A 溶液中获得 A 晶体可用的方法获得晶体。
