大学有机化学反应方程式总结较全
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
大学有机方程式总结_有机反应总结

基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%)⒉硝化,磺化,氧化(略) 烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则 ⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3 CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−OH 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH 顺式加成,反马氏取向生成1︒醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等 ⒏高锰酸钾氧化:酸性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH 碱性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑ ⒐臭氧化: R ORRC=CHR’−→−3OC CHR’→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定−−−→−O璈O H 222RCOR+R’COOH−−→−O H -Zn 2RCOR+R’CHO−−→−4LiAlH RRCHO H+R’CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C300-Ag/200CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl ~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应:氯代:CH 2=CHCH 3−−−−→−︒C 600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl(CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
大学有机化学方程式总结

大学有机化学方程式总结
1. 碳氢化合物的烷烃类反应
1.1 卤代烃和氢化钠的反应
碳氢化合物(卤代烃)与氢化钠反应生成相应的烷烃,并释放出相应的卤化钠。
反应方程式如下:
R-X + NaH -> R-H + NaX
1.2 卤代烃和氢化亚铜的反应
碳氢化合物(卤代烃)与氢化亚铜反应生成相应的烷烃,并释放出相应的卤化铜。
反应方程式如下:
R-X + 2Cu2O + 2Cu -> R-H + 3Cu2X2
2. 醇类的酯化反应
2.1 醇与羧酸的酯化反应
醇与羧酸反应生成相应的酯,并释放出相应的水。
反应方程式如下:
R-OH + R'-COOH -> R'-COOR + H2O
2.2 醇与酸酐的酯化反应
醇与酸酐反应生成相应的酯,并释放出相应的酸。
反应方程式如下:
R-OH + R'-COO-CO-R'' -> R'-COOR + R''-COOH
3. 烯烃的加成反应
3.1 烯烃与卤素的加成反应
烯烃与卤素反应生成相应的二卤代烃。
反应方程式如下:
R-CH=CH2 + X2 -> R-CH2-CHX-CH2-X
3.2 烯烃与负氧化剂的加成反应
烯烃与负氧化剂反应生成相应的环氧化合物。
反应方程式如下:
R-CH=CH2 + [O] -> R-CH2-CH2-O-CH2-CH2-R
以上是一些大学有机化学方程式的总结,希望对您有帮助。
参考文献:
1. 有机化学方程式实验室手册,XX大学化学系,20XX年。
有机化学反应公式

有机化学反应公式
有机化学反应式是一个比较广泛的题目,因为有机化学反应式包括了很多不同的反应类型和反应条件。
以下是一些常见的有机化学反应式,但请注意,这并不是完整的有机化学反应式列表。
烷烃的燃烧反应:CH4 + 2O2 →CO2 + 2H2O
烷烃的氯代反应:CH4 + Cl2 →CH3Cl + HCl
烯烃的加成反应:CH2=CH2 + H2 →CH3CH3
烯烃的氧化反应:CH2=CH2 + O2 →CH3CHO
烯烃的聚合反应:nCH2=CH2 →-[-CH2-CH2-]n-
苯的硝化反应:C6H6 + HNO3 →C6H5NO2 + H2O
苯的磺化反应:C6H6 + H2SO4 →C6H5SO3H + H2O
醇的酯化反应:CH3OH + CH3COOH →CH3COOCH3 + H2O
酮的还原反应:2CH3COCH3 + H2 →CH3CH(OH)CH3
醛的氧化反应:CH3CHO + O2 →CH3COOH
以上只是有机化学反应式的一部分,有机化学是一个非常广泛和复杂的领域,有许多其他的反应和机制。
大学有机方程式总结_有机反应总结

化学竞赛有机方程式总结烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%) ⒉氧化(略)烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 符合马氏规则⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−O H 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH顺式加成,反马氏取向生成1︒醇 ⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 、 HI 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等⒏高锰酸钾氧化:碱性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH酸性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑⒐臭氧化: R O RRC=CHR ′−→−3OC CHR ′→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定′COOH′CHO′CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−→︒C 300-CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应: 氯代:CH 2=CHCH 3−−−−→−︒C600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBS CH 2=CH -CH 2Br ⒓重排:(CH 3)3CCH=CH 2−−→−HCl (CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
(完整版)大学有机化学反应方程式总结(较全).doc
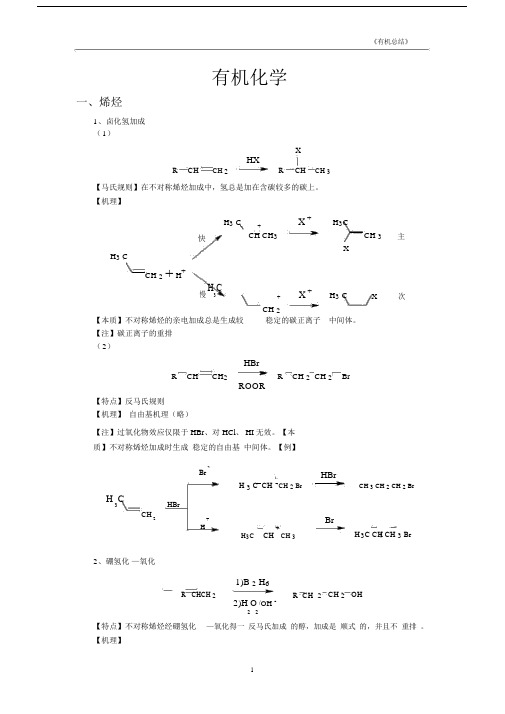
有机化学一、烯烃1、卤化氢加成 ( 1)XHXRCHCH 2R CHCH 3【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】H 3 C+X +H 3CCH 3主快CH CH 3XH 3 CCH 2+ H +慢H 3C+X +H 3 CX次CH 2 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子 中间体。
【注】碳正离子的重排( 2)HBrR CHCH 2 R CH 2 CH 2 BrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于 HBr 、对 HCl 、 HI 无效。
【本质】不对称烯烃加成时生成 稳定的自由基 中间体。
【例】BrH 3 C CH CH 2 BrH 3CHBrCH2+H+H 3CCH CH 3HBrCH 3 CH 2 CH 2 BrBrH 3C CH CH 3 Br2、硼氢化 —氧化1)B 2 H 6R CHCH 2R CH 2 CH 2 OH2)H O /OH -2 2【特点】不对称烯烃经硼氢化 —氧化得一 反马氏加成 的醇,加成是 顺式 的,并且不 重排 。
【机理】H 3CH 3CH 3CCHCH 2CHCH 3CHCH 3HBH 2HBH 2HBH 2H 3CCH 3CH=CH 2-CH 2CH 2CH 3O OH-CH CH 2(CH 3 CH 2 CH 2 )3BH 3 CH 2CH 2C BO OHHBH 2CH 2CH 2CH 3CH 2CH 2CH 3CH 2 CH 2 CH 3+-H 3 CH 2 CH 2 C BOHOH 3CH 2CH 2 C -OCH 2CH 2CH 3B-CH CH CH3OOHHO O22CH 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3BOCH 2 CH 2CH 3OCH 2CH 2CH 3B(OCH 2 CH 2 CH 3 )3+3NaOH 3NaOH3HOCH 2CH2CH33+Na 3BO3【例】1)BH 3OH H2)H 2O 2/OH -CH3HCH33、 X 2 加成BrBr 2 /CCl 4CCCC Br【机理】Br BrBrBr -Br+C +C BrCCC CC CBrBr H 2OBr +BrC+C C-HCC C+2【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
(完整版)有机化学方程式汇总

有机化学反应方程式汇总1. 甲烷与氯气CH 4+Cl 2CH 3Cl+HCl CH 3Cl+Cl 2CH 2Cl 2+HClCH 2Cl 2+Cl 2CHCl 3+HCl CHCl 3+Cl 2CCl 4+HCl (分步取代)2. 甲烷的燃烧3. 烷烃的燃烧通式4. 甲烷的热分解 CH 4−−→−高温C+2H 25. 烷烃的热分解6. 乙烯实验室制法 CH 3CH 2OH H 2O + CH 2=CH 2 ↑(浓硫酸:催化剂,脱水剂)7. 乙烯的燃烧8. 乙烯通入溴水中9. 乙烯和氢气加成10. 乙烯和HCl 的反应 11. 乙烯水化制乙醇 12. 乙烯催化氧化制备乙醛13. 乙烯的加聚反应 14. 制取聚丙烯 CH 4 + 2O CO 2 + 2H 2O燃烧C n H 2n+2 + O n CO 2 + (n + 1)H 2O 3n+1 2燃烧△C 4H C 2H 4+C 2H 6△C 4H CH 4 + C 3H 6CH 2=CH 2 + 3O 2 2CO 2 + 2H 2O点燃2CH 2=CH 2 + O 2CH 3CHO催化剂加热加压CH 3CH=CH 2 + H CH 3CH 2CH 3催化剂CH 2=CH 2 + Br 2 CH 2BrCH 2BrCH 2=CH 2 + HCl CH3CH 2Cl 催化剂CH 2=CH 2 + H 2O CH 3CH 2OH催化剂―CH 2―CH 2―nn CH 2=CH 2催化剂―CH 2――nn CH 2=CH ―CH 催化剂15. 1,3-丁二烯的加成反应 1,2加成1,4加成完全加成16. 1,3-丁二烯的加成反应 17. 乙炔的制取 CaC 2+2H 2O →C 2H 2↑+Ca(OH)218. 乙炔的燃烧19. 乙炔通入溴水中20. 乙炔与氢气的加成反应21. 乙炔水化制备乙醛22. 聚氯乙烯的制备23. 苯的燃烧 24. 苯与液溴反应(FeBr 3作催化剂)25. 苯的硝化反应Cl+ Cl 2催化剂+ Cl 2催化剂Cl+ 2Cl 2催化剂Cl ClCl―CH 2―C=CH ―CH 2―nn CH 2=C ―CH=CH 2催化剂CH 3CH 32 C 2H 2 + 5 O 4 CO 2 + 2 H 2O (l) + 2600 kJ点燃1, 2 - 二溴乙烷HC CH +Br BrC C Br Br H H 1, 1 , 2 , 2 - 四溴乙烷+Br BrC C Br BrH H C C Br Br H Br Br H 催化剂HC CH+H 2H 2C CH 2CH ≡CH + HCl CH 2=CHCl 催化剂氯乙烯CH ≡CH + H 2O乙醛3C C OH 催化剂聚氯乙烯H 2C CHCln -CH 2-CH --Cln 点燃+ 15 O 12 CO 2 + 6 H 2O2+ Br 溴苯NO 226. 苯的磺化反应27. 苯与氢气加成生成环己烷28. 苯与氯气的加成反应29. 苯的同系物被高锰酸钾酸性溶液氧化30.甲苯和氯气的取代反应31. 甲苯的硝化反应32. 甲苯和氢气的加成反应33. 溴乙烷水解 CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr34. 溴乙烷消去反应 CH 3CH 2Br +NaOH CH 2=CH 2↑ + NaBr + H 2O35. 乙醇与钠反应 2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑36. 乙醇催化氧化 2CH 3CH 2OH + O 2 2CH 3CHO + 2H 2O37. 乙醇的燃烧 CH 3CH 2OH +3O 2→2CO 2 + 3H 2OH 2O,△ Cu △醇 △HO SO 3+△+ H 2O3H 苯磺酸催化剂2△ClCl Cl ClClCl + 3 Cl 2光照C H KMnO 4 (H +)CH 3HO NO 2+ 3浓硫酸+ 3 H 2OCH 3NO 2NO 2O 2N2,4,6-三硝基甲苯 (TNT)+ 3 H CH 3CH 3CH 3CH 3Cl+ Cl + HClFeCH 3ClCH 3+ Cl + HClFe38. 乙醇与浓氢溴酸的反应 CH 3CH 2OH +HBr →CH 3CH 2Br + H 2O39. 乙醇脱水(分子内、分子间) CH 3CH 2OH CH 2=CH 2 ↑+H 2O (消去反应)2CH 3CH 2OH CH 3CH 2—O —CH 2CH 3+ H 2O (取代反应)40. 苯酚的电离方程式 41. 苯酚与NaOH 溶液反应42. 苯酚与金属钠反应 43. 苯酚和碳酸钠溶液反应44. 苯酚钠和盐酸反应 45. 苯酚钠溶液中通入CO 2气体46. 苯酚和浓溴水反应(苯酚的定性检验和定量测定方法)47. 苯酚的硝化反应48. 苯酚与FeCl 3溶液49. 苯酚的加成反应浓H 2SO 4 140℃OH电离O -+ H+OH + NaOHONa + H 2OOH 2 + 2Na ONa 2 + H OH + Na 2CO ONa + NaHCO 3+ HCl OH + NaClONa + CO 2 + H 2OH + NaHCO 3ONa OH+ 3 HNO + 3 H 2OOHNO 2O 2NNO 2浓硫酸苦味酸OHFeCl 3溶液紫色,易溶于水的物质OHOH+ 3 H 2Ni环己醇OH+ 3 Br OHBr BrBr+ 3 HBr50. 苯酚的缩聚反应n + n + n H 2O2OHH C OH n51.苯酚的酯化反应52. 乙醛的加成反应(还原反应) 53. 乙醛的氧化反应—燃烧反应54. 乙醛的催化氧化反应 55. 乙醛与银氨溶液的反应 ③ CH 3CHO + 2 [Ag(NH 3)2]+3COO - + NH 4+3 + H 2O56. 乙醛与Cu(OH)2悬浊液反应57. 乙醛的制备方法乙醇氧化法乙烯氧化法乙炔水化法58. 醛的加成反应(还原反应)59. 醛的催化氧化反应OH+ CH 3COOH + H 2OOOCCH3乙酸酐CH 3CHO + H 23CH 2OH 2CH 3CHO + 5O 4CO 2 + 4H 2O点燃2 CH 3CHO + O 3COOH① Ag + + NH 3·H 2O AgOH + NH 4+② AgOH + 2 NH ·H 2O [Ag(NH3)2]+ + OH - + 2 H 2O2 CH 3CH 2OH + O 3CHO + 2 H 2O + H 23CHOHC CH 2 + O 22 CH 3CHO 加热 加压H 2C CH 2催化剂2R―CHO + O 2―COOHR ―CHO + H 2―CH 2OHCH 3CHO + 2 Cu(OH)23COOH + Cu 2O + 2 H 2OCu 2+ + 2 OH - Cu(OH)260. 醛与银氨溶液的反应 61. 醛与Cu(OH)2悬浊液反应 62. 甲醛的银镜反应 63. 甲醛与Cu(OH)2悬浊液反应 64. 乙酸与氢氧化铜悬浊液 2CH 3COOH + Cu(OH)2 = (CH 3COO)2Cu + 2H 2O65. 乙酸乙酯制取(用饱和碳酸钠溶液收集)CH 3COOH + CH 3CH 2OHCH 3COOC 2H 5 + H 2O66. 乙二酸和乙二醇反应C ―OH ∣C ―OH OOHO ―CH 2∣HO ―CH 2+ + 2H 2O 浓硫酸C C O CH 2CH 2O O OnHOOC ―COOH + nHOCH 2―CH 2OH + 2nH 2O ―C ―C ―OCH 2―CH 2O ―O On浓硫酸67. 乙醇和硝酸酯化CH 3CH 2OH + HNO 3 CH 3CH 2ONO 2 + H 2O浓硫酸68. 乙酸乙酯的水解CH 3COOC 2H 5 + H 2O CH 3COOH + CH 3CH 2OH 稀硫酸CH 3COOC 2H 5 + NaOH ==== CH 3COONa + CH 3CH 2OH69. 甲酸钠与银氨溶液反应HCOONa +2Ag(NH 3)2OH NH 4OCOONa +2Ag ↓+3NH 3↑+H2O浓硫酸△R ―CHO + 2Cu(OH)2 R ―COOH + Cu 2O ↓ + 2H 2OR ―CHO + 2Ag(NH 3)2OH R ―COONH 4 + 2Ag ↓ + 3NH 3 + H 2O HCHO + 4 Cu(OH)2 CO 2 + 2 Cu 2O + 5 H 2O HCHO + 4 [Ag(NH 3)2]+ + 4 OH - (NH 4)2CO 3 + 4 Ag + 6 NH 3 + 2 H 2O70.甲酸钠与新制氢氧化铜反应HCOONa+2Cu(OH)2+ NaOH Na2CO3+Cu2O↓+3H2O71.葡萄糖的银镜反应CH2OH(CHOH)4CHO+2Ag(NH3)2OHCH2OH(CHOH)4COONH4+2Ag↓+3NH3↑+H2O72.葡萄糖与新制氢氧化铜反应CH2OH(CHOH)4CHO+2Cu(OH)2 +NaOH CH2OH(CHOH)4COONa+Cu2O↓+3H2O 73. 蔗糖水解C12H22O11 + H2O 催化剂C 6H 12O6 + C6H12O6蔗糖葡萄糖果糖74. 麦芽糖水解C12H22O11 + H2O 催化剂2C6H12O6麦芽糖葡萄糖75. 淀粉水解(C6H10O5)n + nH2O 催化剂nC6H12O6淀粉葡萄糖76. 纤维素水解(C6H10O5)n + nH2O 催化剂nC6H12O6纤维素葡萄糖77. 工业制取肥皂(皂化反应)C17H35COO―CH2∣C17H35COO―CH∣C17H35COO―CH2+ 3NaOH 3 C17H35COONa +HO―CH2∣HO―CH∣HO―CH278.油酸甘油酯硬化79.工业制造乙苯 + CH2=CH280.制造硝酸纤维的反应81.甲苯与高锰酸钾酸性溶液反应5 +6KMnO4+9H2SO4→ 5 +3K2SO4+ 6MnSO4+ 14H2O82.甘油制取炸药83.甲醛与苯酚反应制取酚醛树脂代表物之间的转化关系:CH3CH3CH2=CH2 CH=CH CH2=CHCl CH3CH 2OHCH 2BrCH2BrCH2OHCH2OHCHOCHOCOOHCOOH[ CH2—CH ]nClCH3CHO CH3COOHCH3COOC2H5CH3CH2BrO=CO=CCH2CH2OO。
有机化学反应方程式小结

有机化学反应方程式小结一.取代反应1.CH4+Cl2--光→CH3Cl+HCl2.C2H6+Cl2--光→C2H5Cl+HCl3.C6H6+Br2—Fe→C6H5Br+HBr4.C2H5OH+HBr--加热→C2H5Br+H2O5.C6H6+HNO3--H2SO4水浴加热→C6H5NO2+H2O6.C6H5Cl+H2O--NaOHCu,高温,加压→C6H5OH+HCl7.C2H5Cl+H2O—NaOH→C2H5OH+HCl8.CH3COOC2H5+H2O—稀硫酸,加热→CH3COOH+C2H5OH9.(C17H35COO)3C3H5+3NaOH→C3H5(OH)3+3C17H35COOH10.2CH3CH2OH+2Na→2CH3CH2ONa+H211.2C6H5OH+2Na→2C6H5ONa+H2↑12.2CH3COOH+2Na→2CH3COONa+H2↑(分子间脱水)C2H5OH+C2H5OH--浓H2SO4,140℃→C2H5OC2H5+H2O二.加成反应13.CH2=CH2+H2→Ni,加热→CH3CH314.CH2=CH2+HCl--催化剂,加热→CH3CH2Cl15.C2H2+H2--Ni,加热→CH2=CH216.C2H2+2H2--Ni,加热→CH3CH317.C2H2+2HCl--催化剂,加热→CH3CHCl218.CH2=CH-CH=CH2+Br2→CH2=CH-CHBr-CH2Br19.CH2=CH-CH=CH2+Br2→CH2Br-CH=CH-CH2Br20.CH2=CH-CH=CH2+2Br2→BrCH2-CHBr-CHBr-CH2Br21.CH3CHO+H2–Ni→CH3CH2OH22.CH2OH-(CHOH)4-CHO+H2--Ni→CH2OH-(CHOH)4-CH2OH23.C6H6+3H2—Ni→C6H12(环己烷)24.C6H6+3Cl2--光→C6H6Cl625.CH2=CH2+H2O--H2SO4,加热,加压→CH3CH2OH三.消去反应26.CH3CH2OH--浓H2SO4,170℃→CH2=CH2↑+H2O27.CH3CH2Br+NaOH--醇,加热→CH2=CH2↑+NaBr+H2O四.酯化反应(取代反应)28.CH3COOH+CH3CH2OH--浓H2SO4,加热→CH3COOC2H5+H2O29.C3H5(OH)3+3HNO3--浓H2SO4→C3H5(ONO2)3+3H2O五.水解(卤代烃、酯、油脂的水解见上,亦是取代反应)30.CH3COONa+H2O→CH3COOH+NaOH31.CH3CH2ONa+H2O→CH3CH2OH+NaOH32.C6H5ONa+H2O→C6H5OH+NaOH33.C17H35COONa+H2O→C17H35COOH+NaOH34.(C6H10O5)n+nH2O--H2SO4,加热→nC6H12O6六.氧化反应35.2C2H5OH+O2--Cu或Ag,加热→2CH3CHO+2H2O36.C6H12O6+6O2→6CO2+6H2O+热37.2CH3CHO+O2→2CH3COOH38.CH3CHO+2[Ag(NH3)2]OH→CH3COONH4+2Ag↓+3NH3+H2O39.CH3CHO+2Cu(OH)2加热→CH3COOH+Cu2O↓+2H2O40.CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH→CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O41.CH2OH(CHOH)4CHO+2Cu(OH)2--加热→CH2OH(CHOH)4COOH+Cu2O↓+2H2O42.HCOOH+2[Ag(NH3)2]OH→NH4HCO3+2Ag↓+3NH3+H2O43.HCOOH+2Cu(OH)2加热→CO2+Cu2O↓+3H2O44.HCOONa+2[Ag(NH3)2]OH→NaHCO3+4NH3+2Ag↓+H2O45.HCOONH4+2[Ag(NH3)2]OH→NH4HCO3+2Ag↓+4NH3+H2O46.HCOOR+2[Ag(NH3)2]OH→NH4OCOOR+2Ag↓+3NH3+H2O47.HCHO+2[Ag(NH3)2]OH→HCOONH4+2Ag↓+3NH3+H2O48.HCHO+4[Ag(NH3)2]OH→NH4HCO3+4Ag↓+7NH3+2H2O49.HCHO+4Cu(OH)2加热→CO2+2Cu2O↓+5H2O七.还原反应50.CH3COCH3+H2--Ni→CH3CHOHCH360.HCHO+H2--Ni→CH3OH51.C6H5CH=CH2+4H2--Ni→C6H11CH2CH3八.加聚反应52.nCH2=CH2→[CH2-CH2]n53.nCH3-CH=CH2→[CH-CH2]n67.nCH2=C-COOCH3→[CH2-C]n68.nCH2=C-CH=CH2→[CH2-C=CH-CH2]n九.缩聚反应氨基酸合成蛋白质。
有机化学基础化学方程式整理

1 .甲烷燃烧: CH4 +2O2 点燃CO2 + 2H2O2 .甲烷与氯气在光照条件下反应CH4 + Cl2 光照CH3Cl+ HClCH2Cl2 + Cl2 光照CHCl3 + HCl3 .甲烷高温分解 CH4 高温C + 2H2(二)烯烃CH3Cl + Cl2 光照CH2Cl2 +HCl CHCl3 +Cl2 光照CCl4 +HCl1 .乙烯与溴的四氯化碳溶液反应2 .乙烯与水反应3 .乙烯与氢气加成CH2 =CH2 + Br2 CH2 BrCH2 Br CH2 =CH2 + H2O 催化剂CH3CH2OH催化剂CH2 =CH2 +H2 CH3CH34 .乙烯的加聚反应n CH2 =CH2催化剂5.1,3-丁二烯与溴在温度较低和较高时的反应CH 2 =CH —CH =CH 2 +Br 2 60℃ CH 2 BrCH=CHCH 2 Br ( 1,4—加成)CH 2 =CH —CH =CH 2 +Br 2 -80℃ CH 2 BrCHBrCH=CH 2 ( 1,2—加成)6 .丙烯加聚 n H 2C =CHCH 3CH37. 2— 甲基— 1,3—丁二烯加聚 n(三)炔烃1 .乙炔燃烧 2C2 H 2 + 5O 2 点燃 4CO 2 + 2H 2O2 .乙炔与足量溴的四氯化碳溶液反应 CH ≡CH + Br 2CHBr 2CHBr 23 .乙炔与氢气催化加成 CH ≡CH + 2H 2 催化剂 CH 3CH 34 .乙炔制聚氯乙烯CHnCH 2催化剂CH≡CH +HCl H2C=CHCl n H2C=CHCl(四)芳香烃1 .苯的燃烧2C6 H6 +15O2 点燃12CO 2 + 6H2O2 .苯的催化加氢+3H2催化剂3 .苯与液溴催化反应+ Br2催化剂+ HBr4 .苯的硝化反应浓硫酸+HO-NO2 50~60℃+ H2O5 .甲苯与浓硝酸、浓硫酸的混合酸+ 3HO— NO2催化剂+ 3H2O (六)、卤代烃1.1-氯丙烷与氢氧化钾醇溶液共热 CH3CH2 CH2Cl +KOH醇加热CH3CH=CH2 ↑ + KBr +H 2O水2.2-氯丙烷与氢氧化钠水溶液共热 CH3CHClCH3 +NaOH 加热CH3CH(OH)CH3 + NaCl1 .乙醇与钠反应2 .乙醇的燃烧3 .乙醇的催化氧化2CH3CH2OH + 2Na 2CH3CH2ONa + H2 ↑CH3CH2OH+3O2 点燃2CO 2 +3H2OCu2CH3CH2OH + O2 2CH3CHO + 2H2O浓硫酸4 .乙醇制乙烯 CH3CH2OH 170℃ CH2 =CH2 ↑ + H2O浓硫酸5 .乙醇制乙醚 2CH3CH2OH 140℃ CH3CH2OCH2CH3 + H2O6 .乙醇与红热的氧化铜反应 CH3CH2OH+CuO CH3CHO+H2O(八)、酚类1 .苯酚与氢氧化钠反应2.+CO2 +H2O+NaOH+NaHCO 3+ H2O+Na 2CO 3+NaHCO 34 .苯酚与溴水反应+3Br 2↓ + 3HBr(九)、醛类1 .乙醛的催化加氢 CH 3CHO + H2 催化剂加热、加压CH 3CH 2OH催化剂2 .乙醛的催化氧化 2CH 3CHO + O 22CH 3COOH3.乙醛与银氨溶液反应 CH 3CHO+2Ag(NH 3)2OH 水浴加热 CH 3COONH 4 +2Ag↓ +3NH 3 +H 2O4 .乙醛与新制氢氧化铜反应 CH 3CHO + 2Cu(OH)2 +NaOH CH 3COONa + Cu 2O ↓ +3H 2O5 .甲醛与苯酚制酚醛树脂浓硫酸6.3.+2n H2O浓硫酸1 .乙酸与乙醇发生酯化反应 CH 3COOH + CH 3CH2OH CH3COOCH 2CH3 + H2O2 .乙酸与碳酸钠反应 2CH3COOH+Na2CO3 2CH3COONa+H2O+CO 2 ↑(十一)、糖类1 .葡萄糖燃烧 C6 H12O6 + 6O2 点燃6CO 2 + 6H2O2 .葡萄糖与银氨溶液反应CH2OH(CHOH)4CHO +2Ag(NH 3)2OH 水浴加热CH2OH(CHOH)4COONH 4 +2Ag↓ +3NH 3 ↑ + H2O3 .葡萄糖与新制氢氧化铜反应CH2OH(CHOH)4CHO+2Cu(OH) 2 +NaOH CH2OH(CHOH)4COONa + Cu 2O↓ + 3H2O催化剂4 .葡萄糖被还原为直链己六醇 CH 2OH(CHOH)4CHO + H2 CH2OH(CHOH)4CH2OH5 .葡萄糖在酒化酶作用下获得乙醇 C6 H12O6 酒化酶2CH3CH2OH +2CO 2 ↑6 .蔗糖水解 C12 H22O11 + H2O 催化剂C6 H12O6 +C 6 H12O6蔗糖葡萄糖果糖7 .麦芽糖水解 C12 H22O11 + H2O 催化剂2C6 H12O6麦芽糖葡萄糖8 .淀粉水解 (C6 H10O5)n + nH2O 催化剂n C6 H12O6淀粉葡萄糖9 .纤维素水解 (C6 H10O5)n + nH2O 催化剂n C6 H12O6纤维素葡萄糖10 .纤维素燃烧 (C6 H10O5)n + 6nO2 点燃6nCO2 + 6nH2O11.(C 6H 7O 2)OHn浓硫酸+3n HNO 3ONO 2ONO 2 ONO2n+3n H 2O纤维素(十二)、酯类1 .乙酸乙酯与 H 218O 混合加入稀硫酸水解CH 3COOCH 2CH 3 +H 218O 稀硫酸 CH 3CO 18OH + CH 3CH 2OH2 .油脂的氢化(以油酸甘油酯加氢为例 )3 .油脂的皂化反应(以硬脂酸甘油酯为例)(C 6H 7O 2)OHOH。
有机化学反应方程式汇总

有机化学反应方程式汇总
1.取代反应:
取代反应是有机化学中最常见的类型之一、它涉及将一个原子或官能
团从一个有机化合物中取代成另一个原子或官能团。
一个常见的例子是卤
素取代反应,例如醇与卤代烃反应,生成醚。
反应方程式如下:R-OH+R'-X→R-O-R'+HX
2.消除反应:
消除反应是通过去除一对相邻的官能团来生成双键或三键。
一个常见
的例子是醇的脱水反应,生成烯烃。
反应方程式如下:
R-OH→R-CH=CH2+H2O
3.加成反应:
加成反应是将两个或多个分子结合在一起形成一个新的化合物。
一个
常见的例子是烯烃与氢气的加成反应,生成饱和烃。
反应方程式如下:R-CH=CH2+H2→R-CH2-CH3
4.重排反应:
重排反应涉及有机化合物中的原子或官能团的重新排列,形成其他同
分异构体。
一个常见的例子是烷烃的重排反应,生成更稳定的同分异构体。
R-C(CH3)3→R-CH2-C(CH3)2-CH3
5.加成聚合反应:
加成聚合反应是通过将多个单体结合在一起形成聚合物。
一个常见的例子是乙烯的聚合反应,生成聚乙烯。
反应方程式如下:
nCH2=C H2→(CH2-CH2)n
以上只是有机化学反应方程式的一部分,还有许多其他类型的反应,如氧化反应、还原反应、环化反应等。
每个反应的具体方程式和反应条件都有所不同,所以需要根据具体情况进行研究和学习。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:CnH2n+2)甲烷的制取:CaO △(1)氧化反应甲烷的燃烧:点燃甲烷不成使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应 光照一氯甲烷)+HCl 光照二氯甲烷)+HCl 光照三氯甲烷)+HCl (CHCl3又叫氯仿) 光照四氯化碳)+HCl(3)分解反应甲烷分解:高温2. 乙烯(烯烃通式:CnH2n)乙烯的制取:浓硫酸170℃=CH2↑+H2O(消去反应) (1)氧化反应乙烯的燃烧:CH2=点燃乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH2=—CH2Br与氢气加成:CH2=CH2+H2催化剂CH3CH3 与氯化氢加成:CH2=CH2+HCl 催化剂CH3CH2Cl 与水加成:CH2=CH2+H2O催化剂CH3CH2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH2=CH2催化剂 [CH2—CH2 ] n 适当拓展:CH3CH =׀ Cl CH -׀ ClCH2 CH3CH =CH2+H2催化剂CH3CH2CH3 CH3CH =CH2+HCl 催化剂CH3CH2CH2Cl 或CH3׀ ClCHCH3 CH3CH =CH2+H2O 催化剂CH3CH2CH2OH 或CH3׀ OHCHCH3 nCH2=CH -CH3催化剂 [CH2—׀ CH3CH ] n(聚丙烯) 3. 乙炔(炔烃通式:CnH2n-2)乙炔的制取: CH↑+Ca(OH)2(1)氧化反应乙炔的燃烧:点燃乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CHBr =CHBr CHBr =—CHBr2 与氢气加成:HC≡CH+H2催化剂H2C =CH2与氯化氢加成:HC≡CH+HCl催化剂CH2=CHCl (3)聚合反应图2 乙烯的制取图1 甲烷的制取图3 乙炔的制取氯乙烯加聚,得到聚氯乙烯:nCH2=CHCl催化剂[CH2—׀ Cl CH ] n 乙炔加聚,得到聚乙炔:n HC≡CH催化剂 [CH =CH ] n 4. 1,3-丁二烯 与溴完全加成:CH2=CH -CH =CH2Br -CHBr -CHBr -CH2Br 与溴1,2-加成:CH2=CH -CH =CH2Br -CHBr -CH =CH2 与溴1,4-加成:CH2=CH -CH =CH2Br -CH =CH -CH2Br 5. 苯苯的同系物通式:CnH2n-6(1)氧化反应苯的燃烧:2+15O2点燃苯不克不及使溴水和酸性高锰酸钾溶液褪色。
大学有机化学方程式

1.加硫酸--烯烃的间接水合法制醇:
2.加水--烯烃的直接水合法制醇:
3.加卤素:
4.溴鎓离子机理:
5.加次卤酸(X2/H2O or HXO):
6.自由基加成反应(HBr 特有)
在过氧化物存在下与溴化氢反应得反马氏规则的加成产物:氢加到含氢较少的碳原子上氯化氢和碘化氢没有过氧化物效应,加成取向仍符合马氏规则。
HI吸热不易反应
7.硼氢化反应:
烷基硼烷在碱性条件下用过氧化氢处理转变成醇,反应后氢加在含氢较少的烯碳原子上,用来制备伯醇:
硼氢化反应得顺式加成产物,立体选择性很高,是一个立体专一性的反应。
8.高锰酸钾氧化:
9.臭氧化还原反应:
若无锌粉的存在该条件下醛会被继续还原成羧酸
10.环氧化反应:
烯烃被过氧酸氧化生成环氧化合物,该反应立体化学上是顺式反应
11.α-氢的反应
在高温或光照下,α-氢易被卤素取代,发生自由基取代反应
12.NBS:N-溴代丁二酰亚胺,常见的烯丙位溴代试剂。
有机化学反应方程式汇总
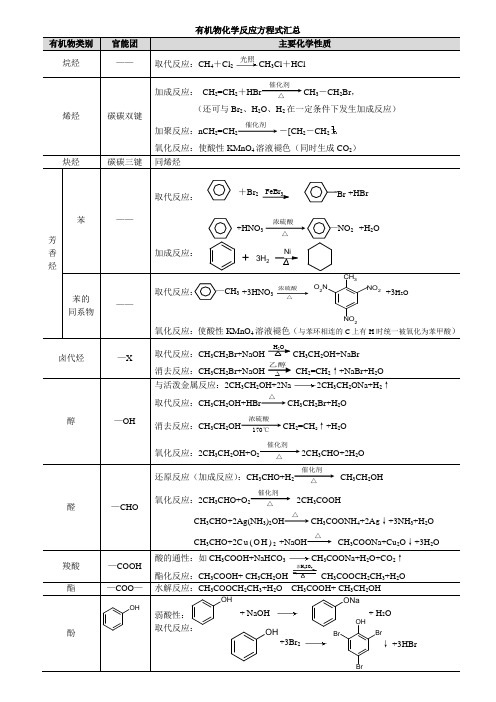
浓硫酸△ 有机物化学反应方程式汇总有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
(完整版)有机化学反应方程式汇总

浓硫酸△ 有机物类别官能团 主要化学性质 烷烃——取代反应:CH 4+Cl 2CH 3Cl +HCl烯烃碳碳双键加成反应: CH 2=CH 2+HBr催化剂 △CH 3-CH 2Br ,(还可与Br 2、H 2O 、H 2在一定条件下发生加成反应)加聚反应:nCH 2=CH 2催化剂-[CH 2-CH 2氧化反应:使酸性KMnO 4溶液褪色(同时生成CO 2)炔烃碳碳三键同烯烃 芳香烃苯——取代反应: FeBr 3加成反应:苯的 同系物——取代反应:氧化反应:使酸性KMnO 4溶液褪色(与苯环相连的C 上有H 时统一被氧化为苯甲酸)卤代烃 —X取代反应:CH 3CH 2Br+NaOHH 2OCH 3CH 2OH+NaBr消去反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O 醇—OH与活泼金属反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑取代反应:CH 3CH 2OH+HBr△CH 3CH 2Br+H 2O 消去反应:CH 3CH 2OH浓硫酸 170℃CH 2=CH 2↑+H 2O氧化反应:2CH 3CH 2OH+O 2催化剂 △2CH 3CHO+2H 2O醛—CHO还原反应(加成反应):CH 3CHO+H 2催化剂 △CH 3CH 2OH氧化反应:2CH 3CHO+O 2催化剂 △2CH 3COOHCH 3CHO+2Ag(NH 3)2OH△CH 3COONH 4+2A g ↓+3NH 3+H 2OCH 3CHO+2C u (O H )2 +NaOH△CH 3COONa+Cu 2O ↓+3H 2O羧酸 —COOH 酸的通性:如CH 3COOH+NaHCO 3CH 3COONa+H 2O+CO 2↑酯化反应:CH 3COOH+ CH 3CH 2OH 浓H 2SO 4CH 3COOCH 2CH 3+H 2O 酯—COO —水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH+ CH 3CH 2OH酚弱酸性:取代反应: 光照+HNO 3—NO 2 +H 2O浓硫酸 △OHOH + NaOH ONa + H 2O OH+3Br 2OHBrBrBr+3HBr↓ 乙醇+HBr+Br 2 Br —CH 3 +3HNO 3 CH 3NO 2O 2N NO 2+3H 2O +3H 2Ni反应试剂有机物类别或官能团反应类型反应方程式举例X2氯气、液溴CH4+Cl2CH3Cl+HCl浓溴水苯酚取代反应溴水或溴的四氯化碳溶液“C=C”或“C≡C”加成反应H2C=CH2 + Br2 BrH2C-CH2BrHX “C=C”或“C≡C”加成反应H2C=CH2+HBr催化剂△H3C-CH2Br醇取代反应CH3CH2OH+HBr△CH3CH2Br+H2OH2O “C=C”或“C≡C”加成反应H2C=CH2+H2O催化剂△H3C-CH2OH酯水解反应CH3COOCH3+H2O催化剂△CH3COOH+CH3OHNa 醇、苯酚、—COOH置换反应2CH3CH2OH+ 2Na 2CH3CH2ONa+H2↑NaOH 苯酚、—COOH中和反应HCOOH+NaOH HCOONa+H2O酯水解反应CH3COOCH3+ NaOH CH3COONa+CH3OH卤代烃取代反应CH3CH2Br+NaOH△CH3CH2OH+NaBr消去反应CH3CH2Br+NaOH CH2= CH2↑+NaBr+H2ONa2CO3苯酚、—COOH复分解反应NaHCO3—COOH 复分解反应HCOOH+NaHCO3==HCOONa+CO2↑+H2OH2“C=C”或“C≡C”加成反应H2C=CH2+H2催化剂△H3C-CH3苯环加成反应羰基、醛基加成反应(还原反应)CH3CHO +H2催化剂△CH3CH2OH银氨溶液、新制Cu(OH)2醛、葡萄糖氧化反应略O2醛、醇氧化反应2CH3CHO+O2催化剂△2CH3COOH 大多数有机物氧化反应大多数有机物可燃烧生成CO2和H2O酸性KMnO4溶液醛、醇、酚、“C=C”、“C≡C”苯的同系物氧化反应略乙醇OH+3Br2OHBrBrBr+3HBr↓光照取代反应烷烃、苯环+3H2Ni。
有机化学反应方程式大全

有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH CH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH32CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH33CH2CH2C2CH2CH3+O H-OHB-OCH2CH2CH3CH2CH2CH3H3CH2CH2B OCH2CH2CH3CH2CH2CH32CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr2/CCl4C CBrBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
常见有机化学反应方程式总结

常见有机化学反应方程式总结有机化学是研究碳和其它元素之间的化学反应的科学领域。
有机化学反应方程式描述了有机化合物之间发生的化学变化,是有机化学研究的基本工具。
下面是一些常见的有机化学反应方程式的总结:1. 取代反应(Substitution reactions):-卤素代替反应:R-X+Y→R-Y+X-核磁代替反应:R-H+X→R-X+H2. 加成反应(Addition reactions):-单一加成反应:R=CH2+X-Y→R-CH2-X-Y-烯烃加成反应:R=CH2+H-CH=CH2→R-CH2-CH-CH33. 消除反应(Elimination reactions):-水解反应:R-X+H2O→R-OH+HX-甲醇酯化反应:R-COOH+CH3OH→R-CO-O-CH34. 氧化反应(Oxidation reactions):-伯醇氧化反应:R-CH2-CH2-CH2-OH→R-CH2-CH=CH2-OH-异醛氧化反应:R-CHO+[O]→R-COOH5. 还原反应(Reduction reactions):-烯烃还原反应:R-CH=CH-R→R-CH2-CH2-R-酮还原反应:R-CO-R→R-CH2-R6. 缩合反应(Condensation reactions):-酯缩合反应:R-COOH+R'-COOH→R-COO-R'+H2O-罗宾逊缩合反应:R-CHO+R'-COOH→R-CH=CH-CO-R'7. 加氢反应(Hydrogenation reactions):-炔烃加氢反应:R-CH=CH-R+H2→R-CH2-CH2-R8. 多聚反应(Polymerization reactions):-乙烯聚合反应:nCH2=CH2→-(-CH2-CH2-)n-9. 光化学反应(Photochemical reactions):-阳光下的氯代烃分解反应:R-CH2-Cl→R-CH2•+Cl•10. 还原消除反应(Reductive elimination reactions):-醇酸脱水反应:R-COOH→R-CO•+H2O以上仅是有机化学反应方程式的一小部分,还有许多其他种类的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学有机化学反应方程式总结较全文件编码(GHTU-UITID-GGBKT-POIU-WUUI-8968)有机化学一、烯烃 1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH 33H 323H 32CH CH 2CH 32CH CH=CH (CH 3CH 2CH 2)3-H 3CH 2CH 2C22CH 3CH 2B OCH 2CH 2CH 3H 3CH 2CH 2C2CH 2CH 3+OH -OHB-OCH 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2CBOCH 2CH 2CH 3CH 2CH 2CH 32CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOCH 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH -CH 3HH OH3、X 2加成C CBr /CCl CC Br【机理】CC CC Br BrC Br +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
【特点】反式加成 4、烯烃的氧化1)稀冷高锰酸钾氧化成邻二醇。
3H 33H3稀冷KMnO433M n O OOO H 2O 3H 33H 3 2)热浓酸性高锰酸钾氧化C CHR R 2R 1KMnO 4H +CRR 1O +R 2CO3)臭氧氧化C C R R 21CRR 1O +R 2CHO1)O 32)Zn/H 2O4)过氧酸氧化C C R R 21ROOOH21C C R R 2121Ag+O 25、烯烃的复分解反应CH 2RCH 2R1+催化剂C H 2CH 2RR 1【例】OH 22C 6H 5OC 6H 5+C H 2CH 26、共轭二烯烃 1)卤化氢加成CHCH 2HXCH 3XCH 23X高温1,4加成为主低温1,2加成为主2)狄尔斯-阿德尔(Diels-Alder )反应【描述】共轭二烯烃和烯烃在加热的条件下很容易生成环状的1,4加成产物。
【例】CH 2CH 2+O O苯∆O OCH 2CH 2+苯∆CHO2CHO二、脂环烃1、环丙烷的化学反应【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
H /Ni CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2CH 2【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。
【注】遵循马氏规则 【例】CH 3CH 2CH CH 2CH 32、环烷烃制备 1)武兹(Wurtz )反应【描述】通过碱金属脱去卤素,制备环烷烃。
【例】C CC 2H 5OHCC2XCH 2X 双键的保护2)卡宾 ①卡宾的生成 A 、多卤代物的α消除X3CH+-a,R-LiC XX+X-+HYB 、由某些双键化合物的分解CO H 2C :N 2H 2C :Cl 2H 2C :Cl-H 2OH 2+Cl 2C++++CO2②卡宾与烯烃的加成反应 【特点】顺式加成,构型保持 【例】Cl CH/NaOH相转移催化剂Cl Cl CH3CH 3Br CH/KOC(CH )3HOC(CH 3)33H3③类卡宾【描述】类卡宾是一类在反应中能起到卡宾作用的非卡宾类化合物,最常用的类卡宾是ICH 2ZnI 。
C H 2I2C u(Zn)IC H 2ZnI+制备【特点】顺式加成,构型保持 【例】CH I 3CH 3CH I 3H 3三、炔烃 1、还原成烯烃1)、顺式加成R 2R 1R 1R 2Cat=[P b/BaSO4,P b/CaC O 3,Ni 3B...](C H 3COO)2NiNaBH 4Ni 3BH 2Cat2)、反式加成R 2R 1H 2CatR 12Cat=[Na/ 液氨...]2、亲电加成 1)、加X 2R 2R 1Br 22R 1Br【机理】中间体Br+R 2R 1【特点】反式加成 2)、加HXCHR2HBrC CH 3BrCH 3RR HBrR Br (一摩尔的卤化氢主要为反式加成)3)、加H 2OCHRH 2OHgSO 4/H 2SO 4O3RCH RO重排【机理】CH RC+Hg+HRHg2+H 2OR Hg +OH 2+-H+R HHg +OH R Hg +H H +O 3R重排【特点】炔烃水合符合马式规则。
【注】只有乙炔水合生成乙醛,其他炔烃都生成相应的酮。
3、亲核加成 1)、CH 3CH CH+OOHCH 3Zn(CH 3COO)CH 2CH OCH 3OCH 3OH+CH 3COOCH 3HCHO H+2维尼纶合成纤维就是用聚乙烯醇甲酯2)、C H CH+HC NNH 4Cl,CuCl 2aqCH 2CNN CH 3C H 3H 3CH 3CN CH 2CN2CH人造羊毛3)、CH CH+C 2H 5OH碱150℃~180℃/压力CH 2CHOC 2H 54、聚合C H CH2Cu 2Cl 2NH 4Cl CH 2CH C CHC H CH3Cu 2Cl 2NH 4ClCH 2CH CHCH 2C H CH3金属羰基化合物C H CH3Ni(CN)25、端炔的鉴别C CHR CC -RAgC CH RC C -R CuCu(NH )+Ag(NH )+白色红色【注】干燥的炔银和炔铜受热或震动时易发生爆炸,实验完毕,应立即加浓硫酸把炔化物分解。
6、炔基负离子CC-RNa+1°烷基(2)H 2OR -L(L=X,OTs)R 1:(1)OO(1)(2)H 2OC CR R 1CCRCH 2R 1OHCCRC R 1OHR 2【例】CH CH NaNHCH C-Na+CH3CH3OH OCH C OHCH33 HPb/BaSO43CH2CH3OHAl O3C2CH2三、芳烃1、苯的亲电取代反应1)卤代+FeBr3Br+Br HBr22)硝化+NO2+H2OHN O3浓H2SO4浓3)磺化+SO3H+H2OH2SO( 7%SO3 )SO3HH+4)傅-克(Friedel-Crafts)反应①傅-克烷基化反应+RClAlCl 3R【机理】RCl+AlCl 3AlC l 4++R CH 2+RCH 2++HR++HR+++AlC l 4+R++HC lAlC l 3【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
【例】+CH 3ClAlCl 3CH3CH3+CH 3ClH 3CH 3AlCl 3CH 3CH 3CH 3CH2Cl2+2AlCl3CH1Cl3+3AlCl3②傅-克酰基化反应+R Cl AlCl3OR+OO ORRAlCl3OR+RCOOH 【例】CH3CH2COClAlCl3CH3OZn-HgHCl浓CH3 +OOAlCl3COOHO2、苯环上取代反应的定位效应1)第一类定位基,邻对位定位基,常见的有:NR2NH R NH2OH HN ROOR ROOR Ar X(F,C l,Br,I)2)第二类定位基,间位定位基,常见的有:NR3NO2CF3Cl3COOH OROCN SO3H CH OCOR【注】第一类定位基除卤素外,均使苯环活化。
第二类定位基使苯环钝化。
卤素比较特殊,为弱钝化的第一类定位基。
3、苯的侧链卤代CH3FehCH 3ClCH 3+CH 2ClCH 3NBSCH 2Br【机理】自由基机理 4、苯的侧链氧化1)用高锰酸钾氧化时,产物为酸。
【描述】苯环不易被氧化,当其烷基侧链上有α氢的时候,则该链可被高锰酸钾等强氧化剂氧化,不论烷基侧链多长。
结果都是被氧化成苯甲酸。
CH KMnO H +COOH【例】C CH 3CH 3CH 3CH 3KMnO H +C CH 3CH 3CH 3COOH2)用CrO3+Ac 2O 为氧化剂时,产物为醛。
【例】CH 3NO 2CrO /Ac OCH (OAc)2CH O23)用MnO 2为氧化剂时,产物为醛或酮。
CH 3MnO H 2SO 4CH OCH 2CH 3MnO H 2SO 4CH 3O5、萘αβ【特点】萘的亲电取代反应,主要发生在α位,因为进攻α位,形成的共振杂化体较稳定,反应速度快。
【例】HNO 3H 2SO 4NO2Br 2CCl 4BrH 2SO 4SO 3HSO 3HCH 3HNO 3HOAcCH 32CH 3HNO 3HOAcCH 3NO 2NO 2HNO 3H 2SO 4NO 2NO 2NO 22+四、卤代烃 1、取代反应 (1)水解R XOH -ROHR XRSH SH -(2)醇解R XROR 1R 1ONaR XRSR 1R 1SNa(3)氰解RR S R1CN -C 2H 5OH(4)氨解RX RNH 2NH 3RXNH 3R 3N(5)酸解R XR1COOR R 1COO -(6)与炔钠反应RX+R 1CC-C C RR1(7)卤素交换反应RXNaI丙酮R I2、消除反应 (1)脱卤化氢 ①β-消除CH CH 2RClHαβNaOH乙醇RCHCH 2【注】当有多种β-H 时,其消除方向遵循萨伊切夫规律,即卤原子总是优先与含氢较少的β碳上的氢一起消除。
【例】CH 3CH 3BrKOH乙醇CH 3CH 3CH 2CH 3+81%19%CH 3CH 3BrCH 2KOH乙醇CH 3CH 3CH 2C C R1RClH Cl HKOH乙醇CCRR1②α-消除C HCl ClNaOHCCl 2(2)脱卤素C C R R1R3R2Br Zn,∆乙醇R3R 2R R1RCH 2Br 2BrZn ∆R3、与活泼金属反应 (1)与金属镁反应RX+Mg无水乙醚RMgX(格式试剂)(2)与金属钠反应 武兹(Wurtz )反应2RX NaRR(3)与金属锂反应RX+Li无水乙醚RLi2RLi+CuI无水乙醚R 2CuLi2+LiX+LiI【注】二烷基铜锂主要是与卤代烃偶联成烷烃2R1XRR 14、还原反应RX+Zn+HClRH5、氯甲基化+CH OH+ClH ZnCl 2CH 3Cl五、醇1、卢卡斯(Lucas )试剂无水氯化锌与浓盐酸的很合溶液叫卢卡斯试剂,用于鉴别伯、仲、叔醇Lucas 试剂很快反应反应很慢反应很快立即混浊几分钟内混浊长时间不出现混浊叔醇仲醇伯醇2、把羟基变成卤基(1)、醇与卤化磷(PX 5、PX 3)R OHPX 3RX(2)、醇与亚硫酰氯(SOCl 2)R OHRCl SOCl 23、醇的氧化(1)沙瑞特(Sarret )试剂ROH CrO 3(C 5H 5N)2RO【注】沙瑞特试剂,是CrO 3和吡啶的络合物。
