溶液的基本性质
溶液的分类与性质
P2 % ...
...
◎稀釋濃硫酸:(放熱反應) 先將濃硫酸緩慢加入適量水中混合均勻,再置入容量瓶,加水至瓶頸刻度。 (若將水加入濃硫酸中,會突沸噴濺出來!)
5
四、實驗室常用酸鹼:購入瓶裝濃度以及注意事項
名稱 CM W% D
注意事項
鹽酸 HCl 12M 35% 1.19 侵蝕皮膚;產生 HCl 氣體,具有腐蝕性
NaOCl 的含量則達 0.2ppm,試問此二濃度分別相當於多少重量百分濃度(%)?
(A)3×10−4 和 2×10−4
(B)3×10−5 和 2×10−5
(C)6×10−4 和 2×10−4
(D)6×10−5 和 2×10−5
(E)1.2×10−4 和 2×10−5 。 【94 學測研究試題】D
【範例 3】《含結晶水之濃度運算》 將膽礬(CuSO4〃5H2O)250 克溶於 750 克水中,試求重量百分率濃度?(Cu=64) 16%
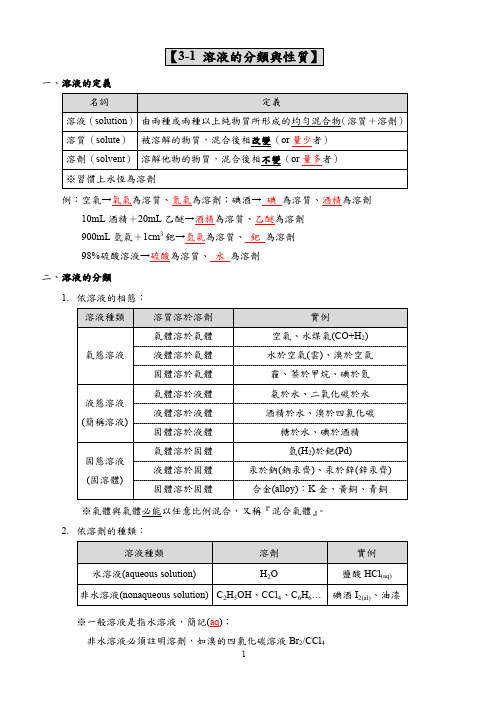
二、溶液的分類
1. 依溶液的相態:
溶液種類
溶質溶於溶劑
氣體溶於氣體
氣態溶液
液體溶於氣體
固體溶於氣體
液態溶液 (簡稱溶液)
氣體溶於液體 液體溶於液體 固體溶於液體
固態溶液 (固溶體)
氣體溶於固體 液體溶於固體 固體溶於固體
實例 空氣、水煤氣(CO+H2) 水於空氣(雲)、溴於空氣 霾、萘於甲烷、碘於氮 氨於水、二氧化碳於水 酒精於水、溴於四氯化碳
註 1:重量濃度與體積無關,故不受溫度影響;體積濃度與體積有關,故受溫度的影響。 (溫度只影響體積大小,不改變重量) 溫差大的實驗,採用重量濃度。體積濃度則因配製方便,適用於溫差小的實驗。
註
2:1ppm
1(g)溶質 106 (g)溶液
专题三 溶液的性质

专题三 溶液的性质一、知能要点1.溶液的特征是均一生、稳定性。
均一性是指溶液形成后,各部分的 相同,稳定性是指外界条件不变,溶质不会从溶液中 出来。
2.溶液由 和 两部分组成。
3.4.饱和溶液、不饱和溶液与浓溶液、稀溶液的关系(1)饮和溶液 是浓溶液,不饱和溶液 是溶液。
(填“一定”或“不一定”) (2)对于同一溶质来说,在一定温度下,它的饱和溶液总比不饱和溶液要 。
5.固体的溶解度在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量(克数),叫做这种物质在这种溶剂里的溶解度。
(1)四要素: 、 、 、 。
(2)影响因素 ⎧⎨⎩内因:溶质、溶剂的性质影响因素外因:(3)溶解性的区分度(20C时某物质的溶解度,S 表示溶解度)(4)溶解度曲线的意义①表示某物质溶解度随着温度变化的情况; ②表示某物质在任一温度下的溶解度;③比较不同物质在同一温度下的溶解度大小;④交点处表示不同物质在同一温度下溶解度相同;⑤交点处表示不同物质的饱和溶液中溶质的质量分数相同。
6.溶质的质量分数①定义:溶质的质量分数是溶质质量与溶液质量比的比值。
②表示方法:100% 溶质的质量溶质的质量分数=溶液的质量注:(1)溶液的质量 = 溶质的质量 + 溶剂的质量 (2)溶液的质量 = 溶液的密度×溶液的体积(3)溶质的质量是已溶解在溶液中的溶质,溶质的质量分数在一定满园内求才有意义。
影响因素: 、 的质量,与温度、压强无关。
二、知能运用典型例题:例1:杯中的某种溶液,倒掉一半后,对剩下的半杯溶液的描述正确的是( )。
A.比热容减半 B.密度减半 C.质量减半 D.溶质质量分数减半例2:如图所示的甲、乙两种物质的溶解度曲线,下列说法正确的是( ) A.乙的溶解度随温度变化比甲大B.1t C警方甲的溶解度大于乙的溶解度C.2t C时甲和乙的溶解度相等D.甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小 例3:关于溶液的叙述正确的是( ) A.溶液都是无色的B.饱和溶液一定是浓溶液C.糖水的溶质是水D.医用生理盐水是溶解三、知能运用提高训练。
常见的溶液知识点归纳有哪些

常见的溶液知识点归纳有哪些史上最全的溶液学问点已经总结出来,那么具体有哪些呢?想要看的请戳下文,下面是学习啦我共享给大家的常见的溶液学问点归纳,希望大家宠爱!常见的溶液学问点归纳一溶液的形成(一)溶液1. 定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2. 基本特征① 均一性:指溶液中各部分的浓度和性质都相同。
② 稳定性:外界条件不变(温度、压强不转变,溶剂不蒸发)时,溶质、溶剂不分层,也不会析出固体。
3. 组成溶液由溶质和溶剂两部分① 溶剂:能溶解其他物质的物质叫做溶剂,常见的溶剂有水、酒精、汽油。
水能溶解很多物质,汽油能溶解油脂,酒精能溶解碘等;通常不指明溶剂的溶液,一般指的是水溶液。
② 溶质:被溶解的物质叫做溶质,可以是固体、液体或气体。
③ 区分溶剂和溶质:固体(或气体)与液体混合时,固体(或气体)是溶质,液体是溶剂;液体和液体混合时,质量小的为溶质,质量大的为溶剂,假如其中一种液体是水,那么水是溶剂。
④ 同一物质在不同溶剂中的溶解性是不同的,不同物质在同一溶剂中的溶解性也是不同的。
例如:碘几乎不溶于水,却可以溶解在汽油中;高锰酸钾几乎不溶于汽油,却可以溶解在水中。
⑤ 溶液中溶质可以有一种或多种,但溶剂只能有一种。
⑥ 水和酒精能以任意体积互溶。
4. 关系① 溶液、溶质、溶剂的质量关系:溶液的质量=溶质的质量+溶剂的质量② 溶液、溶质、溶剂的体积关系:溶液的体积溶质的体积+溶剂的体积(缘由:分子之间存在间隔)(二)溶解时的吸热或放热现象1. 物质在溶解时,通常伴随着热量的转变,会使溶液的温度相应发生转变。
2. 有的物质溶解放热:氢氧化钠固体、浓硫酸、氧化钙等。
3. 有的物质溶解吸热:硝酸钾等。
4. 有的物质溶解没有明显的热现象:氯化钠等。
(三)悬浊液和乳浊液1. 悬浊液:固体小颗粒分散到液体里形成的混合物叫做悬浊液,例如钡餐(硫酸钡的悬浊液)、粉刷墙壁用的涂料、黄河水等。
(完整版)初三化学溶液知识点

《溶液》知识点一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性的混合物注意:a、溶液不一定无色,如CuSO4为蓝色FeSO4为浅绿色Fe2(SO4)3为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积≠溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)固体、气体溶于液体,液体为溶剂2、溶质和溶剂的判断有水,水为溶剂液体溶于液体,一般把量多的叫溶剂3、饱和溶液、不饱和溶液(1)概念:饱和溶液,指的是在一定温度下,一定剂量的溶剂里面,不能继续溶解溶质不饱和溶液:在一定温度下,在一定量的溶剂里,还能再溶解某种物质的溶液(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解(3)饱和溶液和不饱和溶液之间的转化注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
水溶液的某些性质PPT课件

身体健康,学习进步! 感动。
不尊重别人的自尊心,就好像一颗经不住阳光的宝石。——诺贝尔 青春如此华美,却在烟火在散场。 每件事情都必须有一个期限,否则,大多数人都会有多少时间就花掉多少时间。 上天不会亏待努力的人,也不会同情假勤奋的人,你有多努力时光它知道。
水溶液的某些性质
复习提问:
1.什么是物质的溶解? 2.什么是溶液? 3.溶液具有哪些特征?
溶液的性质: 均一性,稳定性
溶液还有哪些性质呢?
问题1:在严寒的冬季,厨房里的水结冰了,而食醋、 酱油容易结冰吗?
说明:溶液的凝固点低
问题2:
A
B
烧杯中液体未沸腾时
A
B
烧杯中液体沸腾时
问题:为什么A烧杯中试管里的Байду номын сангаас加热后不能沸 腾,B烧杯中试管里的水加热后能沸腾?
学以致用:
电工师傅常告诫小朋 友:潮湿的手不可以开 关电器,你知道是为什 么吗?
所以:我们要注意 安全用电
思考:
• 现有稀硫酸和水两瓶无色溶液,你 能设计几种方案来区别它们?
这个世界本来就是痛苦的,没有例外的。 别人都在假装正经的时候,我只好假装不正经。 太过于欣赏自己的人,不会去欣赏别人的优点。 生命在前进的同时,它就是在走向死亡。 为中华之崛起而读书。——周恩来 别人讲我们不好,不用生气难过;说我们好也不用高兴,这不好中有好,好中有坏,就看你会不会用? 人生最大的错误是不断担心会犯错。 在人生征途中有许多弯路小路险路暗路,只有意志坚定且永不停步的人,才有希望到达胜利的远方。 人总是珍惜未得到的,而遗忘了所拥有的。 在所阅读的书本中找出可以把自己引到深处的东西,把其他一切统统抛掉,就是抛掉使头脑负担过重和会把自己诱离要点的一切。 希望的灯一旦熄灭,生活刹那间变成了一片黑暗。——普列姆昌德 不要因为众生的愚疑,而带来了自己的烦恼。不要因为众生的无知,而痛苦了你自己。 你身边总有这样一种人:你成功了,他(她)当面恭喜你,暗地里妒嫉你;你失败了,他(她)当面安慰你,背地里笑话你。 山涧的泉水经过一路曲折,才唱出一支美妙的歌。 孤单寂寞与被遗弃感是最可怕的贫穷。
酸碱溶液的性质

酸碱溶液的性质酸碱溶液作为化学中重要的概念之一,是指溶解了酸或碱的液体。
它们具有不同的性质和特征,对许多领域和过程都具有重要影响。
本文将深入探讨酸碱溶液的性质,包括其定义、酸碱度、导电性、化学反应以及对生活和工业的应用等方面。
一、酸碱溶液的定义酸碱溶液是指溶解了酸或碱的液体,其中酸溶液呈酸性,碱溶液呈碱性。
酸和碱是一对相互对立的概念,称为互补酸碱。
在水中,酸会释放出氢离子(H+),而碱会释放出氢氧根离子(OH-)。
酸碱性质的强弱可通过酸碱指示剂的颜色变化、pH值等来判断。
二、酸碱度酸碱度是衡量酸碱溶液酸碱性强弱的指标。
常用的酸碱度指标是pH值,其数值范围是0-14。
pH值小于7表示酸性溶液,大于7则为碱性溶液,等于7为中性溶液。
pH值的变化是由溶液中氢离子或氢氧根离子的浓度引起的。
pH值越低,酸性越强;pH值越高,碱性越强。
三、酸碱溶液的导电性酸碱溶液的导电性是由其中的离子来决定的。
在水中,酸溶液会产生可导电的氢离子,碱溶液则会产生可导电的氢氧根离子。
因此,酸碱溶液都能够导电。
然而,中性溶液却无法导电,因为其中的氢离子和氢氧根离子浓度相等,导电效果相互抵消。
酸和碱的强弱也能够通过导电性来区分,强酸和强碱的导电性相对较强。
四、酸碱溶液的化学反应酸碱溶液之间可以产生中和反应,即酸和碱反应生成盐和水。
这种反应称为酸碱中和反应,其化学方程式可表示为:酸 + 碱→ 盐 + 水。
其中,酸和碱在反应中失去了它们的酸性和碱性性质。
需要注意的是,不同酸和碱之间具有不同的反应特征和反应程度。
强酸与强碱反应会释放出大量的热量,而弱酸和弱碱的反应则相对温和。
五、酸碱溶液在生活和工业中的应用酸碱溶液在生活和工业中有着广泛的应用。
其中,酸和碱作为化学试剂,被广泛应用于实验室分析、制药、农业等领域。
酸碱中和反应常用于水质处理、废水处理、钢铁冶炼等工业过程中,起到中和、中性化的作用。
此外,酸和碱也被用作食品加工中的调味剂和防腐剂。
化学必修1溶液的配制及分析

氧化还原反应
氧化还原反应是指电子转移的反 应,其中氧化剂获得电子并还原 其他物质,而还原剂则失去电子
并被氧化。
氧化还原反应的标志是元素化合 价的升降。
氧化还原反应广泛应用于化学合 成、工业生产和环境保护等领域。
05
实验:溶液的配制与分析
实验目的与要求
01
02
03
04
掌握溶液配制的基本原理和方 法。
溶解误差
如果溶解不完全或不充分,会 影响溶液的浓度。
转移和定容误差
如果转移或定容不准确,会影 响溶液的浓度。
03
溶液的分析方法
酸碱滴定法
80%
原理
通过滴定实验,利用酸碱指示剂 颜色的变化来确定滴定终点,从 而计算出待测溶液的浓度。
100%
操作步骤
选择适当的指示剂,用标准溶液 滴定待测溶液,观察指示剂颜色 的变化,记录滴定终点时消耗的 标准溶液的体积。
溶液中的溶质和溶剂是相对而言的,通常把被溶解 的物质称为溶质,而把能溶解其他物质的物质称为 溶剂。
溶液的组成
溶液由溶质和溶剂组成,溶质 可以是固体、液体或气体,溶 剂也可以是固体、液体或气体 。
在一定温度和压力下,溶质在 溶剂中的溶解度是有限的,当 达到饱和状态时,溶质和溶剂 将形成均一稳定的混合物。
掌握溶液配制的基本原理和方 法。
掌握溶液配制的基本原理和方 法。
掌握溶液配制的基本原理和方 法。
实验操作步骤
01
02
03
04
05
1. 准备实验仪器 2. 称量与溶解 和试剂
3. 转移与定容
4. 测量与记录 5. 误差分析
容量瓶、天平、烧杯、量 筒、胶头滴管、蒸馏水、 待测物质等。
初中化学溶液

初中化学溶液在初中的化学学习中,溶液是一个非常重要的概念。
它是一种将溶质和溶剂混合在一起形成的均一、稳定的混合物。
在这个混合物中,溶质可以是固体、液体或气体,而溶剂则可以是液体或气体。
在溶液中,溶质被分散在溶剂中,形成了一个均匀的混合物。
这种混合物的特点是,无论你取出溶液的哪个部分,它的组成都是相同的。
这就是溶液的均一性。
同时,溶液也是稳定的,也就是说,它不会像悬浊液那样沉淀,也不会像乳浊液那样分层。
溶液的形成是由于分子之间的相互作用。
当溶质溶解在溶剂中时,它的分子会与溶剂的分子相互作用,形成了一个新的物质分布均匀的系统。
这个过程可以理解为溶质的分子被溶剂的分子包围,形成了一个稳定的混合物。
初中化学中常见的溶液包括食盐溶液、糖溶液、酸碱溶液等。
例如,食盐溶液是由食盐和水混合而成的,其中食盐是溶质,水是溶剂。
糖溶液则是糖溶解在水中形成的,其中糖是溶质,水是溶剂。
酸碱溶液则是酸或碱溶解在水中形成的,其中酸或碱是溶质,水是溶剂。
这些溶液都有一些共同的性质。
它们都具有均一性和稳定性。
它们都可以通过溶剂和溶质的比例来控制溶液的浓度。
它们都可以通过加热或冷却来改变溶液的状态。
初中化学中的溶液是一个非常基础但重要的概念。
理解好溶液的性质和形成过程,对于进一步学习化学和其他科学学科都有很大的帮助。
初中化学溶液单元复习一、溶液的形成1、溶液1)溶液的概念:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,就是溶液2)溶液的基本特征:均一性、稳定性的混合物3)溶液的形成:溶液是由溶质和溶剂组成的溶质:被溶解的物质叫溶质溶剂:能溶解其他物质的叫溶剂2、饱和溶液与不饱和溶液1)饱和溶液:在一定温度下,一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
2)不饱和溶液:在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
二、溶液的组成1、溶质和溶剂的判断1)固体、气体溶于液体时,固体、气体是溶质,液体时溶剂,两种液体混合时量多的是溶剂,量少的是溶质,只要有水,水一定是溶剂。
溶液的性质

即:
mix S R n i ln x i
i ( ) T , n Vi P 将 i (T) = i* (T) + RT ln xi 代入上式,
偏摩尔体积:
G m ,i ( T ) Vi ( ) )T ,n Vm , i T ,n ( P P
i
38
• 理想溶液中,组分混合前后的体积改变:
mix V V混合后 V混合前
事实上, C10 以上的醇几乎不溶于水。
4
例2 固态盐类通常是离子晶体,离子间的引
力很大,只有用强极性的溶剂方能溶解,
非极性溶剂不能溶解。
例如一般无机盐在水中均有一定的溶解度,
而在有机溶剂的溶解度则大大降低。
定性规律需要实验确定
5
2)温度与溶解度:
溶解过程,通常伴随热效应,因此溶解 度往往与温度有关:
为纯
液体 i 的化学势;
i(T) 为理气 i 压力为 P 时的化学势。
36
结论:
凡是溶液中任一组分的化学势在全部浓
度范围内都满足化学势公式:
i (T) = i* (T) + RT ln xi
的溶液,称为理想溶液。反之亦然。
37
三、理想溶液的热力学特性
1. 由化学势 i 与 P 的关系:
同理:由于
x1
MA
c1
MA
A
c1
代入 P1= kx x1 得:
MA P1 k x c 1 k c c1 A
(其中:kc MA
A
kx )
27
即:
P1 = kx x1
P1= kmm1
P1 = kc c1
化学知识点-溶液

第10章溶液一、溶液、饱和溶液、不饱和溶液[要点1]溶液1.溶液的概念: 一种或几种物质分散到另一种物质里形成的均一、稳定的混合物。
2溶液的基本特征:(1)均一性: 溶液中各部分性质相同。
(2)稳定性: 若外界条件不变, 溶液可以永久存在。
(3)透明:由于溶液中存在的主要为单个分子、离子, 肉眼不可见, 也不阻碍光线透过, 所以溶液透明。
★注:①溶液不一定无色, 溶液可以有不同的颜色。
溶液中有Fe2+呈浅绿色, 有Cu2+呈蓝色, 有Fe3+呈黄色, 有MnO4-呈紫红色。
②均一稳定的液体不一定是溶液。
例如水。
3.溶液的组成:溶液=溶质+溶剂溶液的质量= 溶质的质量+ 溶剂的质量(1) 溶液的体积≠溶质的体积+ 溶剂的体积溶质: 被分散的物质。
溶质可以是固体、液体或气体。
如食盐水中的NaCl;氨水中的NH3;碘酒中的I2(2) 溶剂:溶质分散其中的物质。
溶剂通常为液体, 常见的有水、油等。
如食盐水、氨水中的水;碘酒中的酒精固体、气体溶于液体, 液体为溶剂(3)溶质和溶剂的判断有水, 水为溶剂, 液体溶于液体无水, 量多的为溶剂例题1.有关溶液的下列说法正确的是( )A.溶液一定是无色的B.溶剂一定是水C.浓溶液一定是饱和溶液D.溶液一定是混合物解析: 溶液是均一、稳定的混合物;溶液不一定是无色的;溶剂可以是水、酒精、汽油等多种物质;浓溶液不一定是饱和溶液, 判断溶液是否饱和是在一定的条件下是否能继续溶解该物质。
答案: D4.溶解过程:概念:溶质分散到溶剂里形成溶液的过程叫溶解。
物质溶解时, 同时发生两个过程:溶解是一个物理、化学过程, 并伴随着能量变化, 溶解时溶液的温度是升高还是降低, 取决于上述两个过程中放出和吸收热量的相对大小。
如: 浓硫酸稀释溶液温度升高, NH4NO3溶于水溶液温度降低。
[要点2] 饱和溶液和不饱和溶液:饱和溶液: 在一定温度下, 一定量的溶剂里, 不能再溶解某种溶质的溶液, 叫做这种溶质的饱和溶液。
碱性溶液的性质

碱性溶液的性质
碱性溶液是指溶液中含有氢氧根离子(OH-离子)的溶液,具有一系列特定的性质和行为。
本文将探讨碱性溶液的一些常见性质,包括pH值、电导性、中和反应、腐蚀性和用途等方面。
1. pH值
pH值是衡量溶液酸碱性程度的指标,其范围从0(酸性)到14(碱性),7为中性。
碱性溶液的pH值通常高于7,越高表示碱性越强。
在碱性溶液中,氢氧根离子的浓度较高,因此pH值较高。
2. 电导性
碱性溶液通常具有较好的电导性,因为氢氧根离子是带负电荷的离子,能够在溶液中自由移动。
当电流通过碱性溶液时,氢氧根离子会成为电流的导体。
因此,通过测量碱性溶液的电导性可以判断其是否为碱性溶液。
3. 中和反应
碱性溶液可以与酸性溶液进行中和反应,生成盐和水。
这是由于碱性溶液中的氢氧根离子与酸性溶液中的氢离子反应形成水。
中和反应是酸碱中最常见的化学反应之一,也是形成盐的途径之一。
4. 腐蚀性
一些强碱性溶液具有较强的腐蚀性。
碱性物质可以与皮肤和其他物质发生化学反应,损坏细胞和组织结构。
因此,在处理碱性溶液时,需要注意保护措施,避免与皮肤或眼睛直接接触。
5. 用途
碱性溶液在许多领域中有广泛的应用。
例如,氢氧化钠(NaOH)是一种常见的碱性溶液,广泛用于化学实验室中作为试剂。
碱性溶液还可用于清洁剂、肥皂和一些药物的制备过程。
综上所述,碱性溶液具有一系列特定的性质和行为,如较高的pH 值、良好的电导性、可以与酸性溶液发生中和反应、一些溶液有较强的腐蚀性,并且在许多领域有广泛的应用。
了解这些性质有助于更好地理解和应用碱性溶液。
乙醇溶液的定义

乙醇溶液的定义乙醇溶液,作为一种常见的化学物质,在我们的日常生活和工业生产中都有着广泛的应用。
了解乙醇溶液的定义、性质及其应用,对于我们更好地理解和利用这一物质具有重要意义。
本文将围绕乙醇溶液的定义展开讨论,通过深入解析其性质、制备方法及用途,以期帮助读者更全面地理解这一主题。
一、乙醇溶液的定义乙醇溶液是指将乙醇(C2H5OH)溶解于水中所形成的混合物。
乙醇是一种有机化合物,分子式为C2H5OH,具有刺激性气味。
在常温下,乙醇为无色透明液体,易挥发,能与水以任意比例互溶。
因此,将乙醇溶解于水中即可得到乙醇溶液。
二、乙醇溶液的性质1.物理性质:乙醇溶液具有无色透明、易挥发、易溶于水的特点。
随着乙醇浓度的增加,溶液的黏度会逐渐增大。
2.化学性质:乙醇是一种弱酸性物质,具有较强的还原性,可与多种物质发生氧化还原反应。
此外,乙醇还具有酯化反应的能力,可以与羧酸发生酯化反应生成酯类物质。
三、乙醇溶液的制备方法1.直接溶解法:将乙醇直接溶解于水中,得到一定浓度的乙醇溶液。
2.稀释法:将高浓度的乙醇溶液稀释至所需浓度。
3.化学反应法:通过化学反应生成乙醇溶液,例如通过酯化反应生成酯类物质的水溶液。
四、乙醇溶液的应用1.工业生产:乙醇溶液在工业生产中有着广泛的应用,如用作溶剂、清洗剂、燃料等。
2.医药领域:乙醇溶液在医药领域中常用于消毒、杀菌和防腐,如医疗器械、药品等的消毒。
3.食品加工:乙醇溶液在食品加工中可作为溶剂和调味剂,如制作酒类、饮料等。
4.化学分析:乙醇溶液在化学分析中可作为溶剂和稀释剂,用于样品的溶解和稀释。
通过对乙醇溶液的定义、性质、制备方法及应用的探讨,我们可以看到这一物质在日常生活和工业生产中的重要性。
深入理解乙醇溶液的性质和应用有助于我们更好地利用这一物质,满足不同领域的需求。
希望本文能够激发读者对乙醇溶液的兴趣,进一步探索其在各个领域的应用价值。
真溶液的主要特征

真溶液的主要特征真溶液是一种由溶质和溶剂组成的均匀混合物,其中溶质以分子或离子的形式被溶解在溶剂中。
真溶液是一种常见且重要的物质状态,具有许多特征和性质。
1. 均匀性:真溶液具有很高的均匀性,溶质分子或离子被充分分散在溶剂中,形成一个均匀的混合物。
这是因为在溶解过程中,溶质与溶剂发生相互作用,使得溶质与溶剂的分子或离子能够均匀分布。
这种均匀性使得真溶液在宏观上看起来透明无浊点,可以通过肉眼观察到。
2. 透明性:真溶液通常是透明的,光线经过溶液时不会发生散射或折射。
这是因为真溶液中溶质分子或离子的大小与溶剂的分子或离子大小相当,并且它们之间互相作用力适当,不会散射或阻碍光线通过。
透明性使得真溶液在光学、电子学以及许多其他应用中有广泛的应用。
3. 溶解度:真溶液的溶解度是指在一定温度和压力下,单位溶剂中能溶解的最大溶质量。
溶解度取决于溶质与溶剂之间的相互作用力,以及温度和压力等条件。
对于一些溶解度可变的溶质,饱和溶解度还与溶液中已有溶质量有关,符合饱和溶解度曲线。
溶解度的研究对于了解溶质的溶解行为、背后的化学原理以及溶液的稳定性和反应动力学都具有重要意义。
4. 稀释性:真溶液可以通过增加溶剂的量来进行稀释,这是因为溶质与溶剂之间的相互作用力较弱。
稀释会导致溶质分子或离子在溶液中的浓度降低,使得体系的密度和浓度减少。
稀释性使得真溶液在实验室和工业生产中可以方便地进行调整和处理,从而满足特定需求。
5. 物理和化学性质:真溶液的性质取决于溶质和溶剂的种类以及它们之间的相互作用。
一般来说,真溶液具有溶质和溶剂的性质,并且还可能呈现出溶质和溶剂所不具备的新的特性。
溶质在真溶液中可以发生化学反应、电离或形成配合物,这些反应会导致溶液的化学性质发生变化。
此外,真溶液中还可以发生物理性质的变化,如电导性、折射率、沸点和冻结点等。
总之,真溶液具有均匀性、透明性、溶解度、稀释性以及物理和化学性质等特征。
这些特征使得真溶液在许多领域的应用中起到重要作用,例如化学反应、生物化学、分析化学、药物制备、环保处理等。
化学教案溶液与溶液的性质

化学教案溶液与溶液的性质标题:溶液与溶液的性质——一个让化学魅力显现的教案引言:众所周知,化学是一门深受学生厌恶的学科,但事实上,化学蕴含着它独特的魅力,它可以帮助我们了解物质的本质,解释世界的运行机制。
本教案的主题是溶液与溶液的性质,通过精心设计的学习活动,将帮助学生深入理解溶液的形成和相关性质,培养学生的观察和实验技能,激发学生对化学的兴趣和热爱。
一、背景知识:溶液的基本概念(800字)1.1 溶液的定义及组成在化学中,溶液被定义为由溶质和溶剂组成的均匀混合物。
溶质是指被溶解的物质,溶剂是指溶解溶质的物质。
1.2 溶解过程与溶解度介绍溶解的过程,解释溶解度与溶解过程的关系,以及影响溶解度的因素。
1.3 饱和溶液与浓度的关系探讨饱和溶液的概念、判断方法和浓度与溶解度的关系。
二、实验与观察:溶液的形成和溶液的性质(600字)2.1 实验一:探究溶解度和温度的关系通过实验,让学生观察和记录溶解度和温度的关系,引导学生加深对溶解度与温度的理解。
2.2 实验二:比较不同溶质的溶解速度设计实验,让学生比较不同溶质的溶解速度,并引导他们从宏观实验观察到微观理论解释。
2.3 实验三:探究溶解度和溶质粒子大小的关系通过实验,让学生探究溶解度与溶质粒子大小的关系,引导学生理解溶解过程的微观图像。
三、应用探究:饮料中的溶解实例(400字)3.1 饮料的溶解原理介绍饮料中的溶解原理,其中包括可溶性固体、气体和液体成分的溶解。
3.2 饮料中的溶解过程通过案例分析,让学生了解饮料中不同成分的溶解过程,从而进一步理解溶液的形成。
3.3 对饮料中溶解性成分的测定引导学生了解如何通过实验对饮料中的溶解性成分进行测定,培养学生的实验技能和数据处理能力。
四、拓展应用:溶液的应用领域(600字)4.1 医学应用:药物溶解和胶囊制备探讨药物在医学中的溶解原理和胶囊制备方法,引导学生关注医学中的溶液应用。
4.2 工业应用:化学反应的溶液条件介绍工业生产中利用溶液条件进行化学反应的重要性和溶液的应用领域。
浅谈溶液及其性质

浅谈溶液及其性质
请输入您的姓名
目 录 contents
01
溶液的基本概念
定义,组成,分类,表示,基 本性质及分类
02
拉乌尔定律
影响蒸气压,沸点,凝固点
03
溶液的渗透压
定义,计算
01
溶液的基本概念
定义,组成,分类,表示
定义及组成
溶液:物质以分子、原子或离子
状态分散于另一种物质中构成的
均匀而又稳定的单相体系称为溶 液。 溶液由溶剂与溶质组成
03
溶 液 的 渗 透 压
定义,计算
渗透压的相关定义
渗透压
当半透膜两侧透过的溶剂 分子数相等这时溶液液面
半透膜
只允许溶剂通过,而溶质不
渗透
半透膜两侧的溶液因浓度不同 上增加的压力叫渗透压
能通过的膜为半透膜
而出现液面差的现象称为渗透
产生渗透的条件
1
要有半透膜
是半透膜两侧存在溶液浓度差
2
渗透方向是溶剂由稀溶液向浓溶液渗透
沸点升高
稀溶液的蒸 气压曲线
ΔTfb 273.16K
熔点升高和蒸气压降低
难挥发非电解质稀溶液的沸点升高和凝 固点降低与溶液的质量摩尔浓度成正比 实验表明:Δ Tbp∝mB 所以 Δ Tbp=Kb•mB 同理:Δ Tfb=f•mB
Kb Kf:溶剂沸点升高常数和凝 固点降低常数,他们只取决于溶 剂本身的性质,而与溶质无关, 不同溶剂的值不同。
了,使单位时间内从溶液表面逸出液面的溶剂分子
数比纯溶剂减少。当达到平衡时,溶液液面上单位 体积内气态分子数目比纯溶剂少。因此难挥发非电 解质稀溶液的蒸气压必然低于纯溶剂的蒸气压
溶液的蒸气压下降的计算
溶液的性质

溶液性质
一、溶液性质
1、均一性:溶液各处的密度、组成和性质完全一样;
2、稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离(透明);
3、混合物:溶液一定是混合物。
二、扩展资料:
溶液的组成:
1、从宏观上看,溶液是由溶质和溶剂组成的。
溶质:被溶解的物质
溶剂:能溶解其它物质的物质
2、从微观上看,溶液的形成过程是溶质的分子(或离子)均一地分散到溶剂分子之间。
3、溶液、溶剂和溶质之间的量的关系
溶液质量=溶质质量+溶剂质量;溶液体积≠质体积+溶剂体积。
氨甲醇溶液的基本参数

氨甲醇溶液的基本参数氨甲醇溶液是指将氨和甲醇混合而成的溶液。
它是一种常用的有机溶剂,具有多种应用,比如用作溶剂、药物原料等。
本文将围绕氨甲醇溶液的基本参数展开,探讨其物理性质、化学性质、应用范围及注意事项等方面的内容。
一、氨甲醇溶液的物理性质1. 外观和色彩:氨甲醇溶液通常是无色透明的液体,但随着浓度的增加,其色彩可能会逐渐变成淡黄色或淡蓝色。
2. 气味:氨甲醇溶液具有刺激性的气味,类似于氨水和甲醇的气味,因此在使用时应当注意通风换气,避免吸入大量气味。
3. 沸点和密度:氨甲醇溶液的沸点和密度随着溶液中氨和甲醇的浓度而有所变化,通常情况下,其密度介于水和甲醇之间,沸点也随浓度的变化而有所不同。
4. 溶解性:氨甲醇溶液在常温下具有较好的溶解性,可以与多种有机物和部分无机物发生混合溶解反应。
5. pH值:氨甲醇溶液在溶剂中的pH值通常呈中性到碱性,但随着浓度的增加,其pH 值可能会逐渐升高。
二、氨甲醇溶液的化学性质1. 安全性:由于氨甲醇溶液中含有氨和甲醇这两种有毒物质,因此在使用时必须注意安全防护,避免接触皮肤和吸入气味,同时加强通风换气,以防止中毒事故的发生。
2. 稳定性:氨甲醇溶液在室温下属于稳定状态,但是在高温高压下或者受到光照的辐射作用下可能会发生化学反应,产生有毒气体或极易燃的物质,因此在储存和使用时需谨慎防范,并严格按照相关规定进行操作。
3. 反应性:氨甲醇溶液在一定条件下会发生与其他化合物的反应,比如与醛、酮、酸、碱等物质发生加成反应、缩合反应等,因此在使用时需要谨慎避免混合反应导致的不良影响。
三、氨甲醇溶液的应用范围1. 作为溶剂:氨甲醇溶液在化工领域中被广泛应用,可以用作有机合成的溶剂,用于进行酯化、醇化、缩合等有机反应,也可以用于提取和分离化合物。
2. 药物原料:氨甲醇溶液中的氨和甲醇都是一些药物原料的主要成分,可以作为制备药品、消毒剂等药物原料的中间体,也可以用于制备某些口服药物的溶剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
难溶物质的溶解度及表示方法
• 通常溶解度的概念很难用于难溶物质溶解度的表达,因为其物质 在溶液中的含量很低,按溶质考虑几乎不变。
• 难容物质的结晶主要是用于反应结晶过程,使用两种或两种以上 可溶性物质反应,其产物为难容物质
• 难溶物质的溶解特性按离子反应平衡来描述。
• 平衡常数定义为
Hale Waihona Puke AgCl(s) Ag Cl
• 实验测量 : • 当热力学数据得知时,进行计祘Hand book of aqueous electrolyee
thermodynamics. zemaies et al.1986.
有机物的溶解度
• 无机物的溶解度主要以水做溶剂 – 可使用溶剂添加剂
• 有机物的溶解度依赖于溶剂的选择,同种物质在不同 溶剂中具有不同的溶解度(图1.11, 1.12)
• 有机物质的这一特性对选择结晶过程很重要,选择适 合于结晶过程的溶剂会使结晶过程容易操作和控制 – 混合溶剂
• 根据热力学数据有机物质在有机溶液中可以估祘。 – 溶解度的计算
溶解度的测量方法
• 准确的溶解度的数据是结晶过程研究、设计和 操作的关键数据
• 文件中的溶解度的数据有限,很多情况下所研 究的物质的溶解度不能在文献中查到
(AgCl) 活度系数为1
Ksp mAg mCl
• 这个方程叫氯化银的溶度积。 • 通常情况下溶度积被用于描述难溶物质在水溶液中的溶解度和平衡
(饱和)状态。
• 如果反应的离子摩尔数不是1:1例如硫酸银的离子反应
K m m 2
sp
Ag
SO42
• 溶度积的概念能被用于计算其他物质对给定物质的溶解度 的影响(同离子效应)如在氯化钠溶液中,银的溶解度会 随溶液中氯离子的浓度升高而降低。
• 一般情况下,由于其他物质的存在,难溶物质在水中 的溶解度会随其他盐的浓度增加而有所增加。 这一现 象叫做盐效应。(图1.4,1.5,1.6)
• 溶液的pH也会影响其溶解度。(图1.7 )
溶解度数据
• 文献中检索: – solubilities - inorganic and metal-organic compaund.Vol.1, inke W.R.and seidell1985. – 一般规则 • 大多无机物在水中的溶解度随温度的变化比较容易获得。 • 其它盐对某种物质的溶解度的数据比较难找 • 复杂体系的数据就更困难,或几乎找不到。
溶解度
• 在一定的温度下,平衡状态下溶液中最大的溶质含量 叫做溶解度,当溶液中的溶质达到最大溶质含量时, 此溶液叫作饱和溶液。其相应的浓度叫饱和浓度。
• 溶液的溶解度主要依赖于 – 物系 – 温度 – 其他组分的含量 (杂质) – 溶剂的性质和组成
溶解度在结晶过程中的作用
• 是结晶过程的基础数据可用于 – 结晶方法的决定 • 冷却 • 蒸发 • 闪蒸 • 反溶剂结晶 – 结晶操作点的确定 • 工艺路线与工艺参数 • 控制方法 – 直线,曲线 – 结晶过程物料、热量衡算的基础
• 用计祘的方法往往也很难得到准确的溶解度的 数据。
• 尤其是在实际生产过程中溶液中有很多杂质, 杂质对溶解度的影响差异很大。
• 因此实际测量更可靠。
测量方法- 恒温法
• 在恒温装量中加入定量的溶剂(温度误差小于 0.1度)
• 加热溶剂到要求的温度(高温下加冷凝器或密 封,以防蒸发)
• 加过量的溶质于溶剂中搅拌,恒温超过4小时 或更长,24小时更好。
• 在溶剂中加入过量的溶质,升温至全部溶质溶解。 此方法假设在溶质全部溶解时的溶解浓度为其饱 和溶液。(溶解也于是平衡状态,过低估计)
溶液的性质
• 溶液是由一种或多种物质组成的均一相混合物 • 描述溶液的基本性质主要有:
– 粘度 – 浓度 – 溶解度 – 过饱和度 – 沸点,及沸点升 – 悬浮密度
溶液的粘度
• 溶液的粘度是衡量其流动性质的一个参数。粘度越高 溶液的流动性越差:黏度的基本定义:
dU
dy • 溶液的粘度随温度的升高而减小。 • 溶液的粘度虽固体含量的增加而增大-流变学 • 溶液的粘度与固体颗粒的大小相关,在相同的固体含
量 下,颗粒越小溶液的粘度越高 • 溶液的黏度对结晶过程的影响:
– 颗粒的悬浮状态 – 成核过程 – 成长过程
溶液的浓度
• 溶液是由溶剂与一种或多种溶质组成, “浓度”是 描述溶液中溶 质含量的多少的参数。
• 表示浓度的单位很多,主要有质量分率,摩尔分率,体积浓度, 摩尔浓度等,重量浓度等。 – 质量溶质/质量溶剂 (kg溶质/kg溶剂) – 摩尔溶质/摩尔溶剂 (摩尔溶质/摩尔溶剂) – 质量溶质/质量溶剂 (kg溶质/kg溶液) – 摩尔溶质/摩尔溶剂 (摩尔溶质/摩尔溶液) – 质量溶质/体积溶液 (kg溶质/m3溶液) – 摩尔溶质/体积溶液 (摩尔溶质/ m3溶液)
• 溶度积的另一个用途是在混合物中确定微溶物质的溶解度, 在已知各种可能的离子反应和其相应的溶度积的情况下, 可以估算微溶物质在混合物中的溶解度。在没有确切的数 据的情况下,这种大体的估算有时很有用途,尤其是对分 析体系的变化趋势时是很有用的。
难溶物质在浓溶液中的溶解度
• 溶度积的概念在稀溶液中描述溶质的溶解度是可以近 似认为是准确的,然而,在浓溶液中,由于电荷的相 互作用,复杂的溶液性态,和非理想溶液的性质的影 响,其他盐离子对所研究物质的溶解度的影响的估算 是一个相当复杂的问题。
K a a Ag Cl aAgCl
• a 为离子的活度,如果固体物质(AgCl)在它的稳态晶体形态, 在一个大气压下,(叫标准态)难容物质的活度(aAgCl)为1。
• 平衡常数方程变为:
K sp
a Ag aCl
Ag
(m Ag
)
Cl
(m Cl
)
• γ为离子活度系数,m 为以摩尔为单位的离子浓度。对难容物质
• 取溶液分析 • 样品分析
– 可用化学或仪器分析法 – 可蒸干溶剂称重
容易带来误差的两种测量方法
• 对已知浓度的溶液,升温到全部溶质溶解,然后 冷却到第一个晶体出现。认为,此时的温度为此 溶液浓度所对应饱和温度。而此温度下的溶解度 为此溶液的浓度,这是不正确的。因为此时是过 饱和溶液(超过饱和含量)。
