2018版高考化学二轮复习第五章物质结构元素周期律5.1原子结构课件20180324476
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
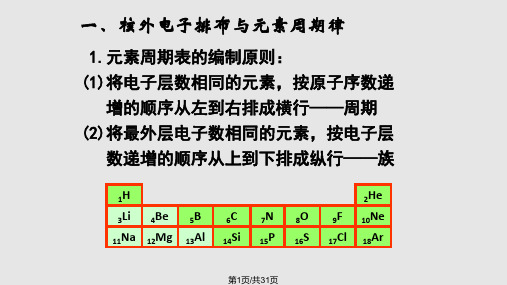
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
高考化学二轮复习课件:专题6物质结构和元素周期律

专题六 物质结构和元素周期律
栏 目 链 接
K 课标考 纲展示
考纲展示 1.了解元素、核素和同位素的含义。 2.了解原子构成;知道原子序数、核电 荷数、质子数、中子数、核外电子数以及 它们之间的相互关系;了解原子、离子等 概念的含义。 3.了解1~18号元素的原子核外电子排布 ,能用原子结构示意图表示原子和简单离 子的结构。 4.了解元素周期表(长式)的结构(周期、 族)及其应用。掌握同一周期、同一主族元 素的原子结构与元素性质的递变规律。 5.了解元素(主族和零族)原子结构、在周 期表中的位置、性质及其它们之间的关系 。 6.知道化学键的含义。能用电子式、结 构式和结构简式表示某些物质的结构。 7.能识别典型的离子化合物和共价化合 物,能从化学键变化的角度认识化学反应 的实质。
栏 目 链 接
(1) 这些元素中, ________ 是最活泼的金属元素; K
________ 是最活泼的非金属元素; ________ 是最不活泼 F Ar
的元素。
H核心 自 查 (2) 短 周 期 元 素 最 高 价 氧 化 物 对 应 的 水 化 物 中 , HClO4 酸性最强; ________ NaOH 碱性最强; ________ Al(OH)3 呈两性 ________ (填化学式)。 (3)⑥和⑭的金属性较强的是________ ;其最高价氧化 Ca 物 的 水 化 物 的 碱 性 强 弱 顺 序 是 Ca(OH)2>Mg(OH)2 _____________________________________________ 。
栏 目 链 接
栏 目 链 接
H核心 自 查 1.下列 8 种符号: 36Li、37Li、 23Na、 11
医用化学第5章 原子结构和元素周期律课件

取值:受l 限制,可取包括0、±1、±2、 ±3……直至±l,共2l+1个数值。
l值
0
1
2
m值
0 -1, 0, 1 -2, -1, 0, 1, 2
m意义:决定原子轨道和电子云在空间的伸展方向。
s、p、d、f 轨道依次有1、3、5、7 种取向。
即:s 亚层只有1个AO; p 亚层有3个AO; d 亚层有5个 AO; f 亚层有7个AO.
解: (1) m = +2, +1, 0, -1, -2 (2) l = 1, 0
二、氢原子的波函数的角分布图和基态电子云图
(一)概率密度和电子云
将空间各处|ψ |2(概率密度)用疏密程度不 同的小黑点表示,所得图形称为电子云 (electron cloud),其单位体积内黑点数与 |ψ |2成正比的。
某些元素的原子半径(r/pm)
1
18
ⅠA
0
H2 32 ⅡA
Li Be 123 89
Na Mg 3 4 5 6 7 8 9
154 136 ⅢB ⅣB ⅤB ⅥB ⅦB
Ⅷ
13 14 15 16 17 He ⅢA ⅣA ⅤA ⅥA ⅦA 93
B C N O F Ne 82 77 70 66 64 112
亚层表示举例: n=2,l=0的称2s电子亚层; n=3,l=1的称为3p电子亚层
(3)在多电子原子中配合n一起决定电子的 能量。 n 相同, l 越大,能量越高。
Ens< Enp< End <Enf
氢原子例外:Ens= Enp= End =Enf
原因:氢原子是单电子原子
(三)磁量子数 m (magnetic quantum number)
复习章节物质结构元素周期律市公开课金奖市赛课一等奖课件

质量数:将原子核内所有质子和中子相 对质量取近似整数值加起来,所得值。
质量数(A)=质子数(Z)+中子数(N)
同位素:质子数相同而中子数不同同一个元素不同原子互称同位素。
同位素相对原子质量 同位素一个原子质量
= 碳-12一个原子质量1/12
第5页
例: 一个氧原子16O质量 一个碳原子12C质量1/12
第15页
Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
碱
Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH– = AlO2– + 2H2O
酸
Al(OH)3是两性氢氧化物
既能跟酸反应,又能跟碱反应氢氧化物, 叫作两性氢氧化物。
4. 阴离子 :核电荷数=质子数<核外电子数,
核外电子数=b+n
第2页
核外电子数相同(10个电子)微粒
原 子: Ne
分 子: CH4、NH3、H2O、HF 阳离子: Na+、Mg2+、Al3+、 H3O+ 、NH4+ 阴离子: O2- 、F-、OH-
第3页
掌握下列几种概念: 1、什么是质量数?什么是同位素? 2、什么是同位素相对原子质量? 3、元素相对原子质量: 4、元素近似相对原子质量:
周期表结构:
①周期:7个周期(7个横行)(三短,三长,一不完全)
②族:16个族(18个纵行)
7个主族:由短周期和长周期共同构成族
7个副族:仅由长周期元素构成族
Ⅷ族:(8,9,10三个纵行)Fe、Co、Ni等9种元素
高三化学高考备考专题物质结构元素周期律课件

Cl2得到电子的能力比Br2的弱
如N2的电子式错写为N⋮⋮N。
CO2的结构式:O==C==O
正误判断,正确的打“√”,错误的打“×”
氯和溴属于同一主族,最外层电子数相等,D项错误。
备考要点
1.掌握微粒结构与相互作用力间的关系,能熟练书写微粒的电子式。 2.掌握表示微粒结构及组成的化学用语。 3.掌握元素周期表和元素周期律,会利用其推断“位—构—性”
4.理清化学键类型与物质类型的对应关系
5.表示物质组成和结构的化学用语 结构示意图
球棍模型 比例模型
电子式
CO2:
结构式
结构简式 分子式或化
学式
乙醇: 对二甲苯:
明矾:KAl(SO4)2·12H2O
6.常考微粒电子式类型 (1)阳离子,如:Na+、Ca2+、
(2)阴离子,如:
、
、
(3)官能团,如:羟基
对点训练
1.氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依 次增大的同族元素,则镆(Mc)在元素周期表中的位置为_第__七__周__期__Ⅴ__A_族__, 已知某种Mc同位素的质量数为288,则其中子数为__1_7_3_。 2.短周期元素aA+、bB2+、cC2-、dD-具有相同的电子层结构,则 (1)原子序数大小关系: b>a>d>c 。 (2)原子半径大小关系: A>B>C>D 。 (3)离子半径大小关系: C2->D->A+>B2+ 。
解析 等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B项 正确; 24 g镁、27 g铝的物质的量均为1 mol,1个镁原子和1个铝原子所含的质 子数分别为12、13,故24 g镁与27 g铝中含有的质子数分别为12 mol和13 mol, A项错误; 1个重水分子含有10个中子,1个水分子含有8个中子,1 mol重水与1 mol 水中含有的中子数之比为10∶8(5∶4),C项错误; 1个乙烷分子中含有7对共用电子,而1个乙烯分子中含有6对共用电子, 故1 mol乙烷与1 mol乙烯中,含有的化学键数之比为7∶6,D项错误。
2018高考化学(全国通用版)大一轮复习第五章物质结构元素周期律第1讲原子结构

原子
元素
化学
第2页,共21页。
2.原子结构中的微粒关系
(1)原子
中子
质子
(2)离子的核外电子数
核外电子数
阳离子:质子数-电荷数 阴离子: 质子数+电荷数
第3页,共21页。
3.同位素 核素
(1)概念辨析
质子 质子
质子
中子
中子
第4页,共21页。
(2)同位素的特征
①相同存在形态的同位素,化学性质
几乎完全,相物同理性质
正确的是(
)
D
A.元素Z的气态氢化物分子中含有10个电子
B.元素Y的气态氢化物分子中含有18个电子
C.元素Z与元素X形成的化合物X2Z中离子都达到稳定结构 D.元素Y、Z组成的化合物属于离子化合物
解析:由Y-知Y为非金属,结合Z的质子数比Y少9,则Y为第ⅦA族的Cl、Z为O,由
此可知X为K。水分子中含有10个电子,HCl分子中含有18个电子,K2O中的K+、 O2-均达到最外层8电子稳定结构。氯、氧组成的化合物为共价化合物。
不同 。
②天然存在的同一元素各核素所占的原子百分数一般
。 不变
(3)常见的重要核素及其应用
核素 用途
U 235
92
核燃料
14 6
C
用于考古断代
2H
3H
1
1
制 氢弹
18 O
8
示踪原子
第5页,共21页。
【多维思考】 1.判断下列说法是否正确,正确的画“√”,错误的画“×”。 (1)所有的原子中都含有质子和中子。( ) (2)2H+核外电子数为2。( ) (3)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原 子。( ) (4)H3O+和OH-中具有相同的质子数和电子数。( ) (5)质量数就是元素的相对原子质量。( )
高考化学大一轮复习 第5章 物质结构 元素周期律 51 元素周期表和元素周期律课件

12/12/2021
30
板块一
板块二
板块三第三十页,共五十页。
高考一轮总复习 ·化学 (经典版)
2.用 A+、B-、C2-、D、E、F、G 和 H 分别表示含有 18 个电子的八种微粒(离子或分子),请回答下列问题:
(1)A 元素是___K___、B 元素是__C__l__、C 元素是__S__。 (用元素符号表示)
题组一 等电子粒子的判断与应用 1.A+、B+、C-、D、E 五种粒子(分子或离子)中,每 个粒子均有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。
12/12/2021
28
板块一
板块二
板块第三二十八页,共五十页。
高考一轮总复习 ·化学 (经典版)
请回答: (1)C-的电子式是_____··O_····_··H__]_-______。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: ________N__H_+ 4__+__H_2_O____N__H_3_·_H_2_O_+__H__+_____、 _________H_3_O__+_+__N_H__3=_=_=__N_H__+ 4 _+__H_2_O_________。
高考一轮总复习 ·化学 (经典版)
第5章 物质结构(jiégòu) 元素周期律
第1节 原子结构
12/12/2021
1
板块一
板块二
板块三第一页,共五十页。
高考一轮总复习 ·化学 (经典版)
考试说明
1.了解原子结构示意图、分子式、结构式和结构简式 的表示方法。
2.了解相对原子质量、相对分子质量的定义,并能进 行有关计算。
12/12/2021
第五章第一讲 原子结构

D )
m mol,所以形成的
R2-含有的电子为
m - n- 2 A. mol w-m
m-n-2 C.w mol m
w(m-n) B. mol n
m-n+2 D.w mol m
w / m (m-n+2)mol,
故选D。
考点突破 实验探究 高考演练 课时训练
考点一 原子的构成
阴离子所带电荷数 (4)阴离子的核外电子数=质子数+ - ____ ____ ____ ___ ___ ___
考点突破 实验探究 高考演练 课时训练
考点一 原子的构成
1.任何原子内都有中子吗?
不是,如1H
+c b d+ 2.试解释符号 a e 中各字母的含义。
X
考点突破 实验探究 高考演练 课时训练
考点一 原子的构成
解析: 题组一 粒子中微粒关系的判断 1.X、Y、Z三种主族元素,X+和Y-两种离子 具有相同的电子层结构,Z原子核内质子数 比Y原子核内质子数少9,Y-在一定条件下 可被氧化成YZ。下列说法正确的是( ) A.离子半径X+>Y- B.X、Y、Z均属于短周期元素 C.化合物XYZ的溶液具有漂白性 D.Y属于ⅤA族元素
中子数 不同的同一元素的不同原子互 ②同位素:质子数相同而_________
称同位素。
质子数 的同一类_______ 原子的总称。 ③元素:具有相同_________
考点突破 实验探究 高考演练 课时训练
考点二 元素
核素
同位素
(2)三者的关系
考点突破 实验探究 高考演练 课时训练
考点二 元素
核素
对象
微观概念,指元素 的具体的某种原子
高考化学一轮复习 第5章 物质结构 元素周期律 第1讲 原子结构课件

【归纳提升】 (1)一种元素可以有多种核素,也可 能只有一种核素。
(2)有多少种核素就有多少种原子。 (3)同位素:“位”即核素在元素周期表中的位置相 同。
(4)核变化不属于物理变化,也不属于化学变化。
考点二 原子核外电子排布的规律
1.电子层的表示方法及排布规律 (1)电子层的表示方法。
(2)核外电子排布规律。 2.原子结构示意图
C.5267Co、5277Co、5287Co、5297Co 和6207Co 互为同位素,物 理性质几乎相同,化学性质不同 D.5267Co、5277Co、5287Co、5297Co 和6207Co 互为同分异构体
解析:5267Co、5277Co、5287Co、5297Co 和6207Co 互为同位素,物 理性质不同,化学性质几乎完全相同,A、C、D 错误; 6207Co 的中子数为 60-27=33,与电子数之差为 33-27 =6,B 正确。 答案:B
第1讲 原子结构
【最新考纲】 1.了解元素、核素和同位素的含义。 2.了解原子的构成;了解原子序数、核电荷数、质 子数、中子数、核外电子数以及它们之间的相互 关系。 3.了解原子核外电子排布。
考点一 原子的构成及其微粒间的数量关系
1.原子的构成
2.原子结构中的微粒关系 (1)原子。
(2)离子的核外电子数。 核外电子数阳阴离离子子::质质子子数数-+电电荷荷数数
解析:氘(12H)是氢元素的一种核素,含有一个质子、一个 中子和一个电子,与 1H 互为同位素,A 项、B 项正确; 由同种元素形成的不同单质之间互称为同素异形体,C 项错误;1H182O 与 D162O 的相对分子质量均为 20,D 项 正确。 答案:C
4.(2015·唐山检测)具有广泛用途的6207Co 放射源首次 实现了国内批量生产。另外,钴还有多种原子,如5267 Co、5277Co、5287Co 和5297Co。下列关于钴原子的说法正确 的是( ) A.5267Co、5277Co、5287Co、5297Co 和6207Co 是摩尔质量不同的 五种同素异形体 B.6207Co 放射源可以用来治疗癌症,其中子数与电子数 之差等于 6
高三化学总复习练习:第五章 物质结构 元素周期律5-16

5—16[A层基础练]1.(2018·安徽合肥期末)最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS).下列有关14C的叙述正确的是()A.14C与C60中普通碳原子的化学性质不同B.14C与14N含的中子数相同C.14C是C60的同素异形体D.14C与12C互为同位素【解析】14C与C60中普通碳原子,为同种元素的原子,其化学性质相同,A错误;14C的中子数为14-6=8,14N的中子数为14-7=7,B错误;14C是原子,不是单质,与C60不是同素异形体,C 错误;14C与12C的质子数均为6,中子数分别为8、6,二者互为同位素,D正确。
【答案】D2.(2018·长沙模拟)下列属于同位素的一组是()A.O2、O3B.Na2O、Na2O2C.错误!K、错误!Ca D.H、D、T【解析】同位素是具有相同质子数不同中子数的同一元素的不同核素。
同位素是核素不是单质、不是化合物,A选项是单质、B选项是化合物,所以A、B错误;C选项是不同种元素的原子,所以C错误;D选项是同种元素的不同原子,所以D正确。
【答案】D3.(2018·东莞模拟)某元素原子R的原子核外有16个电子,质量数为34,则原子核里的中子数为()A.32 B.20C.16 D.18【解析】某元素原子R的原子核外有16个电子,所以质子数=核外电子数=16,中子数=质量数-质子数=34-16=18。
【答案】D4.YBa2Cu8O x(Y为元素钇)是磁悬浮列车中的重要超导材料,下列关于错误!Y的说法不正确的是()A.属于金属元素B.质子数与中子数之差为50C.原子的核外电子数是39D。
错误!Y和错误!Y是两种不同的核素【解析】8939Y的质子数为39,中子数为89-39=50,质子数与中子数之差为11。
【答案】B5.(2018·兰州模拟)下列微粒中,其最外层与最内层的电子数之和等于次外层电子数的是()A.S B.MgC.Cl D.Be【解析】硫原子核外电子排布为:2、8、6,符合最外层与最内层的电子数之和等于次外层电子数,故选A。
2018版高考化学一轮总复习第五章物质结构元素周期律第17讲元素周期表元素周期律课件

2.若甲、乙分别是同一周期的ⅡA 族和ⅢA 族元素,
原子序数分别为 m 和 n,则下列关于 m 和 n 的关系不正
确的是( )
A.n=m+1
B.n=m+18
C.n=m+25 D.n=m+11 解析:对于第一、二、三周期,同一周期的ⅡA 族和
ⅢA 族元素的原子序数只相差 1,而对于第四、五周期来
全国卷三年考情
卷Ⅰ:T13 2016 卷Ⅱ:T9
卷Ⅲ:T12
2015
卷Ⅰ:T12 卷Ⅱ:T9
2014
卷Ⅰ:T10 卷Ⅱ:T27(1)
考点一 元素周期表
1.原子序数 按照元素在周期表中的顺序给元素所编的序号。 原子序数=核电荷数=质子数=核外电子数。
2.编排原则
3.元素周期表的结构
(1)周期(7 个横行,7 个周期):
最外层电子数为 7,位于第五周期第ⅦA 族;88 号元 素比 Rn(86)多 2 个电子,共有 7 个电子层,最外层电子 数为 2,位于第七周期第ⅡA 族;115 号元素比 118 号元 素少 3 个电子,共有 7 个电子层,最外层电子数为 5,位 于第七周期第ⅤA 族。
第五章 物质结构 元素 周期律
第 17 讲 元素周期表 元 素周期律
新课标考纲展示
1.掌握元素周期律的实质。了解元素 周期表(长式)的结构(周期、族)及其 应用。 2.以第三周期为例,掌握同一周期内 元素性质的递变规律与原子结构的 关系。 3.以ⅠA和ⅦA族为例,掌握同一主 族内元素性质递变规律与原子结构 的关系。 4.了解金属、非金属在元素周期表中 的位置及其性质递变规律。
说,由于存在过渡元素,
同一周期的ⅡA 族和ⅢA 族元素的原子序数则相差 11;而对于第六、七周期来说,由于存在镧系和锕系元素, 同一周期的ⅡA 族和ⅢA 族元素的原子序数则相差 25。
2018版高中化学二轮复习文档回扣基础五、化学基本理论知识归纳Word版含答案

五、化学基本理论知识归纳(一)物质结构与元素周期律常考点归纳1.核外电子总数为10的微粒有分子(5种):Ne、HF、H2O、NH3、CH4阳离子(5种):Na+、Mg2+、Al3+、NH+4、H3O+阴离子(5种):F-、O2-、N3-、OH-、NH-22.核外电子数为18的微粒有分子:Ar、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6阳离子:K+、Ca2+2阴离子:Cl-、S2-、HS-、O-3.半径比较:先看层数后看质子数再看最外层电子数,电子层结构相同的离子半径随核电荷数的增大而减小,如:r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
4.周期序数=核外电子层数(共有7个周期,要记住前六个周期每个周期元素的种数分别为2、8、8、18、18、32)。
5.Fe是26号元素,位于第四周期Ⅷ族(第8列,第8、9、10三列称为第Ⅷ族)。
6.超铀元素:指92号元素铀(U)以后的元素。
7.过渡金属包括第ⅢB族到第ⅡB族10个纵行中的所有元素,全部都是金属元素,且最外层都是1~2个电子。
8.镧系元素在第六周期、锕系元素在第七周期,它们都在第3列(即第ⅢB族)。
9.元素的非金属性越强,元素所对应的氢化物越稳定,元素最高价氧化物所对应的水化物的酸性越强。
10.元素的金属性越强,它的单质与水或酸反应越剧烈,元素最高价氧化物所对应的水化物的碱性也越强。
11.判断下列说法是否正确,正确的打“√”,错误的打“×”(1)双原子分子的共价键一定是非极性键(×)(2)非金属元素原子不可能形成离子化合物(×)(3)三氯化硼分子中,B原子最外层满足了8电子结构(×)(4)第ⅠA族元素的金属性一定比同周期的第ⅡA族的强(√)(5)非金属性强弱顺序是F>O>N,所以在一定条件下,氟气能置换水中的氧,氧气也能置换出氨中的氮(√)(6)第三周期元素的离子半径从左至右逐渐减小(×)(7)同周期非金属氧化物对应的水化物的酸性从左到右依次增强(×)(8)按照元素周期表的排布规律,非金属元素最多有23种(√)(二)化学反应速率与化学平衡常考点归纳1.化学平衡常数的意义和应用化学平衡常数可表示反应进行的程度,K 越大,反应进行的程度越大,当K >105时,可以认为该反应已经进行完全。
高一化学 第五章 元素周期律 第一节 原子结构 ppt

D
4、表示带电微粒的结构示意图,则用它表 示的简单阳离子共有( ) A、1种 B、3种 C、4种 D、5种
B
5、根据下列叙述,写出元素名称并画出原子 结构示意图。 (1)A元素原子核外M层电子数是L层电子 数的1/2;___________ 4 硅 28 (2)B元素原子的最外层电子数是次外层 电子数的1.5倍;______3 硼2 (3)C元素的次外层电子数是最外层电子 数的1/4;________ 氖28 6、X和Y是原子序数小于18的元素,X原子 比Y原子多1个电子层;X原子的最外层中只 有1个电子;Y原子的最外层电子层中有7个 电子。这两种元素形成的化合物的化学式是 _________. NaF
氢原子的电子云的特征:
1. 氢原子的电子云呈球形对称,而多电子 原子的电子云则比较复杂。 2. 电子云图上的一个小黑点, 并不表示一 个电子,而是表示 电子在某一时刻曾在 此处出现一次。
3. 小黑点的疏密表示电子在核外空间单位 体积内出现的机会的多少。
离核近的地方,小黑点密即电子云密度大, 电子出现的机会多, 也就是说电子出现的几率高; 离核远的地方,小黑点疏即电子云密度小, 电子出现的机会少, 也就是说电子出现的几率低;
A
(1996年)6.科学家最近制造出第112号新元 素,其原子的质量数为277,这是迄今已知元素中 最重的原子.关于该新元素的下列叙述正确的是. (A)其原子核内中子数和质子数都是112 (B)其原子核内中子数为165,核外电子数为112 (C)其原子质量是12C原子质量的277倍 (D)其原子质量与12C原子质量之比为277:12 B、D
D
思考:决定元素种类的因素是什么?
决定原子种类的因素是什么?
质子数相同而中子数不同的同种 元素的不同原子互为同位素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考为标,全练题点无盲区备考
?
题点(一) 有关概念辨析
1.下列说法正确的是
( B ) 235 235 1 裂变 A. (2015· 全国卷Ⅱ)235 g 核素 92U 发生裂变反应:92U+0n――→
90 136 1 1 Sr + Xe + 10 n ,净产生的中子 ( 38 54 0 0n)数为
C60; 红磷与白磷 HCOOCH3
基点小练
3 4.在1 H 、 1 1H、石墨、金刚石、C60、正丁烷、异丁烷中,属
于同位素的是________,属于同素异形体的是________, 属于同分异构体的是________。
3 答案:1 H 与 1 1H
石墨、金刚石、C60 正丁烷与异丁烷
考什么
?
一
熟记原子的构成
1.原子的构成粒子
2.原子中的 4 个数量关系
(1)质子数(Z)=核电荷数= 核外电子数 。 (2)质量数(A)= 质子数(Z) +中子数(N) 。
+ (3)阳离子的核外电子数=质子数-所带电荷数。如 Mg2
的核外电子数是 10 。 (4)阴离子的核外电子数= 质子数 +所带电荷数。如 S2- 的核外电子数是 18 。
答案:5 6
6
Li 与 7Li
23
Na 与 24Mg
三
明辨“四同”概念 的差别
同位素
同素异形体 同分异构体
同系物
结构 相似, 质子数 相同, 同种 元素 组 分 子 式 相 在分子组成 中子数 不同的 成的结构不 同,结构不 上相差一个
概念 同 一 种 元 素 的 同的单质之 同的化合物 或若干个 不 同 原 子 之 间 间互为同素 互为同分异 CH2 原 子 团 互为同位素 异形体 构体 的物质互称 同系物 对象
2.下列叙述正确的是 ( ) A.40K 和 40Ca 原子中的质子数和中子数都相等 B.某元素最外层只有一个电子,则它一定是金属元素 C.任何原子或离子的组成中都含有质子 D.同位素的不同核素的物理、化学性质完全相同 解析:A 项,40K 的质子数是 19,中子数是 21;40Ca 的质子
数是 20,中子数是 20,错误;B 项,最外层有一个电子的元 素不一定是金属元素,如氢元素是非金属,错误; C 项,原 子是由原子核和核外电子构成的,原子核由质子和中子构成, 原子变成离子,变化的是核外电子,但核内质子不变,所以 任何原子或离子的组成中都含有质子,正确;D 项,同位素 的不同核素其核外电子数相同,电子层排布相同,所以化学 性质相同,但物理性质不同,错误。答案:C
3.一个信息丰富的符号
基点小练
1.判断正误(正确的打“√”,错误的打“×”)。 (1)34S 原子核内中子数为 16 (2)2H+核外电子数为 2 (3)13C 和 15N 核内中子数相差 1 (4)H3O 和 OH 中具有相同的质子数和电子数
-1 (5)1H18 O 的摩尔质量为 20 g· mol 2 + -
1 235 146 235 238 产生的中子 ( n) 数为 10 - 1 = 9,235 g 核素 U D 项中 92U 和 U 是不同核素, D 错误。 0 92U 的物质的量为 92 92
235 238 235 D . (2012· 天津高考 ) U 和 C 项中表示铀原子为 U ,错误; 92 92 92U 是中子数不同,质子数相同的同 1 mol,则发生裂变时净产生的中子数为 9NA; 种核素
第五章 物质结构
元素周期律
第一节 原子结构
考纲要求:
1.了解元素、核素和同位素的含义。 2.了解原子的构成。了解原子序数、核电荷数、质子数、 中子数、核外电子数以及它们之间的相互关系。 3.了解原子核外电子排布规律。 4.掌握原子结构示意图。
考点一
原子构成、同位素
学什么
双基为本,基稳才能楼高
迷点•错点
规避 5 个失分点 (1)任何粒子中,质量数=质子数+中子数,但质子数与电 子数不一定相等,如阴、阳离子中。 (2)有质子的粒子不一定有中子,如 1H;有质子的粒子不一 定有电子,如 H+。 (3)质子数相同的粒子不一定属于同一种元素, 如 F 与 OH 。 (4)核外电子数相同的粒子,其质子数不一定相同,如 Al3
3 (3)不同核素可能具有相同的质子数,如2 1H 和1H;也可能 16 具有相同的中子数,如14 6C 和 8O;也可能具有相同的质量数, 14 如14 6C 和 7N。
基点小练
3.在 6Li、7Li、23Na、24Mg、14C、14N 六种粒子中,包含______ 种元素,________种核素,其中互为同位素的是________, 中子数相等的核素是__________。
核素 用途
235 92 U
14 6C ____
2 1H
3 1H
18 8O
核燃料 用于考古断代
氢弹 制____
示踪原子
注 意
(1)现行元素周期表已发现的元素有 118 种, 由于同位素的 存在,故核素的种数远大于 118 种。 (2)同位素的中子数不同, 质子数相同, 最外层电子数相同, 其化学性质相同。
原子之间 ____
单质 ____之间
一般为有机 有机化合物 化合物之间 之间
同位素
同素异形体
同分异构体
同系物 相似 甲烷、 乙烷、
化学 几乎完 相似,一定条件 可能相似也可 性质 全相同 下可以相互转变 能不同
实例
1 2 1H、 1H、金刚石与石墨、 3 1H
乙烯、 CH3COOH 与 丙烷; 丙烯; 甲酸、 乙酸
10NA
37 B.(2014· 山东高考)35 Cl 与 17 17Cl 得电子能力相同 235 235 1 裂变 90 136 1 核素 U 发生裂变反应, U + n ――→ 38Sr+ 54Xe+100n,净 92 92 0 C.(2013· 江苏高考)中子数为 146、质子数为 92 的铀(U)原子:
(×) (×) (√) (×) ( √)
2.是否所有原子都是由质子、中子和电子构成的?
提示:不是;如1 1H 是由质子和核外电子构成的, 原子中无中子。
二
理清3个概念
1.元素、核素、同位素的关系
2.同位素的特征与应用 (1)同位素的特征 ①化学性质 几乎完全相同 ,物理性质 不同 。 ②天然存在的同一元素各核素所占的原子百分数一般 不变 。 (2)常见的重要核素及其应用
