植物淀粉含量试剂盒说明书
α-淀粉酶测定试剂盒(CNPG3底物法)产品技术要求zhongshengbeikong

α-淀粉酶测定试剂盒(CNPG3底物法)适用范围:本试剂用于体外定量测定人血清中α-淀粉酶的活性。
1.1规格液体单剂型试剂(R):60mL×2 ;试剂(R):80mL×2。
1.2规格划分说明根据净含量划分规格。
1.3主要组成成分试剂盒由试剂(R)液体组成。
1.3.1 试剂(R)液体主要组分:2-(N-吗啉基)-乙磺酸(MES)50mmol/L2-氯-对硝基苯-α-D-麦芽三糖(CNPG3)1.8 mmol/LNaCl350 mmol/L醋酸钙 6 mmo/L 硫氰酸钾900 mmol/L 叠氮钠0.01% 2.1 外观试剂(R)应为无色或浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2净含量液体试剂净含量应不少于标示值。
2.3试剂空白吸光度在波长405nm(400nm~420nm)处(光径1cm),试剂空白吸光度(A)应≤0.350,试剂空白吸光度变化率(△A/min)应≤0.002。
2.4 准确度测定GBW(E)090593,相对偏差应不超过±10%。
2.5 分析灵敏度对应于浓度为 85U/L的淀粉酶所引起的吸光度变化率(△A/min)的绝对值应在0.006~0.040的范围内。
2.6 重复性重复测定血清样本,变异系数(CV)应≤5%。
2.7 批间差测定血清样本,批间差(R)应≤10%。
2.8 线性范围在[5,2000]U/L检测范围内,线性相关系数(r)应≥0.990。
在(50,2000]U/L范围内,线性相对偏差应不超过±10%;在[5,50]U/L范围内,线性绝对偏差应不超过± 5U/L。
2.9 稳定性2.9.1效期稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后2个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.9.2开盖稳定性试剂开盖后,在2℃~8℃避光保存,可稳定30天;开盖稳定期满后1天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
植物中淀粉含量测定

For personal use only in study and research; not for commercial useFor personal use only in study and research; not for commercial use实验 14 植物组织中淀粉含量的测定Ⅰ蒽酮硫酸法一、原理淀粉是由葡萄糖残基组成的多糖,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
二、实验材料、试剂与仪器设备(一)实验材料任何植物材料。
(二)试剂•浓硫酸(比重 1.84 )。
• 9.2mol/L HClO 4 。
•蒽酮试剂,同实验 24 。
(三)仪器设备电子天平,容量瓶: 100 mL 4 个、 50 mL 2 个,漏斗,小试管若干支,电炉,刻度吸管 0.5mL 1 支、 2.0 mL 3 支、 5 mL 4 支,分光光度计,记号笔。
三、实验步骤1. 标准曲线制作同实验 24 恩酮法。
2. 样品提取称取 50 ~ 100 mg 粉碎过 100 目筛的烘干样品,置于 15 mL 刻度试管中,加入 6 ~ 7 mL 80 %乙醇,在 80 ℃水浴中提取 30 min ,取出离心( 3000 rpm ) 5 min ,收集上清液。
重复提取两次(各 10 min )同样离心,收集三次上清液合并于烧杯,置于 85 ℃恒温水浴,使乙醇蒸发至 2 ~3 mL ,转移至 50 mL 容量瓶,以蒸馏水定容,供可溶性糖的测定。
向沉淀中加蒸馏水 3 mL ,搅拌均匀,放入沸水浴中糊化 15 min 。
冷却后,加入 2 mL 冷的 9.2 mol/L 高氯酸,不时搅拌,提取 15 min 后加蒸馏水至 10 mL ,混匀,离心 10 min ,上清液倾入 50 mL 容量瓶。
再向沉淀中加入 2 mL 4.6 mol/L 高氯酸,搅拌提取 15 min 后加水至 10 mL ,混匀后离心 10 min ,收集上清于容量瓶。
实验六淀粉含量测定

实验六淀粉含量测定
实验六淀粉含量测定
一、实验目的
本实验旨在通过碘显色法测定样品中的淀粉含量,了解和掌握该方法的基本原理和操作技巧。
二、实验原理
淀粉能与碘发生显色反应,生成稳定的紫蓝色化合物。
因此,通过测定样品溶液显色后吸光度值,可以推算样品中的淀粉含量。
本实验采用碘显色法进行淀粉含量的测定。
三、实验步骤
1.样品处理:称取适量样品,加入适量蒸馏水研磨成匀浆,备用。
2.制作标准曲线:分别吸取0、0.2、0.4、0.6、0.8、1.0mL的淀粉标准液,
各加入到10mL容量瓶中,再加入1mL碘液,摇匀,显色10分钟,用分光光度计在660nm处测定吸光度值,绘制标准曲线。
3.样品测定:取1mL样品溶液加入到10mL容量瓶中,再加入1mL碘液,摇
匀,显色10分钟,用分光光度计在660nm处测定吸光度值。
4.结果计算:根据测得的吸光度值,在标准曲线上查得相应的淀粉含量,计算
样品中淀粉的含量。
四、实验结果与分析
1.标准曲线的绘制结果如下表所示:
性回归方程为y=0.323x+0.029(R²=0.993)。
结果表明,在所选范围内,淀粉含量与吸光度值呈良好的线性关系。
2.样品测定结果如下表所示:
(绿豆粉等)中的淀粉含量较高,而玉米粉和小麦粉中的淀粉含量相对较低。
这说明不同粮食作物的营养成分组成存在差异,因此在实际应用中需要根据用途选择合适的粮食作物。
同时,本实验方法具有操作简便、快速、准确等特点,可用于实际生产中的质量控制和检测。
直链淀粉含量检测试剂盒说明书 微量法

直链淀粉含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4265规格:100T/96S产品简介:直链淀粉是D-葡萄糖基以α-(1,4)糖苷键链接的多糖链,直链淀粉含量影响着食品的食用品质和外观品质,与食品安全息息相关。
直链淀粉和碘形成蓝色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到直链淀粉含量。
试验中所需的仪器和试剂:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体110mL×1瓶,4℃保存;试剂二:乙醚100mL×1瓶,自备;试剂三:液体55mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体0.5mL×1支,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg直链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的直链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、直链淀粉的提取:称取0.005g烘干样本于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计/酶标仪预热30min以上,调节双波长至550nm和485nm,蒸馏水调零。
淀粉检验操作规程

淀粉检验操作规程淀粉是广泛存在于植物中的一种碳水化合物,是植物储存能量的主要形式。
淀粉的存在对人类起着重要的作用,因此淀粉的检验也显得十分重要。
下面是淀粉检验的操作规程。
1.实验材料与试剂准备:(1)实验材料:需要检验的淀粉样品(2)试剂:1%碘酒溶液、1%淀粉酶溶液、蒸馏水2.实验仪器准备:显微镜、试管架、试管夹、移液管、显微镜玻片、滴管、可调光显微镜等。
3.操作步骤:(1)取一小段透明的淀粉样品,放置在显微镜盒中。
(2)在显微镜盒中加入适量的蒸馏水,用移液管充分搅拌溶解。
(3)加入一滴1%碘酒溶液,再次充分搅拌。
(4)然后观察淀粉颗粒的表现情况,通过在显微镜下进行观察淀粉颗粒的颜色和形态来判断样品中是否含有淀粉。
(5)如果样品中含有淀粉,那么淀粉颗粒会呈现出蓝色、黑色或紫色。
而纯净的蒸馏水不会变色。
(6)如果初步检验结果显示样品中含有淀粉,可以进一步进行淀粉的酶解试验。
(7)取一部分检验样品,加入适量的1%淀粉酶溶液,同时在控制组中加入相同体积的蒸馏水作为对照。
(8)将试管放置在37℃恒温箱中,保持恒温1-2小时。
(9)取出试管,加入适量的碘酒溶液进行观察。
(10)观察结果显示,如果样品中的淀粉被完全酶解,那么样品会变成无色,而对照组中的样品仍然呈现淀粉的蓝色。
4.结果分析与结论:(1)如果观察结果显示样品中的颗粒呈现蓝色、黑色或紫色,可以判断样品中含有淀粉。
(2)如果样品经过酶解试验后呈现无色,说明淀粉已经被酶解,不存在于样品中。
(3)结合实验结果和观察现象,可以得出对样品中是否含有淀粉的结论。
通过以上的操作规程,可以较准确地对淀粉样品进行检验,从而判断样品中是否含有淀粉。
这对于食品行业、农业、医药等领域的品质检验具有重要意义。
植物 β-淀粉酶(β-amylase,β-AL)试剂盒说明书

货号:QS3402 规格:50管/24样植物β-淀粉酶(β-amylase,β-AL)试剂盒说明书可见分光光度法正式测定前务必取2-3个预期差异较大的样本做预测定测定意义:淀粉酶负责水解淀粉,主要包括α-淀粉酶和β-淀粉酶。
β-淀粉酶(EC 3.2.1.2)可随机地作用于淀粉中的α-1,4-糖苷键,生成葡萄糖、麦芽糖、麦芽三糖、糊精等还原糖。
测定原理:还原糖还原3,5-二硝基水杨酸生成棕红色物质。
α-淀粉酶不耐酸,β-淀粉酶不耐热。
根据上述特性,钝化其中之一,就可测出另一种淀粉酶的活力。
自备实验用品和仪器:可见分光光度计、恒温水浴锅、离心机、可调式移液器、玻璃比色皿、研钵和蒸馏水。
试剂的组成和配制:试剂一:50mL×1瓶,常温保存,若有黄色晶体析出,需90℃加热溶解后再用;试剂二:40mL×1瓶,4℃保存,若有沉淀析出,需70℃加热后再用。
粗酶液提取:组织:称取0.1~0.2g样本(建议称取约0.1g样本),加入1mL蒸馏水,研磨匀浆;将匀浆倒入离心管中,提取液在室温下放置提取15min,每5min振荡1次,使其充分提取;3000g,25℃离心10min,取上清液加蒸馏水定容至10 mL,摇匀,即淀粉酶原液。
吸取上述淀粉酶原液1mL,加入4mL蒸馏水,摇匀,即为淀粉酶稀释液,用于(α+β)淀粉酶总活力的测定。
血清(浆)等液体样本:(1)直接检测α-淀粉酶。
(2)吸取淀粉酶原液1mL,加入4mL 蒸馏水,摇匀,即为淀粉酶稀释液,用于(α+β)淀粉酶总活力的测定。
测定步骤:1、分光光度计预热30min以上,调节波长到540 nm,蒸馏水调零。
2、试剂一和试剂二40℃预热10min。
、A3和A4。
第1页,共2页酶活性计算:1、标准条件下测定回归曲线为y=3.7215x -0.1778; x为标准品浓度(mg/mL),y为吸光值。
2、α-淀粉酶活性(1)按照样本质量计算单位定义:每g组织每分钟催化产生1mg还原糖定义为1个酶活力单位。
MEGAZYME直链淀粉试剂盒说明书

前言:谷类淀粉的许多特性决定其最终用途,这些取决于直链淀粉/支链淀粉的比率。
这些特性包括糊化和凝胶化,溶解度,抗性淀粉的形成以及整颗大米的烹饪和构造特性。
因此,淀粉中直链淀粉含量的测定是淀粉加工的一个重要的质量参数。
最常用的测定谷物淀粉中直链淀粉含量的方法是利用电势,电流测定或直链淀粉的碘结合能力比色测定直链淀粉-碘色合配合物。
然而,这些方法具有不确定性。
支链淀粉-碘复合物也可以形成,这样降低了利用非比色法测定的游离碘离子的浓度,并且用比色法测量时,该复合物可能和直链淀粉-碘复合物吸收相同波长的光。
这种复合物致使直链淀粉的测定含量超过实际含量,需要进行校正。
Gibson等详细列举了使用这些方法所遇到的许多其他问题。
支链淀粉结合ConA的特殊复合物为淀粉中直链淀粉的测定提供了一种替代方法,而且不存在不确定性问题。
在指定pH值,温度和离子强度的条件下,ConA特异性结合分支多糖并形成沉淀,这种结合以多个非还原性末端基团上的α-D-吡喃葡萄糖基或α-D-吡喃甘露糖基单位为基础。
因此,ConA可以有效结合淀粉中的支链淀粉成分,但是不能结合线性为主的直链淀粉成分。
此方法是Yun和Matheson改进的ConA方法。
分析之前用乙醇预处理去除脂质。
原理:淀粉样品通过加热完全地溶解在二甲基亚砜(DMSO)里。
用乙醇沉淀淀粉去除其中的脂质,回收沉淀的淀粉。
用醋酸/盐溶液溶解沉淀的样品,加入ConA,特异性沉淀支链淀粉,离心去除沉淀。
单位体积上清液中的直链淀粉用酶水解为D-葡萄糖,然后用葡萄糖氧化酶/过氧化物酶试剂进行测定。
另外一份单位体积醋酸/盐溶液中的总淀粉同样用酶水解为D-葡萄糖,然后加入葡萄糖氧化酶/过氧化物酶,用比色法测定。
根据ConA沉淀样品的上清液和与总淀粉样品中的GOPOD在510 nm处的吸光光度值之比判断直链淀粉在总淀粉中的含量。
该方法适用于所有的纯淀粉和谷物粉。
精确性样品如为纯淀粉,相对标准偏差为<5%。
直链淀粉含量检测试剂盒

直链淀粉含量检测试剂盒说明书(货号:NM-W-0214 微量法100T/96S)一、产品简介:直链淀粉是D-葡萄糖基通过α-(1,4)糖苷键以直链状结构连接而成的大分子物质。
直链淀粉的含量是影响食品感官品质和加工特性的一个重要因素,并且与淀粉的特性密切相关,其含量测定对食品营养价值评价、粮食的合理加工,淀粉的合理利用和农业育种等具有重要意义。
直链淀粉与碘能够形成蓝色络合物,通过测定605 nm 和435 nm 处吸光值的变化即可定量检测直链淀粉的含量。
二、试剂盒组分与配制:三、需自备的仪器和用品:酶标仪、96孔板、台式离心机、恒温水浴锅/培养箱、研钵/匀浆器、天平、60目筛、可调式移液器、乙醚、蒸馏水。
四、操作步骤:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、预实验样本制备℃ 将样本烘干后充分研磨,准确称取0.01g样本至2mL的EP管中,加入1mL试剂一,充分匀浆,80℃水浴提取30min,冷却至室温,4000g,25℃离心5min,弃上清,留沉淀(尽量保留沉淀)。
℃ 向沉淀中加入1mL试剂二,混匀并振荡5min,4000g,25℃离心5min,弃上清,留沉淀(尽量保留沉淀)。
℃ 向上步沉淀中,加入1mL试剂三,混匀(使样本全部浸在液体中),封口,90℃水浴10min(密封以防止水分散失)。
℃ 冷却至室温,将EP管中全部液体转移至10mL EP管中(用1mL蒸馏水冲洗EP管,全部转至10mL EP管中,重复三次),再加蒸馏水准确定容至10mL,混匀,4000g,25℃离心5min,取上清液作为待测样本。
2、标准溶液的配制:把10mg/mL的标准品母液用试剂四稀释成2、1、0.5、0.25、0.125、3、预实验上机操作:℃ 酶标仪预热30min以上,调节双波长至605 nm 和435 nm。
℃ 操作表:4、正式实验:℃ 若预实验测定吸光值超出标准吸光值线性范围:高于最高值建议将待测样本用试剂四适当稀释后再进行测定,低于最低值建议适当增加样本质量W后再进行测定,并将改变后的D和W代入公式计算;℃ 确定好最适实验条件后,正式实验样本制备同预实验样本制备;℃ 正式实验按照预实验上机操作步骤进行(标准管和空白管预实验已做,正式实验可选做)。
直链 支链 总淀粉含量(酶法)试剂盒说明书
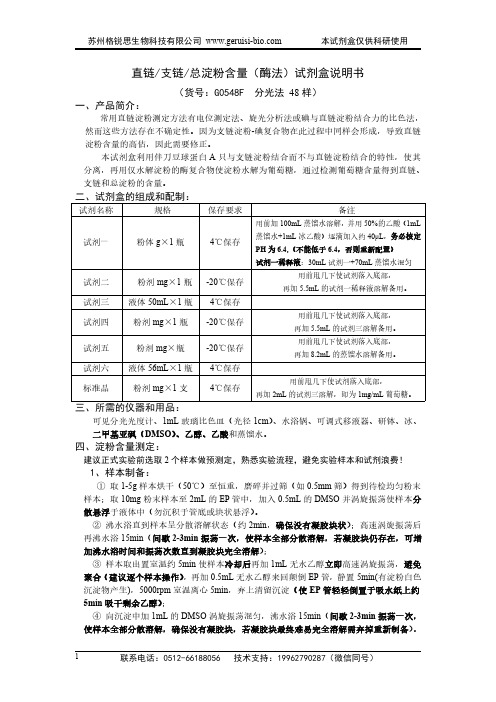
直链/支链/总淀粉含量(酶法)试剂盒说明书(货号:G0548F分光法48样)一、产品简介:常用直链淀粉测定方法有电位测定法、旋光分析法或碘与直链淀粉结合力的比色法,然而这些方法存在不确定性。
因为支链淀粉-碘复合物在此过程中同样会形成,导致直链淀粉含量的高估,因此需要修正。
本试剂盒利用伴刀豆球蛋白A只与支链淀粉结合而不与直链淀粉结合的特性,使其分离,再用仅水解淀粉的酶复合物使淀粉水解为葡萄糖,通过检测葡萄糖含量得到直链、支链和总淀粉的含量。
二、试剂盒的组成和配制:试剂名称规格保存要求备注试剂一粉体g×1瓶4℃保存用前加100mL蒸馏水溶解,并用50%的乙酸(1mL 蒸馏水+1mL冰乙酸)逐滴加入约40μL,务必核定PH为6.4,(不能低于6.4,否则重新配置)试剂一稀释液:30mL试剂一+70mL蒸馏水混匀试剂二粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂一稀释液溶解备用。
试剂三液体50mL×1瓶4℃保存试剂四粉剂mg×1瓶-20℃保存用前甩几下使试剂落入底部,再加5.5mL的试剂三溶解备用。
试剂五粉剂mg×瓶-20℃保存用前甩几下使试剂落入底部,再加8.2mL的蒸馏水溶解备用。
试剂六液体56mL×1瓶4℃保存标准品粉剂mg×1支4℃保存用前甩几下使试剂落入底部,再加2mL的试剂三溶解,即为1mg/mL葡萄糖。
三、所需的仪器和用品:可见分光光度计、1mL玻璃比色皿(光径1cm)、水浴锅、可调式移液器、研钵、冰、二甲基亚砜(DMSO)、乙醇、乙酸和蒸馏水。
四、淀粉含量测定:建议正式实验前选取2个样本做预测定,熟悉实验流程,避免实验样本和试剂浪费!1、样本制备:①取1-5g样本烘干(50℃)至恒重,磨碎并过筛(如0.5mm筛)得到待检均匀粉末样本;取10mg粉末样本至2mL的EP管中,加入0.5mL的DMSO并涡旋振荡使样本分散悬浮于液体中(勿沉积于管底或块状悬浮)。
支链淀粉含量检测试剂盒说明书 微量法

支链淀粉含量检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4275规格:100T/96S产品简介:支链淀粉又称胶淀粉,一般由几千个葡萄糖残基组成,淀粉中直链淀粉和支链淀粉的比例和含量对淀粉产品的加工、物化特性、糊化温度等有着直接的影响。
支链淀粉和碘形成红紫色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到支链淀粉含量试验中所需的仪器和试剂:可见分光光度计/酶标仪、天平、台式离心机、微量玻璃比色皿/96孔板、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体110mL×1瓶,4℃保存;试剂二:乙醚100mL×1瓶,自备;试剂三:液体55mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体2mL×1瓶,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg支链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的支链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、支链淀粉的提取:称取0.005g烘干样本(建议称取约0.01g)于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP 管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计/酶标仪预热30min以上,调节双波长至530nm和755nm,蒸馏水调零。
植物淀粉酶(Amylase)ELISA试剂盒说明书

本试剂盒只能用于科学研究,不得用于医学诊断植物(Plant)淀粉酶(Amylase)ELISA检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被淀粉酶(Amylase)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的淀粉酶(Amylase)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品活性。
样品收集、处理及保存方法1.样本不能含叠氮钠(NaN3),因为叠氮钠(NaN3)是辣根过氧化物酶(HRP)的抑制剂。
2.标本采集后尽早进行提取,提取按相关文献进行。
3.植物萃取液或其它相关样本:请1000x g离心20分钟,取上清即可检测。
4.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL3mL无检测抗体-HRP10mL5mL无20×洗涤缓冲液25mL15mL按说明书进行稀释底物A6mL3mL无底物B6mL3mL无终止液6mL3mL无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、250、500、1000、2000、4000U/L试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。
实验25植物组织中淀粉含量的测定要点

实验25植物组织中淀粉含量的测定要点实验25:植物组织中淀粉含量的测定引言:淀粉作为植物体内的主要贮存物,在植物的生长与发育过程中起着重要作用。
因此,准确测定植物组织中的淀粉含量对于研究植物生理生化过程以及植物的生长状况具有重要意义。
本实验旨在探究测定植物组织中淀粉含量的方法与要点。
材料与试剂:1.植物样品:可选取含有丰富淀粉的植物部位,如种子、根茎或块茎等。
2.无水乙醇3.碘酒溶液4.95%乙醇5.硫酸(浓度为0.1N)6.氢氧化钠固体7.0.1%淀粉溶液8.0.1N硝酸仪器与设备:1.电子天平2.研钵与研杵3.离心机4.蒸发皿5.煮沸水浴6.pH计7.高速离心机8.分光光度计方法:1. 提取淀粉:将植物样品称取一定量,用去离子水冲洗去表面污染物。
然后将样品放入研钵中,加入少量无水乙醇,使用研杵将样品研磨至状况良好的浆状物。
将浆状物转移到离心管中,并以4000 rpm的速度离心5分钟,使淀粉沉淀于离心管底部。
2.淀粉沉淀的处理:将上述离心管中的上清液弃去,并加入适量的去离子水进行洗涤。
重复上述步骤3次,以去除残余的杂质。
接着,将离心管中的淀粉沉淀置于蒸发皿中,在煮沸水浴中加热蒸发至干燥,得到干燥的淀粉样品。
3.碘酒着色:将干燥的淀粉样品加入适量的碘酒溶液中,使其完全浸润。
待样品中的淀粉颜色变为蓝色后,与一个含有相同浓度淀粉溶液的空白对照样品一同测定吸光度。
使用分光光度计在650纳米波长进行测定。
4.构建标准曲线:通过制备一系列浓度已知的淀粉标准溶液,使用相同的方法测定其吸光度。
根据测得的吸光度值,绘制淀粉浓度与吸光度之间的标准曲线。
5.淀粉含量的计算:根据样品的吸光度值,在标准曲线上找出相应的淀粉含量。
将其与样品的重量或体积比例进行换算,得到植物组织中的淀粉含量。
注意事项:1.实验过程中,所有试剂和设备应保持洁净,以避免污染导致实验结果的误差。
2.在将样品置于离心机前,应确保样品密封良好,以避免样品的溢出和污染。
直链淀粉含量检测试剂盒说明书 可见分光光度法

直链淀粉含量检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4260规格:50T/48S产品简介:直链淀粉是D-葡萄糖基以α-(1,4)糖苷键链接的多糖链,直链淀粉含量影响着食品的食用品质和外观品质,与食品安全息息相关。
直链淀粉和碘形成蓝色络合物,利用乙醇分开样品中的可溶性糖和淀粉,再用碘与其反应得到直链淀粉含量。
试验中所需的仪器和试剂:可见分光光度计、天平、台式离心机、1mL玻璃比色皿、可调式移液枪、研钵/匀浆器、乙醚、无水乙醇、EP管。
产品内容:试剂一:液体60mL×1瓶,4℃保存;试剂二:乙醚50mLmL×1瓶,自备;试剂三:液体30mL×1瓶,4℃保存;O=9mL:91mL混匀,现用现配,4℃保存半年。
试剂四:将试剂三:H2试剂五:液体1.5mL×1支,4℃保存;粉剂一:粉剂×1瓶,4℃保存;粉剂二:粉剂×1瓶,4℃保存;试剂六的配制:将粉剂一倒入粉剂二,用蒸馏水定容至10mL,4℃避光保存一个月。
标准品:10mg直链淀粉×1支,4℃避光保存。
临用前加入0.1mL无水乙醇和0.9mL试剂三,混匀后封口膜封口,沸水浴至溶解,即10mg/mL的直链淀粉。
吸取0.1mL加入0.9mL蒸馏水配制为1mg/mL的标准溶液待用。
操作步骤:一、直链淀粉的提取:称取0.005g烘干样本于研钵中研碎,加入1mL试剂一,充分匀浆后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀,加入1mL试剂二(乙醚)振荡5min,3000g,25℃离心5min,弃上清,留沉淀,加入5mL试剂四充分溶解,90℃水浴10min,冷却后3000g,25℃离心5min,取上清待测。
二、测定步骤:1、分光光度计预热30min以上,调节双波长至550nm和485nm,蒸馏水调零。
淀粉总量检测试剂盒

Megazyme淀粉总量检测试剂盒产品编号:K-TSTA(100次)(淀粉葡糖苷酶/α-淀粉酶方法)AOAC法996.11 /AACC法76.13改进版1.简介淀粉测定方法分为酸水解法和酶分析法。
酸水解只能应用于纯淀粉样品。
酶分析方法在前处理步骤,淀粉凝胶化、液化和糊化,糊精水解成葡萄糖、葡萄糖测定步骤等方面存在不同。
AACC 76-11法采用淀粉在高压蒸汽灭菌锅中及含水的条件下凝胶化,并用淀粉葡糖苷酶将淀粉转化为葡萄糖,再测定葡萄糖含量。
采用AACC 76-11法会导致许多样品和材料中(包括高直链淀粉玉米淀粉和谷物制品)淀粉含量检测结果偏低。
目前,许多方法采用在淀粉凝胶化结束后立即加入耐热α-淀粉酶处理。
对于难以凝胶化的样品如高直链淀粉玉米淀粉,用氢氧化钠或DMSO处理。
在膳食纤维的测定方法中为确保淀粉完全溶解,Englyst和Cumming(1988)加入了淀粉脱支化酶,普鲁兰酶。
为了满足极端样品中总淀粉含量定量测定的需要,Megazyme公司研发出一种使用耐热α-淀粉酶和淀粉葡糖苷酶的淀粉总量检测试剂盒。
该方法已被AOAC和AACC采用。
近来,我们将检测方法进行了改进,使耐热α-淀粉酶和淀粉葡糖苷酶可以在相同的pH(pH 5.0)下进行孵育,这样简化了测定步骤,并将麦芽酮糖生成的可能性降到最低。
Megazyme淀粉总量试剂盒可测定大部分食品、饲料、植物和谷物制品(天然或加工过的)。
对于大部分样品(如小麦粉),样品中的淀粉在孵育中(大约100℃,并加入耐热α-淀粉酶)会完全溶解。
含有大量抗性淀粉的样品(如高直链玉米淀粉),需用2M KOH或热DMSO进行预溶解。
含有可溶性淀粉或麦芽糊精的样品,不需要用耐热α-淀粉酶处理。
2.产品性能●特异性:可用于测定α-葡聚糖(包括淀粉、糖原、植物糖原和非抗性麦芽糊精)。
●灵敏度:最小吸光度差异为0.10吸光度单位。
这相当于当样品体积为1.00 mL时,D-葡萄糖的浓度为1.0mg/L或淀粉浓度为0.9 mg/L。
实验 25 植物组织中淀粉含量的测定要点

实验 14 植物组织中淀粉含量的测定Ⅰ蒽酮硫酸法一、原理淀粉是由葡萄糖残基组成的多糖,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
二、实验材料、试剂与仪器设备(一)实验材料任何植物材料。
(二)试剂•浓硫酸(比重 1.84 )。
• 9.2mol/L HClO 4 。
•蒽酮试剂,同实验 24 。
(三)仪器设备电子天平,容量瓶: 100 mL 4 个、 50 mL 2 个,漏斗,小试管若干支,电炉,刻度吸管 0.5mL1 支、 2.0 mL 3 支、 5 mL 4 支,分光光度计,记号笔。
三、实验步骤1. 标准曲线制作同实验 24 恩酮法。
2. 样品提取称取 50 ~ 100 mg 粉碎过 100 目筛的烘干样品,置于 15 mL 刻度试管中,加入 6 ~ 7 mL 80 %乙醇,在 80 ℃水浴中提取 30 min ,取出离心( 3000 rpm ) 5 min ,收集上清液。
重复提取两次(各 10 min )同样离心,收集三次上清液合并于烧杯,置于 85 ℃恒温水浴,使乙醇蒸发至 2 ~ 3 mL ,转移至 50 mL 容量瓶,以蒸馏水定容,供可溶性糖的测定。
向沉淀中加蒸馏水 3 mL ,搅拌均匀,放入沸水浴中糊化 15 min 。
冷却后,加入 2 mL 冷的9.2 mol/L 高氯酸,不时搅拌,提取 15 min 后加蒸馏水至 10 mL ,混匀,离心 10 min ,上清液倾入 50 mL 容量瓶。
再向沉淀中加入 2 mL 4.6 mol/L 高氯酸,搅拌提取 15 min 后加水至 10 mL ,混匀后离心 10 min ,收集上清于容量瓶。
然后用水洗沉淀 1 ~ 2 次,离心,合并离心液于 50 mL 容量瓶用蒸馏水定容供测淀粉用。
3. 测定取待测样品提取液 1.0 mL 于试管中,再加蒽酮试剂 5 mL ,快速摇匀,然后在沸水浴中煮 10 min ,取出冷却,在 620 nm 波长下,用空白调零测定光密度,从标准曲线查出糖含量(μg )。
植物组织中淀粉含量的测定

植物组织中淀粉含量的测定2007-01-12 08:55Ⅰ蒽酮硫酸法一、原理淀粉是由葡萄糖残基组成的多糖,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
二、实验材料、试剂与仪器设备(一)实验材料任何植物材料。
(二)试剂浓硫酸(比重1.84 )。
9.2mol/L HClO 4 。
2%蒽酮试剂,同实验24 。
(三)仪器设备电子天平,容量瓶:100 mL 4 个、50 mL 2 个,漏斗,小试管若干支,电炉,刻度吸管0.5mL 1 支、 2.0 mL 3 支、 5 mL 4 支,分光光度计,记号笔。
三、实验步骤1. 标准曲线制作取小试管11支从0~10编号,按表24-3加入溶液和蒸馏水。
以下步骤按苯酚法或蒽酮法均可,见方法一或方法二,绘制相应的标准曲线。
表24-3 各试管加入标准液和蒸馏水量管号1~23~46~5.7~89~10淀粉标准液(ml)0.40.81.21.62.0蒸馏水(ml)2.01.61.20.80.4淀粉含量(mg)4080120160200.2. 样品提取称取50 ~100 mg 粉碎过100 目筛的烘干样品,置于15 mL 刻度试管中,加入6 ~7 mL 80 %乙醇,在80 ℃水浴中提取30 min ,取出离心(3000 rpm )5 min ,收集上清液。
重复提取两次(各10 min )同样离心,收集三次上清液合并于烧杯,置于85 ℃恒温水浴,使乙醇蒸发至 2 ~ 3 mL ,转移至50 mL 容量瓶,以蒸馏水定容,供可溶性糖的测定。
向沉淀中加蒸馏水3 mL ,搅拌均匀,放入沸水浴中糊化15 min 。
冷却后,加入2 mL 冷的9.2 mol/L 高氯酸,不时搅拌,提取15 min 后加蒸馏水至10 mL ,混匀,离心10 min ,上清液倾入50 mL 容量瓶。
再向沉淀中加入2 mL 4.6 mol/L 高氯酸,搅拌提取15 min 后加水至10 mL ,混匀后离心10 min ,收集上清于容量瓶。
淀粉总量检测试剂盒

Megazyme淀粉总量检测试剂盒产品编号:K-TSTA(100次)(淀粉葡糖苷酶/α-淀粉酶方法)AOAC法996.11 /AACC法76.13改进版1.简介淀粉测定方法分为酸水解法和酶分析法。
酸水解只能应用于纯淀粉样品。
酶分析方法在前处理步骤,淀粉凝胶化、液化和糊化,糊精水解成葡萄糖、葡萄糖测定步骤等方面存在不同。
AACC 76-11法采用淀粉在高压蒸汽灭菌锅中及含水的条件下凝胶化,并用淀粉葡糖苷酶将淀粉转化为葡萄糖,再测定葡萄糖含量。
采用AACC 76-11法会导致许多样品和材料中(包括高直链淀粉玉米淀粉和谷物制品)淀粉含量检测结果偏低。
目前,许多方法采用在淀粉凝胶化结束后立即加入耐热α-淀粉酶处理。
对于难以凝胶化的样品如高直链淀粉玉米淀粉,用氢氧化钠或DMSO处理。
在膳食纤维的测定方法中为确保淀粉完全溶解,Englyst和Cumming(1988)加入了淀粉脱支化酶,普鲁兰酶。
为了满足极端样品中总淀粉含量定量测定的需要,Megazyme公司研发出一种使用耐热α-淀粉酶和淀粉葡糖苷酶的淀粉总量检测试剂盒。
该方法已被AOAC和AACC采用。
近来,我们将检测方法进行了改进,使耐热α-淀粉酶和淀粉葡糖苷酶可以在相同的pH(pH 5.0)下进行孵育,这样简化了测定步骤,并将麦芽酮糖生成的可能性降到最低。
Megazyme淀粉总量试剂盒可测定大部分食品、饲料、植物和谷物制品(天然或加工过的)。
对于大部分样品(如小麦粉),样品中的淀粉在孵育中(大约100℃,并加入耐热α-淀粉酶)会完全溶解。
含有大量抗性淀粉的样品(如高直链玉米淀粉),需用2M KOH或热DMSO进行预溶解。
含有可溶性淀粉或麦芽糊精的样品,不需要用耐热α-淀粉酶处理。
2.产品性能●特异性:可用于测定α-葡聚糖(包括淀粉、糖原、植物糖原和非抗性麦芽糊精)。
●灵敏度:最小吸光度差异为0.10吸光度单位。
这相当于当样品体积为1.00 mL时,D-葡萄糖的浓度为1.0mg/L或淀粉浓度为0.9 mg/L。
淀粉分支酶(Starch branching enzyme,SBE)试剂盒说明书
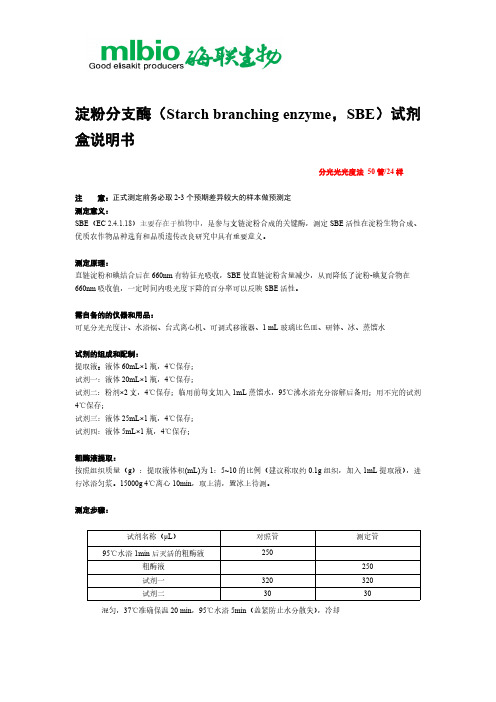
淀粉分支酶(Starch branching enzyme ,SBE )试剂盒说明书分光光光度法 50管/24样注 意:正式测定前务必取2-3个预期差异较大的样本做预测定 测定意义:SBE (EC 2.4.1.18)主要存在于植物中,是参与支链淀粉合成的关键酶,测定SBE 活性在淀粉生物合成、优质农作物品种选育和品质遗传改良研究中具有重要意义。
测定原理:直链淀粉和碘结合后在660nm 有特征光吸收,SBE 使直链淀粉含量减少,从而降低了淀粉-碘复合物在660nm 吸收值,一定时间内吸光度下降的百分率可以反映SBE 活性。
需自备的的仪器和用品:可见分光光度计、水浴锅、台式离心机、可调式移液器、1 mL 玻璃比色皿、研钵、冰、蒸馏水试剂的组成和配制:提取液:液体60mL×1瓶,4℃保存; 试剂一:液体20mL×1瓶,4℃保存;试剂二:粉剂×2支,4℃保存;临用前每支加入1mL 蒸馏水,95℃沸水浴充分溶解后备用;用不完的试剂4℃保存;试剂三:液体25mL×1瓶,4℃保存; 试剂四:液体5mL×1瓶,4℃保存;粗酶液提取:按照组织质量(g ):提取液体积(mL)为1:5~10的比例(建议称取约0.1g 组织,加入1mL 提取液),进行冰浴匀浆。
15000g 4℃离心10min ,取上清,置冰上待测。
测定步骤:混匀,37℃准确保温20 min ,95℃水浴5min (盖紧防止水分散失),冷却试剂名称(μL )对照管 测定管 95℃水浴1min 后灭活的粗酶液250 粗酶液 250 试剂一 320 320 试剂二3030试剂三500 500试剂四40 40混匀,室温静置10min,用蒸馏水调零,660nm处读取各管吸光值。
注意:1、可以在不同对照管中加入不同样品的粗酶液,然后集中进行5min 95℃水浴处理。
2、试剂二如有沉淀,务必沸水浴溶解后使用。
SBE活力单位的计算1、按照蛋白浓度计算单位的定义:以波长660nm的吸光度下降百分率表示,每mg蛋白在反应体系中每降低1%碘蓝值为一个酶活性单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
货号:MS3400 规格:100管/96样
植物淀粉含量试剂盒说明书
微量法
正式测定前务必取2-3个预期差异较大的样本做预测定
测定意义:
淀粉是植物中糖的主要储存形式,其含量测定对于评价食品营养价值和调查植物体内糖代谢都有重要意义。
测定原理:
利用80%乙醇可以把样品中可溶性糖与淀粉分开,进一步采用酸水解法分解淀粉为葡萄糖,采用蒽酮比色法测定葡萄糖含量,即可计算淀粉含量。
自备实验用品及仪器:
可见分光光度计/酶标仪、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰、浓硫酸(不允许快递)和蒸馏水。
试剂的组成和配制:
试剂一:液体100mL×1瓶,4℃保存;
试剂二:液体105mL×1瓶,4℃保存;
试剂三:粉剂×1瓶,4℃避光保存;
淀粉提取:
1、称取0.1~0.2g样本(建议称取约0.1g样本)于研钵中研碎,加入1mL试剂一,充分匀浆
后转移到EP管中,80℃水浴提取30min,3000g,25℃离心5min,弃上清,留沉淀。
2、沉淀中加入0.5mL蒸馏水,放入95℃水浴中糊化15min(盖紧,以防止水分散失)。
3、冷却后,加入0.35mL试剂二,25℃常温提取15min,振荡3-5次。
4、加入0.85mL蒸馏水,混匀,3000g,25℃离心10min,取上清液待测。
测定步骤:
1、分光光度计或酶标仪预热30min以上,调节波长至620nm,蒸馏水调零。
2、调节水浴锅至95度。
3、工作液的配制:临用前在试剂三中加入3.75mL蒸馏水后,缓慢加入21.25mL浓硫酸,不断搅拌,充分溶解,待用;用不完的试剂4℃保存一周;
4、样本测定:取50μL样本和250μL工作液至EP管中,95度水浴10 min(盖紧,防止水分散失),自然冷却至室温,取200uL至微量石英比色皿或96孔板中,在620 nm 波长下记录测定吸光度值A。
淀粉含量计算:
a.用微量石英比色皿测定的计算公式如下
标准条件下测定的回归方程为y = 5.872x - 0.0295;x为标准品浓度(mg/mL),y为吸光值。
1、按照蛋白浓度计算
淀粉含量(mg/mg prot)=[(A+0.0295)×V1]÷5.872 ÷(V1×Cpr)=0.17×(A+0.0295) ÷Cpr 2、按样本鲜重计算
淀粉含量(mg/g 鲜重)= [(A+0.0295)×V1] ÷5.872÷(W×V1÷V2) =0.289×(A+0.0295) ÷W
第1页,共2页
V1:加入反应体系中样本体积,0.05mL;V2:加入提取液体积,1.7 mL;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g
b.用96孔板测定的计算公式如下
标准条件下测定的回归方程为y = 2.936x - 0.0295;x为标准品浓度(mg/mL),y为吸光值。
1、按照蛋白浓度计算
淀粉含量(mg/mg prot)=[(A+0.0295)×V1]÷2.936 ÷(V1×Cpr)=0.34×(A+0.0295) ÷Cpr 2、按样本鲜重计算
淀粉含量(mg/g 鲜重)=[(A+0.0295)×V1]÷2.936÷(W×V1÷V2) =0.578×(A+0.0295) ÷W
V1:加入反应体系中样本体积,0.05mL;V2:加入提取液体积,1.7 mL;Cpr:样本蛋白质浓度,mg/mL;W:样本质量,g
注意:
由于工作液具有强腐蚀性,请谨慎操作。
若吸光值大于1,请将样本用提取液稀释后再测定,计算公式中乘以相应的稀释倍数。
提取液的配置:0.35mL试剂二+1.35mL水。
用多少按照此比例配多少。
最低检测限为10μg/g鲜重或100ng/mgprot。
第2页,共2页。
