杂质谱分析材料模板的汇总整编
恩曲他滨杂质整理总结文档
31540E
20747-49-3
10mg-25mg50mg-100mg
恩曲他滨杂质41
Emtricitabine Impurity 41
31541E
64282-88-8
10mg-25mg50mg-100mg
恩曲他滨杂质42
Emtricitabine Impurity 42
31542E
2216-52-6
31514E
N/A
10mg-25mg50mg-100mg
恩曲他滨杂质15
Emtricitabine Impurity 15
31515E
123821022-4
10mg-25mg50mg-100mg
恩曲他滨杂质16
Emtricitabine Impurity 16
31516E
N/A
10mg-25mg50mg-100mg
恩曲他滨杂质24
Emtricitabine Impurity 24
31524E
147027-109
10mg-25mg50mg-100mg
恩曲他滨杂质25
Emtricitabine Impurity 25
31525E
177349861-5
10mg-25mg50mg-100mg
恩曲他滨杂质26
Emtricitabine Impurity 26
Emtricitabine Impurity 33
31533E
453-18-9
10mg-25mg50mg-100mg
恩曲他滨杂质34
Emtricitabine Impurity 34
31534E
13405-87-3
10mg-25mg50mg-100mg
多西他赛杂质整理总结文档

多西他赛杂质7(多西他赛EP杂质G)Docetaxel Impurity 7(Docetaxel EP Impurity G)32427D 125354-16-710mg-25mg-50mg-100mg 多西他赛杂质8Docetaxel Impurity 832428D N/A10mg-25mg-50mg-100mg多西他赛杂质9Docetaxel Impurity 932429D N/A10mg-25mg-50mg-100mg多西他赛杂质10Docetaxel Impurity 10324210DN/A10mg-25mg-50mg-100mg多西他赛杂质11Docetaxel Impurity 11324211DN/A10mg-25mg-50mg-100mg多西他赛杂质12Docetaxel Impurity 12324212DN/A10mg-25mg-50mg-100mg多西他赛杂质13(2-苯甲酰-2-戊烯基多西他赛)DocetaxelImpurity 13(2-Debenzoyl-2-pentenoylDocetaxel)324213D 1412898-66-810mg-25mg-50mg-100mg多西他赛杂质14Docetaxel Impurity 14324214DN/A10mg-25mg-50mg-100mgImpurity 15D 250mg-100mg多西他赛杂质16DocetaxelImpurity 16324216DN/A10mg-25mg-50mg-100mg多西他赛杂质17Docetaxel Impurity 17324217D 145533-34-210mg-25mg-50mg-100mg多西他赛杂质18DocetaxelImpurity 18324218D 208406-86-410mg-25mg-50mg-100mg多西他赛杂质19DocetaxelImpurity 19324219DN/A10mg-25mg-50mg-100mg多西他赛杂质20Docetaxel Impurity 20324220D 172018-16-510mg-25mg-50mg-100mg多西他赛杂质21DocetaxelImpurity 21324221D 92950-45-310mg-25mg-50mg-100mg多西他赛杂质22DocetaxelImpurity 22324222D 151636-94-110mg-25mg-50mg-100mgImpurity 23D 150mg-100mg多西他赛杂质24DocetaxelImpurity 24324224DN/A10mg-25mg-50mg-100mg多西他赛杂质25Docetaxel Impurity 25324225D 110258-92-910mg-25mg-50mg-100mg多西他赛杂质26DocetaxelImpurity 26324226D 114915-19-410mg-25mg-50mg-100mg多西他赛杂质27DocetaxelImpurity 27324227DN/A10mg-25mg-50mg-100mg多西他赛杂质28Docetaxel Impurity 28324228DN/A10mg-25mg-50mg-100mg多西他赛杂质29Docetaxel Impurity 29324229DN/A10mg-25mg-50mg-100mg多西他赛杂质30Docetaxel Impurity 30324230DN/A10mg-25mg-50mg-100mgImpurity 31D50mg-100mg多西他赛杂质32Docetaxel Impurity 32324232DN/A10mg-25mg-50mg-100mg多西他赛杂质33Docetaxel Impurity 33324233DN/A10mg-25mg-50mg-100mg多西他赛杂质34Docetaxel Impurity 34324234DN/A10mg-25mg-50mg-100mg多西他赛杂质35Docetaxel Impurity 35324235D 1354900-65-410mg-25mg-50mg-100mg多西他赛杂质36Docetaxel Impurity 36324236D 1095547-98-010mg-25mg-50mg-100mg多西他赛杂质37Docetaxel Impurity 37324237D 1095547-96-810mg-25mg-50mg-100mg多西他赛杂质38Docetaxel Impurity 38324238DN/A10mg-25mg-50mg-100mgImpurity 39D50mg-100mg多西他赛杂质40Docetaxel Impurity 40324240D 133524-69-310mg-25mg-50mg-100mg多西他赛杂质41DocetaxelImpurity 41324241DN/A10mg-25mg-50mg-100mg多西他赛杂质42Docetaxel Impurity 42324242DN/A10mg-25mg-50mg-100mg多西他赛杂质43Docetaxel Impurity 43324243D 154306-81-710mg-25mg-50mg-100mg多西他赛杂质44DocetaxelImpurity 44324244D 147058-27-310mg-25mg-50mg-100mg多西他赛杂质45DocetaxelImpurity 45324245D 154428-10-110mg-25mg-50mg-100mg多西他赛杂质46DocetaxelImpurity 46324246D 157240-36-310mg-25mg-50mg-100mgImpurity 47D 58-250mg-100mg多西他赛杂质48Docetaxel Impurity 48324248D 201856-57-710mg-25mg-50mg-100mg多西他赛杂质49DocetaxelImpurity 49324249D 133577-33-010mg-25mg-50mg-100mg多西他赛杂质50DocetaxelImpurity 50324250DN/A10mg-25mg-50mg-100mg多西他赛杂质51Docetaxel Impurity 51324251D119-52-810mg-25mg-50mg-100mg多西他赛杂质52Docetaxel Impurity 52324252DN/A10mg-25mg-50mg-100mg多西他赛杂质53Docetaxel Impurity 53324253D 165173-47-710mg-25mg-50mg-100mg多西他赛杂质54DocetaxelImpurity 54324254DN/A10mg-25mg-50mg-100mg。
3.2.P.5.5杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定2 克/天结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47NON OH SOOK C 16H 17KN 2O 4S MW: 372.48Br2+NON OH SOONO 2C 23H 23N 3O 6S MW: 469.51C 7H 6BrNO 2MW: 216.03PAA22N OH NOH S OONO 2OC 23H 23N O S MW: 485.51TMP toluene N S NH HOOO23H 21N 3O 5S N S N H HOH OO2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/CH 3OHO 3, TMPCH 2Cl 2/TEBAC TsClmorpholineN S N HHN OONO 2OOC 26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OO2O2NC 14H 1235MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 42N SOHOCl OH 2NH C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
杂质谱分析模板的整理

3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A(R2)到ICHQ3D的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO OH N OC H N O S MW: 469.47NON OH SOOK C H KN O S MW: 372.48BrNO +NON OH SOONO C H N O S MW: 469.51C H BrNO MW: 216.03N OH NOH S OONO OC H N O S MW: 485.51TMP toluene N S NH HOOOH N O S N S N H HOH OOOC H N O S MW: 453.47CH Cl /TEBAC TsClmorpholineN S N HHN OONO OOC H N O S MW: 522.571) Br -pyrindineCH Cl N SCl OOONC H MW: 406.00HClHCl 1) (PhO)P/CH Cl 2) N,N-dimethyl aniline, PCl i BuOHNa S O N SOHOCl OH NH C H ClN O S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
原棉杂质分析实验数据汇总

原棉杂质分析实验数据汇总
对原棉杂质分析实验,我们现在要总结以下实验结果。
原棉采取了十二种不同的样本分析,这些样本按细度分为细中粗三个等级,从
粗细度比较细者即为P1到比较粗者即为P12,细度上分别有杂质含量、杂质重量
测定,粗杂质的不同种类也有测算棉及其他物料的比例。
根据实验结果,我们可以得出以下几个要点:
1.各个样本的杂质含量均高于标准规定,且其中P3、P4、P5、P7、P8、P9、P10、
P11、P12杂质含量偏高;
2.杂质重量以P7样本中最高,而P8样本中最低,以P7为原棉含杂量最多,以P8
为最低;
3.从原棉大小粗细度对比来看,随着细度的提高,杂质含量也越来越低,P11、P12处于较高位置;
4.杂质分析结果中,棉籽的含量最多,玉米籽簇、蒜头、杂草、杂质破损的棉絮等占主要比例。
综合上述实验结果,我们确定原始棉质量及其杂质含量超标情况。
此外,粗细
度对杂质含量也有明显影响,分析中发现,棉籽、玉米籽簇、蒜头、杂草及小麦等是棉原纤维的主要杂质。
综上所述,完整的原棉杂质分析实践也为我们的原棉分析提出了正确的方向,
有效地识别原棉中杂质种类、性能和含量,根据实验数据与标准分析对比,我们可以合理控制原棉质量及各个粗度杂质含量,保证质量,提高棉纤维材料的加工价值。
原料药杂质档案模板

原料药杂质档案模板一、杂质名称杂质名称应准确描述,避免使用缩写或代号。
如果杂质名称有多个,请一并列出。
二、杂质代码为便于识别和追踪,为每一种杂质指定一个唯一的代码。
该代码应简洁明了,易于记忆。
三、杂质含量详细记录每一种杂质在原料药中的含量。
提供具体的数值以及含量范围,如果含量未知,请注明“未知”。
四、杂质来源描述杂质的来源,包括原料药生产过程中的各个步骤,如起始物料、合成过程、精制过程等。
分析杂质产生的可能原因,并提出改进措施。
五、杂质分析方法提供用于检测和定量每种杂质的分析方法。
包括使用的仪器、试剂、操作步骤和结果判定标准等。
详细描述方法的准确性和可靠性,并提供相关参考文献。
六、杂质风险评估根据杂质对原料药的安全性、有效性及质量可控性的影响,对杂质进行风险评估。
评估杂质对原料药质量的影响程度,以及在临床使用中可能带来的风险。
针对高风险杂质提出有效的控制措施。
七、控制标准根据风险评估结果,制定每种杂质的控制标准。
包括杂质的限量、检测频率、控制环节等方面的要求。
确保控制标准能够有效地降低杂质对原料药质量的影响。
八、检测记录记录原料药中每种杂质的检测数据,包括检测时间、检测方法、检测结果等。
确保检测记录的完整性和准确性,以便于追溯和分析。
对于不符合控制标准的批次,需详细记录处理措施和结果。
九、杂质处理方法提供针对不符合控制标准的杂质的处理方法,包括物理、化学或生物学方法。
说明处理方法的原理、操作步骤和效果评估。
对于不能处理的杂质,提出相应的风险控制措施。
杂质分析报告模板

****杂质档案******杂质档案回顾期限:**年*月*****年******月*****杂质档案一、概述******是采用*********为原料经过一系列工艺制成********。
主要用于********。
我公司****************,现对***********建立杂质档案。
二、********杂质分析1.无机杂质这类杂质主要来源于生产过程中使用的酸性的化学试剂(如*******)及其它盐类试剂(如**********)。
大部分以钠盐为主,少量钾盐、镁盐,毒性较小,且此类杂质通过后续工序及精制处理,较容易去除,质量标准中采用测试产品的炽灼残渣的方法来控制这类杂质的总量,限度为0.1%。
产品使用化工原料种类较多,原料可能会杂有少量的重金属类杂质,生产过程中使用设备可能引入重金属类杂质,质量标准采用重金属限度检查法进行控制,以铅的限量表示重金属的限度,其限度为*********。
2.残留溶剂这类杂质来源于*****生产中使用的有机溶剂或分解的有机溶剂,包括:一类溶剂有:*************;二类溶剂有:*************;*************** 三类溶剂:***************;其它溶剂:***************。
采用气相色谱法控制上述溶剂残留,限度参考《中国药典》规定的残留溶剂规定制定。
3 有机杂质3.1已知杂质**********在制备过程中可能产生的*************,采用正相色谱法检测,用手性色谱柱对对映异构体进行控制,以面积归一法计算,其限度为不得过*********。
**********在生产制备过程中产生的有机杂质还有工艺杂质(*************),各杂质反应机理详见附件1。
采用高效液相色谱法检测,按有关物质检查方法检查,以对照品定位并按自身对照法计算,*****************的峰面积计算(分别乘以校正因子*******************,其限度为不得过**************%,详见********的杂质概况表。
材料分析汇总表

材料分析汇总表1. 引言在材料科学领域,材料分析是一个关键的研究领域。
通过对不同材料的分析和表征,可以了解其结构、性质和性能,并为材料的设计和开发提供重要的依据。
本文档旨在汇总常见的材料分析技术和方法,并提供详细的说明和操作步骤。
2. 常见的材料分析技术2.1 光学显微镜光学显微镜是一种常用的材料分析工具,它可以通过对材料的表面和截面进行观察,获得样品的形貌和结构信息。
使用光学显微镜,我们可以确定样品的晶粒大小、形状、分布以及可能存在的缺陷。
操作步骤:1.将样品切取合适的大小,并进行必要的研磨和抛光处理。
2.将样品放置在显微镜台上,调整放大倍数和焦距,以获得清晰的图像。
3.使用显微镜观察样品,并记录所观察到的形貌和结构信息。
2.2 扫描电子显微镜(SEM)扫描电子显微镜是一种高分辨率的表征工具,它可以通过扫描样品表面上的电子束,获得样品的表面形貌和结构信息。
与光学显微镜相比,SEM具有更高的分辨率和放大倍数。
操作步骤:1.将样品切取合适的大小,并进行必要的研磨和抛光处理。
2.将样品安装在SEM的样品台上,并通过真空系统排除空气,以避免电子束与气体分子的相互作用。
3.启动SEM并调整加速电压和探针电流,以获得合适的图像对比度。
4.使用SEM观察样品,并记录图像和结构信息。
2.3 X射线衍射(XRD)X射线衍射是一种重要的材料分析技术,它可以通过测量样品对入射X射线的衍射模式,来确定样品的晶体结构和晶体学性质。
X射线衍射可以用于材料的相组成分析、晶体结构分析以及晶体学参数的计算。
操作步骤:1.准备样品,并制备样品块或粉末。
2.将样品安装在X射线衍射仪的样品台上,并调整仪器参数,如入射角和接收角。
3.启动X射线衍射仪并进行扫描,记录衍射图谱。
4.分析衍射图谱,并根据衍射峰的位置、强度和形状,确定样品的晶体结构和晶体学性质。
2.4 电子能谱分析(ESCA)电子能谱分析是一种常用的表面分析技术,它可以通过测量材料表面的电子能谱,来确定样品的表面组成和化学状态。
原料药杂质档案模板

原料药杂质档案模板标题:原料药杂质档案模板的构建与应用一、引言在药品研发和生产过程中,原料药的质量控制是至关重要的。
其中,原料药的杂质控制更是关键的一环,因为它直接影响到药品的安全性和有效性。
因此,建立一份详实、准确的原料药杂质档案模板对于药品生产企业来说至关重要。
二、原料药杂质档案模板的构成1. 杂质信息表:该部分主要记录原料药中所有已知和未知的杂质的详细信息,包括杂质名称、结构式、来源、理化性质、毒性等。
2. 检测方法:这部分应列出用于检测各种杂质的方法,如高效液相色谱法、气相色谱法、紫外可见光谱法等,并详细描述这些方法的操作步骤和参数设置。
3. 杂质限度:这部分应根据法规要求和安全性考虑,设定每种杂质的最大允许含量。
4. 杂质监控计划:这部分应制定出对原料药中杂质进行定期监测的计划,以确保杂质含量始终处于可接受范围内。
5. 杂质风险管理:这部分应评估每种杂质的风险,并提出相应的风险控制措施。
三、原料药杂质档案模板的应用1. 产品质量控制:通过使用原料药杂质档案模板,企业可以更好地控制原料药的质量,确保最终产品的安全性和有效性。
2. 质量体系认证:在进行GMP(药品生产质量管理规范)或FDA(美国食品药品监督管理局)等质量体系认证时,原料药杂质档案模板可以作为重要的参考资料。
3. 问题追踪与解决:当发现产品中的杂质超出允许范围时,可以通过查阅原料药杂质档案模板,快速找出可能的原因,并采取相应的纠正措施。
四、结论原料药杂质档案模板的建立和应用,对于提升药品质量和保障公众健康具有重要意义。
企业应重视这一工作,投入必要的资源,确保杂质档案模板的科学性、准确性,以便于更好地控制原料药的杂质,提高药品的安全性和有效性。
以上只是对原料药杂质档案模板的基本介绍和初步探讨,实际操作中还有很多细节需要注意。
例如,如何选择合适的检测方法?如何确定合理的杂质限度?如何进行有效的杂质风险管理?等等。
这些问题都需要企业在实践中不断学习和探索,才能找到最适合自己的答案。
吡拉西坦杂质全套总结(最新)

英文名称
CAS
吡拉西坦EP杂质A
Piracetam Impurity 1 (Piracetam EP Impurity A)
616-45-5
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
吡拉西坦杂质2 Piracetam Impurity 2 59776-88-4
53934-76-2
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
吡拉西坦杂质5 Piracetam Impurity 5
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
吡拉西坦杂质6 Piracetam Impurity 6
N/A
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
唐 1814- 扬信医药 代理各品种杂质对照品:舒更葡糖钠杂质,达托霉素杂质,依维莫司杂质,他克莫司杂质,阿奇霉素杂质,克拉
志 -064- 维酸钾杂质,红霉素杂质,克拉霉素杂质,林可霉素杂质,罗红霉素杂质,克林霉素杂质,恩曲他滨杂质,艾地那非;
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
吡拉西坦杂质7 Piracetam Impurity 7 77472-71-0
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
吡拉西坦杂质8 Piracetam Impurity 8 872-50-4
康
材料成分分析报告范本

材料成分分析报告范本一、引言材料成分分析是对材料样本的化学组成的定性和定量研究,通过分析样本中的主要化学元素、化合物和杂质,可以了解材料的性质、组织和用途,为材料的生产和应用提供科学依据。
本报告旨在对样品的成分进行分析和解读,以便更好地了解该材料的性质。
二、实验方法1.样品制备:将样品切割成合适大小,并进行研磨和研磨以获得均匀的粉末。
2.样品分析:使用X射线荧光光谱仪(XRF)对样品的元素组成进行分析。
3.实验条件:XRF仪器使用钴阳极和铜阳极的射线源,能量为50kV 和40mA。
4.数据处理:根据实验结果,结合标准样品和仪器校准曲线进行定量分析。
三、结果与讨论1.样品描述:本次分析的样品为钢材,颜色为灰色,表面磨损程度较轻。
2.元素成分分析结果:通过XRF分析,发现样品中主要含有铁、碳、镍和铬四种元素。
-铁(Fe)的含量为80.5%,铁是钢材的主要成分,其含量符合标准要求。
-碳(C)的含量为0.2%,碳的含量较低,可能是由于材料生产过程中的炉温控制有所不足。
-镍(Ni)的含量为8.2%,镍的添加可以提高钢材的耐腐蚀性和强度。
-铬(Cr)的含量为11.1%,铬的添加可以提高钢材的耐腐蚀性和耐磨性。
3.化合物成分分析结果:通过XRF分析,发现样品中主要的化合物为Fe3C(碳化亚铁)。
-碳化亚铁是一种硬质的化合物,可以提高钢材的硬度和耐磨性。
-根据分析结果,样品中碳化亚铁的含量为6.3%,符合标准要求。
4.杂质分析:通过XRF分析,未检测到样品中的其他显著杂质元素。
-样品的杂质含量非常低,符合标准要求。
-杂质元素的存在可能会影响钢材的性能和使用寿命。
四、结论通过XRF分析,我们可以得出以下结论:1.样品为一种钢材,主要成分为铁、碳、镍和铬,其中铁的含量为80.5%。
2.样品中的碳含量较低,可能会影响钢材的硬度和强度。
3.样品中的镍和铬的含量符合标准要求,可以提高钢材的耐腐蚀性和耐磨性。
4.样品中还含有碳化亚铁,其含量为6.3%,可以提高钢材的硬度和耐磨性。
3.2.P.5.5杂质谱分析模板的整理
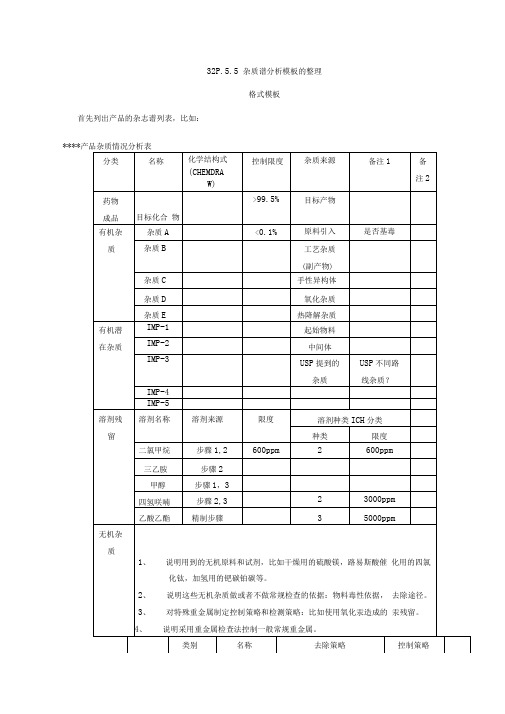
32P.5.5 杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原贝V;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头抱克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头抱克洛的起始物料7-ACCA的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH的杂质鉴定、报告和质控限度:主要参考ICHQ3A (R2)到ICHQ3D的相关规定阈值(原料药)au ICH刮订的杞学廉料药中有关物康的鉴定、报吿和质控限度< 2ft0 10%应i omgf in舖小佈0 IS% ■< 1 .Omg f 呪圮小朗,-■2g0,0^.0 05%1-2 ICH^J订的化学药制珮杂质限度*4jft大日削柠« )>限廈Od%0M%1 + lOmg>2g|g 戎■ JUW0.5 Tj i或2U]ug0.2 .4Mi星小傭】OLIO%<IOmj10 - IDO THF>l(X)TTip * 2g1.0 i 或SOpg『皿竝小恒】0 5召或200跑0.2 1 2 3 jjJEo r%结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头抱克洛的起始物料7-ACCA引入的杂质)4、非对映异构体:比如ACCA的△异构体;还包括非对应异构体自身的各种对映体。
化工产品杂质分析报告模板

化工产品杂质分析报告模板
1. 引言
本报告旨在对化工产品样品中出现的杂质进行分析和评估。
杂质的存在可能会对产品的质量和安全性产生影响,因此对其进行分析和识别至关重要。
本报告将通过样品的表征和分析结果,提供对存在的杂质的详细描述和评估。
2. 样品信息
- 样品名称:
- 样品来源:
- 样品编号:
- 分析日期:
- 样品描述:
3. 样品表征
在本部分,将对样品进行常规的表征和描述,包括外观、颜色、形状、气味等方面的观察。
4. 分析方法
在本部分,将描述所采用的分析技术和方法,包括样品准备、检测仪器和设备的规格等。
5. 分析结果
在本部分,将详细描述对样品进行的分析结果。
5.1 杂质A的分析结果
- 外观描述:
- 化学成分分析结果:
- 可能的来源:
- 对产品质量的影响:
5.2 杂质B的分析结果
- 外观描述:
- 化学成分分析结果:
- 可能的来源:
- 对产品质量的影响:
5.3 其他杂质的分析结果
(根据实际情况增加)
6. 评估和建议
在本部分,将分析并评估各个杂质对产品质量和安全性的可能影响,并提供相应的建议。
7. 结论
在本部分,将对整个分析过程进行总结,并总结出对样品中各个杂质的鉴定和分析结果。
8. 致谢
在本部分,将对参与分析的成员和机构表示感谢。
注意:以上报告模板仅供参考,具体报告内容和结构应根据实际情况进行调整和修改。
组件中杂质分析报告

我司使用的帽子不能有效遮住所有头发
TPT丝、线形纤维及美纹胶纸
这三种不良均可以在排版处检查出来,均为操 作时不小心,检查不到位导致。 及时清洁,仔细检查,可以有效杜绝此类杂质。
总结
杂质不良在不良比例中所占比例惊人, 高达14.9%,其中锡渣、头发导电杂质 更是危害巨大。有效控制杂质引起的不 良,是一个公司整体质量水平的体现。 后续两张图片表明了在一些生产细节上 依旧很粗放,随意。
组件焊接车间地面上杂质
锡渣原因分析
在所有的不良中,锡渣占20%,头发占13%。而这个 比例只是针对不合格组件的统计,也就是说没有统计在标 准范围内的锡渣,在我日常的观察,及客户投诉反馈,我 们组件中的锡渣是很常见的。 电池在焊接过程中会产生锡渣不可避免,但是如果压 带后做好检查,串带后做好检查,排版时做好检查,锡渣 是可避免的;另外,及时对焊接台面进行清洁,及时对电 池片托盘进行清洁,均有有效避免锡渣进行组件。
组件车间图片
及时对台面及托盘进行清洁可以有效避免锡渣
头发原因分析
头发导致的不良一直是各组件公司头疼的问 题,建议我司使用一次性头罩,一次性头罩相应 的收缩性大,能有效遮住所有头发,并且不能因 为长时间戴而引起任何不适。 要控制头发带来的不良,更多的还是要员工 加强检查,特别是排版检查处。
组件车间图片
组件车间图片
滚筒上放玻璃纸
焊带随意摆放在传送带上
注:焊带是组件的一部分,焊带被污染导致的缺陷是不可预料的, 可以用金属托盘来放置焊带,并对托盘定期清洁。
组件中杂质分析报告
杂质统计
8月份,因杂质导致的不良共105块,具 体统计见下表。
杂质统计
C1 的 Pareto 图
120 100 80 C2 60 40 20 0 C1 C2 百分比 累积 % 100 80 60 40 20 0 不明杂质 43 41.0 41.0 锡渣 21 20.0 61.0 头发 15 14.3 75.2 TPT丝 12 11.4 86.7 美纹胶纸 线性纤维 6 5 5.7 4.8 92.4 97.1 其他 3 2.9 100.0 百分比
P杂质谱分析模板的整理

..P..杂质谱分析模板的整理————————————————————————————————作者:————————————————————————————————日期:23.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表分类名称化学结构式(CHEMDRAW)控制限度杂质来源备注1 备注2药物成品目标化合物≥99.5%目标产物有机杂质杂质A≤0.1%原料引入是否基毒杂质B工艺杂质(副产物)杂质C手性异构体杂质D氧化杂质杂质热降E解杂质有机潜在杂质IMP-1起始物料IMP-2中间体IMP-3USP提到的杂质USP不同路线杂质?IMP-4IMP-5溶剂残留溶剂名称溶剂来源限度溶剂种类ICH分类种类限度二氯甲烷步骤1,2600ppm2 600ppm 三乙胺步骤2甲醇步骤1,3四氢呋喃步骤2,32 3000ppm 乙酸乙酯精制步骤3 5000ppm无机杂质1、说明用到的无机原料和试剂,比如干燥用的硫酸镁,路易斯酸催化用的四氯化钛,加氢用的钯碳铂碳等。
2、说明这些无机杂质做或者不做常规检查的依据:物料毒性依据,去除途径。
3、对特殊重金属制定控制策略和检测策略:比如使用氧化汞造成的汞残留。
4、说明采用重金属检查法控制一般常规重金属。
其他试剂类别名称去除策略控制策略催化剂二甲基吡啶水洗去除氧化剂DMP 淬灭,构型转化后水洗去除脱甲基试剂三氟化硼乙醚精馏脱除反应过程的描述:1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA的工艺、杂质控制和质量情况进行详细的说明。
杂质谱的分析

杂质谱的分析(总3页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除杂质谱的分析在药品研发及药品评价的过程中,杂质研究是一项非常重要的内容。
因为药物在临床使用过程中所发生的不良反应除了与药品本身的药理活性有关外,有时还与药品中所含有的杂质有很大的关系。
众所周知,从事药品研发及药品评价所要遵循的一个基本原则就是要保证上市药品的安全性和有效性,由于药品质量的稳定可控是保证药品安全有效的前提和基础,而杂质研究又是药品质量研究的一项重要内容,所以杂质研究及杂质控制是药品质量保证的关键要素,是确保药品安全有效性的重要体现。
2005年SFDA颁布的《化学药物杂质研究技术指导原则》中明确说明任何影响药物纯度的物质统称为杂质。
具体的解释就是指药物中所含有的没有治疗作用、可能影响药物的稳定性和疗效,甚至是对人体健康有害的物质。
杂质的来源有工艺杂质和降解产物等,工艺杂质指的是药品在制备工艺过程中引入的杂质,它包括没有反应完全的反应物、反应过程中所生成的中间体及副产物、反应过程中所使用的试剂及催化剂等。
降解产物指的是药品在生产和贮藏过程中发生化学变化而产生的杂质,如发生水解、氧化、开环等反应,降解产物主要与药物的结构特征密切相关。
由于杂质研究与药品的质量及安全有效性直接相关,为了提高药品的质量,保障公众的用药安全,因此,在药品研发过程中需规范地进行杂质研究,并将其控制在安全、合理的限度范围内。
在杂质研究总体原则的指导下,其中杂质谱的分析应是杂质研究的重要内容之一。
一、杂质研究的总体原则杂质研究的总体原则就是要结合在研产品具体的工艺以及产品的特点开展研究。
首先,要结合具体工艺及产品特点来分析产品中可能产生什么样的杂质,通过杂质谱的分析对产品中杂质的来源及结构情况有较为全面的了解;然后,在杂质谱分析的基础上,有针对性地选择合适的分析方法,以确保杂质的有效检出及控制;最后,需综合药学、药理毒理及临床研究结果确定合理的杂质限度,从而保证药品的质量及安全性。
杂质回顾分析报告

杂质回顾分析报告1. 引言本报告旨在回顾分析杂质的情况,以便进一步改进产品质量控制措施。
杂质是指在产品制造过程中出现的不应出现的物质,可能会对产品的性能和安全性产生负面影响。
通过对杂质进行分析和评估,我们可以确定其来源,并采取相应的措施以减少或消除杂质的存在。
2. 杂质情况分析2.1 杂质的种类和分布情况我们首先对产品中存在的杂质进行分类和数量统计。
经过检测和分析,我们发现以下几类常见的杂质:1.金属杂质:包括铁、铝、铜等金属片或颗粒状物质。
2.纤维杂质:主要是由于生产过程中使用的纤维材料或原料产生的。
3.化学杂质:例如有机溶剂、氧化物等。
4.颗粒杂质:如颗粒状物质、粉末等。
5.生物杂质:如微生物、霉菌等。
根据对产品样本的检测结果,我们发现大部分杂质主要分布在表面或最外层,少量杂质可能会深入产品内部。
2.2 杂质的来源分析通过对原料、生产工艺和设备的调查和分析,我们推测杂质可能来自以下几个方面:2.2.1 原料污染原料可能在采集、运输和储存过程中受到污染。
如果原料的质量控制不严格,其中可能存在杂质,这些杂质可能会随着原料进入生产线。
2.2.2 生产工艺控制不严生产工艺中的每个环节都可能引入杂质。
例如,不适当的搅拌或混合过程可能导致杂质的生成,不恰当的温度控制可能导致杂质的沉淀或挥发。
2.2.3 设备污染生产设备的清洁程度和维护状况可能对杂质的存在有一定影响。
设备表面的污垢或陈列物质可能成为杂质的来源。
3. 杂质控制改进建议鉴于上述分析结果,我们提出以下改进建议,以减少或消除产品中的杂质:3.1 原料质量控制加强对原料供应商的审核和管理,确保原料的质量符合要求。
建立完善的原料采样和检测流程,及时发现和处理可能存在的污染问题。
3.2 生产工艺优化对生产工艺进行细致的优化,确保每个环节控制得当。
强化搅拌、混合和温度控制环节的操作规程,减少杂质的生成和存在。
3.3 设备清洁与维护加强设备清洁和维护工作,确保设备表面的卫生状况良好。
液质杂质鉴定报告模板

液质杂质鉴定报告模板
报告内容如下:
---
尊敬的客户:
感谢您选择我们的服务。
根据您提供的液质样本,我们进行了杂质鉴定分析,并编写了以下报告。
1. 样本信息
样本名称:[样本名称]
样本编号:[样本编号]
采样日期:[采样日期]
样本来源:[样本来源]
2. 鉴定方法
本次杂质鉴定采用了[鉴定方法名称]的方法,并依据相关标准和操作规程进行样本处理和分析。
3. 鉴定结果
3.1 杂质1
- 鉴定方法:[鉴定方法]
- 鉴定结果:[鉴定结果]
- 形态描述:[形态描述]
- 含量测定:[含量测定结果]
3.2 杂质2
- 鉴定方法:[鉴定方法]
- 鉴定结果:[鉴定结果]
- 形态描述:[形态描述]
- 含量测定:[含量测定结果]
[继续列举其他检测出的杂质及其鉴定结果]
4. 结论与建议
根据我们的分析结果,样本中已检出多种杂质。
针对检出的每个杂质,我们提供以下结论和建议:
4.1 结论与建议1
[根据具体情况提供结论与建议]
4.2 结论与建议2
[根据具体情况提供结论与建议]
[继续列举其他杂质的结论与建议]
5. 报告编号及日期
报告编号:[报告编号]
报告日期:[报告日期]
请知悉,本报告仅针对所提供样本的鉴定结果,如有其他问题或需要进一步了解,请随时联系我们。
谢谢!
此致,
[您的公司名称]。
杂质分析知识点梳理总结

杂质分析知识点梳理总结一、引言杂质分析是化学分析的一个重要分支,其主要任务是对化合物中的杂质进行定性和定量分析,从而综合评价化合物的纯度和质量。
杂质分析在药物研发、制药工艺控制、环境监测、食品安全等领域都有重要应用。
本文将对杂质分析的基本概念、分析方法和应用进行总结和梳理,以期为相关领域的研究和应用提供一定的参考和指导。
二、杂质的概念和分类1. 杂质的概念杂质是指不同成分的混合物中,与主要成分性质不同的物质。
杂质可以改变物质的性质、影响制品的质量和使用效果,甚至具有毒性。
因此,对于制药原料和成品药品来说,控制和分析杂质是非常重要的。
2. 杂质的分类根据其性质和来源的不同,杂质可以分为以下几类:(1)进料杂质:指在原料药、所需药品或化工产品的生产过程中输入的杂质。
(2)产物杂质:指在产品生产过程中新生成的杂质。
(3)辅助剂杂质:指生产过程中直接加入的辅助剂的杂质。
(4)杂质混合物:指由多种杂质组成的混合物。
(5)环境杂质:指由于生产环境和外部环境的影响而污染产品的杂质。
三、杂质分析的基本原理和方法1. 杂质分析的基本原理杂质分析的基本原理是利用化学分析技术,对混合物中的各种杂质进行分离、鉴定和定量,从而评价样品的纯度和质量。
常见的杂质分析技术包括色谱分析、光谱分析、质谱分析、电化学分析、热分析等。
2. 色谱分析色谱分析是杂质分析中常用的一种技术手段,其原理是利用样品中各种成分在色谱柱中的不同保留时间来进行分离和鉴定。
常见的色谱分析方法包括气相色谱(GC)、液相色谱(HPLC)、超高效液相色谱(UPLC)、薄层色谱(TLC)等。
3. 光谱分析光谱分析是利用物质对辐射光的吸收、发射、散射等现象进行分析的一种方法。
常见的光谱分析技术包括紫外-可见吸收光谱分析、红外光谱分析、拉曼光谱分析、荧光光谱分析等。
4. 质谱分析质谱分析是利用物质的分子离子在电场作用下产生的碎片离子质荷比进行质量分析的一种方法。
常见的质谱分析技术包括质子转移质谱(MS)、三重四级杆质谱(QQQ-MS)、飞行时间质谱(TOF-MS)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.2.P.5.5杂质谱分析模板的整理格式模板首先列出产品的杂志谱列表,比如:****产品杂质情况分析表反应过程的描述: 1、详细的反应方程式,包括结构式,反应温度,所有试剂,助剂,溶剂,催化剂等。
2、结合CTD 资料的其他部分,对物料控制进行说明,包括起始物料、其他原料、溶剂、辅料(活性炭,硅藻土,硅胶等。
)。
3、起始物料说明。
起始物料符合广泛、易得、质量稳定,适合保存运输等的原则;还应对多个供应商提供的多批次物料进行质量研究,同供应商签署的质量协议以及供应商工艺变更告知义务等协议。
比如头孢克洛,要对起始物料7-ACCA 的工艺、杂质控制和质量情况进行详细的说明。
4、说明制定起始物料的质量控制策略的依据,比如头孢克洛的起始物料7-ACCA 的关键杂质△异构体,结合工艺和实验数据,说明杂质产生来源,分布,控制策略等。
第2、3、4内容可以在CTD 的其他部分,比如物料说明部分进行。
但是本部分内容讨论的展开需要物料控制说明作为基本的理论依据。
5、关于ICH 的杂质鉴定、报告和质控限度:主要参考ICHQ3A (R2)到ICHQ3D 的相关规定结合上述反应过程对杂质谱进行分析,主要分起始物料引入杂质,反应杂质,降解杂质等。
第一部分:起始物料引入的杂质分析(比如头孢克洛的起始物料7-ACCA 引入的杂质)N SOH OONO 2OH N OC 22H 19N 3O 7S MW: 469.47OC 16H 17KN 2O 4S MW: 372.48BrNO 2+O2MW: 469.51C 7H 6BrNO 2MW: 216.0322C 23H 23MW: 485.51N S N H HOH OONO 2OC 22H 19N 3O 6S MW: 453.47CH 2Cl 2/TEBAC TsClmorpholineN S N HHN OO2OOC26H 26N 4O 6S MW: 522.571) Br 2-pyrindineCH 2Cl 2N SCl OONO 2O2NC 14H 12ClN 3O 5S MW: 406.00HClHCl 1) (PhO)3P/CH 2Cl 22) N,N-dimethyl aniline, PCl 5 i BuOHNa 2S 2O 4H 2C 7H 7ClN 2O 3S MW: 234.661、 无机杂质:说明引入情况和消除渠道;以及相关的控制方法和标准以及依据。
比如上述列表中的钯元素控制。
2、 普通有机杂质。
3、对映异构体(根据品种的情况具体分析);考察不同的对应异构体对最终产品质量的影响情况。
4、 非对映异构体:比如ACCA 的△异构体;还包括非对应异构体自身的各种对映体。
第二部分:反应的每个步骤引入的杂质:需要结合实际反应监控(HPLC,LC-MS为主)过程对杂质消除过程以及对后续的影响进行实际说明。
这个内容主要在工艺描述部分进行,本部分引用工艺描述内容。
1、步骤1引入的杂质。
2、步骤2引入的杂质。
3、步骤3引入的杂质。
以及后续的步骤产生的杂质以及消除过程和简单的控制描述……4、精制过程引入的杂质。
第三部分:结合小试中试数据汇总列表、方法适用性、实际检测结果等内容说明各个有机杂质的分布情况。
第四部分:潜在杂质在成品中的检测结果第五部分:自制原料与原研片杂质对比:行对比性说明。
第六部分:制剂中的特定杂质:主要分析制剂与原料药储存过程中降解产生的杂质,以及因为辅料和原料药相容性而产生的特定杂质:比如纤维素类的曼德拉反应产生的杂质等。
储存降解产生的杂质包括酸碱氧热光降解杂质,空气中水分造成的水解杂质,或者跟空气中二氧化碳反应产生的杂质。
1.说明各杂质的限度:****杂质阈值(举例)2. 3.2.P.5.5.1潜在杂质的推测由****公司提供**原料药简单工艺路线,分析整理本品的杂质见下表。
表3.2.P.** ,-------------潜在杂质推测3.潜在杂质特征的鉴定a)原料合成过程带入的相关杂质特征的鉴定由厂家提供的原料药合成过程中所用的起始原料及各步中间产物的色谱行为和紫外光谱特征进行汇总分析,初步鉴定注射用头孢地嗪钠成品中原料合成过程中带入的杂质。
起始原料及各步中间产物鉴定特征如下表:表3.2.P.5-X ****原料合成过程相关杂质特征鉴定b)注射用头孢地嗪钠强制降解试验中杂质的特征鉴定试品与对照品强制降解试验表3.2.P.** 热破坏试验主要降解产物色谱信息表3.2.P.5-50 酸破坏试验主要降解产物色谱信息表3.2.P.5-51 碱破坏试验主要降解产物色谱信息表3.2.P.5-52 氧化破坏试验主要降解产物色谱信息表3.2.P.5-53 光照破坏试验主要降解产物4.制剂杂质列表a)以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
杂质的结构和种类的鉴定在其他模块或者附件中体现。
按照以前惯例,自制杂质的结构确认是通过工艺描述加氢谱确认即可,特殊的需要提供其他佐证手段。
外购杂质的结构确认一般是要提供完整的结构鉴定谱图。
b)说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
报告阈值是指所有高于此阈值的杂质及其含量均应在每批产品的检验报告中记录,并在申报资料中反映;鉴定阈值是指所有高于此阈值的杂质均应对其结构进行确证;合理限度是指只要质量标准中制订的杂质限度不高于此限度,就不需要提供该限度的制订依据,认为该限度是合理的。
c)提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物5.对比自制制剂片和原料药杂质谱以及纯度数据,6.对比自制制剂片和参比制剂杂质谱以及纯度数据,7.对比自制制剂片和参比制剂强制降解和长期稳定性考察的杂质谱变化、图谱以及纯度数据。
************************************************************************************ ************************************************************************************ 附件1:《CTD申报资料中杂质研究的几个问题》这篇需要我们认真研究一下:下面做了简单的抄录。
(/dzkw.do?method=largePage&id=312898)杂志谱研究需要以杂质谱分析为主线,安全性为核心,按照风险控制的策略,将杂质研究与CMC各项研究,乃至药理毒理及临床安全性研究等环节关联思考、综合考虑,而不仅仅拘泥于提供准确分析数据的传统思维,不是一项孤立的分析工作。
1、杂质控制要做到源头控制、过程控制与终点控制相结合的杂质控制理念:CTD格式中杂质控制的考虑要体现在CMC的各个环节,而不是仅仅局限在“质量控制”模块。
比如原辅料首先要满足制剂质量要求;关键工艺步骤及参数的确立、工艺开发过程等要考虑以杂质是否得到有效控制为重点关注。
制剂相关特性中要体现与原研产品杂质谱等的对比情况;包材、贮藏条件以及有效期的确立等也要以杂质是否处于安全合理的可控范围内为核心。
2、关注杂质分析与控制的系统性与整体性,不能割裂各项内容的必然联系和有机统一:杂质分析与控制的相关内容会分布在分析方法(3.2.S.4.2)、方法学验证(3.2.S.4.3)、杂质对比研究与杂质谱分析(3.2.S.4.5)、杂质情况分析总结(3.2.S.3.2)、样品检测与数据积累(3.2.S.4.4)、控制限度(2.3.S.4.1)等各模块中,但杂质研究又是一项系统工程,具有统一的整体性。
因此,不要因为申报资料格式的模块化而人为割裂各项研究内容的相互联系。
3、从杂质谱分析入手确立科学的杂质研究基本思路。
杂质谱包括药物中所有杂质的种类、来源及特性等信息。
有针对性地选择合适的杂质分析方法,以确保杂质的有效检出和确认;通过与原研产品杂质谱的对比研究,根据各相应杂质的一致性求证,或跟踪杂质谱对安全性试验或临床试验结果产生的影响,评估各杂质的安全性风险和可接受水平;结合规模化生产时杂质谱的变化情况,确立安全合理的杂质控制水平。
4、分析方法的验证应具备针对性和全面性。
5、杂质限度的确定应符合相关技术指导原则的要求。
在分析方法相同的情况下,各特定杂质应不超过同品种或同类品种法定标准的相应限度;非特定杂质应采用LC/UV、LC/MS、PDA等多种方法与原研产品或ICH成员国产品进行杂质比较,说明各杂质与原研产品的一致性,相同杂质限度可参考ChP、USP、BP/EP、JP等药典同品种最严格的单个杂质限度确定。
附件2:引用的5.30文件的要求:化学仿制药电子通用技术文档申报指导原则(征求意见稿)A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度B.说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C.提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-4类A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
可以表格形式整理B.说明各杂质在最终质量标准中是否进行控制以及控制的限度,并提供充分的依据。
C.提供详细的降解途径与降解产物研究资料与图谱。
应在对原料药的降解途径与降解产物有充分了解的基础上,进行系统的降解途径与降解产物研究,明确说明本品的降解途径与降解产物化学药品新注册分类申报资料要求(试行)-3类A.以列表的方式列明产品中可能含有的杂质,分析杂质的产生来源,结合相关指导原则要求,对于已知杂质给出化学结构并提供结构确证资料,并提供控制限度。
B.对于最终质量标准中是否进行控制以及控制的限度,应提供依据。
