课时2 氮氧化物及硫氧化物和氮氧化物对空气的污染共22页
二氧化氮和一氧化氮 二氧化硫和二氧化氮对大气的污染

2
2NO+O2===2NO2
3NO2+H2O===2HNO3+NO 4NO2+2H2O+O2===4HNO3
3
继续通入氧气
【实验探究】 2.你的设计对工业上生产硝酸有什么启示?
【提示】工业生产硝酸,将尾气(NO)通入适量的 氧气后再溶解于水,经过多次循环氧化、溶解, 可充分利用原料,并减少NO的排放,有利于保护 环境。
NO和 NO2的性质小结 NO NO2
物理 性质 化学 性质 生成
无色、无味、有毒 难溶于水的气体
2NO+O2 ==2NO2 N2 + O2 === NO
或高温 放电
红棕色、有刺激性、易 溶于水的有毒气体 3NO2+H2O ==2HNO3+NO 2NO+O2 == 2NO2 向上排空气法
收集
排水法
(2)溶于水形成酸雨。
3.酸雨
酸雨是指pH小于5.6的雨水。
正常雨水由于存在CO2的原因其pH约为5.6。当
大气中的SO2和NO2溶于水后形成酸性溶液,随雨水
降下使雨水的pH小于5.6,形成酸雨。
4.酸雨的类型:
(1)硫酸型:SO2→H2SO3→H2SO4 化学方程式: SO2 + H2O ==== H2SO3 2H2SO3 + O2 ==== 2H2SO4 (2)硝酸型:NO2→HNO3 化学方程式: 3NO2 + H2O ==== 2HNO3 + NO 我国的酸雨主要为硫酸型酸雨。
雷雨发庄稼
思考:你知道上述现象中包含 的化学反应原理是什么吗?
N2 +
放电 O2 或高温 ====
2NO
2NO + O2 == 2NO2 3NO2 + H2O == 2HNO3 + NO
二氧化氮和一氧化氮二氧化硫和三氧化硫对环境的污染

我国的酸雨主要为硫酸雨,其发展速度很快,在23 个调查的省、市及自治区中有20个出现过酸雨,有不少 地区的酸雨已相当严重且逐年增加,据2001年4月9日南 京晨报报导:国家环保总局局长解振华讲我国相当多的 城市空气污染程度超标,酸雨区面积为国土面积的30%, 全国七大水系中有1/3的河段达不到使用功能要求……
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
点燃
S + O2 ==== SO2 在煤、石油和某些金 属矿物中含硫物质或硫 的化合物在燃烧或冶炼 时,会生成SO2,这是 大气中SO2的主要来源。
二氧化氮和一氧化氮二 氧化硫和三氧化硫对环
境的污染
2020/11/8
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
1、了解氮的氧化物的主要性质和应用。 2、了解硫和氮的氧化物对环境的影响,及消除污染 的方法。
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
俗语:雷雨肥庄稼?大家知道什么意思吗?
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
酸雨会伤害植物的新生芽,使叶绿素含量偏小,光 合作用受阻,作物产量下降,严重时会导致大面积的农 作物减产或绝收,大片的森林树木枯死,小生物随之灭 绝……最终必然会影响到我们人类自身。
二氧化氮和一氧化氮二氧化硫和三氧 化硫对环境的污染
酸雨的危害主要有: 1、对人体的直接危害,首先是它的刺激性,其次是它会 形成硫酸雾和硫酸盐雾,其毒性比SO2大,能浸入人的肺部, 引起肺水肿等疾病而使人死亡; 2、引起河流、湖泊的水体酸化,严重影响水生动物生长; 3、破坏土壤、植被、森林; 4、腐蚀金属、油漆、皮革、纺织品及建筑材料等; 5、渗入地下,可引起地下水酸化,酸化后的地下水中铝、 铜、锌、镉等对人体有害金属元素的含量会偏高。
二氧化氮和一氧化氮二氧化硫和二氧化氮对大气的污染

我国的酸雨主要为硫酸雨,且酸雨发展趋势值 得警惕,东南沿海地区尤其如此。在2010年上半年 在监测的全国443个城市中,有189个出现酸雨,比 例超过四成。
案例: 2010年上半年,温州、台州、厦门等8个城市
(地区)酸雨频率达到100%!近几年来,温州酸雨发 生频率之高令人咋舌,一直名列全国前茅,属于重 酸雨区。2009年,温州市在全市6个县(市、区)开 展了酸雨监测,全年采集雨样总数468个,其中酸 雨样品442个,平均酸雨率为94.4%,反映酸性的PH 范围为3.07~6.70,均值为4.47,单次最低值为 3.07。这个数值接近于食醋的2.9,相当于“下了 一场醋雨”。
随着人们生活水平的日益 提高,城市工业化步伐的大步 前进,环境污染已经成为全世 界最为关注的问题之一,某些 工厂排出的废气不经过处理直 接排放到空气中,严重造成了 大气污染,使得某些地区雨水 酸性严重超标,形成酸雨。
1872年美国化学家 Smith首先提出酸雨一词, 引起全世界关注。1985 年,几场酸雨过后,我 国四川奉节县9万多亩松 树全部枯死,重庆南山 2.7万亩马尾松死亡过半。
(2NO + O2 === 2N×O32) + (3NO2 + H2O === 2HNO3 +×N2O)
4NO + 3O2 + 2H2O = 4HNO3
当充入3/4试管体积的O2时,水能充满试管。
洛杉矶光化学烟雾事件
洛杉矶从20世纪40年代初,每年 从夏季至早秋,只要是晴朗的日子, 城市上空就会出现一种弥漫天空的浅 蓝色烟雾,使整座城市上空变得浑浊 不清。
NO2是红棕色、有刺激性气味的有毒气体,密度比 空气大,易液化,易溶于水。
二氧化氮溶于水时生成硝酸和一氧化氮。
氧化硫和二氧化氮对大气的污染优秀教案

二氧化硫和二氧化氮对大气的污染教学设计一、教学目标1.知识与技能(1)初步掌握一氧化氮和二氧化氮的重要性质,实验探究由二氧化氮制硝酸的可能方法。
(2)熟悉氮在五种不同氧化物中的化合价。
2.情感态度与价值观(1)通过介绍硝酸的工业制法等研究工作,激发热爱科学、献身科学的精神。
(2)了解氮氧化物对环境的污染,增强环保意识。
通过对汽车尾气的超标排放给人体健康造成的危害和对大气造成污染的调查,培养关注社会、关注人类生存环境的意识,培养对事物的分析要一分为二,辩证看待的观念。
二、教学重难点重点:了解氮氧化物对环境的污染,增强环保意识难点:培养对事物的分析要一分为二,辩证看待的观念三、教学设计环境保护问题已越来越为世界各国所重视,环境意识已成为当代人类文化素质的重要组成部分,并成为衡量一个国家,一个民族乃至一个人的文明程度的重要标准。
环境问题的产生主要是由于人类对自然资源和生态环境的不合理利用和破坏造成的,而这种损害环境的行为又是同人类对环境缺乏正确的认识联系在一起的。
因此,根据课程标准“关注人类面临的与化学相关的社会问题,培养学生的社会责任感、参与意识和决策能力”的要求,加强环境教育,提高学生的环境意识,帮助学生正确认识环境和环境问题。
二氧化硫和二氧化氮是造成大气污染的主要气体,大气质量与二氧化硫、二氧化氮的含量有关。
因此,在本章中,把这二者单独作为一节来学习。
本节从人们熟悉的空气质量日报提出相关的4个问题,然后教科书安排了三部分内容,第一部分是二氧化硫的性质,第二部分是二氧化氮、一氧化氮的性质,第三部分是二氧化硫和二氧化氮对大气的污染。
本节内容编排有以下特点:1.主题明确本节的主题是了解环境污染的原因和树立环境保护意识,教科书从空气质量日报引出环境问题,最后教学内容落实到二氧化硫和二氧化氮对大气的污染,给自然环境、人类的正常生活和工农业生产带来的危害,以及防治环境污染的方法等。
总体的思路是先弄清楚有关污染物的性质,然后让学生了解引起大气污染的原因,从而引导学生形成参与解决环境问题的意识。
课时作业22:4.3.2 二氧化氮和一氧化氮 大气的污染

第2课时二氧化氮和一氧化氮大气的污染基础巩固1.现有以下几种措施,其中能减少酸雨产生的措施是()①对燃烧煤时产生的尾气进行除硫处理②少用原煤作燃料③燃煤时鼓入足量空气④开发清洁能源A.①②③B.②③④C.①②④D.①③④解析煤中含有一定量的硫,煤在燃烧时产生大量的SO2,这是酸雨产生的主要原因之一。
对燃烧煤时产生的尾气进行除硫处理、开发清洁能源、少用原煤作燃料等可以减少酸雨的产生。
燃煤时鼓入足量空气只能促使煤燃烧得更彻底,不能减少SO2的排放量。
本题选C。
答案C2.化学在生产和日常生活中有着重要的应用。
下列说法正确的是()A.高纯度的硅单质广泛用于制作光导纤维B.向煤中加入适量石灰石,在燃烧时SO2最终生成CaSO3,可减少对大气的污染C.汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2D.大量燃烧化石燃料排放的废气中含大量CO2、SO2,造成大气污染,从而使雨水pH=5.6解析光导纤维主要材料为SiO2,A错误;B项中最终生成CaSO4,错误;CO2不形成酸雨,D错误。
答案C3.下列说法中,正确的是()A.NO2能与水反应生成硝酸,故NO2为酸性氧化物B.除去O2中混有的NO2,可将混合气体通过水,将NO2溶解C.NO2与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO2,得橙色溶液的为溴蒸气D.NO2是大气污染物之一解析A项前后无因果关系,故A项错误;除去O2中混有的NO2,将混合气体通过水,NO2溶解的同时又生成新的杂质NO且NO又能与O2反应,故B项错误;NO2、溴蒸气分别与NaOH溶液作用均得无色溶液,所以NaOH溶液无法将NO2与溴蒸气区别开,C项错误。
答案D4.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,发现试管①内的水立刻沸腾了。
则液体A和气体B的组合不可能是下列的()A.亚硫酸钠溶液、氯气B.水、二氧化氮C.水、一氧化氮D.氢氧化钠溶液、二氧化碳解析①中水沸腾说明①中气体压强减小,在C项中水与NO不反应,不能使气体压强减小。
课时2 氮氧化物及硫氧化物和氮氧化物对空气的污染

①请你写出酸雨开始呈酸性的化学方程式。
H2SO3
②这种雨水的pH值逐渐减小,其原因何在?
2H2SO3+ O2=2 H2SO4 弱酸逐渐被氧化为强酸,所以酸性增强,PH渐小,当所有亚 硫酸全部氧化完后PH不再变化。
下列现象主要与NO2有关的是(BC ) A.臭氧空洞 C.光化学烟雾 臭氧空洞:氟氯代烃 光化学烟雾:氮氧化物、碳氢化合物。 温室效应:CO2 B.酸雨 D.温室效应
二、二氧化氮和一氧化氮 1.在放电或高温下: N2 + O2 放电或高温 2 NO(无色) 2.在常温下:2 NO + O2 = 2 NO2(红棕色) 3.NO2 溶于水:3 NO2 + H2O =2HNO3 + NO(工业制硝酸) ★NO和NO2性质的比较: NO:无色、无味、不溶于水、不稳定(易氧化)、剧毒 NO2: 红棕色、有刺激性气味、易溶于水、稳定、有毒性 NO2不能 排水 用法只能用 向上排空气 法。
★易错细节:NO和O2 不能 共存,收集NO只能用
排水法。收集
一场大的雷雨天后,地面上的植物生长得格外茂盛,请解释原因。 N2 + O2 放电或高温 2 NO 2 NO + O2 = 2 NO2 3 NO2 + H2O =2HNO3 + NO
雷雨天降水中的硝酸与土壤中的矿物质形 成硝酸盐相当于给农作物施了一次氮肥, 能促进其生长,所以说“雷雨利庄稼”。
③2CaSO 3 + O 2 =2CaSO 4 总反应: 2CaCO 3 + O 2 + 2SO 2
高温
2CaSO 4 + 2CO 2
练习:某化学小组采集了一份雨水样品 ,每隔一段时间测定一次pH值, 其结果如下: 测试时间 雨水的pH值 SO2+H2O
二氧化硫和二氧化氮对大气的污染 课件

(4)危害。 ①直接破坏农作物、森林、草原,使土壤、湖泊酸化。 ②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。 [微点拨] 呈酸性的雨水不一定是酸雨,正常雨水 pH=5.6,酸雨的 pH<5.6。
[自我诊断] 空气质量日报报道的大气污染物中有CO2吗? 答案: 空气质量日报报道的大气污染物是 SO2、氮氧化合物、固体悬浮颗 粒,CO2 能引起温室效应,但 CO2 不是大气污染物,因为 CO2 是空气的成分。
答案: (1)电动 以汽油为燃料的 催化剂
(2)6NO+4NH34=0=0=℃== =5N2+6H2O
[思考感悟] 环境污染及其防治
1.常见的环境污染
环境污染
形成原因
主要危害
温室效应 大气中 CO2 及气态烃的含量不断 全球变暖,冰雪融化,释放有毒
增加
气体
酸雨
SO2 和氮氧化物的排放
ቤተ መጻሕፍቲ ባይዱ
土壤酸化,腐蚀建筑物
2.酸雨 (1)概念:__p_H_<_5_._6_的降雨。 (2)成因:主要是大气中的__S_O_2_与__N__O_2__溶于水形成的。 (3)类型(写出化学方程式)。 ①硫酸型:SO2→H2SO3→H2SO4 化学方程式:_S_O_2_+__H_2_O________H_2_S_O_3_,2_H__2_S_O_3_+__O_2_=_=_=_2_H__2S_O__4___; ②硝酸型:NO2→HNO3 化学方程式:___3_N_O__2_+__H_2_O_=_=__=_2_H_N__O_3_+__N__O___。
解析: (1)通入的 O2 与 NO 发生反应:①2NO+O2===2NO2,所以看到有 红棕色气体生成。生成的 NO2 溶于水:②3NO2+H2O===2HNO3+NO,①②两 反应的总反应方程式为③4NO+3O2+2H2O===4HNO3。气体消耗,又会看到液 面上升。V(NO)∶V(O2)≠4∶3,故最后有气体剩余,不论剩余 NO 还是 O2,均 为无色气体。
第2课时 氮的氧化物 大气污染物(知识点归纳及例题解析)
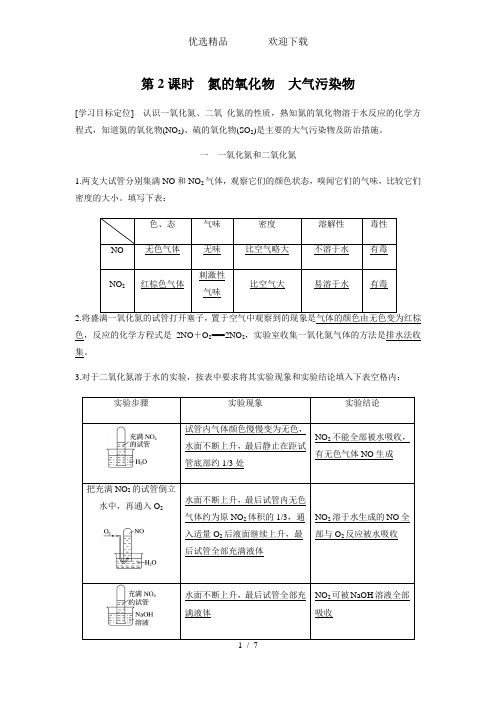
第2课时氮的氧化物大气污染物[学习目标定位]认识一氧化氮、二氧化氮的性质,熟知氮的氧化物溶于水反应的化学方程式,知道氮的氧化物(NO2)、硫的氧化物(SO2)是主要的大气污染物及防治措施。
一一氧化氮和二氧化氮1.两支大试管分别集满NO和NO2气体,观察它们的颜色状态,嗅闻它们的气味,比较它们密度的大小。
填写下表:2.置于空气中观察到的现象是气体的颜色由无色变为红棕色,反应的化学方程式是2NO+O2===2NO2,实验室收集一氧化氮气体的方法是排水法收集。
3.对于二氧化氮溶于水的实验,按表中要求将其实验现象和实验结论填入下表空格内:归纳总结二氧化氮与水的反应(1)二氧化氮溶于水反应的化学方程式是3NO 2+H 2O===2HNO 3+NO ,氧化剂与还原剂的物质的量比是1∶2。
(2)水吸收NO 2制硝酸的原理 3NO 2+H 2O===2HNO 3+NO ; 2NO +O 2===2NO 2;4NO 2+O 2+2H 2O===4HNO 3。
(3)二氧化氮溶于氢氧化钠溶液的化学方程式是2NO 2+2NaOH===NaNO 2+NaNO 3+H 2O 。
1.最新的病毒学研究证实,一氧化氮对SARS 病毒有直接抑制作用。
下列关于一氧化氮的叙述正确的是( )A.一氧化氮是一种红棕色气体B.常温常压下,一氧化氮不能与空气中的氧气直接化合C.一氧化氮可由氮气和氧气在放电条件下直接化合得到D.一氧化氮易溶于水,不能用排水法收集 答案 C解析 NO 是一种无色难溶于水的气体,可以用排水法收集。
常温常压下,NO 容易与氧气直接化合生成NO 2。
2.在一定条件下,将充满NO 2和O 2的试管倒立于水槽中,充分反应后,剩余气体体积为原混合气体体积的18,则原混合气体中NO 2和O 2的体积之比可能是( )①8∶1 ②7∶3 ③7∶1 ④4∶1 A.①② B.①③ C.②③D.②④答案 C解析 反应为4NO 2+O 2+2H 2O===4HNO 3,设原气体体积为8 L ,则剩余气体为1 L 。
第三节 硫和氮的氧化物 第二课时

第三节硫和氮的氧化物第二课时学习重点:二氧化氮与水的反应,二氧化氮对大气的污染知识梳理:一、氮气、一氧化氮和二氧化氮1、氮气:N2占空气体积的左右,是一种色味的气体,密度比空气,氮气在水里溶解度。
在通常情况下,N2与O2,但是在或的条件下,可以化合生成。
化学反应方程式:。
2、一氧化氮:NO是色,溶于水的毒气体。
在常温下很容易与空气中的O2化合生成NO2,化学方程式:。
【练习1】下列气体中,不能用排空气法收集的是()A.H2B.CO2C.NOD.O23、二氧化氮⑴物理性质:NO2是色,有气味的毒气体,密度比空气,易,溶于水。
⑵化学性质:NO2溶于水生成和。
反应方程式:。
【思考】俗话说“雷雨发庄稼”,有哪些科学道理?写出有关的化学方程式。
实验操作:a.将充满NO2的试管倒立在水槽里,发现,最后水充满整个试管容积的。
反应的化学方程式:。
b.向试管中通入O2时,无色气体变为色气体,反应的方程式:。
随着O2的不断通入,气体的体积逐渐,液面不断,当通入的O2恰好完全反应时,水将充满整个试管。
发生的总反应是:。
二、SO2和NO2对大气的污染1、SO2和NO2的主要来源:的燃烧,尾气、硫酸厂、硝酸厂的尾气。
2、危害:⑴引起污染,直接危害人体健康。
⑵溶于水形成。
3、防治措施:⑴工业废气在排入大气之前,必须回收处理;⑵控制汽车尾气的排放标准。
4、酸雨⑴pH 的降水称酸雨,主要是大气中的和溶于水造成的。
⑵形成原理:NO xSO(或⑶危害①直接破坏、、,使、酸化。
②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。
【练习】下列气体中,不会造成空气污染的是()A.N2B.NOC.NO2D.SO2三、有关氮的氧化物溶于水的计算1、NO和NO2的混合气体:此混合气体溶于水的反应:3NO2+ H2O == 2HNO3+ NO,可利用气体体积变化差值进行计算。
V(剩余)=V(NO)原+31V(NO2)2、NO2和O2的混和气体:此混合气体溶于水的反应: NO2+ O2+ H2O == HNO33、NO和O2的混和气体:此混合气体溶于水的反应: NO + O2+ H2O == HNO34、NO2(标准状况)溶于水,溶液的浓度:烧瓶中充满VL NO2,溶于水所得溶液的体积为32VL。
二氧化硫和二氧化氮对大气的污染-PPT课件

(5)空气质量日报报道的大气污染物是 CO2、SO2、氮氧化物、 固体悬浮颗粒。( )
(6)pH<7 的降雨均为酸雨。( ) 【答案】 (1)√ (2)× (3)√ (4)× (5)× (6)×
15
2.下列关于 NO 的叙述正确的是( ) A.NO 是一种红棕色的气体 B.常温常压下,NO 不能与空气中氧气直接化合 C.含等质量的氧元素的 NO 和 CO 的物质的量相等 D.NO 易溶于水,不能用排水法收集 【答案】 C
液面上升 2 mL,为试管容积的13。 【答案】 B
27
2.一定条件下,将等体积 NO 和 O2 充入一试管,并将试管 倒立于水槽中,充分反应后剩余气体的体积约为原总体积的
A.1/4
B.3/4
C.1/8
() D.3/8
【解析】 4NO+3O2+2H2O===4HNO3;若 NO 和 O2 都取 4 体积,则反应后剩余 O2 1 体积,所以充分反应后剩余气体的体
磷的洗涤剂会造成水体污染使水体富营养化而引起赤潮、水华等
现象,D 项错误。 【答案】 A
35
2.下列说法正确的是 ( ) A.pH 小于 7 的雨水被称为酸雨 B.造成温室效应和全球气候变暖的主要物质是 NO2 C.过量使用含磷洗衣粉可能会引起水体富营养化 D.推广使用燃煤脱硫技术,是为了防治 CO2 污染 【解析】 A 项,酸雨的 pH<5.6;B 项,温室效应是 CO2 引起;D 项,脱硫技术是防止 SO2 污染。 【答案】 C
在水槽中,反应停止后试管内剩余 2 mL 的无色气体,求原混合 气体中 NO2 和 O2 各多少毫升?
23
【解析】 剩余 2 mL 气体可能是 NO 或 O2,分两种情况讨 论:
二氧化硫和二氧化氮对环境的污染PPT教学课件

(3)汽车尾气中除含有氮氧化物外,还含有
。
CO、未燃烧的碳氢化合物、含铅化合物和颗粒物等
问题探索 1.下列关于 NO 的说法正确的是( ) A.NO 是酸性氧化物 B.NO 只能通过人工合成 C.NO 是大气污染物,会形成酸雨 D.NO 可以用向下排空气法收集
【答案】 C
2.下列关于 NO2 的物理性质描述中,正确的是( )
合气体的量筒倒立于水槽中,充分反应后,还剩余 2 mL 无色气体,则
原混合气体中 O2 的体积是( )
A.1.2 mL
B.2.4 mL
C.3.6 mL
D.4 mL
【 解 析 】 若 NO2 过 量 , 剩 余 为 NO 气 体 , 则 由 3NO2 + H2O===2HNO3+NO,可知过量的 NO2 为 6 mL,发生 4NO2+O2+ 2H2O===4HNO3 反应的气体为 12 mL-6 mL=6 mL,其中 O2 为 6 mL×15=1.2 mL。
V 剩=V(NO)原+13V(NO2)。
②NO2 与 O2 的混合气体溶于水(反应③)。
当 V(NO2
=4:1,恰好完全反应 :V(O2)>4:1,NO2过量,剩余NO
<4:1,O2过量,剩余O2
③NO 与 O2 的混合气体溶于水(反应④)
=4:3,恰好完全反应
当V
:V(O2)>4:3,剩余NO
<4:3,剩余O2
2.环境保护
(1)二氧化硫的来源:煤、石油的燃烧及某些含硫或硫的化合物的
金属矿物的冶炼。Leabharlann NO、NO2 的来源:汽车尾气等。
(2)溶有二氧化碳的正常雨水的 pH 为5.6 ,酸雨的 pH 小于 5.6。
二氧化氮和一氧化氮、二氧化硫和二氧化氮对大气的污染课件

二氧化氮是一种红棕色、有刺激性气味的有毒气体,密
度比空气大,易液化,易溶于水。溶于水时生成HNO3和NO, 工业上利用这一原理制取硝酸:3NO2+H2O=2HNO3+NO。
二、二氧化硫和二氧化氮对大气的污染
煤、石油和某些金属矿物中含硫或硫的化合物,因此燃烧 煤或冶炼金属矿物时,往往会生成二氧化硫。高温条件下,空 气中的氮气也参与反应,这是汽车尾气中含有NO的原因。
解析 分析氮氧化物破坏臭氧层的各步反应,得出总反
应为O3+O2O2,可以看出氮氧化物起催化剂的作用;同样分 析氟氯烷烃破坏臭氧层的各步反应,得出总反应为O3+O2O2, 即Cl原子是破坏臭氧层时反应的催化剂。
答案 D
= >44∶∶11
恰好完全反应 NO2过量,剩余气体为NO
<4∶1 O2过量,剩余气体为O2
(3)NO和O2的混合气体溶于水 根据4NO+3O2+2H2O=4HNO3 ③ 可知:当体积比
V(NO)∶V(O2) =>44∶∶33
恰好完全反应 剩余气体为NO
<4∶3 剩余气体为O2
(4)NO、NO2、O2三种种混合气体通入水中 可先按①式求出NO2和H2O反应后生成的NO的体积,再 加上原混合气体中NO的体积,即为NO的总体积,再按③式 进行计算。
三、SO2和NO2对大气的污染 1.常见的环境问题的成因、危害 (1)酸雨——形成原因主要是SO2和氮氧化物;能酸化土 壤,腐蚀建筑物等。
(2)光化学烟雾——主要是由氮氧化物、碳氢化物造成的; 将危害人体健康,影响植物生长。
(3)臭氧空洞——主要是由氮氧化物、氟氯代烃等的排放 引起的;将使地球上的生物受太阳紫外线的伤害加剧。
混 合 气 体 按 上 述 反 应 恰 好 进 行 了 反 应 , 所 以 V(NO2) = 10
课时2 氮氧化物及硫氧化物和氮氧化物对空气的污染共22页文档

45、法律的制定是为了保证每一个人 自由发 挥自己 的才能 ,而不 是为了 束缚他 的才、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
课时2 氮氧化物及硫氧化物 和氮氧化物对空气的污染
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的力量应当跟随着公民,就 像影子 跟随着 身体一 样。— —贝卡 利亚 43、法律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
第2课时二氧化氮和一氧化氮二氧化硫和二氧化氮对环境的污染(完整版)4

酸雨的危害
如何控制酸雨?
1.改善燃料种类,积极开发新能源。 2.对煤(其中含硫为0.3%~5%)进行处理,如选洗加工、 综合开发、在煤中加入适量的生石灰、对排放的烟进行 处理以回收SO2。 3.种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉) 等。
1972年6月5日,具有历史意义的人类环境会议在 瑞典首都斯德哥尔摩召开,通过了著名的《人类环境 宣言》,并确定每年6月5日为“世界环境日”。从 1974年起,每年联合国环境规划署确定一个主题,开 展“世界环境日”活动,其中1983年的主题是“防治 酸雨”。
于水,经过多次循环氧化、溶解,可充分利用原料,并减 少NO的排放,有利于保护环境。
二、二氧化硫和二氧化氮对大气的污染 1.二氧化硫和二氧化氮是主要的大气污染物。 2.污染物的来源:
(1)SO2主要来自于化石燃料(如煤与石油)的燃烧、 含硫金属的冶炼以及制造硫酸、磷肥等产生的废气。
(2)NO2主要来自于汽车尾气。
(API)
可吸入颗粒
52
Ⅱ
物
二氧化硫
7
I
二氧化氮
24
I
空气质量描述
良 优 优
A.焚烧垃圾 C.汽车排放的尾气
B.使用含磷洗衣粉 D.用煤和石油产品作燃料
5.煤中含有S,燃烧时会产生SO2排放到空气中去污染空气, 请利用今天学过的知识设计一个合理方案来减少煤燃烧时 SO2的排放量,并写出有关方程式? 【答案】
一、NO和NO2
2NO+O2====2NO2(红棕色) 3NO2+H2O====2HNO3+NO
二、SO2和NO2对大气的污染 1.来源 2.危害 3.防治
1.“酸雨”的形成主要是由于( B ) A.森林遭乱砍滥伐,破坏生态平衡
