2015年专升本考试基础化学考试大纲
2015专升本考试大纲

《法理学》考试大纲一、考试内容《法理学》是法学专业的专业基础课、核心课。
法理学是以法的本质、历史发展、法的运行、法与文化传统等为研究对象的一门学科,法理学不同于部门法学,它研究法学及其发展的一般规律性与普遍性的问题。
按照法理学学科性质与课程大纲的一般要求,该考纲的主要内容包括:法学的研究对象、西方法理学的历史、法的概念、法的要素、法的形式、效力与分类、法律关系、法律体系、法律责任、权利与义务、法的起源、法的历史形态、法系、法的发展、立法、执法、司法、法律监督、法律方法、法治与法治国家、法的作用、法与利益、法与自由、法与人权、法与政治、法与传统法律文化、法与道德等。
本大纲要求学生初步掌握法理学的基本概念、基本原理,并利用法理学的基本概念与原理分析问题、解决问题。
具体要求如下:1、掌握法学的研究对象,法学的概念,法学与其它学科的关系,法学的体系与分科。
2、掌握西方法理学产生、发展的历史。
3、掌握法的概念:法的定义、法的本质及其基本特征。
4、掌握法的要素的概念、法律规则的结构及其分类、法律原则、法律概念。
5、掌握法的渊源、法的效力、法的分类。
6、掌握法律关系的概念、法律关系的主体与客体、法律关系的形成、变更与消灭。
7、掌握法律体系的基本概念、法律部门及其划分标准、当代中国的法律体系。
8、掌握法律责任的概念、法律责任的分类、法律责任的构成、归责与免责。
9、掌握权利与义务的概念、权利与义务的关系、权利与义务的分类。
10、掌握原始社会的社会规范,法产生的一般规律,成文法与原始习惯的区别。
11、掌握法的历史形态的概念,古代法律制度与近、现代资本主义的法律制度的基本特征。
12、掌握法系的概念、中华法系、大陆法系、英美法系13、掌握法的发展的一般理论;法的继承、法律移植、法律改革的基本概念与内涵。
14、掌握立法的概念与立法体制、立法原则、立法权限的划分、立法的程序与立法技术。
15、掌握执法与司法的概念、主体、内容、原则以及执法、司法的区别。
2015专升本考试大纲

2015专升本考试大纲2015年的专升本考试是中国高等教育中一个重要的选拔机制,它为专科生提供了一个继续深造的机会,使他们能够进入本科阶段学习。
考试大纲是指导考生复习和准备考试的重要文件,它规定了考试的内容、范围和要求。
以下是2015年专升本考试大纲的概述。
考试科目与内容2015年专升本考试通常包括公共基础课和专业课两个部分。
公共基础课一般包括语文、数学、英语等科目,而专业课则根据不同的专业要求有所不同,可能涵盖专业基础知识、专业技能等。
1. 语文:考试内容通常包括现代汉语的基础知识、阅读理解、写作能力等。
考生需要掌握一定的汉语词汇、语法,能够理解并分析不同文体的文章,并具备一定的写作能力。
2. 数学:数学考试内容可能包括高等数学、线性代数、概率论与数理统计等。
考生需要掌握数学的基本概念、原理和计算方法,能够解决实际问题。
3. 英语:英语考试通常包括英语听说读写四个方面的能力测试。
考生需要具备一定的词汇量、语法知识,能够进行基本的英语交流和理解英文材料。
考试形式与要求考试形式一般为笔试,可能包括选择题、填空题、简答题、论述题等。
考试要求考生在规定时间内完成所有题目,并且答案需要准确、清晰。
1. 选择题:考生需要从四个选项中选择最合适的答案。
这类题目考察考生对知识点的掌握程度和理解能力。
2. 填空题:考生需要根据题目要求填写正确的答案。
这类题目考察考生的记忆力和对知识点的熟练程度。
3. 简答题:考生需要对问题进行简要回答。
这类题目考察考生的分析和表达能力。
4. 论述题:考生需要对问题进行详细的论述。
这类题目考察考生的综合分析能力和表达能力。
复习建议1. 系统复习:考生应该系统地复习所有考试科目的知识点,确保没有遗漏。
2. 模拟练习:通过模拟考试来检验复习效果,熟悉考试流程和时间管理。
3. 重点突破:针对自己的薄弱环节进行重点复习和练习,提高解题能力。
4. 心理调适:保持良好的心态,避免过度紧张,确保在考试中能够发挥出最佳水平。
江西中医药大学专升本《有机化学》考试大纲

江西中医药大学专升本《有机化学》考试大纲对于专升本的学生来说,特别是中医专业的,化学与医药的关系不能不掌握。
小编在这里整理了专升本《有机化学》考试大纲,希望能帮助到您。
江西中医药大学专升本《有机化学》考试大纲一、绪论1、了解内容:有机化学定义及与药学的关系。
2、熟悉内容:有机化合物分类,有机化学研究方法,官能团。
3、掌握内容:共价键组成、属性,电性效应及影响。
二、立体化学基础1、了解内容:立体异构类型,偏振光与旋光性。
2、熟悉内容:分子模型表示法,立体结构式表示法,构象异构。
3、掌握内容(1)顺反异构类型、命名。
(2)旋光异构表示法、命名。
三、烷烃1、了解内容:来源,应用。
2、熟悉内容:制备,常见化合物,物性。
3、掌握内容:命名,化性(卤代及机理),游离基结构与稳定性。
四、烯烃1、了解内容:来源,应用。
2、熟悉内容:制备,常见化合物,物性,聚合反应,碳正离子结构和稳定性。
3、掌握内容:命名,亲电加成,氧化,α-H 活性及反应性,马氏规则。
五、炔烃和二烯烃1、了解内容:来源,应用。
2、熟悉内容:制备,常见化合物,物性,聚合反应。
3、掌握内容:命名,加成反应,炔氢反应,氧化反应,共轭双烯特性。
六、脂环烃1、了解内容:类型,应用。
2、熟悉内容:命名,结构和稳定性关系。
3、掌握内容:加氢,卤代,氧化。
七、卤烃1、了解内容:类型,应用,多卤烃性质与应用,亲核取代机理。
2、熟悉内容:结构与卤原子恬性,制备。
3、掌握内容:命名,取代反应,消除反应及查氏规则,格氏反应。
八、芳烃1、了解内容:来源,类型,应用,多环芳烃性质,氢化反应。
2、熟悉内容:非苯芳烃结构,定位规则解释。
3、掌握内容:命名,亲电取代反应,氧化,α-H 卤代,定位规则及应用。
九、醇、酚、醚1、了解内容:类型,应用,硫醇,环醚。
2、熟悉内容:结构,制备,物性。
3、掌握内容(1)命名,醇的亲核取代,消除,氧化。
(2)酚的亲电取代,氧化。
(3)醚的成盐,断链反应。
应用化学专业《无机化学》“专升本”考试大纲

《无机化学》“专升本”考试大纲一、考试形式及适用对象本考试采用客观试题与主观试题相结合、单项技能测试与综合技能测试相结合的形式。
考试对象为参加选拔考试的应用化学专业考生,主要考查元素周期律、近代物质结构理论、化学热力学、反应速度、化学平衡、电解质溶液、氧化还原反应及配位化学等基础理论知识和重要元素及化合物的主要性质、结构、变化规律、制备和用途等知识。
二、题型及比例本考试由五个部分组成:填空题20%、选择题30%、简答题10%和计算题40%。
三、考试时间和分数本课程考试满分为100分,考试时限为120分钟。
四、考试大纲第一章. 化学反应中的质量关系和能量关系考核知识点:气体状态方程和分压定律、体系和环境、状态和状态函数、热和功、热力学能、能量守恒、恒压反应热与反应焓变、盖斯定律、标准摩尔生成焓、标准摩尔焓变的计算。
考核要求:1、了解化学中常用的量和单位以及有关的定律,化学计量数、反应进度;2、掌握体系和环境、状态和状态函数、热和功、热力学能、能量守恒、恒压反应热与反应焓变、盖斯定律、标准摩尔生成焓、标准摩尔焓变的计算。
第二章化学反应的方向、速率和限度考核知识点:反应速率、活化分子、活化能和反应速率,标准摩尔熵变、标准摩尔吉布斯函数变、可逆反应与化学平衡;考核要求:1、了解反应速率、活化分子和活化能的概念以及浓度、温度、催化剂对反应速率的影响。
2、掌握标准摩尔熵变、标准摩尔吉布斯函数变的计算,用吉布斯函数变判断反应或过程自发性的方法。
3、了解可逆反应与化学平衡、掌握化学平衡的有关计算。
掌握浓度、压力、温度对化学平衡移动的影响。
第三章电解质溶液中的离子反应考核知识点:同离子效应、水的离子积、缓冲溶液、水解常数、溶度积、溶度积规则;考核要求:1、了解解离常数、解离度、同离子效应、水的离子积、缓冲溶液、水解常数、溶度积、溶度积规则、分步沉淀等名词和概念。
2、掌握水溶液中pH值及有关离子浓度的计算。
3、掌握溶度积规则的有关计算。
2015年普通高等学校招生全国统一考试大纲的说明

2015年普通高等学校招生全国统一考试大纲的说明(理科综合)Ⅰ.考试性质普通高等学校招生全国统一考试是由合格的高中毕业生和具有同等学力的考生参加的选拔性考试。
高等学校根据考生的成绩,按已确定的招生计划,德、智、体全面衡量,择优录取。
因此,高考应有较高的信度、效度、必要的区分度和适当的难度。
Ⅱ.考试形式与试卷结构一、答卷方式闭卷、笔试。
二、考试时间考试时间150分钟,试卷满分300分。
三、科目分值物理110分,化学100分,生物90分。
各学科试题只涉及本学科内容,不跨学科综合。
四、题型试卷包括选择题和非选择题,非选择题一般包括填空、实验、作图、计算、简答等题型。
五、试卷结构1.试卷分第Ⅰ卷和第Ⅱ卷。
第Ⅰ卷为生物、化学、物理三个科目的必考题,题型为选择题,共21题,每题6分,共计126分。
其中生物6道题(单项选择题),化学7道选择题(单项选择题),物理8道题(包括单项选择题和多项选择题)。
第Ⅱ卷由生物、化学、物理三科的必考题和选考题构成。
生物、化学、物理各科选考内容的分值控制在15分左右。
理科综合试卷结构表选择题(二)共8小题,第小题6分。
在每小题给出的四个选项中,有的只有一项符合题目要求,有的有多项符合题目要求。
全部选对的得6分,选对但不全的得3分,有选错的得0分。
在指导语中明确给出单选和多选的题号。
选考题要求考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目睥题号涂黑。
注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。
如果多做,则每学科按所做的第一题计分。
2.组卷:试卷按题型、内容和难度进行排列,选择题在前,非选择题在后,同一题型中同一学科的试题相对集中,同一学科中不同试题尽量按由易到难的顺序排列。
Ⅲ.各学科考核目标、内容及题型示例物理根据普通高等学校对新生文化素质的要求,依据中华人民共和国教育部2003年颁布的《普通高中课程方案(实验)》、《普通高中物理课程标准(实验)》和《2015年普通高等学校招生全国统一考试大纲(理科)》,结合教学实际,确定高考理工类物理科考试内容。
《基础化学》考试大纲

《基础化学》考试大纲一、考试科目基础化学二、适用专业生物技术三、考试内容(一)气体和溶液1、掌握气体状态方程及道尔顿分压定律;2、了解分散系的定义及分类;3、掌握溶液浓度的几种表示方法,并熟练地进行有关浓度的化学计算及相互换算;4、理解稀溶液的依数性(凝固点下降、沸点升高及渗透现象)。
(二)化学热力学和化学动力学基础1、了解热力学常用术语,状态函数特征,理解热力学第一定律、第二定律;2、掌握热化学方程式、反应的摩尔焓变、盖斯定律及有关计算;3、了解摩尔标准熵SØm、摩尔标准生成自由能△f GØm的概念,掌握△r SØm、△r GØm的简单计算,利用自由能变△r GØm判断标准状态下反应自发进行的方向;4、了解化学反应速率的概念、表示方法,活化能的概念,化学反应速率理论;掌握反应级数的概念,质量作用定律、反应速率方程,理解影响反应速率的因素;5、了解化学平衡的概念及标准平衡常数KØ和浓度平衡常数K c 的表示方法,掌握化学平衡的移动规律及平衡计算;6、了解酶催化的一般特征。
(三)物质结构1、了解核外电子运动的特殊性及波函数(原子轨道)、几率密度、电子云等概念;2、掌握四个量子数的物理意义及取值规则;3、掌握核外电子排布三原则,能熟练地书写常见元素的核外电子排布式,并能根据电子层结构特征判断元素在周期表中的位置;了解原子半径、元素电负性的意义及周期性变化规律;4、了解共价键的本质、特点、类型,掌握 sp型杂化轨道理论并能利用其解释简单分子化合物的空间构型;5、掌握分子极性、范德华力、氢键等概念,并能应用它们解释物质的一些物理性质;6、掌握配合物的组成、定义、命名法,了解配位化合物的类型。
(四)定量分析中的误差及分析结果的数据处理1、了解有效数字的含义,掌握正确取舍原则和运算规则;2、掌握定量分析误差的来源、分类和减免措施;3、掌握精密度与准确度的关系;4、了解提高分析结果的准确度的方法,掌握测定结果离群值的取舍方法。
2015年湖北第二师范学院普通专升本《生物化学》考试大纲

2015年湖北第二师范学院普通专升本《生物化学》考试大纲一、考试科目名称:《生物化学》二、考试方式:闭卷三、考试时间:90分钟四、试卷结构:总分100分,其中选择题20分,填空题20分,名词解释题15分,简答计算题30分,综合应用题15分。
五、参考书目张洪渊主编.生物化学(第三版).四川大学出版社,2009王玮主编.简明生物化学.科学出版社,2012六、考试的基本要求生物化学是生物技术及应用专业专升本入学考试中的考试科目,是生物科学及技术专业的一门重要的专业必修基础课程。
本课程主要考察考生对生物大分子物质的组成、结构、性质、分离提取和物质代谢及调控基本知识的理解和掌握程度及应用生物化学的基本理论分析和解决实际问题的能力。
七、考试范围考核知识及要求第一章蛋白质的生物化学熟练掌握氨基酸的种类、结构及理化性质,蛋白质的一级结构和高级结构内容,蛋白质的性质及分离纯化等内容。
第二章核酸化学掌握核酸的组成成分,RNA的结构,DNA的结构,核酸及核苷酸的性质,掌握核酸及组分分离纯化的一般方法。
第三章酶学初步掌握酶促反应的特点,酶的结构与功能的关系,理解酶的作用机制,熟练掌握酶促反应动力学的原理及米氏常数的意义及应用,理解影响酶作用因素,掌握酶活力测定的方法。
第四章维生素和辅酶理解各类维生素的作用,掌握水溶性维生素和其相关的辅酶。
第五章生物氧化理解生物氧化的特点、方式和相关的酶,掌握呼吸链的组成及排列,理解生物氧化中能量的转移和利用。
第六章糖代谢掌握糖的无氧分解及生理意义,掌握三羧酸循环的反应历程及意义和调节,掌握磷酸己糖途径及意义,掌握糖原的生物合成及糖异生。
第七章脂代谢掌握甘油的分解与合成代谢,重点掌握脂肪酸的分解代谢和合成代谢及调节。
第八章蛋白质和氨基酸的代谢熟练掌握氨基酸的脱氨基和脱羧基,掌握尿素循环及酮体的代谢。
第九章核酸代谢掌握核苷酸的分解代谢,嘌呤核苷酸和嘧啶核苷酸合成代谢的两种方式及合成物质的主要来源。
2015年安徽省普通高校专升本考试报考指南
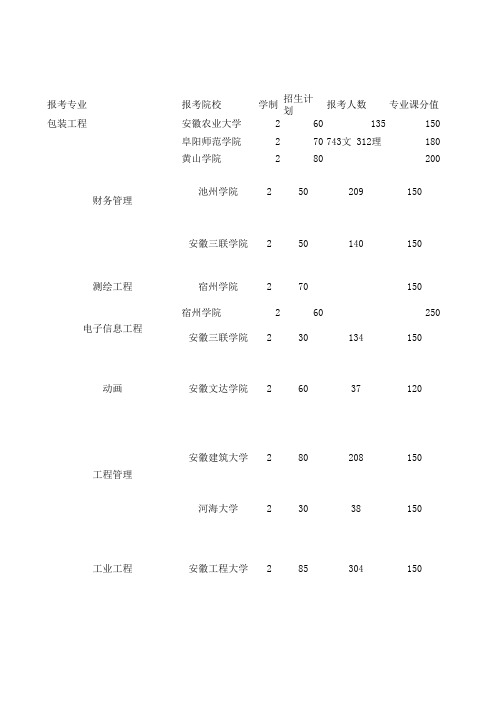
报考专业报考院校学制招生计划报考人数专业课分值包装工程安徽农业大学260135150阜阳师范学院270743文 312理180黄山学院280200宿州学院26025015015015015015015012015020914013437208383048030855050703060222222安徽工程大学池州学院安徽三联学院宿州学院安徽三联学院安徽文达学院工业工程2财务管理测绘工程电子信息工程动画工程管理安徽建筑大学河海大学22护理学安徽医科大学31202141501501501501501501501501501501501501412405669050741358944853886050602580120506085404070222222222222宿州学院巢湖学院池州学院合肥师范学院安徽工程大学合肥师范学院合肥学院池州学院安徽大学安徽新华学院安徽外国语学院皖西学院化学化学工程与工艺广播电视编导广播电视学国际经济与贸易汉语言文学行政管理15015015020015015015015018015015015015015015015015510932420049015218033025514557201334550305080503030406050120607080502222222222222222河海大学池州学院黄山学院池州学院安徽科技学院安徽农业大学阜阳师范学院巢湖学院蚌埠学院合肥师范学院宿州学院安徽建筑大学铜陵学院安徽三联学院安徽外国语学院河海大学旅游管理会计学机械电子工程计算机科学与技术历史学宿州学院2100150蚌埠学院23024415015015015015015015015015015015015015012015015015017914389377文342理2752181820124902031092621719020010050305738024045603060503030605022222222222222222蚌埠学院池州学院安庆师范学院安徽农业大学蚌埠学院安徽农业大学安徽科技学院皖西学院池州学院安徽三联学院安徽外国语学院安徽文达学院安徽农业大学安徽农业大学池州学院安徽外国语学院安徽农业大学涉农类食品科学与工程市场营销视觉传达设计农业水利工程人力资源管理日语商务英语社会工作河海大学230151501501501801501501501501501501501501502135039417104088835480865718018185501004050904520301206045402222222222222皖西学院安徽大学阜阳师范学院池州学院河海大学安庆师范学院合肥师范学院安徽工程大学安徽新华学院蚌埠学院池州学院合肥师范学院蚌埠学院戏剧影视导演(表演、播音主持方向)小学教育社会体育指导与管理水利水电思想政治教育体育教育土木工程物流管理数学与应用数学机械设计制造及其自动化新闻学宿州学院270108150安徽农业大学26030015018015015015020015015040/40/70150/1501502514782119622764099696660205840100505080557012022222222222阜阳师范学院安徽科技学院合肥学院黄山学院蚌埠学院合肥师范学院蚌埠医学院安徽大学滁州学院安徽中医药大学池州学院音乐表演小学教育药学学前教育学前教育(师范)医学检验技术皖西学院2120232150滁州学院2100301150/100安徽外国语学院23045150150150150180150150150150150150150602515272727166472962021321396070404040604530401207022222222222安徽三联学院阜阳师范学院蚌埠学院池州学院安徽中医药大学铜陵学院安徽科技学院巢湖学院宿州学院蚌埠学院池州学院英语应用化学中西医临床医学自动化专业课资格线专业课考试范围公共课分值公共课资格线60工业概论15070100管理学原理12070112西方经济学、会计学150《西方经济学》(第五版),高鸿业主编,人大学出版;《会计学》(第三版)刘永泽主编,东北财经大学出版会计学基础《会计学基础》《会计学基础》主 编:蔡文芬 张道梅出版社:中国科学技术大学出版社《测量学》顾孝烈等编,同济大学出版社第3版98《电子技术基础》(模拟、数字)75/7572电路分析《电路》(第五版)主 编:邱关源出版社:高等教育出版社,2006.5《动漫专业考生宝典四格漫画与多格画创作》,翟翌翚著 ,机械工业出版社 ,漫谭东芳著,京华出版社,2010年3月2011年01月;《动画分镜头技法》,《土木工程施工》(第2版),《土木工程施工》(第2版),重庆大学,同济大学,哈尔滨工业大学 编,中国建筑工业出版社出版,2008年。
2015年考试大纲

2015年考试大纲一、考试目的与要求2015年考试大纲旨在全面检验学生在本学年所学知识与技能的掌握程度,以及运用这些知识分析问题和解决问题的能力。
考试要求学生能够准确理解课程内容,掌握基本概念、基本原理和基本方法,并且能够在实际问题中灵活运用所学知识。
二、考试内容与范围1. 语文- 现代文阅读:包括散文、小说、议论文等文体的阅读与理解。
- 古诗文阅读:涵盖古诗词鉴赏和文言文翻译。
- 写作:包括记叙文、议论文、说明文等不同文体的写作。
2. 数学- 代数:包括方程与不等式、函数与导数、数列等。
- 几何:涵盖平面几何、立体几何、解析几何等。
- 统计与概率:包括数据收集与处理、概率论基础等。
3. 英语- 阅读理解:涉及不同题材和体裁的文章理解。
- 语言知识运用:包括词汇、语法、句型等。
- 写作:包括应用文写作、议论文写作等。
4. 物理- 力学:包括运动学、动力学、能量守恒等。
- 电磁学:涉及电场、磁场、电磁感应等。
- 光学与原子物理:包括光的传播、原子结构等。
5. 化学- 无机化学:包括元素周期表、化学反应类型等。
- 有机化学:涉及有机化合物的结构与性质。
- 化学实验:包括实验操作技能和实验数据处理。
6. 生物- 细胞生物学:涵盖细胞结构与功能、细胞分裂等。
- 遗传学:包括遗传规律、基因表达等。
- 生态学与进化:涉及生物多样性、生态系统等。
7. 历史- 中国历史:包括古代史、近现代史等。
- 世界历史:涵盖不同文明的发展与交流。
- 历史事件与人物:包括重要历史事件的分析与评价。
8. 地理- 自然地理:包括地球科学、气候、水文等。
- 人文地理:涉及人口、城市、文化等。
- 地理信息技术:包括地图阅读与GIS技术应用。
9. 政治- 政治理论:涵盖政治制度、政治思想等。
- 政治经济:包括市场经济、国际政治经济关系等。
- 法律基础:涉及宪法、民法、刑法等基础知识。
三、考试形式与题型1. 选择题:包括单项选择题和多项选择题,主要测试学生对基础知识的掌握和理解。
化学化工学院 730 《有机化学》考试大纲2015

中南大学2015年全国硕士研究生入学考试《有机化学》考试大纲本考试大纲由化学化工学院学院教授委员会于2011年7月7日通过。
I.考试性质全国硕士研究生入学考试是为高等学校招收硕士研究生而设置的。
有机化学属我校自行命题的考试。
它的评价标准是高等学校优秀毕业生能达到的及格或及格以上水平,以保证被录取者具有较扎实的有机化学基础知识。
II.考查目标有机化学是化学的重要分支,是许多学科专业的基础理论课程,它的内容丰富,有机化学考试在考查基本知识、基本理论的基础上,注重考查考生灵活运用这些基础知识分析和解决实际问题的能力。
考生应能:1.掌握各类有机化合物的命名法,有机化合物的各类异构现象,特别是立体异构。
2.掌握重要的有机化学反应:如取代、加成、氧化、还原、酯化、酰化、消除、缩合、脱羧、偶联、重排、周环化等反应,包括一些重要的人名反应。
3.掌握自由基取代、亲电取代、亲核取代、自由基加成、亲电加成、亲核加成反应机理和一些缩合、降解反应的机理。
4.能运用电子效应和空间效应,分析和理解结构与性质的关系。
5.熟悉各类化合物的制备,并能运用基本有机反应和理论,完成有机合成反应的设计、反应现象和机理的解释以及推断有机化合物的结构等。
6.熟悉基本杂环、常见糖类及氨基酸的结构和化学性质。
7.熟悉红外光谱、核磁共振谱的基本原理及其在测定有机化合物结构中的应用。
8.熟悉有机化合物合成、分离纯化的基本原理、基本操作和基本方法。
Ⅲ.考试形式和试卷结构1.试卷满分及考试时间本试卷满分为150分,考试时间为180分钟2.答题方式答题方式为闭卷,笔试。
3.试卷内容结构有机化学基本知识与基本理论约35%基本有机反应约20%有机合成约15%有机反应机理约10%推断有机化合物结构(含波谱分析)约10%有机化学实验约10%Ⅳ.试卷题型结构选择题、填空(如命名和完成有机反应)、问答题、有机合成、反应机理、推断结构、实验等Ⅴ.考查内容一、绪论1.掌握有机物与有机化学概念、碳原子的杂化轨道、共价键的极性与分子的极性、共价键的断裂方式与有机反应类型。
2015年化学考试大纲

2015年化学考试大纲2015年化学考试大纲主要涵盖了化学学科的核心知识点和能力要求,旨在评估学生对化学基础知识的掌握程度以及应用这些知识解决实际问题的能力。
以下是2015年化学考试大纲的主要内容:一、化学基本概念1. 原子、分子和离子的概念及其性质。
2. 化学键的类型,包括离子键、共价键和金属键。
3. 化学计量学,包括摩尔概念、摩尔质量、物质的量浓度等。
4. 化学方程式的书写和平衡。
二、物质的分类与性质1. 元素周期表的结构和元素周期律。
2. 无机化合物的分类和性质。
3. 有机化合物的基本概念,包括烃、醇、酸、酯等。
4. 物质的物理性质,如熔点、沸点、溶解性等。
三、化学计算1. 化学方程式的定量计算。
2. 溶液的浓度计算,包括质量分数、体积分数等。
3. 酸碱平衡的计算,包括pH值的计算和缓冲溶液的概念。
4. 氧化还原反应的计算。
四、化学反应原理1. 化学反应速率的影响因素。
2. 化学平衡的概念和平衡常数。
3. 酸碱理论,包括酸碱中和反应和酸碱指示剂。
4. 氧化还原反应的原理和应用。
五、化学实验技能1. 实验室安全规则和基本操作。
2. 常见化学实验仪器的使用方法。
3. 化学实验的基本步骤和数据处理。
4. 常见化学实验,如滴定实验、沉淀实验等。
六、化学与社会1. 化学在日常生活中的应用。
2. 化学与环境保护的关系。
3. 化学在医药、材料科学等领域的应用。
4. 化学伦理和社会责任。
七、化学创新能力1. 科学探究的基本方法和步骤。
2. 创新思维在化学学习中的应用。
3. 化学问题的发现、提出和解决。
4. 化学实验设计和改进。
八、考试形式和题型1. 选择题:包括单项选择题和多项选择题。
2. 填空题:包括对概念、原理、数据等的填空。
3. 简答题:要求学生对某一化学现象或问题给出简要的回答。
4. 计算题:涉及化学计算和数据处理。
5. 实验设计题:要求学生设计实验方案或分析实验结果。
6. 论述题:要求学生对某一化学问题进行深入分析和论述。
年专升本考试《基础化学》考试大纲

年专升本考试《基础化学》考试大纲一、考试内容(一)无机部分、化学基础知识掌握理想气体状态方程,混合气体的分压、分体积定律,液体的蒸发和沸点,溶液浓度的表示方法,非电解质稀溶液的依数性;了解实际气体的方程。
、化学热力学基础掌握热力学基本概念,热力学第一定律,化学反应的热效应,盖斯定律,生成热与燃烧热,从键能估算反应热,状态函数熵和吉布斯自由能及其应用;了解可逆途径,化学反应方向概念。
、化学反应速率掌握反应速率方程,浓度对化学反应速率的影响及相关计算,温度对化学反应速率的影响及相关计算,催化剂对化学反应速率的影响;了解反应速率理论。
、化学平衡了解化学反应的可逆性和化学平衡;掌握化学平衡常数,标准平衡常数θ与△θ的关系,化学平衡移动的影响因素。
、原子结构与元素周期律了解氢原子光谱和玻尔理论;掌握微观粒子的波粒二象性,几率密度和电子云,波函数的空间图象,四个量子数,多电子原子的能级,核外电子排布的原则及其与元素周期表的关系,元素基本性质的周期性。
、化学键理论概述掌握离子键的形成与特点,离子的特征,离子晶体,晶格能,共价键的本质、原理和特点,杂化轨道理论,价层电子对互斥理论,分子轨道理论,键参数与分子的性质,极性分子和非极性分子,分子间作用力,离子的极化,氢键;一般了解金属键的共性改价理论和能带理论;了解金属晶体。
、酸碱解离平衡掌握一元弱酸(碱)、多元弱酸(碱)氢(氢氧根)离子浓度的计算,同离子效应及缓冲溶液相关计算;了解盐的水解相关计算;一般了解电解质理论及酸碱理论的发展。
、沉淀溶解平衡掌握沉淀溶解平衡中溶度积常数和溶解度的关系,溶度积规则及相关计算。
、氧化还原反应掌握氧化还原反应的基本概念,氧化还原反应方程式的配平,原电池及其符号书写,标准电极电势的意义及应用,能斯特方程及元素电势图的相关计算。
、配位化学基础掌握配合物的基本概念,中心原子和配体对配合物稳定性的影响,配位平衡及其相关的计算,了解配合物的价键理论和晶体场理论。
2015年专升本专业对照与考试课程一览表

数控技术
580104
电机与电器
580201
机电一体化技术
580202
电气自动化技术
580203
生产过程自动化技术
580205
计算机控制技术
580207
检测技术及应用
580301
机电设备维修与管理
23
080601电气工程及其自动化
080701电子信息工程
080702电子科学与技术080714T电子信息科学与技术
工程测量与监理
540605
地理信息系统与地图制图技术
540603
摄影测量与遥感技术
550204
制冷与冷藏技术
570101
水文与水资源
570202
水利工程施工技术
570203
水利水电建筑工程
570207
城市水利
570213
水利工程实验与检测技术
570214
水利水电工程造价管理
560603
给排水工程技术
530204
化纤生产技术
580106
模具设计与制造
580107
材料成型与控制技术
580108
焊接技术及自动化
580150
电线电缆制造技术
580110
计算机辅助设计与制造
20
080202机械设计制造及其
自动化
080204机械电子工程
520501
航空机电设备维修
高等数学
520405
轮机工程技术
530211
楼宇智能化工程技术
570301
水电站动力设备与管理
580104
电机与电器
580111
精密机械技术
2015专接本考试大纲

2015专接本考试大纲2015年的专接本考试大纲是针对希望从专科学历提升到本科学历的学生所制定的一系列考试要求和标准。
专接本考试通常由各省教育考试院组织,旨在选拔优秀的专科毕业生进入本科阶段继续深造。
以下是2015年专接本考试大纲的主要内容概述。
# 一、考试目的专接本考试旨在考查学生是否具备进入本科学习的基本素质和能力,包括专业基础知识、专业技能、综合分析能力以及创新能力等。
# 二、考试科目专接本考试通常包括以下几个科目:1. 公共基础课:如政治、英语等。
2. 专业基础课:根据学生所报考的专业不同,可能包括数学、物理、化学等。
3. 专业课:针对学生所报考专业的核心课程。
# 三、考试形式考试形式可能包括:- 笔试:传统的书面考试,考查学生的理论知识掌握程度。
- 口试:部分专业可能需要进行面试,考查学生的实际操作能力和专业素养。
- 实践操作:针对某些专业,如医学、工程等,可能需要进行实践操作考核。
# 四、考试内容1. 公共基础课考试内容:- 政治:考查学生对政治理论的理解和分析能力。
- 英语:考查学生的英语阅读、写作、翻译等能力。
2. 专业基础课考试内容:- 数学:考查学生对高等数学、线性代数、概率论等基础知识的掌握。
- 物理/化学:根据专业要求,考查学生对物理或化学基础知识的掌握。
3. 专业课考试内容:- 根据学生所报考的专业,考查学生对专业核心知识的理解和应用能力。
# 五、考试要求1. 知识掌握:学生需要对所学专业知识有系统、深入的理解。
2. 分析能力:学生需要具备对复杂问题的分析和解决能力。
3. 实践能力:特别是对于需要实践操作的专业,学生需要有良好的实践操作技能。
# 六、考试准备1. 复习资料:学生应根据大纲要求,准备相应的复习资料,包括教材、参考书、历年真题等。
2. 时间管理:合理安排复习时间,确保各科目均衡复习。
3. 模拟考试:通过模拟考试来检验复习效果,及时调整复习策略。
# 七、考试技巧1. 答题技巧:掌握答题技巧,如快速阅读、关键词定位等,提高答题效率。
安徽中医药大学专升本考试《基础化学》考试纲要

安徽中医药大学专升本考试《基础化学》考试纲要温馨提示:《无机化学》占50%,《有机化学》占50%,以下所列提纲引自安徽中医药大学药学教研室,所涉及内容均为药学专业专升本考试考点,考生可按此考纲看书,若书籍内容无显著差异,毋须使用专用版。
A、无机化学部分一、溶液:溶液浓度(物质的量浓度,质量摩尔浓度,摩尔分数,质量分数、体积分数)的表示方法及其换算。
二、电离平衡与溶液的酸碱性:酸碱质子理论,水的离子积常数和溶液的酸碱性;强电解质溶液(离子强度、活度系数、活度的概念);弱电解质溶液(电离度,一元弱酸弱碱的电离平衡及其近似计算,多无弱酸的电离平衡及其近似计算,同离子效应的概念及其近似计算,盐效应的概念);(扣扣壹壹伍贰露露四四衣岭)盐类水解(强酸弱碱盐、强碱弱酸盐及其近似计算,弱酸弱碱盐、酸式盐的酸碱性);缓冲溶液(概念,缓冲原理,缓冲溶液PH值的近似计算,缓冲能力)。
三、沉淀和溶解平衡:难溶电解质的溶度积(溶度积常数、溶度积与溶解度的关系,溶度积规则),沉淀的生成和溶解(如何判断沉淀的生成、溶解和转化,同离子效应对沉淀平衡的影响,分步沉淀的原理及其应用)四、氧化还原与电极电势:氧化还原反应的基本概念(氧化数、氧化还原反应的配平)、电极电势(原电池组成,原电池符号,电极电势的概念,标准电极电势,nernst方程式及其计算)电极电势应用(扣扣壹壹伍贰露露四四衣岭)(比较氧化剂、还原剂的相对强弱、判断氧化还原反应进行的方向)。
五、原子结构:四个量子数的概念;多电子原子结构(基本原子中电子分布原理,周期表中1—36号元素的电子排布),电子层结构与周期性:(周期、族、区、能级组的划分、元素性质的周期性)六、化学键与分子结构:共价键理论(价键理论的基本要点,共价键的特征和类型);杂化轨道理论(杂化轨道理论的基本要点,杂化轨道类型);分子间作用力和氢键;键参数七、配位化合物:配位化合物的基本概念和命名:配位化合物的价键理论:配位化合物在水溶液中稳定性(配位平衡常数及其计算,酸碱平衡、沉淀平衡及氧化还原平衡对配位平衡的影响)。
专升本《有机化学》考试大纲

宜春学院生物工程专业“专升本”《有机化学》考试大纲一. 考试大纲的性质有机化学是生物类专业的必修的基础课程,也是报考生物类专业“专升本”考试科目之一。
为了帮助考生明确考试复习范围和要求,特制定本考试大纲。
二. 考试内容(一) 有机化学理论基础1.掌握各类有机化合物(烷烃、烯烃、炔烃、二烯烃、脂环烃、芳烃、卤代烃、醇、酚、醚、醛、酮、醌、羧酸、羧酸衍生物、硝基化合物、胺)的系统命名,2.熟悉杂环化合物(母体、音译法)的命名,3.熟悉一些常见有机化合物的俗名4.应用现代价键理论理解分子结构与其物理、化学性质之间的关系,5.有机分子结构的表示方法。
6.有机立体化学问题:构造异构、构型异构(顺反异构、旋光异构)和构象异构。
烯烃顺反异构体的构型命名。
9.偏振光与旋光性。
10.手性和对称因素,手性碳原子的表示方法(DL表示法和RS表示法)。
11.化学次序规则。
乙烷、丁烷、环己烷以及取代环己烷的典型构象和优势构象。
纽曼(Newmann)投影式,费歇尔(Fischer)投影式。
12.单糖的开链结构和氧环式结构(哈沃斯(Haworth)透视式),单糖的优势构象式。
13.单糖的αβ的判定法,呋喃型与吡喃型、变旋现象。
15.诱导效应、共轭效应、空间效应并合理解释有机化合物的性质规律,例如分子极性大小、酸碱性强弱、化学反应活性次序、芳香族亲电取代反应的定位规律等。
(二) 有机化合物的基本反应1.烷烃的卤代反应及卤代反应历程(自由基取代反应历程)。
2.烯烃中碳碳双键的加成反应,亲电加成反应历程;氧化、还原反应。
3.马尔可夫尼可夫(Markovnikov)规则。
4.炔烃中碳碳三键的加成反应、氧化还原反应、端炔的取代反应。
共轭二烯烃的1,2-加成反应和1,4-加成反应、双烯合成反应。
5.环烷烃的取代反应。
环烷烃的小环加成开环反应。
6.芳烃的亲电取代反应、加成反应、氧化反应、侧链氧化。
7.定位效应的应用。
8.卤代烃的亲核取代反应、消除反应及扎依切夫(Saytzeff)规则。
2015化学考纲解读

2015年新课标高考理综化学考试大纲解读及二轮复习策略化学组许芳萍透过2014年高考真题看复习前景回归课本,注重基础试题难度与2013高考理综化学试卷稍稍偏低,主要题型也极为相似,试题在题型、题量、分值、难度上保持相对稳定,避免了大起大落。
知识覆盖面非常全,几乎考查了高中化学所有重要知识点,偏重基础知识,基础知识扎实的学生不难得高分。
题目在条件给出及设问环节有所创新,但整体给学生平和的感觉。
2015年化学考试大纲、考试说明与去年对比2015年化学考试大纲、考试说明以及题型示例上与去年对比没有变动。
因此,可以预计第一,与2014年相比,2015年高考理综化学科目考查将仍会保持相对稳定,既延续前两年高考原有的命题思路,也体现了高中化学课程改革的理念与创新要求;其次,试题设计仍将力求按照以能力考查为基本出发点,立足基础知识,重点加强对主干化学知识、实验与探究能力的考查。
下面就题型示例解读2015年考试说明一透过题型示例解读2015年考试说明由于题型示例与考试目标与要求密切相关,因此先解读考试目标与要求。
可将2015年题型示例分成7部分,即化学反应原理、元素化合物及其应用、化学实验原大纲考试目标与要求与新课程大纲考试目标与要求对比对化学学习能力的要求的解读(1)接受、吸收、整合化学信息的能力(展示各种信息图)(2)分析问题和解决(解答)化学问题的能力案例1 (考试说明中例16)(3)化学实验与探究能力案例2 (考试说明中例13)题型示例的启示1.将继续考查考生对化学与生活、环境、能源等相互关系的理解案例3(考试说明中例1)2.化学反应原理仍是考查的重点且多以图表信息题出现题型示例中有11道题以以考查化学反应原理为主,其中选择题涉及化学反应速率及平衡2题,涉及电解质溶液理论2题,涉及化学反应与能量1题,非选择题则考查化学反应与能量(氧化还原反应、热化学、电化学)、速率(反应速率的表达计算、影响反应速率的因素)及平衡(平衡状态的特征及K的计算、影响平衡移动的因素)、溶液理论(弱电解质的电离平衡、水解平衡、沉淀溶解平衡)。
2015年福建省普通高中学生学业基础会考 化学学科考试大纲.doc

南宁市城市近期建设规划(2006—2010)第一章总则为加强对近期城市建设的指导与统筹,促进经济、社会和环境的可持续发展,依据法律、法规和相关规划的要求,以区域协调、社会和谐、资源节约、环境友好为基本原则,结合南宁市的实际情况,制定本规划。
本规划是落实城市总体规划的重要步骤,是对城市近期发展建设进行控制和指导的法定依据,与南宁市国民经济和社会发展“十一五”规划共同承担对全市经济社会发展与城市建设的综合调控作用。
规划指导思想(1)以“三个代表”重要思想为指导,贯彻实施“五个统筹”、“五个坚持”的发展策略,贯彻全面建设和谐小康社会的建设目标,认真落实以人为本,全面、协调和可持续发展的科学发展观。
(2)坚持遵循经济发展规律的规划思想,遵循城市规划建设和国民经济与社会发展规划、区域与国土规划等有机协调的政府宏观调控的原则。
(3)坚持规划公众参与的思想,遵循规划为城市整体利益、公众利益服务调控的原则。
(4)充分结合城市的土地和水资源承载能力,注重节地、节水、节能,构建集约型的发展模式,建设资源节约型社会。
(5)强化市场经济条件下城市规划的调控和引导作用,建立以近期建设规划为核心的实施方案和操作体系,促进城市社会经济和各项事业协调、全面发展。
(6)坚持城市产业与空间拓展有机结合的思想,通过城市空间的战略拓展与整合,促进产业协调发展和全面升级,促进经济、社会与环境的协调和可持续发展。
规划基本依据(1)《中华人民共和国城市规划法》(1989年)(2)《中华人民共和国土地管理法》(1998年修订)(3)《城市规划编制办法》(2005年)(4)《国务院关于加强城乡规划监督管理的通知》(国发[2002]13号)(5)《关于印发<近期建设规划工作暂行办法>、<城市规划强制性内容暂行规定>的通知》(建规[2002]218号)(6)《关于抓紧组织开展近期建设规划制定工作的通知》(建规[2005]142号)(7)《南宁市城市总体规划(1995—2010)》(8)《邕宁县城总体规划》(2002—2020)(9)《南宁市城市总体规划(2004—2020)修编纲要》(10)《南宁市国民经济和社会发展第十一个五年规划纲要》规划重点内容(1)总结“十五”期间城市发展成就与问题,对总体规划和上版近期建设规划实施情况进行回顾和评价,实事求是分析和检讨总体规划实施存在的问题。
高等教育-化学综合考试大纲(专升本)

化学综合考试大纲(专升本)《化学综合》考试大纲(专升本)一、总体要求本考试大纲涵盖《无机化学》及《有机化学》两门课程。
1、基本知识掌握溶液、电离平衡与多相离子平衡电化学原理、标准电极电位及应用原子结构与分子结构配合物、配合平衡等知识点。
掌握各类有机化合物的结构特征、命名、主要理化性质、它们的主要反应类型、性能和应用、分析鉴别、分离提纯的一般方法。
2、基本理论掌握化学反应速度与化学平衡理论,熟悉理解现代化学键理论(原子轨道、杂化、σ键、π键及大π键)、掌握电性效应(诱导效应、共轭效应和场效应)和立体化学(立体异构、构象分析)、掌握典型的反应机理(亲电反应、亲核反应及游离基反应)、理解有机化合物结构和性质间的关系,初步学会分析分子结构整体性、认识分子的性质。
二、考试知识范围及要求本部份分为《无机化学》考试大纲及《有机化学》考试大纲。
(一)无机化学考试大纲1、化学反应速度与化学平衡(1)化学反应速度:化学反应速度的定义;化学反应速度的表示。
(2)化学反应速度理论:活化能、活化分子;基元反应、质量作用定律;影响化学反应速度的因素。
(3)化学平衡:可逆反应与标准平衡常数K O;化学平衡的移动;有关平衡的计算。
2、溶液、电离平衡与多相离子平衡(1)溶液的浓度:浓度、摩尔分数及常用浓度间的换算。
(2)电解质溶液:电离度、活度;酸、碱质子理论。
(3)电离平衡:Ka、Kb、Kw;弱酸、碱水溶液pH值的计算。
(4)缓冲溶液:同离子效应与缓冲溶液;缓冲溶液的配制、用途及pH的计算。
(5)多相离子平衡:Ksp常数及相关计算;溶度积规则及应用。
3、电化学原理、标准电极电位及应用(1)原电池:原电池、电极和电池的符号表示;电极的种类及应用。
(2)电极电势:电极电势的产生;标准电极电势。
(3)电极电势的应用:判断氧化剂的相对强弱;氧化还原反应的方向;能斯特方程式;氧化还原反应进行的程度;元素电势图。
4、原子结构与分子结构(1)微观粒子的运动特性:波、粒二相性;氢光谱、波尔原子模型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2015年专升本考试《基础化学》考试大纲
一、考试内容
(一)无机部分
1、化学基础知识
掌握理想气体状态方程,混合气体的分压、分体积定律,液体的蒸发和沸点,溶液浓度的表示方法,非电解质稀溶液的依数性;了解实际气体的van der Waals 方程。
2、化学热力学基础
掌握热力学基本概念,热力学第一定律,化学反应的热效应,盖斯定律,生成热与燃烧热,从键能估算反应热,状态函数熵和吉布斯自由能及其应用;了解可逆途径,化学反应方向概念。
3、化学反应速率
掌握反应速率方程,浓度对化学反应速率的影响及相关计算,温度对化学反应速率的影响及相关计算,催化剂对化学反应速率的影响;了解反应速率理论。
4、化学平衡
了解化学反应的可逆性和化学平衡;掌握化学平衡常数,标准平衡常数Kθ与△rGmθ的关系,化学平衡移动的影响因素。
5、原子结构与元素周期律
了解氢原子光谱和玻尔理论;掌握微观粒子的波粒二象性,几率密度和电子云,波函数的空间图象,四个量子数,多电子原子的能级,核外电子排布的原则及其与元素周期表的关系,元素基本性质的周期性。
6、化学键理论概述
掌握离子键的形成与特点,离子的特征,离子晶体,晶格能,共价键的本质、原理和特点,杂化轨道理论,价层电子对互斥理论,分子轨道理论,键参数与分子的性质,极性分子和非极性分子,分子间作用力,离子的极化,氢键;一般了解金属键的共性改价理论和能带理论;了解金属晶体。
7、酸碱解离平衡
掌握一元弱酸(碱)、多元弱酸(碱)氢(氢氧根)离子浓度的计算,同离
子效应及缓冲溶液相关计算;了解盐的水解相关计算;一般了解电解质理论及酸碱理论的发展。
8、沉淀溶解平衡
掌握沉淀溶解平衡中溶度积常数和溶解度的关系,溶度积规则及相关计算。
9、氧化还原反应
掌握氧化还原反应的基本概念,氧化还原反应方程式的配平,原电池及其符号书写,标准电极电势的意义及应用,能斯特方程及元素电势图的相关计算。
10、配位化学基础
掌握配合物的基本概念,中心原子和配体对配合物稳定性的影响,配位平衡及其相关的计算,了解配合物的价键理论和晶体场理论。
11、碱金属和碱土金属
了解碱金属和碱土金属的通性;掌握碱金属和碱土金属单质及其化合物的性质。
12、硼族元素
了解硼族元素的通性;掌握硼、铝单质及其化合的性质,惰性电子对效应和周期表中的斜线关系。
13、碳族元素
了解碳族元素的通性;掌握碳、硅元素的单质及其化合物的性质;了解锗、锡、铅单质及其化合物的性质。
14、氮族元素
了解氮族元素的通性;掌握氮及其化合物,磷及其化合物性质,砷、锑、铋及其化合物的性质。
15、氧族元素
掌握氧族元素的通性,氧,臭氧,水,过氧化氢,硫及其化合物的性质;一般了解硒、碲及其化合物的性质。
16、卤素
掌握卤素的通性,掌握卤素单质及其氢化物、含氧酸的氧化还原性。
(二)有机部分
1、有机化合物命名、顺反及对映异构体的命名、个别重要化合物的俗名和英文缩写。
2、主要官能团(烯键、炔键、卤素、硝基、羟基、醛基、酮羰基、氰基等)的化学性质及它们之间相互转换的规律。
3、烷烃、脂环烃、烯烃、炔烃、卤代烃、芳烃、酚、醇、醚、醛、酮等简单化合物的制备、鉴定、物理性质、化学性质及在合成中的应用。
4、常见有机化合物的波谱(红外、核磁)。
5、饱和碳原子的自由基取代,亲核取代、芳环上的亲电取代,消除反应,氧化反应,还原反应,缩合反应的历程及在有机合成中的应用。
6、碳正离子、碳负离子、自由基的生成与稳定性及其有关反应的规律。
二、考试的题型及分值
1、单项选择题20分左右
2、命名题10分左右
3、完成反应方程式20分左右
4、简答题40分左右
5、鉴别题20分左右
6、推导题20分左右
7、计算题20分左右
三、考试形式及时间
“基础化学”考试形式为笔试。
考试时间为2.5小时。
四、主要参考书目
1、《无机化学》(第4版).天津大学无机化学教研室主编. 高等教育出版社. 2010年。
2、《有机化学(上册)》(第五版),李景宁等主编,高等教育出版社出版,2011年。
应用化学专升本只招20人
招生范围:化学化工类专科、食品营养与检测类专科、药学类专科。
