中南大学物理化学A下册
中南大学物理化学考试试卷2012-2013年

C. 微多相;
D. 动力学稳定。
9、实际电解过程中,在阴极上首先发生还原反应而放电的是(
)。
A. 标准电极电势最大者;
B. 标准电极电势最小者;
C. 不可逆电极电势最小者;
D. 不可逆电极电势最大者。
10、在一定的 T, p 下,将一个大的水滴分散为很多小水滴,基本不变的性质为(
)。
A. 表面张力;
B. 强电解质;
适用于(
)。
C. 无限稀溶液;
D. 强电解质稀溶液。
5、根据下图指出原电池正极的极化曲线是(
)。
A. 曲线 1;
B. 曲线 2;
C.曲线 3;
D.曲线 4。
6、原电池 Ag(s) | AgCl(s) | HCl( a) | Cl 2(g, p) | Pt 的电池反应可写成以下两种形式:
。
4、(4 分)合成氨反应在一定温度和压力下,平衡转化率为
25%。现在加入一种高效催化剂
后,反应速率增加了 3 倍,则其平衡转化率提高
倍,此时平衡转化率为
%。
5、( 2 分)表面超量 Γ是指:单位面积的表面层中所含溶质的物质的量与具有相同质量溶剂
的本体溶液中所含溶质的物质的量之差, 当 dσ/da < 0 时,Γ> 0,此时发生的是
1
⑴ Ag(s) + Cl 2(g) === AgCl(s)
2
ΔrG m⑴
⑵ 2Ag(s) + Cl 2(g) === 2AgCl(s)
ΔrGm⑵
ΔrGm⑴与 ΔrGm⑵的关系是(
A. ΔrGm⑴ = 1 ΔrGm⑵; 2
C. ΔrGm⑴ = ΔrGm⑵;
)。 B. ΔrGm⑴ = 2ΔrGm⑵; D. 说不清楚。
物理化学(下)-春季考试模拟真题-1

) ,最小的是(
)
(B) 0.01 mol· kg CaCl2 (D) 0.001 mol· kg KCl
-1
5. 恒温恒压下可逆电池放电过程 (A)ΔH = Q (C)ΔH > Q (B)ΔH < Q (D)ΔH与Q大小关系不确定
(
)
6.二级反应速率常数的单位是 (A)s-1 (B)dm6· s-1· mol-2 (C)s-1· mol-1
-
tCl-(NaCl)。 (填“>” 、 “<”或“=” ) 。 0。 (填
8. 对表面活性剂的水溶液,其表面张力比纯水的表面张力 活性剂在表面层中的浓度比其在本体中的浓度
(高或低) 。
9. 以活性炭吸附CHCl3气体,0℃时的最大单层吸附量为93.8dm3· kg-1。已知该温度 kg-1,则兰缪尔吸附 下,当CHCl3气体分压为1.34×104Pa时的平衡吸附量为82.5dm3· 等温式中的吸附平衡常数 b = 。
10. 实验测得 NaCl 、 Na2SO4 和 Na3PO4 三种电解质溶液对某溶胶的聚沉值分别为 0.512 mol· dm-3、4.31×10-3 mol· dm-3和8.91×10-4 mol· dm-3,说明该胶体带 电。
三、 (本题 15 分)乙酸乙酯与氢氧化钠皂化反应的速率常数在 282.55 K 时为 2.37(mol· L-1)-1· s-1;287.55 K 时增至 6.024(mol· L-1)-1· s-1。 求:(1) 反应的活化能 Ea 及频率因子 A; (2) 利用一上两个温度的数据求范特霍夫公式中的温度系数 γ; (3) 设乙酸乙酯和氢氧化钠的初始浓度均为 0.001mol· L-1, 反应在 298.15 K 下的 半衰期。
中南大学物化课后习题标准答案-9--章-可逆原电池

第9章可逆原电池1 •写出下列原电池中各电极反应、电池反应及E旳计算公式.②Pt,H 2(101325Pa) | KOH@) I Q(101325Pa),Pt④I :I :l ・」:-:解:⑴负极Pb(s)+「(a-;J —PbSQ4(s)+2e............................................... .正极Cu2+(-丄'')+ 2e —Cu(s)2+电池反应Pb(s)+SQ4(aEM) + Cu (a C2+) ==== PbSO4(s)+Cu(s)⑵负极比(p® ) -2e —2H+ (a H+)正极Q( p® ) + H 2O +2e —2OH -(a OH -).. ........ — ..... —.... ......... .... ... 电池反应H2(p®) + O(l)O2( P®) —H2(3)负极3H2( P H2)- 6e —6H+(aq)正极Sb2Q(s) + 6e + 6H +(aq) —2Sb(s) +3H 20(1)............................................... 电池反应Sb2O3 +3H2 ( P H2)—2Sb(s) + 3H 20(1)⑷负极Ag(s) + I -(a i-) —AgI(s) + e_______________________________________________ 正极AgCI(s) + e —Ag(s) + Cl ( a ci-)电池反应Agl(s) + I -(a i-) —Ag(s) + Cl - ( a。
-)2. iJ:将下勿化学反应陵计成目电池(1) Zn(s) + H 2SQ(a": ===ZnSO4( ◎) + H2( P H2)(2) Ni(s) + H 2Q ==== NiQ(s) + H 2( P H2)(3) H2 (P H2) + Q( P Q2)= :===H 2OQ);(4)H2(P H2)+ HgQ(s)== ==Hg(l) + H 20(1)( 1)负极Zn (s) -2e2+ —Zn正极2H+( a i) + 2e —H2(P H2)----------------------------------------------- 电池反应Zn(s) +2H +(a i) ====Zn2+(a2)+ H 2( P H2)电池符号Zn(s) | ZnSO 4( a?) || H 2SO( a) | H 2( p H》,Pt(2) 负极Ni(s) + 20H -—NiO(s) + H 2O +2e正极2H2O + 2e —H2(P H2)+20H -.............................................. .电极反应Ni(s) + H 20 ==== NiO(s) + H 2伽)电池符号Ni(s),NiO(s) | KOH( 稀)| H 2(P H2), Pt(3) 负极H2(P H2) + 2OH -—2H2O + 2e正极2H2O +2e —2OH- + Q(p°2).............................................. 电池反应H 2( P H2)+ Q( P O2) ==== H2OQ)电池符号Pt,H 2伽)| NaOH(稀)| O 2(p°2>,Pt(4) 负极H2(P H2) + 2OH -—2HO +2e正极HgO(s) + H 2O +2e —Hg(l) +2OH ----------------------------------------------- 电池反应H2(P H2)+ HgO(s) ==== Hg(l) + H 2。
中南大学物化考试卷3

中南大学考试试卷03一、单选题(每题2分,共24分)1. 1 mol 理想气体,从始态(p,V,T ) 出发,分别进行⑴恒温可逆膨胀和⑵绝热可逆膨胀过程,若两过程所达到的末态体积相同,则两过程体积功的关系是()(A)| W⑴| = | W⑵| (B)| W⑴| > | W⑵| (C)| W⑴| < | W⑵| (D)无法确定2. 在T 和pΘ下,C (石墨) + O2(g) === CO2(g) 的反应热为△r H mΘ(T)。
下列说法中不正确的是()(A)△r H mΘ(T)是CO2(g) 在温度T 下的标准生成焓(B)△r H mΘ(T) = △r U mΘ(T) (C)△r H mΘ(T)是C (石墨) 在温度T 下的标准燃烧焓(D)△r H mΘ(T) > △r U mΘ(T) 3. 在确定的T 、p下,无论用什么手段进行一个A + B === C 的反应,若反应的△r H m > 0,则该反应的反应热()(A)大于零(B)小于零(C)视反应手段而定(D)等于零4. 某单组分体系的V m(l) > V m(s),当体系的压力升高时,其熔点将()(A)升高(B)降低(C)不变(D)不确定5. 使用热力学判据△G T,p,W’=0 < 0 判别某过程方向时,下标p 所表示的是()(A)体系中每一组分的分压(B)体系的总压(C)外压(D)标压pΘ6.下列针对偏摩尔量的描述,不正确的是( ) (A)偏摩尔量是体系某种容量性质的一种偏微分(B)偏摩尔量是体系的强度性质,状态函数(C)体系的偏摩尔量可正、可负、亦可为零(D)体系中某组分的偏摩尔Gibbs自由能就是该组分的化学势7. 恒温恒压下由纯组分形成理想溶液,下列各量中为零的是()(A)Δmix G(B)Δmix S(C)Δmix H(D)Δmix A8. 关于溶液中某组分的活度及活度系数,不正确的是()(A)活度相当于是校正浓度,但无量纲(B)活度及活度系数的大小与参考态的选择有关(C)理想溶液中各组分的活度系数皆为1(D)活度及活度系数的大小与标准态的选择有关9. 化学反应等温式△r G m = △r G mΘ + RT ln J a,当选取不同标准态时,反应的△r G mΘ将改变,该反应的△r G m和J a将()(A)都随之改变(B)都不改变(C)J a变,△r G m不变(D)J a不变,△r G m变10. 在等温等压下,当反应的△r G mΘ= 5kJ·mol-1时,该反应能否()(A)能正向自发进行(B)能逆向自发进行(C)不能判断(D)不能进行11. 通常条件下的二组分体系中,最多共存的相有()(A)3相(B)4相(C)5相(D)6相12. CuSO4与水可生成CuSO4·H2O,CuSO4·3H2O 和CuSO4·5H2O三种水合物,在一定压力下与CuSO4水溶液和冰共存的含水盐有()(A)3种(B)2种(C)1种(D)0种二、填空题(每空1分,共16分)1. 某理想气体一从始态出发,分别进行绝热可逆膨胀和绝热不可逆膨胀,若两过程所达到的末态压力相同,则末态温度T可逆T不可逆,而体系的焓变ΔH可逆ΔH不可逆。
2020-2021学年中南大学一年级下学期《物理化学》测试卷附答案

2020-2021学年中南大学一年级下学期《物理化学》测试卷一、选择题(每小题2分,共20分)1. 当理想气体反抗一定的外压作绝热膨胀时,则体系的()(A)焓恒定不变(B)热力学一定增加(C)焓一定增加(D)热力学一定减小2. 对于只做膨胀功的封闭体系,其(ðAðT)V的量值()(A)大于零(B)小于零(C)等于零(D)无法确定3. 某物质溶于互不相溶的两液态溶剂α和β之中,该物质在溶剂α之中以A的形式存在,在溶剂β之中以A2的形式存在,。
则在一定温度、压力下两液相达到平衡时化学势满足()(A)μα(A) = μβ(A2) (B)μα(A) = 2μβ(A2) (C)2μα(A) =μβ(A2) (D)无法确定4. 理想溶液的混合热力学性质是()(A)△mix V = 0, △mix H = 0, △mix S > 0, △mix G < 0(B)△mix V < 0, △mix H < 0, △mix S < 0, △mix G = 0(C)△mix V > 0, △mix H > 0, △mix S = 0, △mix G = 0(D)△mix V > 0, △mix H > 0, △mix S < 0, △mix G > 05. 将20克CaCO3(s)和60克CaCO3(s)分别放入抽真空、同容积的A容器和B容器中,且与同一定温热源相接触,达到化学平衡时CaCO3(s)部分分解成CaO(s)和CO2(g),若忽略固体体积,则两容器中CaCO3(s)的分解量为()(A)A容器中的多(B)B容器中的多(C)一样多(D)无法确定6. 在刚性密闭容器中,理想气体反应A(g) + B(g) === Y(g)达到平衡,若在定温下加入一定量的惰性气体,平衡()(A)正向移动(B)逆正向移动(C)不移动(D)无法确定7. 某反应A —→Y,如果反应物A 的浓度减少一半,它的半衰期也缩短一半,则该反应的级数为()(A)零级(B)一级(C)二级(D)三级8. 催化剂的中毒是指催化剂()(A)对生物体有毒(B)活性减小(C)选择性消失(D)活性或选择性减小或消失9. 不同运动状态的能级间隔不同,对于某一分子而言,其平动(t)、转动(r)和振动(v)的能级间隔大小顺序为()(A)△εv > △εt > △εr(B)△εv > △εr > △εt(C)△εt > △εv > △εr(D)△εr > △εt > △εv10. 某配离子的配位数为n,则其各级稳定常数K稳,i与各级不稳定常数为K不稳,i之间的关系为()(A)K稳,i =( K不稳,n-i+1)-1(B)K稳,i = K不稳,i(C)K稳,i =( K不稳,n)-1(D)K稳,i = K不稳,i二、填空题(每小题2分,共20分)1. 焦耳-汤姆逊系数的定义式μ=;当μ > 0时,表示经节流膨胀后体系温度节流膨胀前体系温度(填高于、低于或等于)。
中南大学物化课后习题答案 1,2章 化学热力学基本定律与函数

第4章化学热力学基本定律与函数(1)恒温可逆相变与向真空蒸发(不可逆相变)的终态相同,故两种变化途径的状态函数变化相等,即0=′∆=∆GG KJKJmolmolHH75.3075.3011=×=′∆=∆− KmolJTHSS3531075.3013−⋅×=′∆=′∆=∆ 1111.87−−⋅⋅=KmolJ nRTHVPHuu−′∆=∆−′∆=′∆=∆ )353314.81(75.3011KmolKjmolkJ×⋅×−=−−kJ82.27= 131011.8735382.27−−⋅××−=∆−∆=∆KkJKkJSTuA kJ93.2−= ∵向真空蒸发0=外P ∴W=0 由WQu+=∆ ∴kJuQ82.27=∆= (2)由(1)的计算结果可知,WAT<∆,∴过程不可逆1.1mol双原子理想气体在300 K、101 kPa下,经恒外压恒温压缩至平衡态,并从此状态下恒容升温至370 K、压强为1 010 kPa。
求整个过程的、、及。
(答案:△U = 1455 J,△H = 2037 J,W=17727 J,Q = -16272 J)解:第一步:恒外压恒温压缩至平衡态,=0,=0此平衡态的体积就是末态的体积V2,此平衡态的压强W= -p’(V2-V1) = -818.92×103×(3.046-24.695)×10-3 =17727 J = 17.727 kJ-Q = W =17.727 kJ Q = -17.727 kJ第一步:因恒容W = 0= Q V = C V,m(T2-T1) = 20.79×(370 -300) =1455.3 J=1.455 kJ= (20.79 + R)×70 =2037.3 J =2 .037 kJ整个过程:W =17.727 kJ;Q = -17.727+1.455 = -16.27 kJ;=1.455 kJ ;=2.037 kJ。
中南大学考试化学试卷及答案

中南大学考试化学试卷及答案2019学年 一 学期期末考试试题 时间110分钟 工科大学化学 课程 42 学时 2.5 学分 考试形式: 闭 卷 专业班级:冶金07-环境07 姓名 学号 卷面总分100分,占总评成绩 70 %, 卷面得分物理化学部分(共55分)一、 填空题(共20分)1. 热力学第一定律的数学表达式为 。
2. 无水CuSO 4溶解时放热66.107 kJ ·mol -1,而CuSO 4·5H 2O 溶解时吸热11.506 kJ ·mol –1。
则反应CuSO 4 +5H 2O === CuSO 4·5H 2O 的热效应△r H m = kJ ·mol –1。
3. 1mol 理想气体经绝热可逆膨胀由始态达到末态,体系的△S = 。
4. A 与B 形成溶液,在某温度下,纯A 的饱和蒸气压为29.57kPa ,当溶液的组成为x B = 0.713时,对应的蒸气压为29.39kPa ,且蒸气的组成为y B = 0.818,则该温度下溶液中A 组元的活度a A = ;活度系数γA = 。
5. H 2与O 2气体在298K 下恒容容器中反应生成298K 的水:Q 0,W 0,∆U 0,∆H 06. 稀溶液的依数性有 、 、 和 。
7. 理想气体从同一始态出发,分别进行恒温可逆膨胀和绝热可逆膨胀到达相同体积的末态,则两过程体系作功量的大小是W 恒温 W 绝热。
8. 若某化学反应的△r H m > 0,△r S m > 0,且△C p = 0,当 Tm r m r S H ∆∆时,反应将自动进行。
9. 某晶体在0K 时残余熵为9.13 J·K -1·mol -1,则该晶体中,分子有 种可能的空间取向.10. 在恒温抽空的玻璃罩中封入二杯液面高度相同的糖水(1)和纯水(2)。
经历若干时间后,二杯液面的高度将是:( )(A )1杯高于2杯; (B )1杯等于2杯; (C )1杯低于2杯; (D )视温度而定。
新物理化学下学期期末考试试卷A卷及其答案详解

新乡学院2009―2010学年度第一学期《物理化学》期末试卷A 卷课程归属部门:化学与化工学院 试卷适用范围: 级化学工程与工艺 班.吉布斯吸附等温式( ),若一溶质加入纯水中后使表面张力降低,则该溶质在溶液表面发生( 正 )吸附。
.不论是电解池或是原电池,极化的结果都是使阳极电势( 更高),阴极电势(更低 )。
. 的 水溶液,若,则平均离子活度。
.常见的亚稳态有四种,它们分别是(过冷液体),(过热液体 ),(过饱和蒸气),( 过饱和溶液 )。
.在下图中画出和。
.振动配分函数计算公式引入的kh Vν=Θ 的量纲为( 或者温度 )。
.由玻尔兹曼公式可知,任意两个能级的玻兹曼因子之比,等于(该两能级分配的粒子数之比 )。
合成氨反应 ( ) ( )→ ( )若反应在恒容条件下进行时,则其反应速率可表示为Υ ( 2H dc dt-; )或Υ (3NH dc dt),两者之间的关系为( 2H dc dt-:3NH dc dt: )。
碰撞理论的临界能C E 与Arrhenius 活化能a E 的关系为( a E C E 12RT ) 在( )的条件下,可以认为a E 与温度无关。
憎液溶胶在热力学上是不稳定的,它能相对稳定存在的原因是( 胶体粒子带电 );( 溶剂化作用)和( 布朗运动)。
.原电池在恒温、恒压可逆放电, 与 的大小关系为 ( ) 。
> < 无法判断.下列原电池中,其电池电动势与氯离子的活度无关的是( ).一定体积的水,当聚成一个大水球或分散成许多水滴时,相同温度下,两种状态相比,以下性质保持不变的是( )表面吉布斯函数 表面张力 比表面 液面下的附加压力.玻尔兹曼分布,只适用于定域子系统; 只适用于离域子系统; 只适用于独立子系统; 只适用于相依子系统。
.酸碱催化的主要特征是( )反应中有酸的存在 反应中有碱的存在一、填空题(每小题 分,共分)二、选择题(每题 分,共 分)院系班级姓名学号Γ=-反应中有电解质存在 反应中有质子的转移某反应,当反应物反应掉 / 所需时间是它反应掉 / 所需时间的 倍时,该反应是( )一级反应 二级反应 三级反应 零级反应反应 1k−−→ ① 2k−−→ ② 。
物理化学教案(下册).

化学与环境科学系—————《物理化学》精品课程系列资料《物理化学》教案院(系、部)化学与环境科学系教研室分析化学-物理化学教研室课程名称物理化学授课对象化学本科,××班授课时间~学年第学期授课地点主讲教师教师职称使用教材南大《物理化学》第五版(下)一、课程名称物理化学二、课程性质专业基础课三、课程说明《物理化学》课程是师范类学校化学专业的重要专业基础课之一,内容上分为化学热力学、电化学、化学动力学、界面现象以及胶体与大分子溶液五大部分,按热力学第一定律、热力学第二定律、溶液、相平衡、化学平衡、电解质溶液、可逆电池、电极与极化、化学动力学基础、界面现象以及胶体分散系和大分子溶液的顺序组成一个完整的理论体系。
每章包括基本概念、基本理论、例题和习题训练。
本教案仅作为物理化学理论课讲授和实习课的指导性参考资料。
本着培养合格药学生的目的,依照教学大纲的要求,要求在教学过程中,不仅要注重传授知识,更要注重培养学生综合分析问题、解决问题及创新思维的能力。
四、先修课程无机化学、有机化学、分析化学、普通物理学、高等数学。
五、对教师的要求1、教师必需认真地备课。
写出讲稿和教案。
熟悉无机化学、有机化学、分析化学、普通物理学和高等数学等课程的知识,以便在教学过程中做到心中有数。
2、教师必需研究和学习教学法,在教学过程中,充分调动学生的学习积极性和主动性,正确引导学生的思路,教学生如何学习,激发其求知欲望,培养学生的自学能力。
3、在教学过程中,教师应注重学生能力的培养、创新意识的培养,同时还要注重学生思想品德的培养,既注重教书,又注重育人。
六、选用教材(1)高等学校教材,《物理化学》,南京大学物理化学教研室傅献彩主编,高等教育出版社,2005年7月,第五版(2)在以上教材基础上自制的电子教案七、教学内容本课程主要讲述热力学第一定律、热力学第二定律、溶液、相平衡、化学平衡、电解质溶液、可逆电池、电极与极化、化学动力学基础(一)、化学动力学基础(二)以及界面现象等内容。
中南大学物理化学A2012(下册)

中南大学考试试卷2011 -- 2012学年下学期时间110分钟(2012.5.6)物理化学课程32学时2学分考试形式:闭卷专业年级:化工、应化、制药、粉体、材化等 2010级总分100分,占总评成绩 70 %注:此页不作答题纸,请将答案写在答题纸上一、单选题(每题2分,共26分)1. 实验测得某二级反应速率常数,正确的是()(A)k=5.0s-1(B)k=5.0 dm6·s-1·mol-2(C)k=5.0 s-1·mol-1(D)k=5.0 dm3·s-1·mol-12. 加催化剂可使化学反应的下列物理量中哪个改变()(A)反应热(B) 平衡常数(C) 反应熵变(D) 速率常数3. 对下列电解质溶液,其中摩尔电导率最大的是()(A) 0.001 mol·kg-1 KCl (B) 0.001 mol·kg-1 KOH(C) 0.001 mol·kg-1 HCl (D) 0.1 mol·kg-1 KCl4. 浓度为0.1mol·kg-1的MgCl2水溶液,其离子强度为( )(A) 0.1mol·kg-1(B) 0.15mol·kg-1(C) 0.2mol·kg-1,(D) 0.3mol·kg-1。
5. 对下列电解质溶液,其中平均活度系数最大的是()(A)0.01 mol·kg-1KCl (B)0.01 mol·kg-1CaCl2(C)0.01 mol·kg-1LaCl3(D)0.001 mol·kg-1KCl6. 用补偿法测定可逆电池的电动势时,是为了( )(A) 消除电极上的副反应;(B) 减小标准电池的损耗;(C) 在可逆情况下测定电池的电动势;(D) 简便易行。
7. 恒温恒压下可逆电池放电过程()(A)ΔH = Q(B)ΔH <Q (C)ΔH > Q (D)ΔH 、Q关系不确定8. 某电池反应为2Hg(l) + O2 + H2O → 2Hg2+ + OH -,当电池反应达到平衡时,电池的电动势E必然为( )(A) E > 0 (B) E = EΘ(C) E < 0 (D) E = 09. 电解金属盐的水溶液时,在阴极上()(A)还原电势愈正的离子愈容易析出(B)还原电势与其超电势的代数和愈正的离子愈容易析出(C)还原电势愈负的离子愈容易析出(D)还原电势与其超电势的代数和愈负的离子愈容易析出10. 将某毛细管垂直插入水中,使毛细管露出水面的长度为8cm,此时毛细管内水面上升了5cm;若将毛细管向下移动,使毛细管露出水面的长度为3cm,则此时毛细管上端口水面的状况是()(A)水从毛细管上端溢出(B)毛细管上端水面呈凸形弯月面(C)毛细管上端水面呈凹形弯月面(D)毛细管上端水面呈水平面11. 对于物理吸附的描述中,哪一条是不正确的()(A)吸附力来源于范徳华力,其吸附一般不具有选择性(B)吸附层可以是单分子层或多分子层(C)吸附热较小(D)吸附速率较小12. 在稀的砷酸溶液中通入H2S制备硫化砷溶胶(As2S3),该溶胶的稳定剂是H2S,则其胶团结构式是()(A)[(As2S3)m·nH+,(n-x)HS-]x+ ·xHS-(B)[(As2S3)m·nHS-,(n-x)H+]x- ·xH+(C)[(As2S3)m·nH+,(n-x)HS-]x- ·xHS-(D)[(As2S3)m·nHS-,(n-x)H+]x+ ·xH+13. 对水溶液中的下列反应,加入惰性电解质能增加反应速率的是()(A)S2O82- + 3I-→I3- +2SO42-(B)H2O2 +2H+ +2Br-→2H2O +Br2(C)蔗糖+OH-→葡萄糖+果糖(D)2H2O2→2H2O +O2↑二、填空题(共18分)1.(2分)某物质分解反应的速率常数k=4.62×10-2s-1,则该物质反应掉3/4所需要的时间为。
中南大学物理化学考试试卷 和答案

中南大学研究生考试试卷2009—2010学年二学期期末考试试题时间110分钟界面化学课程32 学时2.0 学分考试形式:开卷专业班级:矿物加工工工程姓名学号095611057卷面总分100分,占总评成绩70 %,卷面得分一、选择题(每小题2分,共26分)1.液体表面最基本的特性是( A )A.倾向于收缩B.倾向于铺展C.形成单分子吸附层2.若将液体与毛细管壁间的接触角近似看作0°,则液体在毛细管中的液面可以看作(C)A.凹型B.凸型C.球面3.下列方程均为计算液a/液b界面张力γab的经验公式,其中Fowkes公式为( C )A.γab =γa -γbB.γab =γa + γb -2(γaγb)1/2C.γab =γa + γb -2(γa dγb d)1/24.吊片法测定液体表面张力时,要求尽可能采用表面粗糙的吊片材料,其目的是( A )A.改善液体对吊片的润湿使θ接近于0°B. 改善液体对吊片的润湿使θ接近于90°C.改善液体对吊片的润湿使θ接近于180°5.溶液中溶剂记为1、溶质记为2,则吸附量Γ2(1)的含义为(C)A.单位面积表面相与含有相等总分子数的溶液相比较,溶质的过剩量B.单位面积表面相与含有等量溶质的溶液相比较,溶剂的过剩量C.单位面积表面相与含有等量溶剂的溶液相比较,溶质的过剩量6.C12H25SO4Na(1)、C14H29SO4Na(2)、C16H33SO4Na(3)三种物质在水表面吸附达到饱和状态时,三种物质分子在表面所占面积a m存在下列关系( B )A. a m,1> a m,2> a m,3B. a m,1≈a m,2≈a m,3C. a m,1< a m,2< a m,37.苯在水面上先迅速展开后又自动收缩成为小液滴漂浮在水面上,用于描述苯液滴形状的表化专业术语是( C )A.二维液膜B.多分子层C.透镜8.下列说法中不正确的是( B)A.任何液面都存在表面张力B.平面液体没有附加压力C.弯曲液面的表面张力方向合力指向曲率中心D.弯曲液面的附加压力指向曲率中心9.运用过滤手段进行溶胶净化的目的是( C)A.除掉反应过程中过量的副产物B.除掉过量的电解质C.除掉溶胶体系中的粗离子10.溶液中胶体离子表面的热力学电位是指下列哪个电学参数( A )A.φ0B. φsC. ξ11.造成接触角滞后的主要原因是( C )A.测量方法B.实验者过失C.表面不均匀和表面不平整12.固体自稀溶液中吸附等温线可分为4类18种,对于具有L 型吸附等温线的吸附过程的特征,下列说法正确的是( C )A.溶液有强烈的吸附竞争,且溶质分子以单一端基近似垂直吸附于固体表面B.溶质与固体表面具有高亲和力,有类似与化学吸附特征的强烈吸附行为ngmuir 型,溶质比溶剂易于吸附,吸附时溶质分子多以其长轴或平面平行于固体表面13.对于胶体体系下列说法正确的是( B )A.电解质引发胶体体系聚沉的主要原因是使扩散层变厚B.低浓度的聚合物可以使胶体体系发生聚沉,而高浓度的聚合物却可以使胶体体系稳定C.胶体体系属于热力学多相体系,由于界面自由能显著,所以无论采取何种措施都不可能获得相对稳定的胶体溶液二、填空题(每小题2分,共22分)1. 液-固润湿过程有__沾湿过程_,__浸湿过程 , 铺展过程_.2. 固体自溶液中吸附时,极性吸附剂易于从非极性溶液中吸附_极性_物质,而非极性吸附剂易于从极性溶液中吸附 非极性物质。
中南大学物化考试卷及答案 4套

ΔvapHm=ΔsubHm-ΔfusHm= 17 580 J·mol-1
-ΔvapHm/RT + B = -3116 K/T + 27.537
B = 22.922
所以液体 CO2 的蒸气压与温度的经验关系为:
ln(p/Pa) = -ΔvapHm/RT + 22.922 = -2115 K/T + 22.922
0, W
0, Δ
U
0 ,ΔH
0,
2. 1mol 25℃的液体苯在弹式量热计中完全燃烧,放热 3264KJ,则反应
Kp =(x NH3 p)2/(x H2 p)3(x N2 p)= 6.818×10-8 kPa2 解得 p = 1115 kPa
(2 分)
(1 分) (2 分)
(2 分)
(3 分)
6
中南大学考试试卷 02
一、填空题(每小题 3 分,共 45 分)
1. 273.15K,101.325KPa 下,固体冰融化为水,其过程的 Q
15. [答] (C)
二、填空题 ( 共 5 题 9 分 )
16. [答] Q=W=nRTln(V2/V1),n=2 mol
17. [答] 吉布斯自由能
18. [答] f = 3
19. [答] xB(g) > xB(总) > xB(l)
xB= 0.6 恒沸混合物
20. [答] T; T, p
三、计算题 ( 共 5 题 60 分 )
3. N2(g),O2(g) 体系中加入一种固体催化剂,可生成几种气态氮的氧化物,则体系的自由
度为
。
4.完全互溶的二组分溶液,在 xB= 0.6 处平衡蒸气压有最高值,那么组成 xB=0.4 的溶液在 气-液平衡时,xB(g),xB(l),xB(总)的大小顺序为________________ 。将 xB=0.4 的溶液进 行精镏,塔顶将得到 ___________ 。
中南大学大学物理(下)试卷7套
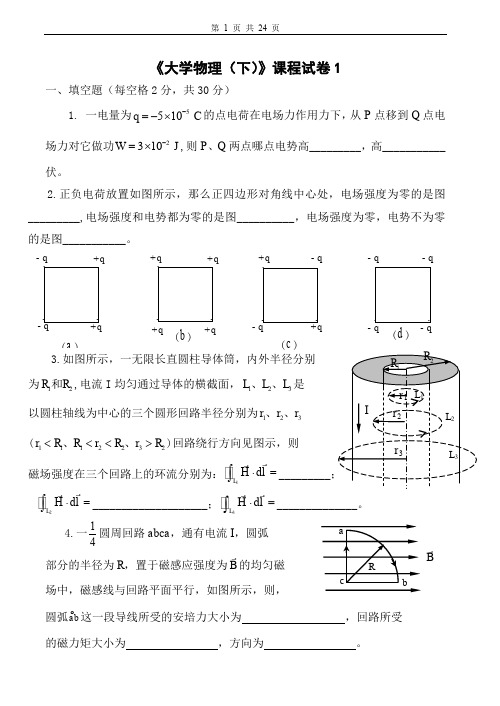
中保持 a = 60o 角不变,C 点与两直导线分别相距 a 和 2a ( a = 0.1m )问:金属杆
CD 中的感应电动势为多大?杆的哪端电势较高?(10 分)
D
V
I
I
L
C
a
a
第 8 页 共 24 页
5.如果用能量为 12.6 eV 的电子轰击氢原子, 将产生哪些波长的光谱线? (10 分)
f 4
(B)
f 8
3 f 8
(D)
f 16
A
a
2.如图所示,一个带电量为 q 的正点电荷位于正方体 的 A 角上,则通过侧面 abcd 的电场强度的通量为( q q q q (A) (B) (C) (D) 6 0 48 0 12 0 24 0 )
d
c
3.如图所示,I1 和 I2 为真空中的稳恒电流,L 为一闭合回
A1
e
I
e
O
B1
A
2 0 I 2R
(B)
0 I
R
(C)
0 I
2R
(D) 0 )
4.关于同时性有人提出以下结论,其中正确的是(
(A)在一惯性系同时发生的两个事件,在另一惯性系一定不同时发生 (B)在一惯性系不同地点同时发生的两个事件,在另一惯性系一定同时发生 (C)在一惯性系同一地点同时发生的两个事件,在另一惯性系一定同时发生 (D)在一惯性系不同地点不同时发生的两个事件,在另一惯性系一定不同时 发生
三、計算題(5 题共 52 分)
)
n1 n2 n3
1.如图所示,半径为 R1 = 0.01m 的金属球,带电量 Q1 11010 c ,球外套一内 外半径分别 R2 3 102 m 和 R3 4 102 m 的同心金属球壳,壳上带电 Q2 111010 c , 求:(1)金属球和金属球壳的电势差;(2)若用导线把球和球壳联接在一起,这时 球和球壳的电势各为多少?(12 分)
《工科大学化学-下册》【中南大学】课后答案

中南大学物理化学中南大学物理化学下下册课后答案第四章化学动力学习题1.以氨的分解反应2NH 3====N 2+3H 2为例,导出反应进度的增加速率t d d ξ与tn d d 3NH ,tn d d 2N ,tn d d 2H 之间的关系,并说明何者用于反应速率时与选择哪种物质为准无关。
解:312,H H 0,N N 0,NH NH 222233n n n n n n −=−=−−=ξtn t n t n t d d d d 31d d 21d d 223N H NH =⋅=⋅−=ξ∴ttn d d 2d d 3NH ξ×=−,t tn d d 3d d 2H ξ×=,tt n d d d d 2N ξ=2.甲醇的合成反应如下:CO +2H2=====CH 3OH已知1-1OH CH h L mol 44.2d /d 3−⋅⋅=t c ,求t c d /d -CO ,t c d /d -2H 各为多少?(答案:2.44,4.88mol ·dm -3·h -1)解:1-1-OH CH CO h L mol 44.2d d d d -3⋅⋅==t c t c ,1-1-OH CH H h L mol 88.4d d 2d d -32⋅⋅=×=tc t c 3.下列复杂反应由所示若干简单反应组成,试根据质量作用定律写出以各物质为准的速率方程式。
(1)(3)解:(1)A 4A 1Ad d c k c k t c +=−,C 3G 2A 1Gd d c k c k c k tc +−=2DA 4Dd d c k tc =,C 3G 2Cd d c k c k tc −=(2)D 2A 1Ad d c k c k tc −=−D C 3D 2A 1Dd d c c k c k c k tc −−=D C 3Cd d c c k tc =−D C 3Gd d c c k tc =(3)22A 1ADd d c k c k tc −=−)(2d d 22A 1DDc k c k tc −=(4)C A 3D 22A 1A )(2d d c c k c k c k tc −−=−D 22A 1D d d c k c k tc −=A C 3Cd d c c k tc =−A C 3Gd d c c k tc =4.理想气体反应2N 2O 5→4NO 2+O 2,在298.15K 的速率常数k 是1.73×10-5s-1,速率方程为 52O N kc r =。
中南大学《物理化学》网上(课程)作业一及参考答案

中南大学《物理化学》网上(课程)作业一及参考答案(一) 单选题1. 下列物理量中,不属于体系性质的是()。
(A) -pdV(B) (C) (D)参考答案: (B)2. 在恒压恒温条件下,溶剂A与溶质B形成一定浓度的溶液,若采用不同的浓度表达形式表示溶液中A和B的浓度,则()。
(A) 溶液中A和B的活度不变(B) 溶液中A和B的参考态化学势值不变 (C) 溶液中A和B的活度系数不变 (D) 溶液中A和B的化学势值不变参考答案: (D)3. 在298K下,A和B两种气体单独在某一溶剂中溶解时均遵守Henry定律,Henry 常数分别为kA和kB,且已知,则当A和B压力(平衡时的)相同时,在一定量的该溶剂中溶解的关系为()。
A的量大于BA的量小于B(B) 的量A的量等于B(C) 的量A的量与B的量无(D) 法比较(A) 的量参考答案: (B)4. 当5mol的H2(g)与4mol的Cl2(g)混合,最后生成2mol的HCl(g)。
若以下式为基本单元:1mol (A)2mol (B) 4mol (C) 5mol (D)参考答案: (A)5.凡是孤立系统中进行的变化,其的值一定是()。
(A)(B) (C) (D)参考答案: (D)6.封闭系统中,若某过程的A=WR,应满足的条件是()。
等温、可逆过等容、可逆过(B) 程等温等压、可逆(C) 过程等温等容、可逆(D) 过程(A) 程参考答案: (A)7.某纯物质体系的,当压力升高时其熔点将()。
(A) 升高降低 (B) (C) 不变不确定 (D)参考答案:(A) 8.在温度T时,纯液体A的饱和蒸气压为凝固点为,化学势为,并且已知在下的,当A中溶入少量与A不形成固态溶液的溶质而形成为稀溶液时,上述三物理量分别为,则()。
(B)(C)(D)参考答案: (D)9. 定义偏摩尔量时规定的条件是()。
(A) 等温等压(B) 等熵等压(C) 等温,溶液浓度不变(D) 等温等压,溶液浓度不变参考答案: (D)10. 盐碱地的农作物长势不良,甚至枯萎,其主要原因是()。
中南大学物化课后习题答案 4章 化学平衡热力学原理

第6章化学平衡热力学原理1. 1000 K,101.325kPa时,反应2SO3(g) ==== 2SO2(g)+O2(g)的Kc=3.54 mol·m-3。
(1)求此反应的 Kp和Ky;(2)求反应SO3(g)==== SO2(g)+1/2O2(g)的Kp和Kc。
(答案:①K p= 29.43 kPa,K Y= 0.29,②K p= 171.6 kPa,K c= 1.88 mol1/2·m-3/2)解:(1) 2SO3(g)==== 2SO2(g)+O2(g)K p=Kc(RT)∑νβ=3.54×8.314×1000=29.43×103 Pa=29.43kPaK y= K p·P-∑νβ=29430×(101325)-1=0.29(2) SO3(g)==== SO2(g)+1/2O2(g)==2.在温度T容积V的容器中,充入1mol H2和3mol I2,设平衡后有x mol HI生成。
若再加入2mol H2,则平衡后HI的物质的量为2x mol。
试计算Kp值。
(答案:4)解:已知平衡时生成HI摩尔数为xH2(g) + I2(g) ==== 2HI反应前摩尔数 1 3 0平衡时摩尔数1-0.5x 3-0.5xx总摩尔数∑n=1- 0.5x +3- 0.5x + x = 4mol ∵∑νB = 0若在上述平衡体系中再加入2摩尔H2H2(g) + I2(g) ==== 2HI重新平衡时摩尔数3-x 3-x 2x总摩尔数=3-x+3-x+2x = 6在同一温度T,,∴,解此方程得:x =1.5,故3.将含有50% CO、25% CO2、25% H2(均为摩尔分数)的混合气体通入1 173 K的炉子中,总压为202.65 kPa。
试计算平衡气相的组成。
已知反应CO2(g)+H2(g)===H2O(g)+CO(g)在1 173 K时,Kp=1.22。
中南大学物理化学英文试卷
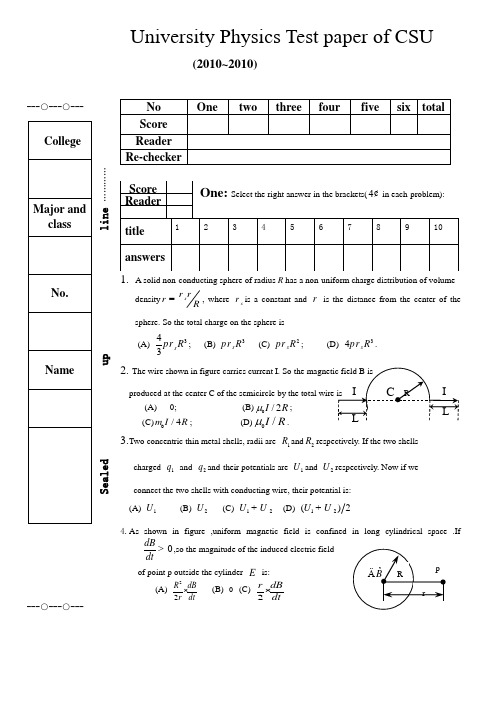
---○---○------○---○---S e a l e d u p l i n e …………University Physics Test paper of CSU(2010~2010)A solid non-conducting sphere of radius R has a non-uniform charge distribution of volumedensity s rRr r =, where s r is a constant and r is thedistance from the center of thesphere. So the total charge on the sphere is (A)343s R pr ;(B) 3s R pr (C) 2s R pr ; (D) 34s R pr . 2. (A) 0;(B)R I 2/0μ;(C)0/4I R m ; (D)R I /0μ.3.Two concentric thin metal shells, radii are 1R and 2R respectively. If the two shellscharged 1q and 2q and their potentials are 1U and 2U respectively. Now if we connect the two shells with conducting wire, their potential is:(A) 1U (B) 2U (C) 12U U + (D) 12()2U U +4.As shown in figure ,uniform magnetic field is confined in long cylindrical space .If0dBdt>,so the magnitude of the induced electric field of point p outside the cylinder E is:(A) 22R dB r dt × (B) 0 (C) 2r dB dt×5. The Maxwell equation which describes the variable electric field will produce magnetic field is(A) (B) (C) (D)6.of negative direction of y-axis ,if we know that the electric potentialdifference between a and b 0ab U >, so the material is (A) N type (B) P type (C) metal (D) not certain.7. Which of the following descriptions of wave function is right?(A) is the probability of finding the particle at position r;(B) is probability density of finding the particle at position r at time t;(C) is probability density of finding the particles at position r at time t; (D) is probability of finding the particles at position r at time t.8. If the quantum number n=1, which of the following quantum state is possible : (A) (1,1,0,1/2) (B) (1,1,0,0) (C) ( 1,0,0,-1/2) (D) (1,0,0,0)Two (4¢ in each problem): Write the right answer in blanks1. The maximum kinetic energy of an electron ejected from a sodium surface whose workfunction is 2.28 eV when illuminated by light of wavelength 410nm is eV2. A circular coil of wire has a diameter of 5.0 cm and contains 25 loops, so the magneticmoment of the coil when it carries a current of 1.5 A is 2A m ×.3. If an electron that has velocity 66(2.010)(3.010)v ij =?moves through the magneticfield (0.03)(0.15)B i j =-, so the force on the electron is . 4. According to Born ’s statistical interpretation to wave function, the standard conditions of wavefunction are: (1)___________ ;(2) __________ ;(3) ___________ .5. A wire is formed into the shape of twohalf circles connected by equal-length straight sections as shown in figure .A current i flows in the circuit anticlockwise as shown ,the magnetic field at the center C is .6. Two long parallel wires, both of radius a and whose centers are a distance d apart, carry currentin opposite directions. Show that ,neglecting the flux(磁通) within the wires ,the inductance(电感)of unit length of a pair of wires is .7. The ground-state energy of electron is -13.6eV ,so the energy of the second excited statesis .),(t r ψ),(t r ψ2),(t r ψS VD dSdV r ? 蝌L S B E dl dS t ¶?- ¶蝌 0S B dS ?òL S D H dl J dS t 骣¶÷ç÷?+ ç÷÷ç¶桫蝌R2),(t r ψThree(9¢): The plastic rod shown in figure has length L and a non-uniform linear charge density cxl=,where c is a positive constant .With V=0 at infinity, find the electric Potential(a)at point1p on the x axis, a distance d from one end and(b) point2p on the y axis ,a distance y from one end of the rod.Four(9¢):As shown in right figure ,an infinite length thin metal plate carries a current I which uniformly distributes in the plate , please work out the magnetic field produced by the current at point P.Five(11¢):Figure shows a rectangular loop of wire immersed in a non-uniform andvarying magnetic field that is perpendicular to and directed intothe page. The field magnitude is given by 22400B t x =, with B in Teslas, t in seconds and x in meters. The loop has width 0.3L m = and height0.2h m =.What are the magnitude and direction of the induced emf(感生电动势) around the loop at 10t s =?Six (11¢): The wave function of particles in one dimensional potential well withwidth a is ()sin()n x A x apy = (0)x a #,please work out the following problems:(1) Normalization constant A;(2) Where is the maximum probability of finding the particles when n=3?Appendix: answers for 0813-0815One: Select the right answer in the brackets (4¢ in each problem)1 B2 C3 B4 A5 D6 A7 C8 C Two(4 in each blank): Write the right answer in blanks 10.75eV 2 20.36A m ×314(6.2410)N k -´4 (a) single-value; (b) continuous;(c) finite 501211()314I R R m ⅱ- 6 0lnd a L am p -= 7 1.51eV -Three (9¢):Solution: We select point o as the origin and select the element charge dq dx l =at thedistance x to the origin, so according to the definition of electric potential 2¢ (a): The electric potential at point1p is10000(ln )4()4()4LLdqcxdx c d LU L d x d x d dpe pe pe +===-++蝌 3¢(b): The electric potential at point2p is200)44LL dqcU y r pe pe ===蝌 4¢ Four (9¢):Solution: We select the left side of the plate as the origin and select the element currentIdi dx a=(2¢)at the distance x to the origin ,according the magnetic field of the infinite long straight wire carrying current:02()didB a d x m p =+- 3¢So: 000ln 22a I I dxa d B a a d x a dm m p p +==+-ò 2¢Direction: perpendicular the paper inward. 2¢Five (11¢):Solution: Because the magnitude of the magnetic fieldBis changing with the time , themagnetic flux Bfthrough the loop is also changing .so we can take thedifferential areadA hdx = (2¢)with its normal being parallel toB, and theflux through the loop is22400B B dA BdA Bhdx t x dx f ====蝌蝌2¢take this integration and inserting the integration limits 0x = and 0.3x m =get:0.322204000.72B t h x d x t f ==ò2¢, when0.2h m =,according toFarady law at any time :1.44Bd t dtf e == 2¢ For 10t s =,14.4V e = 2¢Direction: counterclockwise around the loop at this time. 1¢Six (11¢)Solution: (1) according to the normalization condition:222()sin1aa n x dx A xdx A a p y ==蝌 2¢So: A =2¢ (2) The probability density of finding the particles is:222()sin n x x a a p y =, the position of finding the maximum probability satisfies: 2222()()00d x d x and dt dty y =<, We get: 2sin0n x ap= 2¢ Therefore:23(0,1,2)x k k a pp ´== 6ax k = , 2¢We can get the position of maximum probability of finding the particles is:5,,626a a ax =3¢。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中南大学考试试卷2011 -- 2012学年下学期时间110分钟(2012.5.6)物理化学课程32学时2学分考试形式:闭卷专业年级:化工、应化、制药、粉体、材化等2010级总分100分,占总评成绩70 %注:此页不作答题纸,请将答案写在答题纸上一、单选题(每题2分,共26分)1. 实验测得某二级反应速率常数,正确的是()(A)k=5.0s-1(B)k=5.0 dm6·s-1·mol-2(C)k=5.0 s-1·mol-1(D)k=5.0 dm3·s-1·mol-1 2. 加催化剂可使化学反应的下列物理量中哪个改变()(A)反应热(B) 平衡常数(C) 反应熵变(D) 速率常数3. 对下列电解质溶液,其中摩尔电导率最大的是()(A) 0.001 mol·kg-1 KCl (B) 0.001 mol·kg-1 KOH(C) 0.001 mol·kg-1 HCl (D) 0.1 mol·kg-1 KCl4. 浓度为0.1mol·kg-1的MgCl2水溶液,其离子强度为( )(A) 0.1mol·kg-1(B) 0.15mol·kg-1(C) 0.2mol·kg-1,(D) 0.3mol·kg-1。
5. 对下列电解质溶液,其中平均活度系数最大的是()(A)0.01 mol·kg-1KCl (B)0.01 mol·kg-1CaCl2(C)0.01 mol·kg-1LaCl3(D)0.001 mol·kg-1KCl6. 用补偿法测定可逆电池的电动势时,是为了( )(A) 消除电极上的副反应;(B) 减小标准电池的损耗;(C) 在可逆情况下测定电池的电动势;(D) 简便易行。
7. 恒温恒压下可逆电池放电过程()(A)ΔH = Q(B)ΔH <Q (C)ΔH > Q (D)ΔH 、Q关系不确定8. 某电池反应为2Hg(l) + O2 + H2O → 2Hg2+ + OH -,当电池反应达到平衡时,电池的电动势E必然为( )(A) E > 0 (B) E = EΘ(C) E < 0 (D) E = 09. 电解金属盐的水溶液时,在阴极上()(A)还原电势愈正的离子愈容易析出(B)还原电势与其超电势的代数和愈正的离子愈容易析出(C)还原电势愈负的离子愈容易析出(D)还原电势与其超电势的代数和愈负的离子愈容易析出10. 将某毛细管垂直插入水中,使毛细管露出水面的长度为8cm,此时毛细管内水面上升了5cm;若将毛细管向下移动,使毛细管露出水面的长度为3cm,则此时毛细管上端口水面的状况是()(A)水从毛细管上端溢出(B)毛细管上端水面呈凸形弯月面(C)毛细管上端水面呈凹形弯月面(D)毛细管上端水面呈水平面11. 对于物理吸附的描述中,哪一条是不正确的()(A)吸附力来源于范徳华力,其吸附一般不具有选择性(B)吸附层可以是单分子层或多分子层(C)吸附热较小(D)吸附速率较小12. 在稀的砷酸溶液中通入H2S制备硫化砷溶胶(As2S3),该溶胶的稳定剂是H2S,则其胶团结构式是()(A)[(As2S3)m·nH+,(n-x)HS-]x+ ·xHS-(B)[(As2S3)m·nHS-,(n-x)H+]x- ·xH+(C)[(As2S3)m·nH+,(n-x)HS-]x- ·xHS-(D)[(As2S3)m·nHS-,(n-x)H+]x+ ·xH+13. 对水溶液中的下列反应,加入惰性电解质能增加反应速率的是()(A)S2O82- + 3I-→I3- +2SO42-(B)H2O2 +2H+ +2Br-→2H2O +Br2(C)蔗糖+OH-→葡萄糖+果糖(D)2H2O2→2H2O +O2↑二、填空题(共18分)1.(2分)某物质分解反应的速率常数k=4.62×10-2s -1,则该物质反应掉3/4所需要的时间为 。
2. (2分)合成氨反应在一定温度和压力下,平衡转化率为25%。
现在加入一种高效催化剂后,反应速率增加了3倍,则其平衡转化率提高 倍,此时平衡转化率为 %。
3. (2分)实验测得反应22A B C D +−−→+的速率方程为B A r kc c =;反应历程为12()()k k A B C FA F C D+−−→++−−→+慢快则1k 与k 的关系为 。
4. (2分)若将反应Sn 2++Pb 2+=Sn 4++Pb 设计成可逆电池反应,则其电池表达式为 。
5. (2分)电池:Pt ,H 2(10kPa )︱HCl(1.0 mo l ·kg -1)︱H 2(100kPa ),Pt 该电池的电动势E = V ; 该电池是否为自发电池? 。
6. (2分)极化作用的结果会使得阳极电势 ,阴极电势 。
7. (2分)表面超量Γ是指: 单位面积的表面层中所含溶质的物质的量与具有相同质量溶剂的本体溶液中所含溶质的物质的量之差。
若Γ>0,则称为 吸附;反之, 若 Γ<0, 则称为 吸附。
8. (2分)混合等体积的0.08 mol.dm -3KI 和0.1 mol.dm -3 AgNO 3溶液所得溶胶在电泳时,胶体粒子往 极移动;比较 MgSO 4, Na 2SO 4, CaCl 2电解质对负电溶胶的聚沉能力大小循序为 。
9. (2分)丁达尔(Dyndall)效应产生的原因是 ;丁达尔效应是鉴别 的有效方法。
三、(12分) 某气体分解反应A (g )→2B (g )为一级反应。
553K 下,将气体A 迅速引入一定容的容器中,751秒后测得体系压力为2.710kPa ,经很长时间反应完成后测得体系压强为4.008 kPa ;578K 下,重复实验,经过320秒后测得体系压力为2.838 kPa ,反应完成后体系压力为3.554 kPa 。
(1)求553K 和578K 下,此反应的半衰期;(2)求此反应的活化能。
四、(10分) 某气相反应A+C==P 的反应历程为 12A D k k −−→←−−,3D+C P k −−→,试用稳态近似法导出反应的速率方程 Pdc dt=?;并证明反应在高压下为一级,在低压下为二级。
五、(12分) 对电池 Pt ,H 2(g ,p Θ)︱H 2SO 4(0.01mol· kg -1) ︱O 2(g ,p Θ),Pt在298K 时测得其电动势及电池的温度系数分别为E =1.229V ,p E T ∂⎛⎫ ⎪∂⎝⎭= -8.493×10-4 V·K -1。
(1)写出电池反应;(2)求电池反应在298K 时的r m G ∆、r m H ∆及r m S ∆; (3)该电池在298K 可逆放电时的热效应。
六、(10分) 在298K 时,电解0.5 mol· L -1 的CuSO 4溶液(pH=2),使Cu 镀到Pt 片上。
若H 2 在Cu 上的超电势为0.23V ,当外电压增加到有H 2在电极上析出时,溶液中Cu 2+的浓度为多少?已知298K 时,2/0.340V Cu CuE +Θ=。
七、(12分) 已知373K 时,水的表面张力为58.9×10-3 N· m -1,密度为958.4 kg· m -3。
(1)373K 时直径为1×10-7 m 的气泡内的水蒸气压为多少?该气泡能否从373K 的常压水中长大逸出?(2)在373K 及 202.650kPa 的水蒸气相中,能自然凝结出的最小水珠的半径为多少?参考答案一,选择题:1D;2D;3C;4D;5D;6C;7B;8D;9B;10C;11D;12B;13A二,填空题:1.(2分)30 s 。
2. (2分,每空1分) 0 ; 25% 。
3. (2分,)k1=k。
4. (2分,)Pt︱Sn4+(a1),Sn2+(a2)‖Pb2+(a3)︱Pb(s)。
5. (2分,每空1分)-0.0295 ,非自发。
6. (2分,每空1分)_ 升高_,_ 降低_。
7. (2分,每空1分)_ 正_,_ 负_。
8. (2分,每空1分)_ 正电_,_ Na2SO4>MgSO4>CaCl2_。
9. (2分,每空1分)_ 光散射_,_ 胶体_。
三、(12分) 解:(1) ,02A p p ∞=(1分) ,0,011ln ln A A AtC p p k tC t p p ∞∞-==- (2分) 553K 时,4111 4.008 2.004()ln 5.78310751 4.008 2.710k T s ---==⨯- (1分) 秒3411110198.110783.5693.0)(693.0)(2ln )(21⨯=⨯===-T k T k T t (2分)578K 时,3121 3.554 1.777()ln 2.84110320 3.554 2.838k T s ---==⨯- (1分) 122321ln 20.6930.693()244()() 2.84110t T k T k T -====⨯秒 (1分) (2) 212211()ln ()a RT T k T E T T k T =- (2分) -1-121()578553ln 169.2kJ K mol 578553()k T R k T ⨯⨯==⋅⋅- (2分)四、(10分) 解:D 为中间产物,用稳态法则有: (1分)1230DD D A C dc k c k c k c c dt=--= (2分) 所以有:123D ACc k c k k c =+ (1分)又因:13233A CCP D C k k c c k k c dc k c c dt +== (2 分) 在高压下:23C k k c , (1分)所以:11323A A CCP k c k k c c k k c dc dt =+= 反应为一级 (1分) 在低压下:23C k k c , (1分)所以:1313232A C A CC P k k c c k k c c k k c k dc dt =+= 反应为二级 (1分) 五、(12分) 解:(1)H 2(g ,p Θ)+1/2O 2(g ,p Θ)= H 2O(l) (3分) (2) r m G zEF ∆=- (1分)12 1.22998500242.113kJ mol -=-⨯⨯=-⋅ (1分)r m pE H zEF zFT T ∂⎛⎫∆=-+ ⎪∂⎝⎭ (2分) 41242.113298500298(8.49310)291.97kJ mol --=-+⨯⨯⨯-⨯=⋅ (1分)r m pE S zF T ∂⎛⎫∆= ⎪∂⎝⎭ (1分) 4112985008.49310167.3J K mol ---=-⨯⨯⨯=-⋅⋅ (1分)(3) r r m Q T S =∆ (1分)298167.349.855kJ =-⨯=- (1分)六、(10分) 解:当外电压增加到有H 2在电极上析出时,阴极上的析出电势为:22,2ln 0.232H H H a RT E F a -=--析 (3分) 2ln 0.23ln100.230.336V H RT RT a F F--=-=-=- (2分) 此时对应Cu 的析出,则有:22,/ln 0.3362Cu Cu Cu CuCu a RTE EF a ++Θ=-=-析 (3分) 即:210.34ln 0.3362Cu RT F c +-=-, 所以:22414.5310mol L Cu c +--=⨯⋅ (2分) 此时Cu 已基本析出完全。
