物质的微观结构共27页文档
物质的微观构成和宏观组成

1、分子和原子:是由2、分子是由原子构成的;有些分子由同种原子构成如:1个氧分子O2是由多数分子由不同种原子构成如:1个二氧化碳分子CO23、注意:水是由水构成的,水分子是由构成的,1个水分子是由和构成的;有的物质是由原子直接构成的,如:汞是由4、用分子观点解释由分子构成的物质的物理变化和化学变化物理变化:;化学变化:;如:水蒸发时水分子的变大,但水分子,故为变化,实验室用过氧化氢分解制取氧气时, 分子就变成了和 ,故为变化;再如,加热红色的氧化汞粉末时, 会分解成 和 ,每 个结合成 个 ,许多 聚集成 ;5、化学变化的实质:在化学变化过程中, 分裂变成 , 重新组合,形成新物质的 ;如:水在化学变化中的最小粒子是 ;6、从微观角度解释纯净物和混合物由分子构成的物质的区别:纯净物 ,混合物由 如: 又如图: 7、原子的构成1原子结构示意图的认识8、原子是由居于原子中心的________________________和______________________构成的;原子核是由 和 两种粒子构成的; 9、由于原子核内的质子带__________________,中子____________,原子核带的___________________与____________________相等, 相反,所以整个原子不显电性;不同种类的原子,核内的质子数________,核外的电子数______________;+12 28 2电子带 电不带电电带 电原子10、在原子中 =______________=________________ 11、不同原子的根本区别是__________________________________说明:原子一般是由质子、中子和电子构成,有的原子不一定有中子,质子数也不一定等于中子数;12、练习:13、原子核外电子的排布:电子在核外是 的14、相对原子质量是指以____________________________,其他原子的质量跟_____________________;符号为Ar;单位为“1” 15、⨯=(kg) (kg) 相对原子质量16、原子的质量主要集中在__________________上,质子和中子的质量跟相对原子质量标准相比较,均约等于____,而电子的质量约为质子质量的1/1836,可以忽略不计;17、相对原子质量≈ +决定元素种类 核电荷数18、三决定决定元素化学性质决定原子的质量19、在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上:1能保持物质化学性质的最小粒子是 2化学变化中的最小粒子是3带正电荷的粒子是 4不显电性的粒子是5质量最小的粒子是 6在同一原子中数目相等的粒子是7决定原子质量大小的粒子主要是8构成物质的基本粒子是和离子9构成原子的基本粒子是 10参加化学反应一定发生变化的粒子是20、离子的形成:氯化钠NaCl中,钠原子的最外层有个电子,容易而 ,形成 ;氯原子最外层有个电子,容易电子而 ,形成 ;这样两者都形成相对稳定结构,整个化合物电性;21、离子定义;阳离子如:镁离子;铝离子;阴离子如:硫离子;氧离子;22、符号:表示:E F25、上述示意图中表示原子的是:;表示阳离子的是:;表示阴离子的是:;表示稳定结构的是:;表示金属元素的是:;表示非金属元素的是:;表示稀有气体元素的是:;表示同种元素的是:;化学性质相似的是: ;26、分子与原子区别:原子与离子区别:27、元素:观察下表中几种不同的碳原子相对原子质原子种类质子数核电荷数中子数核外电子数量碳原子 6 6 6 12碳原子 6 7 6 13碳原子 6 8 6 14填空1原子中的质子数核外电子数都是 ,这样的原子都是 ;1.元素定义:元素是数即数相同的一类原子的总称; 1元素种类有种;组成了几千万种物质;元素种类决定于原子的数或数,即不同元素的本质区别是原子的不同如:质子数为8的氧原子统称为;质子数为1的氢原子统称为;2元素分类:、、 ;通过汉子的偏旁来区分;P62 提示:化学反应前后原子的种类 ,元素的种类 ;p59讨论元素原子理一理:学完本课,你对“分子,原子,元素,物质“四个概念间的相互关系有哪些认识课堂练习:1、下列说法有没有错误把错误的说法加以改正;①水是由1个氧元素和2个氢元素组成的;②二氧化硫中有硫和氧2个元素;2、判断下列说法是否正确并将错误的说法加以改正;a.加热氧化汞生成汞和氧气,氧化汞中含有氧气分子;b.二氧化硫分子是由硫元素和氧元素构成的;c.水是由氧原子和氢原子构成的;3、说一说:①水是由构成的;②水分子是由构成的;③一个水分子是由构成的;④水是由组成的;⑤铁是由构成的;⑥铁是由组成的;⑦氯化钠NaCl是由组成的;是由构成的;4、1二氧化碳是由碳和氧组成的;2二氧化碳分子是由碳和氧构成的;3氧化镁MgO、二氧化碳CO2、氧化汞HgO中都含有元素 ;5.我们在看电视的时候,经常看到为健康劝人们“补铁”、“补钙”、“补锌”、“加碘”的广告,这里的“铁”、“钙”、“锌”、“碘”指的是什么6.地壳和生物体中的一些元素的含量:阅读P60图3-17和表3-3回答1地壳中含量居于前五位的元素分别是:、、、、 ,其中属于金属元素的是 ,属于非金属的是 ;2生物体内含量居于前三位的元素分别是、、 ;3空气中最多的元素是、其次是 ;7、物质的组成、构成及分类组成:物质纯净物由组成原子:金属Cu、Fe;稀有气体He、Ne、Ar;碳、硅、硫、磷C、Si、S、P等;、物质构成分子:如氯化氢HCl、CO2; H2、O2、N2、F2、Cl2、Br2离子:NaCl等离子化合物,如氯化钠由、构成混合物多种物质分类单质一种元素:、、纯净物化合物:多种元素氧化物酸、碱、盐、有机物定义:单质:化合物:氧化物:8.在①水H2O、②氢气H2、③二氧化碳CO2、④液氧O2、⑤铁Fe、⑥冰水混合物⑦氨气NH3、⑧过氧化氢H2O2、⑨高锰酸钾KMnO4等物质中用序号填空:属于单质的是;属于化合物的是 ,属于氧化物的是 ;9.下列物质:①空气,②氧气,③二氧化硫,④五氧化二磷,⑤高锰酸,⑥氯酸钾,⑦氯化钾,⑧河水,⑨糖水,⑩汽水; 其中属于混合物的是________________________;属于单质的是;属于化合物的是____________________________;属于氧化物的是________________________;含有氧元素的是__________;含有氧分子的是__________;二、元素符号:3.元素符号的意义:1表示宏观意义;2表示微观意义3金属、稀有气体、固非金属的元素符号还可以表示如:H表示、 ;2H表示 ;Cu表示、、 ;元素符号前面加数值,表示原子的数目,只有微观意义;如:2N表示2个氮;5个铁原子写作: ,6个氟原子写作: ,n个镁原子写作: ;二、写出下列符号的含义及符号:C :P :He:硅元素 :氖气: I : Fe:一个钾原子 :金属钠: Ca : 氮原子: 银元素:H:2H:H22H2H+: 2 H+: O:2O:O2-:2O2-:Fe2+: Fe3+:三、写出下列符号中数字“2”的含义:O:2He: 2Ne: 2Mg: H2Mg2+ : 2Mg2+ : 2S:: ①:2N: 2N2②:2O2-:前边的2:后边的2:O:前边的22Fe: 2H2。
物质构成及微观示意图

物质的构成1.知道分子、原子、离子都是构成物质的粒子; 2.知道什么是分子、原子和离子(含原子团);3.认识分子的主要性质, 能用微粒的观点解释某些常见的现象4.知道原子是由原子核和核外电子构成的,原子核一般由质子和中子构成; 5.记住在原子里质子数==核电荷数==核外电子数;6.记住原子的质子数决定元素的种类,最外层电子数决定化学性质;一、知识脉络二、中考考点质子中子小 动 间隔金属 元素 非金属元素质子数==核电荷数==核外电子数 相对原子质量==质子数+中子数两个 等式 质子数决定元素种类最外层电子数决定元素化学性质两个 决定7.知道分子是由原子构成的,同一元素的原子和离子可以相互转化;8.理解元素符号的含义,记住一些常见的元素符号和名称,会判断元素的种类;9.能根据原子序数在元素周期表中找到指定元素;10.能说出几种常见元素的化合价;11.能用化学式表示常见物质的组成;12.理解化学式的含义,能看懂某些商品标签上标识的物质成分及含量;13.能应用元素的化合价推求化合物的化学式,能依据化合物的化学式推求某一元素的化合价。
三、能力训练一、选择题(每小题只有一个选项符合题意。
)(一)微粒构成物质1.(08·泰安)分子、原子、离子都是构成物质的基本微粒。
下列由原子直接构成的A.铜 B.氧气 C.氯化钠 D.二氧化碳2.(08·厦门)构成氧气的微粒是A.分子 B.原子 C.离子 D.元素3.(08朝阳一模)下列物质由原子直接构成的是A.水B.氧气C.氯化钠D.铁4.(11·延庆期末)下列物质中,含有氧分子的是A.O2B.H2O C.CO2D.SO25.(08·福建)下图中的符号表示2个氢原子的是6. (08宣武一模)能保持氧气化学性质的最小粒子是A .OB .O 2C .O 2-D .2O7.(08延庆一模)若用“”表示氧原子,则保持水的化学性质的最小粒子可表示为A B . C . D . 8.为形象表示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。
物质结构的微观模型ppt王莹莹

1、物质是由大量分子组成的。 2、扩散现象表明: 一切物体的分子都永不停息地做无规则运动。 分子间存在间隙。 3、分子间存在相互作用的引力和斥力。
27
课堂练习
毒品“毁灭自己,祸及家庭,危害社会,我 国政府严厉禁毒。
经过训练的警犬凭什么可以从旅客的行 李箱中发现夹带的海洛因、摇头丸等毒品?
下列现象中,能说明物体的分子在不停地运动的是
A、脏水中有许多小虫在乱动,毫无规律
(B)
B、衣箱里放樟脑丸,过些日子衣服上也有了樟脑味
C、教室里大扫除时,灰尘满屋飞扬
D、洗过的湿衣服,过些日子变干了
31
下列现象说明分子间有斥力作用的是( D )
A、煤堆在墙角时间长了,墙内部变黑了 B、打开醋瓶后,很快嗅到醋味 C、有手压面包,面包体积变小了 D、封闭在容器中的液体很难被压缩
33
关于分子,你认为下面说法中错误的是: ( D)
A.一切物体都是由分子组成的 B.分子做永不停息的运动 C.分子之间存在相互作用力 D.有的分子之间只有引力,有的分子之间
只有斥力
压缩固体和液体很困难说明分子间( A )
A.分子之间存在着斥力 B.分子之间存在着引力 C.分子不停滴在做无规则的运动 D.固体、液体分子之间没有空隙
32
将两块光滑的干玻璃放在一起,很容易把它们分开,但是 如果在玻璃上洒些水后再将它们放在一起,就很难把它们
分开。这一现象说明( C )
A、固体分子间没有作用力,而液体分子间有作用力 B、同种分子没有作用力,而异种分子间有作用力 C、任何分子间均有作用力,距离越小,作用力越大 D、水具有黏性,分子间是否具有作用力与此无关
既然物质是由分子组成的,分 子又在不停地运动着,那为什么固 体和液体还有一定的体积同时又很 难被压缩呢?
物质微观构成
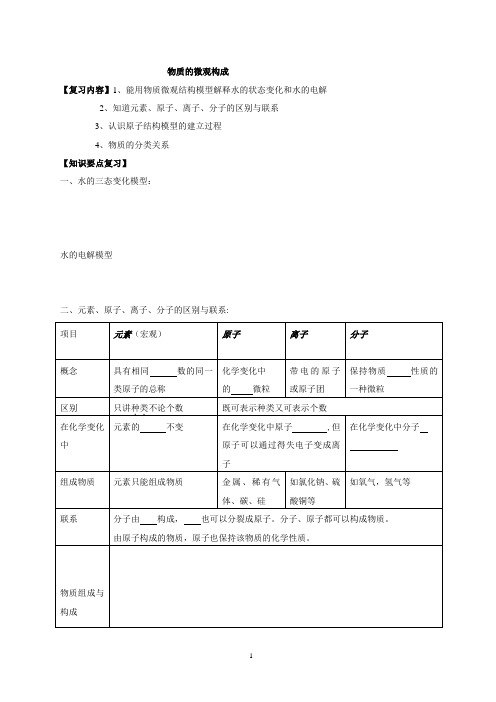
物质的微观构成【复习内容】1、能用物质微观结构模型解释水的状态变化和水的电解2、知道元素、原子、离子、分子的区别与联系3、认识原子结构模型的建立过程4、物质的分类关系【知识要点复习】一、水的三态变化模型:水的电解模型二、元素、原子、离子、分子的区别与联系:1、分子:(1) 分子是构成物质的一种粒子。
它既不是最小的粒子,也不是唯一的粒子。
(2) 分子只保持物质的性质,而不是保持物质的如颜色状态熔点等物理性质。
(3)分子能保持物质的化学性质,但不是保持物质化学性质的唯一的粒子。
因为由分子构成的物质保持物质化学性质的粒子是,如氧气、水等,但也有许多物质是由原子构成,如铁等金属,保持它们化学性质的微粒就是。
(4)分子是由构成的,构成分子的原子可以是同种原子(如1个氢分子由2个氢原子构成),也可以是不同种原子。
(如1个水分子由2个氢原子和1个氧原子构成。
)2、原子:(1)“原子”要注意“最小”和“化学变化”是相互关联的,“最小”是指在化学变化中原子不能再分,离开了“化学变化”这个前提,“最小”就没有意义,因为用其他方法原子还可以再分。
(2)原子的结构:说明:①原子中质子带的正电荷总数与电子带的负电核总数电量相等、电性相反,整个原子显电中性。
②电子的质量比质子、中子小得多,原子的质量主要集中在原子核上。
但原子核占据的空间很小。
③在原子中,核电荷数=质子数=核外电子数。
④相对原子质量=质子数+中子数原子结构示意图:已知如下A.B.C三种元素的原子结构示意图依次为(1)当A.B为原子结构示意图时,x= ;y= .(2)C表示的是(阳离子、阴离子、原子)的结构示意图3、原子与离子的区别与联系粒子的种类原子离子阳离子阴离子区粒子结构质子数=电子数质子数>电子数质子数<电子数别粒子电性不显电性显正电性显负电性符号用元素符号表示用阳离子符号表示用阴离子符号表示4、元素:具有相同核电荷数或相同质子数的同一类原子的总称。
第十二章物质的微观结构

第十二章物质的微观结构本章学习提要1.α粒子散射实验及原子的核式结构模型。
2.天然放射现象和α、β、γ三种射线的基本特性及应用。
3.原子核由中予和质子组成,在核子间存在强大的核力。
4.重核裂变是获得核能的有效方法之一;链式反应和发生链式反应的条件。
5.核能在能源、军事、生命科学等领域的应用;核反应堆、核电站的基本构成;核能转变为电能的概况。
本章容属于物质的微观领域。
本章的重点是原子的核式结构和原子核的组成;难点是理解核能的来源。
在了解我国核物理研究和核工业发展的成就的同时,要学习邓稼先等科学家乐于奉献、报效祖国的精神,树立献身科学的远想。
A 原子的核式结构一、学习要求知道电子是原子的组成部分。
知道卢瑟福的α粒子散射实验。
知道卢瑟福原子核式结构模型的特点。
在形成知识和解决问题的过程中,要知道用物理学的研究方法一一提出假设、建立物理模型、实验验证等方法,“感受”微观世界的奥秘。
感悟科学家对事物敏锐的洞察力和创造性思维能力。
二、要点辨析1.卢瑟福的α粒子散射实验1909年,卢瑟福指导他的学生进行了α粒子散射的研究。
在做α粒子轰击原子(4×10-7m 厚的金箔)的实验时,从大量的观察记录中,发现了居然约有八千分之一的α粒子偏转90°,甚至有少数被反弹回来(约占总数120000)。
卢瑟福为此苦思了好几个星期。
经过严谨的理论推导,卢瑟福于1911年提出了原子的“有核结构模型”。
他认为原子中的所有正电荷和几乎全部原子质量都集中在原子中心的“核”,带正电的核和带负电的电子间的静电引力把整个原子结合在一起。
由于α粒子的质量大约是电子质量的7000多倍,所以α粒子在与电子作用时,几乎不会改变方向。
只有当α粒子打到原子核时,由于库仑斥力,才有可能发生大角度散射。
原子核的发现,使人们对原子的结构有了正确的认识,开始了人类对原子核研究的历史。
2.从卢瑟福的核式结构模型,看建立物理模型的重要意义“卢瑟福核式结构模型”是一种物理模型,它是一种高度抽象的理想客体和形态。
第十二章物质的微观结构讲解

6.D 7.B 8.A 9. 10.A
【能力提高题】:
11.D12.C13.A
14.(1) (2)
D重核裂变链式反应
内容(课标)
第十二章物质的微观结构D重核裂变链式反应
学习水平要求A级
学习目标
1.知道重核裂变是获取核能的有效途径之一;知道链式反应和产生链式反应的条件。
2.通过重核裂变和链式反应的学习过程,感受虚拟实验的方法。
14.写出下列核反应方程式
(1)卢瑟福用α粒子轰击氮14核发现质子_________________________________;
(2)查德威克用α粒子轰击铍9核发现中子____________________1.用α粒子轰击氮核 查德威克 2.A A-Z Z 3.30 64
A.全部穿过金原子
B.绝大多数穿过金原子,只有少数发生大角度偏转,及少数甚至被弹回
C.绝大多数发生很大的偏转,甚至被弹回,只有少数穿过金原子
D.全部发生很大的偏转
3.卢瑟福α粒子散射实验的结果是
A.证明了质子的存在
B.证明了原子核是由质子和中子组成的
C.说明原子的全部正电荷和几乎全部质量都集中在一个很小的核上
出自《物理教学参考资料》(高中二年级第二学期)P16
教学
重点和难点
重点:通过人工转变发现了原子核是由核子(质子和中子)组成的。
难点:查德威克发现中子过程的分析推理过程。
出自《物理教学参考资料》(高中二年级第二学期)P17
本节
知识要点
一、质子的发现
卢瑟福用α粒子轰击氮核,第一次通过人工转变证实了原子核中有质子。
二、中子的发现
查德威克通过实验和分析,发现了不带电的中子。
物质的微观结构表格

1 +β 衰变: 30 P 30 Si 0 e (核内 1 H 0 n 0 e ) 15 14 1 1 1
γ 衰变:光子
C
一、质子的发现:1919 年英国物理学 家卢瑟福用 α 粒子轰击氮核,第一次用 人工方法实现了原子核的转化,并发 现了质子。
二、中子的发现:1932 年英国物理学 家查德威克用 α 射线轰击铍核,产生 一种贯穿能力极强的射线,它能穿透 几厘米厚的铅。这种射线就是中子。
A
三、卢瑟福的原子核式结构模型 1.核式结构模型(行星模型) 1)在原子的中心有一个很小的核, 叫原子核; 2)原子的全部正电荷和几乎全部质 量都集中在原子核里; 3)带负电的电子在核外不停地绕核 运动。 2.原子半径 R、原子核半径 r R=10-10m;r=10-15~10-14m
四、放射性同位素的应用 1.利用其射线: α 射线电离性强, 用于使空气电离, 将静电泄出,从而消除有害静电。 γ 射线贯穿性强, 可用于金属探伤, 也可用于治疗恶性肿瘤。 各种射线均可使 DNA 发生突变, 可 用于生物工程,基因工程。 2.作为示踪原子:用于研究农作物化肥 需求情况,诊断甲状腺疾病的类型,研 究生物大分子结构及其功能。 3.进行考古研究。利用放射性同位素碳 14,判定出土木质文物的产生年代。
E
一、核反应堆 用人工方法控制核裂变链式反应速度并获得核能的 装置。 核反应堆的主要组成是: (1)核燃料:能吸收慢中子的铀 235 (2) 减速剂: 石墨或重水 (使裂变中产生的中子减速, 便于被铀 235 吸收) (3)控制棒:镉(镉吸收中子的能力很强) (4)冷却剂:水(把反应堆内的热量传输出去用于发 电,同时使反应堆冷却,保证安全) (5)水泥防护层:用来屏蔽裂变产物放出的各种射线
物质的微观结构与宏观性质

物质的微观结构与宏观性质物质是构成宇宙万物的基本元素。
从古至今,人们一直试图探究物质的微观结构与宏观性质之间的关系。
随着科学的进步,人类对物质的了解也越来越深入。
本文将从不同角度来探讨物质的微观结构与宏观性质之间的关联。
首先,我们来看物质的微观结构。
微观结构是指物质在最基本单位的层次上的组织情况。
在物理学中,物质被认为是由原子和更小的粒子组成的。
原子是物质的基本构建单位,由质子、中子和电子组成。
不同元素的原子具有不同的质子和中子数量,这决定了其化学性质和性质。
而电子则决定了原子的电荷以及化学键的形成和特性。
原子之间通过化学键相互结合形成分子。
化学键的类型和强度也决定了物质的一些宏观性质。
例如,共价键的形成使得分子中的原子共享电子,使分子保持稳定。
离子键则是通过正负电荷之间的吸引力形成的,使得化合物具有离子晶格结构。
而金属键是通过金属中自由电子在整个金属结构中的运动形成的,使得金属具有导电性和延展性。
除了原子和分子之外,物质中还存在一些更小的结构单位,如晶格、多晶和非晶等。
晶体是由原子或分子按照固定的周期性规律排列而成的。
晶体的物理性质取决于晶格结构和晶体内部的微观结构。
而多晶体则由多个晶体颗粒组成,内部存在晶界。
非晶体则没有明确的晶格结构,呈无序排列。
物质的宏观性质是指物质在我们能够察觉和测量的尺度上展现出来的特征。
宏观性质包括颜色、密度、硬度、热传导等。
宏观性质与微观结构之间存在着密不可分的联系。
以密度为例,密度是物质单位体积内的质量,可以通过微观结构中原子或分子的排列方式来解释。
如果物质的微观结构中原子或分子之间的间隙较小,那么单位体积内的质量就会较大,从而使得密度增大。
另一个例子是热传导。
热传导是指热能在物质内部传播的过程。
物质的热导率与其微观结构密切相关。
对于导热性较好的金属材料来说,其微观结构中存在大量自由电子,这些电子能够在整个金属中快速传导热能。
而对于导热性较差的非金属材料,其微观结构中没有活跃的电子,热能只能通过原子或分子之间的振动传递,速度较慢。
大学物理学-物质的微观结构、气体

p nkT
玻尔兹曼常数
k R 1.38 1023 J K1
分子平均平动动能
NA
k
1 mv2 2
3 kT 2
微观量的统计平均值
宏观可测量量
大学物理学
章目录 节目录 上一页 下一页
6.2 理想气体与真实气体
能量公式和温度的微观解释
温度 T 的物理意义
k
1 mv2 2
3 kT 2
1) 温度是分子平均平动动能的量度 k T(反
数密度相等,这就是阿伏伽德罗定律.
二、
有i种不同的理想气体,同储存在一个容器内,处于平衡态,
因压强均匀一致且无宏观扩散进行,混合气体分子数密度n等
于各种气体分子数密度之和。因温度均匀一致,各种分子的
平均平动动能相等,假如混合气体的压强为p,则有
p
2 3
n
k
2 3
(n1
n2
) k
p1
p2
大学物理学
映热运动的剧烈程度).
2)温度是大量分子的集体表现,个别分子无意义. 3)在同一温度下,各种气体分子平均平动动能均相等. (与第零定律一致)
热运动与宏观运动的区别:温度所反映
注意
的是分子的无规则运动,它和物体的整体运 动无关,物体的整体运动是其中所有分子的
大学物理学
一种有规则运动的表现.
章目录 节目录 上一页 下一页
V
m
m(N2 ) m(He) p(N2 ) p(He)
大学物理学
章目录 节目录 上一页 下一页
6.2 理想气体与真实气体
能量公式和温度的微观解释 例 理想气体体积为 V ,压强为 p ,温度为 T ,一 个分子 的质量为 m ,k 为玻尔兹曼常量,R 为摩尔气体 常量,则该理想气体的分子数为:
物质微观构成研究

物质微观构成研究物质的微观构成探究,一直是自然科学中的重要课题之一。
20世纪初,经过多位杰出科学家的研究,我们开始逐渐了解到了物质微观构成的本质。
本文将会探究物质微观构成的基础知识以及革命性的科学发现。
首先,我们需要了解原子结构的基本概念。
原子是指一种由原子核和电子组成的基本微粒子,是物质最基本的构成单位。
原子核由质子和中子组成,电子则绕着原子核进行旋转。
质子和中子分别带有正电荷和中性,电子则带有负电荷。
原子的质量主要由核与电子的组合数决定,不同数量的质子和中子组合成的核可以形成不同元素的原子。
例如,氧气原子中含有8个质子和8个中子,电子数目为8。
在原子模型中,一般使用电子云的概念来描述电子位置。
根据波动力学理论,在原子周围形成了电子云。
电子云是一个离散的、不连续的区域,用于解释电子的位置以及在不同的位置上出现的概率。
第二,我们需要了解分子结构和化学键的基本概念。
分子是由两个或更多的原子结合成的一种物质。
相反,一个原子不是一个分子的一部分。
化学键是一种原子之间的相互作用,用于维持化学物质的完整性。
化学键的种类多种多样,常见的包括离子键、共价键和氢键等。
离子键是由正离子和负离子之间的电荷吸引力组成的。
正离子是电子数目少于质子的离子,负离子则是电子数目多于质子的离子。
共价键则是由共享一对电子而形成的,可以进一步分为单键、双键和三键等。
而氢键是由氢原子和非金属原子之间的相互作用所产生的。
在了解了基本概念后,我们来看一些革命性的科学发现。
20世纪初期,科学家逐渐让我们了解了物质微观结构的本质。
1905年,爱因斯坦提出了光电效应理论。
“光子”这个词也由此诞生了。
据此,爱因斯坦获得了1905年诺贝尔物理学奖。
而波尔模型——一个电子在一个离子的原子核和电子云之间运动的概念——则被提出。
这个模型能够解释和计算原子束缚能、原子谱、原子大小以及其他有关原子的性质。
同时,由范德瓦尔斯引入的范德瓦尔斯相互作用的概念,也能解释一些不同于程式反应的现象,例如油脂分子间力的诱导偶极作用。
物质的微观结构27页PPT

34、春秋满四泽,夏云多奇峰,秋月 扬明辉 ,冬岭 秀孤松 。 35、丈夫志四海,我愿不知老。
谢谢你的阅读
❖ 知识就是财富 ❖ 丰富你的人生
71、既然我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德 72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗 73、坚持意志伟大的事业需要始终不渝的精神。——伏尔泰 74、路漫漫其修道远,吾将上下而求索。——屈原 75、内外相应,言行相称。——韩非
第十六章物质的微观结构
第十六章物质的微观结构二、本章教材编写说明1、内容为什么要编写本章内容?当今,人类已跨入纪元第三个1000年,自20世纪80年代以来,高新技术竞争席卷世界,使人类社会的一切领域飞速地改变着面貌。
毋容置疑,21世纪将是一个高速发展和变化的新世纪,也是人们探索、研究、设计、塑造未来的新世纪。
物理学的发展,在1900年前,是古代物理学和经典物理学的建立、发展、完成时期;1900—1930年间,是现代物理学的发展时期。
20世纪30年代以后,物理学家们向微观世界的深处推进,初步揭示了原子核构造的秘密,发现了近400种基本粒子,认识到基本粒子是组成物质的最小单位。
而且基本粒子还有内部构造,于是创立了“夸克模型”、“层子模型”。
现代人对微观领域的基本知识应当有些了解。
目前人们关心的另一大问题,就是能源。
能源是人类社会发展进步的物质基础。
现今,能源和信息、材料一起构成了现代文明的三大支柱。
世界能源的发展,正以核能为主并逐渐取代化石能源的第二次能源革命。
现代核技术的发展,已为世界能源向核能为主的转化准备了条件。
那么,什么是核能?如何获取核能?怎样利用核能?这些问题必然会引起我们的兴趣,作为21世纪的公民也必须知道这些有关人类生存的大问题。
在“课程标准”的要求中,本章的知识点不多,但却是学生不可缺少的基础知识。
在教学中务必加以重视。
本章在编写顺序上,是依照原子、原子核等物质结构层次来展开,并涉及一些基本粒子(电子、质子、中子)和核能知识的介绍,体现了人类认识微观探究过程,让学生懂得微观世界中可以认识的,从而进一步发行世界。
本章末“英语角”的标题是:利用放射性辐射观赏油画,主要内容是:利用中子轰击并观察原子核俘获中子后所产生的辐射,可用于分析画中画。
作画颜料中的不同成分有不同的半衰期。
图(a)是范∙戴克的画“圣洛萨利为巴勒莫受灾难祈祷”(注:巴勒莫是意大利港城)图(b)和(c)中的黑白图片,应用了对放射性元素衰变发射的电子敏感的特殊胶片。
6-1 物质的微观结构

第一节 物质的微观结构 第二节 理想气体分子动理论 第三节 气体分子速率分布律和能量分布律 第四节 输运过程 第五节 液体的表面现象
第一节 物质的微观结构
概 述:
热学是研究物质的热现象的理论和运动规律 的学科,是物理学的一个重要分支。
热现象:与温度有关的物理性质及状态的变化。 体积、压强、弹性等属性随温度的变化 状态的变化,如:水的凝固、汽化、蒸发 热学的研究对象: 大量微观粒子(分子或原子)所组成 的系统。
一般气体分子热运动的概念:
•分子的密度 31019 个分子/cm3 = 3千亿个分子/cm3 ; •分子热运动的平均速度约 v = 500m/s ; •分子的平均碰撞次数约 z = 1010 次/秒。 •布朗运动是杂乱运动的流体分子碰撞悬浮 其中的微粒引起的。
分子热运动的基本特征:
(1)无序性 (2)统计性
第一节 物质的微观结构
宏观量:表征大量分子的整体特征的量。如温度、 压强、体积、热容等,是实验中能测得 的量。 微观量:表征大量分子的整体中个别分子特征的物理 量。如某个分子的质量、速度、能量等,在 现代实验条件下是不能直接测得的量。
第一节 物质的微观结构
热学的分类(研究方法):
热力学 从宏观的角度来研究物质的热学性质 以及宏观过程进行的方向和限度。 研究基础: 热力学三定律 热力学第零定律、第一定律、第二定律 统计物理学 从物质的微观结构出发,根据每个粒子遵从 的基本力学规律,应用统计学的方法求出大量粒 子的一些微观量的统计平均值,揭示物质宏观现 象及规律的本质,并确立宏、微观量的联系。
的;所有分子都处在不停的无规则的运动中;分
子之间有相互作用力。这就是关于物质微观结构
的三个基本观点。
第一节 物质的微观结构
