食管癌放疗联合尼妥珠单抗(泰欣生)靶向治疗的II期临床研究
消化道肿瘤常用化疗方案

.胃肠道癌常用化疗方案:MayoClinic方案*:CF 20mg/m2 d 静推(bolus)d1-55-Fu 425mg/m2 d 静推(bolus)d1-5每28天重复,用于大肠癌。
De Gramont (LV5FU2)*:CF 200mg/m2 d 静滴2h d1-25-Fu 400mg/m2.d 静推d1-25-Fu 600mg/m2..d civ 22h/ d1-2每2周重复,适用于大肠癌及胃癌。
*上述方案为既往经典治疗方案,目前不常用FP方案:5-Fu 2500-3000mg/m2civ 120hDDP 60-75mg/m2静滴2h d1每21天重复。
适用于胃癌和食道癌。
ECF/ECX/ECS方案(表阿霉素+顺铂+5-FU/卡培他滨/替吉奥)EPI 50mg/m2iv d1DDP 60mg/m2.d 静滴2h d15-Fu 2500-3000mg/m2civ 120h或Xeloda 1000mg/m2 bid d1-14或S-1 40-60mg bid,d1-14每21天为一周期。
适用于胃癌。
EOF/EOX/EOS方案(表阿霉素+奥沙利铂+5-FU/卡培他滨/替吉奥): EPI 50mg/m2静推d1OXA130mg/m2静滴3h d15-Fu 2500-3000mg/m2civ 120h或Xeloda 1000mg/m2 bid d1-14或S-1 40-60mg bid,d1-14每21天为一周期,用于胃癌。
XELOX(奥沙利铂+ 卡培他滨):OXA130mg/m2静滴3h d1(可总量分d1d8给予)Xeloda 1000mg/m2 bid d1-14每21天为一周期,适用于胃癌和大肠癌。
FOLF0X4方案:OXA 85mg/m2静滴2h d1CF 200mg/m2 d 静滴2h d1-25-Fu 400mg/m2 d 静推d1-25-Fu 600mg/m2 d civ 22h d1-22周为一周期重复。
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自行缓解,未影响治疗皮疹 1.43%- 1.43%自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效观察

尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效观察李赓;游雁;高健全【摘要】目的:探讨尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效.方法:选取2016年2月—2017年5月我院收治的35例局部晚期鼻咽癌(Ⅲ~Ⅳa 期)患者,随机分为对照组15例和试验组20例.对照组采取同步放、化疗治疗,试验组采取尼妥珠单抗联合同步放、化疗治疗,比较两组患者的近期疗效及不良反应严重程度.结果:治疗后1个月,试验组的临床疗效明显高于对照组(P<0.05);治疗期间两组患者不良反应严重程度比较差异无统计学意义(P>0.05),且未见影响治疗的严重不良反应发生.结论:尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效确切,安全有效,其远期疗效有待进一步观察.【期刊名称】《医学理论与实践》【年(卷),期】2019(032)001【总页数】3页(P56-58)【关键词】局部晚期鼻咽癌;同步放化疗;尼妥珠单抗;近期疗效【作者】李赓;游雁;高健全【作者单位】广西梧州市红十字会医院 543002;广西梧州市红十字会医院 543002;广西梧州市红十字会医院 543002【正文语种】中文【中图分类】R739.6鼻咽癌是一种常见的头颈部恶性肿瘤,其局部侵蚀力强,呈浸润性生长且恶性程度高,可直接侵犯周围及邻近的组织器官,具有淋巴结转移发生早、转移率极高的特点[1-2]。
该疾病发病部位深,早期症状缺乏特异性而难以诊断,约75%的患者确诊时已属中晚期[3-4]。
以往放射治疗是鼻咽癌的首选治疗方式,但由于晚期患者局部复发率和远处转移率较高,常规放疗效果欠佳[5]。
目前同期放化疗已成为治疗局部晚期鼻咽癌的标准模式,其疗效显著优于单纯放疗,大大提高了总生存率,但降低了患者机体免疫力,毒副反应亦明显增加,而近年来新兴的分子靶向治疗则有效提高了放化疗的疗效[6-7]。
尼妥珠单抗为一种新型抗EGFR单克隆抗体,张星霖等发现尼妥珠单抗联合放疗治疗晚期鼻咽癌的近期疗效好,且未增加不良反应,临床耐受性好[8]。
泰欣生(尼妥珠单抗注射液)说明书

泰欣生(尼妥珠单抗注射液)说明书【泰欣生药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumablnjection汉语拼音:NiTuoZhuDanKangZhusheye【泰欣生成份】每支10mL含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【泰欣生性状】外观澄清、无色无味,无不溶物的液体。
【泰欣生适应症】泰欣生与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用泰欣生前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用泰欣生。
检验操作应由熟练掌握EGFR检测试剂盒检测技术的实验室完成。
检验中的某些失误,如使用较差的组织样本、未能严格遵从操作规程、使用不当的对照等均可能导致不可靠的结果。
【泰欣生规格】13.5毫升西林瓶装量10毫升(±0.5毫升),尼妥珠单抗浓度为5mg/mL,每支含50毫克。
【泰欣生用法用量】100mg尼妥珠单抗稀释于250ml生理盐水中,前臂静脉输液给药,进药过程在60分钟以上。
次给药时间为放射治疗的天,于放疗前完成,以后每周一次,共8次。
患者同时接受标准的鼻咽癌放射治疗。
【泰欣生不良反应】该药物的不良反应主要表现为发热、血压下降、恶心、头晕、皮疹。
在70例晚期鼻咽癌患者中进行的Ⅱ期临床试验中发现,用药后发热的发生率为4.28%,体温39℃,对症处理后缓解,不影响治疗;血压下降,头晕发生率2.86%,达80/50mmHg,休息后缓解,不影响治疗;恶心发生率为1.43%,轻度,可自行缓解,不影响治疗;头晕发生率2.86%,时有头晕,可自行缓解,不影响治疗;皮疹发生率1.43%,轻度,可自行缓解,不影响治疗。
在古巴和加拿大进行的临床试验发现该药常见的不良反应有发热、寒颤、恶心、呕吐、发冷、贫血、血压降低。
不常见的不良反应有肌肉痛、运动语言障碍、口干、潮红、下肢无力、嗜睡、丧失方向感、肌酐水平升高、白细胞减少、血尿、胸痛、口腔绀紫。
肿瘤科诊疗规范

肿瘤科诊疗规范第一部分常见恶性肿瘤诊疗常规第一节鼻咽癌【病史采集】1.有无耳鼻症状如鼻塞、鼻出血或回缩性血涕、耳鸣及听力下降等。
2.有无上颈部无痛性进行性增大的肿块。
3.有无头痛。
头痛部位多位于颞顶部、顶枕部、额部或普遍性头痛,常呈持续性钝痛。
4.有无颅神经受累,常以Ⅲ、Ⅳ、Ⅴ、Ⅵ对神经受累多见。
5.询问与鼻咽癌发病可能的相关因素,如遗传因素、地理环境与生活习惯、某些化学致癌物质刺激及某些微量元素摄入不平衡(高镍饮食)等。
【体格检查】1.头颈部检查:应检查鼻腔、口咽、外耳道、鼓膜、眼眶、软腭有癌肿向外扩展。
2.眼部检查:是否有视力减退或丧失、突眼、眶内肿块、上睑下垂伴眼球固定。
3.颈部淋巴结检查:是否有单侧或双侧颈淋巴结肿大。
4.颅神经检查:是否有颅神经受累的表现。
5.全身检查:有无远隔部位转移的表现。
远处转移常以骨、肺、肝等部位多见。
【辅助检查】1.间接鼻咽镜或纤维鼻咽镜检查。
2.鼻咽部活组织检查。
3.鼻咽及颈部肿块针吸细胞学检查。
4.影像诊断学检查,如鼻咽部CT或MRI检查、鼻咽侧位及颅底片等。
5.EB病毒血清免疫学检查,如VCA - IgA和EA - IgA测定。
【诊断要点】1.对有头痛、耳鼻症状和颈淋巴结肿大等三大症状或其中之一者,需作鼻咽部检查,以排除鼻咽癌。
2.鼻咽部检查发现鼻咽肿物、溃疡坏死、出血等异常病变。
3.鼻咽部活组织检查是确诊依据。
鼻咽涂片脱落细胞检查可作辅助诊断,但不能单独作为确诊的依据。
4.鼻咽或颈部肿块细针穿刺检查找到癌细胞。
5.EB病毒血清免疫学检查,对确诊有重要的参考价值。
6.影像诊断学检查,有助于确定病变范围。
7.病理学分类:分为高分化鳞癌、低分化鳞癌(其中包括泡状核细胞癌)、未分化癌和其它类型的癌四种类型。
8.临床分型:(1)根据肿瘤生长形态分为浸润型、菜花型、结节型和溃疡型。
(2)根据肿瘤生长特点分为上行型、下行型和混合型。
【临床分期】采用1992年福州会议推荐的“92分期”TNM标准:T1:局限于鼻咽鼻腔内。
《肝癌的靶向治疗》PPT课件

精品医学
10
抗血管生成制剂
血管生成,即新生血和管形成的过程,被认为是肿瘤 生长的关键因素,不仅为肿瘤提供营养和氧气,更是 肿瘤细胞进入系统循环和转移的通路。1971年, Folman教授就提出肿瘤生长依赖于血管形成学说,并 认为肿瘤的血管发生有可能成为抗肿瘤治疗的靶点。 肝癌是典型的富血管肿瘤,肝内丰富的血管及血分支 为肝癌细胞产生的肿瘤 血管生成促进因子发挥诱导血 管内皮细胞迁移、增殖及生成肿瘤血管作用提供了良 好的基础。同时残留在肝癌组织内的血管通过“肿瘤 化”而产生的新生肿瘤血管数目也较多,因此抗肿瘤 血管生成对于分子靶向治疗具有很大的实用性。
肝癌的靶向治疗
251医院 赵增虎
精品医学
1
原发性肝癌是临床上常见的消化系统恶性肿瘤之一, 其中90%为肝细胞癌,在世界范围内发病率呈现上升 趋势,在我国发病率98.9/10万人,仅次于肺癌居第二 位。在导致HCC的多项危险中,HBV、HCV感染和酒 精分别依次位前三位。我国发病人数占全球55%,死 亡人数占45%。
肝癌起病隐袭,早期诊断困难,大多数患者确诊时 已中晚期,晚期肝癌治疗棘手,死亡率高,中位生存 期仅3-6个月,素有“癌中之王”称号,虽然介入栓塞 化疗、全身化疗及射频消融等各种治疗手段被广泛应 用于临床,但对患者生存期改善还很有限,且远期疗 效较差,目前尚无标准的治疗方法。
精品医学
2
迈入21世纪后,肿瘤的治疗已进入分子靶 向治疗新时代。所谓分子靶向治疗就是针对肿 瘤发生、发展过程中的关键大分子包括参与肿 瘤发生发展过程中的关键传导和其他生物学途 径的重要靶点(参与肿瘤细胞分化、周期调控、 凋亡、浸润和转移等过程中,从DNA至蛋白、 酶水平的任亚细胞分子),通过特异性阻断肿 瘤细胞的信号转导,来控制其基因表达和改变 生物学行为,或是通过强力阻止肿瘤血管生成, 从而抑制肿瘤细胞的生长和增殖,积极发挥抗 肿瘤作用。
食管癌免疫检查点抑制剂临床应用全程管理专家共识_随笔

《食管癌免疫检查点抑制剂临床应用全程管理专家共识》读书笔记目录一、内容概述 (2)二、免疫检查点抑制剂简介 (3)1. 免疫检查点的概念 (4)2. 免疫检查点抑制剂的种类 (4)3. 免疫检查点抑制剂的作用机制 (5)三、食管癌免疫检查点抑制剂的临床应用 (7)1. 食管癌的免疫治疗进展 (8)2. 免疫检查点抑制剂在食管癌中的疗效分析 (9)3. 免疫检查点抑制剂治疗食管癌的安全性评估 (10)四、免疫检查点抑制剂全程管理策略 (12)1. 免疫检查点抑制剂的适应症与禁忌症 (13)2. 治疗方案的选择与优化 (14)3. 药物剂量与给药时间的调整 (16)4. 疗效监测与不良反应处理 (17)5. 靶向联合治疗策略 (18)五、免疫检查点抑制剂全程管理的实践指导 (19)1. 医患沟通与教育 (21)2. 患者随访与生活质量评估 (22)3. 数据管理与分析 (24)4. 跨学科合作与团队协作 (25)六、总结与展望 (26)1. 免疫检查点抑制剂在食管癌治疗中的应用前景 (28)2. 未来研究方向与挑战 (30)一、内容概述我有幸阅读了《食管癌免疫检查点抑制剂临床应用全程管理专家共识》深感其对于我们临床医生在食管癌免疫治疗领域的指导意义。
本文详细阐述了免疫检查点抑制剂的原理、适应症、治疗方案以及全程管理策略,为食管癌患者提供了更为精准和有效的治疗方案。
文章首先介绍了免疫检查点抑制剂的工作机制,即通过解除肿瘤细胞对免疫系统的抑制,恢复或增强患者的免疫应答,从而达到杀伤肿瘤的目的。
文章根据最新的临床研究和实践经验,明确了免疫检查点抑制剂在食管癌治疗中的应用范围,包括一线治疗、二线治疗以及后线治疗等不同阶段。
在治疗方案方面,文章提出了根据患者具体情况选择合适的免疫检查点抑制剂组合,如PD1抑制剂与CTLA4抑制剂的联合应用,以及与其他药物的序贯治疗等。
文章还强调了在治疗过程中监测患者免疫相关不良反应的重要性,并提供了相应的处理建议。
药物说明书drins-尼妥珠单抗-百泰

对本品或其任一组份过敏者禁用。
【注意事项】
本品应在具有同类药品使用经验的临床医师指导下使用,并具备相应抢救措施。 冻融后抗体的大部分活性丧失,故本品在储存和运输过程中严禁冷冻。本品稀释于生理盐水后,在2℃-8℃可保持稳定12小时,在室温下可保持稳定8小时。如稀释后储存超过上述时间,不宜使用。 应由熟练掌握EGFR检测技术的专职人员进行EGFR表达水平的检验。检验中若出现组织样本质量较差、操作不规范、对照使用不当等情况,均可导致结果偏差。
尼妥珠单抗注射液
说明书来源: 百泰生物药业有限公司
【药品名称】
通用名称:尼妥珠单抗注射液 英文名称:NimotuzumabInjection 商品名称:泰欣生
【成份】
每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】
本品为无色澄明液体。
【适应症】
试用于与放疗联合治疗表皮生长因子受体 (EGFR) 表达阳性的III/IV期鼻咽癌。
【规格】
50mg/瓶(10mL)。
【用法用量】
将两瓶 (100mg) 尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。首次给药应在放射治疗的第一天,并在放射治疗开始前完成。之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【老年用药】
在70例接受尼妥珠单抗注射液联合放射治疗的患者中,4例(5.7%)年龄在65岁或以上。尚未确定老年患者使用本品安全性和疗效方面的特殊性。
【药物相互作用】
尚缺乏本品与其它药物相互作用的数据。
探讨尼妥珠单抗注射液联合放疗对复发鼻咽癌的效果

探讨尼妥珠单抗注射液联合放疗对复发鼻咽癌的效果发布时间:2022-03-11T01:56:49.828Z 来源:《世界复合医学》2022年1期作者: 1宁春玉 2韦燕 3张芸 4林小梅[导读] 探讨尼妥珠单抗注射液联合放疗对复发鼻咽癌的效果。
1宁春玉 2韦燕 3张芸 4林小梅贵港市人民医院肿瘤科广西贵港 537100【摘要】目的:探讨尼妥珠单抗注射液联合放疗对复发鼻咽癌的效果。
方法:选取我院所收治的复发鼻咽癌患者100例,研究时间为2015年3月到2019年9月,将其随机分为研究组(n=50)和对照组(n=50),对照组患者接受放射治疗,研究组患者接受尼妥珠单抗注射液联合放射治疗,对比不同治疗方案的治疗效果。
结果:研究组患者的治疗总有效率为84.0%(42/50),对照组患者的总有效率52.0%(26/50),研究组患者的治疗有效率明显高于对照组(X2=11.76,P<0.01);两组患者在治疗前血管内皮生长因子(VEGF)、转化生长因子(TGF-β1)对比无统计学差异(P>0.05),治疗后,研究组患者VEGF(186.45±23.51)pg/ml、TGF-β1(20.13±5.30)μg/ml明显低于对照组(213.87±23.14)pg/ml、(36.18±4.54)μg/ml(t=5.878、16.232,P<0.001);通过对比两组患者的不良反应发生率,研究组、对照组患者不良反应发生率分别为52.0%(26/50)、64.0%(32/50),组间对比无统计学差异(X2=1.48,P>0.05)。
结论:对于复发鼻咽癌患者采取尼妥珠单抗注射液联合放疗治疗,可获取显著的疗效,疗效明显优于单纯放疗,可降低VEGF、TGF-β1,用药安全,患者更耐受,是一种有效的治疗方案,值得临床上推广及应用。
【关键词】尼妥珠单抗注射液;放疗;复发鼻咽癌;效果To investigate the effect of nituzumab injection combined with radiotherapy on recurrent nasopharyngeal carcinomaNing Chunyu Wei Yan Zhang Yun Lin Xiaomei(Oncology Department of Guigang Municipal People’s Hospitall,Guigang City,Guangxi Province 537100)【 Abstract 】 Objective: To explore the effect of nimotuzumab injection combined with radiotherapy on recurrent nasopharyngeal carcinoma . Methods: A total of 100 patients with recurrent nasopharyngeal carcinoma admitted to our hospital were selected.The study period was from March 2015 to September 2019 . They were randomly divided into a study group(n=50) and a control group (n=50). Patients in the control group received radiotherapy,and patients in the study group received nittozumab injection combined with radiotherapy to compare the therapeutic effect of different treatment Plans. Results The effective rate of treatment in the study group was 84%(42/50), and the effective rate in the control group was 52.0% (26/50). The effective rate of treatment in the study group was significantly higher than that in the control group (X2=11.76, P < 0.001). There was no significant difference in the comparison of vascular endothelial growth factor (VEGF) and transforming growth factor (TGF-β1) between the two groups before treatment (P > 0.05). After treatment, the study group had VEGF (186.45±23.51) pg/mL , TGF-β 1 (20.13±5.30) μ g/mL was significantly lower than the control group (213.87±23.14)pg/ml/, (36.18±4.54) μ g/mL (t =5.878, 16.232, P < 0.001): The incidence of adverse reactions in the study group and the control group were 52.0%(26/50) 64.0%(32/50), There was no statistical difference between the groups (X2=1.48, P > 0.05). Conclusion: For patients with recurrent nasopharyngeal carcinoma, taking Nittozumab injection combined with radiotherapy can obtain significant curative effect. The curative effect is significantly better than that of radiotherapy alone, It can reduce VEGF and TGF-β1, It is safe to use and more tolerated by patients. An effective treatment plan is worthy of clinical promotion and application.[Keywords] antibiotics for special use;inpatients;rational drug usenimotuzumab injection;Radiotherapy; Recurrent nasopharyngeal carcinoma; Effect鼻咽癌是头颈部一种常见的恶性肿瘤,具有较高的发病率,主要症状表现为头痛、鼻塞、涕中带血、耳闷堵感,甚至侵犯邻近组织及出现远处转移,严重威胁患者的生命安全[1]。
泰欣生说明书终审稿)

泰欣生说明书文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-规格 50mg/瓶(10mL)瓶【泰欣生功效】尼妥珠单抗注射液;泰欣生(尼妥珠单抗注射液)治疗鼻咽癌及其他肿瘤的单抗药.【简述】泰欣生(尼妥珠单抗注射液)与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品。
本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显着,不良反应轻微。
【泰欣生药理作用】【泰欣生临床疗效】【泰欣生不良反应】【其它】【商品名】泰欣生【通用名】尼妥珠单抗注射液【英文名】Nimotuzumab Injection【汉语拼音】Nituozhudankang Zhusheye【成份】每支10ml含50mg尼妥珠单抗(人源化抗人表皮生长因子受体单克隆抗体)、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应证】本品与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品。
本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显着,不良反应轻微。
【用法用量】100或200mg泰欣生(尼妥珠单抗)稀释于250ml生理盐水中静脉滴注,输液进药过程在60分钟以上,每周1次,共8次,患者同时接受标准的放、化疗【药理作用】泰欣生(尼妥珠单抗)能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号传导通路和细胞学效应,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管生成,抑制肿瘤细胞浸润和转移,增强放、化疗疗效。
药理研究:EGFR是分子量为170KD的跨膜糖蛋白,其胞内区具有特殊的酪氨酸激酶活性。
尼妥珠单抗注射液说明书--泰欣生
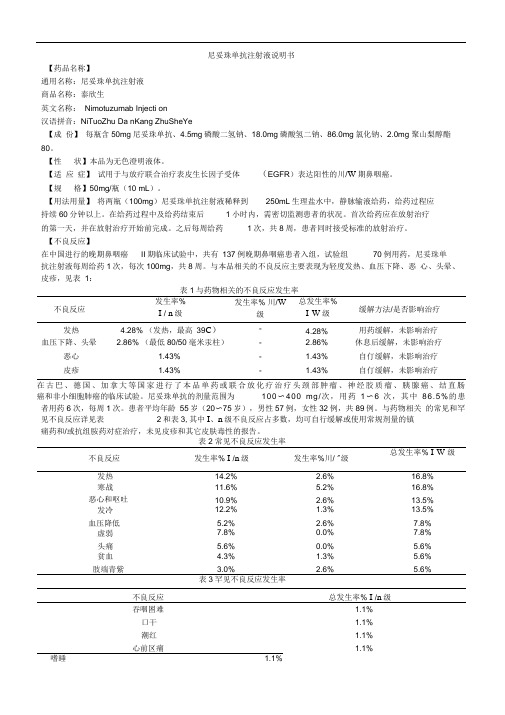
尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injecti on汉语拼音:NiTuoZhu Da nKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg 聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的川/W期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1与药物相关的不良反应发生率不良反应发生率%I / n级发生率% 川/W级总发生率%I-W级缓解方法/是否影响治疗发热 4.28% (发热,最高39C)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86% (最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自仃缓解,未影响治疗皮疹 1.43%- 1.43%自仃缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100〜400 mg/次,用药1〜6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20〜75岁),男性57例,女性32例,共89例。
尼妥珠单抗及西妥昔单抗增强照射对人食管癌细胞系的作用

on
human esophageal carcinoma cells Yongqiang,Meng Lingling,Fens
School
ring,Ma Lin,Qu
Baolin,Li
Jianxiong,Lan
Yuling,Ynng
Linchun.P叫General
Hospital
Cancer Center and Department
evaluated by
was
radiosensitivitv
was
determined
by
clonogenic
assay and the survival
were
curve
fitted
with
multi—targets single-hit model,and cell cycle distribution and apoptosis
Irradiation
放射治疗是食管癌的主要治疗手段之一。目 前,食管癌5年生存率仍低于20%…,部分原因是 肿瘤细胞对放射线抗拒从而降低了照射效果。因
此,如何增强肿瘤的放射敏感性、提高疗效成为放 射治疗食管癌的研究热点。研究表明,表皮生长因 子受体(EGFR)在人类多种实体瘤组织中过度表 达,且其表达异常与肿瘤增殖、分化、血管形成、侵 袭转移和放化疗抵抗有关。“1。食管鳞癌EGFR的 表达率为40%~80%,属中高水平表达p。。。在大 部分EGFR高表达的肿瘤中,尼妥珠单抗及西妥昔
50 v,g/ml[1¨引。
胞存活曲线,并计算细胞放射敏感性参数包括平均 致死剂量(D。)、准阈剂量(D。)、外推值(J7、r)、照射
2
Gy时的细胞存活分数(SF:)和放射增敏比 5.细胞周期分布及细胞凋亡实验:将对数生长
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg 聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28% 用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86% 休息后缓解,未影响治疗恶心 1.43% - 1.43% 自行缓解,未影响治疗皮疹 1.43% - 1.43% 自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书之答禄夫天创作【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成分】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80.【性状】本品为无色澄明液体.【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌.【规格】50mg/瓶 (10 mL).【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中, 静脉输液给药, 给药过程应继续60分钟以上.在给药过程中及给药结束后1小时内, 需密切监测患者的状况.首次给药应在放射治疗的第一天, 并在放射治疗开始前完成.之后每周给药1次, 共8周, 患者同时接受标准的放射治疗.【不良反应】在中国进行的晚期鼻咽癌II期临床试验中, 共有137例晚期鼻咽癌患者入组, 试验组70例用药, 尼妥珠单抗注射液每周给药1次, 每次100mg, 共8周.与本品相关的不良反应主要暗示为轻度发热、血压下降、恶心、头晕、皮疹, 见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热4.28% (发热, 最高39℃)- 4.28% 用药缓解, 未影响治疗血压下降、头晕2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解, 未影响治疗恶心 1.43% - 1.43% 自行缓解, 未影响治疗皮疹 1.43% - 1.43% 自行缓解, 未影响治疗在古巴、德国、加拿年夜等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验.尼妥珠单抗的剂量范围为100~400 mg/次, 用药1~6次, 其中86.5%的患者用药6次, 每周1次.患者平均年龄55岁(20~75岁), 男性57例, 女性32例, 共89例.与药物相关的罕见和罕见不良反应详见表2和表3, 其中Ⅰ、Ⅱ级不良反应占大都, 均可自行缓解或使用惯例剂量的镇痛药和/或抗组胺药对症治疗, 未见皮疹和其它皮肤毒性的陈说.表2 罕见不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级发热14.2% 2.6% 16.8%寒战11.6% 5.2% 16.8% 恶心和呕吐10.9% 2.6% 13.5% 发冷12.2% 1.3% 13.5% 血压降低 5.2% 2.6% 7.8% 虚弱7.8% 0.0% 7.8%头痛 5.6% 0.0% 5.6%贫血 4.3% 1.3% 5.6% 肢端青紫 3.0% 2.6% 5.6%表3 罕见不良反应发生率不良反应总发生率%Ⅰ/Ⅱ级吞咽困难 1.1%口干 1.1%潮红 1.1%心前区痛 1.1%嗜睡 1.1%定向障碍 1.1%肌痛 1.1%血尿 1.1%转氨酶升高 1.1%肌苷升高 1.1%【禁忌】对本品或其任一组份过敏者禁用.【注意事项】本品应在具有同类药品使用经验的临床医师指导下使用, 并具备相应抢救办法.1.冻融后抗体的年夜部份活性丧失, 故本品在贮存和运输过程中严禁冷冻.本品稀释于生理盐水后, 在2~8℃可坚持稳定12小时, 在室温下可坚持稳定8小时.如稀释后贮存超越上述时间, 不宜使用.2.应由熟练掌握EGFR检测技术的专职人员进行EGFR表达水平的检验.检验中若呈现组织样实质量较差、把持不规范、对比使用不妥等情况, 均可招致结果偏差.【孕妇及哺乳期妇女用药】本品可透过胎盘屏障, 研究提示EGFR 与胎儿组织分化、器官形成有关, 故孕妇或没有采用有效避孕办法的妇女应慎用.本品属于IgG1类抗体, 由于人IgG1能够分泌至乳汁, 建议哺乳期妇女在本品治疗期间以及在最后一次给药后60天内停止哺乳.【儿童用药】尚未确定18岁以下儿童使用本品的平安性和疗效.【老年用药】在70例接受尼妥珠单抗注射液联合放射治疗的患者中, 4例(5.7%)年龄在65岁或以上.尚未确定老年患者使用本品平安性和疗效方面的特殊性.【药物相互作用】尚缺乏本品与其它药物相互作用的数据.【药物过量】在每人每次200mg~400mg剂量下可以耐受, 目前尚未获得使用超越400mg剂量时的平安性数据.【临床试验】Ⅰb期临床试验:由中国医学科学院肿瘤医院完成, 该试验分为50mg、100mg、200mg三个剂量组, 每组3例晚期鼻咽鳞状细胞癌患者, 每周1次, 8周为一个疗程.9例可评估患者用药后主要不良反应为:2例呈现Ⅰ度发热;5例呈现一过性的低热, 未经处置自行恢复正常;1例呈现Ⅰ度体重下降.未见低血压、皮疹、肌痛、头痛、寒战、定向障碍、呕吐及血尿等不良反应.Ⅱ期临床试验:由中国医学科学院肿瘤医院负责, 全国共7所新药临床试验基地共同介入完成了随机、开放、多中心临床试验.共137例晚期鼻咽鳞状细胞癌(Ⅲ期或ⅣA-B期)患者入组, 免疫组化法检验均为EGFR中高表达.全部患者随机分为试验组和对比组, 试验组70例患者接受尼妥珠单抗联合根治性放射治疗.用药方法为尼妥珠单抗注射液每次100mg, 第一次给药时间在放射治疗的第一天, 并在开始进行放射治疗前完成.之后每周给药1次, 共8周(与放疗同步结束).对比组67例患者接受纯真根治性放射治疗.研究结果:比力治疗前、治疗中(50Gy)、治疗结束及治疗后第5周和第17周的辅助检查(包括鼻咽MRI、颈部和腹部B超、胸部正侧位X线片)结果, 根据WHO实体瘤疗效评价标准, 于治疗结束、治疗后第5周和第17周分别对原发灶和颈部转移淋凑趣进行疗效评价.1. 肿瘤完全缓解率(CR率):137例患者中, 130例可评估, 试验组肿瘤CR率与对比组相比显示出不同(表4).表4 试验组与对比组CR率比力(%)组别例数治疗结束治疗后5周治疗后17周原发灶淋凑趣总评价原发灶淋凑趣总评价原发灶淋凑趣总评价试验组64对比组66P值** 秩和检验2. 肿瘤有效率(CR+PR):治疗后第17周, 试验组有效率为100.00%, 对比组为90.91%, 显示出不同(P=0.02).3. 卡氏评分(Karnofsky)和体重变动观察:本试验对治疗前后的卡氏评分和体重变动进行了检测.于治疗结束、治疗后第5周和第17周3个观测点, 试验组和对比组卡氏评分未显示出不同(P>0.05, 表5).治疗结束、治疗后第5周, 试验组和对比组体重下降未显示出不同(P值分别为0.930和0.082), 而治疗后第17周, 试验组患者的体重恢复比对比组明显(P=0.026, 表5).表5组别例数卡氏评分(分)体重下降(kg)**治疗结束疗后5周疗后17周治疗结束疗后5周疗后17周试验组70对比组67P值** 秩和检验 ** 指治疗过程中的体重下降4. 三年随访生存结果:表6 三年随访生存结果入组病例死亡失访存活存活率平均生存时间(月)(例)(例)(例)(例)(%)试验组70 5 6 59 (59/70)对比组67 11 4 52 77.61(52/67)P值(Log-rank) - - - - -该临床试验的五年随访尚在进行中.【药理毒理】药理研究:EGFR是一种跨膜糖卵白, 分子量为170KD, 其胞内区具有特殊的酪氨酸激酶活性.体内和体外研究显示, 尼妥珠单抗可阻断EGFR与其配体的结合, 并对EGFR过度表达的肿瘤具有抗血管生成、抗细胞增殖和促凋亡作用.毒理研究:对小鼠和绿猴进行尼妥珠单抗的单次给药急性毒性试验, 剂量分别为 1.42 mg /kg、7.14 mg /kg、28.57 mg /kg、57 mg /kg, 相当于人用剂量的0.85倍至34倍, 未见毒性反应, 单剂量重复给药试验未见毒性迹象.绿猴体内6个月的长期毒性试验, 剂量分别为3.3 mg /kg和33 mg /kg, 相当于人用剂量的2倍和20倍, 血生化、心电图、体重、各器官病理组织学检查均未见异常, 未见长期静脉注射所招致的植物皮肤损害.对小鼠和家兔进行的局部耐受性试验, 注射局部未见静脉安慰反应.用成人分歧组织的冰冻切片进行交叉反应试验, 显示尼妥珠单抗和人体组织(如心脏、血管、肾脏和肺)无交叉反应.尚未进行致癌、致突变和生殖损害的特殊毒性研究.【药代动力学】以下数据来自国外研究.对12例古巴晚期恶性肿瘤患者进行了药代动力学观察, 其中女性11例, 男性1例, 平均年龄59.33岁, 卵巢癌患者4例、乳腺癌患者4例、肺癌患者2例、胃癌患者1例、肾癌患者1例, 静脉注射50mg、100mg、200mg和400mg尼妥珠单抗, 其对应的清除半衰期分别为62.92、82.60、302.95和304.52小时.用药后24小时内, 分歧剂量尼妥珠单抗经尿排出量占注射剂量(ID)的比例分别为:50mg排出21.08%, 100mg排出28.20%, 200mg排出27.36%, 400mg排出33.57%.本品在人体内生物学分布的主要器官为肝脏、脾脏、心脏、肾脏和胆囊, 其中肝脏摄取量最高.植物药代动力学数据证实给药后24小时肿瘤组织药物浓度最高.尚缺乏本品在中国人群中进行药代动力学的研究数据.【贮藏】本品在2~8℃贮存和运输, 不得冷冻.【包装】硼硅玻璃管制注射剂瓶, 1瓶/盒.【有效期】 24个月.。
伊尼妥单抗后线治疗DS-8201_经治失败的HER2_阳性乳腺癌1_例报告

CHINA MEDICINE AND PHARMACY Vol.14 No.8 April 2024195伊尼妥单抗后线治疗DS-8201经治失败的HER2阳性乳腺癌1例报告金奕滋 林明曦 张 剑▲复旦大学附属肿瘤医院肿瘤大内科 复旦大学附属肿瘤医院Ⅰ期临床试验病房复旦大学上海医学院肿瘤学系,上海 200032[摘要]抗人表皮生长因子受体2(HER2)治疗是HER2阳性晚期乳腺癌患者的标准治疗。
针对患者在多线抗HER2治疗耐药后的治疗策略仍然在探索中。
本文报道1例乳腺癌术后多发转移患者,辅助治疗及一线治疗采用以曲妥珠单抗为基础的治疗方案,后经历多线抗HER2治疗失败,包括以吡咯替尼为基础的治疗、抗体偶联药物(ADC)治疗(A166、DS-8201)等。
在第七线时应用伊尼妥单抗联合优替德隆及吉西他滨治疗。
患者症状在第一次疗效评价时即达到部分缓解。
随访至2023年4月,患者无疾病进展生存期已10个月。
伊尼妥单抗联合优替德隆及吉西他滨应用于该例DS-8201经治失败的HER2阳性晚期乳腺癌患者依然具有良好疗效。
[关键词]伊尼妥单抗;优替德隆;吉西他滨;DS-8201;抗HER2治疗;HER2阳性乳腺癌[中图分类号] R737.9 [文献标识码] A [文章编号] 2095-0616(2024)08-0195-04DOI:10.20116/j.issn2095-0616.2024.08.47A case report of HER2-positive breast cancer with failed treatment of DS-8201 with post treatment with InitumumabJIN Yizi LIN Mingxi ZHANG JianDepartment of Medical Oncology, Fudan University Shanghai Cancer Center, Phase ⅠClinical Trial Center, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China[Abstract] Anti-human epidermal growth factor receptor 2 (HER2) therapy is the standard treatment for patients with advanced breast cancer with positive HER2. The treatment strategy for patients who are resistant to multi-line anti-HER2 therapy is still being explored. A case of breast cancer with multiple metastases after operation is reported in this paper. The adjuvant therapy and first-line therapy are based on trastuzumab, and then fail to receive multi-line anti-HER2 therapy, including the treatments based on pyrrolitinib and antibody-drug conjugates (ADC) therapy (A166, DS-8201), etc. Initumumab combined with Utedelon and Gemcitabine is applied in the seventh line. The patient achieves partial remission at the first efficacy evaluation. Follow-up until April 2023 showed the patient’s disease-free survival time has been 10 months. Initumumab combined with Utedelon and Gemcitabine still has good efficacy on this case of HER2 positive advanced breast cancer who fails to be treated by DS-8201.[Key words] Initumumab; Utedelon; Gemcitabine; DS-8201; Anti-HER2 therapy; HER2 positive breast cancer▲通讯作者根据2022年国家癌症中心报道,乳腺癌每年新发病例数约30.6万例,发病率位居女性癌症第一[1]。
泰欣生治疗头颈部肿瘤临床试验方案

第11页
放疗调整
据CTCAEv3.0进行不良反应评价和分级 血液学毒性
放疗进行 ANC≥1.0X109 /L(或WBC ≥2X109 /L,ANC不可得时) PLT ≥50X109 /L 非血液学毒性 不良反应处理 如食欲下降,粘膜炎,皮肤反应等 研究者可依据各中心临床实践进行处理 中止放疗 4级不良反应或表现为严重放疗不良反应时(由临床医生判断)
第4页
入选标准(11条)
自愿参加并书面签署知情同意书 年纪18—70岁,性别不限 组织学确诊为鳞癌 分期为III、IV期下咽癌、口咽癌和喉癌 原发肿瘤可测量 卡氏评分>70
泰欣生治疗头颈部肿瘤临床试验方案
第5页பைடு நூலகம்
入选标准
生存预期≥6个月 生育期女性应确保在进入研究期间避孕 血常规:HGB≥100 g/L, WBC≥4×109 /L,
− IgG1型单克隆抗体,分子量为150KD − 人源化程度达95%,大大降低HAMA
(人抗鼠抗体)反应几率。 − 相对中等亲协力水平(Kd=10-9),
高选择性抑制肿瘤细胞。 − 药代动力学优异,200mg半衰期更长
, AUC更大。
泰欣生治疗头颈部肿瘤临床试验方案
第2页
研究目标
主要目标
3个月后肿瘤局部与区域控制率 尼妥珠单抗联合放化疗安全性
同期化疗周期取决于放射治疗实际时间长短。假 如放射治疗时间延长至≥6周,则能够给予第三个 周期同期化疗。每个患者最多给予三个周期同期 化疗。一旦放疗结束,即结束顺铂单药化疗
泰欣生治疗头颈部肿瘤临床试验方案
第14页
剂量调整
同期化疗时血液学毒性剂量调整:
顺铂剂量水平: -2/(D×60%mg/m2) -1/(D×80%mg/m2) 初始剂量/(D×mg/m2)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
病例 方案 数
80 6 36 27 gefinitib+cis/5Fu/ RT--S gefitinib+oxali/RT gefitinib gefitinib
期别
局部晚 期 局部晚 期 转移 转移 转移 27局部 10转移
ORR TTP 或pCR
OS
3-y 40%
33% 3% 11%
8.4月 2月 1.9月
EGFR过度表达
EGFR在多 EGFR参与 种肿瘤中过 肿瘤细胞 的增殖、 度表达
分化和凋 亡的调控
过度表达与 肿瘤细胞的 侵袭和转移 以及不良预 后显著相关
2011年CSCO年会
厦门
抑制细胞放疗后损伤的修复 放射损伤加重
抑制EGFR信号传 导系统多环节的 磷酸化, 减少肿瘤 细胞的增殖和加 减少肿瘤 速再增殖。放射 再群体化 效应增加 (放射直 接激活EGFR-TK 信号)
2011年CSCO年会
作者
组织学类型
病例 数
25 18 13 24 24 8 38
方案
期别
ORR 或 pCR
0% 10% 17% 27% 87.5% 37.5%
TT P
OS
Hecht IIson Dawson Ku Gang Li Pande Wilkinso n
12E13GEJ 腺癌 7E11GEJ 腺癌 10腺癌 3鳞癌 22E+GEJ腺癌 2鳞癌 鳞癌 腺癌 腺癌
期别 ORR或 pCR
局部 晚期 局部 晚期 局部 晚期 局部 晚期 局部 晚期 13% 27% 32% 40% 36%
TTP
OS
Ruhstal 15E+GEJ ler 13鳞癌 De Vita Agrawa la 9腺癌 18鳞癌 20E11GEJ 9鳞癌
Lorenz en
Gold
鳞癌
E+GEJ 腺癌 厦门
黄晓东, 徐国镇, 高黎等. 中华肿瘤杂志, 2007, 29: 197-201.
2011年CSCO年会 厦门
Survival Functions
1.0
Nimo+放疗:84.29%
group
0.8
对照组 试验组 对照组-c 试验组-c
Cum Survival
0.6
放疗:77.61%
0.4
0.2
0.0 0.00 10.00 20.00 30.00 40.00 50.00
M. S. Ramakrishnan,et ndes Bioscience, mAbs 1:1, 41-48; Jan/Feb 2009
2011年CSCO年会 厦门
作者
Enzing er safran
组织学类 型
5E12GEJ 腺癌 45E3GEJ 12鳞癌
病例 数
17 60 28 27 40
方案
Cetuximab+cis/ CPT/RT Cetuximab+Car /pacl/RT Cetuximab+cis/ doce/RT Cetuximab+FO LFOX/RT Cetuximab/RT
10.8月 5.5月 4.5月
Tew
30 37
erlotinib gefitinib+5Fu/Cis + RT
7% pCR 25%
Sunpawer 34E腺癌 avong 3鳞癌
Safran
E+GEJ 腺癌
厦门
19
Trastuzumab+Cis/ 局部晚 pacl/RT 期
43%
24月 2-y50%
2011年CSCO年会
厦门
1
2
我国食管癌的发病率和死亡率均居世 界首位 局部晚期患者多主张放化同步治疗 近年来靶向治疗逐渐成为研究热点
3
2011年CSCO年会
厦门
瘤种 头颈部肿瘤 食管癌 神经胶质瘤 结肠癌 胰腺癌 肺癌 乳腺癌 卵巢癌 前列腺癌 肾癌
2011年CSCO年会 厦门
EGFR表达率(%) 95-100 73 40-63 25-77 30-50 40-80 14-91 35-70 39-47 50-90
Lapatinib Bevacizumab+ Cis/CTP/RT Celecoxib+5Fu /Cis/RT Bryostation1+pacli Erlotinib+5Fu/ Cis/RT gefitinib+oxali p/RT 14CRT—S 24S
转移 局部晚 期 局部晚 期 转移 局部晚 期
8.8 月 3.7 月
19.6月 8.3月 2-y 70.1%
局部晚 期
EGFR+35月 EGFR-16月
2011年CSCO年会
厦门
毒性反应 ≥3级皮疹
发生率
23%
≥3级食管炎
≥3级超敏反应 ≥3级腹泻
2011年CSCO年会 厦门
15%
5% 11.1%
泰欣生 一种特异性抗人表皮生长因子受 体的抗肿瘤单抗药物
抑制DSB 修复
EGFR抑制剂+ 放射治疗的作 用机制
细胞周期 特殊阻滞
使S期肿瘤细胞的 比例降低, G2/M期 和G0/G1期细胞比 例增加, 肿瘤作为 整体的放射敏感性 提高
增加肿瘤 细胞凋亡
增加放疗后肿瘤细胞的凋亡 , 肿瘤杀灭作用增加 (通过ras介导的PI3K-AKT通路, EGFR-TK抑制P-AKT通路)
32 30
55
Cetuxi+5Fu/Cis 5Fu/Cis
Cetuximab
转移
转移
19% 13%
2%
5.7月 3.6月
1.8月
9.5月 5.5月
4月
2011年CSCO年会
作者
Rodrigue z Javle Janmaat Ferry
组织学类型
75E+GEJ 5鳞癌 E+GEJ 腺癌 26E+GEJ 9鳞癌1腺鳞癌 E+GEJ 腺癌 17E+GEJ 13鳞癌
time
2011年CSCO年会
厦门
RT (60-66 Gy) ,n=23
RT+泰欣生 (200mg),n=23
92例晚期Ⅲ、Ⅳa 头颈癌患者 RT+ CT (Cisplatin),n=23 随机分组 RT+ CT (Cisplatin) +泰欣生 (200mg), n=23
B.K. Reddy, et al. ASTRO 2007
I期临床试验结果表明其不良反应 泰欣生 轻微是一种比较安全的生物制剂
泰欣生 推荐II期临床试验的剂量为 100mg/次-200mg/次
2011年CSCO年会
厦门
局部晚期初治鼻 咽鳞状细胞癌患 者(n=137)
泰欣生 +RT (n=70)
1:1随机
RT (n=67)
III, IVa, IVb 鼻咽癌适合根治性放 射治疗 EGFR中、强表达 研究终点: 主要终点:WHO肿瘤疗效评价标准 次要终点:生活质量 (QoL)
