绿色荧光蛋白的克隆实验汇报.
绿色荧光蛋白基因克隆及表达 结题报告

H2O 10XPCR Buffer EGFP-F EGFP-R dNTP rTap 菌 总体积
15μl 2.5μl 2μl 2μl 2μl 0.5μl 1μl 25μl
11.阳性菌株培养
等转板的菌长出以后,挑取2~3个阳性克隆 摇菌,37℃过夜。
12.重组质粒提取
(1)取已经培养好的含有pEGFP和pET-28a重组质粒1.5mL置于Eppendorf管中 ,以10000r/min离心1min,去掉上清;重复一次。然后将小管倒扣在吸水纸上 ,并用移液枪吸出多余的菌液,尽量除尽。加入150μL的GET缓冲液,充分混 匀,室温下放置10min。使用EDTA是为了除去细胞壁上的Ca2+,使溶菌酶更易 与细胞壁接触。
重复步骤上述步骤。将吸附柱Ca2放回收集管中,12000r/min离心 2min,室温放置数分钟,彻底除去漂洗液PW。将吸附柱Ca2,置于 室温10分钟,向吸附膜的中间位置悬空滴加适量洗脱缓冲液EB,室温 放置2min,12000r/min离心2min,收集DNA溶液。
6.连接反应
(1)将酶切后的片段用T4-DNA连接酶相 连 (2)16℃连接过夜。
试剂
溶液1-G.E.T缓冲液(pH8.0),溶液2- 0.2mol/L NaOH, 1%SDS,溶液3-乙酸钾溶液 (3M, pH=4.8),灭菌蒸馏水,pH7.5~8.0醋酸铵 (NH4Ac)7.5mol/L,异丙醇,70%乙醇,无水 乙醇,0.5 × TBE缓冲液,平衡液BL,溶胶液 PN,漂洗液PW,洗脱缓冲液EB,0.1 mol/L CaCl2溶液,卡那霉素100mg/ml,IPTG,2KB DNA Maker,6XLoading Buffer,酶反应终止 液(10 x Loading Buffer),0.25%溴酚蓝, 10xPCR缓冲液,琼脂糖,NaAc,TE缓冲液, 酚氯仿,T4DNAligase及其缓冲液(10 x ligase Buffer)
绿色荧光蛋白(GFP)基因的克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取南方医科大学2011预防医学(卫生检验检疫)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,以及对其进行粗提取。
方法:从E.coli DH5ɑ中用碱提取质粒的方法提取质粒pEGFP-N3和质粒pET-28a。
然后用质粒DNA 的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定已经提取了GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL-21中,用LB培养基对转化后的E.coli进行扩大培养。
用IPTG诱导GFP基因表达可以看到浅绿色菌落。
最后对绿色荧光蛋白进行粗提取。
结论:本实验有助于学生掌握最基本的分子生物学实验技术,为进一步的实验奠定基础。
关键词:绿色荧光蛋白基因克隆重组表达转化粗提取目录1 前言 (3)2 实验目的 (4)3 实验设备 (4)4 材料及试剂 (5)5 实验操作步骤 (5)5.1操作流程 (5)5.2质粒DNA的分离与纯化 (6)5.2.1 质粒的培养 (6)5.2.2 质粒的DNA的碱提取法 (6)5.2.3 质粒DNA的鉴定与纯化 (7)5.3酶切及连接 (8)5.3.1 双酶切 (8)5.3.2 回收酶切产物(采用DNA回收试剂盒进行回收) (8)5.3.3 连接 (9)5.4大肠杆菌感受态细胞的制备及转化 (9)5.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录).. 95.4.2.感受态细胞的制备 (CaCl2法) (9)5.4.3 转化涂板 (10)5.5GFP蛋白的诱导表达 (10)5.6绿色荧光蛋白的粗提取 (11)参考文献 (11)附录 (12)1LB培养基的配制: (12)2.溶液Ⅰ (12)3.溶液Ⅱ (12)4.溶液Ⅲ(100ML) (12)5.DN ASE-FREE RN ASE A (13)6.TE缓冲液(P H8.0) (13)7.20×TBE (13)8.G ENE F INDER-溴酚蓝上样缓冲液 (13)9.PEGFP-N3质粒全图谱 (13)10.P ET-28A质粒全图谱 (14)1 前言绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白在大肠杆菌中的克隆表达

实验用品
PEGFP -N3模板、菌株E. coli DH5 α、E. coli BL21 、质粒 pET28a 、 限制性内切酶 EcoRⅠ、 Hind Ⅲ、T4 DNA连接酶、1 kb DNA ladder
DNA 凝胶回收试剂盒及质粒小提试剂盒、DNA 纯化试剂盒及 IPTG、 PCR用试剂、卡那霉素、琼脂糖及 PCR 合成引物等、蛋白胨、酵母浸出 粉、琼脂粉等。
转化 筛选及复筛及酶切验证
PCR检测 IPTG诱导表达
SDS-PAGE检测目的蛋白
包涵体检测 分离纯化
电泳检测 酶切
pET28a质粒酶切位点选择
实验用品及方法介绍
方法介绍
研究绿色荧光蛋白在大肠杆菌体内的基因克隆和表达。通过质粒重 组形成所需要的重组质粒pET-28a-GFP,将重组质粒导入大肠杆菌 体内,通过酶切、PCR及用IPTG诱导检测是否在大肠杆菌体内诱导 表达成功。根据电泳结果及荧光现象得出结论,重组质粒在大肠杆
目
1 实验背景
2 实验用品及方法介绍
录
3 实验流程
4 实验原理
5 具体实验步骤
6 实验结果预测
7 参考文献
实验背景
200810月8日,瑞典皇家科学院宣布,2008年诺贝尔化学奖由 日本科学家下村修、美国科学家马丁·沙尔菲和美籍华裔科学 家钱永健获得,他们三人在发现和研究绿色荧光蛋白(GFP)方 面取得了突出成就。
目前应用较多的是GFP的突变体—增强型绿色荧光蛋白(简称EGFP)。 EGFP将GFP的第64位氨基酸苯丙氨酸突变成为亮氨酸,从而发射出的荧光 强度比GFP大6倍以上。
所以,EGFP比GFP更适合作为报告基因来研究基因表达、调控、细胞 分化及蛋白质在生物体内的定位和转运等
克隆绿色荧光蛋白分子生物学实验报告

南方医科大学绿色荧光蛋白的克隆实验报告年级专业 2014级生物技术姓名朱旭峰学号 3147020042摘要细菌质粒是一类双链、闭环的DNA,大小范围从1kb至200kb以上不等。
各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份,通常情况下可持续稳定地处于染色体外的游离状态,但在一定条件下也会可逆地整合到寄主染色体上,随着染色体的复制而复制,并通过细胞分裂传递到后代。
质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。
目前已有许多方法可用于质粒DNA的提取,下面主要介绍碱裂解法提取质粒DNA的方法。
Cloning of green fluorescent proteinAbstract:Bacterial plasmid is a kind of double chain, closed-loop DNA, ranging from 1KB to 200kb. All plasmid is present in the cytoplasm, independently from the chromosome of autonomously replicating genetic component, usually under the condition of sustainable and stable in staining in the free state, but under certain conditions will irreversibly integrated into the host chromosome, with the replication of the chromosome replication and by cell split passed on to future generations.Plasmids have become the most commonly used gene cloning vector molecules, the important condition is to obtain a large number of purified plasmid DNA molecules. There are many methods can be used to extract plasmid DNA, the following are mainly introduced the method of extracting plasmid DNA by alkaline lysis method.关键词 GFP 质粒提取感受态细菌细菌转化1.前言碱裂解法是一种应用最为广泛的制备质粒DNA的方法,纯化质粒DNA的方法通常是利用了质粒DNA相对较小及共价闭环两个性质。
分子生物学实验报告

分子生物学实验报告----绿色荧光蛋白(GFP)基因的克隆、表达和纯化一、实验背景绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
当受到紫外或蓝光激发时,GFP发射绿色荧光。
它产生荧光无需底物或辅因子发色团是其蛋白质一级序列固有的。
GFP由3个外显子组成,长2.6kb;GFP是由238个氨基酸所组成的单体蛋白,相对分子质量为27.0 kMr,其蛋白性质十分稳定,能耐受60℃处理。
1996年GFP的晶体结构被解出,蛋白质中央是一个圆柱形水桶样结构,长420 nm,宽240 nm,由11个围绕中心α螺旋的反平行β折叠组成,荧光基团的形成就是从这个螺旋开始的,桶的顶部由3个短的垂直片段覆盖,底部由一个短的垂直片段覆盖,对荧光活性很重要的生色团则位于大空腔内。
发色团是由其蛋白质内部第65-67位的Ser-Tyr-Gly自身环化和氧化形成。
1996年GFP的晶体结构被解出,蛋白质中央是一个圆柱形水桶样结构,长420 nm,宽240 nm,由11个围绕中心α螺旋的反平行β折叠组成,荧光基团的形成就是从这个螺旋开始的,桶的顶部由3个短的垂直片段覆盖,底部由一个短的垂直片段覆盖,对荧光活性很重要的生色团则位于大空腔内。
实验使用的EGFP蛋白取自原核-真核穿梭质粒pEGFP-NB3B的蛋白质编码序列。
此质粒原本被设计于在原核系统中进行扩增,并可在真核哺乳动物细胞中进行表达。
本质粒主要包括位于PCMV真核启动子与SV40 真核多聚腺苷酸尾部之间的EGFP编码序列与位于EGFP上游的多克隆位点;一个由SV40 早期启动子启动的卡那霉素/新霉素抗性基因,以及上游的细菌启动子可启动在原核系统中的复制与卡那抗性。
在EGFP编码序列上下游,存在特异的BamH I及Not I限制性内切酶位点,可切下整段EGFP编码序列。
表达EGFP 蛋白使用的pET-28 原核载体包含有在多克隆位点两侧的His-tag polyHis 编码序列;用于表达蛋白的T7 启动子,T7 转录起始物以及T7 终止子;选择性筛选使用的lacI 编码序列及卡那霉素抗性序列,pBR322 启动子,以及为产生单链DNA 产物的f1 启动子。
南方医科大学分生实验-绿色荧光蛋白(EGFP)的基因克隆

绿色荧光蛋白(EGFP)的基因克隆南方医科大学学院摘要本实验旨在学习基因克隆并检验,绿色荧光蛋白基因转化入宿主细胞后很稳定,对多数宿主的生理无影响,是常用的报道基因,便于实验。
本实验通过将含有目的基因GFP的pEGFP-N1质粒和pMD18-T载体进行酶切、电泳、回收、连接、转入、筛选之后,把GFP基因成功导入到大肠杆菌DH5α(克隆菌)中,从而实现荧光蛋白基因的克隆和表达。
关键词:绿色荧光蛋白克隆表达实验名称绿色荧光蛋白的基因克隆2015- ~实验日期实验地点2015-合作者指导老师评分教师签名批改日期一、实验目的1.学习使用限制性内切酶进行DNA酶切的原理和方法。
2.学习掌握琼脂糖凝胶电泳的基本原理和操作方法。
3.掌握PCR技术原理和PCR仪的操作方法。
4.学习PCR产物的TA克隆的基本原理和操作步骤。
5.了解和掌握大肠杆菌的制备方法的基本原理和操作要点以及DNA转化大肠杆菌的原理和方法。
6.掌握双酶切法鉴定重组DNA的基本原理和操作步骤,以及菌落PCR鉴定重组DNA的基本原理和方法。
7.掌握IPTG诱导GFP基因表达的基本原理和操作步骤二、实验原理1.pEGFP-N1质粒2.T载体三、材料与方法:1.实验材料:质粒:pEGFP-N1T载体:pUCm-T菌种:DH5(克隆菌)PCR引物:F——GGCATATGGTGAGCAAGGGCGAR——CGGGATCCCTTGTACAGCTCGTCTm=56实验试剂:即用型蓝白T载体(pMD18-T vector cloning kit)快速DNA连接试剂盒限制性内切酶:EcoR I(Fermentas)Axygen质粒提取试剂盒抗生素:氨苄青霉素(Amp)、卡那霉素(Kan)X-gal、IPTG等实验仪器:超净工作台,恒温摇床,高压灭菌锅,恒温培养箱,台式高速离心机,大容量冷冻离心机,PCR仪,紫外分光光度计,水平电泳槽,垂直电泳槽,电泳仪,凝胶成像系统,制冰机、超低温冰箱等2.方法分离目的基因→限制酶切割目的基因与载体→连接重组体→转入受体细胞→筛选重组体、转化子四、实验具体流程1.获取外源基因1)碱裂解法提取质粒使用Axygen质粒提取试剂盒离心1300r pm,1min瞬时离心漩涡震荡颠倒数次悬浮沉淀颠倒数次离心放置3-5min 13000rpm,1min离心13000rpm,1min2)取0.2 ml PCR反应管一支,用微量加样枪按下述顺序分别加入各试剂(注意每换一种试剂换一个新吸头):H2O 6μl质粒DNA(pEGFP-N1)2μl引物GFP1 (10μM) 1μl引物GFP2 (10μM) 1μlPremix Taq 10μl总体积20μl加完试剂后,将PCR反应管放到PCR仪上。
绿色荧光蛋白(GFP)的基因克隆及表达

绿色荧光蛋白(GFP)的基因克隆及表达摘要绿色荧光蛋白(GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
采用PCR技术,对实验室提供的质粒pEGFP-N1中的目的基因进行扩增。
所得PCR产物和质粒pET-28b经过BamH I和Nde I双酶切后,用琼脂糖凝胶电泳法检测酶切产物的酶切情况并回收凝胶,再利用T4DNA连接酶将目的基因与载体连接起来,得到重组质粒。
将重组质粒导入克隆菌E. coli DH5a中培养扩增,提取阳性菌落质粒进行重组子鉴定,进而导入表达菌E. coLi BL-21大肠杆菌感受态细胞中,经IPTG诱导目的基因表达产生绿色荧光蛋白。
关键词:绿色荧光蛋白 PCR 基因克隆表达1.前言1.1绿色荧光蛋白(green fluorescent protein,GFP)绿色荧光蛋白是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
当受到紫外或蓝光激发时,GFP 发射绿色荧光[1]。
1.2 GFP 的结构GFP中央是一个圆柱形水桶样结构,如图二。
长420 nm,宽240 nm,由11 个围绕中心α螺旋的反平行β折叠组成,荧光基团的形成就是从这个螺旋开始的,桶的顶部由3个短的垂直片段覆盖,底部由一个短的垂直片段覆盖,对荧光活性很重要的生色团则位于大空腔内。
发色团是由其蛋白质内部第65-67位的Ser-Tyr-GLy自身环化和氧化形成。
1.3 GFP的研究应用GFP可标记细胞和蛋白质,具有广泛的应用前景。
GFP及其突变体已被广泛应用于基因表达调控、蛋白质空间定位、生物分子之间相互作用、转基因动物]2[等方面。
基于新型功能荧光蛋白的光学分子成像技术的发展,为在活细胞乃至活体动物内研究基因表达和蛋白质功能提供了更多的选择空间。
GFP还用于观察微生物、发育机理研究、细胞筛选、免疫学等方面。
本实验是利用实验室提供的质粒pEGFP-N1,其结构如图三所示。
其上有所用酶的酶切位点。
绿色荧光蛋白(GFP)基因的克隆与表达

分子生物学综合实验论文题目: 绿色荧光蛋白(GFP)的基因克隆及表达中国·黄石2010年12月绿色荧光蛋白(GFP)基因的克隆与表达胡丽丹(湖北师范学院生命科学院0803班湖北黄石 43500)摘要:绿色荧光蛋白(GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
用碱裂解法提取的的质粒pEGFP-N3和pET-28α经过Bam H I和Not I双酶切连接后,得到pET-28α-pEGFP-N3重组质粒。
取部分的重组质粒做酶切实验,验证重组质粒的存在性,剩下的重组质粒导入表达菌E. coLi BL-21大肠杆菌感受态细胞中。
重组有GFP基因的E. coLi BL-21,在含有1 μL/mL 的卡纳霉素的LB培养基上培养。
当A600达到0.7时,用终浓度为0.8 mM的异丙基硫代-β-D-半乳糖苷(IPTG)诱导培养3小时,离心得到下层绿蓝色沉淀物即可。
关键词:绿色荧光蛋白 GFP 基因的克隆荧光蛋白水母CLoning and Expression of Green FLuorescent Protein GeneHU Li-Dan( Class three Grade eight, College of Life Sciences department,Hubei Normal university ,Huangshi 435000)Abstract:Green fluorescent protein(GFP),one kind of bioluminenscent proteins ,hasbeen found existing in the internal of Coelenterates,such as fellyfish,polyp and coral pEGFP-N3 and pET-28αwas harvested by sodium dodecylsulfate(SDS) alkaline process extraction and Agarose Gel Electrophoresis.After treating the two targeted plasmids with Bam H I and Not I, the recombinant plasmid,namely pET-28α-pEGFP-N3, can be retrieved by furthermore Agarose Gel Electrophoresis. Taking slight recombinant plasmid proves that recombinant plasmid does exist by dienzyme cutting(Bam H I and Not I).The recombinant plasmid lefting would be transported to E. coLi BL-21the competent cells. E. coLi BL-21containing recombinant GFP gene was grown overnight in LB solid medium containing kanamycin (Final concentration: 1 μL/mL). When absorbance at 600 nm value was 0.7, isopropyL β-D-thiogalactopyranoside was added to 0.8 mM and the incubation was continued an addition 3 h.Key words:Green fluorescent protein Fellyfish Genetic Cloning Fluorescin目录1.前言: (1)1.1绿色荧光蛋白(GREEN FLUORESCENT PROTEIN,GFP) (1)1.1.1 GFP研究背景 (1)1.1.2 GFP研究应用 (2)1.2基因的克隆与表达 (3)2.实验试剂及实验仪器: (5)2.1实验试剂与材料: (6)2.2实验仪器: (7)3.实验方法 (7)3.1质粒提取方法: (7)3.2琼脂糖凝胶电泳及回收: (9)3.3酶切及连接: (11)3.4E. CO L I DH5Α或E. CO L I BL21感受态制备及转入: (12)3.5酶切验证重组质粒: (13)3.6GFP基因的表达 (14)3.6.1活化菌种 (14)3.6.2扩大培养 (14)3.6.3 IPTG诱导GFP基因的表达 (14)4.结果与分析 (14)4.1质粒提取过程中现象与结果: (14)4.2琼脂糖凝胶电泳 (15)4.3E. CO L I DH5Α或E. CO L I BL21感受态制备及转入结果: (16)4.4酶切验证重组质粒 (16)4.5GFP基因的表达结果: (17)5.讨论: (18)5.1提取质粒出现图六的原因是: (18)5.2琼脂糖凝胶电泳出现图七、图八原因: (18)5.3E. CO L I DH5Α或E. CO L I BL21感受态制备及转入出现图九、十原因: .. 19 5.4酶切验证重组质粒出现图十一原因: (19)5.5GFP基因的表达结果如图十二、十三原因: (19)6.参考文献 (20)前言:1.1绿色荧光蛋白(green fluorescent protein ,GFP )1.1.1 GFP 研究背景绿色荧光蛋白是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
GFP实验报告

绿色荧光蛋白的克隆摘要:目的:研究绿色荧光蛋白基因的基因克隆。
方法:分别提取DH-5α(pEGFP-N1)和DH-5α(pMD-18T)质粒,将两个质粒酶切并连接形成重组质粒pMD-18T-GFP,将重组质粒导入DH-5α克隆菌中进行转化,用抗生素抗性筛选后,通过限制性核酸内切酶EcoR I 和 Hind III对所建质粒进行分析鉴定。
关键词:绿色荧光蛋白 DNA重组The cloning of green fluorescent proteinAbstract:Objective: Studies indicated the cloning of the GFP gene.Methods: Extract the plasmid of the DH-5α(pEGFP-N1) and DH-5α (pMD-18T). Then cutting by enzyme and connecting the two plasmids to form pMD-18T-GFP recombined plasmid. The recombinant plasmid confirmed by restriction enzyme and PCR was transferred into E.coli DH-5αto ensure the expression of green fluorescent protein. After resistant screening with antibiotics, analyze and identify the recombined plasmid.Keywords: Green Fluorescent Protein DNA recombination随着分子生物学和基因工程技术的迅速发展和广泛应用,重组DNA技术在发展蛋白质、多肽类药物与疫苗、转基因和基因敲除动物、HGP、基因诊断和基因治疗等方面得到广泛应用。
绿色荧光蛋白(GFP)基因的克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取南方医科大学2011预防医学(卫生检验检疫)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,以及对其进行粗提取。
方法:从E.coli DH5ɑ中用碱提取质粒的方法提取质粒pEGFP-N3和质粒pET-28a。
然后用质粒DNA的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI 对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定已经提取了GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL-21中,用LB培养基对转化后的E.coli进行扩大培养。
用IPTG诱导GFP基因表达可以看到浅绿色菌落。
最后对绿色荧光蛋白进行粗提取。
结论:本实验有助于学生掌握最基本的分子生物学实验技术,为进一步的实验奠定基础。
关键词:绿色荧光蛋白基因克隆重组表达转化粗提取1 前言 (3)2 实验目的 (4)3 实验设备 (4)4 材料及试剂 (5)5 实验操作步骤 (5)5.1操作流程 (5)5.2质粒DNA的分离与纯化 (6)5.2.1 质粒的培养 (6)5.2.2 质粒的DNA的碱提取法 (6)5.2.3 质粒DNA的鉴定与纯化 (7)5.3酶切及连接 (8)5.3.1 双酶切 (8)5.3.2 回收酶切产物(采用DNA回收试剂盒进行回收) (8)5.3.3 连接 (9)5.4大肠杆菌感受态细胞的制备及转化 (9)5.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录) (9)5.4.2.感受态细胞的制备(CaCl2法) (9)5.4.3 转化涂板 (10)5.5GFP蛋白的诱导表达 (10)5.6绿色荧光蛋白的粗提取 (11)参考文献 (11)附录 (12)1LB培养基的配制: (12)2.溶液Ⅰ (12)3.溶液Ⅱ (12)4.溶液Ⅲ(100ML) (12)5.DN ASE-FREE RN ASE A (13)6.TE缓冲液(P H8.0) (13)7.20×TBE (13)8.G ENE F INDER-溴酚蓝上样缓冲液 (13)9.PEGFP-N3质粒全图谱 (13)10.P ET-28A质粒全图谱 (14)绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白(GFP)基因地克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取南方医科大学2011预防医学(卫生检验检疫)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,以及对其进行粗提取。
方法:从 E.coli DH5ɑ中用碱提取质粒的方法提取质粒pEGFP-N3和质粒pET-28a。
然后用质粒DNA的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI 对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定已经提取了GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL-21中,用LB培养基对转化后的E.coli进行扩大培养。
用IPTG诱导GFP基因表达可以看到浅绿色菌落。
最后对绿色荧光蛋白进行粗提取。
结论:本实验有助于学生掌握最基本的分子生物学实验技术,为进一步的实验奠定基础。
关键词:绿色荧光蛋白基因克隆重组表达转化粗提取1 前言 (3)2 实验目的 (4)3 实验设备 (4)4 材料及试剂 (5)5 实验操作步骤 (5)5.1操作流程 (5)5.2质粒DNA的分离与纯化 (6)5.2.1 质粒的培养 (6)5.2.2 质粒的DNA的碱提取法 (6)5.2.3 质粒DNA的鉴定与纯化 (7)5.3酶切及连接 (7)5.3.1 双酶切 (7)5.3.2 回收酶切产物(采用DNA回收试剂盒进行回收) (8)5.3.3 连接 (9)5.4大肠杆菌感受态细胞的制备及转化 (9)5.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录) (9)5.4.2.感受态细胞的制备 (CaCl2法) (9)5.4.3 转化涂板 (10)5.5GFP蛋白的诱导表达 (10)5.6绿色荧光蛋白的粗提取 (11)参考文献 (11)附录 (12)1LB培养基的配制: (12)2.溶液Ⅰ (12)3.溶液Ⅱ (12)4.溶液Ⅲ(100ML) (12)5.DN ASE-FREE RN ASE A (12)6.TE缓冲液(P H8.0) (12)7.20×TBE (13)8.G ENE F INDER-溴酚蓝上样缓冲液 (13)9.PEGFP-N3质粒全图谱 (13)10.P ET-28A质粒全图谱 (14)绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白基因克隆及表达结果分析
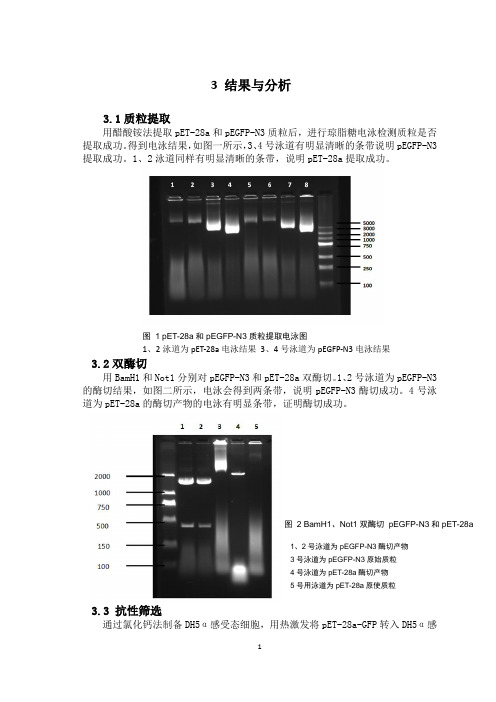
3 结果与分析3.1质粒提取用醋酸铵法提取pET-28a 和pEGFP-N3质粒后,进行琼脂糖电泳检测质粒是否提取成功。
得到电泳结果,如图一所示,3、4号泳道有明显清晰的条带说明pEGFP-N3提取成功。
1、2泳道同样有明显清晰的条带,说明pET-28a 提取成功。
3.2双酶切用BamH1和Not1分别对pEGFP-N3和pET-28a 双酶切。
1、2号泳道为pEGFP-N3的酶切结果,如图二所示,电泳会得到两条带,说明pEGFP-N3酶切成功。
4号泳道为pET-28a 的酶切产物的电泳有明显条带,证明酶切成功。
3.3 抗性筛选通过氯化钙法制备DH5α感受态细胞,用热激发将pET-28a-GFP 转入DH5α感图 1 pET-28a 和pEGFP-N3质粒提取电泳图1、2泳道为pET-28a 电泳结果 3、4号泳道为pEGFP-N3电泳结果图 2 BamH1、Not1双酶切 pEGFP-N3和pET-28a1、2号泳道为pEGFP-N3酶切产物 3号泳道为pEGFP-N3原始质粒 4号泳道为pET-28a 酶切产物 5号用泳道为pET-28a 原使质粒受态细胞。
转化重组质粒后涂平板,进行重组质粒的抗性筛选。
因为28a中含有抗卡那基因,所以筛选后可以得到含28a的重组质粒。
从图中可以看出1号平板长出较多菌落,说明DH5α感受态细胞存活。
2号平板无菌落生长,说明DH5α中不含抗卡那基因。
3号板生长出较少菌落,证明卡那有活性。
4号板无菌落生长。
失败原因其一可能是在倒了第一个平板加入卡那后,由于倒平板速度太慢,导致培养基凝固,影响了卡那的浓度和活性。
其二可能是在转化过程中,离心后,弃上清的过程中,将沉淀和上清混在了一起,影响了溶液的浓度。
图3重组质粒转化DH5α感受态细胞1号图为不含卡那的阴性对照2号图为含卡那的阴性对照3号图为含卡那的自提pET-28a的阳性对照4号图为含卡那的连接产物结果3.4PCR鉴定经PCR扩增后,进行琼脂糖凝胶电泳检测是否扩增成功,得到电泳结果如图四所示,结果表明,1、2泳道的条带约为700bp,说明成功扩增出含有GFP的基因。
绿色荧光蛋白(GFP)基因的克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取之杨若古兰创作南方医科大学2011预防医学(卫生检验检疫)摘要目的:研讨绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,和对其进行粗提取.方法:从E.coli DH5ɑ顶用碱提取质粒的方法提取质粒pEGFP-N3和质粒pET-28a.然后用质粒DNA的琼脂糖凝胶电泳对曾经提取的产品进行电泳,确定从大肠杆菌中成功提取了质粒.再用限制性内切酶BamHI和NotI对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定曾经提取了GFP基因.将含有GFP 基因的质粒转化到感受态扩大培养.用IPTG引诱GFP基因表达可以看到浅绿色菌落.最初对绿色荧光蛋白进行粗提取.结论:本实验有助于先生把握最基本的分子生物学实验技术,为进一步的实验奠定基础.关键词:绿色荧光蛋白基因克隆重组表达转化粗提取目录1 前言32 实验目的43 实验设备44 材料及试剂55 实验操纵步调55.1操纵流程55.2质粒DNA的分离与纯化65.2.1 质粒的培养65.2.2 质粒的DNA的碱提取法65.2.3 质粒DNA的鉴定与纯化75.3酶切及连接85.3.1 双酶切85.3.2 回收酶切产品(采取DNA回收试剂盒进行回收)8 5.3.3 连接95.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录)95.4.2.感受态细胞的制备 (CaCl2法)95.4.3 转化涂板105.5GFP蛋白的引诱表达105.6绿色荧光蛋白的粗提取11参考文献11附录121LB培养基的配制:122.溶液Ⅰ123.溶液Ⅱ124.溶液Ⅲ(100ML)125.DN ASE-FREE RN ASE A136.TE缓冲液(P H8.0)137.20×TBE138.G ENE F INDER-溴酚蓝上样缓冲液139.PEGFP-N3质粒全图谱1310.P ET-28A质粒全图谱141 前言绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包含水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白.当受到紫外或蓝光激发时,GFP 发射绿色荧光.它发生荧光无需底物或辅因子发色团是其蛋白质一级序列固有的.1962 年,下村修等分离纯化了水母中发光蛋白水母素,并发现一种绿色的荧光蛋白.1974 年,他们分离得到了这个蛋白,当时称绿色蛋白,当前称绿色荧光蛋白(GFP)[1]GFP 作为一种新的陈述基因,其长处在于①荧光强度高,波动性高;②GFP 分子量小,易于融合,适用于多种转化方式,对受体无毒害,平安可靠;③不须要反应底物与其他辅助因子,受蓝光激发发生绿色荧光,特别适用于体内的即时检测;④GFP 不具有种属依附性,在多种原核和真核生物细胞中都表达;⑤通过替换一些特殊氨基酸,可以使之发生分歧色彩的光,从而适应分歧的研讨须要.近年来广泛用于基因的表达与调控、蛋白质的定位、转移和彼此感化、旌旗灯号传递、转染与转化,和细胞的分离与纯化等研讨领域[ 2~3].采取GFP 作为标识表记标帜基因,可直接收集转化细胞供实验,缩短了筛选时间、减少对细胞活性的影响并可作为活体标识表记标帜,为研讨发育的基因调控和分子机制提供了一种简洁无效的手段[ 4、5 ].采取基因工程手段生产GFP标识表记标帜的方法,可建立一种简便、快速的免疫诊断技术[6].质粒转化进入大肠杆菌(Escherichia coli)感受态细胞是分子克隆的关键步调[7],是基因克隆和DNA文库构建等研讨中一项次要的惯例操纵.目前,感受态细胞的制备次要采取CaCl2法,该方法操纵简单、容易把握、反复性好、转化率高,可广泛利用于普通的实验室.其道理是Ca2+ 破坏细胞膜上的脂质阵列,并与膜上多聚羟基丁酸化合物、多聚无机磷酸构成复合物以利于外源DNA的渗入[8].大肠杆菌是第一个用于重组蛋白生产的宿主菌,它不但具有遗传布景清楚、培养操纵简单、转化和转导效力高、生长繁殖快、成本低廉、可以快速大规模地生产目的蛋白等长处[9].而且其表达外源基因产品的水平远高于其它基因表达零碎,表达的目的蛋白量甚至能超出细菌中蛋白量的30%,是以大肠杆菌是目前利用最广泛的蛋白质表达零碎[10].大肠杆菌表达零碎是目前最经常使用的外源蛋白表达零碎,大肠杆菌因为遗传布景清楚、易操纵,和有大量可供选择的克隆或表达载体,使之成为人们克隆表达外源基因的次要菌株[11].随着科研的进展,构建出了多种具有分歧特点的表达载体和工程菌株,以满足表达分歧性质、请求的目的基因的须要.在原核细胞中表达蛋白质的载体经常使用启动子有T7启动子、Trp启动子-色氨酸启动子、Tac启动子、T7噬菌体中基因10 的启动子及Lac 启动子等.Lac启动子受分解代谢零碎活化蛋白和cAMP的正调控和隔绝物的负调控,当加入乳糖或某些类似物IPTG可与隔绝蛋白构成复合物,使隔绝蛋白构型改变,隔绝蛋白不再能与把持基因结合,从而使结构基因表达.根据原核生物基因表达特点选择载体进行目的基因克隆,然后转入响应的菌种中表达目的蛋白质[12].研讨绿色荧光蛋白在大肠杆菌体内的基因克隆和表达.通过质粒重组构成所须要的重组质粒pET-28a-GFP,将重组质粒导入大肠杆菌体内,通过酶切及用IPTG引诱检测是否在大肠杆菌体内引诱表达成功.根据电泳结果及荧光景象得出结论,重组质粒在大肠杆菌体内成功引诱表达.2 实验目的学会绿色荧光蛋白基因表达载体的构建及在大肠杆菌中的表达全部过程中的每一步,把握其方法.本实验是通过基因工程手段对目的基因EGFP进行克隆,并进行EGFP表达载体的构建,并在大肠杆菌中引诱表达,获得GFP蛋白.①学会最经常使用的小量制备质粒DNA的碱裂解方法②学会经常使用的DNA琼脂糖凝胶电泳技术③学会用限制性内切酶切割DNA④学会用琼脂糖凝胶中回收DNA片段⑤学会DNA片段的体外连接技术⑥学会用CaCl2法制备大肠杆菌感受态细胞⑦学会用质粒DNA转化感受态受体菌的基本操纵技术⑧学会用酶切法筛选重组质粒转化成功的克隆菌⑨了解外源基因在原核细胞中表达的特点和IPTG引诱表达的方法⑩进修SDS-PAGE 胶的基本灌制方法和用SDS-PAGE 检测表达蛋白3 实验设备恒温培养箱,超净台,恒温摇床,制冰机,台式离心计心情,核酸电泳仪,小型混合器,冰箱,蓝盾可见光透射仪,移液器、电泳槽、振荡器、制冰机、凝胶成像仪,水浴锅,高压灭菌锅、振荡培养箱,手持式紫外灯.4 材料及试剂BamH I ;NotI(10U/μL );T4 ligase ;LB 培养基;溶液Ⅰ;溶液Ⅱ;溶液Ⅲ;TE 缓冲液;20×TBE;GeneFinder-溴酚蓝上样缓冲液.5 实验操纵步调5.1 操纵流程质粒提取质粒提取酶切回收酶切回收连接图一流程图5.2 质粒DNA的分离与纯化5.2.1 质粒的培养1)在含有pEGFP-N3质粒的DH5α平板上菌落上挑取菌种,置于含有5mL LB培养基的试管中.摇摆过夜.2)有pET-28a质粒的平板上挑取单菌落于另外一个试管中,同样摇摆培养过夜.5.2.2 质粒的DNA的碱提取法1)取1.5ml DH5α培养液倒入1.5mL eppendorf 管(微量离心管)中, 13000rpm离心1min.2)反复1.3)弃上清,将管倒置于卫生纸上数分钟,使液体流尽.4)菌体沉淀重悬浮于100μL溶液Ⅰ中(需剧烈振荡),室温下放置10min.5)加入新配制的溶液Ⅱ200μl, 盖紧管口,快速暖和颠倒eppendorf 管5次,以混匀内容物(千万不要振荡),冰浴5min.6)加入150μL预冷的溶液Ⅲ,盖紧管口,并倒置离心管,暖和振荡3次,使沉淀混匀,冰浴中15分钟,13000rpm离心5min.7)上清液移入干净eppendorf 管中,加入等体积的氯仿/异戊醇(24:1),振荡混匀, 13000rpm离心2min.8)将水相移入干净eppendorf 管中,加入等体积的氯仿/异戊醇(24:1)振荡混匀, 13000rpm离心2min.9)将水相移入干净eppendorf 管中,加入2 倍体积的无水乙醇,振荡混匀后,置于室温下2min,然后13000rpm离心5min.10)弃上清,将管口关闭倒置于卫生纸上使所有液体流出,加入1mL 70%乙醇洗沉淀一次, 振荡混匀后,13000rpm离心5min.11)吸除上清液,将管倒置于卫生纸上使液体流尽,室温干燥.12)将沉淀溶于30μL TE缓冲液(pH8.0,含20μg/mL RNaseA)中,保管在-20℃冰箱中.13)按照同样的流程和方法将pET-28a的质粒也提出来,保管在-20℃冰箱中.5.2.3 质粒DNA的鉴定与纯化1)1%琼脂糖凝胶的配制①加20ml 1×TBE缓冲液于三角瓶中,②精确称取0.2g琼脂糖加到三角瓶中,于微波炉中加热至完整熔化,③冷却至60℃摆布,2)琼脂糖凝胶电泳①轻缓倒入封好两端和加上梳子的电泳胶板中,静置冷却30分钟以上,②将胶板除去封胶带,放入电泳缓冲液(TBE)中,使电泳缓冲液刚好没过凝胶约1mm,轻轻革除梳子,③取5μl质粒DNA及2μl GeneFinder混匀上样⑤蓝盾可见光透射仪观察结果.3)回收产品①用干净的刀片将须要的DNA条带从凝胶上切上去,称取分量.②以0.1g凝胶对应300μL的体积加入PN.③50℃水浴放置10min,期间不竭暖和上下翻动离心管至胶完整融解.④将上一步得到的溶液加入到一个吸附柱中,吸附柱再放入收集管,13000rpm离心60s,弃掉废液.⑤加入800μL漂洗液PW,13000rpm离心60s,弃掉废液.⑥加入500μL漂洗液PW,13000rpm离心60s,弃掉废液.⑦将离心吸附柱放回收集管,13000rpm离心2min.⑧取出吸附柱,放入一个干净的离心管中,在吸附膜的两头地位加入适量洗脱缓冲液EB 30μL,洗脱缓冲液先在65℃水浴预热,室温放置2min,13000rpm离心1min,然后将离心的溶液从头加回离心吸附柱中,13000rpm离心1min.⑨置于-20℃保管.5.3 酶切及连接5.3.1 双酶切按如下双酶切体系(30μL)混合:表1 双酶切体系的配制反应物(μL)pEGFP-N3 pET-28a质粒1818BamH I 2 2Not I 2 210×buffer K 3 30.1%BSA缓冲液 3 3灭菌双蒸水至 30ul体系1)离心10s,混匀.2)37℃水浴酶切3-4h.3)配制1.0%(M/V)普通琼脂糖凝胶30ml.4)适当放置冷却,45℃摆布倒于电泳胶板上,插好梳子.5)待凝胶凝固好当前,拨下梳子.6)酶切样品中加入5µl溴酚蓝-GeneFinder混合液混匀,上样.7)1×TBE Buffer,80V(3-4V/cm)下电泳30min.8)荧光激发器观察质粒DNA条带的酶切情况,并照相.5.3.2 回收酶切产品(采取DNA回收试剂盒进行回收)1)配30mL 1%进口琼脂糖凝胶,尽量长一些(用粗梳子),对酶切产品进行电泳分离;2)将酶切产品全部加入加样孔中3)跑胶,观察结果,而且拍照.4)用干净的刀片将须要的DNA条带从凝胶上切上去,称取分量.5)以0.1g凝胶对应300μL的体积加入PN.6)50℃水浴放置10min,期间不竭暖和上下翻动离心管至胶完整融解.7)将上一步得到的溶液加入到一个吸附柱中,吸附柱再放入收集管,13000rpm离心60s,弃掉废液.8)加入800μL漂洗液PW,13000rpm离心60s,弃掉废液.9)加入500μL漂洗液PW,13000rpm离心60s,弃掉废液.10)将离心吸附柱放回收集管,13000rpm离心2min.11)取出吸附柱,放入一个干净的离心管中,在吸附膜的两头地位加入适量洗脱缓冲液EB 30μL,洗脱缓冲液先在65℃水浴预热,室温放置2min,13000rpm离心1min,然后将离心的溶液从头加回离心吸附柱中,13000rpm离心1min.12)置于-20℃保管.5.3.3 连接按照连接体系进行,16℃连接过夜.表2 连接体系反应物体积/μL回收纯化的pET-28a质粒5gfp基因片段12T4连接酶 1缓冲液(10×) 25.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录)氨苄青霉素和卡那霉素等抗生素不抗热,如果培养基温度过高,容易导致抗生素失效,应使培养基降温至60℃摆布后,再加入抗生素.但也不该使培养基的温度过低,否则容易出现气泡.75mm直径的培养皿约需15ml培养基.5.4.2.感受态细胞的制备 (CaCl2法)1)挑一大肠杆菌单菌落放入3ml LB液体培养基(含Kan+),37℃培养过夜.2)活化大肠杆菌:取3ml新颖的LB液体培养基加入50-150μl的过夜菌,培养2-3个小时.3)将昨夜摇出来的DH5α或BL21培养液转入离心管中,冰上放置10min,然后于4℃下4000rpm离心5min.4)弃去上清,用预冷的0.1mol/L 的CaCl2溶液600μL轻轻悬浮细胞,冰上放置20min, 4℃下4000rpm离心5min.5)弃去上清,加入300μL预冷的0.1mol/L的CaCl2溶液,轻轻悬浮细胞,冰上放置5min,即成感受态细胞悬液,可-80℃持久保管.5.4.3 转化涂板1) 取2个无菌离心管,分别加入100μL BL21感受态细胞悬液,第1管加5μl 无菌水,第2管加入质粒DNA 溶液5μl,轻轻摇匀,冰上放置30min.2)42℃水浴中热激90s,热激后敏捷置于冰上冷却5min. 3) 分别向管中加入100μL LB 液体培养基,混匀后在37℃振荡培养30min.4) 从管1中取50μL 涂布于含抗生素和不含抗生素的平板上,从管2中取50μL 和100μL 涂布于含抗生素的平板上.正面向上放置约10分钟,待菌液完整被培养基接收后倒置培养皿,37℃培养20小时.图2 转化涂板模式图5.5 GFP 蛋白的引诱表达1)取阳性克隆质粒DNA 转化BL21; 2)在含有Kan +的固体培养基上,37℃培养20h ; 3)挑取单菌落,37℃振荡培养过夜; 4) 取4支无菌带盖试管,加入新颖LB 液体培养基(含有Kan 管1 管1 管2 管250μL 50μL 50μL 100μL+)5ml,按1:20浓缩比例加入过夜菌,37℃培养至生持久,约2-3小时.5)加入IPTG(1:1000)至终浓度1mmol/L,分别引诱0h,1h,2h,4h.6)分别取1.5ml,10000rpm离心5min,去除上清,收集沉淀,再反复一次收集沉淀.7)分别取IPTG引诱培养液20μl涂布在含Kan+的固体培养基上,37℃培养20小时.8)观察蛋白表达:用紫外线照耀菌体沉淀及培养平板,可以看到绿色荧光.分别对均匀涂布的平板和表达蛋白的样品管拍照,保管照片.5.6 绿色荧光蛋白的粗提取1)挑取上述鉴定准确的单菌落接入5 mL 液体LB 培养基( 含50μg/mL 卡那霉素) , 37 ℃振荡培养过夜,2)将过夜培养菌以1: 500 体积比接种入新的LB 液体培养基扩大培养, 37 ℃培养1 h 后, 加入0.1 mmol/L IPTG 引诱表达3 h.3)将上述引诱表达菌液4 ℃、5 000×g 离心10 min 收集菌体,4)用提取缓冲液(2 mmol/L Tris, pH 8.0, 0.5 mmol/L PMSF,0.2mmol/L NaN3)洗濯菌体一遍,5)将菌体超声破碎( 50 %功率, 超声20 s, 共20 次,两次超声间隔40s) 后, 10 000 ×g离心20 min.6)取离心后的上清,即为粗提取绿色荧光蛋白.参考文献[1] Shimomura O,Johnson FH,Saiga Y. Extraction, purification and properties of aequorin, abioluminescent protein from the luminous hydromedusan, Aequorea [J]. J Cell Como Physiok, 1962, 59: 223-239. [2] Kain SR,AdamsM, Kondepudi A, et al. Green fluorescent p rotein as a reporter of gene exp ression and p rotein localization. biotechniques, 1995, 19 (4) : 650[3] Phillip s GJ. Green fluorescent p rotein - a bright idea for the study of bacterial p rotein localization. FEMSmicrobial Lett, 2001, 204 (1) : 9 [4] ChalfieM, Tu, EKivchen G, et al. Green fluorescent p rotein as a marker forgene exp ression. Science, 1994, 263(5148) : 802[5] ChalfieM. Green fluorescent p rotein. Photochem Photobiol, 1995, 62 (4) : 651[6] Larrick JW, Balint RF, Youvan DC. Green fluorescent protein: untapped potential in immunotechnology. Immunotechnology, 1995, 1 (2) : 83[7] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T. 分子克隆实验指南[M]. 金冬雁,黎孟枫,译. 2版. 北京:科学出版,1995.[8] 杜祯, 马海利, 陈瑞芳.工程菌DH-5α感受态细胞的制备及质粒pGEM的转化研讨中国畜牧兽医,2007 年第34卷第5期[9] Nuc P. Nuc K. Recombinant protein production in Escherichia coli[J].Postepy Biochem,2006,52 (4):448-456.[10] Dong X,Tang B,Li J,et al.Expression and Purification of Intact and Functional Soybean (Glycine max)Seed Ferritin Complex in Escherichia coli [J].J Microbiol Biotechnol,2008,18 (2):299-307.[11] 吕素芳,刘峥,郭广君,蔡永萍,邱德文大肠杆菌中表达外源重组蛋白的研讨[12] 魏春红,李毅主编原核细胞中外源基因的表达和初步纯化,古代分子生物学技术,高等教育出版社,2006.7:95-97附录1 LB培养基的配制:构成液体固体蛋白胨(Trypton)10g10g酵母提取物(Yeast Extract)5g5gNaCl10g10g琼脂(Agar)15g蒸馏水定容至1000ml定容至1000ml2. 溶液Ⅰ: 50mM 葡萄糖25mM Tris-HCl(pH8.0)10mM EDTA3. 溶液Ⅱ(现用现配):0.2N NaOH1% SDS(先加水,再加NaOH和SDS)4. 溶液Ⅲ(100ml):5M KAc 60ml5. DNase-free RNase A:溶解RNase A于TE缓冲液中,浓度为10mg/ml,煮沸10-30min,除去DNase活性,-20℃储存.6.TE缓冲液(pH8.0)[10mM Tris-HCl;1mM EDTA]的配制:药品名称1M Tris-HCl(pH8.0)10ml1ml0.5M EDTA2mlddH2O定容至1000ml定容至100ml7. 20×TBE:216g Tris碱,110g硼酸,80ml 0.5M EDTA (pH8.0),定容至1000ml.8. GeneFinder-溴酚蓝上样缓冲液6×loading buffer:0.25%溴酚兰,0.25%二甲苯青FF,40%(w/v)蔗糖水溶液.配制好后可以按50:1的比例浓缩GeneFinder.9.PEGFP-N3质粒全图谱实验使用的EGFP蛋白取自原核-真核穿梭质粒pEGFP-NB3B 的蛋白质编码序列.此质粒本来被设计于在原核零碎中进行扩增,并可在真核哺乳动物细胞中进行表达.实质粒次要包含位于PCMV 真核启动子与SV40 真核多聚腺苷酸尾部之间的EGFP编码序列与位于EGFP上游的多克隆位点;一个由SV40 初期启动子启动的卡那霉素/新霉素抗性基因,和上游的细菌启动子可启动在原核零碎中的复制与卡那抗性.在EGFP编码序列上下流,存在特异的BamH I及Not I限制性内切酶位点,可切下整段EGFP编码序列.10.pET-28a质粒全图谱表达EGFP 蛋白使用的pET-28 原核载体包含有在多克隆位点两侧的His-tag polyHis 编码序列;用于表达蛋白的T7 启动子,T7 转录起始物和T7 终止子;选择性筛选使用的lacI 编码序列及卡那霉素抗性序列,pBR322 启动子,和为发生单链DNA 产品的f1 启动子.。
绿色荧光蛋白的基因克隆及表达

绿色荧光蛋白的基因克隆和表达的研究沈国军(指导老师:王友如)(湖北师范学院生命科学学院湖北黄石435002)引言随着分子生物学和基因工程技术的迅速发展和广泛应用, 人们根据自己的意愿有目的、有计划、有根据、有预见地将外源基因导入动物细胞内, 使外源基因进行表达、阐明基因表达的调控机理或者通过与染色体基因组进行稳定整合,将生物性状传递给子代动物的研究方兴未艾[1]。
基因标记技术是近年来发展起来的分子生物学技术。
荧光蛋白基因在标记基因方面由于具有独特的优点而引起了科学家的广泛关注,现已被普遍应用到分子生物学研究的各个方面。
荧光蛋白是海洋生物体内的一类发光蛋白,分为绿色荧光蛋白、蓝色荧光蛋白、黄色荧光蛋白和红色荧光蛋白[2]。
2008 年10 月8 日,瑞典皇家科学院把今年的诺贝尔化学奖授予绿色荧光蛋白的发现者和推广者。
他们分别为日本科学家下村修(Osamu Shimomura)、美国科学家马丁·查尔菲(Martin Chalfie)和钱永健(Roger Tsien)[3]。
1962 年,下村修等分离纯化了水母中发光蛋白水母素,并发现一种绿色的荧光蛋白。
1974 年,他们分离得到了这个蛋白,当时称绿色蛋白,以后称绿色荧光蛋白(GFP)[4]。
1994年,查尔菲等首次在大肠杆菌细胞中表达了能发射绿色荧光的GFP,开创了GFP 研究与应用之先河[5]。
绿色荧光蛋白( green fluorescent p rotein, GFP)是238个氨基酸组成的单体蛋白,其分子量为27 kDa。
GFP作为一种新的报告基因,与以往lacZ、CAT 等报告基因相比,有很多无可比拟的优越性: GFP 不具有种属依赖性,在多种原核和真核生物细胞中都表达;荧光强度高,稳定性高;不需要反应底物与其他辅助因子,受蓝光激发产生绿色荧光,尤其适用于体内的即时检测;另外GFP 分子量小,易于融合,适用于多种转化方式,对受体无毒害,安全可靠;并且通过替换一些特殊氨基酸,可以使之产生不同颜色的光,从而适应不同的研究需要。
分子生物学实验设计报告绿色荧光蛋白的克隆表达

分子生物学实验设计报告绿色荧光蛋白的克隆表达陶成秋20杨晨20一、引言基因标记技术是近年来发展起来的分子生物学技术。
荧光蛋白基因在标记基因方面由于具有独特的优点而广受科学家们的关注。
荧光蛋白是海洋生物体内的一类发光蛋白,分为绿色荧光蛋白、蓝色荧光蛋白、黄色荧光蛋白和红色荧光蛋白。
绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白,共27kD,由238个氨基酸构成。
当受到紫外或蓝光激发时,GFP发射绿色荧光。
它产生荧光无需底物或辅因子,发色团是其蛋白质一级序列固有的。
基因克隆技术包括把来自不同物的基因同有自主复制能力的载体DNA在体外人工连接,构建成新的重组DNA,然后送入受体生物中去表达,从而产生遗传物质和状态的转移和重新组合。
采用重组DNA技术,将不同来源的DNA分子在体外进行特异性切割,重新连接,组装成一个新的杂合DNA分子。
在此基础上,这个杂合分子能够在一定的宿主细胞中进行扩增,形成大量的子代分子。
研究绿色荧光蛋白在大肠杆菌体内的基因克隆和表达。
通过质粒重组形成所需要的重组质粒pET-28a-GFP,将重组质粒导入大肠杆菌体内,通过酶切、PCR及用IPTG诱导检测是否在大肠杆菌体内诱导表达成功。
根据电泳结果及荧光现象得出结论,重组质粒在大肠杆菌体内成功诱导表达。
二、实验流程三、具体实验方案实验一、质粒DNA的提取1.实验原理:1)质粒(Plasmid)是一种染色体外的遗传因子,大小在1kb~200kb之间,是具有双链闭合环状结构的DNA分子,主要发现于细菌、放线菌和真菌细胞中。
质粒具有自主复制能力,,能使子代保持他们恒定的复制数,可表达它携带的遗传信息。
它可以独立游离于细胞质内,也可以整合到细菌染色体中,它离开宿主细胞就不能复制,而它控制的许多生物学功能也是对宿主细胞的补偿。
2)从大肠杆菌中抽提质粒DNA的方法很多,可以在实验中根据不同的需要采用不同的方法。
绿色荧光蛋白(GFP)基因的克隆、表达和粗提取

绿色荧光蛋白(GFP)基因的克隆、表达和粗提取南方医科大学2011预防医学(卫生检验检疫)摘要目的:研究绿色荧光蛋白(green fluorescent protein,GFP)基因在大肠杆菌中的基因克隆与重组表达,以及对其进行粗提取。
方法:从E.coli DH5ɑ中用碱提取质粒的方法提取质粒pEGFP-N3和质粒pET-28a。
然后用质粒DNA的琼脂糖凝胶电泳对已经提取的产物进行电泳,确定从大肠杆菌中成功提取了质粒。
再用限制性内切酶BamHI和NotI 对成功提取的质粒进行酶切,并对酶切后的质粒进行琼脂糖凝胶电泳,用以确定已经提取了GFP基因。
将含有GFP基因的质粒转化到感受态细胞E.coli BL-21中,用LB培养基对转化后的E.coli进行扩大培养。
用IPTG诱导GFP基因表达可以看到浅绿色菌落。
最后对绿色荧光蛋白进行粗提取。
结论:本实验有助于学生掌握最基本的分子生物学实验技术,为进一步的实验奠定基础。
关键词:绿色荧光蛋白基因克隆重组表达转化粗提取1 前言 (3)2 实验目的 (4)3 实验设备 (4)4 材料及试剂 (5)5 实验操作步骤 (5)5.1操作流程 (5)5.2质粒DNA的分离与纯化 (6)5.2.1 质粒的培养 (6)5.2.2 质粒的DNA的碱提取法 (6)5.2.3 质粒DNA的鉴定与纯化 (7)5.3酶切及连接 (8)5.3.1 双酶切 (8)5.3.2 回收酶切产物(采用DNA回收试剂盒进行回收) (8)5.3.3 连接 (9)5.4大肠杆菌感受态细胞的制备及转化 (9)5.4.1 LB(Luria-Bertain)液体和固体培养基的配制(参考附录) (9)5.4.2.感受态细胞的制备(CaCl2法) (9)5.4.3 转化涂板 (10)5.5GFP蛋白的诱导表达 (10)5.6绿色荧光蛋白的粗提取 (11)参考文献 (11)附录 (12)1LB培养基的配制: (12)2.溶液Ⅰ (12)3.溶液Ⅱ (12)4.溶液Ⅲ(100ML) (12)5.DN ASE-FREE RN ASE A (13)6.TE缓冲液(P H8.0) (13)7.20×TBE (13)8.G ENE F INDER-溴酚蓝上样缓冲液 (13)9.PEGFP-N3质粒全图谱 (13)10.P ET-28A质粒全图谱 (14)绿色荧光蛋白(green fluorescent protein,GFP)是一类存在于包括水母、水螅和珊瑚等腔肠动物体内的生物发光蛋白。
绿色荧光蛋白分子实验

5、变性时间过长损害酶活性,过短靶序列变性不彻底,易造成扩增 失败。
6、循环数——过多易产生非特异扩增。
7、酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶 的活性丧失或不够而 导致假阴性。需注意的是有时忘加Taq酶或溴 乙锭。
8、引物:引物质量、引物的浓度、两条引物的浓度是否对称,是 PCR失败或扩增条带不 理想、容易弥散的常见原因。有些批号的引 物合成质量有问题,两条引物一条浓度 高,一条浓度低,造成低效 率的不对称扩增。
试验方法——热休克法
10 L载 体DNA
40L感 受态菌
On ice混合, 静置10min
200L转化液 +16ulIPTG+40u lX-Gal,涂含抗
菌素的平板
37℃摇1h
42ºC 45秒
加入1mL LB培养基
检验是否从大肠杆菌中提取出质粒DNA 的电泳图。
影响转化率的因素
➢细胞生长状态和密度:
糖的酶,最常用的β-半乳糖苷酶基因来自大肠杆菌lac操纵子 ,它们使载体中带有大肠杆菌lac操纵子的调节序列和编码β半乳糖苷酶N末端146个氨基酸的序列。用异丙基--D-半乳糖 苷(IPTG)可诱导这个末端片段的合成,合成的片段能与宿主 编码的β-半乳糖苷酶缺陷型进行互补,恢复该酶的活性,这 一过程称为α-互补。
影响因素:
1、dNTP的质量与浓度——dNTP的质量与浓度和PCR扩增效率有密 切关系,dNTP粉呈颗粒状,如保存不当易变性失去生物学活性。
2、模板(靶基因)核酸——模板核酸的量与纯化程度,是PCR成败 与否的关键环节之一。
3、Mg2+浓度——Mg2+对PCR扩增的特异性和产量有显著的影响, 在一般的PCR反应中,各种dNTP浓度为200umol/L时,Mg2+浓度为 1.5~2.0mmol/L为宜。Mg2+浓度过高,反应特异性降低,出现非特 异扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6、重组DNA的鉴定
1、含目的基因质粒DNA的提取
实验原理:
在PH为12.6的碱性环境下,利用细菌 染色体完全变性而质粒DNA为完全分离的 性质,再将溶液PH调至中性,质粒DNA恢 复原状,细菌线性DNA变为沉淀而除去
1、含目的基因质粒DNA的提取
实验步骤:
1. 收集细胞
2. 悬浮细胞
1.5mL 菌液12000rpm 菌体沉淀 250μl 剧烈震荡
实验原理:
转化技术的关键在于制备感受态细胞, 本实验是利用CaCl2转化法,细菌在低温,低 渗的溶液中,菌体细胞膨胀成球形,局部失 去细胞壁,外来DNA可形成粘合物黏附在细 胞表面,经过42℃短暂热冲击,使DNA复合 物进入细胞。
4、重组DNA的转化
热
实验步骤:
激
感受态细菌 100 l
+
连接产物 混匀 10 l 冰浴中30分钟
它的这一些性质为生物学研究提供了 很好的标记分子,可以在黑暗的显微镜视 场中观察到细胞中的细胞器等结构,而且 还能够标记活细胞,使得活细胞中结构的 观察成为可能。
绿色荧光蛋白简介
下村修
马丁·沙尔菲
钱永健
他们因为在研究绿色荧光蛋白方面所作的 贡献而分享了2008年的诺贝尔化学奖
实验目的
掌握绿色荧光蛋白的基因克隆的一般步骤,加深 对基因克隆的认识,如:
2、PCR扩增目的基因
实验步骤:
① 94℃预变性5分钟后开始以下循环 ② 94℃ 30 秒
56℃ 30 秒 30 循环 72℃ 1 分钟 ③ 72℃ 7 分钟 ④ 4 ℃ 保温 实验过程约1小时50分钟
2、PCR扩增目的基因
电泳结果:
结果分析:
3、构建重组DNA
实验原理: 利用pMD18-T Vector这个高效克隆PCR
6、重组DNA的鉴定
实验原理: 提取菌体内重组DNA,运用限制性内
切酶EcoR Ⅰ、Hind Ⅲ对重组DNA进行酶切, 将酶切产物进行电泳,将结果与理论值相 比较
6、重组DNA的鉴定
实验步骤:
1. 收集细胞
2. 悬浮细胞
1.5mL 菌液12000rpm 菌体沉淀 250μl 剧烈震荡
1 min
溶液S1
绿色荧光蛋白的克隆 实验汇报
组员:洪旭伟 唐开强 胡巍然 蔡毅
绿色荧光蛋白简介
绿色荧光蛋白 (GFP)是一种存 在于水母、水螅和 珊瑚等腔肠动物体 内的发光蛋白,其 基因所产生的蛋白 质,在蓝色波长范 围的光线激发下, 会发出绿色荧光。
绿色荧光蛋白简介
绿色荧光蛋白相对荧光素/荧光素酶的优点: 1、发光机理简单 2、光毒性非常弱
5、重组DNA的筛选
实验步骤:
①培养基平板的准备:分别在加有抗生素(氨 苄青霉素(Amp))和没有加入抗生素的琼脂平板 上加40ul X-gal储存液和4ul IPTG溶液; ②设置对比组及涂布:取转化菌若干与受体菌 液若干,与预先加入的X-gal和 IPTG混合,用无 菌玻璃涂布器把溶液涂布于整个平板的表面, 于37°C正面朝上培养,直至菌液完全吸收;
掌握碱裂解法提取质粒的方法 掌握紫外吸收测定DNA的方法 了解质粒酶切鉴定原理 掌握琼脂糖凝胶电泳技术
在提高实验技能的同时,还要注重提高自身的实 验素养以及培养严谨的科学研究态度
实验材料
大肠杆菌DH5a菌株 pMD18-T载体 易瑞质粒小量提取试剂盒
BioWest电泳琼脂糖干粉 0.5×TBE核酸电泳缓冲液 EB 核酸荧光染料 Takara 6 × 电泳上样缓冲液
250μl 裂解液S2
3. 裂解细胞 颠倒混匀4-6次
室温静置
4. 中和 350μl 中和液S3
温和地 颠倒混匀6-8次
12,000rpm 10 min
至出现白色
絮状沉淀
3~5min 5. 过柱分离 12,000rpm
取600μl上清至 30s 吸附柱管
弃滤液
6. 洗柱 12,000rpm
600μl
产物的专用载体,在连接液中短时间对目 的基因与载体进行连接
3、构建重组DNA
实验步骤:
①在微量离心管中配制下列DNA溶液:
pMDTM18-T Vector 0.5μl
Insert DNA
1μl
dH2O
3.5μl
②加入5 μl(等量)的 Solution I。
③16℃反应45分钟。
4、重组DNA的转化
Takara EcoRI 限制性内切酶 Takara Hind III 限制性内切酶 Takara 10 × M 酶切缓冲液
实验仪器
恒温摇床 台式高速离心机 PCR仪 水平电泳槽 电泳仪 水浴锅
1、含目的基因质粒的提取
2、PCR扩增目的基因
实 验
3、构建重组DNA
步
4、重组DNA原理:
PCR由变性—退火—延伸这三个基本反应 构成: ①模板DNA的变性,即加热使DNA双链解离为 单链; ②退火降温后,引物与模板DNA单链配对结合; ③DNA模板—引物结合物在TaqDNA聚合酶的作 用下,合成一条新的与模板DNA链互补的复制 链。经过2~3小时的扩增,目的基因就能扩增 几百万倍
42℃水浴 90秒
勿 动
涂板 培养过夜
加入800l LB培养液 37℃振荡培养45分钟
冰浴1-2分钟
5、重组DNA的筛选
实验原理:
载体DNA控制产生的产物α-肽与宿主菌 染色体上的DNA控制产生的产物ω-肽,结合 为具有完整β-半乳糖苷酶活性的蛋白质。在 诱导剂IPTG的作用下,细菌可产生蓝色菌落。 当外源DNA插入到载体质粒的多克隆位点后, 无法形成具有完整β-半乳糖苷酶活性的蛋白 质,使得带有重组质粒的细菌形成白色菌落
1 min
溶液S1
250μl 裂解液S2
3. 裂解细胞 颠倒混匀4-6次
室温静置
4. 中和 350μl 中和液S3
温和地 颠倒混匀6-8次
12,000rpm 10 min
至出现白色
絮状沉淀
3~5min 5. 过柱分离 12,000rpm
取600μl上清至 30s 吸附柱管
弃滤液
6. 洗柱 12,000rpm
600μl
30s 弃滤液
洗涤液W
7. 洗脱
取吸附柱至 50μl 56℃预热 另一新EP管 洗脱液
600μl 洗涤液W
12,000rpm
10,000rpm
30s 弃滤液 2 min
空柱
室温静置 1min
12,000rpm
1 min 收集洗脱液备用
1、含目的基因质粒DNA的提取
电泳结果:
结果分析:
2、PCR扩增目的基因
