元素常用光谱特征线解析
3.光谱定性定量分析解读

光谱定性分析中注意问题
只有当元素含量低时,最后线也就是光谱中的最灵敏线,但 在含量高时,由于光谱线中谱线的自吸效应而影响其灵敏度 自吸现象:常规的光源其发光区域中间温度高而四周温度低, 发光层四周的蒸汽原子,一般比中心原子处于较低的能级, 因而当辐射能量通过这段路程时,将为其自身的原子所吸收, 而使谱线中心强度减弱 元素浓度低时,不出现自吸。 随浓度增加,自吸越严重,当 达到一定值时,谱线中心完全 吸收,如同出现两条线,这种 现象称为自蚀。
(3)摄谱过程
摄谱顺序:碳电极(空白)、铁谱、试样;
分段曝光法:先在小电流(5A)激发光源摄取易挥发元素光 谱调节光阑,改变暴光位置后,加大电流(10A),再次暴光 摄取难挥发元素光谱;
为了避免摄取光谱时感光板移 动机构带来的机械误差,而造
成分析时铁光谱与试样光谱的
波长位置不一,采用哈特曼光 阑,可多次暴光而不影响谱线
2. 光谱定量分析
(1) 发射光谱定量分析的基本关系式
在条件一定时,谱线强度I 与待测元素含量c关系为: I=ac a为常数(与蒸发、激发过程等有关),考虑到发射光谱中 存在着自吸现象,需要引入自吸常数 b ,则:
I a cb lg I b lgc lg a
发射光谱分析的基本关系式,称为塞伯-罗马金公式(经验 式)。自吸常数 b 随浓度c增加而减小,当浓度很小,自吸
消失时,b=1。
(2) 内标法基本关系式
影响谱线强度因素较多,直接测定谱线绝对强度计算难以 获得准确结果,实际工作多采用内标法(相对强度法)。 在被测元素的光谱中选择一条作为分析线(强度I),再 选择内标物的一条谱线(强度I0),组成分析线对。则:
I a cb
b0 I 0 a 0 c0
常见合金元素光谱分析(含线位置)

紫色区域、Fe1的右侧(4379.7) 20~30s/2mm
蓝绿色区域、双Fe线27、28右侧, 29左侧(4875.5)
20~30s/2mm 40s/2mm 40s/2mm 40s/2mm 40s/2mm 40s/2mm 17s/2mm 17s/2mm 17s/2mm
绿色区域Fe43、44左侧 (5035.4) 绿色区域Fe45、46右侧 (5053.3) 绿色区域Fe45、46右侧 (5054.6) 绿色区域、双铁线40、41左侧 (4990.5) 绿色区域、Fe37左侧第四根 (4961.7)
0.3~1.3%时出现 0.3~1.3%时出现 0.3~1.3%时出现
橙色区域、8根线Fe96、98 (6013.5) 橙色区域、8根线Fe96、98 (6016.6) 橙色区域、8根线Fe96、98 (6021.8)
常见合金元素分析
化学成分 出现条件
在含铬量在8%~31%时 出现
≤0.03%时Cr5不出现,表 示不含Cr
特征(谱线位置)
绿色区域、Fe31/32/35(4922.3) 黄绿色区域、Fe72/73/74 (5345.8) 黄绿色区域、Fe72/73/74 (5348.3) 黄绿色区域、铁线左侧 (5533.0) 黄绿色区域、几乎与Fe87重合 Fe83/84/88/89(5570.5) 橙色区域、Fe98 的右侧 (6030.7)
预燃/极距
10s/1.5mm 10s/1.5mm 10s/1.5mm 40s/2mm 40s/2mm 40s/2mm
Cr1 Cr5 Cr6 Mo3 Mo4 Mo5 V1 V8 Ni3 W2 W3 Ti3 Ti25%时出现 >0.4%时出现
>0.15%时出现 0.8~2.5%时出现 <1%时含量估计比较困 难 1.5~25%时出现 1.5~25%时出现 0.1~0.3%时出现
光谱定性定量分析

Ⅱ显线法
元素含量低时,仅出现少数灵敏线,随元素含量增加, 谱线随之出现。可编成一张谱线出现与含量关系表,依此估 计试样中该元素的大致含量。
应用:用于钢材、合金等的分类、矿石品位分级等大批 量试样的快速测定。
(3)摄谱过程
摄谱顺序:碳电极(空白)、铁谱、试样; 分段暴光法:先在小电流(5A)激发光源摄取易挥发元素 光谱调节光阑,改变暴光位置后,加大电流(10A),再次暴光 摄取难挥发元素光谱;
采用哈特曼光阑,可多 次暴光而不影响谱线相对位 置,便于对比。
二、 光谱定量分析
1. 光谱半定量分析
Ⅰ谱线黑度比较法
一、 光谱定性分析
定性依据:元素不同→电子结构不同→光谱不同→特征光谱 元素的原子结构不同时,产生不同的光谱,也就是说,通过 谱线存在否,确某元素可否存在。 1.元素的分析线、最后线、灵敏线 分析线:复杂元素的谱线可能多至数千条,只选择其中几条 特征谱线检验,称其为分析线; 最后线:浓度逐渐减小,谱线强度减小,最后消失的谱线; 灵敏线:最易激发的能级所产生的谱线,每种元素都有一条 或几条谱线最强的线,即灵敏线。最后线也是最灵敏线; 共振线:由第一激发态回到基态所产生的谱线;通常也是最 灵敏线、最后线;
例如,铅的光谱
Pb % 0.001
0.003
0.01 0.03 0.10
0.30
谱线特征 2833.069 清晰可见 2614.178和2802.00弱
2833.069 清晰可见 2614.178增强2802.00变清晰
上述谱线增强,2663.17和2873.32出现 上述谱线都增强 上述谱线更增强,没有出现新谱线
发射光谱诊断铯-概述说明以及解释

发射光谱诊断铯-概述说明以及解释1.引言1.1 概述铯是一种化学元素,属于第五族元素,原子序数为55,化学符号为Cs。
它是一种软银白色的金属,在自然界中比较稀少,主要存在于矿石中。
铯在工业生产中具有广泛的应用,特别在电子设备、光电子器件和医学诊断等领域发挥着重要作用。
光谱诊断是一种常用的分析方法,通过观察样品发射光谱谱线的特征,可以识别物质的成分及浓度。
对于铯元素的诊断和分析,发射光谱是一种有效的手段。
本文旨在探讨发射光谱在铯元素诊断中的应用,通过详细阐述铯元素的特性和光谱诊断原理,探讨发射光谱在铯元素分析中的重要性和应用价值。
同时,展望未来研究方向,为铯元素的光谱诊断研究提供一定的参考和指导。
1.2文章结构文章结构部分是对整篇文章的布局和组织进行概括和说明。
在本文中,文章结构部分应该包括对整个文章中各个部分的简要介绍,指引读者了解整篇文章的结构和内容,为读者提供清晰的导航和阅读方向。
下面是文章结构部分的内容:"1.2 文章结构:本文将首先介绍铯元素的基本特性和重要性,然后详细解释发射光谱诊断的原理和方法。
接着,将探讨发射光谱在铯元素诊断中的具体应用,并分析其优势和局限性。
最后,总结发射光谱诊断铯的重要性,并展望未来研究的方向。
通过全面深入地讨论,本文旨在为读者提供关于发射光谱诊断铯的全面了解,促进该领域的研究和进展。
"1.3 目的本文旨在探讨发射光谱诊断铯元素的重要性和应用,通过对铯元素的简介、光谱诊断原理及在铯元素诊断中的具体应用进行详细阐述,旨在为读者提供对于该诊断方法的全面了解。
同时,通过总结发射光谱诊断铯的重要性,并展望未来研究方向,希望能够激发更多科研人员对于发射光谱在铯元素诊断中的研究兴趣,推动该领域的快速发展。
最终目的是为铯元素的诊断提供更准确、快捷的方法,为相关领域的发展和应用提供有力支持。
2.正文2.1 铯元素简介铯是一种化学元素,位于周期表的第五周期第一族元素,原子序数为55,原子量为132.91。
光谱定性、定量分析

c.标准加入法 无合适内标物时,采用该法。 取若干份体积相同的试液(cX),依次按比例加入不同量的 待测物的标准溶液(cO),浓度依次为: cX , cX +cO , cX +2cO , cX +3cO , cX +4 cO …… 在相同条件下测定:RX,R1,R2,R3,R4……。 以R对浓度c做图得一直线,图中cX点即待测溶液浓度。 R=Acb b=1时,R=A(cx+ci ) R=0时, cx = – ci
三、原子发射光谱分析法的应用
原子发射光谱分析在鉴定金属元素方面(定性分析)具 有较大的优越性,不需分离、多元素同时测定、灵敏、快捷 ,可鉴定周期表中约70多种元素,长期在钢铁工业(炉前快 速分析)、地矿等方面发挥重要作用; 在定量分析方面,原子吸收分析有着优越性; 80年代以来,全谱光电直读等离子体发射光谱仪发展迅 速,已成为无机化合物分析的重要仪器。
(3)摄谱过程 )
摄谱顺序:碳电极(空白)、铁谱、试样; 摄谱顺序 分段暴光法:先在小电流(5A)激发光源摄取易挥发元素 分段暴光法 光谱调节光阑,改变暴光位置后,加大电流(10A),再次暴光 摄取难挥发元素光谱; 采用哈特曼光阑,可多 次暴光而不影响谱线相对位 置,便于对比。
二、 光谱定量分析
§1-3 光谱定性、定量分析 光谱定性、
一、 光谱定性分析
定性依据:元素不同 电子结构不同 光谱不同→特征光谱 电子结构不同→光谱不同 定性依据:元素不同→电子结构不同 光谱不同 特征光谱 元素的原子结构不同时,产生不同的光谱,也就是说, 元素的原子结构不同时,产生不同的光谱,也就是说,通过 谱线存在否,确某元素可否存在。 谱线存在否,确某元素可否存在。 1.元素的分析线、最后线、灵敏线 元素的分析线、最后线、 分析线: 分析线:复杂元素的谱线可能多至数千条,只选择其中几条 特征谱线检验,称其为分析线; 最后线: 最后线:浓度逐渐减小,谱线强度减小,最后消失的谱线; 灵敏线: 灵敏线:最易激发的能级所产生的谱线,每种元素都有一条 或几条谱线最强的线,即灵敏线。最后线也是最灵敏线; 共振线:由第一激发态回到基态所产生的谱线;通常也是最 共振线 灵敏线、最后线;
常用元素分析方法

X射线荧光光谱
X射线荧光光谱法在化学分析中的应用 主要使用X射线束激发荧光辐射,第一次是在1928年由格洛克尔和施雷伯提出的。到了现在,该方法作 为非破坏性分析技术,并作为过程控制的工具,广泛应用于采掘和加工工业。原则上,最轻的元素,可分析 出铍(z=4),但由于仪器的局限性和轻元素的低X射线产量,往往难以量化,所以针对能量分散式的X射线 荧光光谱仪,可以分析从轻元素的钠(z=11)到铀,而波长分散式则为从轻元素的硼到铀。
电子探针在表面材料分析中的应用
电子探针显微分析
14
X射线能谱分析
X光电子能谱分析的基本原理:一定能量的X光照射 到样品表面,和待测物质发生作用,可以使待测物质原 子中的电子脱离原子成为自由电子。该过程可用下式表 示: hn=Ek+Eb+Er 其中: hn:X光子的能量; Ek:光电 子的能量;Eb:电子的结合能;Er:原子的反冲能量。 其中Er很小,可以忽略。
5
原子吸收光谱
应用: 原子吸收光谱法已成为实验室的常规方法,
能分析70多种元素,广泛应用于石油化工、环 境卫生、冶金矿山、材料、地质、食品、医药 等各个领域中。
如图是我们实验室光催化降解染料所测的光谱图, 主要是对污染物的降解,运用原子吸收光谱仪来测其 吸光度的降解。
6
原子发射光谱
原子发射光谱法,是指利用被激发原子 发出的辐射线形成的光谱与标准光谱比较, 识别物质中含有何种物质的分析方法。用电 弧、火花等为激发源,使气态原子或离子受 激发后发射出紫外和可见区域的辐射。某种 元素原子只能产生某些波长的谱线,根据光 谱图中是否出现某些特征谱线,可判断是否 存在某种元素。根据特征谱线的强度,可测 定某种元素的含量。一次检验可把被检物质 中的元素全部在图谱上显现出来,再与标准 图谱比较。可测量元素种类有七十多种。灵 敏度髙,选择性好,分析速度快。在司法鉴 定中,主要用于泥土、油漆、粉尘类物质及 其他物质中微量金属元素成份的定性分析。 定量分析较复杂且不准确。
元素常用光谱特征线解析

元素常用光谱特征线解析元素的光谱特征线是指在元素的光谱中具有较强的发射或吸收强度的特定频率的谱线。
每种元素都具有一组独特的光谱特征线,这些特征线可以用来鉴定元素的存在和测量其浓度。
本文将对元素常用的光谱特征线进行解析。
元素的光谱特征线可以分为两类:发射谱特征线和吸收谱特征线。
发射谱特征线是指当元素被加热或激发时,电子从高能级跃迁到低能级时产生的辐射。
这种辐射的频率和波长是特定的,由元素原子的电子能级结构决定。
每个元素都有一组特定的发射谱特征线,可以用来确定元素的存在和浓度。
以氢为例,氢原子的电子能级结构简单,只有一个电子。
当氢原子的电子从高能级跃迁到低能级时,会产生一系列的发射谱特征线。
其中最常见的是氢原子的巴尔末系列,包括巴尔末系、帕舍特系、布拉开特系等。
吸收谱特征线是指当元素被辐射物质(如气体或溶液)或固体吸收辐射时产生的谱线。
这些吸收谱特征线通常是元素的发射谱特征线的反向谱线,即在原子吸收谱中出现的吸收峰对应于原子发射谱中的发射峰。
以钠为例,钠原子的光谱中有两个重要的吸收谱特征线,分别是在波长为589.0纳米(黄线)和589.6纳米(黄线)的位置。
这两个吸收谱特征线被广泛用于测量钠的浓度,特别是在食品、环境和药物等领域。
除了上述的发射和吸收谱特征线,还有一些元素具有其他特殊的光谱特征线,如锂的谱线在紫外和蓝光区域,铝的谱线在紫外和红外区域,铜的谱线在绿光区域等。
光谱特征线的解析可以通过光谱仪进行。
光谱仪是一种将光谱分解为不同波长的光线的仪器。
常用的光谱仪包括光栅光谱仪、衍射光谱仪和干涉光谱仪等。
总之,光谱特征线是元素光谱中具有较强发射或吸收强度的特定频率的谱线。
各元素的光谱特征线是由其原子的电子能级结构决定的,可以用于鉴定元素的存在和测量其浓度。
了解和解析元素的光谱特征线对于理解和应用光谱学在化学分析、物质检测和新材料研究等领域具有重要意义。
莫塞莱定律图解用于选择X射线特征线

元素Mo K能级的激发电位示意图
在钼的K系激发电位20KV以下, 仅能产生连续谱,当电压为20KV 时,连续谱上迭加着微弱的钼的 K系特征谱线。
参考文献:
[1] 杨福家. 原子物理学(第三版). 北京:高等教育出版社, 1999
[2]杨福家. 原子物理学(第三版). 北京:高等教育出版社, 1999
以钼为例, 取吸收边理论值,高速电子的能量 等于K层被移走一个电子并使其脱离原子的能 量.
计算结果即为查资料得到钼的K谱线激发电位 理论值为20.02KV.
电子轰击出的X射线,早先出现的是能量较小的 Kα射线,是靶原子的电子从L层跃迁到K层放出的X 光,所以选取探测Kα射线.经NaCl晶体衍射,发 射谱中Kα特征谱出现在β=7.2°,可以根据在β =7.2°处是否出现峰值,判断钼靶是否发射特 征谱,以此判断钼靶是否产生X光K系列特征波。
Thank you!
如果把各元素的特征X射线的频率的平方根对 原子序数作标绘,就会得到线性关系。这就 是莫塞莱当年得出的规律,称为莫塞莱定律。
各元素的特征X射线能量值(或波长值)各不相 同,被用来作为元素的标识,所以又可以称为 元素的标识谱。
特征线的波长相当于高层电子填充该能级空位 时所释放的能量,谱线的波长必然大于吸收边 的波长,谱线的能量必然小于吸收限的能量。
钼靶上打出的X射线发射谱 横坐标为X射线经NaCl晶体的入射角
纵坐标为收集极记录X射线强度
吸收限的波长等价于产生内层轨道空位 所吸收的能量,等价于从该能级上移走 一个电子并使其脱离原子的能量。
产生K系X射线的阈能大于K系X射线本身的能量
图二为钼吸收片的透射率与 X射线能量的关系。Kα和Kβ 是钼的标识K系X射线的能量.
稀土元素的光谱特征及

其中Sm3+ Eu3+除了基态(6H5/2, 7F0)向激
3
发态跃迁外,还存在着由第一、二激发态
4
( Sm3+ :6H7/2 和Eu3+ :7F1 7F2)向更高能态
5
的跃迁。能级图.ppt
6
Sm3+ Eu3+的这种有别于其它三价稀土离子
7
的情况是由于Sm3+ 的6H7/2 和Eu3+ 的7F1 7F2
8
能级与基态能级差太小,常温下部分离子可居于
9
上述能态的原因。
10
2.f-d跃迁光谱 稀土离子的f-d跃迁光谱不同于f-f跃迁光 谱。 4f n → 4f n-15d1跃迁是组态间的跃迁。 这种跃迁是宇称选律规则允许的,因此 4fn→4fn-15d1跃迁强度较大。 摩尔消光系数 Є=50-800 l/molcm。 稀土离子(III)的4fn → 4fn-15d1 跃迁吸收带一般出现在紫外光区。 并具有以下 特点:
3-3稀土配合物的吸收光谱
当稀土离子与配体形成配合物时,配
体场对稀土离子的f-f跃迁光谱产生一定
的影响,通常使f-f跃迁谱带位置发生移
动,同时也会改变谱带的强度。
下面我们将从这两个方面分别讨论稀
土配合物的吸收光谱。
01
02
形成配合物后中心离子与配体之间存
01
在着某种程度的共价作用,这种共价作用
04
移;
05
配体的电子云部分转移到稀土离子的
06
空的6s6p轨道上形成部分共价键,同时
07
对4f轨道能级产生影响,使4f轨道能级发
08
生改变,导致谱带位移。
影响电子云重排效应的因素: a.配体的性质: 稀土离子配合物电子云重排效应的 大小可定量的用电子云重排参数 (1-β,)来表示。 (1-β,)越大表示谱带位移程度 越大。
光谱分析的原理与元素的特征线谱

光谱分析的原理与元素的特征线谱光谱分析是一种通过分析物质所发射或吸收的电磁辐射谱线来确定其元素组成的方法。
在这种分析过程中,可以利用光的特性来研究物质的结构、性质和化学组成。
下面将介绍光谱分析的原理以及元素的特征线谱。
一、光谱分析的原理光谱分析的基本原理是根据物质对电磁辐射的吸收和发射特性来研究物质的组成。
当物质受到激发或加热时,会发射出一系列的特定波长的光线,这些波长构成了物质的特征线谱。
而当物质处于外部光源照射下时,会吸收掉一部分特定波长的光线,这些被吸收掉的波长也构成了物质的特征线谱。
光谱分析通常通过光的分散、检测和记录来实现。
首先,将光通过光栅或棱镜进行分散,将不同波长的光分离开来。
然后,使用光电探测器将分散后的光信号转换为电信号。
最后,将电信号记录下来,并通过计算机等设备进行数据处理。
光谱分析可以应用于多种领域,如天文学、材料科学、环境监测等。
通过分析物质的特征线谱,可以得到物质的元素组成、浓度、结构等信息。
二、元素的特征线谱每种元素都有其特定的特征线谱,这些谱线由元素原子的电子在能级跃迁过程中所产生。
光谱中的谱线位置、强度和形状与元素的能级结构和物理性质等密切相关。
下面以几种常见元素为例,介绍其特征线谱。
1. 氢氢是最简单的元素,其特征线谱被称为巴尔末系列。
巴尔末系列包括了一系列波长较长的谱线,其中最强的几条谱线位于紫外光区域,通常不可见。
2. 氦氦是第二轻的元素,其特征线谱主要包括黄线和红线。
其中,黄线位于黄色光区,红线位于红色光区。
3. 锂锂的特征线谱主要包括红线和蓝线。
红线位于红色光区,蓝线位于蓝色光区。
4. 铁铁的特征线谱非常丰富,包括了多条紫外、可见和红外光谱线。
其中,铁的可见光谱线主要分布在黄色和绿色光区。
通过这些元素的特征线谱,可以通过光谱分析的方法来确定物质中的元素种类和含量。
不同元素的特征线谱是非常重要的标识,其独特性使得光谱分析成为一种非常有效的化学分析方法。
总结:光谱分析是一种通过分析物质所发射或吸收的电磁辐射谱线来确定其元素组成的方法。
第十章 原子吸收光谱法

二、原子化系统
作用是将试样中待测元素转变成原子蒸气。 1.火焰原子化法 (1)雾化器:作用是将试样溶液雾化。当助
燃气高速通过时,在毛细管外壁与喷嘴口构 成的环形间隙中,形成负压区,将试样溶液 吸入,并被高速气流分散成气溶胶,在出口 与撞击球碰撞,进一步分散成微米级的细雾。 (2)混合室:作用是将未被细微化的较大雾 滴在混合室内凝结为液珠,沿室壁流入泄漏 管排走;并让气溶胶在室内与燃气充分混匀。
第十章 原子吸收光谱法
§10-1 §10-2 §10-3 §10-4 §10-5 §10-6
试题
概述 原子吸收法的基本原理 原子吸收分光光度计 定量分析方法 干扰及其抑制方法 灵敏度与检出限
1
§10-1 概述
一、 原子吸收光谱法
原子吸收光谱是利用待测元素的原子蒸 气中基态原子对特征电磁辐射(共振线)的吸 收来测定的。
式中ν0为谱线中心频率;M 为吸光原子的相对 原子质量;T 为绝对温度。 ΔνD约10-3数量
级,是谱线变宽的主要原因。 3.碰撞变宽(压力变宽) 由于原子相互碰撞使能量发生轻微变化。
劳伦兹变宽ΔνL :待测原子和其他原子碰撞引
起的谱线变宽。
ΔνL约10-3数量级,是碰撞变宽的主要因素。
10
赫鲁兹马克变宽ΔνH :同种原子碰撞引起的
29
二、标准加入法
取若干份体积相同的试液(cX),依次按比 例加入不同量的待测物的标准溶液(cO), 定容后浓度依次为:cX、cX+cO、cX+2cO、 cX+3cO、cX+4cO,分别测得吸光度为:A0、 A1、A2、A3、A4。以A对浓度c做图得一直 线,图中cX点即待测溶液浓度。
30
注意: 1.本法只能消除基体效应带来的干扰,不能消
特征光谱(或特征光谱线组)理论基础基本原理

(在光谱定性分析中还有一个“最后线” 的概念它是指样品中被检测元素浓度 逐渐减小时而最后消失的谱线,一般说 来,最后线就最灵敏的谱线)
例如:含有10%Cd的溶液的光谱中,可以 出现14条Cd谱线 当Cd的含量为0.1%时,出现10条 当Cd的含量为0.01%时,出现7条 而到Cd的含量为0.001%时,仅出现一 条光谱线(226.5nm)因此,这条谱线是 Cd的最后线
离子线:原子最外层电子激发到无穷 远处,剩下的离子的外层电子跃迁时发 射的谱线叫离子线。 三、定量分析的依据
分析元素谱线强度与该元素含量之间 存在的比例关系, 因此进行光谱定量分 析时, 是根据被测试样光谱中欲测元素 的谱线强度来确定元素浓度的
1. 罗马金公式: I=acb(3-5)
是光谱定量分析依据的基本公式,式中a 及b是两个常数,常数a是与试样的蒸发, 激发过程和试样组成等有关的一个参数。 常数b, 称为自吸系数,它的数值与谱线 的自吸收有关。所以,只有控制在一定 的条件下,在一定的待测元素含量的范 围内, a和b才是常数。
有所不同,a 值同谱线的固有强度 成正比;d为弧层厚度
谱线的固有强度越大, 自吸系数越 大, 自吸现象愈严重, 共振线是原子由 激发态跃迁至基态产生的, 强度较大, 最易被吸收, 其次, 弧层越厚, 弧层被 测元素浓度愈大, 自吸也愈严重。直 流电弧弧层较厚, 自吸现象最严重。
进行定量分析应注意: ① 保证含量要低 ② 无自吸的谱线可做分析线 即无“R”或“r”标志
直线段的斜率为γ,则
γ =tgα γ(斜率) :称为感光板的反衬度
光谱定量分析一般在正常曝光 部分内工作
γ : 感光板的反衬度。 它是感光板的重要特性之一,它表示 当曝光量改变时,黑度变化的快慢。
各种元素的本生灯光谱

各种元素的本生的灯光谱元素的本生光谱(也称为原子光谱或线谱)是指当元素被激发时,其原子发射或吸收特定波长的光而产生的光谱。
这种光谱是由元素的原子结构决定的,因此每种元素都有其独特的光谱特征。
本生光谱是光谱分析的基础,可以用来识别和量化元素。
以下是一些常见元素的本生光谱特征:1. 氢(H):氢的巴尔末系列是可见光区域中最著名的光谱线,包括波长为397、410、434、486、656纳米的谱线。
2. 氦(He):氦的谱线包括波长为58、447、468、476、492纳米的谱线。
3. 锂(Li):锂的谱线包括波长为610、625、680纳米的谱线。
4. 钠(Na):钠的谱线包括波长为588、616、655、760纳米的谱线,其中588纳米的黄色谱线是最为明显的。
5. 钾(K):钾的谱线包括波长为404、422、435、670、770纳米的谱线。
6. 钙(Ca):钙的谱线包括波长为422、445、660、790纳米的谱线。
7. 铝(Al):铝的谱线包括波长为396、410、434、484、663纳米的谱线。
8. 硅(Si):硅的谱线包括波长为455、498、610纳米的谱线。
9. 磷(P):磷的谱线包括波长为394、405、426、480、620纳米的谱线。
10. 硫(S):硫的谱线包括波长为395、407、432、615纳米的谱线。
11. 氯(Cl):氯的谱线包括波长为405、435、475、510、675纳米的谱线。
12. 氩(Ar):氩的谱线包括波长为411、419、445、471、497、514、660、799纳米的谱线。
这些光谱线可以用于光谱分析,通过比较样品光谱和已知元素光谱的特征,可以确定样品中存在的元素种类和含量。
本生光谱分析是化学、物理、材料科学等领域的重要分析技术。
光谱 光谱分析
乙
有金属蒸气的发射光谱是线状光谱 D、在吸收光谱中,低温气体原子吸收的光恰好就
是这种气体原子在高温时发出的光
思考与研讨
4、关于光谱分析,下列说法错误的是:( D) A、光谱分析的依据是每种元素都有其独特的特征
谱线 B、光谱分析不能用连续光谱 C、光谱分析既可以用线状谱也可以用吸收光谱 D、分析月亮的光谱可得知月球的化学组成
思考与研讨
1、下列物质能产生线状谱的是:( D)
A、炽热的钢水 B、炽热的高压气体 C、发光的白炽灯 D、试电笔内氖管
2、下列产生吸收光谱的是:( D)
A、霓红灯发光产生的光谱 B、蜡烛火焰 C、高压水银灯发光产生的光谱 D、白光通过温度较低的钠蒸气
思考与研讨
3、关于光谱的下列说法中正确的是:( AB)D A、连续光谱和线状光谱都是发射光谱 B、线状光谱的谱线含有原子的特征谱线 C、固体、液体和气体的发射光谱是连续光谱,只
上分别会聚成不同颜色的像(谱线)。通过望远
镜B的目镜L3,就看到了放大的光谱像。
一、光谱
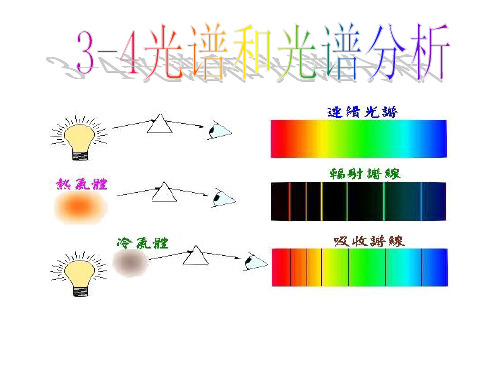
1、光谱:光按一定频率或波长排列的彩色光带。 2、分类:发射光谱和吸收光谱。
二、发射光谱
• 1、发射光谱:物体发光直接产生的光谱。 • 2、分类:连续光谱和明线光谱。
3、连续光谱
(1)定义:连续分布的包含有从红光到紫光各种 色光的光谱。
{ 光
线状光谱 产生条件:稀薄气体发光形成的光谱
谱
(原子光谱) 光谱形式:一些不连续的明线组成,不同
元素的明线光谱不同(又叫特征光谱)
定义:连续光谱中某些波长的光被物质吸收后
吸 产生的光谱
收 产生条件:炽热的白光通过温度较白光低的
光 谱
不同元素的光谱

不同元素的光谱光谱是一种通过分析物质所发出或吸收的光的性质和特征来研究物质本质的方法。
在自然界中,有许多不同元素都可以通过光谱进行研究和分析。
不同元素的光谱具有各自独特的特点和应用价值。
本文将分别介绍几种常见元素的光谱特征及其应用。
一、氢元素的光谱氢元素是宇宙中最常见的元素之一,在自然界中广泛存在。
氢的光谱分为连续光谱和线状光谱两种。
连续光谱是指由各种波长、连续的光组成的光谱。
线状光谱则是指在连续光谱中出现的明亮或暗淡的曲线,由分离的光线组成。
氢元素的光谱分析在天文学和物理学领域都有重要应用。
通过氢的光谱,科学家们可以研究恒星的性质、结构和演化过程。
同时,氢的光谱还可以用于观测宇宙中其他天体的光谱,帮助我们了解宇宙的组成和演化。
此外,氢的光谱还被应用于核物理实验中,用于研究原子和分子的结构,以及激光技术的发展。
二、氦元素的光谱氦元素是地壳中第二丰富的元素,在宇宙中也广泛存在。
氦的光谱是以明亮的黄色和淡紫色线状光谱为主,这些光谱线称为谱线。
氦元素的光谱线是通过电子跃迁而形成的,其波长和能量呈特定的离散分布。
氦的光谱广泛应用于氦气激光器的研究和制造。
氦激光器是一种重要的激光装置,其在医疗、科研、通信等领域中有广泛应用。
通过分析氦的光谱,科学家们可以了解氦气原子的能级结构,进而优化和改进氦气激光器的设计和性能。
三、氖元素的光谱氖元素是一种惰性气体,在大气中含量较少。
氖气的光谱主要由红、黄、绿和蓝四种颜色的谱线组成,其中黄色谱线最为明亮,被广泛应用于标志牌、广告灯等发光装置中。
氖的光谱线具有较窄的波长范围和较高的亮度,使得氖灯成为一种理想的光源。
氖灯不仅在照明领域得到广泛应用,还用于光谱分析、荧光标记和光学仪器校准等领域。
此外,氖的光谱线还可以用作标准线源,用于校准和校验光谱仪器。
四、氧元素的光谱氧元素是地球上重要的元素之一,在大气中占据相当的比例。
氧的光谱主要由氧原子和氧分子的吸收线谱构成,其特征是有许多明亮的和淡紫红色的谱带,分布在可见光和紫外线区域。
各种元素的光谱特征线

各种元素的光谱特征线
元素的光谱特征线主要用于识别和研究元素的化学和物理性质。
不同的元素有不同的光谱特征线。
1.铁(Fe)元素:光谱特征线主要有Fe I和Fe II两种类型。
Fe I的光谱特征线主要出现在紫外线和可见光区域,其中最明显的是
位于490.4 nm处的Fe I谱线,该谱线常用于电弧或火焰光谱法中测定铁元素的含量。
Fe II的光谱特征线则集中在可见光和近红外
光区域,其中最重要的是位于523.5 nm处的Fe II谱线,该谱线常用于光电离法中研究铁的电离能。
2.铜(Cu)元素:光谱特征线在可见光区域包括324.8 nm的Cu I谱线和521.8 nm的Cu I谱线,这两个谱线常用于火焰光谱法中
测定铜的含量。
此外,在红外光区域,铜还有一些显著的光谱特征线,如610.3 nm处的Cu I谱线和643.8 nm处的Cu I谱线,这些谱线常用于原子吸收光谱法中测定铜元素的含量。
3.钠(Na)元素的光谱特征线为黄色双线,波长589.0nm和589.6nm;
4.钾(K)元素的特征线为紫色双线,波长766.5nm和
769.9nm。
