2017兽药质量标准
gb2761-2017食品安全国家标准

gb2761-2017食品安全国家标准一、总则1.1 本标准规定了食品中污染物、真菌毒素、农药残留、兽药残留、放射性物质及其他危害物质的限量要求。
1.2 本标准适用于我国境内生产、加工、销售的各类食品。
1.3 食品生产经营者应严格执行本标准,保证食品的食用安全。
二、污染物限量2.1 食品中污染物的限量要求如下:(1)重金属及有害元素:铅、镉、汞、砷等;(2)有机污染物:多氯联苯、二噁英等;(3)其他污染物:苯并[a]芘、丙烯酰胺等。
2.2 食品中污染物的限量应符合表1中的规定。
三、真菌毒素限量3.1 食品中真菌毒素的限量要求如下:(1)黄曲霉毒素B1、B2、G1、G2;(2)赭曲霉毒素A;(3)伏马毒素B1、B2;(4)玉米赤霉烯酮;(5)T-2毒素、HT-2毒素。
3.2 食品中真菌毒素的限量应符合表2中的规定。
四、农药残留限量4.1 食品中农药残留的限量要求如下:(1)杀虫剂;(2)杀菌剂;(3)除草剂;(4)植物生长调节剂;(5)其他农药。
4.2 食品中农药残留的限量应符合表3中的规定。
五、兽药残留限量5.1 食品中兽药残留的限量要求如下:(1)抗生素;(2)合成抗菌药;(3)激素类药;(4)其他兽药。
5.2 食品中兽药残留的限量应符合表4中的规定。
六、放射性物质及其他危害物质限量6.1 食品中放射性物质及其他危害物质的限量要求如下:(1)放射性物质:铯-137、碘-131等;(2)其他危害物质:塑化剂、溴酸盐等。
6.2 食品中放射性物质及其他危害物质的限量应符合表5中的规定。
七、食品中致病微生物限量7.1 食品中致病微生物的限量要求如下:(1)沙门氏菌;(2)金黄色葡萄球菌;(3)副溶血性弧菌;(4)大肠埃希氏菌;(5)其他致病微生物。
7.2 食品中致病微生物的限量应符合表6中的规定。
八、食品添加剂使用要求8.1 食品添加剂的使用应符合国家有关食品添加剂使用的技术要求和卫生标准。
8.2 食品添加剂的使用不得超出规定的使用范围和使用量。
关于《中华人民共和国农产品质量安全法》(畜产品质量安全)执法检查情况的报告

关于《中华人民共和国农产品质量安全法》(畜产品质量安全)执法检查情况的报告主任、各位副主任、各位委员:按照省人大工作部署,根据市人大常委会2017年工作要点的安排,7月13日,市人大常委会执法检查组深入广华生猪定点屠宰场、湖北加益加生物科技有限公司、湖北南泥湾畜牧有限公司、潜江市病死畜禽无害化处理中心,采取听取汇报、查阅资料、实地察看等方式,对我市贯彻实施《中华人民共和国农产品质量安全法》(畜产品质量安全)(以下简称《农产品质量安全法》)情况进行了执法检查。
重点检查了我市畜产品质量安全及投入品管理、畜禽粪污资源化利用、病死畜禽无害化处理等工作情况。
现报告如下:一、我市贯彻落实《农产品质量安全法》的基本情况《农产品质量安全法》颁布实施以来,市政府及各相关部门依法履行工作职能,切实加强监督管理,全市畜产品质量安全水平不断提高,连续多年无重大畜产品安全事件发生,并于2016年成功创建国家农产品质量安全县(市)。
(一)强化监管责任,完善监管体系。
成立了畜产品质量安全监管工作领导小组,建立了市、镇、村三级畜产品安全监管网络体系,初步形成了覆盖投入品、养殖、检疫、屠宰、流通环节的全程监管体系。
一是坚持源头治理。
严格按照《兽药管理条例》《饲料和饲料添加剂管理条例》《动物防疫条件审查办法》等法律法规规定进行行政审批和备案,对饲料生产和涉牧企业审批备案率达到100%,生猪规模化养殖场监管率达98%以上。
同时,坚决依法依规取缔兽药无证经营、违规经营门店。
二是狠抓检疫屠宰。
严守产地检疫、屠宰检疫、运输检疫三道关口,在定点屠宰场设立检疫点,严防病死、未经检疫或检疫不合格动物产品进入屠宰加工环节。
实施放心肉工程,取缔6家不符合标准的屠宰点,升级改造4家小型屠宰点,对屠宰场生产重点环节24小时不间断视频监控;按照随机抽取检查对象、随机选派检查人员的原则,对全市生猪定点屠宰场(点)、私屠滥宰点进行抽查,确保上市猪肉的安全。
三是严格无害化处理。
中华人民共和国农业部令2017年第8号涉及兽药和饲料管理

中华人民共和国农业部令2017年第8号涉及兽药和饲料管理中华人民共和国农业部令2017年第8号现公布《农业部关于修改和废止部分规章、规范性文件的决定》,自公布之日起施行。
部长2017年11月30日农业部关于修改和废止部分规章、规范性文件的决定为了依法保障简政放权、放管结合、优化服务改革措施落实,农业部对规章和规范性文件进行了全面清理。
经过清理,农业部决定:一、对18部规章和4部规范性文件的部分条款予以修改。
(附件1)二、对3部规章和36部规范性文件予以废止。
(附件2)本决定自公布之日起施行。
附件:1.农业部决定修改的规章和规范性文件2.农业部决定废止的规章和规范性文件附件1:农业部决定修改的规章和规范性文件(本文只列出涉及兽药和饲料管理部分)一、修改的规章-------8.饲料和饲料添加剂生产许可管理办法(2012年5月2日农业部令2012年第3号公布,2013年12月31日农业部令2013年第5号、2016年5月30日农业部令2016年第3号修订)删去第十七条。
9.进口饲料和饲料添加剂登记管理办法(2014年1月13日农业部令2014年第2号公布,2016年5月30日农业部令2016年第3号修订)将第四条修改为:“境外企业申请进口登记,由境外企业驻中国境内的办事机构或者委托的中国境内代理机构办理。
”10.饲料质量安全管理规范(2014年1月13日农业部令2014年第1号公布)删去第四条中的“年度备案和”。
11.动物诊疗机构管理办法(2008年11月26日农业部令第19号公布,2016年5月30日农业部令2016年第3号修订)删去第八条第二款。
12.兽药生产质量管理规范(2002年3月19日农业部令第11号公布)将第三十三条修改为:“兽药生产企业必须具备与所生产产品相适应的生产和检验设备,其性能和主要技术参数应能保证生产和产品质量控制及实施兽药产品电子追溯管理的需要。
”第六十七条增加一项,作为第八项:“兽药产品追溯管理制度和记录。
《中国兽药典(2020年版)》编制完成2021年7月1日起施行

此彳政政_____________________________________________《中国兽药典(202◦年版)》编制完成2021年7月1曰起施行根据《兽药管理条例》规定,农 业农村部组织完成《中华人民共和 国兽药典(2020年版)》(以下简称 《中国兽药典(2020年版)》)一部、二 部、三部的编制工作,并制定了配套 的说明书范本,自2021年7月1日起施行。
《中国兽药典(2020年版)》是兽 药研制、生产(进口)、经营、使用和 监督管理活动应遵循的法定技术标 准。
《中国兽药典(2020年版)》包括 凡例、正文及附录。
自《中国兽药典 (2020年版)》施行之日起,《中国兽 药典(2015年版)》《兽药质量标准》(2017年版)及农业农村部公告等收 载、发布的同品种兽药质量标准同 时废止。
《中国兽药典(2020年版)》收载品种未收载的制剂规格(已废止的除外),其质量标准按照《中国兽药典(2020年版)》收载品种相关要求执行,规格项按照原批准证明文件执行。
下列标准继续有效,但应执行《中国兽药典(2020年版)》相关通用要求。
《中国兽药典(2020年版)》未收载品种且未公布废止的兽药国家标准;经批准公布的兽药变更注册标准且《中国兽药典(2020年版)》未收载的兽药国家标准。
2021年7月1日起申报兽药产品批准文号的企业和兽药检验机构应按照《中国兽药典(2020年版)》要求进行样品检验,并在兽药检验报告上标注《中国兽药典(2020年版)》兽药质量标准。
此前申报的,兽药检验报告标注的执行标准可为原兽药质量标准,也可标注《中国兽药典(2020年版)》兽药质量标准。
2021年6月30日(含)前生产的相应兽药产品可按原兽药标准进行检验,并在产品有效期内流通使用。
2021年6月30日(含)前取得批准文号的《中国兽药典(2020年版)》收载品种,其兽药标签和说明书内容不符合范本要求的,兽药生产企业应当按照范本内容自行修改,印制新的标签和说明书,原标签和说明书可继续使用至2021年12月31日。
2017年版《兽药质量标准》勘误表

352
驱球止痢合剂说明书
【规格】
【规格】每1ml相当于原生药2g。
生物制品卷
序号
页码
标准名称
原内容
修正内容
1
320
猪白细胞干扰素
附加说明:
1.本标准由山东省乐至县世红生物技术有限公司提出。
附加说明:
1.本标准由四川省乐至县世红生物技术有限公司提出。
2
352
猪伪狂犬病活疫苗(HB-98株)
反应体系:
【主要成分与含量】疫苗中含有鸡传染性法氏囊病低毒力A80株,每0.1ml病毒含量应≥106.0ELD50。
中国兽医药品监察所办公室2018年3月23日印发
【药物相互作用】……②Ca2+、Mg2+、Fe3+和Al3+等重金属离子可与本品可发生螯合,……
590、
591
盐酸沙拉沙星可溶性粉
592、593
盐酸沙拉沙星注射液
594、
595、596
盐酸沙拉沙星溶液
596、597、598
盐酸环丙沙星可溶性粉
599、600
盐酸环丙沙星注射液
16
620、621、622
【规格】按C22H24N2O7计算……。
【规格】按C14H24N2O7计算……。
13
577
盐酸吖啶黄注射液说明书
兽用非处方药
兽用处方药
14
578
盐酸多西环素子宫注入剂说明书
兽用处方药
兽用非处方药
15
588、
589
盐酸沙拉沙星片
【药物相互作用】……②Ca2+、Mg2+、Fe3+和Ab3+等重金属离子可与本品可发生螯合,……
农业部公告第2513号――《兽药质量标准》(2017年版)

农业部公告第2513号――《兽药质量标准》(2017年版)
【法规类别】兽医兽药
【发文字号】农业部公告第2513号
【发布部门】农业部
【发布日期】2017.04.07
【实施日期】2017.11.01
【时效性】现行有效
【效力级别】部门规范性文件
农业部公告
(第2513号)
为加强兽药国家标准管理,我部对2010年12月31日前发布的、未列入《中国兽药典》(2015年版)的兽药质量标准进行了修订,编纂为《兽药质量标准》(2017年版),并制定了配套的说明书范本,现予发布,自2017年11月1日起施行。
现就有关事宜公告如下。
一、《兽药质量标准》(2017年版)包括化学药品卷、中药卷和生物制品卷等三个部分。
二、自2017年11月1日起,除《中国兽药典》(2015年版)和《兽药质量标准》(2017年版)收载品种的兽药质量标准外,2010年12月31日前(含31日)各版《中
国兽药典》《兽药国家标准》《兽用生物制品质量标准》《兽用生物制品规程》以及农业部公告发布的同品种兽药质量标准同时废止。
凡《兽药质量标准》(2017年版)品种项下未收载的制剂规格(已明令废止的除外),其质量标准按《兽药质量标准》(2017年版)同品种相关要求执行,规格项按原批准证明文件执行。
三、自2017年11月1日起,申报《兽药质量标准》(20。
兽药生产质量检查管理规定

兽药生产质量检查管理规定
是为了保证兽药生产过程中产品质量的稳定性和安全性,以及保护兽医用药对象的身体健康,制定出来的一系列管理规定。
以下是一些可能包括的内容:
1. 质量计划管理:包括制定和执行兽药生产质量计划,明确质量目标和实施策略,确保质量工作能够按照规定进行。
2. 质量控制体系:建立和落实兽药生产质量控制体系,包括质量管理手册、工艺文件等,明确质量控制的流程和要求。
3. 质量检查和验证:对兽药的原料、中间品和成品进行质量检查和验证,确认产品符合相关标准和规定。
4. 质量问题处理:建立兽药生产质量问题的处理机制,包括对质量问题的调查和分析,以及采取相应的纠正措施和预防措施。
5. 质量记录和报告:记录和报告兽药生产质量相关信息,包括质量检查结果、质量问题处理情况等,确保质量管理的透明和可追溯性。
6. 质量培训和教育:对兽药生产从业人员进行质量培训和教育,提高其质量意识和操作技能,确保质量管理能够得到有效执行。
以上只是一些可能的内容,具体的兽药生产质量检查管理规定还需要根据国家和行业的相关法律法规以及标准进行制定。
第 1 页共 1 页。
兽药的标准

兽药的标准兽药是用于治疗和预防动物疾病的药物。
为了确保兽药的安全性、有效性和合规性,各国都制定了一系列的标准和规范。
下面将介绍一些相关的参考内容,以便在兽药研发、生产和使用过程中的参考。
1. 国际兽药标准:兽药的国际标准由国际兽药协会(International Federation for Animal Health)制定。
这些标准包括兽药试验和评估方法、药物安全性评价、药物残留、兽药质量控制等方面的要求。
这些标准是全球范围内兽药研发和使用的参考依据。
2. 国家兽药法规:各国家都有一套兽药管理的法规和标准。
这些法规和标准规定了兽药的注册流程、兽药使用的合规性、兽药广告的规范等方面的要求。
世界卫生组织(World Health Organization)和世界动物卫生组织(World Organization for Animal Health)也发布了一系列关于兽药管理的指南和建议,为各国的兽药法规提供了参考。
3. 国家药典和兽药制剂工艺规范:许多国家都有自己的药典,其中包括了一些兽药的标准。
这些标准包括了兽药原材料和中间体的质量要求、兽药制剂的规格和质量控制要求等方面的内容。
此外,一些国家还制定了兽药制剂的生产和质量控制的工艺规范,具体规定了兽药的生产流程、操作规范、检验方法等。
4. 动物药物残留限量:为了确保兽药使用的安全性,各国都制定了相关的动物药物残留限量。
这些限量值是根据药物的安全性评价、毒理学研究、短期和长期暴露的风险评估等综合考虑确定的。
兽药残留限量的设定旨在保护人类通过食物摄入动物源性产品时不会对其身体健康造成危害。
5. 兽药质量控制:兽药质量控制是确保兽药质量合格的重要环节。
国家和国际标准对于兽药的质量控制提供了相应的要求。
质量控制涉及原料药的合规性、制剂的规格和各项质量指标的检验。
兽药生产企业需要遵守这些要求,制定和执行相应的质量管理体系,并通过药品质量标准认证来证明其产品质量的合格性。
产品-批准文号-审查要点-申报-常见问题汇总 -

同但剂型或规格不同的,应当使用同一商品名称。
申报常见问题汇总
一、不符合农业部公告第2273号第六条要求。
申请兽药产品批准文号事项的证明性文件可用加盖
申报企业公章的复印件替代原件,审批结束后,我部不
退回纸质申报资料。申请人上传的标签和说明书样稿电 子版中暂不填写商品名,商品名以农业部兽药产品批准 文号批件为准。
申报资料审查要点
一、执行标准
1.《中国兽药典》2015年版一、二、三部
2.《兽药质量标准》(2017年版) ——农业部公告第2513号
3.农业部以公告形式颁布的兽药产品质量标准
申报资料审查要点
申报 企业 生产 范围 的审 查
激素类产品是否有独立的生产线
全发酵类产品是否有独立的生产线 中兽药制剂生产有关委托加工和集团内 部调剂
六、标签说明书标有广告用语。
企业申报的标签说明书样稿标有与说明书无关的
文字、图案等。
如“品质保证”,“绿色环保”,“规模化养殖
专用”,“国标精品”等。 印有天安门、长城、国旗等图案。
申报常见问题汇总
七、不符合农业部令(2013)年第2号 要求。
企业申报的标签说明书样稿未按农业部令( 2013)年第2号要求标注“兽用处方药”。 应按农业部公告1997号兽用处方药目录(第一 批)、农业部公告2471号兽用处方药目录(第二批
全发酵类产品审查
涉及产品主要包括黄霉素预混剂、盐霉素
预混剂、土霉素钙预混剂、莫能菌素预混剂、金
霉素预混剂、恩拉霉素预混剂等,审查时需预混
剂(具体产品)生产线。
例如:预混剂(黄霉素)、预混剂(土霉素钙)
等产品。
申报资料审查要点
是否具备相应生产条件
属于集团内部调剂,审查企业是否提供委 托加工协议,中药提取物的内控质量标准,工艺, 制法,稳定性试验数据(至少6个月),委托方 资质证明等资料。
中华人民共和国农业部公告第2576号——新兽药注册目录-中华人民共和国农业部公告第2576号

中华人民共和国农业部公告第2576号——新兽药注册目录正文:----------------------------------------------------------------------------------------------------------------------------------------------------中华人民共和国农业部公告第2576号根据《兽药管理条例》和《兽药注册办法》规定,经审查,批准中牧实业股份有限公司等6家单位申报的猪口蹄疫O型合成肽疫苗(多肽0405+0457)等2种兽药产品为新兽药,核发《新兽药注册证书》,并发布产品试行规程、质量标准、说明书和标签,自发布之日起执行。
批准齐鲁动物保健品有限公司申报的注射用头孢噻呋钠增加靶动物牛变更注册,并发布修订后的质量标准、说明书和标签,自发布之日起执行。
特此公告。
附件:1.新兽药注册目录2.试行规程(略)3.质量标准(略)4.说明书和标签农业部2017年8月31日附件1新兽药注册目录新兽药名称研制单位类别新兽药注册证书号备注监测期猪口蹄疫O型合成肽疫苗(多肽0405+0457)中牧实业股份有限公司三类(2017)新兽药证字45号注册3年盐酸贝那普利咀嚼片中国农业大学动物医学院、瑞普(天津)生物药业有限公司、齐鲁晟华制药有限公司、佛山市南海东方澳龙制药有限公司、北京中农大动物保健品集团湘潭兽药厂五类(2017)新兽药证字46号注册3年注射用头孢噻呋钠齐鲁动物保健品有限公司三类(2003)新兽药证字15号变更注册:增加靶动物牛新增靶动物牛监测期为3年——结束——。
2017年版《兽药质量标准》休药期表格
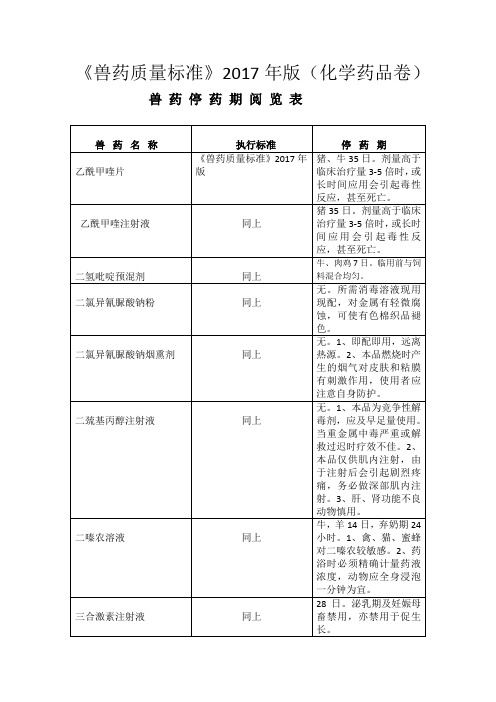
同上
牛、羊35日。1、泌乳期禁用。2、阿维菌素对鱼、虾及其他水生生物有剧毒,残留药物的包装切勿污染水源。3、使用本品后,牛和羊的排泄物中因含阿维菌素,对降解厩类的有益昆虫有潜在损害作用。
环丙氨嗪预混剂(1%)
同上
鸡3日。本品药料浓度达25mg/kg时,可使饲料消耗量增加,达500mg/kg以上可使饲料消耗量减少,1000mg/kg以上长期喂养可能因摄食过少而死亡。
甲磺酸达氟沙星注射液
同上
猪25日。1、勿与含铁制剂在同一日内使用。2、孕畜及泌乳母畜禁用。
甲磺酸达氟沙星粉
同上
鸡5日。蛋鸡产蛋期禁用。
四环素片
同上
牛2日、猪10日鸡4日。1、成年反刍兽、马属动物和兔不宜内服。2、产蛋期和泌乳期禁用。
头孢氨苄注射液
同上
猪28日。1、本品应振摇均匀后使用。2、对头孢菌素、青霉素过敏动物慎用。
兽药名称
执行标准
停药期
过氧乙酸溶液
《兽药质量标准》2017年版
无。1、使用前将A、B液混合反应10小时后生成过氧乙酸消毒液。2、本品腐蚀性强,操作时戴上防护手套,避免药液灼伤皮肤,稀释时避免使用金属器具。3、当室温低于15℃时,A液会结冰,用温水融化后即可使用。
伊维菌素氧阿苯达唑粉
同上
羊35日。1、泌乳期禁用。2、母畜妊娠前期45日内慎用。
阿苯达唑颗粒
同上
牛14日,羊4日,猪7日,禽4日,弃奶期60日。1、泌乳期禁用。2、绵羊、兔等动物妊娠早期使用阿苯达唑,可能伴有至畸和胚胎毒性的作用。3、犬按50mg/kg每日2次用药,会逐渐产生厌食症。
阿苯达唑阿维菌素片
同上
牛、羊35日。1、泌乳期禁用。2、阿维菌素的毒性较伊维菌素稍强,敏感动物慎用。3、阿维菌素对光敏感,易被迅速氧化灭活,应避光保存。
兽药质量标准2017年版生物制品卷

兽药是用于预防和治疗动物疾病的药物,其质量标准对于保障动物健康和人类食品安全具有重要意义。
2017年版的兽药质量标准生物制品卷是针对生物制品兽药的质量要求,本文将对其进行详细介绍。
一、主要内容2017年版兽药质量标准生物制品卷主要包括以下几个方面的内容:1. 通则包括了兽药生物制品的范围、应用范围、命名、分类、标志、保质期以及兽药生产企业的责任等内容。
2. 质量控制主要包括了兽药生物制品的质量要求、质量控制的一般原则、质量控制的基本要求、质量控制的技术要求、质量控制的检验方法等内容。
3. 药效学主要包括了兽药生物制品的药理学要求、药物代谢和药效动力学要求、药物致敏性评价、耐药性评价等内容。
4. 毒理学主要包括了兽药生物制品的急性毒性评价、慢性毒性评价、致突变性评价、致畸性评价、致致癌性评价等内容。
5. 病原学主要包括了兽药生物制品病原菌的鉴定、纯化、培养和保存要求、病原菌毒力评价、毒素的鉴定和纯化要求等内容。
6. 疫苗学主要包括了病原疫苗的免疫原性评价、免疫原的纯化要求、疫苗生产工艺要求等内容。
7. 血清学主要包括了兽用血清的免疫原性评价、血清的纯化要求、血清生产工艺要求等内容。
8. 分析学主要包括了兽药生物制品的分析方法、分析标准等内容。
二、更新与优化2017年版的兽药质量标准生物制品卷相较于之前的版本进行了更新与优化,主要体现在以下几个方面:1. 标准内容更加全面2017年版的标准内容更加全面,不仅对兽药生物制品的质量要求进行了详细的规定,还对质量控制、药效学、毒理学、病原学、疫苗学、血清学、分析学等方面进行了全面规定,使得标准更加完善。
2. 技术要求更加严格2017年版的标准在质量控制、药效学、毒理学、病原学、疫苗学、血清学等方面对技术要求进行了进一步严格,充分保障了兽药生物制品的质量和安全性。
3. 检验方法更加科学2017年版的标准对分析学方面的内容进行了补充和完善,对兽药生物制品的检验方法进行了进一步科学化,确保了检验结果的准确性和可靠性。
50%多西环素兽用说明书

50%多西环素兽用说明书【兽药名称】通用名称:盐酸多西环素可溶性粉。
商品名称:替宁。
英文名称:Doxycycline Hyclate Soluble Powder汉语拼音:Yansuan Duoxihuansu Kerongxingfen【主要成分】盐酸多西环素。
【性状】本品为淡黄色或黄色结晶性粉末。
【药理作用】四环素类抗生素。
多西环素通过可逆性地与细菌核糖体30S亚基上的受体结合,干扰tRNA与mRNA形成核糖体复合物,阻止肽链延长而抑制蛋白质合成,从而使细菌的生长繁殖迅速被抑制。
多西环素对革兰氏阳性菌和阴性菌均有抑制作用。
细菌对多西环素和土霉素存在交叉耐药性。
内服吸收迅速,受食物影响较小,生物利用度高,组织渗透力强,分布广泛,有效血药浓度维持时间长。
猪体内蛋白结合率为93%。
【作用与用途】四环素类抗生素。
用于治疗猪、鸡革兰氏阳性菌、阴性菌引起的大肠埃希菌病、沙门氏菌病、巴氏杆菌病以及支原体引起的呼吸道疾病。
【用法与用量】以本品计。
混饮:每1L水,猪50~100mg;鸡600mg。
连用3~5日。
【不良反应】长期应用可引起二重感染和肝脏损害。
【注意事项】(1)蛋鸡产蛋期禁用。
(2)避免与含钙量较高的饲料同时服用。
【休药期】28日。
【规格】50%。
【包装】100g/袋。
【贮藏】密封,遮光,干燥处保存。
【生产批号】xxx。
【生产日期】xxx。
【有效期】xxx。
【执行标准】《兽药质量标准》(2017年版)化学药品卷。
【批准文号】xxx。
【生产企业】xxx。
【公司地址】xxx。
兽药质量标准2017

兽药质量标准2017兽药是保障畜禽健康的重要物质,其质量直接关系到养殖业的发展和动物健康。
2017年发布的兽药质量标准,对兽药的质量要求和监管进行了详细规定,以保障兽药的安全有效使用。
本文将对兽药质量标准2017进行详细解读。
一、兽药质量标准的制定背景。
兽药质量标准是根据国家相关法律法规,结合兽药生产和使用的实际情况,由国家药品监督管理部门制定的,是对兽药质量的基本要求和监管标准。
2017年发布的兽药质量标准,是为了适应兽药生产和使用的新形势,加强兽药质量监管,保障兽药的安全有效使用而制定的。
二、兽药质量标准的主要内容。
兽药质量标准主要包括兽药的质量要求、生产管理、质量控制、质量评价等方面的规定。
其中,兽药的质量要求是兽药质量标准的核心内容,包括兽药的成分、纯度、稳定性、有效性等方面的要求。
兽药的生产管理包括生产设施、生产工艺、人员素质等方面的要求。
兽药的质量控制包括原料药的质量控制、生产过程中的质量控制、成品药的质量控制等方面的要求。
兽药的质量评价包括兽药的质量检验、质量评价、质量监管等方面的要求。
三、兽药质量标准的意义。
兽药质量标准的发布对于兽药行业具有重要的意义。
首先,兽药质量标准的制定和实施,可以提高兽药的质量,保障畜禽的健康。
其次,兽药质量标准的实施,可以规范兽药生产和使用行为,减少兽药滥用和药物残留,保障食品安全。
再次,兽药质量标准的实施,可以促进兽药行业的健康发展,提升兽药行业的整体水平。
四、兽药质量标准的落实措施。
为了确保兽药质量标准的有效实施,需要采取一系列的措施。
首先,加强兽药生产企业的管理,提高企业的生产管理水平。
其次,加强兽药质量监管,加大对兽药生产和使用的监督检查力度。
再次,加强兽药质量监测,建立健全的兽药质量监测体系,及时发现和解决兽药质量安全问题。
最后,加强对兽药生产企业和兽药使用单位的宣传教育,提高兽药生产和使用单位的法律意识和质量意识。
五、兽药质量标准的展望。
兽药质量标准的发布是兽药行业的一次重要改革,对于兽药行业的发展具有重要意义。
论麻杏石甘口服液在鸡鸭病上的应用

论麻杏石甘口服液在鸡鸭病上的应用今天和大家交流一下麻杏石甘口服液治疗鸡气囊炎和鸭呼吸型感冒的问题。
我们先来看看《兽药质量标准》麻杏石甘口服液的描述:《兽药质量标准》2017年版中药卷P265麻杏石甘口服液处方:麻黄300克、苦杏仁300克,石膏1500克,甘草300克。
功能:清热、宣肺、平喘。
主治:肺热咳嗽。
这里面存在着二个问题:一是没有提到解表的功能。
二是没有提到针对表寒里热的主治。
在桂林古本《伤寒论》中讲到:发汗若下后,不可更行桂枝汤,汗出而喘,无大热者,可与麻黄杏仁甘草石膏汤。
麻黄杏仁甘草石膏汤方:麻黄四两去节;杏仁五十个,去皮尖;甘草二两,炙;石膏半斤碎绵裹。
右四味,以水七升。
先煮麻黄减二升,去上沫,内诸药,煮取二升,去滓,温服一升,日再服。
柯琴(柯韵伯)注:“此温病发汗逐邪之方剂。
凡冬不藏精之人,热邪内伏于脏腑,至春风解冻,伏邪自内而出,法当乘其热而汗之,热随汗散。
是方也,温病初起,可以解表而清里。
麻黄汤去桂枝之辛热,加石膏之甘寒,佐麻黄而发汗,助杏仁以定喘,一加一减,温解之方,转为凉散之剂。
”《万友生医论选》中讲到“对麻杏石甘汤证的体会”:发汗后,不可更行桂枝汤,汗出而喘,无大热者,可与麻黄杏仁甘草石膏汤。
下后,不可更行桂枝汤,若汗出而喘,无大热者,可与麻黄杏仁甘草石膏汤。
两者均为表(太阳、卫分)寒轻里(手太阴肺气分)热重所致。
其“无大热”“汗出”既与阳明“蒸蒸发热”“大汗出”者不同;其与“汗出而喘”又与表寒闭肺“无汗而喘”的麻黄汤证有别。
它既不是单纯的里热气分证,又不是单纯的表寒卫分证,而是太阳表病入里,气分之热已炽,卫分之寒未尽的卫气同病证。
柯琴对此卫气同病的病机认识未清,以为汗出不可用麻黄,无大热不可用石膏,竟将原文改为“无汗而喘,大热者”,这显然是不够全面的。
本方是麻黄配石膏,而且石膏用量大于麻黄,变辛温为辛凉,其意显然是以大清气分里热为主,而以轻散卫分表寒为佐。
故适用于“汗出而喘,无大热者”的卫气同病证。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017兽药质量标准
2017年兽药质量标准的制定是为了确保兽药的质量与安全。
兽药
作为一种用于预防、控制和治疗动物疾病的药物,其质量标准要求严格,以保障动物的健康和人类的食品安全。
2017年兽药质量标准主要包括以下几个方面的内容:
第一,有关兽药的生产要求。
兽药的生产必须在符合质量管理系
统要求的条件下进行,以确保兽药的质量和安全性。
此外,生产过程
中还需要遵守相关法律法规,如药品生产质量管理规范、药品GMP等。
兽药生产企业必须建立合适的生产设备和设施,确保生产过程的可操
作性和有效性。
第二,有关兽药原料和药品成分的要求。
兽药的原料必须符合药
典规定的质量标准,包括其纯度、含量、痕量杂质等方面的要求。
兽
药的成分应符合药品注册的要求,并且需要进行有效的检测和分析。
第三,有关兽药的稳定性要求。
兽药的稳定性是指其在一定条件
下的保存期限内,其质量和性能能够保持稳定。
稳定性的评估必须符
合相关的规定和标准,并且需要进行相应的实验和检测。
第四,有关兽药的包装要求。
兽药的包装必须符合相关的法规和标准要求,以防止其受到污染和破坏。
包装材料和包装工艺必须符合卫生要求,并且需要对包装进行必要的标识和说明。
第五,有关兽药的质量控制要求。
兽药的质量控制主要包括分析方法的验证、质量控制样品的制备和使用、质量控制记录的保存和归档等方面的要求。
兽药企业必须建立完善的质量控制体系,并且进行有效的质量控制措施。
以上仅是2017年兽药质量标准的一部分内容,具体的标准还有更多详细的要求。
2017年兽药质量标准的制定是为了确保兽药的质量和安全性,提高兽药在动物疾病控制和人类食品安全方面的作用。
兽药企业必须严格遵守相关的标准和规定,确保兽药的质量和安全性。
只有如此,我们才能有效地预防和控制动物疾病,保障兽群的健康和人类的食品安全。
