139-2-6多原子分子分子轨道能级图课件
原子的能级结构PPT教学课件

2021年10月20日星期三
31
单倍体育种
花药离体组织培单倍体植 秋水仙素处理 正常植株 自交
培养 养
株 染色体加倍 (纯合体)
发育
种子
新植株
(新品种)
第一年
第二年
YR
YR
yR
yR
YyRr
Yr
Yr
yr
yr
YYRR yyRR YYrr yyrr
YYRR yyRR YYrr yyrr
YYRR yyRR YYrr yyrr
锈病
以下是杂交育种的参考方案:
杂交 P 自交 F1
高抗
矮不抗 思考:要培育出
DDTT
ddtt 一个能稳定遗传
的植物品种至少
高抗 DdTt 要几年?
选优 F2 高抗
高不抗 矮抗 矮不抗 ddTT
自交 矮抗 ddTT
ddTt 矮抗 ddTt
选优 F3矮抗 ddTT
矮抗 矮不抗 ddTT
ddTt
第一代 p 第二代 F1 第三代 F2
针对训练1 (单选)下列与玻尔理论有直接关系的叙述中,错
误的是
()
A.电子绕原子核做加速运动,但并不向外辐射能量,这
时原子的状态是稳定的
B.原子的一系列能量状态是不连续的
C.原子从一个能量状态跃迁到另一个能量状态时,一定
要吸收或放出某一频率的光子
D.氢原子由带正电的原子核和带负电的电子组成,电子
绕原子核旋转
错误;同理从 n=1 跃迁到 n=2 的能级需要的光子能量大 约为从 n=3 跃迁到 n=2 的能级差的五倍左右,对应光子 波长应为从 n=3 跃迁到 n=2 的能级辐射光波长的五分之 一左右,选项 B 错误;氢原子从 n=3 跃迁到 n=1 的能级 的能级差最多有三种情况,即对应最多有三种频率的光谱 线,选项 C 正确;氢原子在不同能级间跃迁必须满足|En-
分子轨道理论

已知多肽链内部N—H··· Ph氢键的结合方式有下面
两种:
在甲苯· 2HCl晶体结构中的Cl—H ··· 氢键结构已 得到测定。在此晶体中,甲苯芳香环上的离域键 作为质子的受体,两个Cl—H分子从苯环上、下两个 6 6 方向指向苯环中心:
除上述N—H··· 和Cl—H ··· 氢键外,在有些化
共轭效应
• 共轭效应也称离域效应,是分子在形成 离域键时引起的物理化学性质的变化。 • 共轭效应会影响分子的构性和构象、电 性、颜色、酸碱性、化学反应等等。
酚酞指示剂的变色原理:
等电子原理
• 原子数相同、电子总数相同的分子或离子, 互称为等电子体。等电子体的结构相似、 物理性质相近。
(1)CO2、 N2O、 NO2+、N3–具有相同的通式—
(3)溶解性 对于溶质分子,凡能为生成氢键提供H与接受H者,均 可通过氢键和水结合,在水中溶解度较大. (1999全国初赛卷) (4)分子间生成氢键会增大粘度和表面张力。
例:①乙醚②乙醇③丙酮三者沸点依此增大的 顺序为 A. ①②③ B. ③②① C. ②③>① D. ③①②
非常规氢键 1、X—H··· 氢键
4、分子轨道的能级
• 根据同核双原子分子的电子组态可以预见分子及 离子的性质。已知及O2其离子的键能有如下数据, 请画出它们的对应关系。 • O2 O2O22O2+ • • 键能 / kJ· -1 493.5 626.1 138.1 392.9 mol
高中化学竞赛多原子分子分子轨道能级图ppt
2020年高中化学竞赛多原子分子分子 轨道能 级图27p pt
When two 1s-orbitals overlap in the same region of space in such a way that their wavefunctions have opposite signs, the wavefunctions interfere destructively and give rise to a region of diminished amplitude and a node between the two nuclei (blue line).
2020年高中化学竞赛多原子分子分子 轨道能 级图27p pt
2020年高中化学竞赛多原子分子分子 轨道能 级图27p pt
A molecular orbital energy-level diagram for the bonding and antibonding molecular orbitals that can be built from two sorbitals. Different signs of the s-orbitals (reflecting how they are combined together to form the molecular orbital) are depicted by the different shades of blue.
2020年高中化学竞赛多原子分子分子 轨道能 级图27p pt
2020年高中化学竞赛多原子分子分子 轨道能 级图27p pt
Two p-orbitals can overlap side by side to give bonding (below) and antibonding (above) orbitals. Note that the latter has a nodal plane between the two nuclei. Both orbitals have a nodal plane through the two nuclei and
分子轨道、键参数、金属键理论

第一、二周期同核双原子分子(除O2、F2外) 的分子轨道能级 σ *2p 能 2p π *2p 2p 1s<*1s 量 σ 2p < 2s <*2s π σ 2s σ 2s
2p *2s
2s
2py=2pz <2px
1s
A.O
σ *1s σ 1s
M.O
1s
A.O
*2py=*2pz *2px
• 二、能带理论 • 是在分子轨道理论基础上发展起来的现代金属键 理论。 • 能带理论把金属晶体看成一个大分子,这个分子 由晶体中所有原子组合而成。由于各原子的原子 轨道之间的相互作用便组成一系列相应的分子轨 道,其数目与形成它的原子轨道数目相同。 • 根据分子轨道理论,一个气态双原子分子Li2的分 子轨道是由2个Li原子轨道(1s22s1)组合而成的。 6个电子在分子轨道中的分布如图所示。σ2s成键轨 道填2个电子,σ*2s反键轨道没有电子。现在若有n 个原子聚积成金属晶体,则各价电子波函数将相 互叠加而组成n条分子轨道,其中n/2条的分子轨道 有电子占据,另外n/2条是空的。
1、 分子轨道理论的基本要点
把构成分子的各个原子的原子核作为分子 的骨架,电子分布在骨架附近的各个分子 轨道上,每个分子轨道都具有一定的能量. 分子轨道由原子轨道组合而成,其数目等 于原子轨道数目之和。 分子中电子的分布和在原子中分布相同:
遵守泡利不相容原理、能量最低原理和洪德规则
电子进入分子轨道后,若体系能量降低, 即能成键,反之,则不能成键。
• 绝缘体中的价电子都处于满带,满带与相邻带 之间存在禁带,能量间隔大(Eg≥5ev),故不 能导电。(如金刚石)。 • 半导体的价电子也处于满带(如Si、Ge),其 与相邻的空带间距小,能量相差也小(Eg < 3ev) 低温时是电子的绝缘体,光照、外电场或高温 时电子能激发跃过禁带而导电。 • 所以半导体的导电性随温度的升高而升高,而 金属却因升高温度,原子振动加剧,电子运动 受阻等原因,使得金属导电性下降
2.4.3 分子轨道能级图——课件

分子轨道理论—分子轨道能级图主讲人:张兴文分子轨道能级图(1)同核双原子分子的分子轨道能级图分子轨道的能量与组成它的原子轨道的能量相关,能量由低到高组成分子轨道能级图。
同核双原子分子的分子轨道能级图,分为A图和B图两种。
A 图适用于O 2 ,F 2分子2pπ*π22pπ*π2σ22 p yp y2 p zp x p z σ*2 p x 2s 2s σ2s σ*2s σ1sσ*1s 1s 1s MOAOAOB 图适用于B 2,C 2,N 2等分子2p2pπ*2 p yσ*2 p x π2p yπ*2 p zσ2p x π2p z 2s 2s σ2s σ*2s σ1sσ*1s 1s 1s MOAOAOA 图必须注意A 图和 B 图之间的差别B 图2p π2p yσ2p xπ2p z 2pπ2p yσ2p x π2p z在分子中,成键电子多,体系的能量低,分子就稳定。
分子轨道理论把分子中成键电子数和反键电子数之差的一半定义为分子的键级:键级=成键电子数-反键电子数2键级越高,分子越稳定。
键级为0的分子不能稳定存在。
(2)异核双原子分子不同种类原子组合成分子轨道,也遵循对称性匹配、能量相近原则和轨道最大重叠原则。
这样,两个不同原子的轨道才能发生有效的组合,形成分子轨道。
CO 属于异核双原子分子。
由于O 的电负性比C 大,O 的2s 和2p 轨道能量都比C 的2s 和2p 轨道能量低。
它和N 2是等电子体,其分子轨道能级图与N 2相似。
σ2p 2x ()CO 的分子轨道式为KK σ2s 2σ2s 2π2p 2π2p 2*y z ()()()()AO MO AOCO 分子中存在一个σ键,两个π键。
无单电子,显抗磁性。
键级=6-02=3CO 的分子轨道式为σ2p 2x ()KK σ2s 2σ2s 2π2p 2π2p 2*y z ()()()()NO 的分子轨道式为NO 属于异核双原子分子,其分子轨道能级图与O 2相似。
2020年高中化学竞赛多原子分子分子轨道能级图27pptppt
路易斯理论 形成稀有气体式的稳定的电子层结构 无量子力学的计算基础
现代共价键理论 有量子力学计算基础 1927 年以后
现代价键理论 分子轨道理论
电子在原子轨道中运动 电子属于原子 电子在分子轨道中运动 电子属于分子 分子轨道由原子轨道线性组合得到
V. B. 法, 价层电子对互斥理论, 杂化轨道理论等,均属于 现代价键理论。
The two electrons in an H2 molecule occupy the lower-energy (bonding) molecular orbital and result in a stable molecule.
Two p-orbitals can overlap to give bonding (lower) and antibonding (upper) -orbitals. Note that the antibonding combination has a node between the two nuclei. Both – orbitals have nodes passing through the nuclei, but no nodes along the axis of the bond.
Two p-orbitals can overlap side by side to give bonding (below) and antibonding (above) orbitals. Note that the latter has a nodal plane between the two nuclei. Both orbitals have a nodal plane through the two nuclei and
第四节 原子的能级结构(精品课件)

不同的圆形轨道绕核运动相对应。原子的定态是
不连续的,因此电子的可能轨道的分布也是不连 续的。
跃迁假设: 当原子从一个能量
为En的定态跃迁到另一个能量 为Em的定态时,就要发射或吸 收一个频率为 m-n的光子.
vmn
Em En h
Em>En 发射光子, Em<En 吸收光子
能级结构猜想
能级:原子内部不连续的能量称为原子的能级。 数值上等于原子在定态时的能量值。
3、原子在不同的状态之中具 有不同的能量,所以原子的能 量也是量子化的。
经典电磁理论
经典电磁理论认为:电子绕核作匀速圆周运动
, 绕核运动的电子将不断向外辐射电磁波。由于
原子不断地向外辐射能量,能量 逐渐减小,电子绕核旋转的频 率也逐渐改变,原子的发射光
e
r+
v
F
e
谱应是连续谱。由于原子总能 e
量减小,电子将最终逐渐接近 原子核,而使原子变得不稳定。
e +
经典电磁理论与现代物理学的矛盾
事实上: 氢原子发射的光谱是不连续的光谱,而
核外的电子总是不停地绕核运动。 表明:
从宏观现象总结出来的经典电磁理论跟 原子微粒产生的微观现象出现了矛盾。
玻尔理论的基本假设
现象:氢原子光谱是分立(线状)的,原子是 稳定的.
量和电子轨道引入了量子化假设 B、对经典电磁理论中关于“做变速运动的
电荷要辐射电磁波”的观点提出了异议 C、用能量转化与守恒建立了原子发光频率
与原子能量变化之间的定量关系 D、玻尔的公式是在他的理论基础上利用经
典电磁理论和牛顿力学计算出来的
ABCD
2、下面关于玻尔理论的解释中,不正确的说法
是( )
多电子原子轨道能级PPT教案

3d和4s对1s2s2p原子芯的钻穿 3d和4s对1s2s2p3s3p原子芯的钻穿
8≤Z≤20:4s对K,L内层原子芯钻穿大, E4s<E3d
Z≥21 :4s对原子芯钻穿效应相对变小, E4s>E3d
第46页/共76页
核外电子的排布
1. 基态原子的核外电子排布原则
• 能量最低原理 电子在原子轨道中的排布,要尽可能使
第13页/共76页
不确定原理与微观粒子 运动的统计规律
1927年,Heisenberg不确定原理 x p ≥ h
4
Δx—微观粒子位置的测量偏差 Δp—微观粒子的动量偏差 微观粒子的运动不遵循经典力学的规律。
第14页/共76页
微观粒子的波动性与粒子行为的统 计性规律联系在一起,表现为:
微观粒子的波动性是大量微粒运动 表现出来的性质,即是具有统计意义的 概率波。
第2页/共76页
8.1.2 氢原子光谱
1.光和电磁辐射
红
橙
黄绿
青蓝
紫
第3页/共76页
2.氢原子光谱
Hδ Hγ 410.2 434.0 7.31 6.91
c
Hβ 486.1 6.07
Hα 656.3 4.57
光速 c 2.998108 m s1
第4页/共76页
/nm /1014s1
氢原子光谱特征: • 不连续光谱,即线状光谱 • 其频率具有一定的规律
…
En
RH n2
J
第11页/共76页
§8.2 微观粒子运动的基本特征
微观粒子的波粒二象性 不确定原理与微观粒子
运动的统计规律
第12页/共76页
微观粒子的波粒二象性
1924年,de Broglie关系式
139-2-6多原子分子分子轨道能级图课件
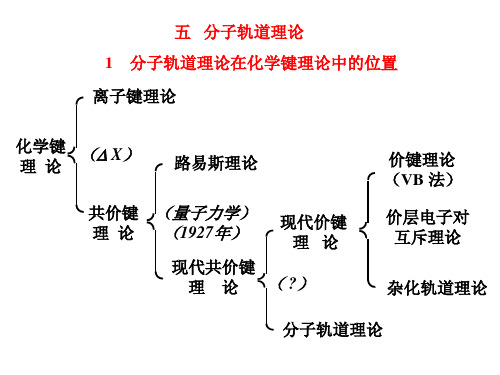
化学键 理论
( X)
路易斯理论
共价键 理论
(量子力学) (1927年)
现代价键 理论
现代共价键
理 论 ( ?)
价键理论 (VB 法)
价层电子对 互斥理论
杂化轨道理论
分子轨道理论
离子键理论 共价键理论
x > 1.7 电子发生转移 形成离子 x < 1.7 共用电子对
σ* px σ px
同时
py 和
py , pz
和
pz 分别肩并肩组合成 π*
p
,π
y
py
和
π*
p
,π
z
p分z 子轨道。
π*p 反键
核间有节面
±
πp 成键
π 轨道有通过两核连线的节面 ,σ 轨道没有。
2°线性组合三原则 a ) 对称性一致原则 对核间连线呈相同的对称性的轨道可以进行线性组合。 除上 述的 s - s ,p - p 之外 ,还有 s - px 沿 x 方向的组合, 两 者的对称性一致。组成 σ 分子轨道。 py - dxy 沿 x 方向,也可以组合成有效的 π 分子轨道。
+ +
+
+ ++
s
px
d xy
py
b ) 能量相近原则
H 1s - 1312 kJ·mol -1
Na 3s - 496 kJ·mol -1
O 2p - 1314 kJ·mol -1
Cl 3p - 1251 kJ·mol - 1 ( 以上数据根据 I1 值估算 ) 左面 3 个轨道能量相近,彼此间均可组合,形成分子轨道 ;
原子的量子能级和能级图

S:总自旋。其值为个别价电子自旋 :总自旋。其值为个别价电子自旋
1 s(其值为 2)的矢量和。 的矢量和。 其值为 的矢量和
当电子数为偶数时, 当电子数为偶数时, S 取零或正整数 0,1,… , , 当电子数为奇数时 当电子数为奇数时, 为奇数 S 取正的半整数 ,3/2, … 取正的半整数1/2,
钠原子的能级图
用原子光谱项符号写出Mg 2852 Å (共振 例: 用原子光谱项符号写出 共振 的跃迁。 线)的跃迁。 的跃迁
Mg基态电子组态 基态电子组态
[ Ne ]3 s 2
l1 = l 2 = 0
1 s1 = s 2 = 2
L=0
S=0
J =0
S为何不等于 ? 为何不等于1? 为何不等于
两个3s电子处于同一轨道, 两个 电子处于同一轨道,根据保里不相容原 电子处于同一轨道 理,这两个电子的自旋必须反平行 基态镁原子的光谱项符号: 基态镁原子的光谱项符号:
主量子数n 主量子数
决定电子的能量和电子离核的远近。 决定电子的能量和电子离核的远近。 其数值为外层价电子角量子数l的 其数值为外层价电子角量子数 的矢
1.4.4 多电子原子的能级——课件

核外电子排布—多电子原子的能级图多电子原子的能级1 鲍林原子轨道近似能级图美国著名结构化学家鲍林(Pauling)提出了多电子原子的原子轨道近似能级图。
所有的原子轨道,共分成七个能级组。
第七组7s,5f,6d,7p第六组6s,4f,5d,6p第五组5s,4d,5p第四组4s,3d,4p第三组3s,3p第二组2s,2p第一组1s其中第一能级组只有一个1s能级。
第七组7s,5f,6d,7p第六组6s,4f,5d,6p第五组5s,4d,5p第四组4s,3d,4p第三组3s,3p第二组2s,2p第一组1s其余各能级组中能级由低到高依次为n s n-2f n-1d n p ()()组内能级间能量差小,能级组间能量差大。
每个代表一个原子轨道。
p三重简并,d五重简并,f七重简并。
对于多电子原子能级高低顺序,我国化学家徐光宪提出了(n+0.7l)规则。
即对于一个能级,其(n+0.7l)值越大,则能量越高,而且该能级所在能级组的组数就是(n+0.7l)的整数部分。
以第七能级组为例:7p(n+0.7l)=7+0.7⨯1=7.76d(n+0.7l)=6+0.7⨯2=7.45f(n+0.7l)=5+0.7⨯3=7.17s(n+0.7l)=7+0.7⨯0=7结果表明,各能级均属第七能级组,能<E5f<E6d<E7p级顺序为E7s2 科顿原子轨道能级图Pauling的原子轨道能级图是一种近似的能级图,基本上反映了多电子原子的核外电子填充的顺序。
但是由于各原子轨道的能量随原子序数增加而降低(且降低的幅度不同)所造成的不同元素的原子轨道能级次序不完全一致的事实在Pauling的能级图中没有得到体现。
2 科顿原子轨道能级图美国人科顿(Cotton)总结前人的光谱实验和量子力学计算结果,画出了原子轨道能量随原子序数变化图。
在图中可见(1)Z=1,不产生能级分裂。
即En s =En p=En d=En f2 科顿原子轨道能级图2 科顿原子轨道能级图(2)Z>1,各轨道的能量,随Z的增大而下降。
知识点7-分子轨道能级图及其应用

第二章分子结构第五节分子轨道理论2.5.2 分子轨道能级图及其应用分子轨道能级图及其应用1. 同核双原子分子轨道能级图a图:适合O2,F2 b图:适合N2,C2 ,B2N2和O2分子轨道与N、O原子轨道能级数据2. 同核双原子分子轨道电子排布式:◆H 22H 1s 1 →H 2H 2 [(σ1s )2] (分子轨道式)键级 = (相当于共价单键)◆H 2+(氢分子离子)H 2+ [(σ1s )1]键级 = 单电子键(VB 法和Lewis 理论无此说法)20122--==成键分子轨道电子数反键分子轨道电子数100.52-=◆He 2 [(σ1s )2 (σ*1s )2 ]键级 = (不成键),He 2不能稳定存在。
◆He +2 [(σ1s )2 (σ*1s )1 ]键级= , He 2+ 可以存在。
2202-=210.52-=2*22*24221s 1s 2s 2s 2p 2p N ()()()()(π)()σσσσσ⎡⎤⎣⎦键级 = 1/2( 10 - 4 ) = 3N 22*22*224*221s 1s 2s 2s 2p 2p 2p O ()()()()()(π)(π)σσσσσ⎡⎤⎣⎦键级= 1/2 ( 10 - 6 ) = 2O 2第二周期同核双原子分子的电子结构、键级、稳定性及磁性:3.异核双原子分子的分子轨道图及电子排布式: 分子轨道符号不再用下标1s、2s、2p等。
HF分子的电子构型:2224σσσ[123 1 π]CO与N2互为等电子体(14 e ),分子轨道能级相近。
CO [1σ2 2σ2 3σ2 4σ21π45σ2]键级= 3 相当于价键法:C ≡ O对比:N2 (σ1s) 2 (σ*1s) 2 (σ2s) 2 (σ*2s) 2 (π2p) 4 (σ2p) 2。
同核双原子分子轨道能级图

< π2py*=π2pz* <σ2px*
继续
σ*2px 2p π*2py π*2pz π2py π2pz σ2px 2s 2p
能级 差大
px py pz
px py pz
σ*2s
σ2s
2s
1s
σ*1s
1s
σ2px< π2p
σ1s
图(a)O2和F2分子轨道能级示意图
继续
组成原子的2s和2p轨道的能量相差较小,在 组合成分子轨道时,一个原子的2s轨道除能和另 一个原子的2s轨道发生重叠外,还可以与其2p轨 道重叠,其结果是使σ2px超过π2py和π2pz。这些原子 组成的同核双原子分子的分子轨道能级顺序为: [见图(b)] σ1s<σ1s*< σ2s<σ2s* < π2py=π2pz < σ2px < π2py*=π2pz* <σ2px*
把分子中各分子轨道按能量高低的顺序排 列起来就可以得到分子轨道能级图。 组成原子的2s和2p轨道的能量相差较大,在 组合成分子轨道时,不会发生2s和2p轨道的相互 作用,只是两原子轨道的s-s和p-p轨道的线性组合, 因此,这些原子组成的同核双原子分子的分子轨 道能级顺序为:[见图(a)] σ1s<σ1s*< σ2s<σ2s*< σ2px < π2py=π2pz
继续
σ*2px 2p π*2py π*2pz σ2px π2py π 2pz 2s 2p
能级 差小
px py pz
pห้องสมุดไป่ตู้ py pz
σ*2s
σ2s
2s
1s
σ*1s
1s
σ2px> π2p
σ1s
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
*1s
1s
1s
1s
键级 = ( 6 - 0 ) / 2 = 3 , 三 键 一个 键,两个 p 键
AO MO AO
O2 分子轨道图
p*2 p y 2p
p 2py
2s
1s
AO MO
分子轨道能级图为 A 图
*2 px p*2 pz
2p
p 2 pz 2 px *2s 2s 2s *1s 1s 1s
必须注意 A 图和 B 图之间的差别 。
A图 p*2 p y
*2 px p*2 pz
B图 p*2 p y
2p
2p 2p
*2 px p*2 pz
2p
p 2 py
p 2 pz 2 px
p 2py
2 px p 2 pz
2°电子在分子轨道中的排布
H2 分子轨道图
*1s
1s
1s 分子轨道式
1s
AO MO AO
*
MO
。
组合成的
MO 和
*
MO
的能量总和与原来 2 个
原子轨道 AO ( 2 个 s 轨道)的能量总和相等。
σ 的能量比 AO 低,称为成键轨道, σ* 比 AO 高,称为反键轨道。
当原子沿 x 轴接近时,px 与 px 头对头组合成 σ p和x σ* p。x
+
±
成键轨道在核间无节面,反键轨道在核间有节面。
AO
分子轨道式 ( 1s ) 2 ( *1s ) 2 键级 = ( 2 - 2 ) / 2 = 0
由于填充满了一对成键轨道和反键轨道,故分子的能量与原
子单独存在时能量相等, 键级为零。He 之间无化学键,即 He2 分子不存在。
He
+ 2
分子离子
1s
AO MO
*1s 1s
AO
分子轨道式
反键σ*
+
MO
成键σ
AO
AO
MO
When two 1s-orbitals overlap in the same region of space in such a way that their wavefunctions have the same signs in that region, their wavefunctions (red lines) interfere constructively and give rise to a region of enhanced amplitude between the two nuclei (blue line).
2 理论要点
1°分子轨道由原子轨道线性组合而成 分子轨道由原子轨道线性组合而成。分子轨道的数目与参与 组合的原子轨道数目相等。
H 2 中的两个 H ,有两个 1s ,可组合成两个分子轨道 : MO = c1 1 + c2 2 , * MO = c1 1 - c2 2
+
±
+
+
E
*
MO
-
O O 氧气分子的路易斯电子式为
,电子全部成对。
根据现代价键理论 px-px 成 σ 键, py - py 成π键。单电子全
look like p-orbitals when
viewed along the internuclear axis.
A typical molecular orbital energy-level diagram for the homonuclear diatomic molecules Li2 through N2. Each box represents one molecular orbital and can accommodate up to two electrons.
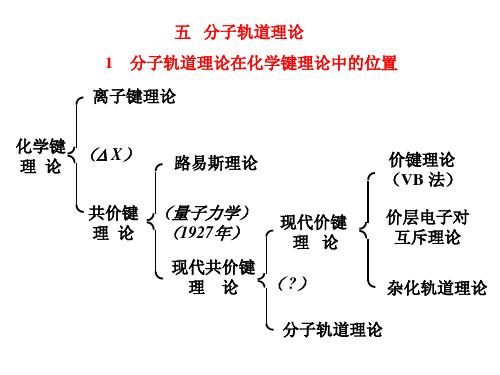
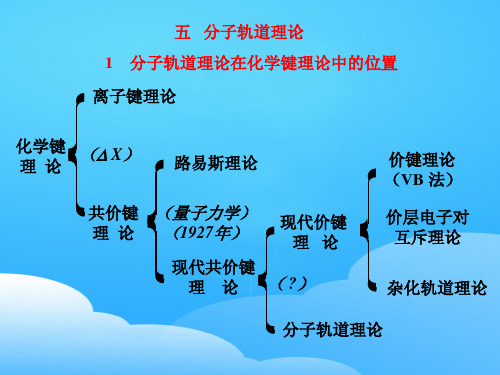
五 分子轨道理论 1 分子轨道理论在化学键理论中的位置 离子键理论
化学键 理论
( X)
路易斯理论
共价键 理论
(量子力学) (1927年)
现代价键 理论
现代共价键
理 论 ( ?)
价键理论 (VB 法)
价层电子对 互斥理论
杂化轨道理论
分子轨道理论
离子键理论 共价键理论
x > 1.7 电子发生转移 形成离子 x < 1.7 共用电子对
σ* px σ px
同时
py 和
py , pz
和
pz 分别肩并肩组合成 π*
p
,π
y
py
和
π*
p
,π
z
p分z 子轨道。
π*p 反键
核间有节面
±
πp 成键
π 轨道有通过两核连线的节面 ,σ 轨道没有。
2°线性组合三原则 a ) 对称性一致原则 对核间连线呈相同的对称性的轨道可以进行线性组合。 除上 述的 s - s ,p - p 之外 ,还有 s - px 沿 x 方向的组合, 两 者的对称性一致。组成 σ 分子轨道。 py - dxy 沿 x 方向,也可以组合成有效的 π 分子轨道。
+ +
+
+ ++
s
px
d xy
py
b ) 能量相近原则
H 1s - 1312 kJ·mol -1
Na 3s - 496 kJ·mol -1
O 2p - 1314 kJ·mol -1
Cl 3p - 1251 kJ·mol - 1 ( 以上数据根据 I1 值估算 ) 左面 3 个轨道能量相近,彼此间均可组合,形成分子轨道 ;
The two electrons in an H2 molecule occupy the lower-energy (bonding) molecular orbital and result in a stable molecule.
Two p-orbitals can overlap to give bonding (lower) and antibonding (upper) -orbitals. Note that the antibonding combination has a node between the two nuclei. Both – orbitals have nodes passing through the nuclei, but no nodes along the axis of the bond.
分子轨道能级图为 B 图
*2 px p*2 pz
2p
2 px p 2 pz *2s 2s 2s
分子轨道式 ( 1s ) 2 ( *1s ) 2 ( 2s ) 2 ( *2s ) 2 ( p 2 p y ) 2 ( p 2 pz ) 2 ( 2 px ) 2
或简写成 [ Be 2 ] ( p 2 p y ) 2 ( p 2 pz ) 2
The molecular orbital energy-level diagram for the homonuclear diatomic molecules on the righthand side of Period 2, specifically O2 and F2.
两个 s 轨道只能 “头对头” 组合成σ分子轨道 MO 和
A图 p*2 p y 2p
*2 px p*2 pz
2p
B图 p*2 p y 2p
*2 px p*2 pz
2p
p 2py 2s
p 2 pz 2 px
*2s 2s
2s
p 2py 2s
2 px p 2 pz *2s
2s 2s
*1s
*1s
1s
1s 1s
1s
1s
1s
AO MO AO
AO MO AO
Two p-orbitals can overlap side by side to give bonding (below) and antibonding (above) orbitals. Note that the latter has a nodal plane between the two nuclei. Both orbitals have a nodal plane through the two nuclei and
A molecular orbital energy-level diagram for the bonding and antibonding molecular orbitals that can be built from two sorbitals. Different signs of the s-orbitals (reflecting how they are combined together to form the molecular orbital) are depicted by the different shades of blue.
( 1s ) 2
电子填充在成键轨道中,能量比在原子轨道中低 。这个能量 差就是分子轨道理论中化学键的本质 。
可用键级表示分子中键的个数
键级 = ( 成键电子数 - 反键电子数 ) / 2 H2 分子中,键级 = ( 2 - 0 ) / 2 = 1 (单键 )
He2 分子轨道图
1s
AO MO
*1s 1s 1s
4°分子轨道中的电子排布 分子中的所有电子属于整个分子。电子在分子轨道中依能量 由低到高的次序排布。与在原子轨道中排布一样,仍遵循能量最 低原理,保里原理和洪特规则。
3 同核双原子分子 1°分子轨道能级图 同核双原子分子的分子轨道能级图分为 A 图和 B 图两种。 A 图适用于 O2 ,F2 分子;B 图适用于 B2,C2,N2 等分子。
