无机化学_晶体结构
无机化学第3章_晶体结构

[答] 图3-1中的小立方体不具有平移性,因为它与相邻的小立方体并非等 同。相反,大立方体才具有平移性,在它的上下左右前后都有无隙并置的完 全等同的立方体,只是没有画出来而已,因此大立方体才是晶胞,小立方体 不是晶胞。
(2) 晶胞具有相同的顶角、相同的平面和相同的 平行棱
图3-19 底心晶胞举例(I2) [答]将晶胞原点移至bc面心(a)和ab面心(c)均不能
使所有原子坐标不变,只有将晶胞原点移至ac面心(b) 才得到所有原子坐标不变的新晶胞,可见碘的晶胞是B底 心(正交)晶胞。
立方
边长: a=b=c
夹角: = = =900
实例: Cu , NaCl
(只有1个晶胞参数a是可变动的)
四方
边长:a=bc
夹角: = = =900
实例: Sn, SnCl2
(有2个晶胞参数a和c)
六方
边长:a= bc
夹角: = =900 =1200
实例: Mg, AgI
(有2个晶胞参数a和c)
面心晶胞的特征
可作面心平移,即所有原子均可作在其原子坐标上+ (1/2,1/2,0;0,1/2,1/2;1/2,0,1/2)的平移 而得到周围环境完全相同的原子。如晶胞顶角有一个原子, 在晶胞三对平行面的中心必有完全相同的原子(周围环境 也相同)。
[例3-5]图3-17中哪个晶胞是面心晶胞?
图3-17面心晶胞(金属铜)(左)与非面心晶胞(Cu3Au)(右)举例
3-2-4 素晶胞与复晶胞
素晶胞是晶体微观空间中的最小基本单元。 复晶胞是素晶胞的多倍体。即体心晶胞、面心晶胞、 底心晶胞。
晶
素晶胞P
体心晶胞 I(2倍体)
无机化学第七章 晶体结构

例1:体心立方晶胞中金属原子的空间利用 率计算 (教材P.213, 图9-10) (1)计算每个晶胞含有几个原子:
1 + 8 × 1/8
= 2
体心立方晶胞:中心有1个原子, 8个顶点各1个原子,每个原子被8个 晶胞共享。
(二)空间利用率计算(续)
(2)原子半径r 与晶胞边长a 的关系: 勾股定理: 2a 2 + a 2 = (4r)
半径比规则(续)说明:
3. 值位于“边界”位置附近时,相应化合物 有2种构型。 例:GeO2 r + / r - = 53 pm / 132 pm = 0.40. 立方ZnS NaCl 两种晶体空间构型均存在. 4.离子晶体空间构型除了与r + / r -有关外,还 与离子的电子构型、离子互相极化作用(如 AgI)以至外部条件(如温度)等有关。
(三)半径比规则(续)说明:
1.―半径比规则”把离子视为刚性球,适用于离子 性很强的化合物,如NaCl、CsCl等。否则,误差大。 例:AgI(c) r + / r - = 0.583. 按半径比规则预言为NaCl型,实际为立方ZnS型。 原因:Ag+与I-强烈互相极化,键共价性↑,晶型转 为立方ZnS(C.N.变小,为4:4,而不是NaCl中的6:6) 2.经验规则,例外不少。 例:RbCl(c),r / r 147pm / 184pm 0.80 0.732 预言CsCl型,实为NaCl型。
一、离子极化作用
离子极化作用(教材P.220图9-18) 离子极化力(Polarizing主动) 离子变形性 ( Polarizability, Polarized被动) 在异号离子电场作用下,离子的电子云发生变形, 正、负电荷重心分离,产生“诱导偶极”,这个过程 称为“离子极化”。 阳离子、阴离子既有极化力,又有变形性。 通常阳离子半径小,电场强,“极化力”显著。 阴离子半径大,电子云易变形,“变形性”显著。
无机化学 第7章 晶体的结构和性质

离子电荷 NaCl Na+ +1 CuCl Cu+ +1
r+/pm 95 96
溶解性 易溶于水 难溶于水
说明影响离子晶体的性质除了离子电荷、 离子半径外,还有离子的电子构型
7.6.1 离子的电子构型
简单阴离子的电子构型:ns2np6 8电子构型
阳离子外电子层 电子分布式
离子电 子构型
实例
1s2
2(稀有 气体型)
晶 液晶——介于液态和晶态之间的各向异 性的凝聚流体。
近似液态:能流动、不能承受应切力
近似晶体:介电常数、折射率、电导 率等性质各向异性
应用
由于对光、电、磁、热、机械压力及 化学环境变化都非常敏感,可作为各种信 息的显示和记忆材料。
第七章 固体结构与性质
7.2
离子晶体及其性质
7.2.1 离子晶体的特征和性
Sn2+、Pb2+ 、 Sb3+、Bi3+
7.6.2 离子极化的概念
+
+
-
对于孤立的简单离 子来说,离子电荷 分布基本上是球形 对称的,离子本身 的正、负电荷中心 重合, 不存在偶极
电场中,离子的原子 核和电子受电场的作 用,离子会发生变形, 产生诱导偶极,这种 过程称为离子极化
Li+
0.034
OH-
1.95
Na+
0.199
F-
1.16
Ca2+
0.52
Cl-
4.07
B3+
0.0033
Br-
5.31
Ag+
1.91
O2-
4.32
Hg2+
1.39
无机化学第二版课后练习题含答案

无机化学第二版课后练习题含答案
第一章晶体结构与晶体化学
练习题
1.什么是晶体结构?
2.描述组成配位数和形貌相同的正交晶系、四方晶系和六方晶系的特点。
3.TaCl5的结构类型是什么?给出TaCl5的点阵参数。
4.描述共价晶体和离子晶体的结构特点并给出两个例子。
答案
1.晶体结构是指对于一种给定的化学元素或化合物,其原子或离子分别
按一定的规律有序排列,形成具有规则重复的空间排列的结构。
–正交晶系:组成配位数为8,形貌倾向于长方体或正方体,一般相互垂直,如NaCl、MgO等。
–四方晶系:组成配位数为8,形貌为正方形或长方形板状,沿着一个轴和对角线对称。
如ZnS、TiO2、CaF2等。
–六方晶系:组成配位数为12,形貌为六边形柱状或针状,有沿着一个轴对称的等边六边形截面。
如α-石墨、SiC等。
2.TaCl5的结构类型是正交晶系。
TaCl5的点阵参数为a = 5.73 Å,b
= 5.28 Å,c = 11.85 Å,α = β = γ= 90°。
–共价晶体:由原子间较强的共价键构成,如金刚石、氧化硅(SiO2)。
–离子晶体:由阳离子和阴离子通过电滑移力相互结合而成,如NaCl、MgO。
1。
固体无机化学-晶体学基础2

l) (h k l) l) (h k i l) i = - h+k ) (
[U V W] [u v t w] U = u - t, V = v - t, W = w 1 1 u = [2U - V], v = [2V - U], t = -(u + v), w = W 3 3
(Miller Indices of Crystallographic Direction and Planes) 前已指出,任何阵点的位置可由矢量ruvw和该点阵的坐标u,v,w来确定。 同样晶向OP可沿a,b,c三个方向分解为三个矢量,即 1.阵点坐标 op = xa + yb + zc 2.晶向指数(Orientation index)
宏观对称要素— 宏观对称要素—回转对称轴
二维晶胞的密排图形
宏观对称要素— 宏观对称要素—对称面
1 晶体通过某一平面作 镜像反映而能复原, 则该平面称为对称面 或镜面。 2 对称面用符号 m 表示。
宏观对称要素宏观对称要素-对称中心
1 如果位于晶体中心O点一边 的每点都可在中心的另一边 得到对应的等同点,且每对 点子的连线均通过O点并被 它所等分,则此中心点称为 晶体的对称中心 对称中心。或称为反 对称中心 演中心。即晶体的每一点都 可借以O点为中心的反演动 作而与其对应点重合。 2 对称中心用符号 z 表示。
1 对称要素构成一些动作,即晶体经过这些动作 之后所处的位置与其原始位置完全重合,也就 是晶体上每一点的新旧位置都完全重合。 2 晶体的对称要素可分为宏观和微观两类。宏观 对称要素反映出晶体外形和其宏观性质的对称 性。而微观对称要素与宏观对称要素配合运用 就能反映出晶体中原子排列的对称性。
无机化学晶体结构

晶体结构和类型 金属晶体 离子晶体 分子晶体 混合晶体
§9.1 晶体结构和类型
9.1.1 晶体结构的特征与晶格理论 9.1.2 晶体缺陷 非晶体 9.1.3 球的密堆积 9.1.4 晶体类型
9.1.1 晶体结构的特征与晶格理论
晶胞:晶体的最小重复单元,通过晶胞
在空间平移无隙地堆砌而成晶体。 晶胞的两个要素:
第九章 晶体结构
• 教学要求: • 1、理解晶体的基本概念,掌握四种晶体类
型的特征和性质; • 2、初步了解离子极化的概念及其应用; • 3、掌握金属键的“自由电子”理论,了解
能带理论。 • 教学难点: • 离子极化;离子晶体的空间结构。
第九章 晶体结构
§9.1 §9.2 §9.3 §9.4 §9.5
a=b=c a=b=c a = b≠c a = b≠c a≠b≠c a≠b≠c a≠b≠c
α=β=γ= 900 α=β=γ≠900 α=β=γ= 900 α=β= 900, γ= 1200 α=β=γ= 900 α=β= 900, γ≠ 900 α≠β≠γ≠ 900
NaCl
Al2O3 SnO2 AgI HgCl2 KClO3 CuSO4·5H2O
-:8 1
1个
8
ZnS型(立方型)
晶格:面心立方
配位比:4:4 (红球-Zn2+ , 绿球-S2-) 晶胞中离子的个数: Zn2:4个
S2-:6 1 8 1 4个 28
半径比(r+/r-)规则: 其中一层横截面: (4r )2 2(2r 2r )2
令 r 1
r / r 0.414
NaCl晶体
△ rHm,1=89.2kJ·mol-1 △ rHm,2 =418.8kJ·mol-1 △ rHm,3 =15.5kJ·mol-1 △ rHm,4 =96.5kJ·mol-1 △ rHm,5 =-324.7kJ·mol-1 △ fHm =295.3kJ·mol-1
无机化学——原子晶体与分子晶体
B
B
C A
A
面心立方 紧密堆积
六方紧密堆积
Body-centered cubic cell (BCC)
体心立方紧密堆积 CN=12,利用率 =68% K、Rb、Cs、Li、 Na A B
A
体心立方 紧密堆积
7.4.2 金属键 金属键:金属原子的价电子可以完全失去成为自由电子,并在 晶格中运动,自由电子把金属阳离子胶合成金属晶体,这种胶 合作用就叫金属键。金属键无饱和性和方向性。
氯化氢、氨、三氯化磷、冰等由极性键构成的极性分子,晶体 中分子间存在色散力、取向力、诱导力,有的还有氢键,所以 它们的结点上的粒子间作用力大于分子量相近的非极性分子之 间的引力。
分子晶体的特性 分子晶体是以独立的分子出现的 ,化学式就是分子式。
分子晶体可以是非金属单质,如卤素、H2、N2、O2; 非金属化合物,如CO2、H2S、HCl、HN3等 绝大多数有机化合物,稀有气体的晶体
7.6.3 离子极化对物质性质的影响 一、离子的电子构型
外层电子结构 电子构型 阳离子实例
ns2np6
8
Na+, Mg2+,Al3+,Ti4+
ns2np6 nd1-9
9-17
Cr3+,Mn2+,Fe3+,Cu2+
ns2np6 nd10
18
Ag+,Zn2+,Cd2+,Hg2+
s2p6d10ns2
18+2
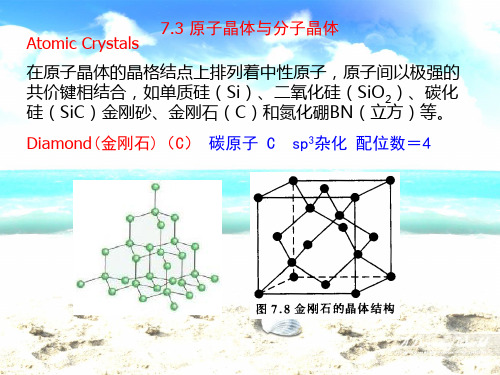
7.3 原子晶体与分子晶体 Atomic Crystals
在原子晶体的晶格结点上排列着中性原子,原子间以极强的 共价键相结合,如单质硅(Si)、二氧化硅(SiO2)、碳化 硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。
无机化学《晶体结构》教案

无机化学《晶体结构》教案[ 教学要求]1 .了解晶体与非晶体的区别,掌握晶体的基本类型及其性质特点。
2 .了解离子极化的基本观点及其对离子化合物的结构和性质变化的解释。
3 .了解晶体的缺陷和非整比化合物。
[ 教学重点]1 .晶胞2 .各种类型晶体的结构特征3 .离子极化[ 教学难点]晶胞的概念[ 教学时数] 4 学时[ 主要内容]1 .晶体的基本知识2 .离子键和离子晶体3 .原子晶体和分子晶体4 .金属键和金属晶体5 .晶体的缺陷和非整比化合物6 .离子极化[ 教学内容]3-1 晶体3-1-1 晶体的宏观特征晶体有一定规则的几何外形。
不论在何种条件下结晶,所得的晶体表面夹角(晶角)是一定的。
晶体有一定的熔点。
晶体在熔化时,在未熔化完之前,其体系温度不会上升。
只有熔化后温度才上升。
3-1-2 晶体的微观特征晶体有各向异性。
有些晶体,因在各个方向上排列的差异而导致各向异性。
各向异性只有在单晶中才能表现出来。
晶体的这三大特性是由晶体内部结构决定的。
晶体内部的质点以确定的位置在空间作有规则的排列,这些点本身有一定的几何形状,称结晶格子或晶格。
每个质点在晶格中所占的位置称晶体的结点。
每种晶体都可找出其具有代表性的最小重复单位,称为单元晶胞简称晶胞。
晶胞在三维空间无限重复就产生晶体。
故晶体的性质是由晶胞的大小、形状和质点的种类以及质点间的作用力所决定的。
3-2 晶胞3-2-1 晶胞的基本特征平移性3-2-2 布拉维系十四种不拉维格子类 型 说 明单斜底心格子( N ) 单位平行六面体的三对面中 有两对是矩形,另一对是非矩形 。
两对矩形平面都垂直于非矩形 平面,而它们之间的夹角为β, 但∠β≠ 90°。
a 0≠ b 0 ≠ c 0 ,α = γ =90°, β≠ 90°正交原始格子( O ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交体心格子( P ) 属于正交晶系,单位平行六 面体为长、宽、高都不等的长方 体,单位平行六面体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交底心格子( Q ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °正交面心格子( S ) 属于正交晶系,单位平 行六面体为长、宽、高都不 等的长方体,单位平行六面 体参数为: a 0 ≠ b 0 ≠ c 0 α = β = γ =90 °立方体心格子( B ) 属于等轴晶系,单位平行六 面体是一个立方体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例如:在标态和298.15K下, NaCl(s) → Na+(g) + Cl-(g)
U= 770kJmol-1
NaCl 型 离子晶体 NaF NaCl NaBr NaI MgO CaO SrO BaO
Z1 1 1 1 1 2 2 2 2
Z2 1 1 1 1 2 2 2 2
r+ /pm 95 95 95 95 65 99 113 135
根据晶格结点上微粒的种类及其作用力的不同, 晶体分为 离子晶体、原子晶体、分子晶体和金属晶体
镍基单晶高温合金
7.2 离子晶体
7.2.1 特征和性质 晶格结点上交替排列着正、负离子,以离子键相结合。 典型的离子晶体是由活泼金属与活泼非金属形成的化合物。 总的:由于离子键的键能较高,离子晶体一般具有较高的 熔点、硬度,难于挥发,但较脆。 具体:离子晶体中的晶格的牢固程度,可用晶格能来衡量 (后面介绍)。 概念:配位数: 通常是指晶体内(或分子内)某一粒子周围最接近该粒 子的粒子数目。例如:NaCl中, Na+周围最接近的有6 个Cl- , Cl-周围最接近的有6个Na+ ,Na+和Cl-的配位 数均为6。
第七章 固体结构
思考题 1)为什么同是固体的金刚石和干冰性质差别如何 之大? 2)为什么阴阳离子电荷相同、半径相近的NaCl和 CuCl晶体,性质却有很大差别(NaCl 溶于水 而 CuCl不溶)?
7.1 晶体及其内部结构 7.1.1 晶体的特征 (1)有特定的几何形状
(2)有固定的熔点 (判断是否是晶体的一个很重要标准) (3)各向异性 晶体与非晶体在性质上的差异,是由其内部结构上的差异 造成的。 晶体:内部微粒(分子、原子或离子)的排列是有次序的, 有规律的,而且在不同的方向上排列往往不同,因而造 成了晶体的各向异性。 非晶体:内部微粒的排列是无次序的,无规律的
钒(1890℃) 铬(1857℃) 铌(2468℃) 钼(2610℃)
锝(2172℃) 钌(2310℃) 铑(1966℃) 铪(2227℃)
钽(2996℃) 钨(3410℃) 铼(3180℃) 锇(3045℃)
铱(2410℃) 钨是熔点最高的金属 高熔点合金
高温合金制造的火焰筒
பைடு நூலகம்
金属晶体的内部结构(金属堆积方 式 ): 假定晶体中的粒子是球形的, 每个球周围可排6个球构成密 堆积层(第一层);第二层堆积 在第一层上,每个球放入第一 层三个球所形成的空隙中;第 三层有两种不同的情形,一是 第三层与第一层球对齐,成 ABAB型排列----六方最密堆积, 二是第三层与第一层有一定错 位,以ABCABC型排列----面 心立方最密堆积。
3 能带理论 能带理论把金属晶体看成为一个大分子。这个分子由 晶体中所有原子组合而成。以Li原子为例,每立方 厘米的金属Li晶体,所含Li原子近1022数量级,一个 Li原子有1s、2s两个轨道,按分子轨道概念,n个原 子轨道可以组成n个分子轨道, 1022个原子轨道可 以组成1022个分子轨道,分子轨道如此之多,分子 轨道之间的能级差很小,实际上这些能级很难分清, 可以看成连成一片成为能带。 由2s原子轨道组成的能带称为2s能带。
思考题:实验发现:在石英表面涂覆一层石蜡后,当用热 的针尖接触石蜡时,发现接触点周围的石蜡熔化成椭 圆形;当用玻璃代替石英实验时,发现接触点周围的 石蜡熔化成圆形。为什么? 晶体与非晶体在一定条件下可以相互转化。例如把石英晶 体熔化后迅速冷却,可以得到硅石玻璃(非晶体)。 从热力学上讲,晶态比非晶态稳定。
例: 金刚石晶体中,每一个C原子(sp3杂化)通过共价 键与相邻的四个C原子结合,构成正四面体 熔点 3570℃ 硬度 10
7.3.2 分子晶体 晶格结点上排列的是分子,分子之间以分子间力(有些还 有氢键)相结合。 分子间力较小,故分子晶体熔点低,硬度小 常见分子晶体:稀有气体、大多数非金属单质和非金属之 间的化合物、大部分有机化合物 例如:干冰(固体CO2) 就是典型的分子晶体, 晶格结点上排列的是 CO2分子。在-78.5 ℃时升华。
rU /pm /kJ·mol-1 136 920 181 770 195 733 216 683 140 4147 140 3557 140 3360 140 3091
熔点 /o C 992 801 747 662 2800 2576 2430 1923
硬度 3.2 2.5 <2.5 <2.5 5.5 4.5 3.5 3.3
半导体与绝缘体的区别不是绝对的。绝缘体在通常情况 下是不导电的,但在高温或高压下,价带中的电子就有 可能穿越禁带、跃迁到导带,而使绝缘体变为半导体。 例如,零族元素单质可在高压下导电,并发出各种颜色 的光。“人造小太阳”就是在石英管中充有氙气的氙灯。
思考题
如何根据能带结构来说明温度对导体、半导体和绝缘体导电性的 不同影响? 最常见的导体是金属,金属的导电主要是通过导带中电子的定向 运动来实现的。当温度升高时,金属中离子的热振动加剧, 电子与它们碰撞的频率增加,使电子运动受到阻碍,从而使 金属导电能力下降。因此金属的导电性随温度升高而下降。 绝缘体由于禁带宽度较大(通常达到500kJ· mol-1),在一 般温度下,电子难以藉热运动从价带跃过禁带而迁移到导带 中,因此没有能自由运动的电子,即使升高温度也仍然不能 导电。但在很高的温度下有可能使少量价带电子热激发到导 带而具有半导体性质。 半导体的禁带宽度要小得多,一般在100kJ· mol-1左右, 可能有少数电子藉热激发,从价带跃迁到导带而成为能在电 场下运动的自由电子,所以有一定导电性。随温度升高,电 子的热激发增强,因此半导体的导电性随温度升高而增强
2 晶体缺陷 理想晶体:晶体内每一个粒子的排列均完全符合某种规 律的晶体 实际晶体内部的点缺陷可分为空穴缺陷、置换缺陷和间 充缺陷。
a 空穴
b 置换
c 间充
晶体中的缺陷对晶体的物理、化学性质产生影响。如纯铁 中加入少量碳或某些金属可制得性能优良的合金钢;纯锗 中加入微量的镓或砷,可强化锗的半导体性能。
7.4 金属晶体
1 内部结构 晶格结点上排列的是金属原子,金属原子间以金属键 相结合。 金属键的强弱不同,金属晶体的熔点、硬度差异很大。 常见的金属晶体:金属单质,合金 低熔点金属 低熔点金属主要集中于第Ⅰ主族、第Ⅱ副族及大多数p 区金属。第Ⅰ主族金属较活泼,p 区的镓、铟、铊资源 稀少,因此常用的低熔点金属有汞(-38.84℃)、锡 (231.97℃)、铅(327.5℃)、锑(630.7℃)和铋(271.3℃)等。 低熔点金属主要用于制备低熔点的合金。
NaCl晶体的晶胞
7.1.3 单晶体和多晶体( 自学)
晶体还可分为单晶和多晶。单晶是由一个晶核沿各个方向 均匀生长而成的,其晶体内部粒子基本上是按一定规则 整齐排列的,如单晶硅。通常的晶体是由很多单晶颗粒 杂乱聚结而成。尽管每颗晶粒是各向异性的,但由于晶 粒排列杂乱,各向异性互相抵消,使整个晶体失去了各 向异性的特征。这种晶体称为多晶,例如大多数金属及 其合金。
另外还有一种体心立方密堆积,就是在由A球组成的立 方体中心堆积有B球 面心立方最密堆积 配位数为12 例Ca、Sr、Fe、Co、Ni 六方最密堆积 配位数为12 例Be、Mg、Y、Ce、Zr 体心立方密堆积 配位数为8 例Li、Na、Cs、Ba、Ti
2 金属键
• 与非金属原子相比,金属原子的半径比较大,核对价 电子的吸引力比较弱 • 价电子容易从金属原子上脱落下来汇集成所谓的“电 子海” • 脱落下来的电子能在整个金属晶体中自由流动而被称 之为自由电子 • 金属中自由电子与金属正离子间的作用力叫做金属键, 正是这种作用力将金属原子“胶合”起来形成金属晶 体。 • 金属键不具有方向性和饱和性
金属键理论可以定性解释金属的多数特征 • 导电性 自由电子在外电场影响下定向流动形成电 流使金属具有良好的导电性 • 导热性 金属的导热性也与自由电子有关,运动中 的自由电子与金属离子通过碰撞而交换能量进而将 能量从一个部位迅速传到另一个部位 • 延展性 与离子型和共价型物质不同,外力作用于 金属晶体时,正离子间发生的滑动不会导致键的断 裂,使金属表现出良好的延展性,从而便于机械加 工 一般说来,价电子比较多的金属熔、沸点相对比较高, 据认为这是由于更多的电子“下海”后增强了金属 键。价电子多的金属,其硬度和密度也比较大。
能带分为满带、导带、禁带
充满电子的较低能量的能带称为满带 未充满电子的较高能量的能带称为导带 满带与导带之间不存在电子能级的能量间隔称为禁带
按能带结构的不同,可将固体分为导体、半导体和绝缘 体。 只有在既有电子、又有空能级的能带中,电子才能自由 移动,从而可在电场作用下产生定向运动而导电。
金属具有如下图所示的几种类型的能带结构,因 此具有良好的导电性
低熔点合金
低熔点合金通常由锡、铅、铋等元素组成。 例如,质量分数50%的铋、25%的铅、12.5% 的锡和12.5%的镉组成的合金(伍德合金),其熔 点为71℃,可用于自助灭火设备、高压锅和蒸气 锅炉的安全装置上
轻合金
镁合金
铝合金
手机壳
飞机的铝合金蒙皮
钛合金
钛合金制造的发动机叶片
高熔点金属 高熔点金属主要集中于第Ⅵ副族附近的d 区元素。通常 认为熔点等于或高于铬的熔点(1857℃)的金属为耐高温金 属,共有13种,分别为
7.5 混合型晶体和晶体缺陷(自学)
1混合型晶体 晶体内同时存在着几种不同的作用力,具有几种晶体的结构和性质。 例:石墨 C以sp2杂化方式形成3条 sp2杂化轨道,分别与相邻的3个C原 子形成3条σ键,键角为120°,构成一 个正六角形的平面层。每个C原子还 有1个2p电子,其p轨道垂直于上述平 面层。这些相互平行的p轨道相互重叠 形成遍及整个平面层的大π键。大π键 中的电子能沿着层面流动,使石墨具 有良好的导电、导热性,工业上可用 作电极和冷却器。石墨晶体中层与层间的距离较远,作用力较小, 所以外力作用下易滑动,可作固体润滑剂。
