无机化学_晶体结构-文档资料
无机化学第3章_晶体结构

[答] 图3-1中的小立方体不具有平移性,因为它与相邻的小立方体并非等 同。相反,大立方体才具有平移性,在它的上下左右前后都有无隙并置的完 全等同的立方体,只是没有画出来而已,因此大立方体才是晶胞,小立方体 不是晶胞。
(2) 晶胞具有相同的顶角、相同的平面和相同的 平行棱
图3-19 底心晶胞举例(I2) [答]将晶胞原点移至bc面心(a)和ab面心(c)均不能
使所有原子坐标不变,只有将晶胞原点移至ac面心(b) 才得到所有原子坐标不变的新晶胞,可见碘的晶胞是B底 心(正交)晶胞。
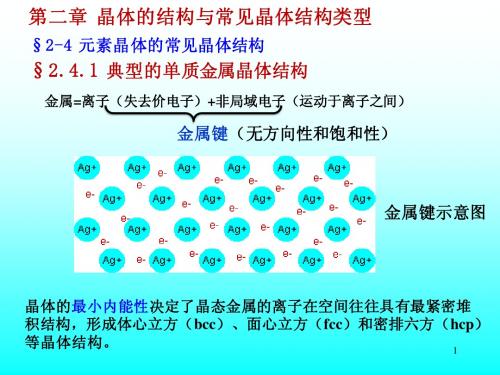
立方
边长: a=b=c
夹角: = = =900
实例: Cu , NaCl
(只有1个晶胞参数a是可变动的)
四方
边长:a=bc
夹角: = = =900
实例: Sn, SnCl2
(有2个晶胞参数a和c)
六方
边长:a= bc
夹角: = =900 =1200
实例: Mg, AgI
(有2个晶胞参数a和c)
面心晶胞的特征
可作面心平移,即所有原子均可作在其原子坐标上+ (1/2,1/2,0;0,1/2,1/2;1/2,0,1/2)的平移 而得到周围环境完全相同的原子。如晶胞顶角有一个原子, 在晶胞三对平行面的中心必有完全相同的原子(周围环境 也相同)。
[例3-5]图3-17中哪个晶胞是面心晶胞?
图3-17面心晶胞(金属铜)(左)与非面心晶胞(Cu3Au)(右)举例
3-2-4 素晶胞与复晶胞
素晶胞是晶体微观空间中的最小基本单元。 复晶胞是素晶胞的多倍体。即体心晶胞、面心晶胞、 底心晶胞。
晶
素晶胞P
体心晶胞 I(2倍体)
无机化学第七章 晶体结构

例1:体心立方晶胞中金属原子的空间利用 率计算 (教材P.213, 图9-10) (1)计算每个晶胞含有几个原子:
1 + 8 × 1/8
= 2
体心立方晶胞:中心有1个原子, 8个顶点各1个原子,每个原子被8个 晶胞共享。
(二)空间利用率计算(续)
(2)原子半径r 与晶胞边长a 的关系: 勾股定理: 2a 2 + a 2 = (4r)
半径比规则(续)说明:
3. 值位于“边界”位置附近时,相应化合物 有2种构型。 例:GeO2 r + / r - = 53 pm / 132 pm = 0.40. 立方ZnS NaCl 两种晶体空间构型均存在. 4.离子晶体空间构型除了与r + / r -有关外,还 与离子的电子构型、离子互相极化作用(如 AgI)以至外部条件(如温度)等有关。
(三)半径比规则(续)说明:
1.―半径比规则”把离子视为刚性球,适用于离子 性很强的化合物,如NaCl、CsCl等。否则,误差大。 例:AgI(c) r + / r - = 0.583. 按半径比规则预言为NaCl型,实际为立方ZnS型。 原因:Ag+与I-强烈互相极化,键共价性↑,晶型转 为立方ZnS(C.N.变小,为4:4,而不是NaCl中的6:6) 2.经验规则,例外不少。 例:RbCl(c),r / r 147pm / 184pm 0.80 0.732 预言CsCl型,实为NaCl型。
一、离子极化作用
离子极化作用(教材P.220图9-18) 离子极化力(Polarizing主动) 离子变形性 ( Polarizability, Polarized被动) 在异号离子电场作用下,离子的电子云发生变形, 正、负电荷重心分离,产生“诱导偶极”,这个过程 称为“离子极化”。 阳离子、阴离子既有极化力,又有变形性。 通常阳离子半径小,电场强,“极化力”显著。 阴离子半径大,电子云易变形,“变形性”显著。
无机化学 第7章 晶体的结构和性质

离子电荷 NaCl Na+ +1 CuCl Cu+ +1
r+/pm 95 96
溶解性 易溶于水 难溶于水
说明影响离子晶体的性质除了离子电荷、 离子半径外,还有离子的电子构型
7.6.1 离子的电子构型
简单阴离子的电子构型:ns2np6 8电子构型
阳离子外电子层 电子分布式
离子电 子构型
实例
1s2
2(稀有 气体型)
晶 液晶——介于液态和晶态之间的各向异 性的凝聚流体。
近似液态:能流动、不能承受应切力
近似晶体:介电常数、折射率、电导 率等性质各向异性
应用
由于对光、电、磁、热、机械压力及 化学环境变化都非常敏感,可作为各种信 息的显示和记忆材料。
第七章 固体结构与性质
7.2
离子晶体及其性质
7.2.1 离子晶体的特征和性
Sn2+、Pb2+ 、 Sb3+、Bi3+
7.6.2 离子极化的概念
+
+
-
对于孤立的简单离 子来说,离子电荷 分布基本上是球形 对称的,离子本身 的正、负电荷中心 重合, 不存在偶极
电场中,离子的原子 核和电子受电场的作 用,离子会发生变形, 产生诱导偶极,这种 过程称为离子极化
Li+
0.034
OH-
1.95
Na+
0.199
F-
1.16
Ca2+
0.52
Cl-
4.07
B3+
0.0033
Br-
5.31
Ag+
1.91
O2-
4.32
Hg2+
1.39
无机化学晶体结构

晶体结构和类型 金属晶体 离子晶体 分子晶体 混合晶体
§9.1 晶体结构和类型
9.1.1 晶体结构的特征与晶格理论 9.1.2 晶体缺陷 非晶体 9.1.3 球的密堆积 9.1.4 晶体类型
9.1.1 晶体结构的特征与晶格理论
晶胞:晶体的最小重复单元,通过晶胞
在空间平移无隙地堆砌而成晶体。 晶胞的两个要素:
第九章 晶体结构
• 教学要求: • 1、理解晶体的基本概念,掌握四种晶体类
型的特征和性质; • 2、初步了解离子极化的概念及其应用; • 3、掌握金属键的“自由电子”理论,了解
能带理论。 • 教学难点: • 离子极化;离子晶体的空间结构。
第九章 晶体结构
§9.1 §9.2 §9.3 §9.4 §9.5
a=b=c a=b=c a = b≠c a = b≠c a≠b≠c a≠b≠c a≠b≠c
α=β=γ= 900 α=β=γ≠900 α=β=γ= 900 α=β= 900, γ= 1200 α=β=γ= 900 α=β= 900, γ≠ 900 α≠β≠γ≠ 900
NaCl
Al2O3 SnO2 AgI HgCl2 KClO3 CuSO4·5H2O
-:8 1
1个
8
ZnS型(立方型)
晶格:面心立方
配位比:4:4 (红球-Zn2+ , 绿球-S2-) 晶胞中离子的个数: Zn2:4个
S2-:6 1 8 1 4个 28
半径比(r+/r-)规则: 其中一层横截面: (4r )2 2(2r 2r )2
令 r 1
r / r 0.414
NaCl晶体
△ rHm,1=89.2kJ·mol-1 △ rHm,2 =418.8kJ·mol-1 △ rHm,3 =15.5kJ·mol-1 △ rHm,4 =96.5kJ·mol-1 △ rHm,5 =-324.7kJ·mol-1 △ fHm =295.3kJ·mol-1
无机材料化学03-无机材料的晶体结构

第三章 无机材料的晶体结构1. 研究材料结构的意义 2. 晶体结构的基本知识 3. 晶体结构的表示 4. 晶体结构的确定 5. 无机材料的结构 6. 影响材料结构的因素2 研究材料结构的意义¾ 研究材料的结构是了解材料性质的基础 ¾ 建立结构与性能之间的关系为新材料的 设计奠定基础NaCl结构Na-Al2O3结构La2CuO4结构3 晶体结构的基本知识¾ 晶胞晶胞是晶体的代表,是晶体中的最小单位。
晶胞并 置起来,则得到晶体。
NaCl的晶胞CsCl的晶胞4晶胞的代表性体现在以下两个方面: 一是代表晶体的化学组成;二是代表晶 体的对称性,即与晶体具有相同的对称 元素(对称轴,对称面和对称中心)。
晶胞是具有上述代表性的体积最 小、直角最多的平行六面体。
ZnS的晶胞 取晶胞的条件:可以表现出晶体结构全部对称性的最小单位。
5晶胞参数:晶胞的形状和大小可以用6个参数来表示,此 即晶格特征参数,简称晶胞参数。
它们是3条棱边的长度 a、b、c和3条棱边的夹角α、β、γ。
根据晶胞参数取值不同, 可将晶体分为立方、四方、 正交、三方、六方、单斜 和三斜七种晶系。
6¾ 7 个晶系晶系 高级 中级 立方 六方 四方 三方 正交 低级 单斜 三斜 对称元素 四个沿体对角线的三重轴 六重对称轴 四重对称轴 三重对称轴 垂直的两个镜面或三个二重轴 两重对称轴或对称面 无 晶胞类型 a=b=c, α=β=γ=90° a=b≠c, α=β=90°, γ=120° a=b≠c, α=β=γ=90° a=b≠c, α=β=90°, γ=120° a=b=c,α=β=γ≠90° a≠b≠c,α=β=γ=90° a≠b≠c,α=β=90°≠γ a≠b≠c,α≠β≠γ≠90°7 个晶系的对称元素和晶胞类型7边长: a=b=c 夹角: α=β=γ=900 实例: Cu, NaCl立方四个沿体对角线的三重轴8边长: a=b≠c 夹角: α=β=900, γ=1200 实例: Mg, AgI六方六重对称轴9边长: a=b≠c 夹角: α=β=γ=900 实例: Sn, SnO2四方四重对称轴10边长: a=b=c 夹角: α=β=γ≠ 90°或者 边长: a=b≠c 夹角: α=β=90 °, γ=120 ° 实例: Al2O3, Bi三方三重对称轴11三方格子有两种取法aH aR cHa c aR = + 3 9 α aH sin = 2 aR2 H2 H12边长: a≠b≠c 夹角: α=β=γ=900 实例: I2, HgCl2正交垂直的两个镜面或三个二重轴13边长: a≠b≠c 夹角: α=γ=900, β≠900 实例: S, KClO3单斜两重对称轴或对称面14边长: a≠b≠c 夹角: α≠β≠γ≠900 实例: CuSO4.5H2O三斜无对称元素15¾ 14种Braviais(布拉维)格子立 方 晶 系 四 方 晶 系 正 交 晶 系 六 方 晶 系 三 方 晶 系 三 斜 晶 系简单立方-P体心立方-I 单 斜 晶 系面心立方-F六方-P简单四方-P体心四方-I简单单斜-P 底心单斜-C三方-R简单正交-P 底心正交-C体心正交-I面心正交-F三斜-P16P-不带心,R-斜方,I-体心,H-六方,C-底心,F-面心立方P立方I立方F四方P四方I单斜P单斜C17P-不带心,R-斜方,I-体心,H-六方,C-底心,F-面心三斜P三方R六方P正交P正交C正交I正交F1819¾ 32个晶体学点群 (宏观点群)晶系 立方 Cubic 六方 Hexagonal 四方 TetragonalOh / Th / m3 D6 / 622 D4 / 422m3m熊夫利符号 / 国际符号 Td / 43m T / 23 C6h / 6/m C4h / 4/m O / 432D6h / 6/mmm D3h / 62 m C6v / 6mm C6 / 6 C3h / 6 S4 / 420D4h / 4/mmm D2d / 42m C4v / 4mm C4 / 4C i /C 1/ 1三斜TriclinicC 2h /2/m C s /m C 2/ 2D 2h /mmmC 2V / mm 2D 2 /222D 3d /2/mC 3V / mD /32C 3i /C 3/3熊夫利符号/国际符号单斜Monoclinic 正交Orthorhombic 三方Trigonal晶系13国际符号中三个位置所代表的方向a+b 2a+b a+b ----c ----a+b+c a a a-b a b ----a c c a+b+c c a b --立方晶系六方晶系四方晶系三方晶系(R)三方晶系(H)正交晶系单斜晶系三斜晶系321三个位置表示的方向晶系24a bacc b等效点系各种符号的含义:旋转轴,螺旋轴反演中心镜面a 滑移面n 滑移面各对称操作的位置27产生等效点的对称操作2930(space group) P (No. 221)晶体学表示32SrTiO 3结构(Perovskite, 钙钛矿结构)TiO 6八面体连接Ba, O密置层结构BaTiO334•晶体结构的确定¾方法:X 射线衍射,中子衍射,电子衍射。
无机化学@7 晶体结构

金属键的“量子力学”描述---能带理论: 晶体可看作由无限个原子组成的大分子 形成金属晶体同时,每个原子都提供原子轨道 多条相同原子轨道重叠形成能级密集的分子轨道 分子轨道能级只能在有限宽度范围内分布 分子轨道越多,轨道间能极差越小 由无限个原子组成的晶体,分子轨道间能极差趋于零,形 成一定能量范围的连续能带 不同类型原子轨道(例如s、p或d轨道)形成不同能量范 围的能带,例如,s带、p带或d带 能带之间由带隙分开 能量相近的不同宽能带,可能发生重叠失去带隙 能带宽度
θ f Hm [NaCl(s)] 411 kJ
Na(s)+ Cl2 (g)
1 2
f Hmθ = - 411kJ mol-1
NaCl(s)
H5θ
H
θ 1
H 2θ
Cl(g)+ e
Na(g) - e
θ m
-
H 4
H
θ 3
θ
Cl (g)
Na (g)
θ θ 5
-
θ 1 θ
+
+
f H H H2 H H4 H
离子极化对离子键性质影响
离子极化作用,特别是还具有附加极化作用
的正、负离子会靠得更近, 使正、负离子的电子云发生重叠,离子键带 有共价键成分,甚至形成共价键。
+ -
+
-
离子键
带有共价键成 分的离子键
共价键
变形性:
描述离子本身变形性质的物理量。
离子的极化作用:
描述一个离子导致其它离子变形的影响能力。
离子
A A n A A
A A A
A1 B2 A3 B1
B3 A2 A
A A A
无机化学@6 晶体结构

H3BO3晶体的氢键连结构
不论堆积,还是键连, 粒子(原子、分子或离子)在空间排列 都存在某种共性上的规律 , 要弄清这些规律, 先要对晶体进行抽象。
空间点阵学,把晶体内部的粒子(原 子、分子或离子)抽象成质点 让质点成行成列的排列 研究质点排列的规律性
3.2 晶体、晶格与晶胞
晶体中质点成行成列的排列,叫点阵。点与点 连接起来的格子,叫晶格。质点所占据的位置, 叫晶格结点。结点上的粒子不同,形成不同类 型的晶体。
等径圆球常见堆积方式
A
B
A
B
A
B
A
A
A
B
A
B
A
B
A
A
A
A
A
A
A
单层等径圆球的非密排---方式Ⅰ
A
B
A
B
C
A
B
C
A
B
C
A
C
A
B
C
A
B
C
A
B
C
A
B
C
A
A
B C
A
B
A
B C
A
B C
A
C
C
A
A
A
A
A
单层等径圆球的密排---方式Ⅱ
A A B A
B
A
B
A
B
A n A
B
A
A
B
A
A
A
A
A
A
A
第二、三层等径圆球的非密排方式
自行计算
1 8 8
1
含1个粒子 原子空间占有率52.3% 简单立方晶胞
自行计算
《无机化学》第3版 宋天佑 第7章 晶体结构

分子越大,越容易变形,瞬 间偶极也越大。
7. 1. 2 分子间作用力
分子间力最早是由范德华 研究实际气体和理想气体状态 方程的偏差时提出来的
因而,分子间力又称为范 德华力。
分子间的范德华力可根据 来源不同分为
取向力、诱导力和色散力
1. 取向力 取向力又称定向力,是极性 分子之间的永久偶极与永久偶极 之间的静电引力。
对弱的氢键,如 C-H ···O,C-H ···N 等, 其方向性和饱和性不如经典的 氢键严格。
H ···Y 间距离较长, 经常出现一个 Y 原子同时 形成多个氢键的情况。
(2) 氢键的强度
氢键的强弱与 X 和 Y 的电负性 大小有关。
X,Y 的电负性越大,则形成 的氢键越强。
氢键的强弱也与 X 和 Y 的半径大小有关。
q+·q- V吸引 = 4 π ε0 r
当正负离子相互接近时,它 们之间主要是静电吸引作用。
但当正负离子进一步相互接 近时,除了静电吸引外,还存在 外层电子之间以及原子核之间的 相互排斥作用。
这种排斥作用当 r 较大时 可以忽略。
但当正负离子充分接近,r 极小时, 这种排斥作用的势能 迅速增加。
V
0
Vr0 r
主要表现为吸引作用。 所以,体系的能量随着 r 的 减小而降低。
V
0
Vr0 r
当 Na+ 和 Cl- 非常接近时, r 很小,此时排斥作用为主,体 系能量迅速增大。
V
0
Vr0
r0
r
当 Na+ 和 Cl- 接近平衡距离
r0 时,体系的吸引作用和排斥作 用处于动态平衡,
V
0
Vr0
无机单质及化合物晶体结构

立方ZnS(闪锌矿)型结构
闪锌矿属立方晶系,点群3m,空间群F3m,与金刚石结构相似;S2-作面心立方堆积,Zn2+占据1/2四面体空隙,即交错填充于8个小立方体体心,正负离子配位数均为4;晶胞分子数Z=4;整个结构由Zn2+和S2-各一套面心立方格子沿体对角线方向位移1/4体对角线长度穿插而成。 Zn2+具有18电子构型,S2-易于变形,则Zn-S键带有相当程度共价键性质。 常见闪锌矿型结构有Be、Cd、Hg等的硫化物、硒化物和碲化物以及CuCl及-SiC等。
对于第V族元素,单键个数为8-5=3,每个原子周围有3个单键(或原子),其结构是原子之间首先共价结合形成无限层状单元,层状单元之间借助范德华力结合形成晶体。 对于第IV族元素,单键个数为8-4=4,每个原子周围有4个单键(或原子)。其中C、Si、Ge皆为金刚石结构,由四面体以共顶方式共价结合形成三维空间结构,如图1-14 。
CsCl型结构 CsCl属于立方晶系,点群m3m,空间群Pm3m。结构中正负离子作简单立方堆积,配位数均为8,晶胞分子数Z=1,键性为离子键。CsCl晶体结构也可以看作正负离子各一套简单立方格子沿晶胞的体对角线位移1/2体对角线长度穿插而成。
CsCl晶胞结构
CsCl晶胞结构
CsCl晶体结构
闪锌矿晶胞结构
闪锌矿结构在(001)面上的投影
闪锌矿结构中[ZnS4]分布及连接
六方ZnS(纤锌矿)型结构及热释电性
结构解析 纤锌矿属六方晶系,点群6mm,空间群P63mc;S2-作六方最紧密堆积,Zn2+占据1/2四面体空隙,Zn2+和S2-配位数均为4。六方柱晶胞中ZnS的“分子数”为6,平行六面体晶胞中,晶胞分子数Z=2;结构由Zn2+和S2-离子各一套六方格子穿插而成 。 常见纤锌矿结构晶体:BeO、ZnO、CdS、GaAs等晶体。
无机化学第七章晶体结构

无机化学第七章晶体结构晶体结构是无机化学中一个重要的概念。
晶体是由一个或多个原子、离子或分子有序排列组成的固体,具有规则的几何形状。
晶体结构研究的是晶体中原子、离子或分子的排列方式和间距。
晶体结构的研究首先要确定晶胞的类型和晶格常数。
晶胞是晶体中基本的重复单元,可以通过晶胞的平移得到整个晶体。
晶格常数是指晶胞中原子、离子或分子的排列方式和间距。
晶体结构可以用晶胞的对称性来描述。
对称性是指晶胞的各个面和角的排列方式。
晶胞的对称性可以分为平面对称、轴对称和空间对称。
根据对称性的不同,晶体可以分为立方晶体、四方晶体、正交晶体、六方晶体、单斜晶体、三斜晶体和三角晶体等七种类型。
晶体结构中还有一些重要的概念,如晶系、空间群和点群。
晶系是指晶体结构的基本几何形状,包括立方、四方、正交、六方、单斜、三斜和三角七种类型。
空间群是指晶体结构的完整的对称操作,包括平移、旋转、反射和滑移。
点群是指晶体结构的实际的对称操作,只包括旋转和反射,不包括平移。
晶体结构的研究方法主要有X射线衍射方法、电子衍射方法和中子衍射方法等。
X射线衍射是最常用的晶体结构研究方法。
当X射线通过晶体时,会发生衍射现象。
根据衍射的图样可以确定晶体的结构。
晶体结构的研究对于了解物质的性质和应用具有重要的意义。
晶体结构可以影响物质的物理和化学性质,如硬度、透明度和导电性等。
通过了解晶体结构,可以设计和合成具有特定性能的材料,如硅和镍钴锌铁氧体等。
晶体结构的研究还可以为材料科学、能源、光电子学和生物医学等领域的研究提供指导。
总之,晶体结构是无机化学中一个重要的概念。
通过研究晶体结构,可以了解晶体的组成和排列方式,以及晶体对物质性质的影响。
晶体结构(无机材料科学)
a 2 2R
V a 3 16 2 R 3
V球 V晶胞
4 4 R 3 3 100% 74.05% 3 16 2 R
16
名 称 六方密 堆积 立方密 堆积
堆积方式
配位 数 12
密排面 ∥
空 隙
堆积 系数 0.74
ABAB……
四面体空隙 (0001) 八面体空隙
4
六方最紧密堆积
ABABAB……
每两层重复一次
A B A B A
5
六方晶胞——六方密堆积
A A B B A A
6
密 排 面
※ 六方最紧密堆积的排列层序是:AB AB AB... ... 将这些球的球心联结起来,便形成六方原始格子,即在这 种堆积中可找出六方晶胞,故称为六方最紧密堆积。其 最紧密排列层平行于{0001}面网。
B
B
14
即:每个球的周围共有六个八面体空隙及八个四面体空隙。 属于一个球的空隙数为: 6×1/6=1个八面体空隙;8×1/4=2个四面体空隙。 ※ 若有n个等径球体作密堆积,则必有n个八面体空隙和 2n个四面体空隙。(六方和立方密堆相同)
※ 六方和立方密堆积的空间 利用率都是74.05%(称为堆 积系数);空隙占整个空间 的25.95%。
通常只考虑正离子对负离子的极化作用。但当正离子外层 为18电子构型时,如Cu+ 、Ag+ 、Zn2+ 等,极化率也比较大, 需考虑负离子对它们的极化作用。
③极化的结果:由于极化,电子云相互穿插,使正、负 离子间距离缩短,从而降低了配位数,晶体的结构类 型发生变化及质点间的化学键由离子键向共价键过渡 (键能、晶格能增大,键长缩短)。
无机化学 晶体结构

我们研究的晶体含有各种原子、分子, 它们按某种规律排列成基本结构单元, 我们可按结构基元抽象为点阵点。
3-2 晶 胞
1. 晶胞基本特征
晶体中最有代表性的重复单位。 晶胞有二个要素:一是晶胞的大小、型式,另 一是晶胞的内容。晶胞的大小、型式由a、b、 c三个晶轴及它们间的夹角α.β.γ所确定。晶胞 的内容由组成晶胞的原子或分子及它们在晶胞 中的位置所决定。
3-5 原子晶体和分子晶体 1、分子晶体 、
特点:分子间的作用力为范德华力。硬度小,熔 沸点低等。
2、原子晶体 、
特点:
原子和原子之间的结合力是共价键。硬度大,不到电。 原子和原子之间的结合力是共价键。硬度大,不到电。 属于原子晶体的物质有: 属于原子晶体的物质有: 单质Si 单质硼、 单质Si , 单质硼、 SiC, SiO2 , BN, B4C , AlN
离子半径的变化规律
1.同主族 从上到下 电子层增加 具有相同电荷数的离子 同主族, 从上到下, 电子层增加, 同主族 半径增加. 半径增加 2.同周期 主族元素 从左至右 离子电荷数升高 最高价离 同周期: 离子电荷数升高, 同周期 主族元素, 半径减小. 子, 半径减小 3.同一元素 不同价态的离子 正电荷高的半径小。 同一元素, 同一元素 不同价态的离子, 正电荷高的半径小。 4.一般负离子半径较大 正离子半径较小 一般负离子半径较大; 一般负离子半径较大 5.周期表对角线上 左上元素和右下元素的离子半径相似 周期表对角线上, 周期表对角线上 左上元素和右下元素的离子半径相似. 的半径相似. 如: Li+ 和 Mg2+, Sc3+ 和 Zr4+ 的半径相似 6. 镧系元素离子半径,随原子序数增加,缓慢减小 镧系元素离子半径,随原子序数增加,
第一章晶体结构(四晶体的结构与性质--无机化合物结构)

纤锌矿型结构的晶体,如ZnS、CdS、GaAs等和 其它II与IV族,III与V族化合物,制成半导体器件,可 以用来放大超声波。这样的半导体材料具有声电效应。 通过半导体进行声电相互转换的现象称为声电效应。
二、AX2型结构
AX2型结构主要有萤石(CaF2,fluorite)型,金红石 (TiO2,rutile)型和方石英(SiO2,-cristobalite)型结构。 其中CaF2为激光基质材料,在玻璃工业中常作为助熔剂和晶 核剂,在水泥工业中常用作矿化剂。TiO2为集成光学棱镜材 料,SiO2为光学材料和压电材料。AX2型结构中还有一种层 型的CdI2和CdCl2型结构,这种材料可作固体润滑剂。AX2 型晶体也具有按r+/r-选取结构类型的倾向,见表1-7。
(a)晶胞结构图
(b)(001)面上的投影图
图1-20 金红石(TiO2)型结构
TiO2除金红石型结构之外,还有板钛矿和锐钛矿两 种变体,其结构各不相同。常见金红石结构的氧化物有 SnO2,MnO2,CeO2,PbO2,VO2,NbO2等。TiO2在光 学性质上具有很高的折射率(2.76),在电学性质上具 有高的介电系数。因此,TiO2成为制备光学玻璃的原料, 也是无线电陶瓷中常用的晶相。
结构中O2-离子作变形的六方最紧密堆积,Ti4+离子在晶胞顶点及 体心位置,O2-离子在晶胞上下底面的面对角线方向各有2个,在晶胞 半高的另一个面对角线方向也有2个。
Ti4+离子的配位数是6,形成[TiO6]八面体。O2-离子的配位数是3, 形成[OTi3]平面三角单元。Ti4+填充八面体空隙的1/2。晶胞中TiO2的 分子数为2。整个结构可以看作是由2套Ti4+的简单四方格子和4套O2的简单四方格子相互穿插而成。
无机材料科学基础 第二章 晶体结构

(Fe,Mg)2SiO4
Tetrahedron facing up
Ca2MgSi2O7
岛状硅氧骨干
环状骨干
三元环
四元环
六元环
链状骨干
单链
双链
层状结构
Al2[Si4O10](OH)2
Al4[Si4O10](OH)8
架状结构
[SiO2]n
K[AlSi3O8]
石英架状
长石架状硅氧骨干
(Fe,Mg)2SiO4
第二章 晶体结构
第一章内容回顾:晶体外形的几何特征—对称性;晶体 内部质点规则排列的物理原因。 X射线衍射的应用:1912年 可以直接测量晶体内部 结与利用其他方法所测得的性能 结合使研究晶体结构与性能之间 相互关系成为可能。 第二章内容: 介绍常见的晶体结构,初步揭 示结构与性能的基本关系。
描述晶体结构的三种方法:
一、金刚石结构
典型结构类型
晶体结构为立方晶系 Fd3m, a0= 0.356nm
7 75 0 25
25
75
晶胞图
(001)面投影图
多面体图
每个碳周围都有4个碳,碳原子之间形成共价键。
金刚石结构与性能间关系
C原子以sp3杂化共价键结合 具有很高的硬度 具有半导体性 具有高的热导率
共价键结合(结构) C原子很轻 (组成)
如何写出质点在晶胞中的坐标
先在直角坐标系中投影
根据三个投影写出坐标 检查坐标与投影之间的一直形成[ZnS₄] 四面体。S2-的配位数也是4。
结构中 S2- 作六方密堆积, Zn2+填入1/2的四面空隙中。
Zn
2/3
S
结构中Z=2
1/3
六方ZnS(纤锌矿)型结构
