日立l-8900氨基酸自动分析仪原理
氨基酸分析仪原理、分类及几种氨基酸分析仪的比较-科邦实验室

氨基酸分析仪原理、分类及几种氨基酸分析仪的比较概述氨基酸分析仪是一种分析仪器,采用经典的阳离子交换色谱分离、茚三酮柱后衍生法,对蛋白质水解液及各种游离氨基酸的组分含量进行分析。
工作原理通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸锂进行梯度洗脱。
其中钠盐系统一次最多分析约25种氨基酸,速度较快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,基线一般不如钠盐系统好。
应用全自动氨基酸分析仪主要应用:各种物质中18种氨基酸的定性定量分析。
1.饲料上的应用:质量控制:各种饲料必需氨基酸的含量和它们之间的比例必须恰当,测定原料和产品中的氨基酸含量,以达到保证质量的目的。
真伪鉴别:鱼粉氨基酸组成特点是赖氨酸、蛋氨酸含量高,氨基酸分析结果很容易就可以区别它的真伪。
2.农业、食品、饮料及玉米、大豆、小麦等农作物的氨基酸含量进行检测;对果汁、饮料进行真伪的鉴别;检验测定茶氨酸来鉴别真伪茶叶;对酱油级别的认定。
分类氨基酸分析仪按其分离和检测方法的不同可分为两大类型。
第一类是基于阳离子交换柱分离、柱后茚三酮衍生光度法测定的经典方法(IEC)。
此类方法于1972年获诺贝尔奖,是当今国际标准和国家标准以及仲裁和涉外的方法。
第二类是所有基于反相色谱分离、柱前衍生、荧光或紫外检测的高效液相法(HPLC)以及阴离子交换分离直接安培法检测的离子色谱法(IC)。
选型指南1、原理。
基于阳离子交换柱分离、柱后茚三酮衍生、光度法测定的离子交换色谱法(IEC)。
此类方法由Stein和Moore两人1958年发明,并于1972年获诺贝尔奖,是当今国际标准和国家标准以及仲裁和涉外的方法。
2、重要指标。
满足分析需要的技术指标如分离度、重复性等要求,而其中的分离度又是更为重要的指标,因为,色谱理论一般以分离度达到1.2作为两峰基本分离的判定前提,只有峰分开了,才有意义去讨论定性和定量的重复性。
日立L-8900全自动氨基酸分析仪简易标准操作规程

日立L-8900全自动氨基酸分析仪标准操作规程一. 目的为规范日立L-8900全自动氨基酸分析仪的基本操作、维护保养、异常处理程序,防止人为操作失误,确保氨基酸分析仪正常运转,特制定本程序。
二.适用范围本程序适用于日立L-8900全自动氨基酸分析仪。
三.责任1. 本程序的实施者为氨基酸分析仪操作者,各实验室负责人对本程序的实施情况进行监督。
2. 日常运行及维护、定期维护、定期点检及保养由氨基酸分析仪操作者负责。
四. 内容1.联机(1)打开电脑。
(2)打开L-8900主机电源。
(3)双击桌面的图标,进入1-1画面,双击图标,进入程序。
1-1(4)在菜单栏中依次点击和,出现1-2画面,单击联机。
大约两分钟,初始化完毕。
中Uninitialized变成Idle,图1-2变成了图1-3,各个组件可以进行控制了。
初始化完毕后,分离柱的温度逐渐上升,分离柱的温度会升到50℃。
如果打开反应柱的柱温控制,则温度大约20分钟升到135℃。
1-21-32、手动各组件控制操作(1)泵1和泵2点击,出现2-1的画面。
设置泵1,流量0.1ml/分钟,B6 100%。
点击打开泵1。
泵打开后,泵的背景颜色由灰色变为黄色。
2-1点击,出现2-2的画面,设置泵2,流量0.1ml/分钟,R3 100%。
点击打开泵2。
泵打开后,泵的背景颜色由灰色变为黄色。
2-2(2)自动进样器点击,出现2-3的画面,设置Sampler Wash不少于3次。
2-3(3)分离柱柱温箱点击,出现2-4画面,设置柱温50℃,设置ON,打开柱温箱。
柱温箱打开后,背景颜色由灰色变为黄色。
2-4(4)反应柱柱温箱点击,出现2-5画面,设置柱温135℃,设置ON,打开柱温箱。
柱温箱打开后,背景颜色由灰色变为黄色。
2-5(5)钨灯点击,出现2-6画面,设置ON,打开钨灯。
钨灯打开后,背景颜色由灰色变为黄色。
2-63、编辑方法(1)Stand By 程序(a)依次点击、、出现3-1-1的画面。
日立l-8900全自动氨基酸分析仪简易标准操作规程

日立L-8900全自动氨基酸分析仪标准操作规程一. 目的为标准日立L-8900全自动氨基酸分析仪的根本操作、维护保养、异常处理程序,防止人为操作失误,确保氨基酸分析仪正常运转,特制定本程序。
二. 适用范围本程序适用于日立L-8900全自动氨基酸分析仪。
三.责任1. 本程序的实施者为氨基酸分析仪操作者,各实验室负责人对本程序的实施情况进展监督。
2. 日常运行及维护、定期维护、定期点检及保养由氨基酸分析仪操作者负责。
四. 内容1.联机〔1〕翻开电脑。
〔2〕翻开L-8900主机电源。
〔3〕双击桌面的图标,进入1-1画面,双击图标,进入程序。
1-1〔4〕在菜单栏中依次点击和,出现1-2画面,单击联机。
大约两分钟,初始化完毕。
中Uninitialized变成Idle,图1-2变成了图1-3,各个组件可以进展控制了。
初始化完毕后,别离柱的温度逐渐上升,别离柱的温度会升到50℃。
如果翻开反响柱的柱温控制,则温度大约20分钟升到135℃。
1-21-32、手动各组件控制操作〔1〕泵1和泵2点击,出现2-1的画面。
设置泵1,流量0.1ml/分钟,B6 100%。
点击翻开泵1。
泵翻开后,泵的背景颜色由灰色变为黄色。
2-1点击,出现2-2的画面,设置泵2,流量0.1ml/分钟,R3 100%。
点击翻开泵2。
泵翻开后,泵的背景颜色由灰色变为黄色。
2-2〔2〕自动进样器点击,出现2-3的画面,设置Sampler Wash不少于3次。
2-3〔3〕别离柱柱温箱点击,出现2-4画面,设置柱温50℃,设置ON,翻开柱温箱。
柱温箱翻开后,背景颜色由灰色变为黄色。
2-4〔4〕反响柱柱温箱点击,出现2-5画面,设置柱温135℃,设置ON,翻开柱温箱。
柱温箱翻开后,背景颜色由灰色变为黄色。
2-5〔5〕钨灯点击,出现2-6画面,设置ON,翻开钨灯。
钨灯翻开后,背景颜色由灰色变为黄色。
2-63、编辑方法〔1〕Stand By 程序〔a〕依次点击、、出现3-1-1的画面。
氨基酸自动分析仪

1、3 衍生及检测
衍生方式:
1、柱前衍生法: 将AA混合物先衍生后,在用反相 分配 色谱法分离,测定其紫外吸收或产生的 荧光强度。
2、柱后衍生法: 将AA混合物用离子交换色谱法分离,在 把分离后的氨基酸衍生为具有可见吸收 或产生荧光的物质,然后测定。
1、3 衍生及检测
常用的衍生方法:
(1)茚三酮法
1.1 离子交换树脂
1.填料:磺酸型强酸阳离子交换树脂 2.苯乙烯为主体; 3.离子交换的活性基团:磺酸根(连
接在苯乙烯中乙烯基的对位上); 4.与二乙烯基苯交联,形成不溶的高
分子骨架,易吸水溶解。 5.交联剂所占比例决定网状结构的孔
径大小(氨基酸:8%~12%的交联 度)。
6.Na+型(蛋白质水解液中的氨 基酸分析),Li+型(全部氨 基酸的分析)
OPA法,分离柱流出液与NaClO混合,再 与OPA混合,生成荧光衍生物,采用荧光 光度计分析测定。
第二节 氨基酸分析仪的结构 性能
(3)程序控制系统
(4)数据处理系统及其他辅助 系统
常见的仪器的主要性能:见表38-4 (p183)
第三节 试样的前处理方法
3、1 上机分析试样液的要求
试液澄清透明无可见杂质,放置或离心不产生 沉淀;
7、考虑磺化程度、交联剂纯度 和类型、粒度大小 (5~10um)。
1.2 氨基酸在色谱柱中的分离
XO3-Na+ + H3N+—CHRCOOH
PH减小 PH增大
XSO3-H3N+—CHRCOOH + Na+
PH小于氨基酸的等电点时,氨基酸带正电荷,可被 磺酸基团吸引,随着PH升高或离子强度增大,氨基 酸所带正电荷减少,吸引力下降乃至消失而被洗脱 下来。
氨基酸分析原理与方法

4.提高流动相PH值,氨基酸正电荷减少,吸附力减弱,最后从离子交换柱 上洗脱下来。洗脱顺序是酸性和带羟基氨基酸、中性氨基酸、碱性氨基 酸。
5.氨基酸标准液中各种氨基酸在氨基酸自动分析仪上被洗脱的顺序有一定; 标准液各种氨基酸的浓度一定,洗脱峰的面积一定;由此可计算出样品中
• 生理体液样品首先要除去样品中的蛋白质,获得游离 氨基酸。除去蛋白质化学方法为:
• 1.苦味酸法 • 2.三氯醋酸法 • 3.磺基水杨酸法 • 4.乙醇沉淀法 • 常用方法为磺基水杨酸法:用4%磺基水杨酸,按1:3比
例与样品混合离心去蛋白,转速2万转以上离心10分钟 或更长一些时间。取上清液用样品稀释液稀释后上机 测定。(建议进样前用C18过滤柱处理一下为好)。
• 山东大学生命科学院发表的《低智儿童与正常儿童中氨 基酸的比较研究》一文着重叙述了血清中11种氨基酸的降 低可直接影响人体组织的正常发育、生长,从而导致儿童 智力发育不全。
• 军事医科院《条件性必需氨基酸在创伤愈合中的作用》 一文中叙述了条件性必需氨基酸在创伤愈合中的关系。
• 北京军区总医院《人胃癌组织及胃正常组织氨基酸的差 异研究》一文中通过对胃癌组织及自身胃正常组织氨基酸 的测定,探讨了肿瘤组织氨基酸代谢的变化规律。
LL--88880000氨氨基基酸酸分分析析仪仪 成成都都交交流流讲讲座座
吕守民 天美科技有限公司
目录
• 一、氨基酸分析仪 • 二、氨基酸 • 三、氨基酸分析仪基本分析原理 • 四、氨基酸分析仪法与HPLC的比较 • 五、样品的制备 • 六、应用
日立L-8800氨基酸分析仪简介
一、氨基酸分析仪: (一)氨基酸分析仪的构成(见图1) (二)氨基酸分析仪的流程图(见图2)
日立-8900全自动氨基酸分析仪简单操作规程
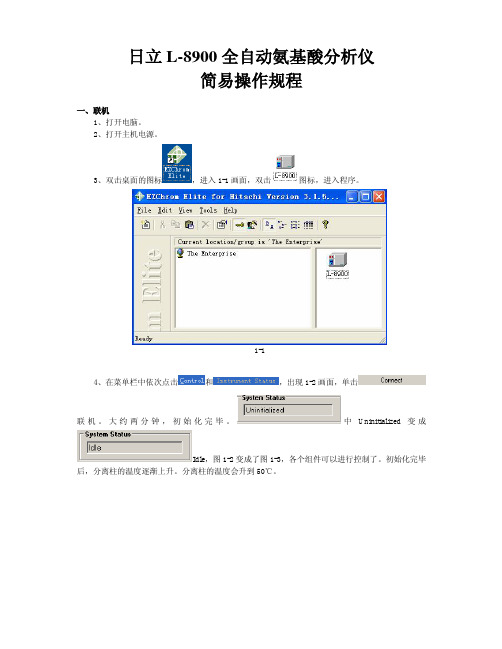
日立L-8900全自动氨基酸分析仪简易操作规程一、联机1、打开电脑。
2、打开主机电源。
3、双击桌面的图标,进入1-1画面,双击图标,进入程序。
1-14、在菜单栏中依次点击和,出现1-2画面,单击联机。
大约两分钟,初始化完毕。
中Uninitialized变成Idle,图1-2变成了图1-3,各个组件可以进行控制了。
初始化完毕后,分离柱的温度逐渐上升。
分离柱的温度会升到50℃。
1-21-3二、手动各组件控制操作1、泵1和泵 2点击,出现2-1的画面。
设置泵1,流量0.ml/min,B1 100%。
点击打开泵1。
泵打开后,泵的背景颜色由灰色变为黄色。
2-1点击,出现2-2的画面,设置泵2,流量0.1ml/分钟,R3 100%。
点击打开泵2。
泵打开后,泵的背景颜色由灰色变为黄色。
2-22、自动进样器点击,出现2-3的画面,设置Sampler Wash不少于3次。
2-32-43、反应柱柱温箱点击,出现2-5画面,设置柱温135℃,设置ON,打开柱温箱。
柱温箱打开后,背景颜色由灰色变为黄色。
2-52-6三、编辑方法1、依次点击、、出现3-1-1的画面。
3-1-12、选中,点击。
再依次点击、,出现3-1-2的画面。
3-1-23、在设置中选中各个柱,其余参数默认。
4、将方法另存为L8900分析方法,文件名及路径均可自选。
注意一定不要覆盖原来的方法,一定得另存。
注意将梯度设为3-3-1所示,其余参数默认。
3-3-12、保存方法。
四、编辑Sequence1、依次点击、、,出现4-1画面。
选中,其余参数默认。
4-12、点击,出现4-2画面,根据需要填写各个参数。
4-23、点击,出现4-3画面,根据需要填写各个参数。
4-34、点击,出现4-4画面,根据需要填写各个参数。
4-45、点击,出现4-5画面。
4-56、通过复制、编辑,最终将Sequence编辑如图4-6所示。
注意此时第一行是再生程序(RG),进样体积为0,Run Type是Unknown,第二行是标准样品,三行起是未知样。
氨 基 酸 自 动 分 析 仪 简 介

氨基酸自动分析仪氨基酸是蛋白质的组成成分,是蛋白质化学研究的主要内容之一。
蛋白质是一切生命物质的基础,因此,探讨和揭示生命现象的发生、生长、新陈代谢、遗传变异过程,都与氨基酸的研究有关。
随着近代物理学、化学和电子学的飞速发展,氨基酸的分析技术亦在不断更新。
氨基酸分析仪是本世纪50年代研制的,仅40多年,已发展到现在的进样、分离、检测和数据处理全部自动化的程度。
检出量由微克分子到毫微克分子,分析时间由原来的24小时到现在的半个小时,分析技术的提高促进了其他科学领域的发展。
一、氨基酸自动分析仪的进展用于氨基酸分析的方法很多,有纸色谱法、柱色谱法、薄层色谱法、电泳法及气相色谱法等。
一般认为离子交换柱色谱法是较为精确的检测方法,氨基酸分析仪就是在此基础上研制成功的。
1951年Moor和Stein采用离子交换树脂色谱,用茚三酮试剂显色和分光光度计检测而设计,后来在Spaekman的协助下,使分析操作自动化。
迄今氨基酸分析仪的条件和自动程度有了很大的改观,其特点主要表现以下几个方面。
⒈树脂粒径减小近年来制成的小颗粒球状树脂,使氨基酸分析仪得到很大改进。
由于树脂粒径减小就对应地增加等量树脂的总面积,使现在少量树脂达到过去大量树脂的分离效果,从而减小了树脂柱的内径和体积,节省了试剂用量,缩短了分析时间。
树脂的粒径从200→20→10→5µm。
⒉色谱柱内径缩小树脂粒径减小使填充树脂床的色谱柱内径减小,由过去的粗长柱变为微柱。
色谱柱内径的变化为18→6→2.8→1.75mm。
⒊输压泵压力增高一般氨基酸分析仪采用低压泵,其施加于输液的压力只有几9.80665×104Pa,以后增加至几十9.80665×104Pa,现在发展到2068×104Pa。
⒋分析时间缩短由于树脂粒径的改善,色谱柱内径缩小和泵压增高,使分析时间大大缩短。
蛋白质水解液的分析时间从过去的24小时缩短到现在的半个小时左右。
氨基酸分析仪培训讲义

6、开放的试剂
试剂配方公开、可自行配制不需冷 藏保存。
氨基酸
二、氨基酸 (一)氨基酸的定义 (二)氨基酸的分类 (三)氨基酸的化学性质
二、氨基酸
自然界中的氨基酸种类很多,但组成蛋 白质的氨基酸只有20多种,从结构式上来 看组成蛋白质的氨基酸除甘氨酸以外,都 有一个不对称碳原子、即a-碳原子,a-碳 原子有四个不同的取代基:COOH羧基、NH2 氨基、H氢原子、和R基团,不同氨基酸的R 基团不同。氨基酸的R基团又称为侧链,由 于不同氨基酸的侧链不同它们的分子量、 解离程度和化学反应、性能均不同。除甘 氨酸外每种氨基酸都有L-构型、D-构型。 蛋白质中的氨基酸都是L-型的,从形状
下面将日立氨基酸分析仪的构成、流程图 及特点给大家介绍如下: (一)氨基酸分析仪的构成
1、输液单元(泵与管路) 作用:输送缓冲液、反应液在流路系统 中流动。
2、进样单元(自动进样器) 作用:将样品在流动相的带动下送入仪 器体系中。
3、分离单元(离子交换柱、柱温箱)
作用:主要是样品的分离、将混合的样 品分离成单一组分。
通讯接口、电源连接器、氮气源连接器。
(二)氨基酸分析仪流程图 见图(2)
(三)日立氨基酸分析仪特点 1、优异的性能 (1)高灵敏度:以蛋白水解液标准
为例可检测到3pmol,是灵敏度最高的仪 器之一。
(2)快速、高分辨率:日立氨基酸 分析仪,目前在各种氨基酸分析仪中分 析时间是最短的,水解氨基酸分析时间 只有30分钟。能在短短的30分钟之内将 18种氨基酸分离开来、关键在于采用了 最新的日立专用3um阳离子交换树脂填充 的高分辨率的分析柱,同等条件下对于 填充柱来讲,填充微粒越细的树脂
其理论塔板数越高,其分离效果也越好, 而且此种填充柱还可以在高流速下进行 工作,大大提高了分辨率和工作效率。
氨基酸分析仪培训讲义
基团不同。
每种氨基酸有D-构型和L-构型,蛋白
质中的氨基酸都是L-构型。
(一)氨基酸的定义
(略)
(二)氨基酸的分类
它的分类有两种: 1.按氨基酸具有的酸性和碱性基团的多 少分类: 中性氨基酸:甘氨酸、丙氨酸、缬氨酸、 亮氨酸、异亮氨酸、苏氨酸、丝氨酸(以 上七种又称脂肪族氨基酸)、苯丙氨酸、 酪氨酸、色氨酸(这三种又称芳香族氨基 酸)、蛋氨酸、胱氨酸、半胱氨酸(含硫 氨基酸)、脯氨酸、
状态 的衍生反应。而别的公司大多采用 反应圈技术,在传统的反应圈中样品带 在分离时容易扩散、引起重叠效应,液 体在反应圈中流动时中间部位快、两边 慢,从而引起样品带的加宽,反应后会 产生峰重叠。而通过在反应柱中填充的 小颗粒,流动相移动平缓、流动均匀, 无样品带加宽现象,峰显高斯分布,更 不会产生峰重叠。
2、离子进一步扩散到交换位置以致进入树 脂内部交换位置。这决定于树脂的交联 度和溶液的浓度,这个过程是整个离子 交换反应的关键。
3、在交换位置上进行离子交换,这个平衡 是瞬间的。被交换的离子带的电荷越多, 它与树脂的结合越紧密,被其它离子取 代就越困难。
4、被交换的离子通过树脂扩散到表面。
5、用洗脱液洗脱,被交换的离子扩散到
快速反馈给cpu、并发出指令使步进电机 加快运转、消除脉动,反之当系统压力 升高时则电机减慢运行。
(5)高效的光学系统:日立氨基酸分 析仪,分光光度计采用了高能量卤素灯、 高效的光学系统。光谱为:消象差凹面 衍射光栅,这种光直接入射到光栅的高 效单色器系统,即使在很小的空间也能 造就优异的光路、这种光栅同时还能聚 光及消除象差、仪器长时间工作测定时 也非常稳定。
6、开放的试剂
试剂配方公开、可自行配制不需冷 藏保存。
氨基酸分析仪培训讲义

日立氨基酸分析仪 采用双柱塞串联往 复泵,此种泵采用了高速反馈实时控制 技术,最大的优点是脉动小、流速稳定、 噪音低,所采用的这种泵它可保证所供 液体流量恒定、流速稳定。流量是否恒 定关系到峰的重复性、分辨率和定量的 准确。流速如果不稳定会产生脉动,它 可导致检测器噪音增大、最小检测量增 加灵敏度下降。实时控制技术系统采用 了一个高速传感器,对内部压力进行实 时监控,在柱塞换向的时间区段内、系 统压力有所下降趋势时
大家好!
日立氨基酸分析仪 培训讲义
天美科技有限公司
目录
一、氨基酸分析仪简介 二、氨基酸 三、氨基酸分析仪基本分析原理 四、氨基酸分析仪法与HPLC的比较 五、样品的制备 六、影响氨基酸分析的各种因素 七、应用
日立氨基酸分析仪简介
一、氨基酸分析仪: (一)氨基酸分析仪的构成(见图1) (二)氨基酸分析仪的流程图(见图2) (三)特点
2、独特的设计 不需要额外的空间,只要打开前门就
可以进行缓冲液、反应液和分离柱的更换、废 液的处理及进行仪器的日常维护保养。
3、独到的柱后衍生技术(实时混合) 日立氨基酸分析仪,反应试剂是在与
氨基酸反应前才将两种反应液R1、R2进行实时 混合,有效的延长了反应液的使用期限、且不 需要额外的制冷装置存放。
4、专利的氨气排除系统
-
日立氨基酸分析仪,采用了日立公司专用的 2650阳离子树脂对氨进行排除。在泵后、进样器 前连接了日立专用的除氨柱,它能很好的排除氨 的存在对于分析过程中对基线及峰形的干扰。
5、氮气保护气
日立氨基酸分析仪,系统内使用氮气保护器对 缓冲液进行隔离、对反应液进行保护、可防止氧 化延长反应液的使用时间、以及避免由于氧气进 入缓冲液影响个别氨基酸的分析结果。
日立L_8800氨基酸分析仪的工作原理与常见故障维修_胡亮

较松动 。拆下排放阀 , 发现排放阀的密封圈已破损 。因
无备件 , 就用薄橡胶片自制了一个 O 型密封圈装上
后 , 泵 1 、泵 2 压力稳定正常 。
故障 4 样品分析结果 , 基线来回跳动 , 波峰不稳 。检
查泵 1 、泵 2 工作压力和流量均正常稳定 , 排除了泵的
[ 中图分类号] T H 776
[ 文献标识码] C
[ 文章编号] 1007 -7510(2003)09 -0070 -01
The work pr inci ple and routi ne main tenance of L -8800 HITACHI amin oacid anal yzer
H U L iang , F EN G Jin -y i
般为管路内被堵引起的 , 而泵 1 、 泵 2 的压力同时过 高 , 故障很可能发生在二者的公共管路通道上 。拆开
工作原理与常见故障分析及处理 。 1 工作原理 该仪器采用柱后茚三酮法来测定样品 中的各种氨基酸含量 。即经过前处理的体液标本从自 动进样器进入保护柱进行预分离 , 然后再进入分离柱
反应柱与混合器的接头 , 此时泵 1 , 泵 2 的工作压力迅 速 下 降 为 正常 值 (泵 1 为 5 .1kg f/ cm 2, 泵 2 为 0.03kg f /cm 2)。 说明反应柱前管路正常 , 故障发生在 反应柱及其以后的通道上 。 拆开反应柱 , 发现其与混
漏液处 , 排放阀也已关紧 , 但在关闭排放阀时 , 感觉比
R1:茚三酮溶液 R2 :茚三酮溶液的缓冲液
R 3 :水
B 1~ B 5:是 PH 值不同的试剂
不同种类啤酒中氨基酸含量的分析

不同种类啤酒中氨基酸含量的分析[摘要]本论文是以啤酒为研究对象,探索不同种类啤酒中氨基酸的含量。
本实验先对啤酒进行预处理,之后对预处理后的样品进行研究。
啤酒中的氨基酸含量通过日立L-8900氨基酸全自动分析仪测定,该仪器灵敏、快速、提供数据准确可靠、分辨率高、操作简单、分析周期短。
通过一系列实验之后,得出精酿啤酒比市售啤酒的总游离氨基酸含量高,且精酿啤酒与市售啤酒中的脯氨酸含量均为最高;而且精酿啤酒相较于市售啤酒口感更佳;两种啤酒中部分必需氨基酸高于FAO/WHO理想氨基酸构成比例,而部分则低于FAO/WHO理想氨基酸构成比例。
[关键词]啤酒;氨基酸分析仪;游离态氨基酸第一章绪论啤酒主要由是麦芽、啤酒花、水等原料组成。
它是继饮用水和茶之后人类饮用的第三大饮料[1]。
啤酒约含有17种氨基酸,其中7种是必不可少的,不是人体合成且必不可少的氨基酸。
啤酒中的氨基酸有两种形式:1.以蛋白质或蛋白质的形式存在2.存在于溶解状态的啤酒中。
啤酒中的游离氨基酸含量越高,越接近人体蛋白质的氨基酸组成,消化吸收时人体的营养价值越高。
课题旨在通过对不同种类啤酒游离氨基酸含量的测定,确定啤酒中含有氨基酸,并比较精酿啤酒与市售啤酒中游离氨基酸不同,为了获得更高含量的啤酒中的游离氨基酸。
“工业啤酒”:当麦芽汁和啤酒花煮沸至10°C以下时,添加制作Lager型啤酒的酵母,但添加后,它会下沉至麦芽汁的最低端。
发酵罐也较大,可实现批量生产,发酵时间短,一般为7天,以控制时间成本。
过滤和母线灭菌将在发酵后进行,以延长啤酒的保质期。
“精酿啤酒”:当将麦芽汁和啤酒花煮沸并冷却至15℃时,加入制造Ale型啤酒的酵母。
添加后,将在麦芽汁顶部开始发酵,发酵时间更长,一般需要2个月左右。
为了确保啤酒的原始风味和味道,通常在发酵后不进行过滤和灭菌。
1.1啤酒的营养价值⑴啤酒含有多种氨基酸:啤酒约有十多种氨基酸,其中,光我们人体必需吸收的氨基酸就有7种,仅缺色氨酸这一种。
氨基酸自动分析仪简介

氨基酸自动分析仪氨基酸是蛋白质的组成成份,是蛋白质化学研究的要紧内容之一。
蛋白质是一切生命物质的基础,因此,探讨和揭露生命现象的发生、生长、新陈代谢、遗传变异进程,都与氨基酸的研究有关。
随着近代物理学、化学和电子学的飞速进展,氨基酸的分析技术亦在不断更新。
氨基酸分析仪是本世纪50年代研制的,仅40连年,已进展到此刻的进样、分离、检测和数据处置全数自动化的程度。
检出量由微克分子到毫微克分子,分析时刻由原先的24小时到此刻的半个小时,分析技术的提高增进了其他科学领域的进展。
一、氨基酸自动分析仪的进展用于氨基酸分析的方式很多,有纸色谱法、柱色谱法、薄层色谱法、电泳法及气相色谱法等。
一样以为离子互换柱色谱法是较为精准的检测方式,氨基酸分析仪确实是在此基础上研制成功的。
1951年Moor和Stein采纳离子互换树脂色谱,用茚三酮试剂显色和分光光度计检测而设计,后来在Spaekman的协助下,使分析操作自动化。
迄今氨基酸分析仪的条件和自动程度有了专门大的改观,其特点要紧表现以下几个方面。
⒈树脂粒径减小最近几年来制成的小颗粒球状树脂,使氨基酸分析仪取得专门大改良。
由于树脂粒径减小就对应地增加等量树脂的总面积,使此刻少量树脂达到过去大量树脂的分离成效,从而减小了树脂柱的内径和体积,节省了试剂用量,缩短了分析时刻。
树脂的粒径从200→20→10→5µm。
⒉色谱柱内径缩小树脂粒径减小使填充树脂床的色谱柱内径减小,由过去的粗长柱变成微柱。
色谱柱内径的转变为18→6→→。
⒊输压泵压力增高一样氨基酸分析仪采纳低压泵,其施加于输液的压力只有几×104Pa,以后增加至几十×104Pa,此刻进展到2068×104Pa。
⒋分析时刻缩短由于树脂粒径的改善,色谱柱内径缩小和泵压增高,使分析时刻大大缩短。
蛋白质水解液的分析时刻从过去的24小时缩短到此刻的半个小时左右。
⒌仪器灵敏度提高由于仪器的不断改良,使灵敏度大为提高,过去仪器的最高灵敏度已远不及此刻仪器的最低灵敏度。
水产品一般成分的检测—氨基酸的测定

水产品氨基酸态氮的测定 ——酸度计法
目录页
概述 原理 试剂与仪器 分析步骤 注意事项
一、概述
水产品中含有丰富的蛋白质,在食品加工 的过程中蛋白质会分解成多种氨基酸,这些氨 基酸可让食品呈现出独有的“鲜味”。
氨基酸态氮是指以氨基酸形式存在的氮元 素的含量,可以间接反映产品中氨基酸的多少, 是衡量产品鲜味和品质的特征性指标。
3. 混合氨基酸标准工作液和样品测定液分别以相同体积注入氨基酸 分析仪,以外标法通过峰面积计算样品测定液中氨基酸的浓度。
结果的计算 样品测定液氨基酸的含量按下式计算:
式中:
Ci——样品测定液氨基酸i的含量,单位为nmol/ml ; Ai——样测定液氨基酸i的峰面积; As —— 氨基酸标准工作液氨基酸s的峰面积; Cs —— 氨基酸标准工作液氨基酸s的含量,单位为nmol/ml ;
含水量较低或固态样品
样品搅拌均匀后,放入研钵中,在10min内迅速研磨至无肉眼可见颗粒, 装入磨口瓶中备用。用已知重量的称量瓶称取搅拌均匀的样品5.0g,用 50mL80℃左右的蒸馏水分数次洗入100mL烧杯中,冷却后,转入100mL容量 瓶中,用少量水分次洗涤烧杯,洗液并入容量瓶中,并加水至刻度,混匀后过滤。
混合氨基酸工作液色谱图
vis1 检测波长570nm时
vis1 检测波长440nm时
五、注意事项
本方法适用于食品中酸水解氨基酸的测定,包括天冬氨酸、 苏氨酸、丝氨酸等共16种氨基酸。也就是说20种氨基酸中不能测 谷氨酰胺、天冬酰胺、色氨酸和半胱氨酸。
脯氨酸在波长440 nm测定,其余氨基酸在570 nm波长下测定。 实验中注意控制氮气压力:仪器需要的压力一般为0.05-
日立L-8900高速全自动氨基酸分析仪测定食品中牛磺酸

1.1 仪器与试剂 氨基酸自动分析仪:日立835-50型高效氨基酸自
动分析仪,连有自动数据处理机和记录仪、自动进样 装置、梯度洗脱系统等;电热恒温干燥箱;牛磺酸标 准溶液,500 mg/mL;盐酸,6 mol/L;茚三酮显色剂: 将26.67 g茚三酮溶于1000 mL乙二醇甲醚中,加入 333.33 mL醋酸缓冲液,再加入2.3 mL三氯化钛,低温 保存。 1.2 色谱条件
表5 样品测试分析结果
2.2 仪器精密度 配制牛磺酸标准溶液10 mg/L,连续进样6次,由
表2可知,峰面积相对标准偏差为0.27%。
Table 5 Results of analysis of sample
样品名称
牛磺酸含量/(10-2 g/g)
牡蛎 1
5.42
表2 精密度实验
牡蛎 2
5.37
Table 2 The results of the precision test
分离柱:26 mm i.d.×150 mm不锈钢柱;交换树脂 型号:No.2619,日本公司生产的氨基酸分析专用树脂;
现代食品科技
Modern Food Science and Technology
2012, Vol.28, No.3
柱温:53 ℃;泵流速:0.225 mL/min;泵压力:8.8 MPa; 次独立测定结果的相对标准偏差为/g)
5.42
2
5.38
3
5.38
4
5.41
5
5.40
6
5.43
2.4 加标回收率
平均值 /(10-2 g/g)
标准偏差
RSD/%
5.40 0.0191 0.35
2 结果与讨论
酸水解—全自动氨基酸分析仪测定蜂蜜中17种氨基酸

酸水解—全自动氨基酸分析仪测定蜂蜜中17种氨基酸摘要运用酸水解法和全自动氨基酸分析技术,建立蜂蜜中氨基酸的测定方法。
17种氨基酸的线性范围为1~100 μmoL/L,线性回归系数均在0.999以上,加标回收率为88%~106%。
该方法测定了蜂蜜中的17种氨基酸,结果令人满意。
关键词蜂蜜;全自动氨基酸分析仪;酸水解;氨基酸;测定蜂蜜是蜜蜂采集花蜜酿制的,而花是植物的生殖器官,植物的精华大部分聚集于此,蜜蜂采集植物的“精华”,含有多种分解酶的唾液与其融合酿造而成的,是大自然奉献给人类的天然保健食品,味道甜蜜且营养丰富。
蜂蜜主要成分除葡萄糖和果糖外,还富含人体必需的多种氨基酸营养成分[1]。
不同产地、不同花种蜂蜜主要成分基本相同,但是其中的氨基酸含量不尽相同。
目前氨基酸的分析方法[2]主要有化学方法、荧光光谱法、电化学方法和分光光度法等。
其中荧光光谱法具有较高的灵敏度和较低的检出限,特别是全自动氨基酸分析仪[3-7](荧光检测器)分析法具有较高的灵敏度和较强的操作和分析自动化能力。
本文运用酸水解-全自动氨基酸分析仪法技术,建立了快速、简便而准确测定油菜蜜、洋槐蜜、紫云英蜜、枣花蜜等安徽省常见4种蜂蜜中17种氨基酸检测的方法,并解析天然蜂蜜中氨基酸的含量。
现将该测定方法总结如下。
1 材料与方法1.1 主要仪器与试剂仪器:日立L-8900氨基酸自动分析仪(配有荧光检测器),干燥箱,真空泵,水解管:耐压螺盖玻璃管(体积为20~30 mL)。
试剂:盐酸(优级纯),重蒸苯酚,柠檬酸钠的缓冲溶液,茚三酮溶液(二甲基亚砜150 mL+pH值5.2乙酸锂溶液50 mL+水合茚三酮4 g+还原茚三酮0.12 g)。
混合氨基酸标准溶液2.5 mmoL/mL,SIGMA。
1.2 仪器分析条件检测器类型:荧光检测器(VIS);检测波长:570、440 nm;色谱柱:离子交换柱,柱温60 ℃;进样体积:20 μL;流动相;柠檬酸缓冲液,流速0.4 mL/min;柱后反应柱的柱温:135 ℃。
氨基酸分析原理与方法

非必需氨基酸 谷氨酸
天门冬氨酸 丙氨酸 丝氨酸 脯氨酸 羟脯氨酸
• 动物的必需氨基酸除上述8种外,还有精 氨酸、组氨酸共10种。
(三)氨基酸的化学性质
• 氨基酸分子中都具有氨基和羧基,因此 它们都能产生氨基与羧基的一般反应, 如脂化、甲基化、乙酰化以及酸碱的中 和作用等。有些氨基酸由于存在其它基 团而产生特殊反应,如半胱氨酸的巯基 (-SH)
碱性氨基酸 > 芳香族氨基酸 > 中性氨基酸 > 酸性氨基酸及羟基氨基 酸
4.提高流动相PH值,氨基酸正电荷减少,吸附力减弱,最后从离子交换柱 上洗脱下来。洗脱顺序是酸性和带羟基氨基酸、中性氨基酸、碱性氨基 酸。
5.氨基酸标准液中各种氨基酸在氨基酸自动分析仪上被洗脱的顺序有一定; 标准液各种氨基酸的浓度一定,洗脱峰的面积一定;由此可计算出样品中
• DYDA在570nm处有最大吸收。 • 脯氨酸、羟脯氨酸与茚三酮反应生成黄色物
质,在440nm处吸收峰最大。 • 生除成氨有基色酸物以质外(,这如N种H反2肽应类机也理可现与应茚用三于酮我反们应使
用的氨基酸分析仪之中)。
三、氨基酸分析仪基本分析原理
• 氨基酸的分离分析方法很多,近几年来 一般认为离子交换色谱法是比较准确的 定量方法。氨基酸分析仪就是以此为基 础研制出来的。近几年越来越多的日立 L-8800型氨基酸分析仪被引进到各行各 业之中,为我们科学研究及检测提供了 现代化的手段。
OPA是快速反应剂,有些氨基酸反应极其不稳定,特别 是甘氨酸、赖氨酸衍生物的信号衰减很快,一天变化很 大。从以往我们做的实验来看此方法的变异系数CV%一 般为5%左右,个别的氨基酸如组氨酸可达9%左右,尤 其对带有盐分的饲料氨基酸类样品特别不适合,因样品 中带有的盐分直接影响衍生(紫外法基线不好)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各种氨基酸的含量。
通常细分为两种系统:蛋白水解分析系统(钠盐系统)和游离氨基酸
分析系统(锂盐系统),利用不同浓度和pH值的柠檬酸钠或柠檬酸
锂进行梯度洗脱。其中钠盐系统一次最多分析约25种氨基酸,速度较
快,基线平直度好;锂盐系统一次最多分析约50种氨基酸,速度较慢,
基线一般不如钠盐系统好。
离子交换树脂
用6N 的盐酸作为水解剂,此方法的特点是水解彻底,水解后的氨基 酸全部以L-型形式存在,但色氨酸遭破坏。(6N HCL 、110℃真空 水解24小时)
优点:HCL本身加热可以蒸发除掉。 缺点:溶液显黑褐色、与含醛基化合物作用的结果。 提示:盐酸中的重金属,作为接触剂可使氨基酸遭到破坏,故要求高 纯度的盐酸水解样品。
日立 L-8900 氨基酸自动分析仪
内容
氨基酸相关内容介绍 氨基酸分析仪发展及生产厂家 氨基酸分析仪原理及相应部件 样品的制备 应用
常见故障的分析与处理
保养
一 氨基酸相关内容介绍
氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通 称。是生物功能大分子蛋白质的基本组成单位,是构成动物营养 所需蛋白质的基本物质。
优点:水解时间短,适合大批量的样品前处理。(此法有待于同行 的认可及实验比对数据的论证)
游离氨基酸样品的制备
游离氨基酸的样品在分析前必须进行磨碎、脱脂、提取、脱盐、 去蛋白、脱色等处理。在进行分析前建议使用C18过滤柱处理。
生理体液样品的处理
生理体液的样品首先要除去样品中的蛋白质,获得游离氨基酸。除去
苯丙氨酸 Phe (F)5.48 丝氨酸 色氨酸 缬氨酸 Ser(S)5.68 Trp (W)5.88 Val (V)5.97
氨基酸的化学性质
氨基酸分子中都具有氨基和羧基,因此它们都能产生氨基与
羧基的一般反应,如脂化、甲基化、乙酰化以及酸碱的中和 作用等。有些氨基酸由于存在其它基团而产生特殊反应,如 半胱氨酸的巯基(-SH)
(三)D-CL法 (丹酰氯) 反应比较简单,以5个 mol/L 比例,在室温、避光条件下短时间即 可完成反应。
缺点:衍生物对紫外比较敏感,反应必须要在避光下进行,赖氨酸、 组氨酸和半胱氨酸均生成二级衍生物影响准确测量。
(四)2,4-二硝基氟苯法 此方法是比较常见的液相测定方法,最大缺点是衍生剂峰比较大, 对柱子危害比较厉害。组氨酸分离不好、组氨酸的二级衍生物与丝
>中性氨基酸>酸性氨基酸及羟基氨基酸。
4.提高流动相pH值,氨基酸正电荷减少,吸附力减弱,最后从离子交换柱
上洗脱下来,洗脱顺序是酸性和带羟基氨基酸、中性氨基酸、碱性氨基酸。
5.氨基酸标准溶液中各种氨基酸在氨基酸自动分析仪上被洗脱的顺序一定, 标准液各种氨基酸的浓度一定,洗脱峰的面积一定,由此可计算出样品中
性氨基酸、酸性氨基酸结合力最弱。按照氨基酸分析仪设定的洗脱程
序,用不同离子强度、pH值的缓冲液依次将氨基酸按吸附力的不同洗 脱下来(先酸性氨基酸再中性氨基酸最后碱性氨基酸),被洗脱下来
的氨基酸与茚三酮反应液在加热的条件下反应(135度),生成可在分
光光度计中570nm和440nm检测到的蓝紫色物质(仲氨生成浅黄色物 质440nm检测),外标法定量。
日立氨基酸分析仪发展历史
三 氨基酸分析仪原理及相应部件
氨基酸分析仪基本分析原理: 各种蛋白质是由20种氨基酸首尾相连,并以一定的顺序组成肽链。用
水解的方法将肽链打开,形成单一的氨基酸进行分析。所有的氨基酸
在低pH值的条件下都带有正电荷,在阳离子交换树脂上均被吸附,但 吸附的程度不同,碱性氨基酸结合力最强、其次为芳香族氨基酸、中
氨基酸分析仪洗脱过程
1. 氨基酸在pH 2.2的条件下都带正电荷,在阳离子交换树脂上均被吸附, 但结合强度各不相同。
2. 随着缓冲液在离子交换柱上流动,氨基酸不断的被吸附、解吸附。由于 氨基酸性质的差异(酸碱性、极性、分子大小),吸附强度有差异。
3. 不同氨基酸与离子交换树脂的亲和力不同:碱性氨基酸>芳香族氨基酸
2. 碱水解法:用2.5N NaOH (氢氧化锂)作为水解剂,色氨酸
不被破坏,但有消旋作用,丝氨酸、苏氨酸、精氨酸、胱氨酸
遭到不同程度的破坏(水解时20小时) 优点:水解液清亮 缺点:氨基酸发生外消旋作用,水解产物氨基酸有L-型和D-型, 水解过程中会放出氨气和硫化氢。
提示:只是为了测定蛋白质中色氨酸含量才会采用此水解方法。
缺点:水解时间长、而且不易水解完全。
提示:作为氨基酸全分析不可采用此法。
目前日本、欧洲和我国植物蛋白水解生产上采用的工艺均为酸水解法
4. 微波消解法:微波消解技术,近年来在化学领域尤其是在氨基酸
样品前处理方面显示出了良好的应用前景。
微波水解条件:体积30毫升左右高强度、耐腐蚀和透射微波的容器, 水解温度150-160℃,水解时间30分钟。
茚三酮反应
茚三酮溶液与氨基酸共热,生成氨。氨与茚三酮和还原性茚三酮 反应,生成紫色化合物。该化合物颜色的深浅与氨基酸的含量成 正比,可通过测定570nm处的光密度,测定氨基酸的含量。
离子交换法分离分析氨基酸的原理
根据氨基酸是两性电解质这一特性,以及目的氨基酸与
杂质氨基酸 pK、pI 值的差异,利用离子交换树脂对各
及经阴离子交换分离直接安培法检测的离子色谱法(IE)。
氨基酸分析仪法与HPLC法比较
近年来,常见的检测氨基酸的液相方法不少,现将几种常用的方法 与氨基酸分析仪法进行比较:
(一)OPA法(邻苯二甲醛)(反应机理略)
不足之处:做全分析时需配以其他技术一起使用,方可带有与仲氨 基团的氨基酸进行反应。赖氨酸及胱氨酸衍生物荧光较弱,灵敏度 低。因为OPA是快速反应剂,有些氨基酸反应及其不稳定,特别是 甘氨酸、赖氨酸衍生物的信号衰减很快,一天变化很大。根据资料 显示,此方法的变异系数CV%一般为5%左右,个别氨基酸如组氨 酸可达9%左右,尤其对带有盐分的饲料氨基酸类样品特别不合适, 因样品中带有盐分直接影响衍生(紫外发基线不好)。
天冬酰胺 Asn (N)5.41 半胱酰酸 Cys (C)5.02 谷氨酰胺 Gln (O)5.65 组氨酸 赖氨酸 His (H)7.58 Lys (K)9.74
天冬氨酸 Asp(D) 2.98 谷氨酸 Glu (E) 3.22 甘氨酸 Gly (G) 5.97 亮氨酸 Leu (L) 5.98 蛋氨酸 Met (M)5.75 脯氨酸 Pro (P)6.30 苏氨酸 Thr (T)6.53 酪氨酸 Tyr (Y)5.65 异亮氨酸 Ile (I)6.02
ห้องสมุดไป่ตู้
蛋白质化学方法为:
1. 苦味酸法 2.三氯醋酸法 3.乙醇沉淀法 4.磺基水杨酸法
影响氨基酸分析的各种因素
(1)样品中氨基酸浓度的影响 (2)缓冲液 pH 值、钠离子浓度的影响 (3)柱温的影响 (4)氨的影响
(5)氧存在的影响
(6)光源的影响(钨灯)
(1)样品中氨基酸浓度的影响
2.保留时间、峰面积、重现性好,检出限可达3pmol。
3.不存在液相方法生成二级衍生物的问题。 4.峰形显高斯分布,体系稳定快(半小时即可)
氨基酸分析仪按其分离和检测方法的不同可分为两大类型, 第一类是基于阳离子交换柱分离、柱后茚三酮衍生光度法 测定的经典方法(IEC)。第二类是所有基于反向色谱分离、 柱前衍生、荧光或紫外检测的高效液相色谱法(HPLC)以
L-8900 氨基酸分析仪性能指标
以蛋白质水解液标准分析方法为例: 净分析时间:≤30分钟 检出限:3pmol (信噪比=2,天门冬氨酸) 保留时间重现性: ≤ CV 0.3% 峰面积重现性: ≤1.0%(甘氨酸、组氨酸)
氨基酸分析仪特点
1. 灵敏、快速、提供数据准确可靠、分辨率高、操作简单、 分析周期短(水解30分钟、体液110分钟)。
(二)PITC法 (异硫氰酸苯脂)(反应机理略) 此方法的重现性明显低于茚三酮法,最大缺点是: 一个组分衍生后可生成2个以上的衍生物。而且和其 他组分峰重叠,灵敏度比较低。由于有残留的衍生 剂,柱效与柱寿命降低很快(200个样品左右),变 异系数在4%左右,个别氨基酸如组氨酸可达8%, 某些氨基酸在24小时内即被降解。
种氨基酸吸附能力的不同进行分离纯化。
二 氨基酸分析仪发展及生产厂家
氨基酸分析仪进入国内市场已有近三十年的历史,它是专用于 测定蛋白质水解液(水解氨基酸)及生理体液中(游离氨基酸) 混合氨基酸含量的一种专用仪器,现已广泛应用于各行各业。 它与其他分析仪器区别在于只能检测氨基酸,不能作为他用,
具有专一性。
3. 酶水解法:酶是有机催化剂,它不需要高温高压,而是在常温常压
下即可催化有机物质的合成与分解。
优点:水解条件温和,无需特殊设备,氨基酸不受破坏,产物中除氨 基酸外尚有较多肽类,目前来说,没有一种酶能全部完全水解蛋白质,
与酸法比较酶法要考虑酶试剂的种类、量、温度、pH值等因素,此
方法主要用于生产水解蛋白及蛋白肽。
氨基酸在溶液中受溶液 pH 的影响存在着下列平衡
等电点(pI):在某一 pH 的溶液中,氨基酸解离成阳离子和阴
离子的趋势或程度相等,成为兼性离子,呈电中性,此时溶液
的pH成为该氨基酸的等电点。
不同氨基酸等电点
丙氨酸
Ala (A)6.02
精氨酸
Arg (R)10.76
1958年 stein 与moore 两人先后独立发明离子交换分离、茚三 酮柱后衍生氨基酸自动分析仪。基于阳离子交换柱分离、柱后
