无机及分析化学第八章S区元素
无机及分析化学第八章

5
2012/12/27
配合物的杂化轨道和空间构型
配位数 杂化轨道 空间构形 实 例
价电子构型
配合物的杂化轨道和空间构型
配位数 杂化轨道 空间构形 实 例 价电子构型 5 dsp3 三角双锥 [Co(CN) [ ( )5]33d7 6 sp3d2 正八面体 FeF633d5 6 d2sp3 正八面体 Fe(CN) ( )633d5
2012/12/27 第八章 配位化合物与配位滴定 23 2012/12/27
2.内界:
配体名称 ONO 亚硝酸根 SCN 硫氰酸根 CO 羰基 NO2 硝基 NCS 异硫氰酸根 OH 羟基
第八章 配位化合物与配位滴定 24
4
2012/12/27
3.
配体命名先后要求:
3.
配体命名先后要求:
无沉淀生成
8
CuSO 4 4NH 3 [Cu(NH 3 ) 4 ]SO 4
内界配离子 外界离子
8.1.1 配位化合物的组成
1. 形成体——中心离子或中心原子,为具有能接受孤 电子对空轨道的原子或离子。 A) 绝大多数为金属离子,如: Fe3+、Cu2+、Co2+、Ni2+、Ag+等 B) 少数为非金属离子,如: B3+: [BF4] ;Si4+ : [SiF6]2 ; C) 金属原子,如:Ni、Fe等
8. 1 配位化合物的组成和命名
8.2 配位化合物的化学健理论 8.3*配位化合物的类型和异构化 8 4 配离子在溶液中的解离平衡 8.4
提 兵 百万 西 湖 上 , 立 马 吴山 第 一 峰 。 金 ·完 颜 亮
《无机化学》课件第八章

第一节 元 素 简 介
一、 元素的发现与分类
元素的发现与人类文明进步有着密切的关系。18世纪 的工业革命促进了化学的变革,使化学从愚昧中解放出来, 进入实验科学阶段,所以在这一百年间发现了19种元素, 而在此前的千年内只发现了13种元素。19世纪科学技术迅 速进步,使元素的发现不再受天然存在的局限。那些因半 衰期短、在自然界无法长期存在的放射性元素也可以通过 人工核反应制造。元素按其主要性质可分为金属、非金属、 准金属和稀有气体四类。
无机化学
第八章 s区和p区元素
元素简介 s区元素 卤素及其化合物 氧族元素及其化合物
第八章 s区和p区元素
氮族元素及其化合物 碳族元素及其化合物 硼族元素及其化合物 稀有气体 常见阴离子的鉴定
第八章 s区和p区元素
人类对化学元素的发现、认识和利用经历了漫长而曲 折的过程。迄今为止,人类已发现和合成了一百多种元素, 其中地球上天然存在的元素有90余种。这些元素所组成的 单质和化合物的制备、性质及其变化规律是无机化学的主 要研究内容。本章重点介绍s区和p区元素所组成的单质和 化合物的制备、结构、性质及其变化规律,各区元素的划 分可参见书后的元素周期表。
第二节 s 区 元 素
第二节 s 区 元 素
成碱金属能与水迅速反应放出氢气,所以不能在水溶 液中用于还原任何物质,但可成为非水介质中有机化学反 应的重要还原剂。同时也是高温条件下从氧化物或氯化物 中制备稀有金属的重要还原剂。当然,这些反应必须在真 空或稀有气体保护下进行。
对比锂和镁的性质,不难发现在它们之间有许多相似 之处,如它们都能与氧或者氮直接化合生成氧化物、氮化 物,它们的氢氧化物、碳酸盐、磷酸盐等都难溶于水。
第一节 元 素 简 介
第二节 s 区 元 素
无机及分析化学答案全(南京大学)(第四版)

第8章习题答案1.命名下列配合物:(1)K2[Ni(CN)4] (2)(NH4)2[FeCl5(H2O)](3)[Ir(ONO)(NH3)5]Cl2 (4)Na2[Cr(CO)5]解:(1)四氰根合镍(Ⅱ)酸钾(2)五氯•一水合铁(III)酸铵(3)二氯化亚硝酸根•五氨合铱(III)(4)五羰基合铬(-Ⅱ)酸钠(参考P172)2.写出下列配合物(配离子)的化学式(1)硫酸四氨合铜(Ⅱ) (2)四硫氰•二氨合铬(III)酸铵(3)二羟基•四水合铝(III)离子(4)二苯合铬(0)解:(1)[Cu(NH3)4]SO4 (2)(NH4)[Cr(NH3)2(SCN)4](3)[Al(H2O)4(OH-)2]+ (4)[Cr(C6H6)2]6.试用价键理论说明下列配离子的键型(内轨型或外轨型)、几何构型和磁性大小。
(1)[Co(NH3)6]2+ (2)[Co(CN)6]3-解:(1)Co最外层价电子排布为:27Co:3d74s2Co2+的最外层价电子排布为:27Co2+:3d74s0[ ][ ][ ][ ][ ] [ ] [ ][ ][ ] [ ][ ][ ][ ][ ]3d7 4S0 4P0 4d0[ ][ ][ ][ ][ ] [ ][ ][ ][ ][ ][ ] [ ][ ][ ]SP3d2杂化、成键,形成[Co(NH3)6]2+因为:形成[Co(NH3)6]2+时用的是Co2+最外层4S、4P、4d空轨道以SP3d2杂化、成键,而且中心离子Co2+形成配离子的前后单电子数没变,所以:该[Co(NH3)6]2+配合离子是外轨型,SP3d2杂化,几何构型为正八面体。
因为:以SP3d2杂化、成键形成[Co(NH3)6]2+后,具有3个单电子,所以:[Co(NH3)6]2+的磁矩为:,因为具有单电子分子是顺磁性分子,无单电子分子是抗磁性分子,所以形成[Co(NH3)6]2+后,具有3个单电子,[Co(NH3)6]2+是顺磁性分子。
S区元素(化学竞赛课件)

丰度可以用质量分数表示,也可用原子分数表述 氧是地壳中含量最多的元素,其次是硅,二者的总质 量约占地壳的75%。氧、硅、铝、铁、钙、钠、钾、 总质量占地壳的90%以上。 人体中大约含有30多种元素,11中为常量元素,约占 人体质量的99.95%,其余的为微量元素或超微量元素。
❖ 3.元素的分类:普通元素和稀有元素。
都能与水反应,并生成氢气。
常将钠与钙作碱为金某属锂些的钠的有化、反学钾应反与不应水如反钠应激激烈烈,,另放外出, 机溶剂的脱水剂。反大应量生的成热的,氢使氧钠化、锂钾溶熔解化度,较
4LO i2(过 量 2L2 ) O i 小也同,降时覆低使盖了氢在反燃金应烧属速。表率面 。上,从而
2M S M 2S
稀有元素:一般是指在自然界中含量少,或被人 们发现较晚,或对其研究较少,或比较难以提炼, 以致在工业上应用得也较晚的元素。
在自然界中只有少数元素(如稀有气体,O2,N2, S,C,Au,Pt等)以单质的形态存在,大多数 以化合态,而且主要以氧化物、硫化物、卤化物 和含氧酸盐的形式存在。)
结 构 分 区
S区元素是最活泼的金属元素。(原子半径、核电 荷数、第一电离能)
✓同一族元素自上而下性质的变化是有规律的。 (原子半径、离子半径、电离能、电负性、金属 性、还原性)
✓各族元素通常只有一种稳定的价态。
✓除铍和镁外,都较易与水反应,形成稳定的氢 氧化物,这些氢氧化物大多是强碱。
✓S区元素所形成的化合物大多是离子型的。
Li Be B C
Na Mg Al Si
❖1. 锂与镁的相似性
✓在过量的氧气中燃烧时不生成过氧化物,而生成 正常氧化物;
✓它们的氢氧化物都是中强碱,溶解度都不大,在 加热时可分解为Li2O和MgO; ✓它们的某些盐类如氟化物、碳酸盐、磷酸盐均难 溶于水;
无机化学s区和p区元素共33页文档

66、节制使快乐增加并使享受加强。 ——德 谟克利 特 67、今天应做的事没有做,明天再早也 是耽误 了。——裴斯 泰洛齐 68、决定一个人的一生,以及整个命运 的,只 是一瞬 之间。 ——歌 德 69、懒人无法享受休息之乐。——拉布 克 70、浪费时间是一桩大罪过。——卢梭
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去ቤተ መጻሕፍቲ ባይዱ余香。
无机化学s区和p区元素 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生世世的轮 回里有你。
无机及分析化学

ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 1H 2He 3Li 4Be 5B 6C 7N 8O 9F 10Ne 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 19K 20Ca 31Ga 32Ge 33As 34Se 35Br 36Kr 37Rb 38Sr 49In 50Sn 51Sb 52Te 53I 54Xe 55Cs 56Ba 81Tl 82Pb 83Bi 84Po 85At 86Rn 87Fr 族和ⅡA族的原子最外层分别有1个和2个s电子,故这 88Ra ⅠA
(1)正常氧化物
制备
Li、ⅡA金属与空气作用或由碳酸盐加 热分解时均生成氧化物: 4M+O2====4M2O (M=碱金属,常温) 6Li + N2 ====2Li3N (常温) △ 2M+O2====2MO (M=碱土) △ MCO3====MO+CO2↑ (M=碱土) M2O+H2O = 2MOH (M=碱金属)
性质
M2O+CO2 = M2CO3(M=碱金属)
MO+H2O=M(OH)2 (M=碱土金属)
MO+CO2 = MCO3 (M=碱土金属) BeO+NaOH=Na2Be(OH)4(铍酸钠) BeO+2HCl=BeCl2+H2O
(2)其他氧化物
4Na+O2=======2Na2O
573-673K
453-473K
表17-2 碱土金属元素的一些基本性质
元素 性质 价电子构型 主要氧化数 第一、 二电离势 (kJ.mol-1) 第三电离势 (kJ.mol-1) E0(M2+/M)(V) M2+ 水合热 (kJ.mol-1) 905 1768 14939 -1.85 2494 742 1460 7658 -2.375 1921 Be 2S2 Mg 3S2 Ca 4S2 +2 593 1152 4942 -2.76 1577 552 1070 4351 -2.89 1443 564 971 3575 -2.90 1305 Sr 5S2 Ba 6S2
《无机及分析化学》第八章课后题答案

第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2 B )B. S (AB )>S (A 2 B )C. S (AB )=S (A 2 B )D. 不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水 B. 在0.1mol ·L -1 HCl 中 C. 在0.1mol ·L -1 NH 4Cl 中 D. 在0.1mol ·L -1 Mg Cl 2 中 (3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3 C. AgNO 3,KSCN D. AgNO 3,NH 4SCN(4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄 C. 曙红 D. 铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低 B.偏高 C.无影响 D. 正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型 有关,而且还与溶液中相应离子 浓度 有关。
;4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为1.05×10-5 , 1.1×10-4 。
;三、简答题6.试用溶度积规则解释下列事实解:(1)CaCO3沉淀溶于稀HCl :CaCO3Ca2++CO32-,在稀HCl中存在H+,能与CO32-结合生成HCO3-和H2CO3,导致平衡向右移动,直到完全溶解。
无机化学s区和p区元素ppt课件

氢卤酸的还原能力依HI>HBr>HCl>HF的次序减弱。
上页 下页 目录 返回
7.2.3 卤化物
除了氮、氖和氩外,周期表中所有元素都能与其生成 卤化物。 •金属卤化物: 电负性小的活泼金属与卤素形成的卤化物多为离子型化 合物;电负性大的金属与卤素形成的多为共价型化合物。 不同氧化态的某一金属:FeCl2显离子型;FeCl3显共价型 7.2.4 卤素的重要含氧酸 除氟外,其余卤素几乎均可形成含氧酸及其盐,例如氯 的+1、+3、+5、+7的含氧酸及其盐,溴、碘类似。 通式:HXOn: n=1,2,3,4;(X:氯,溴,碘) 未见HIO2 次卤酸,亚卤酸,卤酸,高卤酸
上页 下页 目录 返回
溶解性 碱金属盐大多易溶于水,并且在水溶液中完全电离,例 外有LiF、Li2CO3和等; 钠盐的吸湿性比钾盐强,因此分析化学中所用的基准物 质多是钾盐; 碱土金属盐:大多数碱土金属盐溶解度小; CaC2O4是钙盐中溶解度最小的,常用作定量分析; 钡餐:BaSO4+Na2SO4溶液中的糊状物(可溶性钡盐对人体 有毒)。
无机化学s区和 p区元素
7.1 碱金属和碱土金属化合物
Ca,Sr,Ba 碱性 “土性”: 氧化物难 溶于水
S区元素在周期表中的位置
上页 下页 目录 返回
7.1.1 碱金属和碱土金属通性
有金属光泽,密度小,硬度 小,熔点低、导电、导热性好 的特点; 锂和铍由于原子半径小,而且 次外层为2电子构型,所以在同 族元素中熔点和沸点最高; 铯失电子的倾向很大,受光照 射金属表面的电子逸出(光电效 应),因此常用铯(也可有钾铷)来 制造光电管.
O -3
上页 下页 目录 返回
过氧化物(O22-): Na2O2常见 2Na+O2→ Na2O2
《无机及分析化学》教学大纲

《无机及分析化学》教学大纲篇一:《无机及分析化学》教学大纲《无机及分析化学》教学大纲课程名称:无机及分析化学课程编号:课程类别:专业基础课/必修课学时/学分:48/3开设学期:第一学期开设单位:化学与化工学院说明一、课程性质与说明1.课程性质专业基础课/必修课2.课程说明《无机及分析化学》是全国高等农业院校“十五”规划教材,也是农学、园艺、生物等专业的必修基础课,是上述专业学生学习的第一门基础化学课程。
本课程在元素周期律、原子和分子结构理论及四大平衡(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)原理的基础上,讨论重要元素及其化合物的结构、组成、性质、变化规律及其含量测定的理论和方法。
上述内容与相关专业对化学基础的要求相结合,为学生学习后继课程、写作毕业论文及从事专业实践打下必要的基础。
二、教学目标1.理解分散系、物质结构、化学反应速率和化学平衡等无机化学的基本概念、基础理论。
2.理解酸碱滴定法、沉淀滴定法、配位滴定法、氧化还原滴定法和吸光光度法等分析化学的基本原理,初步掌握定量分析的常用测定方法。
3.掌握定量分析基本计算方法,能正确表示定量分析结果。
4.培养学生具有初步解决化学问题的能力并且养成严谨细致、实事求是的科学作风。
三、学时分配表章序章题讲授学时实验学时辅导学时自学学时小计1溶液和胶体42化学反应速率23化学热力学基础及化学平衡74物质结构基础55酸碱平衡与沉淀溶解平衡56配位化合物47氧化还原反应68重要的生命元素自学9分析化学概论610滴定分析法611重量分析法自学12吸光光度法413电势分析法自学合计48 四、教学教法建议本课程教学应在充分了解中学化学教学内容的基础上展开,既要注意与中学教学内容的衔接,又要注意避免不必要的重复。
对于已习惯中学教学的新生一时难以适应大学化学学习的情况,教师在本课程教学开始就应注意学习方法的指导和教学内容的精炼,以使学生尽快适应。
每章讲完之后应及时小结重点,以助学生理清思路,及时消化。
无机化学课件12-s区元素

对土壤的影响
土壤污染
S区元素在工业生产过程中 可能通过废渣、废气等途 径进入土壤,导致土壤污 染。
土壤质量下降
这些元素在土壤中积累, 可能影响土壤的理化性质 ,导致土壤质量下降。
农产品安全问题
被污染的土壤可能影响农 作物的生长和品质,进而 影响农产品安全。
对大气的影响
大气污染
S区元素可能以气态或颗粒物的形 式排放到大气中,造成大气污染 。
SUMMAR Y
01
S区元素的概述
定义与特性
定义
S区元素指的是元素周期表中第12族(IIIB族)的元素,包括钪(Sc)、钇(Y )、镧(La)、锕(Ac)等。
特性
S区元素都是金属元素,具有金属的通性,如导电、导热、延展性等。它们在化 学反应中通常表现出较强的还原性,易于失去电子成为正离子。
S区元素在自然界中的存在形式
金属氢化物是S区元素与氢反应生成的化合物,它们具有高的能量密度和稳定性。金属氢化物在能源储存和转换领域有潜在的 应用价值。
金属氢化物在工业中有一定的应用,如作为储氢材料和制备其他金属氢化物的原料。此外,一些金属氢化物还具有特殊的物 理和化学性质,可用于制备新型材料和器件。
REPORT
CATALOG
环保催化剂
利用硫元素制备的催化剂可用于 处理工业废气,降低污染物排放 。
合成新物质
含硫化合物
硫单质或硫化物可与其他元素合成多 种含硫化合物,如硫酸、硫代硫酸盐 等。
高分子材料
含硫元素的高分子材料具有特殊性能 ,如耐高温、抗氧化等,在航空、航 天等领域有广泛应用。
REPORT
CATALOG
DATE
REPORT
CATALOG
DATE
无机及分析化学第8章习题答案
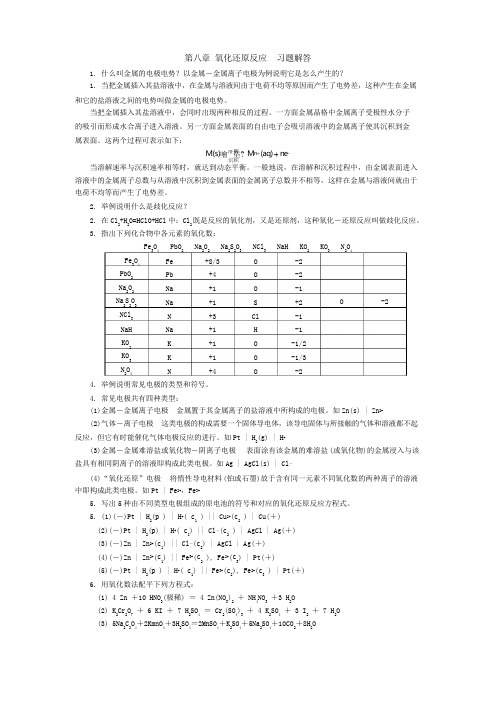
M(s)噲溶垐? M n + (aq) + n e -第八章 氧化还原反应 习题解答1. 什么叫金属的电极电势?以金属-金属离子电极为例说明它是怎么产生的?1. 当把金属插入其盐溶液中,在金属与溶液间由于电荷不均等原因而产生了电势差,这种产生在金属和它的盐溶液之间的电势叫做金属的电极电势。
当把金属插入其盐溶液中,会同时出现两种相反的过程。
一方面金属晶格中金属离子受极性水分子 的吸引而形成水合离子进入溶液。
另一方面金属表面的自由电子会吸引溶液中的金属离子使其沉积到金属表面。
这两个过程可表示如下:解沉积当溶解速率与沉积速率相等时,就达到动态平衡。
一般地说,在溶解和沉积过程中,由金属表面进入溶液中的金属离子总数与从溶液中沉积到金属表面的金属离子总数并不相等,这样在金属与溶液间就由于 电荷不均等而产生了电势差。
2. 举例说明什么是歧化反应?2. 在 Cl 2+H 2O=HClO+HCl 中:Cl 2 既是反应的氧化剂,又是还原剂,这种氧化-还原反应叫做歧化反应。
3. 指出下列化合物中各元素的氧化数:Fe 3O 4PbO 2 Na 2O 2Na 2S 2O 3 NCl 3 NaHKO 2 KO 3 N 2O 4Fe 3O 4 PbO 2 Na 2O 2 Na 2S 2O 3 NCl 3 NaHKO 2 KO 3N 2O 4Fe Pb Na NaNNaKKN+8/3+4+1 +1 +3 +1 +1 +1+4OO O SClHO OO-2 -2 -1 +2 -1 -1-1/2-1/3-2O -24. 举例说明常见电极的类型和符号。
4. 常见电极共有四种类型:(1)金属-金属离子电极 金属置于其金属离子的盐溶液中所构成的电极。
如 Zn(s) | Zn 2+(2)气体-离子电极 这类电极的构成需要一个固体导电体,该导电固体与所接触的气体和溶液都不起反应,但它有时能催化气体电极反应的进行。
如 Pt | H 2(g) | H +(3)金属-金属难溶盐或氧化物-阴离子电极 表面涂有该金属的难溶盐 (或氧化物)的金属浸入与该 盐具有相同阴离子的溶液即构成此类电极。
无机化学课件:s区元素2017

总H焓2θ变/ k△JH• mmo/kl J1•mol-1
θ θ
(计算值) / V(实验值) /V
Li
150.5
520.1 -514.1 163.1 -454.5 -291.4 -3.02 -3.0401
Na
109.5
495.7 -413.8 197.3 -454.5 -275.2 -2.67 -2.71
保持在较小的数值。不难预料随Pk变小,ΔrGm向负值的方向 变动,有利于反应向右进行。
5.2.3 用途概述
两族元素金属和化合物的重要性可排出如下顺序:
金 属: Na>> Li >K > Cs > Rb Mg >> Ca > Be > Ba > Sr
化合物: Na > K >> Li >> Cs > Rb Ca >> Mg >> Ba >> Sr > Be
● 碱金属的液氨溶液比纯溶剂密度小
● 液氨中随 C(M) 增大,顺磁性减少
(2e
e22- )
钠溶于某些干燥的有机溶剂(如醚)也会产生溶剂合
电子的颜色.
用钠回流干燥这些溶剂时,颜色的出现可看作溶剂
处于干燥状态的标志。
Question 4
金属钠与水、液氨、乙醇的
反应有何不同?
Solution
2 Na(s) + 2 H2O(l)
5.1 概述 Generalization
碱金属 (alkalin metals) 碱土金属 (alkalin earth
(ⅠA): ns1
metals)
(ⅡA): ns2
电 金 原 锂 lithium
离属子
能性半 、、径
钠
sodium
电还增 负原大
钾
potassium
无机化学第五版s区元素42页PPT

41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不机化学第五版s区元素
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
高校无机化学(高教版)S区元素第一节课件

ΔrHmθ
ΔrHmθ = Δ升华Hmθ + I 电离+ Δ水合Hmθ
水溶液中金属的离子化过程不仅与电离有关,也与金属离子 的水合及金属的升华有关。由于Li+半径小,水合能力比Na+ 强的多。所以在水中Li更易失去电子。
2. 碱土金属的基本性质
元素
性质
Be
原子半径/pm
111.3
离子半径/pm
35
第一电离势
M+ (g) + e-
电离过程
Mn+ (aq) + ne- 半电池反应
ΔrGmθ = - nFEθ (Mn+/ M ) ΔrGmθ = ΔrHmθ - TΔrSmθ
对于碱金属来说,ΔrSmθ 可忽略, 所以,ΔrGmθ ~ ΔrHmθ
M (s)
升华
M (g) 电离 Mn+ (g)
水合 Mn+ (aq)
(2) 通式为M2ISO4·MgSO4·6H2O的矾类, (MI=K+、Rb+、Cs+) 如:软钾镁矾K2SO4·MgSO4·6H2O;
(3) 通式为MIMIII(SO4)2·12H2O的矾类, (MI=Na+、K+、Rb+、Cs+; MIII=Al3+、Cr3+、Fe3+、Co3+、Ga3+、V3+等) 如:明矾KAl(SO4)2·12H2O。
Na2O2 + 2H2O == 2NaOH + H2O2
H2O + O2
KO2 + 2H2O == 2KOH + H2O2 + O2
➢ 与CO2的作用
厦门大学无机化学s区元素

第八章s区元素8.1 S区元素概述 (1)8.2 S区元素的一些规则 (3)8.3 重要单质与化合物 (10)8.4 制备 (18)8.5 S区元素的生物作用 (20)8.1 S区元素概述8.1.1 碱金属S区元素价电子构性、氧化还原性及其变化规律S区元素包括周期系中的ⅠA族-碱金属和ⅡA族-碱土金属。
表8-1ⅠA和ⅡA的特征氧化态为+1和+2,但还存在低氧化态,如等。
从标准电极电势(E),均具有较大的负值。
金属单质都是强的还原剂,如纳、钾、钙等常用作化学反应的还原剂。
表8-2 S区元素电极电势由于它们都是活泼的金属元素,只能以化合状态存在于自然界。
如钠和钾的主要来源分别为熔盐NaCl 、海水;天然氯化钾、光卤石KCl·MgCl 2·6H 2O 等。
钙和镁主要存在于白云石、方解石、菱镁矿、石膏等矿物中,锶和钡的矿物有天青石和重晶石等。
岩盐 白云石 菱镁矿 重晶石8.1.2 碱土金属2.碱土金属碱金属和碱土金属元素在化合时,多以形成离子键为主要特征。
氢氧化物除具有两性,为中强碱外,其他均是强碱。
【问题1】铍与锂具有一定的共价性,为什么?由于锂和铍原子半径和离子半径小,且为2电子构型,有效核电荷大,极化力强,因此它们的化合物,具有一定的共价性。
碱金属元素的原子也可以共价键结合成分子,如等碱金属单质的双原子分子就是共价分子。
IA 和IIA 族金属的一些基本性质列于表中。
表8-3 碱金属与碱土金属的基本性质【问题2】为什么ⅡA 金属的熔沸点升华热高于IA ?ⅡA 离子水合放热更多? 因为ⅡA 金属中有两个电子参与形成金属键,金属键较强,所以熔沸点及升华热均高于IA 。
ⅡA 离子带有两个正电荷,更容易与水结合,会放出更多的热量。
8.2 S 区元素的一些规则8.2.1 对角线规则(1)锂和镁的相似性 S 区元素的一些规律1.对角线规则第二周期元素Li 、Be 、B 的性质和第三周期处于对角位置的元素Mg 、Al 、Si 一一对应,它们的相似性称为对角线规则。
无机化学s区元素PPT课件

能 量 2p
σ*2p π*2p
2p
σπ22pp
O2分子轨道式
σ*2s
2s
2s
O2[(1s)2(*1s)2 (2s)2
(*2s)2(2px)2 (2py)2
(2pz)2(*2py)1 (*2pz)1]
1s
σ 2s σ *1s
1s
σ1s
A.O M.O A.O
第17页/共34页
3.化学性质
•与H2O的作用:
这是由于对角线位置上的邻近两个元素的电荷数和半径对极化 作用的影响恰好相反,使得它们离子极化力相近而引起的。
第32页/共34页
锂与镁的相似性: •单质与氧作用生成正常氧化物; •氢氧化物均为中强碱,且水中溶解度不大; •氟化物、碳酸盐、磷酸盐均难溶; •氯化物均能溶于有机溶剂中; •碳酸盐受热分解,产物为相应氧化物。
2NH3 (l) →2M +
+
2NH
2
+
H 2 (g)
M(s) 液氨溶剂 M+ (am) + e- (am)
第9页/共34页
12.2.2 s区元素的存在和单质的制备
均以矿物形式存在:
钠长石: NaAlSi 3O8
钾长石: KAlSi 3O8
光卤石: KCl MgCl 2 6H 2O 明矾石: K(AlO) 3 (SO 4 )2 3H 2O 锂辉石: LiAl(SiO 3 )2
第27页/共34页
对于IIA族的化合物溶解度变化如下:
其氟化物、氢氧化物
从 上 到 下
溶 解 度 增 大
其硫酸盐、铬酸盐、碘化物
从 上 到
下
溶 解 度 减 小
第28页/共34页
五、无机及分析化学重要知识点汇编

华中科技大学2017年攻读硕士学位研究生入学考试试题重要知识点汇编(无机化学及分析化学)绪论一、化学的地位及作用自然科学在纵向方面分为三个层次:工程技术、技术科学、基础科学。
化学是一门基础学科,它是在分子、原子或离子等层次上研究物质的组成、结构和性质以及可能发生的变化和变化中的能量转换。
化学理论已渗透到许多技术学科当中,如采矿和冶金工业的需要,推动了无机和分析化学的发展;纺织、印染、煤、石油的综合利用又使有机化学向前迈进了一大步。
二、四大化学化学在发展过程中逐步形成了许多分支学科,如"四大化学"这些都属于纯粹的化学。
无机化学:以所有元素及其化合物(除C、H化合物及其衍生物)为研究对象;有机化学:以C、H化合物及其衍生物为研究对象;分析化学:研究物质的化学组成和鉴定方法及其原理;物理化学:以应用物理测量方法和数学处理方法来研究物质及其反应,以寻求化学性质和物理性质间本质联系的普遍规律。
另外,随着化学在不同领域中的应用,又产生了许多应用化学:如工业化学、高分子化学、放射化学、环境化学、生物化学、半导体化学等等。
三、本课程的目的及主要内容1、目的:化工类专业一门重要的基础课,是后续化学课程的基础。
2、主要内容:主要是研究无机物的组成、结构、性质、制备、应用以及其变化的基本原理。
本教程分为两部分:化学理论与元素及其化合物其中化学理论又分为:四大平衡(化学平衡、酸碱平衡、沉淀溶解平衡、氧化还原平衡)及结构理论。
3、学习方法:(1)理论课大学的学习模式:每节课的讲授内容多,讲授内容重复性小,作业量少,无课堂练习,强调自学能力的提高。
针对大学学习特点,提出如下要求:①课堂认真听讲,跟上教师讲授思路,有弄不懂的问题暂且放下,待以后解决,不然,由于讲授速度快,容易积累更多的疑难问题。
②作好课堂笔记,留下一定的空白处,做标记,提出问题,写出结论。
(2)实验课化学是以实验为基础的学科,实验对于理论的理解十分重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、反应的激烈程度
编辑课件
10
(3)单质的应用
S区元素单质的用途不广泛、价值不大(为什么?)主要用途: ▲ 还原剂(冶金、有机合成) ▲ 某些特殊用途:光电池、核反应冷却剂、特殊光源材料 ▲ 制造合金(N弹的组成:
信号弹的组成
在一Na些NO军3事4方5%面应用 成分 红 绿 黄
编辑课件
8
(2)化学性质
1)电子构型:ns1 和ns2(次外层?)
2)极活泼的金属:电负性低、电极电势低,第一、或第一和 第二电离能低。
3)主要氧化态为+1和+2,离子状态为主,也有共价态的:
a. M → M2( Li2、Na2、K2 ,T > b.p) b.有机化合物中:C6H5Li c.无机化合物中:MgO
元 素化学
第八章
S区元素
编辑课件
1
元素周期表的分区
周期 ⅠA
ⅧA
1
ⅡA
ⅢA ⅣA ⅤA ⅥA ⅦA
2
3
ⅢB ⅣB ⅤB ⅥB ⅦB ⅧB ⅠB ⅡB
4S
p
5
d
ds
6
7
镧系
f
锕系
编辑课件
2
绪论
元素化学概要
1、无机化学 基本理论
轻有色
元素化学
黑色金属 重有色
2、元素的分类
自然存在的72种
贵金属
金属元素88种
(3)非金属的物理、化学性质
(4)非金属的应用
6、元素化学学习的要求
(1)综合运用化学原理方面的知识;
(2) “粗”、“细”结合,元素化学具有叙述性、实验性质, 但是有规律的。既要学习、掌握元素变化的规律性的东西,元素 的共性,又要学习、掌握某些元素具体的性质(个性),如:在 自然界中的存在形式、提取方法、单质及化合物的性质、相互转 化规律、应用等等。
K
2s1
3s1
4s1
52 1341 180.54 0.534 0.98 526.41
186 881.4 97.82 0.968 0.93 502.04
227 759 63.38 0.89 0.82 425.02
-59.6 -3.040
-52.9 -2.714
-48.4 -2.936
+1
+1
+1
编辑课件
卤化物 盐的制取
重要盐 硝酸盐 盐的物理性质
硫酸盐 盐的化学性质
碳酸盐 盐的应用
1、氢化物
(1)氢化物的制备:M + H2 → MH (注意反应条件)
M + H2 → MH2 (注意反应条件)
(2)氢化物的性质: MH + H2O → MOH + H2
MH2 + 2H2O编辑→课件M(OH)2 + 2H2
Rb 5s1
248 691 39.31 1.532 0.82 409.22
46.9 -2.943
+1
Cs 6s1
265 668.2 28.44 1.878 0.79 381.90
45 -3.027
+1
6
价电子层构型
金属半径/pm 沸点/0C 熔点/0C 密度/(g.cm-3) 电负性 电离能(I1)
有色金属 稀有
110种元素
人造元素16种
准金属
非金属元素22种 3、元素的丰度
4、金属通论
(1)金属的存在:金属矿藏、金属单质等(矿物化学、地质 化学)
(2)金属的提取:高温冶金、湿法冶金(冶金化学) (3)金属的物理、化学性质
(4)金属的应用
编辑课件
3
5、非金属通论
(1)非金属的存在,聚集状态
(2)单质的制备
12
(3) 氢化物的应用:主要用作还原剂
2、氧化物
(1)氧化物种类及制备:
M + O2 → MnO(注意反应条件) M=Li,Na,K … n = 1,2 正常氧化物、过氧化物、超氧化物,哪些元素易形成过氧化物和 超氧化物?为什么?
(3)要重视基本理论的学习,又要重视实验,要与元素化学实
验相结合。
编辑课件
4
8.1 S区元素概述
1、S区元素包括第一主族和第二主族: Li、Na、K、 Rb、Cs、Fr Be、Mg、Ca、Sr、Ba、Ra
2、S区元素在自然界中的存在形式及丰度 1)多以卤化物、碳酸盐等矿物形式(为什么?); 2)电解还原法制取(为什么?)
3、 S区元素单质及化合物性质变化的规律性 单质:同一周期从上到下的物理性质与化学性质的
变化规律性;
同一类化合物性质变化的规律性。
编辑课件
5
价电子层构型
金属半径/pm 沸点/0C 熔点/0C 密度/(g.cm-3) 电负性 电离能(I1)
电子亲合能 电极电势
氧化值 晶体结构
碱金属的基本性质
Li
Na
28.9 -2.869
+2
+2
+2
编辑课件
Sr 5s2
215 1366 757 12.64 0.95 555.7
28.9 -2.899
+2
Ba 6s2 217 1845 727 3.51 0.89 508.9
-2.906 +2
7
8.2 S区元素的单质
1、物理性质
1)固体密度小,多为极轻金属或轻金属 例如:Li的密度为0.53,K:0.86,Ba的密度也只有3.51. 2) 熔点低:Cs的m.p28.60C ,Rb:39.00C, Be: 12850C 3) 硬度低 4)光电性 在光的照射下能产生光电子 原因呢?
d.配合物中
4) S区元素的多数化合物多是离子型的,易溶于水,难形成 配位化合物。原因?
5) S区元素的氧化物的水化物均有强碱性
6) 易形成过氧化物。
7) S区元素的化合物的性质变化规律性强。
8) 较难形成配合物
编辑课件
9
碱金属、碱土金属的化学反应
M + O2 → MOn (n > 1) M + S → MnS (n > 1) M + H2O → M(OH)n (n > 1) M + O2 → MOn (n > 1) M + H2 → MHn M + H+ → Mn+ + H2 M + X2 → MXn 应注意的问题:
电子亲合能 电极电势
氧化值 晶体结构
碱土金属的基本性质
Be
Mg
Ca
2s2
3s2
4s2
111 2467 1287 1.847 1.57 905.63
160 1100 651 1.738 1.31 743.94
197 1484 842 1.55 1.00 596.1
48.2 -1.968
38.6 -2.357
Mg 45%
Mg 29 15 26
聚氯乙烯 2%
Sr(NO3)2 34 16 /
在聚日酯常树生脂活8及%医B药a(方NOC面u3)O的2 应/ 用/
2 45
/ 29
KClO4 29 / 23
沥青 2 2 2
草酸钠 / 编辑课/件 13
11
8.3 S区元素的化合物
氢化物
氧化物
S区元素的化合物 水化物
