大学课程遗传学实验实验四 孚尔根(Feulgen)核染色课件
实验四染色体核型分析课件

臂比(长/ 短)
Arm ratio(L/
S)
类型 Type
1 3.25+0.99=4.24
7.05
2 2.49+0.92=3.41
5.61
3 2.06+1.02=3.08
5.06
4 1.71+1.03=2.74
4.51
5 1.46+0.96=2.42
3.99
6 1.21+0.92=2.13
3.52
L
核型模式图
二、实验原理
不同物种的染色体都有各自特定的形态结构 (包括染色体的长度、着丝点位置、臂比、随 体大小等)特征,而且这种形态特征是相对稳 定的。因此,染色体核型分析是生物种质资源 遗传性研究的重要内容。
染色体核型分析主要包括染色体长度、染色体 臂比、着丝点位置、次缢痕等。
三、实验材料及用品
3.27
st
L
2.70
sm
L
2.03
sm
M2
1.66
m
M2
1.51
m
M1
1.32
m
五、实验方法与步骤
1.用Photoshop图像处理软件,对染色体照片进行适 当的编辑(包括去色、调节反差和对比度)、并对 染色体进行初编号。
2.用Image j 或 Image tool软件,测量每一条染色体 的短臂、长臂的长度,计算其相对长度、臂比值。
核型(karyotype) 是指染色体组在有丝分裂中期的表型,
包括染色体数目、大小、形态特征的总和。 核型模式图(idiogram)
将一个染色体组的全部染色体逐个按 其特征绘制下来, 再按长短、形态等特征排 列起来的图象称为核型模式图,它代表一个 物种的核型模式。
孚尔根染色法

孚尔根染色法DNA是主要的遗传物质,集中于染色体上。
1924年孚尔根首先用席夫试剂(Schiff)作试验,鉴定了染色体上DNA的存在,故称为孚尔根染色法。
孚尔根染色法的反应原理主要与席夫试剂的化学性质有关,此试剂的基本成分是碱性品红,偏亚硫酸氢钠(NaHSO3)和盐酸.碱性品红的主要成分是三氨基三苯甲烷氯化物。
实验原理:细胞中的DNA受1NHC1,60℃水解作用以后,核酸中的嘌呤碱很快完全被除掉,使脱氧核糖中潜在的醛基获得自由状态。
水解后,组织要经水洗再移至希夫(Schiff)试剂中,希夫试剂即同露出来的醛基发生反应,呈现紫红色。
这个反应是Feulgen在1942年提出来的,是DNA的一个特异性检查法。
水解的时间很重要,因为核酸的水解有两个过程,第一,漂呤碱很快被除掉,脱氧核糖中潜在的醛基显露出来,第二,组蛋白和核酸愈来愈多地被除掉。
在短时间的水解作用以后,第一个过程占优势,这时候用希夫试剂染色,染色体的染色作用最强。
随着水解作用的继续进行,第二个过程逐渐变成优势,因此水解液中的希夫反应增强,而染色体中的希夫应减弱。
最后,第二个过程超过第一过程时,染色体也随之停止反应。
希夫试剂是碱性品红———亚硫酸溶液,呈无色。
与DNA醛基反应后,使碱性品红恢复原来的红色。
二、实验目的:观察蚕豆根尖细胞或其它根尖细胞内染色体中的DNA,以及染色体在有丝分裂中的行为,掌握Feulgen染色方法。
三、实验材料:上次实验制成了石蜡切片。
四、实验准备:1.用具立式染色缸一套,镊子,盖玻片,小漏斗,铁架,毛边纸,玻璃棒,显微镜,恒温水浴锅,温度计,烧杯,棕色瓶,黑纸。
2.玻璃器皿的清洗主要是染色缸的清洗,一般用肥皂粉洗,用水冲净即可,如不能洗净时,要用洗液浸泡后,再冲洗,自来水洗后,再用少量蒸馏水过洗一次。
盛放100%酒精、二甲苯的染色缸必须干燥,缸盖内缘必须涂以几士林,以防止蒸发和收水分,影响浓度。
染色缸上要贴上标签。
植物染色体的孚尔根染色法

四、实验步骤
1. 希夫试剂的配制
• 将0.5g碱性品红徐徐加入煮沸的 碱性品红徐徐加入煮沸的100ml蒸馏水中 用玻璃棒搅拌 蒸馏水中, 碱性品红徐徐加入煮沸的 蒸馏水中 用玻璃棒搅拌, 使之充分溶解, 待溶液冷却至58°C左右 过滤于棕色瓶中。 使之充分溶解 待溶液冷却至 ° 左右, 过滤于棕色瓶中。 左右 • 当滤液冷却至 °C时, 再加入 当滤液冷却至26° 时 再加入10ml的1M盐酸和 盐酸和0.5g亚硫酸氢钠 的 盐酸和 亚硫酸氢钠 或偏重亚硫酸钠(钾 摇动, 溶解后密封于棕色瓶中, 或偏重亚硫酸钠 钾), 摇动 溶解后密封于棕色瓶中 置于黑暗 低温处。次日检查溶液颜色, 须呈无色透明或淡茶色才可使用。 低温处。次日检查溶液颜色 须呈无色透明或淡茶色才可使用。 • 若稍呈红色可加入 若稍呈红色可加入0.5g活性炭连续摇动 在4°C下静置过夜 然 活性炭连续摇动, 下静置过夜, 活性炭连续摇动 ° 下静置过夜 后过滤脱色。 后过滤脱色。
2. 染色过程
① 取固定好的根尖, 用水洗2-3分钟, 放入室温条件下的1N HCl处理根尖 材料2-3分钟。 ② 将根尖换入60℃预热的HCl, 置于恒温水浴中, 在60±0.5℃的条件下水 解8-10分钟。 ③ 吸出热HCl, 换入室温1N HCl再处理1-2分钟, 然后水洗2-3次。 ④ 吸净水分, 加入Schiff试剂, 盖上盖子, 在黑暗条件下染色30分钟, 也可 过夜。 ⑤ 用水漂洗, 去掉细胞中残存的一些有色的品红分子。 ⑥ 取根尖置载玻片上, 用镊子夹碎后, 加一滴45%醋酸, 然后盖上盖片。 ⑦ 压片、观察。
玉米染色体核型图(2n=20), Feulgen 染色
玉米染色体核型图(2n=20+2B)
玉米染色体核型图(2n=20+4B) /mnl/79/18rosado.htm
细胞生物学:实验4 feulgen反应显示细胞中的DNA

实验四
Feulgen 反应显示细胞中 的DNA
细胞膜/壁 细胞质
核仁
标题
细胞核
染色方法(放大倍数)
作业:用铅笔绘制一个洋葱根尖细胞并注 明各主要部位的颜色。
绘图的要求见实验ห้องสมุดไป่ตู้告P16。
选取具有普遍性的细胞
线条平滑、点均一、细致
5)弃去schiff试剂,用 1ml 亚硫酸氢钾洗 3 次,每次浸泡 2-3 min;
6)弃去亚硫酸氢钾,用 2ml 左右的蒸馏水漂洗 2 遍;
7)吸取洋葱根尖置于玻片上,稍微吸取水分;滴加 1 滴 4.5% 醋酸,然后 盖上盖玻片,轻压使根尖散开成单层云雾状;
8)观察:在低倍镜下找到分生区细胞,再高倍镜下观察细胞各部位的染色反 应。
实验目的
• 了解Feulgen反应的基本原理 • 熟悉Feulgen反应的染色方法 • 掌握生物学绘图方式
实验原理
DNA可在酸性条件下水解,嘌呤—脱氧核糖之间的糖苷键 断开,形成醛基(—CHO),再用显示醛基的特异性试剂Schiff 试剂处理,形成光镜下所见的细胞核内紫红色反应产物。
Schiff试剂的主要成分是碱性品红,碱性品红结构中的醌基是一个发 色基团,经亚硫酸处理后,则醌基两端的双键打开,形成无色品红-硫 酸复合物。
紫红色
Meristem
洋葱根尖
实验步骤
1)取 0.6cm 长的洋葱根尖放到离心管中;
《孚尔根核染色》课件

染色过程
孚尔根核染色包括几个关键步骤:细 胞固定、细胞通透性处理、DNA氧化 、染色和观察。
染色过程需要在弱酸条件下进行,以 促进DNA的氧化和后续的染色反应。
在染色过程中,需要使用特定的染料 ,如Giemsa染料或巴尔巴土染料,这 些染料能够与DNA-蛋白质加合物结 合,产生明显的染色效果。
染色效果
政策支持
政府可以出台相关政策, 支持孚尔根核染色技术的 研发和应用,促进其发展 壮大。
感谢您的观看
THANKS
该技术可用于DNA多态性分析 ,有助于研究基因变异与疾病 的关系。
技术局限性
1 样本量要求
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
2 交叉污染风险
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
3 假阳性结果
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
减少人工操作误差。
降低成本
通过优化试剂和设备, 降低检测成本,使更多 实验室和医疗机构能够
应用该技术。
05
孚尔根核染色技术的未来发展
技术发展趋势
自动化与智能化
随着机器人技术和人工智能的发展,孚尔根 核染色技术将逐渐实现自动化和智能化,提 高染色效率和准确性。
环保与可持续发展
随着环保意识的提高,未来的孚尔根核染色 技术将更加注重环保和可持续发展,减少对 环境的污染和资源消耗。
《孚尔根核染色》PPT课件
目录
• 引言 • 孚尔根核染色技术原理 • 孚尔根核染色技术的应用 • 孚尔根核染色技术的优缺点 • 孚尔根核染色技术的未来发展
01
引言
核染色技术简介
孚尔根反应
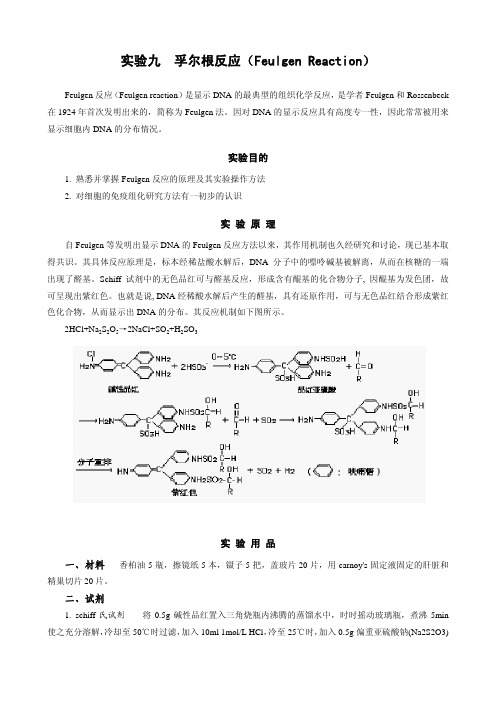
实验九 孚尔根反应(Feulgen Reaction)Feulgen反应(Feulgen reaction)是显示DNA的最典型的组织化学反应,是学者Feulgen和Rossenbeck 在1924年首次发明出来的,简称为Feulgen法。
因对DNA的显示反应具有高度专一性,因此常常被用来显示细胞内DNA的分布情况。
实验目的1. 熟悉并掌握Feulgen反应的原理及其实验操作方法2. 对细胞的免疫组化研究方法有一初步的认识实验原理自Feulgen等发明出显示DNA的Feulgen反应方法以来,其作用机制也久经研究和讨论,现已基本取得共识。
其具体反应原理是,标本经稀盐酸水解后,DNA分子中的嘌呤碱基被解离,从而在核糖的一端出现了醛基。
Schiff试剂中的无色品红可与醛基反应,形成含有醌基的化合物分子, 因醌基为发色团,故可呈现出紫红色。
也就是说, DNA经稀酸水解后产生的醛基,具有还原作用,可与无色品红结合形成紫红色化合物,从而显示出DNA的分布。
其反应机制如下图所示。
2HCl+Na2S2O5→2NaCl+SO2+H2SO3实验用品一、材料 香柏油5瓶,擦镜纸5本,镊子5把,盖玻片20片,用carnoy's固定液固定的肝脏和精巢切片20片。
二、试剂1. schiff氏试剂将0.5g碱性品红置入三角烧瓶内沸腾的蒸馏水中,时时摇动玻璃瓶,煮沸5min 使之充分溶解,冷却至50℃时过滤,加入10ml 1mol/L HCl,冷至25℃时,加入0.5g偏重亚硫酸钠(Na2S2O3)无水亚硫酸钠(NaHSO3),在室温冷暗处至少放置24h(有时需2~3天),使其颜色退至淡黄色,密封瓶口,藏于暗处,最好保存于4℃冰箱中(可保存数月或更长时间)。
在使用前加入0.5g活性碳, 摇1min, 用粗滤纸过滤,滤液应为无色;若液体颜色变为粉红色,便不能再用。
2. 亚硫酸水(洗涤剂) 用200ml普通自来水(不要用蒸馏水, 以免引起误差)、10ml 10%的偏重亚硫酸钠水溶液和10ml 1mol/L HCl,三者在使用前混合,现用现配。
孚尔根(FEULGEN) 染色

Schiff 试剂的配置
称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角烧瓶), 时时振荡,继续煮 5分钟(勿使之沸腾),使之充分溶解。然 后冷却至50℃时用滤纸过滤,滤液中加入10ml 1N HCl,冷却至 25℃时,加入0.5g Na2S2O5(偏重亚硫酸钠或钾),充分振荡 后,塞紧瓶塞,在室温暗处静置至少24小时(有时需2~3天), 使其颜色退至淡黄色,然后加入0.5g活性炭,用力振荡1分钟, 最后用粗滤纸过滤于棕色瓶中,封严瓶塞,外包黑纸。滤液应 为无色也无沉淀,贮于4℃冰箱中备用。如有白色沉淀,就不 能再使用,如颜色变红,可加入少许偏重亚硫酸钠或钾,使之 再转变为无色时,仍可再用
反应原理
样品经稀盐酸水解后,DNA分子中的嘌呤 碱基被解离,从而在核糖的一端出现了醛 基。Schiff试剂中的无色品红可与醛基反应, 形成含有醌基的化合物分子, 因醌基为发色 团,故可呈现出紫红色。也就是说, DNA经 稀酸水解后产生的醛基,具有还原作用, 可与无色品红结合形成紫红色化合物,从 而显示出DNA的分布。
操作方法及步骤
以Feulgen染色法观察洋葱根尖有丝分裂为例
•1.将洋葱根尖或鳞茎内表皮放在1N HCl中, 加热到60℃水解8~10 min。 • 2.蒸馏水水洗。 •3.Schiff试剂遮光染色30min。 •4.用新鲜配制的亚硫酸水溶液洗3次,每次 1min。 • 5.水洗5min。 •6.将根尖放在载玻片上,镊子捣碎,盖上盖 玻片,压片(洋葱表皮可省去压片这一步)。 • 7.显微镜检查。 结果:细胞中凡有DNA的部 位应呈现紫红色的阳性反应。
孚尔根染色法的反应原理主要与Schiff试剂的化学性质有关,此试剂的基本 成分是碱性品红,偏亚硫酸氢钠(NaHSO3)和盐酸.碱性品红的主要成分是 三氨基三苯甲烷氯化物。
孚尔根核染色25页PPT

6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
Thank you
孚尔根核染色
1、纪律是管理关系的形式。——阿法 纳西耶 夫 2、改为训练,不是通过语言影响 ,而是 让儿童 练习良 好道德 行为, 克服懒 惰、轻 率、不 守纪律 、颓废 等不良 行为。 4、学校没有纪律便如磨房里没有水。 ——夸 美纽斯
5、教导儿童服从真理、服从集体,养 成儿童 自觉的 纪律性 ,这是 儿童道 德教育 最重要 的部分 。—— 陈鹤琴
《DNAFeulgen染色》课件

添加标题
应用:DNAFeulgen染色技术广泛应用于细胞生物学、遗传学、病理学等领域,用于观 察DNA的分布和形态,研究DNA的结构和功能。
DNAFeulgen染色技术的优势
高灵敏度:能够检测出极低浓度的DNA,提高了检测的准确性。 特异性高:只与DNA中的碱基结合,不受其他物质干扰。 染色效果好:染色后细胞核颜色鲜艳,易于观察和分辨。 稳定性好:染色后颜色稳定,不易褪色,有利于长期保存。
染色步骤:严格按照操作规程进行染色, 避免遗漏或错误操作
染色后处理:染色完成后,及时进行后处 理,如清洗、脱水、封片等
安全防护:操作过程中注意个人防护,避 免接触有害物质
染色后的注意事项
染色后立即用清水冲洗,避免染色过度 染色后应立即观察,避免染色时间过长导致染色效果不佳 染色后应立即进行后续实验,避免染色效果随时间变化 染色后应避免阳光直射,避免染色效果受到破坏
染色前的注意事项
确保实验环境清洁,避免污染 准备足够的染色试剂,避免中途中断 确保实验材料新鲜,避免变质 严格按照实验步骤操作,避免错误
染色过程中的注意事项
染色时间:根据样本类型和染色目的,选 择合适的染色时间
染色温度:保持稳定的染色温度,避免过 高或过低
染色剂浓度:根据样本类型和染色目的, 选择合适的染色剂浓度
域进一步拓展应用
DNAFeulgen染色技术在未来医学和生物学研究中的应用 前景
细胞生物学研究:用于研究细胞结构、 功能及基因表达等
药物研发:用于研究药物作用机制、药 物筛选等
遗传学研究:用于研究遗传病、基因突 变等
生物技术:用于基因工程、细胞工程等
肿瘤学研究:用于研究肿瘤的发生、发 展及治疗等
环境科学:用于研究环境污染、生物多 样性等
DNA的孚尔根反应PPT教学课件

一、实验目的
掌握孚尔根(Feulgen)反应的原理和 方法,观察了解DNA在细胞内的分布。
二、实验器材及试剂
显微镜、染色缸、剪刀、镊子、培养皿等;
1M HCl、席夫试剂、亚硫酸水溶液等。
2020/12/09
1
三、实验材料 洋葱
四、实验原理
孚尔根反应是 Feulgen 和 Rosserbeck于1924 年发现的,是鉴定细胞内DNA特殊有效的方法。其 原理一般认为:稀酸(1M HCl,60℃)水解DNA,打 开DNA分子上嘌呤碱和脱氧核糖连接的键,从而使 脱氧核糖中的醛基释放出来,然后再与席夫试剂 (Schiff试剂,无色品红)反应,由于醛基的氧 化作用,使之与无色品红结合成紫红色的化合物。 细胞内凡有DNA的地方都呈阳性反应。
2020/12/09
3
PPT精品课件
谢谢观看
Thank You For Watching
4
2020/12/09
2
五、实验方法
1、将洋葱鳞茎内表皮放在1mol/l的HCl中, 加热到60℃水解8-10分钟。
2、蒸馏水水洗。 3、入席夫试剂 6、将鳞茎内表皮放在载玻片上,盖好盖玻片
,用吸水纸吸去玻片上多余的溶液,置显微 镜下检查,细胞内凡有DNA的地方都呈阳性 反应(玫瑰红色)。
Feulgen染色

Feulgen反应的基本原理:
稀HCl水解DNA,破坏嘌呤和 脱氧核糖间的配糖键,并在脱 氧核糖C1端形成游离的醛基, 醛基和Schiff试剂结合,形成 紫红色的化合物。因此在有 DNA的部位,就会呈现除紫 红色阳性反应。
三、实验步骤 核酸的显示——Feulgen反应
1. 取鸭血,血涂片,室温凉干,甲醇室温固定5 min,凉干; 2. 蒸馏水过一下; 3. 1 mol/L 盐酸(600C )水解8-10 min; 4. 1 mol/L 盐酸(室温)1 min; 5. 蒸馏水稍洗; 6. 置Schiff试剂中室温染色1小时左右; 7. 亚硫酸盐溶液洗3次,总时间为6 min; 8. 自来水流水冲洗5 min,蒸馏水过一下; 9. 用1%亮绿水溶液复染5-10秒; 10. 自来水流水冲洗2 min; 11. 蒸馏水稍洗; 12. 甘油/PBS封片剂封片;显微镜观察。
四、注意事项
1. 使用Schiff试剂时要注意不小心染色; 2. 盐酸水解时要注意温度及处理时间.
五、作业与思考题
简述Feulgen反应和PAS反应的原理, 并描述显微观察到的实验现象。
思考题: Schiff试剂的主要作用是什么?
PAS反应的基本原理:
利用强氧化剂使多糖产生游离的 醛基,醛基和Schiff试剂结合, 形成紫红色的化合物。因此在有 多糖的部位,就会呈现除紫红色 阳性反应。
二、试剂与器材
青蛙、鸭子 剪刀、载玻片、盖玻片、吸管、甲醇、1 mol/L 盐 酸、Schiff试剂、亚硫酸盐溶液、1%亮绿水溶液、 1%过碘酸、苏木精、甘油/PBS封片剂 普通光学显微镜
糖类的显示——PAS反应
feulgen染色法

feulgen染色法Feulgen染色法是一种细胞核染色的技术,是由德国生物学家弗朗西斯·费尔根(Robert Feulgen)在1914年发明的。
该技术的主要原理是利用増感反应特异性亲合性使DNA成为已知物质之一的二硫化物发生比较强的发色反应,因而得名 Feulgen 染色法。
Feulgen染色法以弗洛分离作为基础原理,对细胞内的核酸进行染色,并通过显微镜观察、分析和研究细胞发生分裂的相关特征。
该方法能够比较准确的区分细胞核与其他成分,尤其是有机质成分。
因此,Feulgen染色法在细胞学、细胞遗传学、组织学等领域中都有广泛的应用。
下面是 Feulgen 染色法的步骤:1. 细胞固定将要检测的细胞固定于载玻片上, Feulgen 染色法通常使用3.7%的甲醛作为固定液,使DNA在细胞和载玻片上不再发生运动和变化。
2. 酸解样品的酸解可以利用鹰嘴豆素和酸来进行。
这一步旨在剥离细胞的蛋白质并让核酸暴露在表面上,使其改变成醛基结构,以便接下来的染色成分与核酸相互作用。
3. 饱和无水硝酸样品用饱和无水硝酸处理,以去除酸中不必要的离子,同时也可以使其完成DNA的醛基反应。
4. Feulgen 组合液染色细胞样品将在染色溶液中放置2至10分钟,然后被放置于高氯酸中洗涤。
洗后,样品将被去水、除脂和用玻片覆盖。
5. 显微镜下观察使用荧光显微镜观察样品,利用目镜下特殊荧光物质的作用,可以使核酸发亮,显露出来并被直接观察到。
总的来说,Feulgen 染色法是一种快速、准确的核酸染色方法,可用于在细胞组织学、细胞遗传学和生物亚细胞学等领域中快速、准确地检测DNA的含量,为对生命现象的研究提供了有效的工具。
实验四 孚尔根(FEULGEN)反应

9.封片:中性树胶封片
10.贴标签,镜检
组织切片
鱼血涂片 95%乙醇固定 Feulgen反应 日期 姓名
五:实验结果
细胞核呈紫红色,细胞质呈浅绿色,对 照片只呈浅绿色。
六、作业
简述Feulgen反应的原理及关键步骤。
二、实验用品
1. 器材:显微镜、盖玻片、染色缸、眼科剪、解 剖刀、镊子、水浴锅
2. 试剂: 95%乙醇(固定液)、Schiff氏试剂、 1N盐酸、亚硫酸水、1%亮绿甲苯、酒精、中 性树胶
3. 材料:鸡血或鱼血涂片
三、实验原理
细胞中DNA经1N60℃盐酸水解后, DNA双螺旋结构中的嘌呤与脱氧核糖之间的 连接打开,并在脱氧核糖的一端形成潜在的 醛基。这些醛基与Schiff氏试剂作用,形成 紫红色的三苯甲烷衍生物。
四、实验方法
1.血涂片放入90%乙醇中固定1’30l’ink’ 2.放入70%酒精1’, 放入蒸溜水1’ 3.稀酸水解:1N HCl (室温) 1’
1N HCl 60℃水浴 8’ 1N HCl (室温) 1’ 蒸馏水 1’ 对照片以5%三氯醋酸90℃水浴l5’抽提核酸 后,再经稀酸水解。
link
实验四feulgen反应孚尔根光镜标本制作一实验目的?了解dna的显示原理并掌握其操作过程
实验四 孚尔根 (Feulgen)反应
光镜标本制作
切片法: 取材 固定 切片 贴片
非切片法: 1. 涂片法 2. 磨片法 3. 分离法等
脱水 染色
透明 包埋 封片 观察
一、实验目的
了解DNA的显示原理并掌握其操作过程。
link
4.染色: Schiff氏试剂30’-40’
5.分色 :亚硫酸水I、Ⅱ、Ⅲ 各 2’
实验4 Feulgen反应制作细胞DNA定性、定量测量样品

恒温水浴锅两台
四、实验方法
2019/7/4
5
每人做三片:①样品;②对照
固定→酸解→水洗→避光染色→ 亚硫酸水漂洗→水洗→压片→镜检
2019/7/4
6
介绍:RNA显色——Brachet反应
甲基绿-派洛宁为碱性染料,它能分 别于细胞内的DNA和RNA结合而呈现不 同颜色。当甲基绿与派洛宁作为混合染料 时,甲基绿与染色质中的DNA选择性结 合显示绿色或蓝色;派洛宁与核仁、细胞 质中的RNA选择结合显示红色。其原因 可能是两种染料的混合染液中有竞争作用, 同时两种核酸分子都是多聚体,而其聚合 程度有所不同。甲基绿易于聚合程度高的 DNA结合呈现绿色,而派洛宁则与聚合 程度较低的RNA结合呈现红色,但解聚 的DNA也能与派洛宁结合呈现红色。总 的说来,RNA对派洛宁亲和力大,被染 成红色,而DNA对甲基绿亲和力大,被 染成蓝绿色。
二、实验原理
2019/7/4
3
HCl+Na2S2O5→ →亚硫酸根 亚硫酸根+碱性品红→ →无色的亚硫酸品红—Schiff试剂 DNA在60℃,1 mol/L HCl溶液作用下形成半缩醛羟基,
与Schiff试剂反应,形成紫红色化合物。
2019/7/4
4
三、实验器具与药品
•每组学生
复式显微镜(带油浸物镜);擦镜纸;记号笔;小片 滤纸;载玻片;镊子;Carnoy固定液;Schiff试剂; 1mol/L HCl;自来水;香柏油、二甲苯;甲基绿
实验 4
2019/7/4
1
Feulgen反应制作细胞
DNA定性、定量测量样品
一、实验目的
1.掌握临时制片法。 2.熟悉Feulgen反应的原理及操作步骤。 3.观察细胞中DNA的分布
孚尔根反应
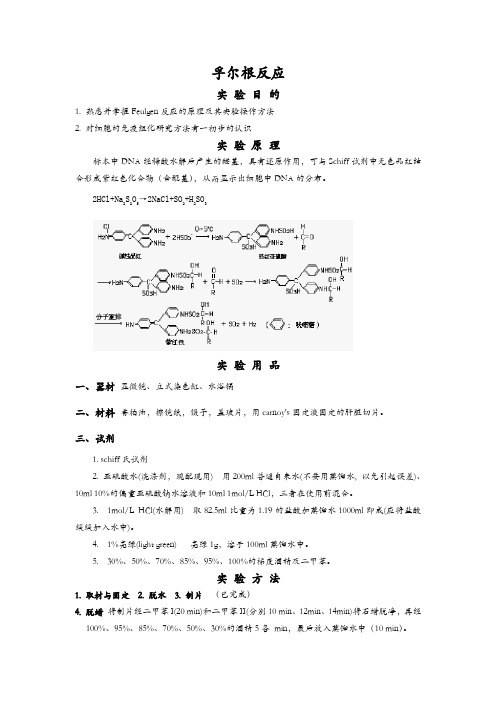
孚尔根反应实验目的1. 熟悉并掌握Feulgen反应的原理及其实验操作方法2. 对细胞的免疫组化研究方法有一初步的认识实验原理标本中DNA经稀酸水解后产生的醛基,具有还原作用,可与Schiff试剂中无色品红结合形成紫红色化合物(含醌基),从而显示出细胞中DNA的分布。
2HCl+Na2S2O5→2NaCl+SO2+H2SO3实验用品一、器材显微镜、立式染色缸、水浴锅二、材料香柏油,擦镜纸,镊子,盖玻片,用carnoy's固定液固定的肝脏切片。
三、试剂1. schiff氏试剂2. 亚硫酸水(洗涤剂,现配现用) 用200ml普通自来水(不要用蒸馏水, 以免引起误差)、10ml 10%的偏重亚硫酸钠水溶液和10ml 1mol/L HCl,三者在使用前混合。
3. 1mol/L HCl(水解用) 取82.5ml比重为1.19的盐酸加蒸馏水1000ml即成(应将盐酸缓缓加入水中)。
4. 1%亮绿(light green) 亮绿1g,溶于100ml蒸馏水中。
5. 30%、50%、70%、85%、95%、100%的梯度酒精及二甲苯。
实验方法1. 取材与固定2. 脱水3. 制片(已完成)4. 脱蜡将制片经二甲苯I(20 min)和二甲苯II(分别10 min、12min、14min)将石蜡脱净,再经100%、95%、85%、70%、50%、30%的酒精5各min,最后放入蒸馏水中(10 min)。
5. 水解先将制片放入一盛有1 mol/L HCl的染色缸内,清洗一下,然后将载片放入已温浴至60℃的1 mol/L HCl溶液中水解8 min。
水解后很快将标本取出,放入室温1 mol/L HCl 溶液中。
注意: 这个步骤非常重要,必须用1 mol/L稀盐酸冲洗,因为它可以洗去贴在切片上的试剂的痕迹。
如用蒸馏水冲洗,则试剂本身也可以水解,所释放出的碱性品红,可以使切片内一切嗜碱性物质皆染色从而引起严重的错误。
若切片较厚,可延长其水解时间,而且每次均需更换洗涤剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1N HCl 60℃
酸解使DNA醛基暴露
醛基与Schiff试剂发生显色反应
孚尔根核染色法是Feulgen和Rossonbek于1924 年提出的鉴定细胞中DNA的组织化学方法。其 优点是制片清洁、染色体清晰、组织软化好, 易于压片。但对小型染色体(如玉米、水稻) 效果较差。在切片、涂片上研究核和染色体时, 能减少细胞质着色对观察的影响。在细胞学研 究中普遍采用
材料:大蒜根尖、洋葱根尖
1mol/L 盐酸(常温和60℃) Schiff试剂 45%醋酸或亮绿
实验步骤
预处理的目的及方法
目的:改变细胞质粘度,破坏和抑制纺锤体 的形成,使染色体适度缩短和分散。
方法: 0.04-0.2%秋水仙素溶液2-4小时。 对二氯苯饱和溶液3-5小时。 0.002M (或0.03%)8-羟基喹啉1.5-2小时以
黑暗条件下染色。 要保证细胞呈单层,使染色体在一个平面上,
根尖的切片尽量要薄,压片必须用力适度,压 片的实验台面要平坦。
实验作业
绘制你所观察到的图象,并说明是有丝 分裂的哪一个时期,并注明放大倍数。
前期、中期、后期、末期
思考题
为什么要严格掌握DNA的水解条件? 为什么实验材料从60℃盐酸中倒出后,
实验原理
有丝分裂是体细胞分裂的主要方式,在植物根尖或茎尖的 分生组织中可清晰观察。在有丝分裂时,细胞核与细胞质有很 大的变化,但以细胞核内染色体的变化最为明显,而且是有规 律地进行。各种生物染色体在数目上和形态上是相对恒定的, 并随科属种的不同而具有一定的特征。大蒜体细胞中有8对共 16条染色体,在有丝分裂过程中,每个染色体能复制一份, 然后分配到两个子细胞中,所以两个子细胞与母细胞所含的染 色体在数目、形态和性质上都是相同的。在细胞遗传学研究中, 人们常常需要了解某一物种的染色体数目,而最有效的方法就 是观察细胞有丝分裂的中期,这样能得到较为准确的结果。
Carnoy’s固定液: 冰醋酸:氯仿:无水乙醇=1:3:6 改良Carnoy’s固定液: 冰醋酸:无水乙醇=1:3
分组:6人一组
1、取材: 每人2-3个根尖置于eppendorf管—— dH2O洗2-3次——1N HCl,室温2分钟。
2、水解 :倒掉HCL,换入60O预热的HCl——60O 水浴10’。去掉热HCl,再换冷HCl,1分 钟,——蒸馏水洗2次
Schiff试剂 的组成及配制
Schiff试剂 :即无色亚硫酸品红。 配制方法:溶解1g碱性品红于200ml煮沸的重蒸
水中,轻轻摇动,继续煮5min使其完全溶解, 冷却至55-50℃时过滤到棕色带塞子的玻璃瓶中, 加入1N HCl 20 ml,继续冷却至25 ℃左右,再 加入1g偏重亚硫酸钠,摇动使之溶解,置黑暗低 温处或冰箱内18-24小时后检查,试剂如透明无 色或淡黄色即可使用。
3、染色: 吸净水分,加入Schiff试剂,盖上盖子, 暗处染色30’——漂洗液漂洗2次,2分钟/次
4、取根尖置于载玻片上,用镊子夹碎后,再加 一滴45%的醋酸,软化5min,压片镜检。
HE XI UNIVERSITY
根尖形态与结构
成熟区 伸长区
分生区 根冠
注意事项
Schiff试剂小心取放,及时清洗吸取Schiff试剂 的吸管。
实验 四
植物有丝分裂的孚尔根 (Feulgen)核染色观察
实验目的
掌握孚尔根核染色的方法。 了解孚尔根染色的原理。 有丝分裂
实验原理
孚尔根染色法是鉴别细胞中DNA的组织 化学方法.
DNA—1NHCl,60OC水解,部分地破坏核 糖与嘌呤之间的糖苷键—嘌呤碱脱掉—核 糖的C1上的醛基呈游离态—与Schiff试剂 的无色亚硫酸品红分子反应——呈现为紫 红色的化合物。
材料从60℃的盐酸倒出后温度还相当高,如 果直接转入Schiff试剂中,则会使Schiff试剂发 生分解影响效果。所以我们首先要把材料转入 室温的盐酸溶液中,做一个缓冲以避免Schiff 试 剂分解。
为什么RNA在此过程中不会着色?
由于在酸解条件下,RNA较DNA分子更 加稳定,它的醛基难以游离,所以在用 Schiff试剂染色时RNA分子不会着色。
前期(prophase)
染色体逐渐变得清晰可辨,缩短变粗,收缩成 螺旋状,核仁逐渐消失,核膜开始破裂,核质 和细胞质融为一体。
前中期(premetaphase)
纺锤体逐渐明显,在核区形成 ,着丝粒附着在纺锤 丝上。
中期(metaphase)
后期(anaphase)
着丝粒纵裂为二,姐妹染色单体彼此分离,各自移向 一极,染色体的两臂由着丝粒拖曳移动。
使组织内各种物质成分产生不同的折射率,便 于鉴定、观察。
使不同组织成分对染料有不同的亲和力,便于 染色。
防止细胞过度收缩或膨胀,失去原有的形态结 构。
固定液
简单固定液:如乙醇、甲醛、冰醋酸、 升汞等。
混合固定液:如Carnoy’s固定液、AF液 (乙醇:甲醛=9:1)
Carnoy’s固定液
漂洗液——200ml水+10ml 1 M HCl+1g偏 亚硫酸钾(钠)
背背景景知知识识
有丝分裂(mitosis)是细胞分裂的方式,每个 子细胞精确地具有和亲代细胞在数目上及形态上完 全相同的染色体,以保证子细胞含有与母细胞相等 的遗传信息。有丝分裂时,染色体呈现连续的、动 态的变化,一般分为间期、前期、中期、后期和末 期5个时期。从间期到前期和中期,每条染色体为 两条染色单体。从后期到末期,直到下一个细胞周 期的G1期,其染色体实质上只是一条染色单体。在 光学显微镜下,可根据染色体的收缩程度、集结等 特征来确定一个细胞所处的分裂时期。
细胞类型
体细胞
生殖细胞
DNA复制 细胞分裂次数
染色体数目
一次
一次
一次
二次
不变(2n 2n) 减半(2n n)
DNA含量由4c 2c DNA含量由4c c
联会、互换
无
有
实验原理
有丝分裂是一个复杂的连续过程,细胞 内发生了一系列的变化,最主要的是细胞核 内的染色质形成了染色体。经过复制,每条 染色体复制成为两条。有规则地平均分配到 两个子细胞中去
还要放入室温的盐酸中呢? 为什么RNA在此过程中不会着色?
为什么要严格掌握DNA的水解条件?
温度过低,时间过短:则DNA的水解不 够彻底,醛基暴露不充分,染色会过浅。
温度过高,时间过长:则DNA过度水解, 游离的核苷酸会漂移到细胞质中,造成 染色浅或不均一 。
为什么要在实验材料从60℃盐酸中倒 出后,再放入室温的盐酸中呢?
上,室温。 低温:1-4℃处理24小时。
固定:将新鲜的活组织从生物体取下后, 立即投入固定剂中,借助化学药品的作 用,使细胞保持原有形态结构的一种手 段。
固定的目的
迅速防止细胞的死后变化,防止自溶、腐败, 尽量保持生长状态结构。
使细胞中的蛋白质、脂肪、糖、酶等成分转变 为不溶性物质,以保持生前状态。
末期(telophase)
子细胞的染色体凝 缩为一个新核,在核的 四周核膜重新形成,染 色体又变为均匀的染色 质,核仁又重新出现。 纺锤体被降解,细胞质 被新的细胞膜分隔成两 部分,结果产生2个子 细胞,其染色体和原来 细胞中完全一样。
减
数
分期Ⅰ
分
中期Ⅱ
中期
裂
的
后期Ⅱ
后期
比
较
有丝分裂 减数分裂
