实验三 孚尔根染色法
植物染色体的孚尔根染色法(2021精选文档)

玉米染色体核型图(2n=20), Feulgen 染色
玉米染色体核型图(2n=20+2B)
玉米染色体核型图(2n=20+4B) /mnl/79/18rosado.htm
Rye, Secale cereale, 2n=2x=14+2B (standard B), metaphase I pairing with 5II ring + 2II rod + 1B rod, FEULGEN staining
– 在细胞内只有DNA才具有这种反应, 故可定性地鉴定细胞核内 DNA的存在。
– 这一染色方法是Feulgen和Rossenbeck于1924年首先发现和确定的, 故称孚尔根染色法。
二、实验目的
• 在熟悉火焰干燥法制片的基础上, 掌握弗尔 根染色法, 并观察有丝分裂的各个时期
三、材料、方法、器具、药品
• 当滤液冷却至26C时, 再加入10ml的1M盐酸和0.5g亚硫酸氢钠 或偏重亚硫酸钠(钾), 摇动, 溶解后密封于棕色瓶中, 置于黑暗 低温处。次日检查溶液颜色, 须呈无色透明或淡茶色才可使用。
• 若稍呈红色可加入0.5g活性炭连续摇动, 在4C下பைடு நூலகம்置过夜, 然 后过滤脱色。
2. 染色过程
① 取固定好的根尖, 用水洗2-3分钟, 放入室温条件下的1N HCl处理根尖 材料2-3分钟。
② 将根尖换入60℃预热的HCl, 置于恒温水浴中, 在600.5℃的条件下水 解8-10分钟。
③ 吸出热HCl, 换入室温1N HCl再处理1-2分钟, 然后水洗2-3次。 ④ 吸净水分, 加入Schiff试剂, 盖上盖子, 在黑暗条件下染色30分钟, 也可
过夜。 ⑤ 用水漂洗, 去掉细胞中残存的一些有色的品红分子。 ⑥ 取根尖置载玻片上, 用镊子夹碎后, 加一滴45醋酸, 然后盖上盖片。 ⑦ 压片、观察。
实验三 DNA的Feulgen染色法

四、实验材料及实验器材
1. 材料 Carnoy液固定的大蒜根尖 液固定的大蒜根尖 洋葱根尖纵切永久制片 马蛔虫卵切片永久制片 2. 实验器材 显微镜、恒温水浴锅、温度计、镊子、解剖针、刀片、 显微镜、恒温水浴锅、温度计、镊子、解剖针、刀片、 剪 冰箱、温箱、天平、载玻片、盖玻片、吸水纸、 刀、冰箱、温箱、天平、载玻片、盖玻片、吸水纸、镜头 青霉素瓶、吸管、烧杯、量筒。 纸、青霉素瓶、吸管、烧杯、量筒。
植物细胞的细胞质分裂
洋葱根尖纵切永久制片观察(同大蒜根尖) 2 洋葱根尖纵切永久制片观察(同大蒜根尖) 3 马蛔虫受精卵切片永久制片观察 马蛔虫是真核生物中染色体数目最少的物种, 马蛔虫是真核生物中染色体数目最少的物种,二倍体马 蛔虫的染色体数目为2条或4 三倍体为6 蛔虫的染色体数目为2条或4条,三倍体为6条。在观察切 片时要注意所观察卵的染色体数目的不同。 片时要注意所观察卵的染色体数目的不同。 注意 : 1)马蛔虫受精卵是动物细胞,在细胞分裂过程中与植物细 马蛔虫受精卵是动物细胞, 马蛔虫受精卵是动物细胞 胞有所不同。首先最明显的不同就是, 胞有所不同。首先最明显的不同就是,植物细胞的赤道板 在后期可形成细胞板,而动物细胞却不能。 细胞的整体 在后期可形成细胞板,而动物细胞却不能。2)细胞的整体 分裂形式也不太一样,植物细胞是细胞板的缢裂, 分裂形式也不太一样,植物细胞是细胞板的缢裂,动物细 胞是细胞膜中部向内凹陷缢裂成两个子细胞。 再有 再有, 胞是细胞膜中部向内凹陷缢裂成两个子细胞。3)再有,高 等植物细胞内没有中心体。马蛔虫的细胞内有中心体, 等植物细胞内没有中心体。马蛔虫的细胞内有中心体,在 有丝分裂过程中,中心体会进行复制,然后发出星射线ቤተ መጻሕፍቲ ባይዱ 有丝分裂过程中,中心体会进行复制, 引染色体等等。 引染色体等等。
植物染色体的孚尔根染色法

四、实验步骤
1. 希夫试剂的配制
• 将0.5g碱性品红徐徐加入煮沸的 碱性品红徐徐加入煮沸的100ml蒸馏水中 用玻璃棒搅拌 蒸馏水中, 碱性品红徐徐加入煮沸的 蒸馏水中 用玻璃棒搅拌, 使之充分溶解, 待溶液冷却至58°C左右 过滤于棕色瓶中。 使之充分溶解 待溶液冷却至 ° 左右, 过滤于棕色瓶中。 左右 • 当滤液冷却至 °C时, 再加入 当滤液冷却至26° 时 再加入10ml的1M盐酸和 盐酸和0.5g亚硫酸氢钠 的 盐酸和 亚硫酸氢钠 或偏重亚硫酸钠(钾 摇动, 溶解后密封于棕色瓶中, 或偏重亚硫酸钠 钾), 摇动 溶解后密封于棕色瓶中 置于黑暗 低温处。次日检查溶液颜色, 须呈无色透明或淡茶色才可使用。 低温处。次日检查溶液颜色 须呈无色透明或淡茶色才可使用。 • 若稍呈红色可加入 若稍呈红色可加入0.5g活性炭连续摇动 在4°C下静置过夜 然 活性炭连续摇动, 下静置过夜, 活性炭连续摇动 ° 下静置过夜 后过滤脱色。 后过滤脱色。
2. 染色过程
① 取固定好的根尖, 用水洗2-3分钟, 放入室温条件下的1N HCl处理根尖 材料2-3分钟。 ② 将根尖换入60℃预热的HCl, 置于恒温水浴中, 在60±0.5℃的条件下水 解8-10分钟。 ③ 吸出热HCl, 换入室温1N HCl再处理1-2分钟, 然后水洗2-3次。 ④ 吸净水分, 加入Schiff试剂, 盖上盖子, 在黑暗条件下染色30分钟, 也可 过夜。 ⑤ 用水漂洗, 去掉细胞中残存的一些有色的品红分子。 ⑥ 取根尖置载玻片上, 用镊子夹碎后, 加一滴45%醋酸, 然后盖上盖片。 ⑦ 压片、观察。
玉米染色体核型图(2n=20), Feulgen 染色
玉米染色体核型图(2n=20+2B)
玉米染色体核型图(2n=20+4B) /mnl/79/18rosado.htm
DNA的原位显示—Feulgen染色法

Carnoy固定液:3份95%酒精加入1份冰醋酸。固定显 示DNA、RNA的效果好
,否则会使染色剂浓度降低。
• 漂洗时,所用的亚硫酸水,最好在每次实验前
临时配制,以便保持较浓的SO2。
• 加盖玻片时,切勿用力过大。
『其他固定液』
Flemming固定液:1%铬酸水溶液 25ml,1%冰醋酸 (用前加入)10ml,蒸馏水 60ml
Champy固定液:3%重铬酸钾 70ml,1%铬酸 70ml,2% 锇酸 40ml
『实验原理』 DNAຫໍສະໝຸດ 弱酸(1M的HCL)水解,其上的嘌呤碱和脱氧
核糖之间的键打开,使脱氧核糖的一端形成游离的醛 基,这些醛基在原位与Schiff试剂(无色品红亚硫酸 溶液)反应,形成紫红色的化合物,使细胞内含有DNA 的部位呈紫红色阳性反应。紫红色的产生是因为反应 产物的分子内含有醌基,醌基是一个发色团,所以具
『思考题』
欲得到一张好的Feulgen反应制片,制片过程 中应注意些什么?
• 水解是本实验成败关键之一。水解时间和温度
一定要合适,如果温度过高或时间过长,造成 水解过度,醣与醛基之间的键被破坏,醛基流 失到水解液中,反之,不能出现潜在的醛基, 都不能呈现颜色反应。
• 用Schiff试剂染色前,蒸馏水的残留不宜过多
4、Schiff液黑暗条件下染色30-50min(避光: 因为生成不稳定的物质,见光很容易分 解)。
5、用新配制的亚硫酸氢钠溶液洗3次,每次 约5min。(洗去无色品红,在自然条件下 易还原为碱性品红)
6、用清水洗2次,每次2min。 7、取一根尖置于载玻片上,切下生长区部位
孚尔根染色

孚尔根染色法中Schiff试剂配方的研究一、实验目的1、进一步深入了解孚尔根染色的基本原理2、探究尝试用非传统的方法配置Schiff试剂并观察其染色效果二、实验原理DNA是遗传的物质基础,应用Feulgen反应法显示细胞DNA是常用的组化染色技术,其中Sehitt试剂是染色成败的关键因素。
Sehiit试剂(希夫试剂),又称品红醛试剂,与醛类反应呈紫红色。
它有多种不同的配制方法,归结起来有经典热配法以及冷配法。
实验室经常采用的热配法,配制过程繁琐,常会因一个步骤的偏差而造成配制失败,实验中尝试改用冷配法,可收到与热配法同样的染色效果。
Schiff试剂的主要成分是碱性品红,属三氨基三苯甲烷类,它由副品红、品红、二号碱性品红组成四。
碱性品红在酸性环境下与亚硫酸盐作用,生成无色品红。
其配制方法有2种:热配法(将碱性品红加热煮沸)是通过热效应来加速分子运动,使染料溶解与脱色;冷配法(室温下采用振荡或搅拌的方法)是通过增加分子间的碰撞,促进染料溶解与脱色。
2种方法的反应机制相同。
三、实验器材实验材料:蚕豆根尖实验器具:显微镜、载玻片、盖玻片、电炉、滤纸、烧杯、纱布、量筒、锥形瓶、标签、刀片、容量瓶实验药品:蒸馏水、卡诺氏液、0.1mol/L的盐酸、碱性品红、盐酸、偏重亚硫酸钠、活性炭。
四、实验方法1.浸种催芽选择无虫、饱满、大小均匀的蚕豆种子50粒放入蒸馏水的烧杯中, 25℃浸泡24h,其中换水1次。
种子吸胀后,在培养皿中铺一层脱脂棉,倒入足量的蒸馏水,将种子置于其中25 ℃培养2至3天,期间随时补充水分,大部分初生根长至1~2cm左右。
2.不同试剂配置1. 热配法(常规法)称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角瓶),时时振荡,继续煮5min(勿使之沸腾),充分溶解。
然后冷却致50℃时用滤纸过滤,滤液中加入10ml1mol/L HCl,冷却致25℃时,加入0.5g偏重硫酸钠,充分振荡后,塞紧瓶塞,在室温暗处静置至少24h(有时需要2至3天),使其颜色退至淡黄,然后加入0.5g 活性碳,用力振荡一分钟,最后用粗滤纸过滤于棕色瓶中,封瓶塞,外包黑纸。
实验三孚尔根染色法

实验三孚尔根染色法一、实验原理染色体是遗传物质的载体,它的主要化学成分是脱氧核糖核酸(DNA),DNA系核苷酸的多聚体,核苷酸又由碱基脱氧核糖和磷酸所组成,当细胞经60℃、1mol?1-1HCl处理后,不仅使分生组织的细胞彼此分离,而且可以破坏核内DNA链上的嘌呤碱与脱氧核糖之间的糖苷键,嘌呤脱下,脱氧核糖上的醛基暴露,形成含醛基的无嘌呤结构物,醛基与希夫试剂反应显紫红色。
细胞中只有DNA才具有这种专一的孚尔根反应,因此所以根据紫红色出现的部位就可鉴定脱氧核糖核酸(DN A)的存在,并广泛应用于核及染色体的研究中。
二、实验目的学习和掌握孚尔根反应染色法,鉴定植物细胞核内染色体上DNA的存在。
三、实验材料、用具及药品1.材料:洋葱或大蒜的根尖2.用具显微镜、恒温水浴锅、温度计、镊子、解剖针、刀片、冰箱、温箱、天平、载玻片、盖玻片、吸水纸、吸管、烧杯、量筒、3.药品希夫氏试剂(无色碱性品红液)、漂洗液、1m ol?1-1 HCl、45%醋酸等。
四、实验步骤1. 取材与固定:待大蒜根尖长1cm时,于上午8时剪下根尖,经过预处理后投入卡诺固定液中固定2-24h。
固定后,保存在70%的酒精中,放入冰箱中冷藏供用。
2.水解试管1:取大蒜根尖数条,投入试管,先用清水洗3次,换1N H Cl洗一次,倾去,换入预热60℃的1NHCl 浸没根尖,放入恒温水浴锅中在60±0.5℃下水解10分钟(视材料而定,水解时间可以从10分钟延长至30分钟)。
然后吸去热1N HCl,换入冷1N HCl洗一次,再用清水将根尖洗三次。
试管2(对照)取大蒜根尖数条,投入试管,先用清水洗3次,入预热60℃的蒸馏水浸没根尖,放入恒温水浴锅中在60±0.5℃下水解10分钟。
《孚尔根核染色》课件

染色过程
孚尔根核染色包括几个关键步骤:细 胞固定、细胞通透性处理、DNA氧化 、染色和观察。
染色过程需要在弱酸条件下进行,以 促进DNA的氧化和后续的染色反应。
在染色过程中,需要使用特定的染料 ,如Giemsa染料或巴尔巴土染料,这 些染料能够与DNA-蛋白质加合物结 合,产生明显的染色效果。
染色效果
政策支持
政府可以出台相关政策, 支持孚尔根核染色技术的 研发和应用,促进其发展 壮大。
感谢您的观看
THANKS
该技术可用于DNA多态性分析 ,有助于研究基因变异与疾病 的关系。
技术局限性
1 样本量要求
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
2 交叉污染风险
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
3 假阳性结果
孚尔根核染色技术需要一定量的样本才能进行检测,对 于微量样本可能存在限制。
减少人工操作误差。
降低成本
通过优化试剂和设备, 降低检测成本,使更多 实验室和医疗机构能够
应用该技术。
05
孚尔根核染色技术的未来发展
技术发展趋势
自动化与智能化
随着机器人技术和人工智能的发展,孚尔根 核染色技术将逐渐实现自动化和智能化,提 高染色效率和准确性。
环保与可持续发展
随着环保意识的提高,未来的孚尔根核染色 技术将更加注重环保和可持续发展,减少对 环境的污染和资源消耗。
《孚尔根核染色》PPT课件
目录
• 引言 • 孚尔根核染色技术原理 • 孚尔根核染色技术的应用 • 孚尔根核染色技术的优缺点 • 孚尔根核染色技术的未来发展
01
引言
核染色技术简介
孚尔根反应
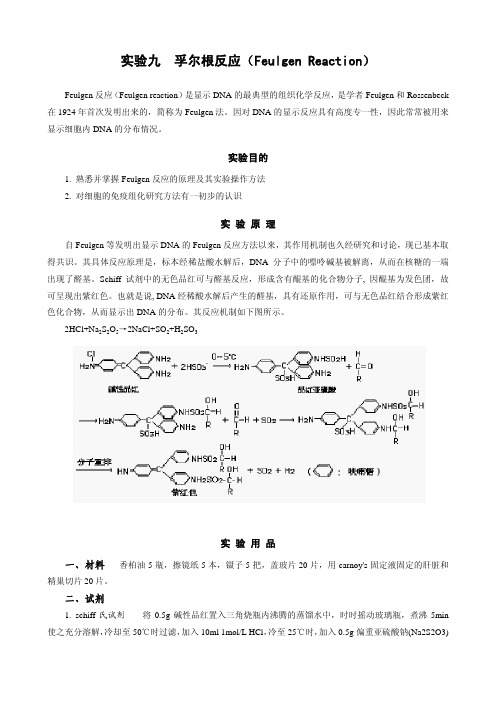
实验九 孚尔根反应(Feulgen Reaction)Feulgen反应(Feulgen reaction)是显示DNA的最典型的组织化学反应,是学者Feulgen和Rossenbeck 在1924年首次发明出来的,简称为Feulgen法。
因对DNA的显示反应具有高度专一性,因此常常被用来显示细胞内DNA的分布情况。
实验目的1. 熟悉并掌握Feulgen反应的原理及其实验操作方法2. 对细胞的免疫组化研究方法有一初步的认识实验原理自Feulgen等发明出显示DNA的Feulgen反应方法以来,其作用机制也久经研究和讨论,现已基本取得共识。
其具体反应原理是,标本经稀盐酸水解后,DNA分子中的嘌呤碱基被解离,从而在核糖的一端出现了醛基。
Schiff试剂中的无色品红可与醛基反应,形成含有醌基的化合物分子, 因醌基为发色团,故可呈现出紫红色。
也就是说, DNA经稀酸水解后产生的醛基,具有还原作用,可与无色品红结合形成紫红色化合物,从而显示出DNA的分布。
其反应机制如下图所示。
2HCl+Na2S2O5→2NaCl+SO2+H2SO3实验用品一、材料 香柏油5瓶,擦镜纸5本,镊子5把,盖玻片20片,用carnoy's固定液固定的肝脏和精巢切片20片。
二、试剂1. schiff氏试剂将0.5g碱性品红置入三角烧瓶内沸腾的蒸馏水中,时时摇动玻璃瓶,煮沸5min 使之充分溶解,冷却至50℃时过滤,加入10ml 1mol/L HCl,冷至25℃时,加入0.5g偏重亚硫酸钠(Na2S2O3)无水亚硫酸钠(NaHSO3),在室温冷暗处至少放置24h(有时需2~3天),使其颜色退至淡黄色,密封瓶口,藏于暗处,最好保存于4℃冰箱中(可保存数月或更长时间)。
在使用前加入0.5g活性碳, 摇1min, 用粗滤纸过滤,滤液应为无色;若液体颜色变为粉红色,便不能再用。
2. 亚硫酸水(洗涤剂) 用200ml普通自来水(不要用蒸馏水, 以免引起误差)、10ml 10%的偏重亚硫酸钠水溶液和10ml 1mol/L HCl,三者在使用前混合,现用现配。
富(孚)尔根(Feulgen)核染色

立即投入固定剂中,借助化学药品的作
用,使细胞保持原有形态结构的一种手 段。
固定的目的
迅速防止细胞的死后变化,防止自溶、腐败,
尽量保持生长状态结构。 使细胞中的蛋白质、脂肪、糖、酶等成分转变 为不溶性物质,以保持生前状态。 使组织内各种物质成分产生不同的折射率,便 于鉴定、观察。 使不同组织成分对染料有不同的亲和力,便于 染色。 防止细胞过度收缩或膨胀,失去原有的形态结 构。
实验 二 植物有丝分裂的孚尔根 (Feulgen)核染色观察
实验目的
掌握孚尔根核染色的方法。 了解孚尔根染色的原理。
有丝分裂
实验原理
浮尔根染色法是鉴别细胞中DNA的组织
化学方法. DNA—1NHCl,60OC水解,部分地破坏核 糖与嘌呤之间的糖苷键—嘌呤碱脱掉—核 糖的C1上的醛基呈游离态—与Schiff试剂 的无色亚硫酸品红分子反应——呈现为紫 红色的化合物。
能减少细胞质着色对观察的影响。在细胞学研
究中普遍采用
Schiff试剂 的组成及配制
Schiff试剂 :即无色亚硫酸品红。 配制方法:溶解1g碱性品红于200ml煮沸的重蒸
水中,轻轻摇动,继续煮5min使其完全溶解,
冷却至55-50℃时过滤到棕色带塞子的玻璃瓶中,
加入1N HCl 20 ml,继续冷却至25 ℃左右,再
根尖形态与结构成熟区H XI UNIVERSITY伸长区
分生区
根冠
注意事项
Schiff试剂小心取放,及时清洗吸取
Schiff试剂的吸管。
黑暗条件下染色。
实验作业
绘制你所观察到的图象,并说明是有丝
分裂的哪一个时期,并注明放大倍数。
前期、中期、后期、末期
孚尔根(FEULGEN) 染色

Schiff 试剂的配置
称取0.5g碱性品红加入到100ml煮沸的蒸馏水中(用三角烧瓶), 时时振荡,继续煮 5分钟(勿使之沸腾),使之充分溶解。然 后冷却至50℃时用滤纸过滤,滤液中加入10ml 1N HCl,冷却至 25℃时,加入0.5g Na2S2O5(偏重亚硫酸钠或钾),充分振荡 后,塞紧瓶塞,在室温暗处静置至少24小时(有时需2~3天), 使其颜色退至淡黄色,然后加入0.5g活性炭,用力振荡1分钟, 最后用粗滤纸过滤于棕色瓶中,封严瓶塞,外包黑纸。滤液应 为无色也无沉淀,贮于4℃冰箱中备用。如有白色沉淀,就不 能再使用,如颜色变红,可加入少许偏重亚硫酸钠或钾,使之 再转变为无色时,仍可再用
反应原理
样品经稀盐酸水解后,DNA分子中的嘌呤 碱基被解离,从而在核糖的一端出现了醛 基。Schiff试剂中的无色品红可与醛基反应, 形成含有醌基的化合物分子, 因醌基为发色 团,故可呈现出紫红色。也就是说, DNA经 稀酸水解后产生的醛基,具有还原作用, 可与无色品红结合形成紫红色化合物,从 而显示出DNA的分布。
操作方法及步骤
以Feulgen染色法观察洋葱根尖有丝分裂为例
•1.将洋葱根尖或鳞茎内表皮放在1N HCl中, 加热到60℃水解8~10 min。 • 2.蒸馏水水洗。 •3.Schiff试剂遮光染色30min。 •4.用新鲜配制的亚硫酸水溶液洗3次,每次 1min。 • 5.水洗5min。 •6.将根尖放在载玻片上,镊子捣碎,盖上盖 玻片,压片(洋葱表皮可省去压片这一步)。 • 7.显微镜检查。 结果:细胞中凡有DNA的部 位应呈现紫红色的阳性反应。
孚尔根染色法的反应原理主要与Schiff试剂的化学性质有关,此试剂的基本 成分是碱性品红,偏亚硫酸氢钠(NaHSO3)和盐酸.碱性品红的主要成分是 三氨基三苯甲烷氯化物。
实验三、DNA的原位显示--福尔根染色法
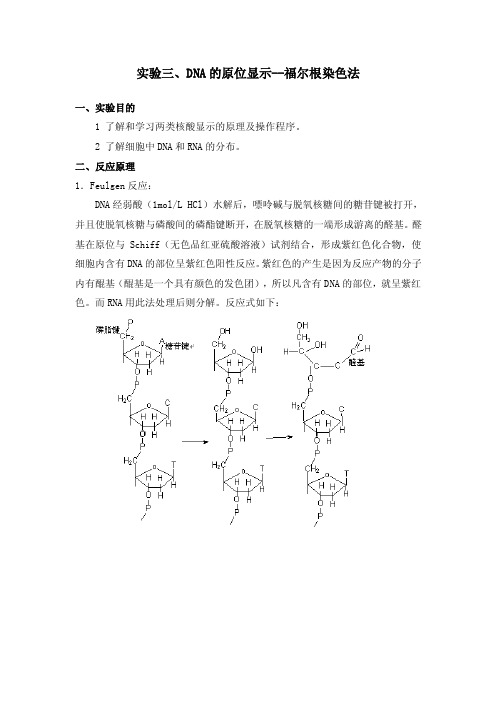
实验三、DNA的原位显示--福尔根染色法一、实验目的1 了解和学习两类核酸显示的原理及操作程序。
2 了解细胞中DNA和RNA的分布。
二、反应原理1.Feulgen反应:DNA经弱酸(1mol/L HCl)水解后,嘌呤碱与脱氧核糖间的糖苷键被打开,并且使脱氧核糖与磷酸间的磷酯键断开,在脱氧核糖的一端形成游离的醛基。
醛基在原位与Schiff(无色品红亚硫酸溶液)试剂结合,形成紫红色化合物,使细胞内含有DNA的部位呈紫红色阳性反应。
紫红色的产生是因为反应产物的分子内有醌基(醌基是一个具有颜色的发色团),所以凡含有DNA的部位,就呈紫红色。
而RNA用此法处理后则分解。
反应式如下:2.Unna染色法:1899年Pappenheim 首创了甲基绿-哌洛宁(mehtyl-green-pyronim)染色法。
1902年Unna对这一方法进行了改良。
1940年Brachet研究证明用甲基绿—哌洛宁对DNA和RNA有选择性的染色效果。
碱性的甲基绿-哌洛宁混合染料处理细胞后,由于DNA、RNA对染料具有的亲和力不同,而使这两种染料对两类核酸具有了选择性。
DNA被甲基绿染成绿色,RNA 被哌洛宁染成红色,这样就能使细胞中两种核酸分布显示出来。
三、材料、试剂和仪器1.材料洋葱根尖,洋葱鳞茎表皮细胞2.试剂1)Carnoy固定液:无水乙醇:冰醋酸 = 3:12)95% 乙醇3)70% 乙醇: 95% 乙醇 70mL 加水 25 mL4) 5% 三氯乙酸(TCA):固体TCA 5g,加水溶解到100 mL。
5) 1N HCl (当量盐酸)6) Schiff 试剂:煮沸200mL 水,稍冷放入1g 碱性品红,充分搅拌有助溶解,50℃时过滤,置磨口棕色瓶内,向滤液中加1N HCl 20mL ,待25℃时加亚硫酸氢钠或亚硫酸钾 1g ,盖严放暗处,静止勿动,几天后,红色稍退,溶液呈无色或淡黄色,即可使用,如有红色,可加一勺活性炭,振荡过滤,黑布罩好。
期末实验 孚尔根染色法和植物染色体标本的制备

期末实验孚尔根染色法和植物染色体标本的制备207.12.1 6.结果与分析6.1结果(1)孚尔根染色结果图1.洋葱根尖分生区孚尔根DNA染色结果(10×10倍)图2.洋葱根尖分生区孚尔根DNA染色结果(10×40倍)①结果描述:在光学显微镜下,洋葱根尖细胞被均匀地压成了单层细胞,细胞分布较为均匀,变形细胞较少。
DNA成功被染上紫色,染色较深,视野背景为白色无红色颗粒较为清晰,视野中无气泡。
处于分裂时期的细胞约占10%,分裂期的细胞染色体染色较深,而分裂间期的染色较浅,中间有1-3个白斑为核仁。
②结果评价:较成功③结果分析:在物镜10倍观察下可以清晰反映出压片的结果与染色的情况。
在压片前要注意用亚硫酸水把染液冲洗干净,防止背景一片红,不利于观察,压片时先把根尖捣碎,防止细胞堆积;在压片时要固定好盖玻片防止盖玻片与载玻片之间发生摩擦,防止细胞变形,同时也要注意力度的把握和敲击的方向,垂直敲打,且从中间到边缘。
染色的时间要足够长,这是我实验时制作的第二张装片,染色时间为18min,第一张为10min,染色较浅,不利于观察。
视野中,由于分裂期的染色质高度螺旋为染色体,DNA浓度较高,所以分裂期的染色体染色较深,而分裂间期的细胞,DNA分裂较为均匀,所以染色较为均匀且相对浅,中间的白斑为核仁,因为核仁中主要为rRNA,所以不被染成紫色。
A B C DE F G HI J K LM N O P图2.洋葱根尖分生区孚尔根DNA染色有丝分裂过程(10×40倍)①结果描述:A间期:DNA均匀分部于细胞核中,核仁明显,为透明发亮圆形,可见1—3个。
B-E前期:细胞核膨大,染色质缩短变粗,晚前期(D、E)核仁、核膜消失。
F-G中期:染色体缩短变粗,形成姐妹染色单体,整齐排列与赤道板上。
H-L后期:着丝粒分裂,姐妹染色单体分离,分别移向细胞两极。
M-P末期:染色体解旋为染色质,核仁核膜重新出现,细胞中间形成细胞板。
孚尔根

课程名称:细胞生物学指导老师:成绩:__________________实验名称:孚尔根染色同组学生姓名:一、实验目的和要求(必填)二、实验内容和原理(必填)三、实验材料与试剂(必填)四、实验器材与仪器(必填)五、操作方法和实验步骤(必填)六、实验数据记录和处理七、实验结果与分析(必填)八、讨论、心得一、实验目的1.以Feulgen染色法为例学习细胞化学方法检测细胞核DNA的原理和方法;2.观察DNA在细胞内的分布。
二、实验原理孚尔根反应分为水解和显色两个步骤。
在水解过程中,细胞中DNA经1N60℃盐酸水解后,DNA双螺旋结构中的嘌呤与脱氧核糖之间的连接打开,使脱氧核糖的第一碳原子上形成游离的醛基,这些醛基与Schiff氏试剂作用,形成紫红色的三苯甲烷衍生物。
Schiff试剂是由碱性品红和偏重亚硫酸钠相作用,形成无色的品红液,当无色品红与醛基结合形成紫红色的化合物。
紫红色的产生,是由于反应产物的分子内含有醌基,醌基是一个发色基团,所以具有颜色。
因此凡有DNA的地方,都能显示紫红色。
但是,细胞中除了DNA酸解会产生醛基之外,多糖等物质也会产生醛基,此外细胞中可能还有自由醛基,但多糖的醛基不会再该反应条件下裸露,而且自由醛基可被盐酸消除;此外,细胞中的RNA也不被染色。
目前认为,RNA的N-糖苷键较为稳定,在孚尔根反应的酸解条件下,其嘌呤碱基不会易被脱去。
故只有DNA不完全水解出来的醛基才能与Schiff试剂反应生成紫红色产物;由于线粒体,叶绿体的结构原因,内部的DNA也不被染色。
从而,孚尔根反应时对细胞中核DNA高度专一的一种检测手段。
材料不经过水解或预先用热的三氯醋酸或DNA酶处理,得到的反应是阴性的,从而证明了Feulgen反应的专一性。
三、实验材料与试剂器材:显微镜、盖玻片、染色缸、眼科剪、解剖刀、镊子、水浴锅试剂:Schiff试剂,亚硫酸水溶液,1mol/L HCl,5%三氯醋酸材料:洋葱鳞茎四、实验步骤1.撕取小块洋葱内表皮,放入10mL预热的60°C的1mol/L HCl中温育水解8-10分钟。
实验三孚尔根反应

实验三孚尔根反应实验三孚尔根(Feulgen)反应⼀、实验⽬的:(1)熟悉并掌握孚尔根反应得原理及实验操作⽅法。
(2)对细胞的免疫组织化学研究⽅法有⼀初步的认识。
⼆、实验原理:标本经稀盐酸⽔解后,DNA分⼦中的嘌呤碱基被解离,从⽽在核糖的⼀端出现了醛基。
Schiff试剂中的⽆⾊品红可与醛基反应,形成含有醌基的化合物分⼦,因醌基为发⾊团,故可呈现出紫红⾊。
也就是说,DNA经稀酸⽔解后产⽣的醛基,具有还原作⽤,可与⽆⾊品红结合成紫红⾊化合物,从⽽显⽰出DNA的分布。
三、实验⽤品:1、材料:镊⼦、盖玻⽚、⽤carnoy固定液固定的肝脏切⽚。
2、试剂:(1)schiff试剂1瓶。
(2)亚硫酸⽔(洗涤剂)3瓶。
(3)1mol/L HCl(⽔解)1瓶。
(4)1%亮绿1瓶。
(5)30%,50%,70%,85%,95%,100%的酒精各1瓶,100%的酒精2瓶。
(6)⼆甲苯3瓶。
3、器材:显微镜、⽴式染⾊缸。
四、实验⽅法:1、脱⽔:依次经过95%酒精两次,每次20-30分钟;100%酒精两次,分别为30分钟、40分钟。
2、制⽚:⼆甲苯透明,⽯蜡包埋,切⽚6-7µm,动物胶(明胶)贴⽚,烘⼲。
在贴⽚时应滴加1-2滴10%甲醛予以固定,否则很容易脱⽚。
(以上两部实验前已经准备完成)3、脱蜡:将制⽚经⼆甲苯Ⅰ(20分钟)和⼆甲苯Ⅱ(10分钟)将⽯蜡脱净。
4、复⽔:将制⽚分别放⼊100%Ⅰ,95%,85%,70%,50%,30%的酒精各5分钟,再放⼊蒸馏⽔中10分钟,然后⽤1mol/L HCl冲洗⼀下。
5、⽔解:将制⽚放⼊已温浴⾄60℃的1mol/L HCl溶液⽔解8分钟(对照不⽔解),然后⽤蒸馏⽔洗3次。
6、染⾊:⽤schiff试剂染⾊1个⼩时。
7、洗涤:⽤亚硫酸溶液⽔洗3次,每次3分钟。
8、⽔洗:⽤蒸馏⽔洗3-5次。
9、复染:⽤1%亮绿复染数秒(3个制⽚所⽤时间依次为20s、30s、50s),然后⽤蒸馏⽔洗2次,每次5分钟。
孚尔根反应
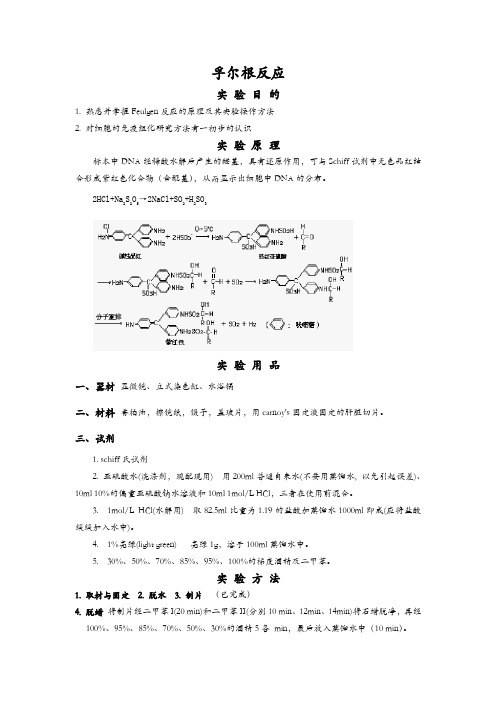
孚尔根反应实验目的1. 熟悉并掌握Feulgen反应的原理及其实验操作方法2. 对细胞的免疫组化研究方法有一初步的认识实验原理标本中DNA经稀酸水解后产生的醛基,具有还原作用,可与Schiff试剂中无色品红结合形成紫红色化合物(含醌基),从而显示出细胞中DNA的分布。
2HCl+Na2S2O5→2NaCl+SO2+H2SO3实验用品一、器材显微镜、立式染色缸、水浴锅二、材料香柏油,擦镜纸,镊子,盖玻片,用carnoy's固定液固定的肝脏切片。
三、试剂1. schiff氏试剂2. 亚硫酸水(洗涤剂,现配现用) 用200ml普通自来水(不要用蒸馏水, 以免引起误差)、10ml 10%的偏重亚硫酸钠水溶液和10ml 1mol/L HCl,三者在使用前混合。
3. 1mol/L HCl(水解用) 取82.5ml比重为1.19的盐酸加蒸馏水1000ml即成(应将盐酸缓缓加入水中)。
4. 1%亮绿(light green) 亮绿1g,溶于100ml蒸馏水中。
5. 30%、50%、70%、85%、95%、100%的梯度酒精及二甲苯。
实验方法1. 取材与固定2. 脱水3. 制片(已完成)4. 脱蜡将制片经二甲苯I(20 min)和二甲苯II(分别10 min、12min、14min)将石蜡脱净,再经100%、95%、85%、70%、50%、30%的酒精5各min,最后放入蒸馏水中(10 min)。
5. 水解先将制片放入一盛有1 mol/L HCl的染色缸内,清洗一下,然后将载片放入已温浴至60℃的1 mol/L HCl溶液中水解8 min。
水解后很快将标本取出,放入室温1 mol/L HCl 溶液中。
注意: 这个步骤非常重要,必须用1 mol/L稀盐酸冲洗,因为它可以洗去贴在切片上的试剂的痕迹。
如用蒸馏水冲洗,则试剂本身也可以水解,所释放出的碱性品红,可以使切片内一切嗜碱性物质皆染色从而引起严重的错误。
若切片较厚,可延长其水解时间,而且每次均需更换洗涤剂。
feulgen染色法

feulgen染色法Feulgen染色法是一种细胞核染色的技术,是由德国生物学家弗朗西斯·费尔根(Robert Feulgen)在1914年发明的。
该技术的主要原理是利用増感反应特异性亲合性使DNA成为已知物质之一的二硫化物发生比较强的发色反应,因而得名 Feulgen 染色法。
Feulgen染色法以弗洛分离作为基础原理,对细胞内的核酸进行染色,并通过显微镜观察、分析和研究细胞发生分裂的相关特征。
该方法能够比较准确的区分细胞核与其他成分,尤其是有机质成分。
因此,Feulgen染色法在细胞学、细胞遗传学、组织学等领域中都有广泛的应用。
下面是 Feulgen 染色法的步骤:1. 细胞固定将要检测的细胞固定于载玻片上, Feulgen 染色法通常使用3.7%的甲醛作为固定液,使DNA在细胞和载玻片上不再发生运动和变化。
2. 酸解样品的酸解可以利用鹰嘴豆素和酸来进行。
这一步旨在剥离细胞的蛋白质并让核酸暴露在表面上,使其改变成醛基结构,以便接下来的染色成分与核酸相互作用。
3. 饱和无水硝酸样品用饱和无水硝酸处理,以去除酸中不必要的离子,同时也可以使其完成DNA的醛基反应。
4. Feulgen 组合液染色细胞样品将在染色溶液中放置2至10分钟,然后被放置于高氯酸中洗涤。
洗后,样品将被去水、除脂和用玻片覆盖。
5. 显微镜下观察使用荧光显微镜观察样品,利用目镜下特殊荧光物质的作用,可以使核酸发亮,显露出来并被直接观察到。
总的来说,Feulgen 染色法是一种快速、准确的核酸染色方法,可用于在细胞组织学、细胞遗传学和生物亚细胞学等领域中快速、准确地检测DNA的含量,为对生命现象的研究提供了有效的工具。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、实验原理
染色体是遗传物质的载体,它的主要化学成分是脱氧核糖核酸(DNA),DNA系核苷酸的多聚体,核苷酸又由碱基脱氧核糖和磷酸所组成,当细胞经60℃、1mol?1-1HCl处理后,不仅使分生组织的细胞彼此分离,而且可以破坏核内DNA链上的嘌呤碱与脱氧核糖之间的糖苷键,嘌呤脱下,脱氧核糖上的醛基暴露,形成含醛基的无嘌呤结构物,醛基与希夫试剂反应显紫红色。细胞中只有DNA才具有这种专一的孚尔根反应,因此所以根据紫红色出现的部位就可鉴定脱氧核糖核酸(DNA)的存在,并广泛应用于核及染色体的研究中。
四、实验步骤
1. 取材与固定:待大蒜根尖长1cm 时,于上午8时剪下根尖,经过预处理后投入卡诺固定液中固定2-24h。固定后,保存在70%的酒精中,放入冰箱中冷藏供用。
2.水解 试管1:取大蒜根尖数条,投入试管,先用清水洗3次,换1N HCl洗一次,倾去,换入预热60℃的1N HCl 浸没根尖,放入恒温水浴锅中在60±0.5℃下水解10分钟(视材料而定,水解时间可以从10分钟延长至30分钟)。然后吸去热1N HCl,换入冷1N HCl洗一次,再用清水将根尖洗三次。试管2(对照)取大蒜根尖数条,投入试管,先用清水洗3次,入预热60℃的蒸馏水浸没根尖,放入恒温水浴锅中在60±0.5℃下水解10分钟。以下各步骤两试管相同。(水解是本实验成败的关键之一。重要的是温度,应保持在60±0.5℃之间。如果温度过高或时间过长,造成水解过度,醣与醛基之间的键被破坏,醛基流失到水解液中,反之,不能出现潜在的醛基,都不能呈现颜色反应。)
2.比较根尖经盐酸水解处理与否所获称1g碱性品红于200ml煮沸的蒸馏水中,5分钟后断电使其冷却至55~50℃,过滤到一个棕色的试剂瓶中,加入1N HCl 20ml,继续冷却至25℃,加入3g偏重亚硫酸钠,摇动瓶子使其溶解。密闭瓶口,置黑暗低温处或冰箱内(4℃左右),18~24小时后检查,试剂如透明无色或呈浅黄色时即可使用。如有不同程度的红色未褪,可加入1g活性炭,强烈震荡一分钟,仍在低温下静置过夜,然后用滤纸过滤后使用。密封瓶口,包以黑纸,在5℃以下冰箱内可以保存半年。
2.漂洗液 在200ml蒸馏水中,加入10ml 1N HCl 和10ml 10%亚硫酸钠溶液。此液在临用前配制。
3.1N HCl 准确量取86.2ml浓盐酸(比重1.18)加入到913.8ml蒸馏水中。
二、实验目的
学习和掌握孚尔根反应染色法,鉴定植物细胞核内染色体上DNA的存在。
三、实验材料、用具及药品
1.材料:洋葱或大蒜的根尖
2.用具 显微镜、恒温水浴锅、温度计、镊子、解剖针、刀片、冰箱、温箱、天平、载玻片、盖玻片、吸水纸、吸管、烧杯、量筒、
3.药品 希夫氏试剂(无色碱性品红液)、漂洗液、1mol?1-1 HCl、45%醋酸等。
3. 染色 两试管中均滴加希夫试剂,浸没根尖,立即置于暗处处理0.5—1h,然后用漂洗液换洗3次,每次2min;再用蒸馏水换洗2次,每次2min。
4. 压片镜检。分别取上述两试管中的根尖,置于载玻片上,滴加1滴45%醋酸,然后压片镜检。
〖注意事项〗 注意水解时间和温度。
五、作业
1.经孚尔根染色的压片,用指甲油将盖玻片的四周封固成临时片,储于冰箱中。
