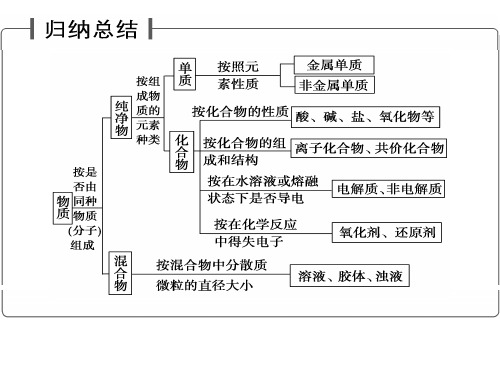
氧化还原反应--氧化性、还原性强弱的比较
高一氧化性还原性强弱比较

氧化性、还原性的强弱判断1.依据反应原理氧化剂+还原剂―→还原产物+氧化产物氧化性:氧化剂>氧化产物还原性:还原剂>还原产物2.依据金属、非金属活动性顺序(1)依据金属活动性顺序(2)依据非金属活动性顺序3.依据反应条件及反应的剧烈程度反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、有无催化剂及反应温度高低和反应物浓度大小等。
由上述反应条件的不同,可判断氧化性:KMnO4>MnO2>O2。
依据氧化还原反应的程度(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
氧化性:Cl2>S2.基本规律(1)守恒规律化合价有升必有降,电子有得必有失。
对于一个完整的氧化还原反应,化合价升降总数相等,得失电子总数相等。
(2)强弱规律氧化性较强的氧化剂跟还原性较强的还原剂反应,生成还原性较弱的还原产物和氧化性较弱的氧化产物。
(3)价态规律元素处于最高价态,只有氧化性;元素处于最低价态,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现其中一种性质。
(4)转化规律(5)难易规律越易失电子的物质,失电子后就越难得电子,越易得电子的物质,得电子后就越难失电子;一种氧化剂同时和几种还原剂相遇时,优先与还原性最强的还原剂发生反应;同理,一种还原剂遇到多种氧化剂时,与氧化性最强的氧化剂优先反应。
3.特殊的氧化还原反应——歧化反应和归中反应(1)歧化反应:同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:(2)归中反应:同种元素由高价态、低价态转化至中间价态。
二、氧化还原反应氧化性还原性的比较

二、氧化还原反应氧化性还原性的比较物质氧化性(还原性)相对强弱判断方法:(1)可依据若干反应条件的差异判断:条件越容易,反应速率越快,氧化性(还原性)越强,而不是以得失电子数多少。
例:判断反应中氧化剂的强弱。
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O氧化水平:KMnO4>MnO2>O2(2)可依据金属活动顺序表判断:排位越后的金属,其原子的还原性越弱;而金属阳离子的氧化性越强。
(但是氧化性Fe3+>Cu2+)(3)可依据元素在同期表的位置判断:同周期(适用于二、三周期):从左到右:金属单位的还原性依次减弱,非金属单质的氧化性逐渐增强。
从上到下:金属单质的还原性依次增强,非金属单质的氧化性逐渐减弱。
(4)可依据具体反应实行判断:理论根据:氧化剂1+还原剂1=氧化剂2(氧化产物)+还原剂2(还原产物)。
氧化水平:氧化剂1>氧化剂2(氧化产物)。
还原水平:还原剂1>还原剂2(还原产物)。
例:判断下列反应中氧化性强弱。
①I2+SO2+2H2O=2HI+H2SO4;②2FeCl2+Cl2=2FeCl3;③2FeCl3+2HI=2FeCl2+2HCl+I2。
氧化性:D(5)依据电极反应判断:在电解池中阴极上哪种金属的阳离子先析出(被还原)则氧化性越强,而由这种金属单质的还原性越弱,其金属活泼性越弱。
例:A、B、C是三种金属,根据下列①②实验确定它们还原性强弱顺序:①将A与B浸在稀H2SO4中用导线连接,A上有气体逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
A.A>B>C; B.B>A>C;C.B>C>A; D.C>A>B选:B(6)依据元素化合价判断:对同一元素来说,化合价越高,氧化性越强。
如:Fe3+>Fe2+;Cu2+>Cu+,(但有例外如氧化性:HClO>HClO3>HClO4)。
【练习】1. 根据下列反应的化学方程式,判断相关物质的还原性强弱顺序是( )I 2+SO 2+2H 2O===H 2SO 4+2HI 2FeCl 2+Cl 2===2FeCl 32FeCl 3+2HI===2FeCl 2+2HCl +I 2A .I ->Fe 2+>Cl ->SO 2B .Cl ->Fe 2+>SO 2>I -C .Fe 2+>I ->Cl ->SO 2D .SO 2>I ->Fe 2+>Cl -2. 已知Co 2O 3在酸性溶液中易被还原成Co 2+,Co 2O 3、Cl 2、FeCl 3、I 2的氧化性依次减弱。
氧化还原反应---基本规律和氧化性还原性强弱的比较方法

【例3】 Cu + Cl2 = CuCl2 氧化性:Cl2 > S
2Cu + S = Cu2S
▲注:判断物质的氧化性或还原性强弱是依 据电子转移的难易,而不是电子转移多少。
【例4】 Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O 3Cu+8HNO3(稀)= Cu(NO3)2+ 2NO↑+ 4H2O 氧化性: 浓硝酸 > 稀硝酸 (浓硝酸反应比较剧烈)
积的变化)( C )
A.0.75 mol•L—1 B.1.5 mol•L—1 C.2 mol•L—1 D.3 mol•L—1
20
练习(09全国卷Ⅱ13) 含有a mol FeBr2的溶 液中,通入x mol Cl2。下列各项为通Cl2过 程中,溶液内发生反应的离子方程式,其 中不正确的是( B )
常温下,在溶液中可发生如下反应: ⑴16H++10Z—+2XO4—=2X2++5Z2+8H2O; ⑵2A2++B2=2A3++2B—;⑶2B—+Z2=B2+2Z—,由此推断,
下列说法错误的是(BD)
A、反应Z2+2A2+=2A3++2Z—可以进行 B、Z元素在⑴ ⑶反应中均被还原 C、氧化性由强到弱的顺序为XO4—、Z2、B2、A3+ D、氧化性由强到弱的顺序为XO4—、A3+、B2、Z2
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++H2O2=2Fe2++O2 下列说法正确的是
氧化还原反应的规律和强弱判断

氧化还原反应的规律和氧化性、还原性强弱的判断第一课时主备人:陈翠平【教学目的】1、掌握氧化还原法应规律及其应用2、掌握氧化性和还原性强弱的判断依据【教学重点】氧化还原反应的规律和氧化性还原性强弱的判断的方法一、氧化还原反应四规律1、守恒规律:在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
例1(1993年高考题)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水。
反应中生成的氧化产物和还原产物的物质的量之比是( )。
A.1∶3 B.2∶3 C.1∶1 D.4∶3设有n摩电子得失,则得到氧化产物N2为n/6摩,还原产物SO2为n/2摩,它们的物质的量之比n/6∶n/2=1∶3,故选(A)。
2、价态规律同种元素具有多种价态时,一般处于最低价时只具有还原性,处于最高价时只具有氧化性,处于中间可变价时既具有氧化性又具有还原性。
例2在下列物质中,既具有氧化性又具有还原性的是( )。
A.铁B.硫C.铁和硫D.氧和铁答案:B。
(练习)请判断下列几个问题的正误:①H2S只具有还原性?②金属单质既有氧化性又有还原性③元素或物质的氧化性、还原性不只完全取决于元素的价态,有时还受浓度、酸度、温度等影响(练习)在下列各组物质中,只有还原性的是()A、Fe、Cl-、S2-B、Cl-、CO、Na+C、Fe2+、SO42-、NO3-D、Fe3+、O2、H2S 3、先后规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧剂,则它首先与溶液中还原性最强的还原剂作用;同理,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中氧化性最强的氧化剂作用。
例如1993年全国高考化学题中涉及到NaBr、H2SO4、MnO2之间发生的主要反应的化学方程式。
我们知道,浓H2SO4,可氧化Br-,MnO2也可氧化Br-,究竟是发生反应2NaBr+3H2SO4(浓)+MnO2 2NaHSO4+MnSO4+2H2O+Br2↑,还是2NaBr+3H2SO4(浓)=2NaHSO4+SO2↑+2H2O+Br2↑?这就要分析浓H2SO4、MnO2的氧化性哪个更强些。
氧化还原反应___基本规律和氧化性还原性强弱的比较方法
难溶的物质有哪 些呢?
氧化物:Al2O3、SiO2 等 酸: H2SiO3 等
需要熟记 物质溶解性表!
碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3 等
盐:BaSO4、CaCO3、AgCl、AgBr、AgI 等
离子反应发生的条件
离子反应的条件:生成难溶、难电离、易挥发性物质;
离子间发生氧化还原反应、双水解反【应设或疑络】合常反见应的。 难电离的物质有
“五看”反应物或生成物的配比是否合理: 如稀H2SO4与Ba(OH)2溶液反应不能写成: H+ + OH― + SO42― + Ba2+ = BaSO4↓ + H2O
“六看”是否符合题设条件:题设条件 “过量”、“少量”、 “适量”、“任意量”、“滴加顺序”等字眼,解题时要特别留 心。
“七看”各种符号是否表正确:如“=”、“ →”、 “↑”、“↓”、可逆号及离子符号写成价态符号等。如 Na2CO3的水解不能写成CO32― + H2O = HCO3― + OH―
(2)、生成难电离物质---弱电解质哪些呢?
弱酸:H2CO3、HClO、HF、CH3COOH、C6H5OH 等 (除 H2SO4、HNO3、HCl、HBr、HI外的多数酸)
弱碱: NH3·H2O 等
水:
H2O
少数盐: HgCl2 等 (3)、生成挥发性物质-----气体
H2、 Cl2、O2 、SO2 、CO2 、NH3、PH3 等
(3)有弱电解质生成 ①如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、 AlO2-、SiO32-、CN-、C17H35COO-、 C6H5O-、等与 H+ 不能大量共存; ② 一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4 -、HSO3不能与OH-大量共存; ③NH4+与OH-不能大量共存; ④ 弱碱的简单阳离子(比如:Cu2+、Al3+、Fe3+、Fe2+、Mg2+ 等等)不能与OH-大量共存
化学新高考 专题21 氧化还原反应之氧化性还原性强弱比较

氧化还原反应(二)氧化性、还原性强弱规律1.氧化性、还原性的判断(1)氧化性是指得电子的性质(或能力);还原性是指失电子的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。
如:Na -e -===Na +,Al -3e -===Al 3+,但根据金属活动性顺序表,Na 比Al 活泼,更易失去电子,所以Na 比Al 的还原性强。
从元素的价态考虑:最高价态——只有氧化性,如:Fe 3+、浓H 2SO 4、KMnO 4等;最低价态——只有还原性,如:金属单质、Cl -、S 2-等;中间价态——既有氧化性又有还原性,如:Fe 2+、S 、Cl 2等。
2.氧化性、还原性强弱的比较方法(1)根据化学方程式判断氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
技巧点拨:从规律看都是剂大于产物,所以平时具体做题比较强弱的时候,记住一点就行,在同个化学反应方程式中,左边的大于右边(2)根据反应条件和产物价态高低进行判断①与同一物质反应,一般越易进行,则其氧化性或还原性就越强。
如Na 与冷水剧烈反应,Mg 与热水反应,Al 与水加热反应也不明显,所以还原性:Na>Mg>Al ;非金属单质F 2、Cl 2、Br 2、I 2与H 2反应,F 2与H 2暗处剧烈反应并爆炸,Cl 2与H 2光照剧烈反应并爆炸,Br 2与H 2加热到500 ℃才能发生反应,I 2与H 2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F 2>Cl 2>Br 2>I 2。
②当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应条件的高低进行判断:一般条件越低,氧化剂的氧化性越强,如:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O,2KMnO 4+16HCl(浓)===2KCl +2MnCl 2+5Cl 2↑+8H 2O ,由上述反应条件的不同,可判断氧化性:KMnO 4>MnO 2。
氧化还原反应中物质的氧化性、还原性强弱比较规律总结(精品)

物质氧化性、还原性强弱比较规律总结方法归纳:物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。
即物质越易得到电子,则其氧化性越强,越难得到电子则其氧化性越弱;反之,物质越易失去电子,则其还原性越强,越难失去电子,则其还原性越弱。
★越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失去电子。
一. 利用化合价,比较物质氧化性、还原性的强弱由同种元素形成的不同价态物质的氧化性和还原性的强弱规律:元素的最高价态只具有氧化性(如:Fe 3+、KMnO 4等),元素的最低价态只具有还原性(如S 2-、I -等),元素的中间价态既具有氧化性又具有还原性,但主要呈现一种性质(如SO 2一还原性为主)。
如:由铁元素组成的物质,氧化性:Fe Fe Fe <<++23;还原性:Fe Fe Fe >>++23。
二、依据元素周期表1.同周期,如:Na 、Mg 、Al 、Si 、P 、Cl 从左到右,还原性逐渐减弱,氧化性逐渐增强。
2.同主族,从上到下,还原性逐渐增强(如:Li 、Na 、K 、Rb 、Cs ),氧化性逐渐减弱(如:F 、Cl 、Br 、I 、At)。
三、利用元素活泼性的不同,比较物质氧化性、还原性的强弱1. 对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。
如:对金属活动性顺序表而言:K 、Ca 、Na 、Mg 、Al 、Zn 、Fe 、Sn 、Pb (H )、Cu 、Hg 、Ag 、Pt 、Au ,其活泼性(金属性)依次减弱;单质的还原性 K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H 2)>Cu> Hg>Ag>Pt>Au ;离子的氧化性:K +<Ca 2+<Na +<Mg 2+<Al 3+<Zn 2+<Fe 2+<Sn 2+<Pb 2+<(H +)<Cu 2+< Hg 2+<Ag +<Pt 2+<Au +2.对非金属而言,非金属越活泼(非金属性越强),其非金属单质的氧化性越强,其阴离子的还原性越弱。
氧化还原反应的基本规律及氧化性和还原性强弱的判定

3. 认为同种元素不同价态的化合物的氧化性 (还原性)强弱只与元素化合价的高低有关。 实际上,除此之外还与化合物的稳定性有关。
如:
——次氯酸中氯的价态比高氯酸中氯的 价态低,但次氯酸不稳定,氧化性却比高氯 酸强。
酸性: HClO4>HClO3 >HClO2 >HClO
氧化性:HClO>HClO2 >HClO3 >HClO4
例1、已知: ①.2BrO3-+Cl2===Br2+2ClO3-; ②.5Cl2+I2+6H2O===2HIO3+10HCl; ③.ClO3-+5Cl-+6H+===3Cl2↑+3H2O。
下列粒子氧化性强弱顺序为( C )
A.ClO3- > BrO3- > IO3- > Cl2
B.BrO3- > Cl2 > ClO3- > IO3-
将氯水滴加到NaBr和KI的混合液中。
先反应的是: C l2 2 K I 2 K C l I 2
后反应的是: Cl2 + 2 NaBr = 2 NaCl + Br2 返回
②.2FeCl2 + Cl2 == 2FeCl3
③.F2 + 2KI(熔融) == 2KF + I2
③.F2 + 2KCl(熔融) == 2KF + Cl2
中的一些有关事实,要除去其中的FeI2,应
选用的试剂是( C ) A.F2
B.过量的Cl2
C.FeCl3
D.FeCl2
返回
三、判断氧化性和还原性强弱的误区
4. 认为同一种还原剂(氧化剂)与多种氧化剂 (还原剂)反应是同时进行的。
实验证明:氧化剂的氧化性(还原剂的还原性)越 强的越先反应,并非几个反应同时进行。
高中化学 氧化性还原性强弱的判断顺序比较方法

氧化性、还原性强弱的比较•氧化性:是指物质得电子的能力。
处于高价态的物质一般具有氧化性。
还原性:是指物质失电子的能力,一般低价态的物质具有还原性。
•氧化性,还原性强弱的比较方法:(1)根据氧化还原反应方程式判断氧化性:氧化剂的氧化性>氧化产物的氧化性还原性:还原剂的还原性>还原产物的还原性(2)根据金属(非金属)活动性顺序判断①金属活动性顺序②非金属活动性顺序(3)根据与同一物质反应的难易(条件)判断:当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件高低来进行判断。
例:三个反应还原剂都是浓盐酸,氧化产物都是氯气,氧化剂分别是高锰酸钾、二氧化锰、氧气,有反应方程式可得,反应条件越来越难,可得结论:氧化性KMnO4> MnO2> O2(4)根据氧化产物的价态高低判断当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态高低来判断氧化剂氧化性的强弱。
例如:,,可得:氧化性Cl2>S注:不能通过氧化剂化合价降低的多少来判断氧化性的强弱。
(5)根据元素周期表判断①同周期主族元素从左→右,金属单质还原性逐渐减弱(对应的阳离子的氧化性逐渐增强),非金属单质氧化性逐渐增强(对应的阴离子的还原性逐渐减弱);同主族元素从上→下,金属单质还原性逐渐增强(对应的阳离子的氧化性逐渐减弱),非金属单质氧化性逐渐减弱(对应的阴离子的还原性逐渐增强)。
注:元素在周期表中越是位于左下方,其单质的还原性越强,其阳离子的氧化性越弱;元素在周期表中越是位于右上方,其单质的氧化性越强,其阴离子的还原性越弱。
(6)根据原电池、电解池的电极反应判断氧化性、还原性的强弱(根据这个规律也可判断原电池、电解池电极)①两种不同金属构成原电池的两级:负极:金属电子流出,正极:金属电子流入还原性:负极>正极②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
§1-3-2 氧化还原反应:四大规律(高一暑期衔接班)

§1-3-2、氧化还原反应的一般规律一、氧化性、还原性强弱比较规律:氧化性、还原性强弱比较(1)根据原子结构:原子半径大,最外层电子少,其单质易失电子,还原性强;原子半径小,最外层电子多,其单质易得电子,氧化性强。
氧化性、还原性的强弱并不决定于得失电子的数目,而决定于得失电子的难易程度。
金属单质的还原性看金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au还原性逐渐减弱K +Ca 2+Na +Mg 2+Al 3+Zn 2+Fe 2+H +Cu 2+Fe 3+Ag +氧化性逐渐增强非金属单质的氧化性看非金属活动顺序:F 2>Cl 2>Br 2>I 2>S;非金属离子的还原性强弱看非金属活动顺序表倒过来顺序:如:S 2->I ->Br ->Cl ->F -(2)根据反应条件:是否加热、温度高低,有无催化剂等,如:由2H 2SO 3+O 2=2H 2SO 4(快)2Na 2SO 3+O 2=2Na 2SO 4(慢)2SO 2+O 2SO 3还原性:H 2SO 3Na 2SO 3SO 2所得结论:和同一氧化剂越容易发生反应的还原剂的还原性越强。
(3)根据反应剧烈程度:如Cu 与浓HNO 3反应剧烈,Cu 与稀HNO 3反应微弱,故氧化性:浓HNO 3稀HNO 3。
所得结论:溶液浓度越大,其氧化性越强。
(4)根据不同氧化剂与同一物质反应后,还原剂中相关元素价态高低:如Fe+S=FeS,2Fe+3Cl 22FeCl 3,故氧化性:Cl 2S。
所得结论:不同氧化剂氧化同一还原剂,使还原剂的化合价升的越高,该氧化剂的氧化性越强。
(5)氧化剂+还原剂=还原产物+氧化产物氧化性:氧化剂的氧化性>氧化产物的氧化性;还原性:还原剂的还原性>还原产物的还原性;例如:2FeCl 3+Cu=2FeCl 2+CuCl 2,氧化性:Fe 3+>Cu 2+,还原性:Cu>Fe 2+。
【知识解析】物质的氧化性、还原性强弱的比较方法

物质的氧化性、还原性强弱的比较方法氧化剂在反应中表现氧化性,氧化性强弱是氧化剂得电子能力的强弱,不是得电子数目的多少。
还原剂在反应中表现还原性,还原性强弱是还原剂失电子能力的强弱,不是失电子数目的多少。
如钠原子失电子数目比铝原子的少,但钠原子的还原性比铝原子的强。
1 根据氧化还原反应方程式进行比较例如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O氧化剂还原剂还原产物氧化产物氧化性:氧化剂>氧化产物,即MnO2>Cl2。
还原性:还原剂>还原产物,即浓盐酸>MnCl2。
2 根据同一种元素的化合价进行比较特例:HClO、HClO2、例如:Fe、FeCl2、FeCl3,H2S、S、SO2,氧化性依次增强,还原性依次减弱。
含不同价态的同种元素的化合物间发生反应时,同种元素高价态与低价态之间发生归中反应。
例如:Cl-+ClO-+2H+===Cl2↑+H2O。
3 根据单质的活动性顺序进行比较(1)根据金属活动性顺序(2)根据非金属活动性顺序4 根据反应的难易程度进行比较与同一种物质发生氧化还原反应时,若氧化产物(或还原产物)中元素价态相同,反应条件越容易,一般可说明物质的氧化性或还原性越强。
例如:MnO 2+4HCl (浓)Cl 2↑+MnCl 2+2H 2O2KMnO 4+16HCl (浓)===2KCl +2MnCl 2+5Cl 2↑+8H 2OMnO 2与浓盐酸需加热才能反应,KMnO 4与浓盐酸在常温下即可反应,说明氧化性:KMnO 4>MnO 2。
5 根据变价元素被氧化或被还原的程度进行比较不同种氧化剂将同种还原剂中的元素氧化时,得到的元素价态越高,其氧化性越强。
例如:Fe +SFeS 2Fe +3Cl 22FeCl 3 氧化性:Cl 2>S 。
名师提醒金属单质之间的置换是还原性强的金属单质置换出还原性弱的金属单质;非金属单质之间的置换是氧化性强的非金属单质置换出氧化性弱的非金属单质。
典例详析例4-16(一题多解)已知三个氧化还原反应:①2FeCl 3+2KI===2FeCl 2+2KCl +I 2②2FeCl 2+Cl 2===2FeCl 3③2KMnO 4+16HCl===2KCl +2MnCl 2+5Cl 2↑+8H 2O若某溶液中Cl -、Fe 2+和I -共存,要想除去I -而又不影响Fe 2+和Cl -,可加入的试剂是( )A .Cl 2B .KMnO 4C .FeCl 3D .HCl解析◆解法①(逐项分析法) 由反应②知,Cl 2可将Fe 2+氧化为Fe 3+,A 项不符合题意;由反应③知,KMnO 4可将Cl -氧化为Cl 2,B 项不符合题意;由反应①知,FeCl 3可将I -氧化为I 2,自身转变为FeCl 2,故FeCl 3可将I -除去,而Fe 2+、Cl -不受影响,C 项符合题意;HCl 不能氧化I -,D 项不符合题意。
物质氧化性、还原性强弱的判断

物质氧化性、还原性强弱的判断物质氧化性(得电子的能力)、还原性(失电子的能力)的强弱取决于物质得失电子的难易,与得失电子的数目无关,但也与外界因素(如反应条件、反应物浓度、酸碱性等)有关,具体判断方法如下:1.依据氧化还原反应原理判断(1)氧化性强弱:氧化剂>氧化产物。
(2)还原性强弱:还原剂>还原产物。
2.依据“二表、一律”判断(1)依据元素周期表判断①同主族元素对应单质的氧化性从上到下逐渐减弱,对应阴离子的还原性逐渐增强。
②同周期元素对应单质的还原性从左到右逐渐减弱,氧化性逐渐增强。
Na Mg Al Si P S Cl2还原性减弱,氧化性增强――――――――――――――――――――――――→(2)依据金属活动性顺序表判断(3)依据元素周期律判断①非金属元素的最高价氧化物对应水化物的酸性越强,其对应单质的氧化性越强。
如酸性:HClO4>H2SO4>H3PO4>H2CO3>H2SiO3,则氧化性:Cl2>S>P>C>Si。
②金属元素的最高价氧化物对应水化物的碱性越强,其对应单质的还原性越强。
如碱性:NaOH>Mg(OH)2>Al(OH)3,则还原性:Na>Mg>Al。
3.依据产物中元素价态的高低判断(1)相同条件下,不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
例如:(2)相同条件下,不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。
例如:4.依据反应条件判断[细练过关]题点(一)氧化性、还原性强弱判断与应用1.根据下列反应,判断有关物质的氧化性由强到弱的顺序正确的是()①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S↓+2HIA.H2S>I2>Fe3+>Cl2B.Cl2>Fe3+>I2>SC.Fe3+>Cl2>H2S>I2D.Cl2>I2>Fe3+>H2解析:选B由反应①可知氧化性:Cl2>I2,由反应②可知氧化性:Cl2>Fe3+,由反应③可知氧化性:Fe3+>I2;由反应④可知氧化性:I2>S,则氧化性:Cl2>Fe3+>I2>S。
高一化学氧化性和还原性强弱的比较试题答案及解析

高一化学氧化性和还原性强弱的比较试题答案及解析1.已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为A.H2SO4(浓) > Cu2+ > Fe3+ > Br2B.H2SO4(浓) > Br2> Fe3+ > Cu2+C.Br2 > H2SO4(浓) > Cu2+ > Fe3+D.Cu2+ > Fe3+ > Br2> H2SO4(浓)【答案】B【解析】本题是比较氧化性强弱,运用氧化剂的氧化性大于氧化产物,区分氧化剂和氧化产物;氧化剂:反应物中含有元素化合价降低的物质;氧化产物:还原剂失去电子后(化合价升高)所得的产物,由题干可知:氧化性H2SO4(浓) > Cu2+, Fe3+ > Cu2+,H2SO4(浓) > Br2,Br2> Fe3+,综上所述,H2SO4(浓) > Br2> Fe3+ > Cu2+,A.错误;B.正确;C.错误;D.错误。
【考点】氧化剂、氧化产物的区分、氧化性强弱的判断。
2.根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-=B2+。
由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是()。
A.D2+>A2+>B2+>E2+B.A2+>B2+>D2+>E2+C.D2+>E2+>A2+>B2+D.E2+>B2+>A2+>D2+【答案】D【解析】由信息知氧化性B2+>A2+,D能和水反应而A、E、B不和水反应,所以有金属活泼性D大于A、B、E,B、E组成的原电池中B失电子,金属活泼性越强,对应阳离子的氧化性就越弱,所以E2+>B2+>A2+>D2+,选D。
化学第一轮复习——氧化还原反应专题氧化性还原性强弱比较

海水是巨大的资源宝库,我们从海水中提取溴,从
海带中提取碘.
1.从海水中提取溴单质
氯气 热空气
提取粗食盐后的母液 (Br-)
氧化
Br2
Br2(g) 冷凝 粗溴
高纯度溴单质
2.从海产品中提取碘单质
水
氯气
干海带灰 浸泡 过滤 氧化 提纯 碘单质
相对原子质量:Ag-108 Cu-64 Zn-65 Al-27
K + 、 C a 2 + 、 N a + 、 M g 2 + 、 A l 3 + 、 Z n 2 + 、 F e 2 + 、 H + 、 C u 2 + 、 F e 3 + 、 A g +
还原性逐渐减弱
K + 、 C a 2 + 、 N a + 、 M g 2 + 、 A l 3 + 、 Z n 2 + 、 F e 2 + 、 H + 、 C u 2 + 、 F e 3 + 、 A g +
氧化性逐渐增强
还原剂的还原性越强,相应氧化态的氧化性越弱
A. ①③ B. ③④ C. ①② D. ①③④
!!已知常温下在酸性环境中能发生下列反应,则在 该环境中下列结论正确的是( )
2BrO3-+Cl2=2ClO3-+Br2 2ClO3-+I2=2IO3-+Cl2 BrO3-+I2=2IO3-+Br2 A.氧化性:ClO3->BrO3->IO3- >Cl2 B.氧化性:Cl2>ClO3->BrO3->IO3C.还原性: I2>Br2>I2 D.还原性:I2>Cl2>Br2
高中化学知识专题--氧化剂的氧化性和还原剂的还原性强弱比较以及离子共存问题

高中化学知识专题--氧化剂的氧化性和还原剂的还原性强弱比较以及离子共存问题 一. 学习内容:1. 氧化剂的氧化性和还原剂的还原性强弱的比较。
2. 离子共存问题。
二. 知识重点:1. 氧化剂的氧化性和还原剂的还原性强弱的比较。
(1)常见的氧化剂有:非金属单质:2F 、2Cl 、2O 、2Br 、S 等。
不活泼金属的阳离子:+Ag 、+2Cu、+3Fe 。
某些金属氧化物或高价态的含氧酸盐:2MnO 、4KMnO 、3KClO 。
某些酸:HClO 、3HNO 、浓42SO H 等。
(2)常见的还原剂有:活泼金属单质:K 、Na 、Mg 、Al 、Zn 等。
低价的金属阳离子:+2Fe 、+2Sn等。
非金属的阴离子:-I 、-Br 、-Cl 、-2S 等。
一些较低价态的化合物:CO 、2SO 、32SO H 、32SO Na 、HI 、3NH 等。
(3)氧化剂氧化性和还原剂的还原性强弱的判断: ① 根据氧化还原反应判断; ② 根据金属活动顺序判断;③ 同种物质的氧化性或还原性还可根据外界条件的不同而受影响; ④ 根据元素周期表位置判断。
2. 离子共存问题。
可在溶液中能发生离子反应的离子,则在溶液中不能共存。
(1)在强酸性溶液中(含+H )反应生成气体,难电离物质的离子,则不能存在:(-OH 、-COO CH 3、-23CO 、-23SO 、-2S 、-ClO 、-34PO 、-3HCO 、-3HSO 、-HS 等)(2)在强碱性溶液中(含-OH )反应生成难溶物质、气体、难电离物质的离子不能存在:(+H 、+4NH 、+2Mg、+3Al、+2Fe 、+3Fe 、+2Cu、+2Hg、+Ag 、-3HCO 、-3HSO 、-HS 、-24HPO 、-42PO H 等)(3)若反应生成难溶物、微溶物的离子也不能大量共存。
(如:-23CO 与+2Ca 、+2Ba、+2Mg 、+Ag 等不能大量共存;-24SO 不能与+2Ba 、+2Pb 、+2Ca 、+Ag 等大量共存;-Cl 不能与+Ag 等大量共存。
氧化性与还原性以及强弱的比较

氧化性与还原性以及强弱的比较
解析:氧化性: 氧化剂>氧化产物 ,还原性: 还原剂>还原产物;越活泼,单质还原性越强, 对应离子的氧化性越弱。
答案:C
氧化性与还原性以及强弱的比较
3、根据元素周期表
右上角,单质氧化性越强,离子还原性弱 左下角,单质还原性越强,离子氧化性弱
氧化性与还原性以及强弱的比较
单质的氧 化性增强
单质的氧 化性增强
氧化性与还原性以及强弱的比较
3、常见物质的比较
氧化性:KMnO4>Cl2(O2)>Br2>Fe3+>I2>SO2>S
还原性:Cl—<Br—<Fe2+<I—<SO32—<S2—
解析:本题主要考查氧化还原反应的先后顺序和反 应原则,侧重考查学生的分析判断能力,及对氧化 还原反应实质的理解。氧化还原反应发生的条件是 强氧化剂+强还原剂=弱还原剂+弱氧化剂。A中反 应物I-的还原性大于Fe2+的还原性,故Cl2应首先氧 化强还原性I-而不是Fe2+,故A反应错误,选A。
氧化性与还原性以及强弱的比较
组成物质 中某些元 素化合价 降低
氧化性与还原性以及强弱的比较
二、氧化性和还原性
氧化性:得电子的难易程度 还原性:失电子的难易程度 高价氧化低价还,中间价态两头转
氧化性与还原性以及强弱的比较
三、氧化性和还原性强弱的比较
1、氧化性: 氧化剂>氧化产物 还原性: 还原剂>还原产物
2、根据金属活动性顺序表
氧化还原反应基本规律

氧化还原反应基本规律
氧化还原反应的基本规律有五大规律:
1.强弱律:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
2.价态律:元素处于最高价态,只具有氧化性;元素处于最低价态,只具有还原性;处于中间价态,既具氧化性,又具有还原性。
3.转化律:同种元素不同价态间发生归中反应时,元素的氧化数值接近而不交叉,最多达到同种价态。
4.优先律:对于同一氧化剂,当存在多种还原剂时,通常先和还原性最强的还原剂反应。
5.守恒律:氧化剂得到电子的数目等于还原剂失去电子的数目。
氧化-还原反应(oxidation-reduction reaction,也作redox reaction)是化学反应前后,元素的化合价有变化的一类反应。
氧化还原反应的特征是元素化合价的升降,实质是电子的得失或共用电子对的偏移。
氧化还原反应是化学反应中的三大基本反应之一(另外两个为(路易斯)酸碱反应与自由基反应。
自然界中的燃烧,呼吸作用,光合作用,生产生活中的化学电池,金属冶炼,火箭发射等等都与氧化还原反应息息相关。
研究氧化还原反应,对人类的进步具有极其重要的意义。
物理概念
在无机反应中,有元素化合价升降,即电子转移(得失或偏移)的化学反应是氧化还原反应。
在有机反应中,有机物引入氧或脱去氢的作用叫做氧化反应,引入氢或失去氧的作用叫做还原反应。
氧化与还原的反应是同时发生的,即是说氧化剂在使被氧化物质氧化时,自身也被还原。
而还原剂在使被还原物还原时,自身也被氧化。
氧化还原反应的特征是元素化合价的升降,实质是发生电子转移。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(第五课时)
实验中学 zrf
[知识回顾]
双线桥:
表明反应前后同一元素原子的电子转移情况
1、标价:标化合价发生改变的元素 2、连桥:连向同生一成元 物素 。不同价态,且由反应物指 3、在桥上标明得失电子总数、化合价升降、被 氧化、被还原等
单线桥: 表明不同元素原子的电子转移情况
1、标箭头(从还原剂指向氧化剂),且要对准化 合价发生变化的元素。
返回
3 依据元素化合价判断
➢最高价态只表现氧化性 ➢最低价态只表现还原性 ➢中间价态既可表现氧化性也可表现还原性
-2
H2S
只有还原性
0 +4
S SO2
既有氧化性又有还原性
+6
SO3
只有氧化性性
下列各粒子中既具有氧化性又具有还原性的是( D)
A.Al B.Cl- C.Cu2+ D. Fe2+
返回
4 依据反应条件和反应程度判断
氧化剂 还原剂
还原产物 氧化产物
由这一反应可以判断出, 氧化性:KMnO4>Cl2 同理,由(2)反应可以判断出,氧化性:Cl2>I2
由(3)反应可以判断出,氧化性:I2>S
综合考虑,应有KMnO4 >Cl2 > I2>S
② 根据以下反应方程式判断X2、W2、Y2、Z2 四种单质的氧化性强弱
(1). 2W-+X2=2X-+W2 (2). 2Y-+W2=2W-+Y2 (3). 2X-+Z2=2Z-+X2
2Fe+3Cl2 2FeCl3
氧化性:Cl2 > S
返回
根据反应条件的难易判断
氧化性、还原性的强弱并不取决于得失电子的
多少,而取决于得失电子的难易。得失电子的难
易可以通过反应的条件和反应的程度来判断。一般
来说,反应条件越容易,反应的程度越激烈, 则得失电子越容易。
如Na和盐酸反应比Al与盐酸反应激烈。 尽管在反应中,Na失去一个电子,变成Na+, 而Al失去3个电子,变成Al3+。但不能认为还原 性Al>Na,而应是Na>Al
还原性: 氧化性:
Fe > Cu
还原剂
还原产物
Cu2+ > Fe2+
氧化剂
氧化产物
【思考与练习】
根据下列反应判断有关物质还原性由强到弱
的顺序是
(A )
H2SO3 + I2 + H2O == 2HI + H2SO4 2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2 + 4HNO3 == 2FeCl3 + NO↑ + 2H2O + Fe(NO3)3
单质的还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+... Cu2+ Hg2+ Ag+...
对应的阳离子的氧化性逐渐增强
例 还原性:Na > Mg > Al
氧化性:Na+<Mg2+<Al3+
A. H2SO3 > HI > FeCl2 > NO B. HI > FeCl2 > H2SO3 > NO C. FeCl 2> HI > H2SO3 > NO D. NO > FeCl2> H2SO3 >H I
结论: 不论是氧化性还是还原性判断都是
•
反应物 > 生成物
2、根据金属活动性顺序判断
① 根据下列三个反应的化学方程式,判断Cl2、 I2、S、KMnO4的氧化性强弱顺序
(1). 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O (2). 2KI+Cl2=2KCl+I2
(3). Na2S+I2=2NaI+S
[分析]: 在(1)反应中,
(1). 2KMnO4+16HCl(浓)=2KCl+2MnCl2+ 5Cl2↑+8H2O
2、标明电子转移的数目(不要标明“得、失” 电子)。
氧化还原反应基本概念之间的关系
还原剂 具有 还原性 失电子 氧化反应 价升高
①同时存在 ②得失电子相等
氧化剂
具有
氧化性
得电子 价降低
还原反应
含价升 高元素
氧化产物
还原产物
含价降 低元素
常见的强氧化剂:
O2、 Cl2、Br2 、 HNO3 、H2O2、浓硫酸 、 HClO 、 KMnO4 、MnO2 、 FeCl3等
•
3、越是没有本领的就越加自命不凡。 20.12.1 105:54: 2005:5 4Dec-20 11-Dec-20
•
4、越是无能的人,越喜欢挑剔别人的 错儿。 05:54:2 005:54: 2005:5 4Friday , December 11, 2020
•
5、知人者智,自知者明。胜人者有力 ,自胜 者强。 20.12.1 120.12. 1105:5 4:2005: 54:20D ecembe r 11, 2020
[分析]:由(1)得,氧化性:X2>W2
由(2)得,氧化性:W2>Y2
由(3)得,氧化性:Z2>X2 综合考虑,应有Z2 >X2 >W2>Y2
返回
•
1、有时候读书是一种巧妙地避开思考 的方法 。20.1 2.1120. 12.11Fr iday, December 11, 2020
•
2、阅读一切好书如同和过去最杰出的 人谈话 。05:5 4:2005: 54:2005 :5412/ 11/2020 5:54:20 AM
常见的强还原剂:
Al 、K 、 Na 、 Zn 、 Fe 、 C 、 H2 、SO2 CO 等
四、氧化性还原性强弱的比较
1、根据方程式判断
氧化剂 + 还原剂 = 氧化产物 + 还原产物
氧化性: 氧化剂 > 氧化产物 还原性: 还原剂 > 还原产物
【思考与探究】
已知反应:Fe+CuSO4=Cu+FeSO4,请找出 该反应的氧化剂、还原剂、氧化产物、还原产 物 ,并比较氧化剂与氧化产物的氧化性强弱, 还原剂与还原产物的还原性强弱。
•
6、意志坚强的人能把世界放在手中像 泥块一 样任意 揉捏。 2020年 12月11 日星期 五上午 5时54 分20秒0 5:54:20 20.12.1 1
•
7、最具挑战性的挑战莫过于提升自我 ecember 11, 2020
根据以下两个方程式判断KMnO4 、MnO2的氧化性强弱 MnO2+4HCl(浓) MnCl2+Cl2 ↑ +2H2O 2KMnO4+16HCl (浓) ==2kCl+2MnCl2+5Cl2 ↑ +8H2O
氧化性:KMnO4 > MnO2
根据以下两个方程式判断Cl2 、S的氧化性强弱 Fe + S FeS
