高等有机化学4
高等有机化学

(1)环丁二烯 (1)环丁二烯
环丁二烯不稳定
环丁二烯的取代衍生物有较大 的稳定性。1,2,3-三叔丁基环 丁二烯可以在-70℃的溶液中 存在一段时间
2,3,4-三叔丁基环丁二烯甲酸甲酯在室 温下可以分离出来。
它们环中的键长是不相等的,明显有单 键、双键的区别。前者为0.1506nm,后者 为0.1376nm。
Fe
(4) 环庚三烯正离子
七元环的环庚三烯正离子含有6 电子,按照H ckel 七元环的环庚三烯正离子含有6个π电子,按照Hückel 规则应具有芳香性。 规则应具有芳香性。
环庚三烯与溴加成得到二溴化物,后者在70 环庚三烯与溴加成得到二溴化物, 后者在 700C时加热失 去一分子溴化氢得一黄色物质, 去一分子溴化氢得一黄色物质 , 在乙醇中重结晶得黄色棱 状晶体,NMR谱显示δ= 18ppm单峰,表明为芳香对称结构. ,NMR谱显示δ=9 ppm单峰 状晶体,NMR谱显示δ=9.18ppm单峰,表明为芳香对称结构.
Li
(6) 环辛四烯双负离子
环辛四烯与金属钠作用形成环辛四烯双负 离子,有10个π电子,符合Hückel规则,有芳 香性。
+ 2 Na 2 Na
+
2.轮烯
轮烯( annulene) 轮烯 ( annulene ) 是一类单键与双键交替的 环状多烯烃类。它们有的很稳定,有的不稳定。 环状多烯烃类。它们有的很稳定,有的不稳定。有 的在自然界存在,有的是实验室间接证明的东西。 的在自然界存在,有的是实验室间接证明的东西。 命名或书写时通常是把成环碳原子数置于词前 并定在方括弧内, 例如苯可以看作是[6] 轮烯, 环 并定在方括弧内 , 例如苯可以看作是 [ 轮烯 , 辛四烯是[ 轮烯, 但一般是把较大的环称作轮烯。 辛四烯是 [8] 轮烯 , 但一般是把较大的环称作轮烯 。 这类化合物如果是在一个平面上并含有4n+2 这类化合物如果是在一个平面上并含有4n+2π 电子的应具有芳香性。 电子的应具有芳香性。
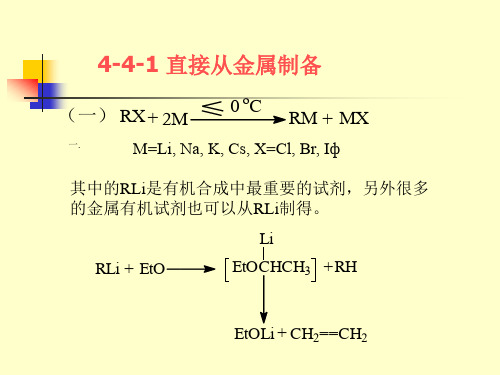
高等有机化学第四部分4-4金属有机化合物的制备.ppt
(三)其它价态金属
4EtCl + 4NaPb 4EtBr + Mg2 Sn
Et4 Pb + 4NaCl + 3Pb E4t Sn + 2MgB2r
2C6H6 + Cr*
Cr(C6H6)2
PEt3
C6F5Br +Ni* + 2 Et3P
C6F5 _ Ni Br
PEt3
4-4-2 从金属有机试剂的 交换反应制备
尽管这些取代基有的推电子,有的吸电 子,但都得到邻位的Li化试剂,这主要是诱导 效应和取代基时Li的配位作用所至。
Li
MeO
R
H
MeO Li
当然这反应也不限于芳基金属试剂,如:
+ ( i Pr )2NU1 HMPT
N
CH2LI W
(四)金属化合物对双键的加成
1、 RLi + C C
R C C Li ( 增加两个碳 )
M=Fe,Cr,V
这类金属交换反应在有机合成中非常有用,
因为可以直接从金属本身制备的金属有机化 合物太活泼,反应的选择性差,而选择性高 的金属有机试剂活性低,难以直接从金属制 备,所以只好用间接方法。
(二)另一种交换方式
R M + R' X
R' M + RX
其中用得最多的是Li交换反应。
BuLi +
2、M(CO)6 + RLi [ Me3O]BF4
(CO)5M
C
OLi R
(CO)5M
C
OMe R
( Fisher Carbene)
3、B2H6 + 6MeCH2CH CH2
2Bu3
南开大学高等有机化学课件第四章有机反应机理的研究和描述

Ea ln k ln A RT
R: 气体常数, A: 频率因数,
在不同温度下测速率常数, 可计算出 Ea: Arrhenius活化能
Ea ΔH RT ΔS Ea log k 10 .753 log T 4.576 4.576T
4.3.1 简单速率表达式的积分形式
正常情况下动力学数据用微分方程的积分形式来处理:
如简单的一级反应和二级反应:
1 C0 一级级反 : k ln( ) t C 1 b0(a) 二级反应 : k (a0 - b0)ln t a0(b)
a, b, c: 时间t时浓度
a0, b0, c0: 起始浓度
一些反应速率方程积分形式的推导:
4.2 动力学数据(Kinetic Data)
动力学数据使我们能更详细地洞察反应机理。用跟踪反 应物消失和产物出现的方法可以测定某一个反应的速度。波 谱技术提供了一个迅速又连续地监测浓度变化的方法,因而 往往被用来测量反应进行的程度。总之,任何与一种反应物 或产物的浓度有关而且能被测量的性质,都可利用来测定反 应速度。 动力学研究的目的是为了在反应物和催化剂的浓度以及 反应速度之间建立定量关系。
k1[A][B] [C] k -1
d[D] k1 k2[C] k2 [A][B] kobs.[A][B] dt k -1
大多数反应不止一步, 可以参考一些重要的多步反应例子来得出动 力学表达式, 例如在决速步之前可以有一个快速平衡:
ROH + H+
+ ROH2
快 k1 k -1
_
ROH2 RBr +H2O
计算出一个反应的自由能变化,就使反应平衡位置的计算有了 可能,也就指出了某一化学过程的可实现性。 有兴趣的反应大多数发生在溶液中,任何这种反应的焓、熵和 自由能都与溶剂介质有关。 但是,热力学数据并不能说明是否存在一个能量上有利的潜在 反应途径,即反应速度上的情报。因此,深入了解反应机理以及 有机反应进行是中间所经各步的速度和能量要求是极为重要的。
高等有机化学-第4章-立体化学

性质 顺式 反式
1, 2-二氯乙烯顺反异构体的物理性质
μ/10-30C·m 6.34 0
b. p./℃ 60.3 47.5
d
20/g·ml-1
4
1.2837
1.2565
n20 D
1.4490 1.4454
m.p./℃ −80.5 −50.0
(二) 含C=N和N=N的化合物 在这些化合物的分子中,同样是由于键阻碍了双键两个原
NH2 NH2
(S)-(−)-2, 2’-二氨基-6, 6’-二甲基联 苯
分子中具有手性面的化合物:
(CH2)8
O
O
HOOC
(CH2)8
O
O
COOH
取代对苯二酚双环醚衍生物,其手性面是包括氧原子并与 苯环垂直的平面。
二. 前手性关系 前手性中心: 对于非手性分子如CH3CH2CH3,其C-2上的任一氢原子被取代 后所形成的两个新分子是完全一样的仍是一个非手性分子:
O
二重对称轴
C O
O
C O
1,6−二氧杂螺 [4,4] 壬烷
Cl
Cl
二重对称轴
Cl
反1,2−二氯环丙烷
Cl
分子中具有手性轴的手性分子:
H3C
CH3
CCC
H
H
(R)-(−)-1, 3-二甲基丙二烯
H3C
CH3
CCC
H
H
(S)-(+)-1, 3-二甲基丙二烯
CH3 CH3
CH3 CH3
NH2 NH2
(R)-(+)-2, 2’-二氨基-6, 6’-二甲基联 苯
H
H
C
CH3
CH3
高等有机化学第四部分4-6金属有机化合物

O
四、反应还被用来合成高分子(特殊 的高分子,如导电子分子)
X Ar MgCl
Ni (Ar)n
Br Ar Br+ (HO)2B Ar B(OH)2 Pd
(Ar) (Ar')
*从机理看反应应用了 a)O.A. b)烷基化 c)R.E.
R'M'
RX
M(O) O.A
R MX
M'X R
M R'
R R' +M(o)
实验二:
CH3 CH = CH CH3
+
CO3 CO = CO CO3
CH3 CH = CO CO3
"W"
CH3 CH = CH CO3
CH3 CO = CO CH3
CH3 CH = CO CH3
只有这种产物所以证明反应中没有氢或烷基的转移。
最早认为机理:
R M ⅡⅡ
M
R
R
RR
R
R
到1972年.E.O.Fishec发现:
1、
(CO)5CR = C
Ar OCH3
+ CH2 = C
CO3Et H
Ar CH2 = C OMe
2、
Ar (CO)5W = C Ar +
CH2 = C
OCH3 Ar
(CO)5W = C
R.E.
O ?Ⅱ ?Ⅱ ?Ⅱ
X_ Pd
OH
R
X
O
Pd R
HO ?Ⅱ ?Ⅱ H
O
Ph R CH CH2 + CO
O
Ph
R CH CH2 CO
O
β_ ⅡⅡ
O CH2 Rh CHR
高等有机化学课件第四章 有机化合物的芳香性

丁二烯的分子轨道能量
类似处理可以得到其它单环共轭体系的轨道能量为:
芳香体系的特征—芳香性是与分子轨道的“特殊 稳定性”相联系的。分子轨道理论假设,在芳香体系 中,除了碳-碳和碳-氢之间有键以外,还存在着一种 更稳定的键 (大键)。
Hü ckel对芳香化合物的特征用简单分子轨道理论 作了满意的解释,提出以sp2杂化的原子形成的含有 4n+2个电子的单环平面体系,具有相应的电子稳定性。 通常把这个规律称为4n+2规律。
光谱研究的结果表明苯分子具有六重对称性,其 中六个碳原子位于平面正六边形的角顶,六个碳-碳 键彼此相当。X-射线分析、电子衍射和偶极矩测定, 也都证明了苯的平面六边形结构。
苯的实验结构数据
共价键理论对苯结构的解释: 苯分子的各个键角都是120,因而碳原子必须采 取sp2杂化轨道,构成六个C-C 键和六个C-H 键。而 每一个碳原子的另外一个p电子轨道,则在与环垂直的 方向形成8字形的轨道相继重叠,均匀对称地配布在整 个环上,形成一个环状共轭体系。这里,电子公共化, 电子密度平均化,环上没有单键复键的区别。因而, 经典的定域化的价键结构式(环己三烯式)不能代表苯 的结构。
NMR研究证明蓝烃的芳香性。蓝烃分子的化学活 性相当于一个活泼的芳香化合物。亲电取代很容易地 发生在1(3)位置上,亲核取代发生在4(8)位置上。蓝烃 似乎不发生加成反应。这样的化学活性也表明此烃的 芳香性。 理论计箅的结果和测定的数值是一致。以此键长 与苯的键长(1.395Å)相比就表明了蓝烃的芳香性。9, 10-键显然没有参加共轭体系,因此可以把蓝烃看作 [10]轮烯。蓝烃的共轭能是302千卡/摩尔。
(3)富烯衍生物 富烯不很稳定,但是它的寿命和偶极矩 可以被环丙基和胺基所提高。富烯、6,6—二环丙基富 烯和6,6—二(二甲胺基)富烯的偶极矩分别为1.1,1.7和 5.4D。
高等有机化学第四章有机反应中间体解析

正电荷分散程度大
共轭体系的数目越多,正碳离子越稳定:
CH2 CH 3C > CH2 CH 2CH > CH2 CHCH2
当共轭体系上连有取代基时,供电子基团使正碳离子 稳定性增加;吸电子基团使其稳定性减弱:
CH3
CH2 >
CH2 > O2N
CH2
环丙甲基正离子比苄基正离子还稳定:
3C >
2CH > CH2 >
含有带负电荷的三价碳原子的原子团。 是最早被确认的活性中间体
1、碳负离子的结构
两种构型: 未共用电子对占据p轨道
未共用电子对占据sp3杂化轨道
有利构型!
桥头碳负离子 角锥结构可以快速翻转,不具有手性
三元环碳负离子难于翻转 得到构型保持的氘代产物
当碳负离子与相邻的不饱和体系共轭时,平面结 构变为有利结构
CH2
环丙甲基正离子的结构:
C
其结果是使正电荷分散
CH2
空的 p 轨道与弯曲轨道的交盖
随着环丙基的数目增多,
CH2
CH2
正碳离子稳定性提高。
直接与杂原子相连的碳正离子结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,未共有电子对离域, 正电荷分散。
CH3 O CH2
CH3O CH2
HC CH
NaNH3 液 NH3
HC CNa
NH3
Ph3C H
NaNH3 液 NH3
Ph3CNa
NH3
CH3COCH2COOEt NaOEt CH3COCHCOOEt
常用的碱 ■ 有机锂试剂:n-BuLi, PhLi, MeLi ■ KOBut ■ LDA
高等有机化学(书籍)

引言概述:《高等有机化学》是一本经典的有机化学教材,深入浅出地介绍了有机化学的基本原理、反应机制和合成方法。
本文将对该书的内容进行详细阐述,涵盖化学键的构成、有机反应的类型、手性化学、杂环化合物以及天然产物的合成等五个大点。
正文内容:一、化学键的构成1. 共价键的形成: 介绍原子之间共享电子对的过程,包括共价键的形成原理和优势。
2. 极性键的特点: 讨论共价键中电子云的不均匀分布引起的分子极性,以及极性键在化学反应中的作用。
3. 多重键的构成: 解释在化学键中存在的双键和三键,以及它们与单键在反应活性和空间结构上的差异。
4. 氢键的重要性: 介绍氢键在有机分子间相互作用中的关键角色,以及它们对化学反应速率和产物稳定性的影响。
二、有机反应的类型1. 取代反应: 阐述有机分子中取代基的进攻性和离去基的活性,以及它们在取代反应中的作用机制。
2. 加成反应: 讨论有机分子中π键的活性以及它们与电子云的相互作用,解释加成反应的机理和条件选择。
3. 消失反应: 介绍一些特殊条件下的消失反应,如弱酸、弱碱环境下的甲酸脱水和光化学反应等。
4. 消除反应: 详细论述消除反应的机制和条件,包括Beta消除和酯醇消除反应。
5. 重排反应: 解释重排反应的原理和分类,涵盖环状重排、离子重排和分子重排等。
三、手性化学1. 手性物质的定义: 介绍手性分子的结构和性质,以及手性物质在自然界和实验室中的重要性。
2. 手性中心的概念: 讨论手性分子中手性中心的定义和分类,并解释手性中心对分子结构和性质的影响。
3. 手性分离技术: 详细阐述手性分离的原理和应用,包括手性层析、手性色谱和手性合成等。
4. 对映体的描述: 探讨对映体的概念和性质,以及对映体间的对称性和非对称性。
5. 映像异构体: 解释芳香化合物中手性构象的特点和性质,并阐述双键对芳香环产物手性的影响。
四、杂环化合物1. 杂环化合物的分类: 介绍杂环化合物的命名规则和结构多样性,包括融合环、连接环和阶梯环等。
沈阳药科大学高等有机化学课件(胡春版)——第四章 芳香性

ph
O
O
+
+
.
ph
BF4-
ph
Cl
SbF5, SO2
+ +
-75oC,
-2Cl
离子体系的芳香性
CH3 CH3 CH3 Cl Cl CH3
CH3
SbF5, SO2 -75oC, -2Cl-
CH3 ++
+ 2SbF5Cl
CH3
CH3
..
Na -H2
+
Na+
O
_
2
_
+
FeCl2
Fe
2+ +
_
CH3COCl FeCl3 Fe
化学家Willstatter历时八年(19031911年),以伪石榴碱为原料经12步 反应,合成了一克多环辛四烯。
[10]轮烯,环癸五烯,无芳香性。
因环内氢的作用,发生了扭曲非 平面。
H H
[14]轮烯,14个π电子 ,无芳香性。 因环内氢的作用,发生了扭曲非平面。
HH HH
[18]轮烯,18个π电子,符合4n+2规则。经 X-射线衍射,环中碳碳键长几乎相等。整 个分子基本是处于同一平面上,说明了轮 烯内氢原子的排斥力是很微弱的,具有一 定芳香性。
2+
CCH3
_
_
H H
+ Ph3C+Br夺取负氢离子
+
Br-
AgNO3
+
+ AgBr
环庚三烯正离子 1891年合成
7 6
H O 1 2 O
O +
高等有机化学教案4酸和碱acidandbase

A cid - any substance w hich delivers hydrogen ion (H +) to the solution. HA H+ + A¯
B ase - any substance w hich delivers hydroxide ion (O H ¯ ) to the solution. BOH X+ + OH¯
Lew is acids are electrophils: H +, N a+, B F3,
Lew is bases are nucleophils: N H 3, H 2O , P H 3
A cid base reactions: BF3 + :NH3 F3B:NH3
Lewis at his desk. He generalized an idea.
H C 2H 3O 2 A l(H 2O )63+
H 2C O 3 H 2S
B r¯
C l¯
N O 3¯ H 2O S O 42¯ HSO3 ¯ H2PO 4 ¯ N O 2¯ F¯
C2H3O 2 ¯ A l(O H )(H 2O )52+ HCO3 ¯ HS ¯
The stronger the acid, the w eaker its conjugate base.
Polar Effects
Acid
pK a
Acid
CH 3 COOH
4.80
(CH
3
)
3
NC
+
H
高等有机化学(绪论)

伞形式
Br 键向后
在平面上
C
H
I
Cl
键向前
2. 烯烃:平面型
H2C CH2
平面型
CH3CH CHCH3
有顺反异构体 (双键不能旋转)
H C
H
H C
H
H3C C
H
CH3 C
H
顺式
H3C
CH3
or
H3C C
H
H C
CH3
反式
H3C or CH3
键线式
3. 炔烃:直线型
HC CH
HCC H
直线型
H3CC CCH2CH3
CCC C
直链
C CCC C
C
带侧链
C CC CC
环状
(二) 杂化轨道理论与有机分子结构
原子轨道理论(s 轨道、p 轨道) 共价键:两个带有自旋反平行单电子轨道的交叠 (s 键 和 p 键)
杂化轨道理论:成键之前原子轨道进行了重组
H
C
H
H
H C-H键长度相等
四面体型分子
H C
H
H C
H
有一根键较活泼
有机化学(Organic Chemistry) —— 研究有机化合物的组成, 结构, 性质 及其变化规律的科学
有机化合物 —— 含碳化合物 有机化合物中常见的元素
H
C B
NOF
Si P S Cl
Br
I
Friedrich Wöhler (German)的实验(1828年)
由氰酸铵(无机物)制得尿素(有机物)
第一节 有机化学的发展 有机化学和有机化合物 有机化合物的特点 学习有机化学的重要性
一. 有机化学和有机化合物 生命力论与早期的有机化学(1828年之前)
2024年度有机化学(第四版)全套课件(新)

27
醇、酚、醚的制备方法和应用
制备方法
醇可以通过烯烃的水合反应、卤代烃的还原反应等方法制备;酚可以通过芳烃的磺化反 应、卤代芳烃的水解反应等方法制备;醚可以通过醇的脱水反应、威廉姆森合成法等方
法制备。
应用
醇、酚、醚在有机合成、医药、农药、染料等领域具有广泛的应用。例如,乙醇可用作 溶剂和消毒剂;苯酚可用于合成酚醛树脂和染料;乙醚可用作麻醉剂和有机溶剂等。
应和氧化反应等。
不同结构的芳香烃具有不同的化 学性质。例如,苯环上带有给电 子基团的芳香烃更容易发生亲电
取代反应。
2024/3/24
17
苯环上亲电取代反应的定位规律
01
苯环上亲电取代反应的 定位规律是指反应中亲 电试剂进攻苯环的位置 选择规律。
2024/3/24
02
定位规律受取代基效应 影响,给电子基团使苯 环活化,吸电子基团使 苯环钝化。
• 亲核试剂的性质:亲核试剂的亲核性和浓度对亲核取代反应的速率有很大影响 。亲核性越强,反应速率越快;浓度越高,反应速率也越快。
• 溶剂效应:溶剂对亲核取代反应也有影响。极性溶剂有利于SN2反应的进行, 而非极性溶剂有利于SN1反应的进行。此外,溶剂的粘度、极性等性质也会影 响反应的速率和选择性。
• 温度和催化剂:温度对亲核取代反应的速率也有影响。一般来说,升高温度有 利于反应的进行。有些卤代烃的亲核取代反应需要催化剂的参与,如路易斯酸 等,它们可以降低反应的活化能,从而加快反应速率。
12
炔烃和二烯烃
2024/3/24
炔烃
含有碳碳三键的脂肪烃,性质活泼,可发生加成、氧化等反 应。
二烯烃
含有两个碳碳双键的脂肪烃,具有共轭效应,稳定性增强, 可发生1,2-加成或1,4-加成等反应。
高等有机化学 第四章 亲电加成反应(2010)

implies formation of a complex between one
molecule of the reagent and the reactant and also
is expected to result in anti addition.
11
(2)双分子历程 ① 碳正离子历程
H
+
+
13
CH3 C C H H
DCl CH3COOD
D
+C
D Cl C C CH3 H H
C CH3 H
H
通常不具有立体选择性
CH CH3 3 + CH3 + H2O CH3 H
+
CH3 CH3 顺式 OH HO + H CH3
H
OH
OH CH3 H CH3
反式
CH3 H
14
有时有重排产物出现
鎓离子存在的直接证据?
Biadamantylidene bronomium
19
(3)三分子历程(AdE3)
某些非共轭烯烃与HX加成按AdE3历程进行。
立体化学通常为反式加成
20
complex
21
HBr + H3C C C H H H CH3 H3C C C CH3 H
22
2. 烯烃亲电加成反应的立体化学
5
(2) Formation of carbocation ion pair from
alkene and electrophile.
6
Mechanism(2)also involves a carbocation intermediate, but it is generated in the presence of an anion and exists initially as an ion pair. Depending on the mutual reactivity of the two ions, they might or might not become free of one another before combining to give product.
高等有机化学 课件 分子结构与化学活性间的定量关系

但是邻位取代苯甲酸衍生物和脂肪酸衍生物却不是这样。苯甲酸及其对位取代 衍生物仍在一条直线上,而O-NO2 和O –Cl 苯甲酸衍生物远离于直线的一边,乙 酸和乳酸则远离于直线的另一边。
p-NO2 m-Br m-Cl p-Br p-Cl p-CH3 H p-CH3O m-CH3O CH3 C 6 H5 m-NO2 CH3CHOH
(y=bX + c)
是一个直线方程,其中r 为直线的斜率,c为直线的截距,两者都是常数。 进行其他化学反应时,如醇解反应,所测定的反应速度常数照同样方式作图, 也得线性关系,只是斜率和截距不同。由此可见这种线性关系具有一定的普 遍性。对于未取代苯甲酸酯和苯甲酸也可以写出同样的方程式。
lg k0=rlg Ka0 + c
列出了有些对位取代基的 s+ 和 s值。
例如:对芳环的亲电取代反应,使用 s 值作图不能得到一条好的直线,而用 s+ 值代 替的时候得到很好吻合的直线。
5.0
lgk/lgk0
CH3 Br2 R 硝基甲烷 R
C
0.2
0.4
见87页图4-3。
三、哈米特方程的应用
利用哈米特方程及相应的 s 和 r 值,可预测某些化学反应速度和化学平衡;了解有 关过渡态或中间体的反应中心部位的部分电荷符号和大小及反应机理。 (一)计算 k 值和 K 值 例 1 已知间硝基苯甲酸乙酯碱催化水解比相应未取代的苯甲酸酯在相同条件下 快 63.5 倍;问在该条件下对甲氧基苯甲酸乙酯水解的相对速度是多少? 查表4-1 的 s 值,s
例 2 已知苯乙酸的 pKa =4.31,求对氯苯乙酸的 pKa? 查表可知 s p-Cl = 0.23 和 r = 0.56,再根据公式; pKa = pKa0-rs = 4.31-0.56 x 0.53 = 4.18 实测值 4.19 目前哈米特方程的应用范围还在扩大。例如。就酸性强的 Ka 的考察来 说,哈米特方程不仅适用于苯环,也适用于以下各种类型的化合物:
高考化学选修四知识点

高考化学选修四知识点高考化学选修四是高中化学的重要内容之一,其涉及到化学领域内的多个知识点。
其中,较为重要的知识点包括有机化学、化学反应原理、物质与能量转化等。
下面,本文将分别对这三方面的知识点进行介绍。
一、有机化学有机化学是高考化学选修四中的重要组成部分,该领域内重点掌握关于有机物的组成成分、结构特征及反应机制等相关知识。
例如,根据分子结构,有机物可分为链状、环状和支链性等不同类型。
此外,有机化学还包括有机物的反应机制,其中,酯化反应、加成反应和还原反应等是其中比较重要的几种类型。
在学习有机化学的过程中,还需要了解不同有机物之间的化学性质以及它们在实验室中的制备方法。
二、化学反应原理在学习选修四的化学时,我们还需要了解一些基本的化学反应原理,这包括酸碱中和反应、氧化还原反应以及配位反应等。
在这些反应原理中,酸碱中和反应是化学反应中的基础之一,它涉及到酸、碱物质之间的互相转化以及最终形成盐和水等。
而氧化还原反应则是化学反应中的重要一环,它涉及到物质中的电荷转移以及由此产生的反应产物。
此外,还需要掌握一些重要的化学反应实验方法,例如测定一些物质的电荷数、溶液的浓度以及某些重要元素的存在形态等。
三、物质与能量转化物质与能量转化是选修四化学中的另外一个重要方面。
学生需要深入地了解不同物质之间的相互转化形式以及它们对于能量的消耗和生产。
在这方面,热化学是其中一个非常重要的领域,它涉及了各种热力学变化与能量耗散问题。
此外,学习选修四化学还需要了解一些基本的化学计算方法,例如计算化学平衡反应、有机物的结构和化学性质等重要参数。
在实验室中,还需要学习一些基本的化学实验方法和测试技巧,以便更好地分析实验数据和进行相关科学研究。
总之,高考化学选修四涵盖了众多的知识点和学习内容,包括有机化学、化学反应原理以及物质与能量转化等多个方面。
如果想要在高考中取得优异的成绩,就需要认真学习丰富的化学知识,并且将这些知识应用到实际的化学实验中,加深自己的理解和掌握程度。
高等有机化学课件4金属有机化学-1

金属有机化学
Reference:
①A.Yamamoto, “Organotransition Metal Chemistry” ② A.W.Parkins & R.C.Poller.“An Introduction to Organicemctalliv Chemistry” ③ S.G.Dauies,“Orgametransition Metal Chemistry Application to Organic Synthesis”
金属有机化学的发展历史:
1827年:发现Zeise盐
Cl CH2 Cl Pt CH2 Cl K H2O
1900年:发现Grignard试剂RMgX,(Grignard获 1912年诺贝尔奖)
(Fisher和Wilkinson获 1973年诺贝尔奖)
1952年:发现二茂铁
Fe
1955年:Ziegler-Natta催化剂发现 (Ziegler Natta获1963年诺贝尔奖) 1973年:Fisher.E.O.和Wilkinson获诺贝尔奖 1976年:Lipscowle.B-H键结构获诺贝尔奖 1979年:Brown.Wittig获诺贝尔奖 1981年:Hoffmamn(Richard)提出金属有机化 合物“等瓣性类似”概念。
目录
4-1 引言 4-2 金属有机化合物的结构 4-3 过渡金属-碳键 4-4 金属有机化合 4-5 过渡金属有机化合物的基元反应 4-6 金属有机化合物在有机合成中应用
4-1 引言
金属有机属有机化学与无机化学的交叉 学科,作为一个完整的学科它是在50年代形 成的,自那以后金属有机化学取得了突飞猛 进的发展,现在已经成为化学中最高生命力 的分支之一。如果作为一门课程来讲授也是 分量很重的一门课程。 金属有机化学之所以要被重点讲授, 这不仅是因为它在有机化学中占有很重的份 量,(目前的合成反应中80%包含有金属物 种),更重要的是金属有机化合物有其独特 的化学键理论和反应性能。
高等有机化学课件4金属有机化学-4金属有机化合物的制备共21页PPT

13、遵守纪律的风气的培养,只有领 导者本 身在这 方面以 身作则 才能收 到成效 。—— 马卡连 柯 14、劳动者的组织性、纪律性、坚毅 精神以 及同全 世界劳 动者的 团结一 致,是 取得最 后胜利 的保证 。—— 列宁 摘自名言网
15、机会是不守纪律的。——雨果
31、只有永远躺在泥坑里的人,才不会再掉进坑里。——黑格尔 32、希望的灯一旦熄灭,生活刹那间变成了一片黑暗。——普列姆昌德 、希望是人生的乳母。——科策布 34、形成天才的决定因素应该是勤奋。——郭沫若 35、学到很多东西的诀窍,就是一下子不要学很多。——洛克
高等有机化学课件4金属有机 化学-4金属有机化合物的制备
11、战争满足了,或曾经满足过人的 好斗的 本能, 但它同 时还满 足了人 对掠夺 ,破坏 以及残 酷的纪 律和专 制力的 欲望。 ——查·埃利奥 特 12、不应把纪律仅仅看成教育的手段 。纪律 是教育 过程的 结果, 首先是 学生集 体表现 在一切 生活领 域—— 生产、 日常生 活、学 校、文 化等领 域中努 力的结 果。— —马卡 连柯(名 言网)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Wittig-Horner反应
(EtO)3P + RCH2Br
亚磷酸酯
EtO + O Et
-EtBr
P EtO CH2R
Br-
R'CHO R
H Mechanism:
H
O
+ (EtO)2P-O-Na+ R'
溶于水
OEt
O O P OEt + -C
R' H H R
(2) 立体选择性高, 以E-型产物为主, 副产物二乙基磷酸盐溶于水, 容易除去23.
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Wittig-Horner反应的应用
1.
NaH
O + (EtO)2P(O)CH2CO2Et
CHCO2Et 67-77%
2.
NaOEt
O + (EtO)2P(O)CH2CO2Et
3
Ph Me
Ph
Ph Ph
Proposed mechanism: Cl4Sn
Cl4Sn O
O
-HCl
CH2 Me
H Ph C
H2
Cl3Sn O Ph
Ph O Me
Ph H
OSnCl4 Ph
Cl4Sn
SnCl4
H O H2C
Cl3Sn -HCl
O
CH2
O Me Ph
Ph
Ph
Ph
第四章 碳杂不饱和键的亲核加成
许家喜 北京化工大学
1. 醛酮C=O键的亲核加成 2. 亚胺C=N键的亲核加成 3. 腈CN键的亲核加成 4. 累积双键的亲核加成
1
醛酮羰基的亲核加成
醛酮羰基的亲核加成. 反应机理.
亲核试剂亲核性弱时需要酸催化, 增加亲电试剂亲2电性
醛酮羰基的亲核加成
醛酮羰基的亲核加成.
Me2CHCHO + CH2(CO2Et)2
PhH
Me2CHCH=C(CO2Et)2 90%
CO2H
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 安息香缩合反应
俗称安息香
CN增加了H的酸性
29
30
5
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 安息香缩合反应
俗称安息香
31
32
醛酮羰基的亲核加成
Ph
Ph O
SnCl4
38
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 醛缩合反应: 交叉缩合 (醛酮一个有-氢, 另一个无-氢) (i)甲醛的羟甲基化反应(HCHO)
OHHCHO + CH3CHO
2HCHO
HCHO
HOCH2CH2CHO OH-
(HOCH2)3CCHO con. OH-
OH-
醛酮羰基与含碳亲核试剂的亲核加成 羟醛缩合反应(Aldol reaction).
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 羟醛缩合反应(Aldol reaction). 应与机理
33
34
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 羟醛缩合反应的可逆性.
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 羟醛缩合反应:自身缩合 (醛易, 酮难)(分子间缩合)
与R2CuLi的加成反应
O + R2CuLi Et2O
H3O+
HO
R
与炔化物的加成反应
13
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 与Grignard试剂的加成
Ph Et H
HO
O MgX
Et
H
R
HPh
H
H
H3O+ HO
RR +
OH
Et
Ph Et
Ph
H
H
Major
Minor
空间位阻对反应的影响.
43
44
醛酮羰基的亲核加成
醛酮羰基与含氮亲核试剂的亲核加成 与氨及其衍生物反应生成亚胺及其衍生物
14
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Reformasky反应
15
只与醛酮反应, 且位阻不能太大, 不与酯反应.
16
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Darzens反应 :
R1 O + BrCHCO2Et NaNH2 or NaOEt R1 O R
R2
R
R2 CO2Et
C=O碳上的H来自NaBH4, KBH4, 氧上的H来自H3O+.
1) 孤立双键被还原(亲电加成).
9
2) C=O碳上的H来自BH3, 氧上的H来自H3O+.
10
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 与HCN的加成
有机玻璃
11
12
2
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 与烷基锂的加成反应
4
醛酮羰基的亲核加成
醛酮羰基与含氢试剂的亲核加成(醛酮的还原) 醛酮与LiAlH4, NaBH4, KBH4, BH3的亲核加成
1)孤立双键不被还原.
2)C=O碳上的H来自LiAlH4, 氧上的H来自H3O+.
5
6
1
醛酮羰基的亲核加成
醛酮羰基与含氢试剂的亲核加成(醛酮的还原) 醛酮与LiAlH4的亲核加成(需要在无质子溶剂中进行,一般用THF和乙醚)
OH HCHO
OH
CHO + HCHO
O con. OH-
OH
(HOCH2)4C + HCO2Na
两个醛酮均无-氢, 发生什么反应?
两个醛酮均有-氢, 反应情况如何?
39
40
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 羟醛缩合反应: 交叉缩合 (醛酮一个有-氢, 另一个无-氢) (ii)Claisen-Schmidt反应(ArCHO, 由于失水得共轭产物稳定, 很易得失水产物)
CH2NH2 O
CO2H +
OH O
H2O
OH
OO
major
香豆酸
香豆素
27
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成
Knoevenagel反应(-二羰基化合物与醛酮的反应)(Perkin反应的改进) 用活泼亚甲基化合物代替了酸酐, 任何醛酮均可以反应, 扩大了应用范围. 用弱碱Py, 哌啶, 一二级胺代替了羧酸盐, 可以减少醛酮的副反应. 降低了反应温度, 提高了产率. (有时会加入一点有机酸作催化剂,促进脱水).
41
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 定向缩合 (两个醛酮均有-氢) (i)对称酮和醛的定向缩合
将乙醛气体通入KOH/丙酮中 (Me2CH) 2NH pKa 40 RCOMe pKa 20
42
7
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 定向缩合 (两个醛酮均有-氢) (ii)非对称酮和醛的定向缩合
OH2+ -H2O R
R
R'
R'
Z Z'
28
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Knoevenagel反应
O2N O
CO2H Py
CHO + H2C
CO2H
O2N
Alanine-HOAc
+ NCCH2CO2Et
PhH
CO2H -CO2
CO2H
O2N
CN
CO2Et 85%
74-80%
piperidine-HOAc
(4)选择合适的碱制备磷叶立德.
19
20
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Wittig反应
1. MeO
O OEt + Ph3P+--CH2
O
MeO
CH2 OEt
O
2. PhCHO + Ph3P+CH2Ph Cl- NaOEt
Ph
H Ph +
Ph
H Ph H H
41%
35%
3.
O
CH3CHO + Ph3P+ -C Me CH2Cl2 H
O
OO
O
O Ar O R
R
R O
O-
O
R
R
O Ar O O
O
O
RH
O R + -O
-RCH2CO2H R
R
O Ar O O
O -O R
R
-RCH2CO2-
OO R
H2O
Ar
CO2H
25
Ar
O
-RCH2CO2H
R
26
R
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Perkin反应 芳香醛和杂环芳香醛均可以反应, 简单脂肪醛不反应; 产物以反式为主.
Me
Me
O Me
Me
96%
O PPh3
H
COMe
Me
Me
stable
4. PhCH=CHCH=O
+
Ph3P+--CHCO2Et
PhCO2H
PhCH=CHCH=CHCO2Et
O PPh3
H
Me
Me
COMe
unstable
21
醛酮羰基的亲核加成
醛酮羰基与含碳亲核试剂的亲核加成 Wittig反应的应用
