高等有机化学汇总
高等有机化学试题及答案文库

高等有机化学试题及答案文库高等有机化学试题及答案文库________________________________高等有机化学是一门重要的理论和应用结合的科学,它不仅是药物研究的基础,而且也是重要的工业原料和产品制造工艺的基础。
对于初学者来说,需要通过不断的练习来巩固学习成果。
一、有机化学试题及解析1、下列关于有机物分子式正确的是()A、乙烯C2H2B、乙醇CH2OHC、乙醛CH2OD、乙酸C2H3O2正确答案:A、B、C、D2、下列关于构象正确的是()A、乙烯具有均相异构象B、乙醇具有对映异构象C、乙醛具有对映同构象D、乙酸具有均相同构象正确答案:A、B、C3、下列关于有机物的反应性正确的是()A、甲醛可以通过加氢反应得到甲醇B、乙醛可以通过加氢反应得到乙醇C、丙酸可以通过加氢反应得到丙醇D、甲酸可以通过加氢反应得到乙醇正确答案:A、B、C4、下列关于有机物的性质正确的是()A、甲醛是一种无色气体B、乙醇是一种清澈无色液体C、丙酸是一种混浊的无色液体D、甲酸是一种无色固体正确答案:A、B、D二、有机化学试题及解析进阶1、下列关于芳香族化合物正确的是()A、苯可以与甲酸反应得到对甲苯胺B、乙醛可以通过氧化反应得到甲醛C、苯乙酮可以与甲酸反应得到对甲基苯胺D、苯乙酮可以通过氧化反应得到乙醛正确答案:A、C2、下列关于芳香族化合物性质正确的是()A、苯是一种无色气体B、乙醇是一种清澈无色液体C、苯乙酮是一种混浊的无色液体D、对甲基苯胺是一种无色固体正确答案:A、C、D3、下列关于有机物的合成方法正确的是()A、甲基胺可以通过Fischer-Tropsch合成法合成B、乙酸可以通过Friedel-Crafts反应合成C、甲基胺可以通过Friedel-Crafts反应合成D、乙酸可以通过Fischer-Tropsch合成法合成正确答案:B、C4、下列关于有机物的催化剂正确的是()A、甲基胺合成所需要的催化剂是金属钴B、乙酸合成所需要的催化剂是金属银C、甲基胺合成所需要的催化剂是金属铜D、乙酸合成所需要的催化剂是金属钛正确答案:A、B三、有机化学实验室实践1、下列实验室中常用仪器正确的是()A、真空泵B、真空测定仪C、气体流量计D、真空干燥仪E、真空分子泵F、气体分析仪G、浊度仪正确答案:A、B、C、D、E、F2. 下列实验室中常用试剂正确的是()A. 硝酸盐试剂B. 氢氧化物试剂C. 碘试剂D. 过氧化物试剂正确答案:A, B, C, D。
高考化学基础知识:有机化学的常识

高考化学基础知识:有机化学的常识
1.能发生银镜反应的物质有:醛类、葡萄糖,麦芽糖、甲酸、甲酸盐、甲酸酯等。
2.能发生显色反应的有:苯酚遇Fe3+溶液显紫色;淀粉遇I2显蓝色;蛋白质遇浓硝酸显黄色;多元醇遇Cu(OH)2
显绛蓝色。
3.能与活泼金属发生置换反应生成H2的物质有醇、酚、羧酸。
置换反应不属于取代反应。
4.能发生缩聚反应的物质有:苯酚与醛(或酮)、二元羧酸与二元醇、二元羧酸与二元胺、羟基酸、氨基酸等。
5.需要水浴加热的实验有:制取硝基苯、制取苯磺酸、制取酚醛树脂、银镜反应、酯的水解、二糖水解等。
6.光照条件下能发生的反应有:烷烃与卤素的取代反应、苯与Cl2的加成反应(紫外光)。
7.常用的有机鉴别试剂有:新制Cu(OH)2、溴水、KMnO4(H+)溶液、银氨溶液、NaOH溶液等。
总结:小编整理的高考化学基础知识有帮助到大家吗?如果大家还需要了解有关学习的内容,请关注。
祝大家天天开心。
浏览了本文的读者也浏览了:
高三化学知识点汇总
高考化学复习笔记整理
更多精彩内容尽在:首页 gt; 高中 gt; 高三 gt; 高三化学 gt; 高三化学知识点。
高等有机化学

(氯甲酸乙酯)
NaCl
+ RCON3
H2O + RCON3
(70%)
+
NaN 3
C 2H5O C N 3 O
(叠氮基甲酸酯)
ROCO
N3
hv or
RO C N : + N2 O
3、消除反应
烷氧羰酰乃春由N-(对硝基苯磺酰氧基)胺基甲酸酯在碱存在下消
除反应得到:
ROCONHOSO 2 NO 2 KOH
二、高等有机化学
1、高等有机化学(Advanced Organic Chemistry)是基础有 机化学的深化和提高。
2、有机化学结构与性能的关系是高等有机化学的基本研究内 容之一。 3、对于有机化合物的结构研究,高等有机化学主要以物理测 试方法为主 。
三、高等有机化学的发展
1、由宏观观测向微观观测发展 2、由静态立体化学向动态立体化学的发展 3、量子化学的应用 4、研究由简单体系向复杂体系延伸
:CH2>:CHCl>:CCl2>:CBr2>:CF2
C X
+
: CH2
C CH2
X
(X=H,Cl,O,N,etc.),碳碳键不能插入
hv CH3CH2CH2CH2CH3 + CH2N2 o CH3CH2CH2CH2CH2CH3 + CH3CH2CH2CHCH3 + CH3CH2CHCH2CH3 -75 C
Cl (1) Na / NH3 (2) O 3 NaBH4 MeOH O
OH
CH3COCl NaH CH3I , NaH
OCOCH3
OCH3
第二节
乃春 (Nitrenes)
高等有机化学pdf

高等有机化学pdf
1 高等有机化学
高等有机化学是一门综合性学科,它涉及有机化合物的结构、性质、反应机理、反应性等方面的研究。
它在天然产物的化学结构和分离方法、有机合成等方面具有重要意义,为新型有机物质的开发创造了条件,如药物、农药等。
高等有机化学研究的概念有以下几个:一是研究有机物质在反应条件下发生的既定反应;二是定量和定性研究有机物质的反应;三是研究新型有机化合物的合成;四是研究有机结构的改变;五是利用物质的运动模式和定性或定量方法研究有机反应。
有机化学常用的分析化学方法有:熔点测定法、溶解度检测法、中和反应检测法、灰量分析法、红外光谱分析法、核磁共振波谱法、气相色谱法和质谱法。
它们能够有效的测定待测物质的性质,以及进行反应机制检验,有助于研究有机物质的合成路线、结构以及反应机理,可以帮助科学家们更好的理解自然界或生物界的物质的种类的复杂性。
此外,采用高等有机化学方法可以制备新型合成有机物质,如新型小分子活性物质、纳米生物物质、光子学功能等,这些有机物质可以在各个领域服务于人们,如医药、农药、食品、化妆品、非金属材料等。
总之,高等有机化学是一门重要的学科,它的研究给科学家提供了深入理解有机物质的方法并探究一些没有解决的有机物质及它们的反应机理的可能性,给这些领域的开发带来了许多希望。
高等有机化学

6、水解反应
(1)积二卤化物水解
ArCH3 X2 ArCHX2 H3O+ ArCHO
(2)炔、炔化物水解
H2O H H HgSO4,H2SO4 CH3CHO
7、重排反应
(1)邻二醇重排
R2C CH2 R2CHCHO
OH OH (2)乙烯基、烯丙基醚重排(Claisen重排)
CH2=CHOCH2CH=CH2
1.O3 CH R HCHO +RCHO 2.Zn-H2O
HIO4
RCHO + R'CHO
(4)烯烃的臭氧化
CH2
(5)伯卤代烃的氧化
O
RCH2X + CH3SCH3 NaHCO3
+ [RCH2OS(CH3)2]X
RCHO + (CH3)2S + HX
(6)芳烃的侧链氧化
CrO3 乙酐 ArCH(OCOCH3)2 HCl-H2O ArCHO
LiAlH(OR')3 RCOZ RCHO (Z=OR',NR'2,OH)
H2O-HOAc- 吡啶
+ H3O RCHO
(3)腈的还原
HCl
a. RCN
RCHO
b. RCN
RC=NH HCl SnCl2-HCl Cl
RCH=NH
3、甲酰化反应 (1)Gattermann-Koch反应
ArH + CO + HCl
a. ArCH3
b. ArCH3
O
MnO 2
SeO2
ArCHO
c. ArCCH3
ArCOCHO
高中有机化学方程式汇总(全)(已免费)

24.
+ 3H2
催化剂 △
CH3
CH3
25. +3HO-NO2 催化剂 O2N
NO 2+3H 2O
26.
3CH≡ CH→
NO2
27. CH3CH 2Br + H2O NaOH CH 3CH2OH + HBr
H 2O
28. CH3CH 2Br + NaOH
CH 3CH2OH + NaBr
29. CH3CH 2Br+ NaOH
催化剂
13. nCH2=CH-CH=CH 2
[CH 2-CH=CH-CH 2] n
催化剂
14. 2CH2 = CH2 + O2
2CH3CHO
15. CH≡CH + Br 2
CHBr = CHBr
16. CHBr = CHBr+ Br 2
CHBr 2- CHBr 2
17. CH≡CH + HCl
催化剂 △
C17H35COO-CH 2
O O CH 2-OH
58. CH 2OH COOH +
CH 2OH COOH
1. CH 4 Cl 2 光
浓硫酸 △
C— C
O
O + 2H 2O
CH 2- CH 2
CH 3Cl HCl
光
CH 3Cl Cl 2
CH 2Cl 2 HCl
ห้องสมุดไป่ตู้
2.
3.
4. 5.
6.
7. 8.
CH 2 CH CH CH 2 Br2
52. C12H22O11+H2O 催化剂 C6H12O6+ C6H12O6
高等有机化学总结

前言
什么是高等有机化学? 物理有机化学是怎样的学科? 物理有机化学的内容主要是什么? 物理有机化学的研究方法怎样?
第一部分 有机化合物结构理论和结构 -性能关系
有机化合物的结构理论有那些? 取代基效应是怎么回事?包括那些具体类型? 什么是芳香性?常见的有机芳香结构有那些? 什么是酸碱性?各类有机化合物酸碱性大概如何? 什么是有机立体化学?立体异构体有那些类型? 有机化合物结构-性能关系如何定量化?
第二部分 有机活性中间体
什么是有机活性中间体? 常见的有机活性中间体有那些? 每种有机活性中间体,它的定义、种类、结 构、稳定性、生成、反应、检定如何?
第三部分 有机反应机理
什么是有机化学反应?有机化学反应分类的 依据是什么? 有机反应理论有那些?研究有机反应机理的 方法有那些? 常见的有机反应机理类型有那些? 每种反应反应机理类型,它的定义、具体反 应机理、影响因
高考化学必背:有机化学知识模块

高考化学必背:有机化学知识模块【】:高三是紧张又充溢应战的一年,在这一年里,同窗们一定要掌握住分分钟的时间,温习好每门功课,查字典化学网为大家整理了2021高考化学必背,供大家参考。
1.羟基官能团能够发作反响类型:取代、消去、酯化、氧化、缩聚、中和反响正确,取代(醇、酚、羧酸);消去(醇);酯化(醇、羧酸);氧化(醇、酚);缩聚(醇、酚、羧酸);中和反响(羧酸、酚)2.最简式为CH2O的无机物:甲酸甲酯、麦芽糖、纤维素错误,麦芽糖和纤维素都不契合3.分子式为C5H12O2的二元醇,主链碳原子有3个的结构有2种正确4.常温下,pH=11的溶液中水电离发生的c(H+)是纯水电离发生的c(H+)的104倍错误,应该是10-45.甲烷与氯气在紫外线照射下的反响产物有4种错误,加上HCl一共5种6.醇类在一定条件下均能氧化生成醛,醛类在一定条件下均能氧化生成羧酸错误,醇类在一定条件下不一定能氧化生成醛,但醛类在一定条件下均能氧化生成羧酸7.CH4O与C3H8O在浓硫酸作用下脱水,最多可失掉7种无机产物正确,6种醚一种烯8.分子组成为C5H10的烯烃,其能够结构有5种正确9.分子式为C8H14O2,且结构中含有六元碳环的酯类物质共有7种正确10.等质量甲烷、乙烯、乙炔充沛熄灭时,所耗用的氧气的量由多到少正确,同质量的烃类,H的比例越大熄灭耗氧越多11.棉花和天然丝的主要成分都是纤维素正确,棉花、天然丝、天然棉、玻璃纸都是纤维素12.聚四氟乙烯的化学动摇性较好,其单体是不饱和烃,性质比拟生动错误,单体是四氟乙烯,不饱和13.酯的水解产物只能够是酸和醇;四苯甲烷的一硝基取代物有3种错误,酯的水解产物也能够是酸和酚14.甲酸脱水可得CO,CO在一定条件下与NaOH反响得HCOONa,故CO是甲酸的酸酐错误,甲酸的酸酐为:(HCO)2O15.运用取代、加成、恢复、氧化等反响类型均能够在无机物分子中引入羟基正确,取代(卤代烃),加成(烯烃),恢复(醛基),氧化(醛基到酸也是引入-OH)16.由自然橡胶单体(2-甲基-1,3-丁二烯)与等物质的量溴单质加成反响,有三种能够生成物正确, 1,2 1,4 3,4 三种加成方法17.苯中混有己烯,可在参与过量溴水后分液除去错误,苯和1,2-二溴乙烷可以互溶18.由2-丙醇与溴化钠、硫酸混合加热,可制得丙烯错误,会失掉2-溴丙烷19.混在溴乙烷中的乙醇可参与过量氢溴酸除去正确,取代后分液20.运用干馏方法可将煤焦油中的苯等芬芳族化合物分别出来错误,应当是分馏21.甘氨酸与谷氨酸、苯与萘、丙烯酸与油酸、葡萄糖与麦芽糖皆不互为同系物错误,丙烯酸与油酸为同系物22.裂化汽油、裂解气、活性炭、粗氨水、石炭酸、CCl4、焦炉气等都能使溴水褪色正确,裂化汽油、裂解气、焦炉气(加成)活性炭(吸附)、粗氨水(碱反响)、石炭酸(取代)、CCl4(萃取)23.苯酚既能与烧碱反响,也能与硝酸反响正确24.常温下,乙醇、乙二醇、丙三醇、苯酚都能以恣意比例与水互溶错误,苯酚常温难溶于水26.分子式C8H16O2的无机物X,水解生成两种不含支链的直链产物,那么契合题意的X有7种正确,酸+醇的碳数等于酯的碳数27.1,2-二氯乙烷、1,1-二氯丙烷、一氯苯在NaOH醇溶液中加热区分生成乙炔、丙炔、苯炔错误,没有苯炔这种东西28.甲醛加聚生成聚甲醛,乙二醇消去生成环氧乙醚,甲基丙烯酸甲酯缩聚生成无机玻璃错误,乙二醇取代生成环氧乙醚,甲基丙烯酸甲酯加聚生成无机玻璃29.甲醛、乙醛、甲酸、甲酸酯、甲酸盐、葡萄糖、果糖、麦芽糖、蔗糖都能发作银镜反响错误,蔗糖不是恢复性糖,不发作银镜反响30.乙炔、聚乙炔、乙烯、聚乙烯、甲苯、乙醛、甲酸、乙酸都能使KMnO4(H+)(aq)褪色错误,聚乙烯、乙酸不能使酸性高锰酸钾溶液褪色。
高等有机化学 课件总结

芳胺重氮化形成的重氮离子在5°C以下比较稳定,能与弱碱性的酚或弱酸性的芳胺
2010-6-29
C正离子 正离子的形成容易引起分子结构的重排: 正离子 化-脱汞反应则使原烯烃的C结构得到较好的保持. 胺基钠反应形成端炔C负离子.
同一烯烃 同一烯烃,酸催化水合时会发生重排;羟汞
端炔烃具有一定的酸性,pKa在25左右,能与 卤代烃在有机合成中具有十分重要的作用,
2010-6-29
�
课程总结
2010-6-29ቤተ መጻሕፍቲ ባይዱ
叔丁醇与含酸伯醇可用于合成不对称醚.伯醇的质子化,使难离去基团-羟基转化为易离去基团 水分子,反应可获较好的收率. 一般说来,醛酮的亲电活性比酯高,利用缩醛(酮)可对羰基进行保护.伯胺和仲胺能与 醛,酮形成亚胺,烯胺. 酚羟基具有邻对位活化性能,酚氧负离子活性更高. 发生耦合反应.
除了制备各种试剂,其本身既可进行亲核取代反应, 也能进行消除反应: 伯卤代烃与位阻小的强碱易于进行S 取代反应 取代反应, 伯卤代烃与位阻小的强碱易于进行 N2取代反应, 与位阻强碱易于进行E2消除反应 消除反应;对于仲卤代烃, 仲卤代烃, 与位阻强碱易于进行 消除反应 仲卤代烃 与强碱易于进行E2消除反应 消除反应, 与强碱易于进行 消除反应,弱碱强亲核试剂易于 取代反应;叔卤代烃与强碱易于进行 消 进行SN2取代反应 叔卤代烃与强碱易于进行E2消 进行 取代反应 叔卤代烃与强碱易于进行 除反应,与弱碱弱亲核试剂易于进行S 亲核取代 除反应,与弱碱弱亲核试剂易于进行 N1亲核取代 反应. 反应
高等有机化学之有机化学取代基效应汇总.

Substituent Effects in Organic Chemistry
Substituent Effects
一. 诱导效应 Inductive Effect
二. 共轭效应 Conjugative Effect
三. 超共轭效应 Hyperconjugation Effect
四. 场效应
诱导效应 共轭效应
超共轭效应
一. 诱导效应 (Inductive effect I )
δ
C
Cδ
δ 取代基的影响:沿分子链传递
ቤተ መጻሕፍቲ ባይዱ
Cl
导致电子云密度分布
δδ
C C Cl
Cδ
δ
C
Cl
不均匀 取代基性质
方向 转移的结果
结构特征: 单、双、叁键 传递方式:σ、π键 传递强度:与距离相关。距离越远,强度越弱。
诱导效应的相对强度:
O R C OH
O R C O+ H
相对强度: C C C Y
(I)
CCX
(II)
Y为吸电子基团时-吸电子共轭效应 (-C), X为供电子基团时-给电子共轭效应 (+C).
共轭效应的强度取决于取代基中的中心原子的电负性 与主量子数的大小。
电负性越大,-C越强。
π-π共轭体系:
同周期元素,随原子序数增大,-C 增强:
Field Effect
五. 空间效应 Space Effect
有机合成化学
C-C键的形成和断裂 C-X键的形成和断裂
有
机
合
试剂,催化剂
成
方
法
温度,溶剂
学
中间体 生成
中间体 相互转化
高等有机化学

液相中分子碰撞到分子激烈振动发生断裂、成键在10-13sec。因此,
跟踪能力至少为10-14~10-15sec的观察手段。而IR为10-12sec。这个问题有 待解决。
47
1. 研究手段由宏观向微观观察发展
该图为美国能源部斯坦福线性加速器中心(SLAC)国 家加速器实验室研究人员首次通过X射线激光观测观测 到的化学键形成的过渡状态。反应物是一氧化碳分子 (左边,由一个碳原子(黑)和一个氧原子(红)构 成)和它右边的一个氧原子。它们附着在钌催化剂表 面,催化剂让它们彼此靠近,更容易反应。当发射一 束光学激光脉冲,反应物振动并互相碰撞,碳原子和 氧原子形成一个过渡状态的键(中间)。生成的二氧 化碳分子脱离催化剂表面飘走(右上)。
35
在掌握“词汇”和“语法”的基础上,“创造”有机化合物,
进行有机合成。 发现新的反应
研究反应机理
新的合成方法
制备特定功能的复杂分子
设计有效的合成路线
有机化学的核心问题之三就是制造新分子。
其目标是从简单易得的原料出发合成复杂的有机化合物。 为此,需要了解各种有机反应,在机理层面上预测反应产物, 发展新的合成方法,从而更有效地合成“目标”分子。
①官能团的种类; ②分子中官能团之间的相互 影响; ③分子中直接相连、不直接 相连的原子之间的相互影响
决定
各类有机物的性质和反 应性以及同类有机物中 各个化合物性质和反应 性的差异——各类反应 构成
有机化学的词汇表
熟练使用
①转化的类型;②所用试剂; ③反应条件;④每种类型的 逐步熟悉 局限性
分子和官能团的 相互转化
28
有机化学研究内容:
天然产物有机化学 金属有机化学(元素有机化学)
有机化学
高等有机化学总结

第一章绪论键长:键角:规则:第2章酸碱理论一、二、第3章立体化学1、2、()第四章活泼中间体C、D第八章脂肪族亲和取代反应高等有机化学模拟试题一、完成反应式,写出原料、反应条件或产物的构造式(产物只写有机主要产物,本大题共9小题,每空2分,共30分) 1.CNO 2O CH 2NO 2( )2.CH 3(CH 3)3CCH 2+3.4.ClHCCHCH 500 C5.Ph 3P C(CH 3)225℃乙醚CH(CH 3)2 X -Ph 3P +6.COOEtCOOEtEtONa27.ClCl NO 2+ONa3248.PhCH 2CHCH 3N +Me 3 OH-HCl9.OCH 3+CHO二、单项选择题(选择符合题意的答案,将其代号填入括号,本大题共7题,每小题2分,共14分)1.COOH SO 3H OHBrCOOH (a)(b)(c)(d)上述化合物的酸性由强到弱的排列顺序为……………………( )。
(A ) a>b>c>d; (B ) c>d>b>a; (C ) c>b>a>d; (D ) b>a>c>d 。
2.试剂的亲核活性由强到弱的顺序为…………………………( )。
(A ) CH 3CH 2- > CH 3O -> (CH 3)2N - > F -; (B ) CH 3CH 2- > (CH 3)2N - > CH 3O -> F -; (C ) F -> CH 3O -> (CH 3)2N - >CH 3CH 2-; (D ) (CH 3)2N - >CH 3CH 2-> CH 3O -> F -。
3.t-BuBr ;(a)(b)(c)(d)i-PrBr ;PhCH 2Br ;发生SN1反应时的相对速度由大到小的顺序为……………( )。
高等有机化学电子档

钌和锇1.概述:立体化学钌和锇化学除了像硫化物或磷化物以及具有像CO,PR3,或者h5-C5H5为配位体的络合物以外,与铁化学略相似。
高氧化态VI和VIII,比铁更容易得到,四氧化物,MO4,卤氧化物和络氧阴离子的化学是广泛而重要的。
Ru Os和Re化学,特别是在络氧,氮及氮化物的络化物方面是类似的。
对于钌,主要的较低氧化态有零,II和III,而对于锇则是0,III和IV。
尽管在二甲基乙酰胺中用氢还原RuCI3所得到的对空气敏感的褐色溶液可能含有RU物种。
但是对二种元素氧化态I(化合物中以金属一金属键形式除外)的存在没有良好的证据。
氧化态0,这种氧化态的化学主要是金属基化和物,已经知道了两种元素的单核和多核基化物。
二种类型都能发生取代反应并在多核类中常保留着簇状的结构。
他们也发生质子化反应,已知了各种各样的氢化物。
氧化态II, 已知道许多具有CO, PRA的Ru和Os络合物。
也存在着大量的共它配位体的(主要是氯,氨和共它胺)络合物。
已制备出{Ru(H2O)6}2+水合离子,但是它很容易被氧化成{Ru(H2O)6}3+,锇的最特征的络合物是芳胺类络合物。
氧化态III以π一酸和给予体为配位体的络合物化学都是很广泛的。
钌〔III)物种比饿III)物种更普遍。
所有络合物都是具有一个未成对电子的低自旋型八面体的络合物。
钌和饿的四氧化物可以从水溶液中能够把它蒸馏出来,利用它们高挥发性很容易回收和分离。
硝酸能充分氧化饿化合物,但是对钌需要更强的氧化剂。
因此OsO4是商品源料,用浓HCI还原RuO4所得到的“RuCl3。
3H2O”是制备钌化合物的常用原料,所以我们首先讨论高氧化态。
2.四氧化合物,RuO4和OsO4这两个挥发性的晶体是具有刺激性的、类似臭氧气味的特征的有毒物质。
OsO4对眼睛是特别危险的,因为它容易被有机物质还原成黑色氧化物,实际已利用它的稀的水溶液作为生物着色剂。
用氧化剂如:MnO4,AuCl4,BrO3或Cl2处理酸性钌溶液时,得到四氧化钌;氧化物可以从溶液中蒸馏出或用气流吹出。
高考化学有机化合物汇总归纳精品
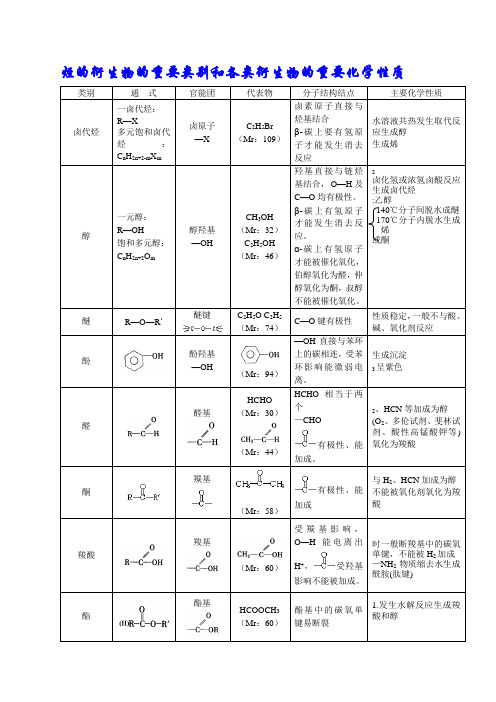
烃的衍生物的重要类别和各类衍生物的重要化学性质类别通式官能团代表物分子结构结点主要化学性质卤代烃一卤代烃:R—X多元饱和卤代烃:C n H2n+2-m X m卤原子—XC2H5Br(Mr:109)卤素原子直接与烃基结合β-碳上要有氢原子才能发生消去反应水溶液共热发生取代反应生成醇生成烯醇一元醇:R—OH饱和多元醇:C n H2n+2O m醇羟基—OHCH3OH(Mr:32)C2H5OH(Mr:46)羟基直接与链烃基结合,O—H及C—O均有极性。
β-碳上有氢原子才能发生消去反应。
α-碳上有氢原子才能被催化氧化,伯醇氧化为醛,仲醇氧化为酮,叔醇不能被催化氧化。
2卤化氢或浓氢卤酸反应生成卤代烃:乙醇140℃分子间脱水成醚170℃分子内脱水生成烯或酮醚R—O—R′醚键C2H5O C2H5(Mr:74)C—O键有极性性质稳定,一般不与酸、碱、氧化剂反应酚酚羟基—OH(Mr:94)—OH直接与苯环上的碳相连,受苯环影响能微弱电离。
生成沉淀3呈紫色醛醛基HCHO(Mr:30)(Mr:44)HCHO相当于两个—CHO有极性、能加成。
2、HCN等加成为醇(O2、多伦试剂、斐林试剂、酸性高锰酸钾等)氧化为羧酸酮羰基(Mr:58)有极性、能加成与H2、HCN加成为醇不能被氧化剂氧化为羧酸羧酸羧基(Mr:60)受羰基影响,O—H能电离出H+,受羟基影响不能被加成。
时一般断羧基中的碳氧单键,不能被H2加成—NH2物质缩去水生成酰胺(肽键)酯酯基HCOOCH3(Mr:60)酯基中的碳氧单键易断裂1.发生水解反应生成羧酸和醇(Mr:88)硝酸酯RONO2硝酸酯基—ONO2不稳定易爆炸硝基化合物R—NO2硝基—NO2一硝基化合物较稳定一般不易被氧化剂氧化,但多硝基化合物易爆炸氨基酸RCH(NH2)COOH氨基—NH2羧基—COOHH2NCH2COOH(Mr:75)—NH2能以配位键结合H+;—COOH能部分电离出H+两性化合物能形成肽键蛋白质结构复杂不可用通式表示肽键氨基—NH2羧基—COOH酶多肽链间有四级结构(生物催化剂)糖多数可用下列通式表示:C n(H2O)m羟基—OH醛基—CHO羰基葡萄糖CH2OH(CHOH)4CHO淀粉(C6H10O5) n纤维素[C6H7O2(OH)3] n多羟基醛或多羟基酮或它们的缩合物(还原性糖)油脂酯基可能有碳碳双键酯基中的碳氧单键易断裂烃基中碳碳双键能加成(皂化反应)重要的有机反应及类型1.取代反应酯化反应水解反应C 2H 5Cl+H 2O ∆−−→−NaOHC 2H 5OH+HClCH 3COOC 2H 5+H 2O −−−→−无机酸或碱CH 3COOH+C 2H 5OH2.加成反应3.氧化反应2C 2H 2+5O 2−−→−点燃4CO 2+2H 2O2CH 3CH 2OH+O 2℃网550−−→−Ag 2CH 3CHO+2H 2O 2CH 3CHO+O 2℃~锰盐7565−−→− CH 3CHO+2Ag(NH 3)2OH −→−∆+2Ag↓+3NH 3+H 2O5.消去反应C 2H 5OH ℃浓17042−−−→−SO H CH 2═CH 2↑+H 2O CH 3—CH 2—CH 2Br+KOH ∆−−→−乙醇CH 3—CH═CH 2+KBr+H 2O 7.水解反应卤代烃、酯、多肽的水解都属于取代反应10.聚合反应11.中和反应1.能使溴水(Br 2/H 2O )褪色的物质 (1)有机物 ① 通过加成反应使之褪色:含有、—C ≡C —的不饱和化合物② 通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
高中化学有机总结汇总

一、从无机物的角度研究有机反应P2二、各类烃的代表物的结构、特性P4三、烃的衍生物的重要类别和化学性质P4四、有机物的鉴别P6五、混合物的分离或提纯(除杂)P7六、有机物的结构P8七、具有特定碳、氢比的常见有机物P10八、重要的有机反应及类型P11九、某些重要的有机反应对比P13十、有机化学计算P14注:打印时请选择A4纸并选择灰度打印!切记切记!、从无机物的角度研究有机反应(1) 有机物① 通过加成反应使之褪色:含有 广一■八、一A C —的不饱和化合物 ② 通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀。
③ 通过氧化反应使之褪色:含有 一CHO (醛基)的有机物(有水参加反应) 注意:纯净的只含有一CHO (醛基)的有机物不能使溴的四氯化碳溶液褪色④ 通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和 酯 (2) 无机物①通过与碱发生歧化反应3Br 2 + 6OH - == 5Br - + BrO 3- + 3H 2O 或 Br 2 + 2OH - == Br - + BrO - + H 2O _②一与还原性物质发生氧化还原反应,如_H 2S 、S 2-、SO 2、SO 32-、I -、F0 2. 能使酸性高锰酸钾溶液 KMn O 4/H +褪色的物质(1)有机物:含有 、一g C-、— OH (较慢)、—CHO 的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物( 与苯不反应)(2) 无机物:与还原性物质发生氧化还原反应,如 H 2S 、S 2-、SO 2、SO 32-、Br -、I -、 Fe 2+_______________________________________________ 3. 与Na 反应的有机物:含有 一OH 、一COOH 的有机物与NaOH 反应的有机物:常温下,易与含有 酚羟基、一COOH 的有机物反应加热时,能与卤代烃、酯反应(取代反应)与Na 2CO 3反应的有机物:含有 酚羟基的有机物反应生成酚钠和 NaHCO 3;含有一COOH 的有机物反应生成羧酸钠,并放出CO 2气体; 含有一SO 3H 的有机物反应生成磺酸钠并放出 CO 2气体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
研究生课程论文题目: 浅谈有机化学的研究进展姓名: 陶月红学院: 理学院专业: 化学学号: 20141110042015 年1 月12 日南京农业大学教务处制浅谈有机化学的研究进展理学院2014111004 陶月红摘要:本文综述了中国大陆地区有机化学研究人员2011至2012年两年内在合成方法学领域获得的重要成果。
文章中共引用参考文献50篇,其中30多篇手性金属配合物和有机小分子催化的不对称反应、金属催化的碳氢键活化等合成方法学论文。
本文汇集了中国有机化学家两年中合成的30多个不同物质。
关键词:有机化学合成方法学有机合成有机化学是化学科学中一个十分重要的二级学科,也是与人类日常生活联系最紧密的化学分支,其发展与人类社会的发展息息相关。
近年来,在国家科技政策和科研经费的支持下,我国有机化学事业得到了长足发展,有机化学相关领域研究队伍不断壮大(如,全国有机化学学术研讨会的参会人员数已由十年前500多人发展到超过2000人),研究工作水平不断提高,在国际顶级学术刊物上发表研究论文数迅猛增加(几乎每期国际一流化学期刊上都有中国有机化学家的论文刊登)。
同时,也有越来越多的中国有机化学家被邀请担任国际顶级学术刊物的地区主编和编委,国内的有机化学期刊也开始得到重视。
从近期学术论文发表情况看,我国有机化学的各分支学科存在发展不平衡的问题,工作主要集中于有机反应和合成方法学的研究。
我国有机反应和合成方法学研究始终保持强盛的发展势头,但原创性、实用性工作仍旧有限。
有机合成化学得到了发展,但主流观念和思路还停留在首次合成上。
在元素有机化学中我国有机氟化学一支独秀,其他元素有机化学需要加强。
中国天然产物化学研究工作突飞猛进,成为发现新化合物分子的主力。
通过对我国有机化学学科2011~2012年发表的研究结果进行系统检索,本文对有机反应和合成方法学、有机合成化学、元素有机化学和天然产物化学等有机化学研究领域的学术进展做一个简要总结。
1 有机反应和合成方法学有机反应和合成方法学是有机化学的基础,历来受到有机化学家的重视。
有机化学发展过程中曾经出现许多以发现者名字命名的人名反应,使这些化学家名垂青史。
在我国除黄鸣龙外,尚未有其他有机化学家获此荣誉,故在近30 年来,有机反应和合成方法学在我国有机化学界受到越来越多的重视。
在我国有机化学界,从事有机反应和合成方法学的化学家人数和各种资源占有半壁江山,导致我国在国际一流学术刊物上发表的论文多为有机反应和合成方法学内容,为此本文也仅能收录刊登在《J.Am.Chem.Soc.》和德国《Angew.Chem.Int.Ed.》上的成果。
国际上流行的热点研究领域,如金属催化的不对称反应、交叉偶联反应、碳氢键活化反应、有机小分子催化反应等,我国有机化学家不仅几乎全部涉足,而且人数比例和发表论文的数量均占有重要地位。
只要美国化学家能开辟一个新领域,我们就会使这一领域成为论文发表的热点领域。
我国有机化学家在有机反应和合成方法学研究领域的影响力日新月异,如2012年10月,北京大学施章杰承办了第一届碳氢键活化国际学术研讨会,并担任大会主席。
无论如何,与西方国家的有机化学家,特别是美国化学家相比,我国的研究工作思路和成果还是属于跟踪的多,自己独创的少。
《J.Am.Chem.Soc.》创刊125周年列举的125篇有影响的文章中,来自我国的仅为黄鸣龙先生于20世纪40年代发表的论文,足以说明我国还是缺乏真正有影响的独创性研究成果。
我国有机反应和合成方法学研究领域的特点是人数众多,仅从事金属有机化学的人员就已超过千人;另一特点是发展均衡,在国际一流刊物上发表学术论文的作者既有我国著名科研院所和高等院校的院士、教授,也有许多普通高校名不见经传、刚涉足其间的青年学者。
总之,有机反应和合成方法学是我国有机化学界最有希望从跟随者变为领跑人的领域,但道路还很长,还需要加倍努力。
1.1金属参与的反应和合成方法学金属有机化学自20 世纪70 年代以来在国际上得到迅速发展,所发展的反应涉及有机化学的各个领域,并发展了很多新型的合成反应,该领域有机化学家多次获得诺贝尔奖化学奖。
本文主要综述了2011~2012年我国在碳氢键活化、加成活化以及金属催环合反应、偶联反应、过渡金属催化氟化反应、惰性小分子CO2化不对称合成反应等方面的进展。
1. 1. 1 碳氢键活化将惰性的碳氢键直接转化为碳碳键或碳杂原子键一直是有机化学家们想要实现的目标之一,也是近年来有机方法学研究的热点领域,并且已经取得了一些可喜的成果。
碳氢键活化研究中最具挑战性的工作是非活化的烷烃碳的碳氢键活化[1~5]。
我国当前取得的大部分成果多属于活化的烯烃或烯丙位碳的碳氢键活化。
施章杰等[6~8]报道了不同金属催化的碳氢键活化反应,通过吡啶作为导向基团在铑催化下碳氢键活化与亚胺进行加成,得到碳碳键偶联的产物(式1)[9,10]。
焦宁等[11]利用钯催化碳氢键活化实现了以DMF为氰源的直接氰基化。
刘国生等[12,13]报道了钯催化下活性烯烃的芳基烷基化反应,实现了苯胺与乙腈的双碳氢键断裂(式2)。
张前等[14]也报道钯催化苯胺的碳氢键胺化反应,该反应可能经历高价钯中间体形成碳氮键。
雷爱文等[15]利用两次钯催化碳氢键活化,在常压CO氛围下进行羰基化,高效合成了含氧杂蒽酮结构单元的分子(式3)。
关正辉等[16]应用类似的碳氢键活化策略,通过两次CO插入,实现了芳基的羰基化,合成了靛红酸酐(式4)。
黄汉民等[17]在钯催化下,通过自由基活化苄位碳氢键形成苄基钯物种,对CO加成得到酯类产物(式5)。
此外,刘磊等[18]通过钯催化苯酚导向的碳氢键活化合成二苯并呋喃。
麻生明等[19]报道了钌催化联烯的氢芳基化反应,反应通过苯甲酰胺导向的碳氢键活化进而对联烯进行加成而实现。
除了钯钌等贵金属催化的碳氢键活化外,利用相对廉价的铜、铁等金属实现碳氢键活化也受到很大关注。
焦宁等[20]实现了铜催化苯胺的邻位碳氢键活化而引入叠氮基(式6),该反应可能经历的是一个单电子转移过程。
1. 1. 2 加成环合反应麻生明等报道了用一锅法,从3-碘-烯丙基吲哚出发,在零价钯催化下与炔丙基溴发生碳碳偶联,形成的联烯中间体进一步环化得到了吲哚并八元环结构(式7)[21]。
此外,他们还报道了通过钯催化碳碳键偶联合成手性联烯的方法,丰富了联烯的化学内容[22]。
刘元红等[23,24]利用金催化1,6-二炔环合得到多取代的萘环以及苯并芴,并提出了Au/Sn转金属的反应模式(式8)。
施敏等发展了利用金催化1,6-二炔环合得到多取代的二氢吡咯结构[25](式9),而含炔基的联烯基环丙烷在铑催化下环合则得到多环化合物[26]。
支志明等[27]利用金催化分子内酮的α-位对非活性烯烃的氢烷基化反应。
1. 1. 3 偶联反应雷爱文等[28]在钯催化下,通过氧化酯化反应将伯醇转化成为相应的羧酸酯(式10)。
在此基础上,利用苄氯作为温和氧化剂,实现了醛和醇的选择性酯化[29]。
江焕峰等[30]提供了通过钯催化烯烃碳酯化反应从炔酸酯和烯烃出发合成α-甲叉基-γ-内酯的方法。
田世凯等报道在钯催化的烯丙基胺与芳基硼酸[31]或亚磺酸盐[32]的偶联反应。
苏伟平等[33,34]发展了钯催化羧酸的脱羧偶联反应等。
近年来,铜以及铁、钴、镍等廉价金属催化的偶联反应也得到了很大的发展。
雷爱文等[35]发展了镍催化的Heck反应(式11)。
刘磊等通过铜催化,实现了一级烷基卤代物与芳基硼酸酯[36]、二级烷基卤代物与格氏试剂[37](式12)以及二级烷基卤代物与硼酸酯B2pin2的偶联反应[38]。
焦宁等[39~42]利用铜、铁催化剂在氧化剂DDQ的促进下,产生的正离子与叠氮等反应形成四唑、芳胺等化合物(式13)。
王剑波等[43,44]发展了铜催化磺酰腙与炔烃等的偶联反应。
李金恒等[45]发展了镍催化的Kumada 偶联反应,实现了烷基磺酸与格氏试剂的偶联。
蔡倩等[46]首次报道了铜催化的去不对称Ullmann反应,并用于合成手性二氢吲哚。
1.1.4过渡金属催化氟化反应近年来,随着含氟化合物在医药、农药、材料等领域的广泛应用,如何合成含氟化合物倍受有机化学家的关注。
利用过渡金属催化将氟原子或含氟片段引入到有机分子中的策略得到了很大发展。
这部分工作被纳入有机氟化学研究范围,将在后面元素有机部分进行叙述。
1.1.5惰性小分子CO2活化如何将CO这一惰性小分子进行活化,引入到有机分子中进行转化利用2是有机化学家面临的又一大挑战。
麻生明等报道了镍催化炔烃的氢酯化反应,[47]该反应仅需要常压的CO,具有很好的立体选择性,反应得到反式α,β-不饱和2羧酸(式14)。
吕小兵等[48]通过银催化直接将端炔进行羧化,有效地合成了炔基羧酸(式15)。
丁奎岭等[49]通过二价铑催化氢化,高效地将环碳酸酯转化为乙二醇和甲醇这两类重要的化工原料(式16),相应的环碳酸酯可由环氧与CO制得,2从而实现了CO向甲醇的高效转化。
21.1.6金属催化的不对称合成反应我国化学家在新型手性配体、新反应、新方法等研究方面也取得了显著的成绩。
周其林等以螺二氢茚为配体骨架,设计了手性双噁唑啉配体[50]、手性氮膦配体[51]等,它们与不同金属络合后催化不对称反应[52, 53]均表现了很好的催化活性,如手性双噁唑啉配体与铜络合催化卡宾对氮氢键不对称插入反应(式17)。
丁对称的单齿亚膦酰胺配体,在铑催化不对称氢化反应中取得了奎岭等发展了C2很好的结果[54, 55],随后发展的手性螺缩酮骨架配体[56],实现了钯催化不对称烯丙基胺化反应[57](式18)以及不对称α-羟基化反应[58]。
唐勇等设计合成了具有“边臂效应”的假C对称的双齿或三齿噁唑啉配体,在不对称碳叶立德环合[59]、3环丙烷开环[60](式19)以及环丙烷化反应[61,62]中表现出优异的效果。
游书力等设计合成了一系列以联萘酚为骨架的亚膦酰胺配体,在铱催化不对称苯酚、吲哚和吡咯的去芳构化烯丙基化反应(式20)[63~65]以及吲哚、苯胺烯丙基胺化等反应[66~68]中显示了很好的区域和立体选择性。
余志祥等[69]通过铑催化将该类配体应用于活化烯丙位碳氢键对共轭双烯的不对称加成反应。
冯小明等发展的手性氮氧金属络合物(如式21方框内所示),在不饱和酮的氯胺化反应[70]、酮与α-重氮酯亲电加成反应[71]、不对称Baeyer-Villiger 氧化反应[72]、烷基烯醇醚对1,2-二羰基化合物的对映选择性加成[73]、2-吲哚酮的羟胺化反应[74]、吡唑啉酮对不饱和酮的Michael加成反应[75,76]以及靛红与α-烷基-α-重氮酸酯的不对称扩环反应[77]中,均体现出极优异的选择性(式21)。
