蛋白质一级结构测序共62页文档
蛋白质一级结构测序.

4.根据核苷酸序列的推定法
蛋白质链 核糖体
(七)肽段在多肽链中次序的决定
重叠肽(overlaping peptide)—— 片段重叠法重建完整多肽链一级结构
片段重叠法重建完整多肽链一级结构 所得资料:
氨基末端残基 H
羧基末端残基 S
第一套肽段
OUS PS
第二套肽段
SEO WTOU
EOVE
RLA
利用两/多套肽段的AA顺序彼此间的交错重叠,拼
凑出整条多肽链的AA顺序。
8、确定半胱氨酸残基间形成二硫键交联桥的 位置 不包括辅基成分分析
(二)鉴定多肽链N-末端、C-末端氨基酸 残基
Sanger法(二硝基氟苯反应)
N端
DNS法(丹磺酰氯反应)
Edman法(苯异硫氰酸脂反应)
氨肽酶法
肼解法
C端
羧肽酶法 LiBH4还原法
3.LiBH4还原法
多肽+ LiBH4
水解
α-氨基醇+ n氨基酸
含C—端氨基酸,用层析法鉴定
(三)二硫桥的断裂
几条多肽链通过 二硫键交联在一起。 可在8mol/L尿素或 6mol/L盐酸胍存在 下,用过量的巯基乙醇(还原法) 处理,使二硫键还 原为巯基,然后用 烷基化试剂碘乙酸 (ICH2COOH)保护 生成的巯基,以防 止它重新被氧化。
(九)蛋白质序列数据库
60年代中期到80年代初,美国国家生物医学研究基金会 (National Biomedical Research Foundation,简称BNRF) 将搜集到的蛋白质序列和结构信息以“蛋白质序列和结构地图 集”(Atlas of Protein Sequence and Structure)的形式发表, 主要用来研究蛋白质的进化关系。 1984年,“蛋白质信息资源”(Protein Information Resource,简称PIR)计划正式启动,蛋白质序列数据库PIR也 因此而诞生。 1988年,美国的NBRF、日本的国际蛋白质信息数据库 (Japanese International Protein Information Database,简 称JIPID)和德国的慕尼黑蛋白质序列信息中心(Munich Information Center for Protein Sequences,简称MIPS)合 作成立了国际蛋白质信息中心(PIR-International),共同收集 和维护蛋白质序列数据库PIR。
蛋白质一级结构测定

氨基酸与肽的定量组成测定
定量组成测定,第一步是将蛋白质水解 为基组成氨基酸。 蛋白质的水解方法有: 1、酸水解法:用6MHCl于100~120℃下在真 空的安瓿瓶内进行,水解10~24小时
特点: (1)所得的氨基酸不消旋;但色氨酸全部被破坏。 (2)天冬酰胺和谷氨酰胺的酰胺基被水解下来而转 变为相应的氨基酸,酰胺基的总量由产生的氨算出。
2013年11月12日星期二
1
蛋白质的一级结构是指蛋白质分子中 氨基酸的组成、排列顺序连接方式和 二硫键的位置。 在生物化学与分子生物学中不少问题 都面临着需要知道蛋白质一级结构的 情况。如研究蛋白质的结构与功能的 关系、酶的结构与功能的关系、一级 结构与高级结构的关系等。因此,只 有把一级结构研究清楚之后,我们才 能研究生命过程中的许多复杂问题。
2013年11月12日星期二 32
(2)三价铁显色法: 含有色氨酸的样品,与铁离子的醋 酸溶液混合,加入浓硫酸,振荡之后呈 玫瑰红色,在545nm比色测定。 此法测定简便、快速,线性关系较 好。但反应混合物中的含水量对显色有 一定影响。因此,不如对-二甲基氨基 苯甲醛法使用广泛。
2013年11月12日星期二 33
2013年11月12日星期二 17
氨 基 端 的 分 析
2013年11月12日星期二
18
2013年11月12日星期二
19
丹磺酰氯(DNS-Cl)法:Harytley 等1956年报告了丹磺酰氯与氨基酸、肽 或蛋白质的氨基反应产生黄色的荧光, 由此产生了测定N末端的新方法,称 DNS法。 本法测定N末端的原理与DNP法有 相似之处。但比DNP法的灵敏度提高了 100倍,使用更为广泛。
对氯汞苯甲酸与巯基反应, 形成巯基的对氯汞苯甲酸 衍生物(PCMB)。PCMB 最大吸收在233nm摩尔消光 值为1.96×104。与巯基形 成硫醇盐以后,增加到2.2 ×104从图中可以看出在 250nm处差值最大,这个差 值与参与反应的试剂量有 直接关系。测定时,用含 巯基化合物支滴定固定量 的汞试剂,直至吸收差值 不再增加为止,根据汞试 剂的量可以计算出巯基数 量。由于测定是在蛋白质 的吸收范围内进行,因此 必须作蛋白质含量对吸收 36 影响的校正。
蛋白质一级结构测序解析

O NH CH C R1 R2
O NH CH C R3
O NH CH C R4
O NH CH C
梭 菌 蛋 白 酶
• 梭状芽孢杆菌中分离,专一性强 • R1=Arg 。
化学法:可获得较大的肽段
溴化氰水解法:它能选择性地切割由甲 硫氨酸的羧基所形成的肽键。 羟胺(NH2OH):专一性断裂-Asn-Gly之间的肽键。也能部分裂解-Asn-Leu之间的肽键以及-Asn-Ala-之间的肽键。
4 、鉴定多肽链 N -末端、 C -末端氨基酸残 基
多肽链的另一部分样品进行末端残基的确定,以 便建立两个重要的氨基酸序列参考点,方法比较多。
5、裂解多肽链成较小的片段
酶解法,化学法。
采用两/多种不同的断裂方法将多肽断裂成两套 或多套肽段,并将其分离。
6、测定各肽段的氨基酸序列
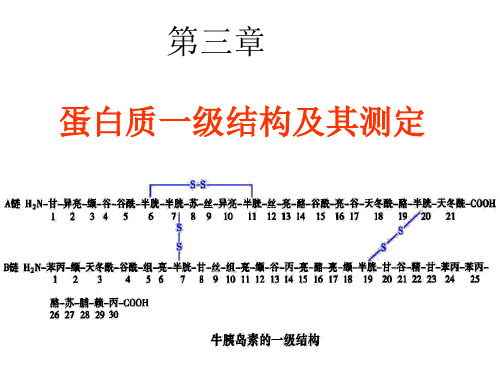
7、片段重叠法重建完整多肽链一级结构
质谱法(Mass Spectrometry, MS),即用电场和磁场将运动的离子(带电荷的原子、 分子或分子碎片)按它们的质荷比分离后进行检测的方法。测出了离子的准确质量, 就可以确定离子的化合物组成。这是由于核素的准确质量是一多位小数,决不会有两 个核素的质量是一样的,而且决不会有一种核素的质量恰好是另一核素质量的整数倍。
一级结构的化学键?
2.一级结构的意义
测定蛋白质氨基酸顺序的重要意义:
• 测定蛋白质中的AA顺序,是走向阐明其生 物功能基础中的很重要步骤。顺序可以给 出更多的信息。 • 为了了解多肽链折叠成三维构象所受到的 限制,顺序测定是必须的。 • AA顺序的改变可以导致异常的功能和疾病, 所以顺序测定是分子病理学的一个重要部 分。 • 蛋白质中的AA顺序很能指明它的进化史。
二硫键位置的确定
第二节蛋白质一级结构的测定方法

蛋白质序列测定的基本战略和步骤
一 蛋白质序列测序的基本战略 1、直接法(测蛋白质的序列) 对于一个纯蛋白质,理想方法是从N端直接测至C端,
但目前只能测60个N端氨基酸。 2、间接法(测核酸序列推断氨基酸序列) 蛋白质化学家收集的一个蛋白质资料库(database or
各种氨基酸侧链基团的性质对于氨基酸与离子交 换树脂,结合的情况有相当复杂的影响。在氨基酸自 动分析仪的记录上可以看出:天冬氨酸(pI为2.98) 最先随洗脱液下来,赖氨酸(pI为9.74)最后下来, 三个中性氨基酸如:甘氨酸(pI为5.97)、苏氨酸 (pI为6.53)和亮氨酸(pI为5.98)洗脱的顺序又如 何呢? 苏氨酸应当带有较多的正电荷,与树脂结合比 较紧,不易被洗脱下来,但是由于羟基具有极性,减 弱了树脂对氨基酸的吸引力。所以反而比甘氨酸和亮 氨酸后被洗脱下来。甘氨酸和亮氨酸相比,亮氨酸侧 链疏水性强,与树脂结合紧,后甘氨酸被洗脱下来。
(2)C-末端分析
A.肼解法
无水肼NH2NH2 100℃ 5-10h。 苯甲醛沉淀氨基酸的酰肼,C端游离氨基酸 留在上清中。 Gln(谷氨酰胺)、Asn(天冬酰胺)、 Cys(半胱氨酸)、Arg(精氨酸)不能产 生游离的羧基末端aa。
(2)C-末端分析 B.羧肽酶水解法
羧肽酶可以专一性地水解羧基末端氨基酸。根 据酶解的专一性不同,可区分为羧肽酶A、B和C。 应用羧肽酶测定末端时,需要事先进行酶的动力学 实验,以便选择合适的酶浓度及反应时间,使释放 出的氨基酸主要是C末端氨基酸。
氨肽酶法
氨肽酶是一种肽链外切酶,它能从多肽链 的N-端逐个的向里水解。根据不同的反应 时间测出酶水解所释放出的氨基酸种类和 数量,按反应时间和氨基酸残基释放量作 动力学曲线,从而知道蛋白质的N-末端残 基顺序。
蛋白质分子基础5-蛋白质一级结构测定

C末端分析
a)肼解法 b)还原法:硼氢化锂还原剂 c)羧肽酶法
还原法
肽链C末端AA ↓硼氢化锂 α-氨基醇 ↓水解 C末端氨基酸+ α-氨基醇 ↓ 色谱法鉴定
羧肽酶法
羧肽酶法:
最有效,最常用的测C端殘基方法 性质:肽链外切酶,专一地从肽链的C端逐个降 解,释放出游离AA。
巯基含量测定
DTNB法(5.5’-二硫代双(-2-硝基苯甲酸)
Protein-S- +R-S-S-R(DTNB) Protein-S-S-R+RSProtein-SH Protein-S-S-Protein+RS-(CNT) R
-
-COOH -NO2
反应产物(CNT)在412nm处可产生光吸收, 根据光吸收值可以相应地计算出巯基的含 量。
优点:Trp在水解中不受破坏。
蛋白质的水解
磺酸水解
4mol/L 甲基氨酸 ( 含 0.2%β- 吲哚乙胺 ) 色氨酸可 回收90%以上,Ser与Thr的回收接近定量值。 用二硫苏糖醇还原胱氨酸,再用过量的连四硫酸 钠氧化,得到S-磺基半胱氨酸再测定。 缺点: 水解环境需中性,条件苛刻。 水解液中含较多碳水化合物时,色氨酸容易被破 坏。 优点:中性水解液可以直接上机,色氨酸稳定。
蛋白质化学
蛋白质一级结构的测定
序列测定的基本方法学
将肽段用不同方法专一性地切断,将得到的 肽段分离纯化之后,分别测出各自的序列。 再将不同方法得到的序列进行比对,就可以 得到肽链的一级结构。
序列测定一般步骤
纯度要求:纯度在97%以上。
双向电泳;凝胶电泳;N-末端测定;纯化至恒定酶活; 肽谱分析。
蛋白质一级结构测定

2、浓度测定
紫外吸收法
①蛋白质( ug/ ml )=( 1.45A 280 一 0.74A 260 ) X 稀释倍数 ②显色法 双缩脲法:Cu2+与蛋白质的肽键,以及酪氨酸残基络合,形成紫蓝
色络合物,此物在540nm波长处有最大吸收。双缩脲法常用于 0.5g/L~10g/L含量的蛋白质溶液测定。 干扰物有硫醇,以及具有肽性质缓冲液,如Tris、Good缓冲液等 。可用沉淀法除去干扰物,即用等体积10%冷的三氯醋酸沉淀蛋 白质,然后弃去上清液,再用已知体积的1m NaOH溶解沉淀的 蛋白质进行定量测定
双向电泳 = IEF + SDS-PAGE 第一向:根据电荷差异用 IEF 分离
第二向:根据分子量差异用 SDS- PAGE 分离
IEF
SDS-PAGE
每一个点代表一条多肽链,每一条多肽链有自己的等电 点和分子量。多肽链可以用染色法或放射自显影进行检 测
(4)其它方法
• 离子交换层析(根据物质所带电荷进行分离) • 亲和层析(利用蛋白质与与其他分子的结合特异性) • N-末端氨基酸测定 • 纯化至恒定比活 • 肽(酶)谱分析 • Western 印迹法(由蛋白质的SDS-PAGE、电转及杂
Lowry法
即Cu2+与蛋白质在碱性溶液中形成络合物(双缩脲反应) ,然后这个络合物还原磷钼磷-磷钨酸试剂(福林-酚 试剂),结果得到深蓝色物,于700nm下达到最 大吸收峰。
此法比双缩脲法灵敏得多,适合于测定20mg/L~ 400mg/L含量的蛋白质溶液。
干扰物质与双缩脲法相同,而且受他们的影响更大
蛋白质一级结构测定(重点)
指蛋白质多肽链中氨基酸的排列顺序以及二硫键的位置。 测定的基本步骤:
蛋白质一级结构测定

2021/3/11
29
亚基拆离、肽链降解和肽段的分离
2021/3/11
30
蛋白 分子 亚基
切成 小段
2021/3/11
31
2021/3/11
13
胰蛋白酶(trypsin)
O
O
O
O
NHCHC NHCHC NHCHC NHCHC
R1
R2
水解位点
R3
R4
肽链
• 特点:基参与形成的肽键 • R1=Lys(赖、K)和Arg(精、R) • R2=Pro(抑制)
2021/3/11
如,血红蛋白为四聚体,烯醇化酶为二聚体;可用8mol/L 尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基)。
2021/3/11
8
★巯基的保护
-OOC CHCH2 SH NH3+
O
C H2O C C l
-OOC CHCH2 SOCCH2
CH2Cl
NH3+
O
-OOC CHCH2 SCH2
O
NH3+
ICH2CNH2
-OOC CHCH2 SCH2CNH2
NH3+
O
用烷基化试剂保护生成的巯基,以防止它重新被氧化
2021/3/11
9
④多肽链的选择性降解及肽段的氨基酸组成和顺 序的测定
用酶溴化氢选择性降解多肽链产生的肽段用酸水解、碱 水解(针对色氨酸分析)或酶水解后,用氨基酸自动分析 仪测定; 测定并计算出蛋白质的氨基酸种类和数量;用Edman反 应分析各肽段氨基酸顺序;
2021/3/11
10
⑤利用酶选择性降解和溴化氰选择性降解
获得的各肽段的氨基酸顺序彼此间的交替重 叠,拼凑出整条多肽链的氨基酸顺序; 确定多肽链中二硫键的位置。
蛋白质一级结构测定讲课文档

第一页,共143页。
第四章 蛋白质一级结构测定
第一节 蛋白质序列测定的基本策略和步骤
第二节 蛋白质和肽的氨基酸组成分析
第三节 末端氨基酸的测定
第四节 肽链的专一性水解和肽段的分离纯化
第五节 肽段的序列测定
第六节 由已知序列肽段建立蛋白质一级结构
第七节 蛋白质一级结构研究进展
第二页,共143页。
Gln的总量,或者用不水解酰胺的方法水解肽键后直 接测定。
第三十八页,共143页。
盐酸水解时,Met易被氧化转变为甲硫 氨酸砜,损失约20% 左右,可以用这一数 值进行校正,也可用保护剂(在盐酸中加入 0.l~1.0%巯基乙酸)来减少水解中 Met 的损失; Tyr 的破坏率约为 10%,如水解 时加入 0.l~1.0% 巯基乙酸和 0.05~0.l %苯酚,能使Tyr和 Ser回收率明显提高, 这时 Met也能免遭破坏。
分子筛效应
电荷效应
第十三页,共143页。
(3)双向电泳(two-dimensional gel electrophoresis)
双向电泳 = IEF + SDS-PAGE 第一向:根据电荷差异用 IEF 分离
第二向:根据分子量差异用 SDS- PAGE 分离
第十四页,共143页。
IEF
SDS-PAGE
第十五页,共143页。
每一个点代表一条多肽链,每一条多肽链有自己的等电点 和分子量。多肽链可以用染色法或放射自显影进行检测
第十六页,共143页。
(4)其它方法
• 离子交换层析(根据物质所带电荷进行分离)
• 亲和层析(利用蛋白质与与其他分子的结合特异性)
• N-末端氨基酸测定 • 纯化至恒定比活 • 肽(酶)谱分析 • Western 印迹法(由蛋白质的SDS-PAGE、电转及杂交几部
蛋白质的一级结构(共价结构)

1.蛋白质的一级结构(共价结构)蛋白质的一级结构也称共价结构、主链结构。
2.蛋白质结构层次一级结构(氨基酸顺序、共价结构、主链结构)↓是指蛋白质分子中氨基酸残基的排列顺序二级结构↓超二级结构↓构象(高级结构)结构域↓三级结构(球状结构)↓四级结构(多亚基聚集体)3.一级结构的要点.4.蛋白质测序的一般步骤祥见 P116(1)测定蛋白质分子中多肽链的数目。
(2)拆分蛋白质分子中的多肽链。
(3)测定多肽链的氨基酸组成。
(4)断裂链内二硫键。
(5)分析多肽链的N末端和C末端。
(6)多肽链部分裂解成肽段。
(7)测定各个肽段的氨基酸顺序(8)确定肽段在多肽链中的顺序。
(9)确定多肽链中二硫键的位置。
5.蛋白质测序的基本策略对于一个纯蛋白质,理想方法是从N端直接测至C端,但目前只能测60个N端氨基酸。
6. 直接法(测蛋白质的序列)两种以上特异性裂解法 N CA 法裂解 A1 A2 A3 A4B 法裂解 B1 B2 B3 B4用两种不同的裂解方法,产生两组切点不同的肽段,分离纯化每一个肽段,分离测定两个肽段的氨基酸序列,拼接成一条完整的肽链。
7. 间接法(测核酸序列推断氨基酸序列)核酸测序,一次可测600-800bp8. 测序前的准备工作9. 蛋白质的纯度鉴定纯度要求,97%以上,且均一,纯度鉴定方法。
(两种以上才可靠)⑴聚丙烯酰胺凝胶电泳(PAGE)要求一条带⑵DNS —cl (二甲氨基萘磺酰氯)法测N 端氨基酸10. 测定分子量用于估算氨基酸残基n=方法:凝胶过滤法、沉降系数法11. 确定亚基种类及数目多亚基蛋白的亚基间有两种结合方式:⑴非共价键结合8mol/L 尿素,SDS SDS-PAGE 测分子量⑵二硫键结合过甲酸氧化:—S —S —+HCOOOH → SO 3Hβ巯基乙醇还原:举例:: 血红蛋白 (α2β2)(注意,人的血红蛋白α和β的N 端相同。
)分子量: M拆亚基: M 1 、M 2 两条带拆二硫键: M 1 、M 2 两条带分子量关系: M = 2M 1 + 2M 212. 测定氨基酸组成主要是酸水解,同时辅以碱水解。
第4章 蛋白质一级结构测定

SDS -PAGE
•
SDS-PAGE 分离的蛋白 质可以用 Coomassie blue 染色,也可银染( silver stain)
•
SDS-PAGE 能分离分 子量差异小于 10% 的 蛋白质
• 用于蛋白质纯化和分子 量近似值测定
(2)等电聚焦(isoelectric focusing , IEF )
(二)蛋白质的分子量测定
常用的测定方法有: 1. 渗透压(osmotic pressure) 2. 沉降平衡(sedimentation equilibrium) 3.凝胶过滤法; 4. SDS — 聚丙烯酸胺凝胶电泳法 5. 激光解吸电离飞行质谱法
分子量测定
Ⅰ. 渗透压(osmotic pressure) π:渗透压 c:溶质浓度 R:气体常数 T:绝对温度 M:分子量
Ⅱ. 沉降平衡(sedimentation equilibrium)
公式: 2RT ln(c2/c1) M= (1-v ρ) ω2 (x22-x12)
x:蛋白质界面到旋转中 心的距离 c: x 处的蛋白质浓度 ρ:溶剂的密度 ω:角速度 v:蛋白质的偏微比容 • 用较低的速度离心(8,000~20,000 r/min) • 离心开始后,颗粒发生沉降,造成浓度梯度,同时产生 扩散作用。扩散力与离心力作用方向相反,相互平衡
在凝胶上加入一种两性电解质(ampholyte),电泳时会 形成连续的 pH 梯度 电泳后,各种蛋白质停留在与其等电点(pI)相同的位 置
IEF 能分离 pI 值仅相差 0.01 的蛋白质(即一个净电 单位)
不连续电泳的三种效应:
浓缩效应,
分子筛效应
电荷效应
(3)双向电泳(two-dimensional gel electrophoresis)
第三章 蛋白质一级结构及测定

1.氧化法(过甲酸) 优点:—S—S—切断后,肽链不能重新形成— S—S—,便于肽链分离。 缺点:①甲硫氨酸侧链氧化成亚砜,但由 于相当稳定,并不影响分析 ②色氨酸会遭到破坏 ③氧化产物不能重新还原为巯基
2.还原法(巯基乙醇)
利用还原剂巯基乙醇亦可使蛋白质的-S-S-断裂。当高浓度 的巯基乙醇在pH8条件下室温保温几小时后,可以使-S-S-定量 还原为SH。此同时反应系统中还需要有8摩尔脲或6摩尔盐酸胍 使蛋白质变性,多肽链松散成为无规则的构型,此时还原剂就 可作用于-S-S-。此反应是可逆的,因此要使反应完全,疏基乙 醇的浓度必需在0.1-0.5摩尔。
第三章 蛋白质的一级结构及其测定 蛋白质一级结构:指多肽链上各种 氨基酸的排列顺序及二硫键的位置。
蛋白质分子中多肽链的数目及种类、蛋白质 氨基酸的定量组成、多肽链氨基酸的排列顺 序、二硫键数目和位置、酰胺基的数目和位 置、糖类、脂类或磷酸基的数目和位置。
蛋白质一级结构测定的意义
①对于酶催化部位及高级结构的研究提供化学基础 ②对于研究生物进化提供不可缺少的重要材料 ③研究病变的机理:如分子病 ④为合成某些生物药类提供依据 ⑤是研究基因工程中基因表达的重要内容 ⑥预测蛋白质的二级及三级结构,甚至预测蛋白质 的某些功能
鉴定N-末端或 C-末端残基 确定蛋白质分 子的肽链数 测定各亚基 的分子量 测定肽链的 氨基酸组成
一、拆分蛋白质分子中的多肽链
若肽链间非共价键连接,可使蛋白质变性, 用高浓度变性剂,8mol/L脲素或解聚剂SDS拆 离,或6mol/L盐酸胍处理。 若肽链间通过—S—S—连接,需拆开—S—S—, 并将出现的—SH保护(防止氧化连结),保护剂用 烷基化试剂,如碘乙酸等。
苯异硫氰酸酯 ( PITC ) S
蛋白质化学--一级结构测定
4、氨肽酶法
• 根据不同的反应时间测出酶水解所释放出 的氨基酸种类和数量,按反应时间和氨基 酸残基释放量作动力学曲线,从而知道蛋 白质的N-末端残基顺序 。
• 但由于氨肽酶的特异性 和对各种氨基酸水解速 度不同,结果往往不易 判断,在实际应用中容易 导致错误结论而少用。
第三章 蛋白质一级结构及其测定
2008年全国硕士生植物(动物)生理学 与生物化学入学考试题
生物化学部分 六 简答题
简述蛋白质的一级结构及其与生物进 化的关系
38
(1) 蛋白质一级结构是指蛋白质多肽链中氨 基酸残基的排列顺序及二硫键的位置。
(2) 不同物种同源蛋白质一级结构存在差 异,亲缘关系越远,其一级结构中氨基酸 序列的差异越大;亲缘关系越近,其一级结 构中氨基酸序列的差异越小。 (3)与功能密切相关的氨基酸残基是不变的, 与生物进化相关的氨基酸残基是可变的。
OC OH CH2 CH2 CH C NH--H2N O OC CH2 CH2 CH C NH--O
NH
焦谷式(吡咯烷酮羧基)末端处理方法 采用牛肝焦谷氨酸氨肽酶方法,该酶 能够水解N-末端的吡咯烷酮羧基,水 解后可使肽用 Edman法分析。
ቤተ መጻሕፍቲ ባይዱ OC
CH2 CH2 CH C NH--O
O OC CH2 CH2 CH
内切肽酶 外切肽酶 (蛋白酶) (肽酶)
Exopeptidase (Peptidase)
内链内切肽酶(内肽酶)中还分: Serine–类 (EC 3.4.21)
如胰蛋白酶,胰凝乳蛋白酶,凝血酶
Cysteine -类
蛋白质一级结构测序解析共62页

41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不饶。——贝多芬
45、自己的饭量自己知道。——苏联
蛋白质一级结构测序解析
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温 42、法律的律和制度必须跟上人类思想进 步。— —杰弗 逊 44、人类受制于法律,法律受制于情 理。— —托·富 勒
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
21、没有人陪你走一辈子,所以你要 适应孤 独,没 有人会 帮你一 辈子, 所以你 要奋斗 一生。 22、当眼泪流尽的时候,留下的应该 是坚强Hale Waihona Puke 。 23、要改变命运,首先改变自己。
24、勇气很有理由被当作人类德性之 首,因 为这种 德性保 证了所 有其余 的德性 。--温 斯顿. 丘吉尔 。 25、梯子的梯阶从来不是用来搁脚的 ,它只 是让人 们的脚 放上一 段时间 ,以便 让别一 只脚能 够再往 上登。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
