高等有机化学各章习题及答案 (9)
有机化学-杨红-各章课后习题答案在学习指导上-第九
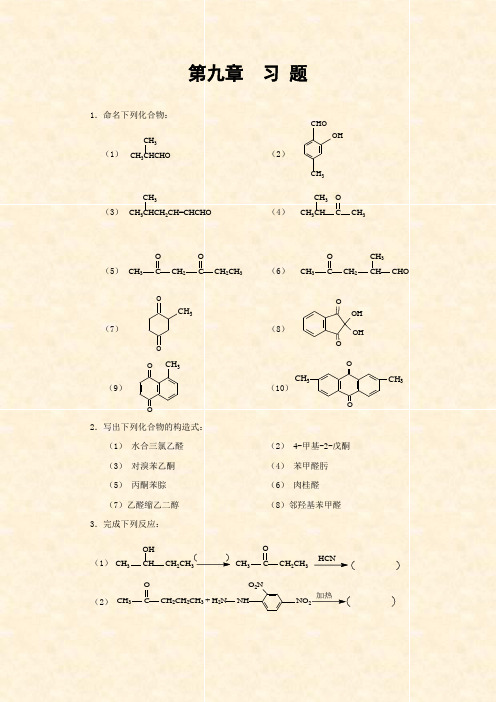
第九章 习 题1.命名下列化合物:(1) (2)(3) (4)(5) (6)(7)(8)(9) (10)2.写出下列化合物的构造式:(1) 水合三氯乙醛 (2) 4-甲基-2-戊酮 (3) 对溴苯乙酮 (4) 苯甲醛肟 (5) 丙酮苯腙 (6) 肉桂醛 (7)乙醛缩乙二醇 (8)邻羟基苯甲醛 3.完成下列反应:(1)(2)CH 3CHCHO CH 3CHOOHCH 3CH 3CHCH 2CH=CHCHO CH 3CH 3CHCH 3CCH 3OCH 3C CH 2C CH 2CH 3OOCH 3CCH 2CHO CH 3CHOOOOH OH CH 3CCH 2CH 2CH 3O +H 2NNHO 2N NO 2加热CH 3CHCH 2CH 3OH CH 3CCH 2CH 3O HCNOOCH 3OOCH 3CH 3OOCH 3(3) (4) (5)(6)(7)(8)(9) (10)(11) (12) (13)4.将下列化合物按沸点由高到低排列成序:(1) a 正丁醛 b 正戊烷 c 正丁醇 d 2-甲基丙醛 (2) a 苯甲醇 b 苯甲醛 c 乙苯 d 苯甲醚 5.完成下列转化: (1) (2) (3)CH 3CH 2CH 2CHO +CH 3CH 2MgBr 无水醚H +/H 2O(CH 3)3CCHO 浓NaOH(CH 3)3C CCH 3O (CH 3)3CCO -O+CH 3CH 2CHO 稀NaOH 加热CCH 3O +CH 3MgBr1乙醚2 H +/H 2OCHCHCHO Ag(NH 3)2+OH -CHCHCHO KMnO 4/H+CH CH CH 3CHOCHCl 3+CH 3CHO CH 3CHOCH 2CH 2OCH 3CH 2CHOCH 3CH 2CHCCH 2OHCH 3CH 2CH 2CH 3OO +加热HCHOCHO+NaOH浓( ) + ( )CH 2CH 2CH 3CH 2CH 2CH 2O HCH 2CH 3CH 2CH 2CH 2OHCH 3CH(4)6.用化学方法鉴别下列各组化合物:(1)甲醛、乙醛、丙酮、苯丙酮(2)戊醛、2-戊酮、3-戊酮、2-戊醇(3)苯甲醛、苯乙酮、对羟基苯甲醛7.某化合物分子式为C6H12O,能与羟胺作用生成肟,但不起银镜反应,在铂的催化下加氢得到一种醇。
《有机化学》章节习题答案.docx
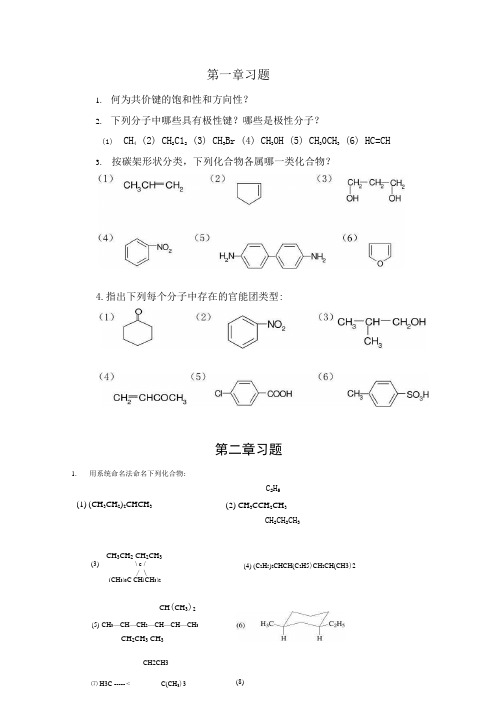
第一章习题1.何为共价键的饱和性和方向性?2.下列分子中哪些具有极性键?哪些是极性分子?(1)CH4 (2) CH2C12 (3) CH3Br (4) CH3OH (5) CH30CH3 (6) HC=CH3.按碳架形状分类,下列化合物各属哪一类化合物?第二章习题1.用系统命名法命名下列化合物:(1) (CH3CH2)2CHCH3C2H5 (2) CH3CCH2CH3CH2CH2CH3CH3CH2 CH2CH3(3)\ c // \(CH3)3C CH(CH3)2(4) (C2H5)2CHCH(C2H5)CH2CH(CH3)2CH(CH3)2(5)CH3—CH—CH2—CH—CH—CH3CH2CH3 CH3CH2CH34.指出下列每个分子中存在的官能团类型:⑺ H3C ----- < C(CH3)3 (8)2. 写出下列化合物的构造式:(1) 由一个叔丁基和异丙基组成的烷炷; (2) 含一侧链甲基,分子量为98的环烷炫(3) 分子量为114,同时含有1°、2°、3。
、4。
碳的烷炷。
3.写出下列化合物的结构式,如其名称与系统命名原则不符,请予以改正。
(1)3, 3-二甲基丁烷 (2)2, 3-二甲基-2-乙基丁烷 (3) 4 -异丙基庚烷(4) 3> 4-二甲基-3 -乙基戊烷(5)3, 4, 5-三甲基-4-正丙基庚烷 ⑹2 -叔丁基-4, 5 -二甲基己烷4. 相对分子质量为72的烷任进行高温氯化反应,根据氯化产物的不同,推测各种烷炷的结构式。
(1)只生成一种一氯代产物(2)可生成三种不同的一氯代产物(3) 生成四种不同的一氯代产物 (4)只生成二种二氯代产物 5.不查表将下列烷炷的沸点由高至低排列成序: (1)2, 3-二甲基戊烷 (2) 2-甲基己烷 (3)正庚烷 (4) 正戊烷(5)环戊烷6. 写出下列化合物的优势构象—( 「CH2CH3 (1) BrCH 2CH 2Cl (2) CH 3CH 2CH 2CH 2CH 3 (3) '、'、—/(4)反-1-甲基-4-叔丁基环己烷7. 写出1, 3-二甲基环已烷和1-甲基-4-异丙基环已烷的顺、反异构体优势构象,并比较每组中哪个稳定。
(完整版)有机化学练习题以及答案修

有机化学各章习题及答案第一章绪论1. 在下列化合物中,偶极矩最大的是 ( )A.CH3CH2ClB. H2C=CHClC. HC≡CCl2. 根据当代的观点,有机物应该是 ( )A.来自动植物的化合物B. 来自于自然界的化合物C. 人工合成的化合物D. 含碳的化合物3. 1828年维勒(F. Wohler)合成尿素时,他用的是 ( )A.碳酸铵B. 醋酸铵C. 氰酸铵D. 草酸铵4. 有机物的结构特点之一就是多数有机物都以 ( )A.配价键结合B. 共价键结合C. 离子键结合D. 氢键结合5. 根椐元素化合价,下列分子式正确的是 ( )A.C6H13B. C5H9Cl2C. C8H16OD. C7H15O6. 下列共价键中极性最强的是 ( )A.H-CB. C-OC. H-OD. C-N7. 下列溶剂中极性最强的是 ( )A.C2H5OC2H5B. CCl4C. C6H6D. CH3CH2OH8. 下列溶剂中最难溶解离子型化合物的是 ( )A. H2OB. CH3OHC. CHCl3D. C8H189. 下列溶剂中最易溶解离子型化合物的是 ( )A.庚烷 B. 石油醚 C. 水 D. 苯10. 通常有机物分子中发生化学反应的主要结构部位是 ( )A.键B. 氢键C. 所有碳原子D. 官能团(功能基)第二章烷烃1. 在烷烃的自由基取代反应中,不同类型的氢被取代活性最大的是 ( )A.一级B. 二级C. 三级D. 那个都不是2.氟、氯、溴三种不同的卤素在同种条件下,与某种烷烃发生自由基取代时,对不同氢选择性最高的是( )A.氟B. 氯C. 溴D.3. 在自由基反应中化学键发生 ( )A. 异裂B. 均裂C. 不断裂D. 既不是异裂也不是均裂4. 下列烷烃沸点最低的是 ( )A. 正己烷B. 2,3-二甲基戊烷C. 3-甲基戊烷D. 2,3-二甲基丁烷5. 在具有同碳原子数的烷烃构造异构体中,最稳定的是 ( )的异构体 ( )A. 支链较多B. 支链较少C. 无支链6. 引起烷烃构象异构的原因是 ( )A. 分子中的双键旋转受阻B. 分子中的单双键共轭C. 分子中有双键D. 分子中的两个碳原子围绕C-C单键作相对旋转7. 将下列化合物绕C-C键旋转时哪一个化合物需要克服的能垒最大 ( )A. CH2ClCH2BrB. CH2ClCH2IC. CH2ClCH2ClD. CH2ICH2I8. ClCH2CH2Br中最稳定的构象是 ( )A. 顺交叉式B. 部分重叠式C. 全重叠式D. 反交叉式9. 假定甲基自由基为平面构型时,其未成对电子处在什么轨道 ( )A. 1sB. 2sC. sp2D. 2p10. 下列游离基中相对最不稳定的是 ( )A. (CH3)3C.B. CH2=CHCH2.C. CH3.D. CH3CH2.11. 构象异构是属于 ( )A. 结构异构B. 碳链异构C. 互变异构D. 立体异构12. 下列烃的命名哪个是正确的? ( )A、乙基丙烷 B. 2-甲基-3-乙基丁烷C. 2,2-二甲基-4-异丙基庚烷D. 3-甲基-2-丁烯13. 下列烃的命名哪个不符合系统命名法? ( )A.2-甲基-3-乙基辛烷 B. 2,4-二甲基-3-乙基己烷C. 2,3-二甲基-5-异丙基庚烷D. 2, 3, 5-三甲基-4-丙基庚烷14. 按沸点由高到低的次序排列以下四种烷烃①庚烷②2,2-二甲基丁烷③己烷④戊烷 ( )A. ③>②>①>④B. ①>③>②>④C. ①>②>③>④D. ①>②>③>④15. 异己烷进行氯化,其一氯代物有几种? ( )A. 2种B. 3种C. 4种D. 5种16. 化合物的分子式为C5H12一元氯代产物只有一种,结构式是 ( )A.C(CH3)4 B. CH3CH2CH2CH2CH3C. (CH3)2CHCH2CH317. 下列分子中,表示烷烃的是 ( )A. C2H2B. C2H4C. C2H6D. C6H618. 下列各组化合物中,属同系物的是 ( )A. C2H6和C4H8B. C3H8和C6H14C. C8H18和C4H10D. C5H12和C7H1419.甲烷分子不是以碳原子为中心的平面结构,而是以碳原子为中心的正四面体结构,其原因之一是甲烷的平面结构式解释不了下列事实 ( )A. CH3Cl不存在同分异构体B. CH2Cl2不存在同分异构体C.CHCl3不存在同分异构体 D. CH4是非极性分子20. 甲基丁烷和氯气发生取代反应时,能生成一氯化物异构体的数目是 ( )A. 1种B. 2种C. 3种D. 4种21. 实验室制取甲烷的正确方法是 ( )A. 醇与浓硫酸在170℃条件下反应B. 电石直接与水反应C. 无水醋酸钠与碱石灰混和物加热至高温D. 醋酸钠与氢氧化钠混和物加热至高温第三章烯烃1. 在烯烃与HX的亲电加成反应中,主要生成卤素连在含氢较( )的碳上 ( )A. 好B. 差C. 不能确定2. 烯烃双键碳上的烃基越多,其稳定性越 ( )A. 好B. 差C. 不能确定3. 反应过程中出现碳正离子活性中间体,而且相互竟争的反应是 ( )A. SN2与E2B. SN1与SN2C. SN1与E14. 碳正离子a.R2C=CH-C+R2、 b. R3C+、 c. RCH=CHC+HR 、 d.RC+=CH2稳定性次序为 ( )A. a>b>c>dB. b>a>c>dC. a>b≈c>dD. c>b>a>d5. 下列烯烃发生亲电加成反应最活泼的是 ( )A. (CH3)2C=CHCH3B. CH3CH=CHCH3C. CH2=CHCF3D. CH2=CHCl36. 下列反应中间体的相对稳定性顺序由大到小为( )CH 2CH 3CH 3CHCH 3CH 3C CH 3CH 3+++A. B. C.A. A >B >CB. A >C >BC. C >B >AD. B >C >A7. 1-己烯、顺-3-己烯和反-3-己烯三者相对稳定性的次序是 ( )A. 反-3-己烯>顺-3-己烯>1-己烯B. 1-己烯>顺-3-己烯>反-3-己烯C. 顺-3-己烯>1-己烯>反-3-己烯8. 在烯烃与HX 的加成反应中,反应经两步而完成,生成( )的一步是速度较慢的步骤( )A. 碳正离子B. 碳负离子C. 自由基 9. 分子式为C 5H 10的烯烃化合物,其异构体数为 ( )A. 3个B. 4个C. 5个D. 6个10. 在下列化合物中,最容易进行亲电加成反应的是 ( )A.CH 2=CHCH=CH 2B.CH 3CH=CHCH 3C.CH 3CH=CHCHOD.CH 2=CHCl11. 马尔科夫经验规律应用于 ( )A. 游离基的稳定性B. 离子型反应C. 不对称烯烃的亲电加成反应D. 游离基的取代反应12. 下列加成反应不遵循马尔科夫经验规律的是 ( )A. 丙烯与溴化氢反应B. 2-甲基丙烯与浓硫酸反应C. 2-甲基丙烯与次氯酸反应D. 2-甲基丙烯在有过氧化物存在下与溴化氢反应13. 若正己烷中有杂质1-己烯,用洗涤方法能除去该杂质的试剂是 ( )A. 水B. 汽油C. 溴水D. 浓硫酸14. 有一碳氢化合物I ,其分子式为C 6H 12,能使溴水褪色,并溶于浓硫酸,I 加氢生成正己烷,I 用过量KMnO 4氧化生成两种不同的羧酸,试推测I 的结构 ( )A. CH 2=CHCH 2CH 2CH 2CH 2B. CH 3CH=CHCH 2CH 2CH 3bC. CH 3CH 2CH=CHCH 2CH 3D. CH 3CH 2CH=CHCH=CH 215. 下列正碳离子中,最稳定的是 ( )CH 3CH 3CH 3CH 3CH 2CH 3++A. B.C.D.CH 3CH 3++16. 具有顺反异构体的物质是 ( )CH 3CH C CO 2HCH 3CH 3CH C CH 3CH 3CH 3C CH 3CHCH 2CH 3H 2C CH 2A. B.C. D.17. 分子式为C 4H 8的烯烃与稀、冷KMnO 4溶液反应得到内消旋体的是 ( )CH 2CHCH 2CH 3CH 2C(CH 3)2C CHHCH 3CH 3C CH CH 3H CH 3A. B.C. D.18. 下列反应进行较快的是( )A.B.CH 3CH 3Cl CH 3CH 3CH 3CH 3Cl CH 3CH 319. 下列化合物稳定性最大的是 ( )A. B.C. D.H 3C CH 2H 3CCH 3H 3CCH 3H 3CCH 3CH 3第四章 炔烃和二烯烃1. 在含水丙酮中,p-CH 3OC 6H 4CH 2Cl 的水解速度是C 6H 5CH 2Cl 的一万倍,原因是 ( )A.甲氧基的-I 效应B. 甲氧基的+E 效应C. 甲氧基的+E 效应大于-I 效应D. 甲氧基的空间效应2. 下列化合物中氢原子最易离解的为 ( )A. 乙烯B. 乙烷C. 乙炔D. 都不是3. 二烯体1,3-丁二烯与下列亲二烯体化合物发生Diels-Alder反应时活性较大的是 ( )A. 乙烯B. 丙烯醛C. 丁烯醛D. 丙烯4. 下列化合物中酸性较强的为 ( )A. 乙烯B. 乙醇C. 乙炔D. H25. 在CH3CH=CHCH2CH3化合物的自由基取代反应中, ( )氢被溴取代的活性最大A. 1-位B. 2-位及3-位C. 4-位D. 5-位6. 下列物质能与Ag(NH3)2+反应生成白色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔7. 下列物质能与Cu2Cl2的氨水溶液反应生成红色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔8. 以下反应过程中,不生成碳正离子中间体的反应是 ( )A. SN1B. E1C. 烯烃的亲电加成D. Diels-Alder反应9. 在sp3, sp2, sp杂化轨道中p轨道成分最多的是()杂化轨道( )A. sp3B. sp2C. sp10. 鉴别环丙烷,丙烯与丙块需要的试剂是 ( )A. AgNO3的氨溶液;KMnO4溶液B. HgSO4/H2SO4; KMnO4溶液C. Br2的CCl4溶液;KMnO4溶液D. AgNO3的氨溶液11. 结构式为CH3CHCICH=CHCH3的化合物其立体异构体数目是 ( )A. 1B. 2C. 3D. 412. 1-戊烯-4-炔与1摩尔Br2反应时,预期的主要产物是 ( )A. 3,3-二溴-1-戊-4-炔B. 1,2-二溴-1,4-戊二烯C. 4,5-二溴-2-戊炔D. 1,5-二溴-1,3-戊二烯13. 某二烯烃和一分子溴加成结果生成2,5-二溴-3-己烯,该二烯烃经高锰酸钾氧化得到两分子乙酸和一分子草酸,该二烯烃的结构式是 ( )A. CH 2=CHCH=CHCH 2CH 3B. CH 3CH=CHCH=CHCH 3C. CH 3CH=CHCH 2CH=CH 2D. CH 2 =CHCH 2CH 2CH=CH 214. 下列化合物无对映体的是 ( )HCH 3H 3C H 3CH 3C CH C CH CH 3H 5C 6CH C CHC 6H 5H 5C 6N CH 3C 2H 5C 3H 7I -+A.B.C. D.15. 下列炔烃中,在HgSO 4-H 2SO 4的存在下发生水合反应,能得到醛的是( )A. B.C. D.CH 3C C CH3CH 3C CHHC CHCH 3CH 2CH 2C CH16.一化合物分子式为C 5H 8,该化合物可吸收两分子溴,不能与硝酸银的氨溶液作用,用过量的酸性高锰酸钾溶液作用,生成两分子二氧化碳和一分子丙酮酸推测该化合物的结构式( )A. B.C. D.CH 3C CCH 2CH 3HC C CHCH 3CH 3CH 2CHCH CHCH 3H 2C C CH CH 2CH 317. 下面三种化合物与一分子HBr 加成反应活性最大的是( )A. B. C.PhCH CH 2p O 2NC 6H 4CH CH 2p CH 3C 6H 4CH CH 2第五章 环烷烃1. 环已烷的所有构象中最稳定的构象是 ( )A. 船式B. 扭船式C. 椅式2. A. 环丙烷、B. 环丁烷、C. 环己烷、D. 环戊烷的稳定性顺序 ( )A. C>D>B>AB. A>B>C>DC. D>C>B>AD. D>A>B>C3. 下列四种环己烷衍生物其分子内非键张力(Enb )从大到小顺序应该( )A. B.C.D.(CH 3)3CCH 3(CH 3)3CCH 3C(CH 3)3CH 3C(CH 3)3CH 3A. A >B >C >DB. A >C >D >BC. D >C >B >AD. D >A >B >C4. 1,3-二甲基环己烷不可能具有 ( )A. 构象异构B. 构型异构C. 几何异构D. 旋光异构5. 环烷烃的环上碳原子是以哪种轨道成键的?( )A. sp 2杂化轨道B. s 轨道C. p 轨道D. sp 3杂化轨道6.碳原子以sp 2杂化轨道相连成环状,不能使高锰酸钾溶液褪色,也不与溴加成的一类化合物是( )A. 环烯烃B. 环炔烃C. 芳香烃D. 脂环烃7. 环烷烃的稳定性可以从它们的角张力来推断,下列环烷烃哪个稳定性最差? ( )A. 环丙烷B. 环丁烷C. 环己烷D. 环庚烷8. 单环烷烃的通式是下列哪一个? ( )A. C n H 2nB. C n H 2n+2C. C n H 2n-2D. C n H 2n-69. 下列物质的化学活泼性顺序是①丙烯 ②环丙烷 ③环丁烷 ④丁烷 ( )A. ①>②>③>④B. ②>①>③>④C. ①>②>④>③D. ①>②>③=④10. 下列物质中,与异丁烯不属同分异构体的是 ( )g oA. 2-丁烯B. 甲基环丙烷C. 2-甲基-1-丁烯D. 环丁烷11.CH 2CH 3CH 3HH的正确名称是 ( )A. 1-甲基-3-乙基环戊烷B. 顺-1-甲基-4-乙基环戊烷C. 反-1-甲基-3-乙基戊烷D. 顺-1-甲基-3-乙基环戊烷12. 环己烷的椅式构象中,12个C-H 键可区分为两组,每组分别用符号( )表示 ( )A. α与βB. σ与πC. a 与eD. R 与S 13. 下列反应不能进行的是( )A.B.C.D.CH 3+KMnO 4/H ++H 2¸ßÎÂ+Br 2hv+KMnO 4/H 3O +14. 下列化合物燃烧热最大的是 ( )A.B.C.D.15. 下列物质与环丙烷为同系物的是 ( )A. B.C.D.CH 3CHCH 316. 1,2-二甲基环己烷最稳定的构象是 ( )A.B.C.D.H CH 3CH 3HCH 3CH 3CH 3CH 3317. 下列1,2,3-三氯环己烷的三个异构体中,最稳定的异构体是 ( )A. B.C.ClClCl ClClClCl ClClth第六章 对映异构1. 下列物质中具有手性的为( )。
有机化学课后习题答案(张凤秀主编)

第1章 习题答案1. 1. 指出下列化合物中每个碳原子的杂化轨道类型:(1)均为sp 3 杂化。
(2)(3)(4)(5)(6)2. 指出下列分子或离子哪些是路易斯酸?哪些是路易斯碱?(1)路易斯碱; (2)路易斯酸; (3)路易斯碱; (4)路易斯碱; (5)路易斯碱; (6)路易斯酸; (7)路易斯碱; (8)路易斯酸; (9)路易斯酸; (10)路易斯酸; (11)路易斯碱; (12)路易斯酸3. 指出下列化合物中官能团的名称及所属化合物的类别:(1)卤素,卤代烃; (2)醚键,醚; (3)羟基,醇; (4)醛基,醛 (5)双键,烯烃; (6)氨基,胺; (7)羧基,羧酸; (8)酯基,酯 (9)酐键,酸酐; (10)酰胺基,酰胺 (11)三键,炔 (12)羟基,酚 4. 下列化合物哪些易溶于水?哪些易溶于有机溶剂? 易溶于水的有(1)、(3)、(4)、(5)、(6);易溶于有机溶剂的有:(1)、(2)、(3)、(4)、(5)。
5求该化合物的实验式和分子式。
该化合物的实验式为:CH 2O ,分子式为C 2H 4O 2、第2章 饱和烃习题答案1.用系统命名法命名下列化合物:(1)2-甲基戊烷 (2)2,2,4-三甲基-3-乙基戊烷 (3)2,2-二甲基己烷 (4)2-甲基-5-乙基庚烷 (5)反-1-氯-2-溴环丁烷 (6)反-1,2-二甲基环戊烷 (7)9-甲基-2-乙基二环[3.3.1]壬烷 (8)3,5-二甲基螺[3.4]辛烷 2.写出下列化合物的结构式:CH 3CHCH 2CH 2CH 33CH 3CH 2CHCHCH 2CH 2CH 3CH 32H 5(1)(2)CH CH 3CH 3C CH CH 32H 5CH 3CH 3(3)(4)(5)HCH 3HC(CH 3)3(6)sp 2CH 2C 3O 232杂化3杂化sp 杂化杂化33杂化32杂化sp 332CH 2CH 3C CH (CH 2)3CH 33CH 3CH CH 2CH 3CH 3CH 3C CH CH 3CH 3(CH 2)4CH 33)2(7)(8)(9)(10)2H 53.写出分子式为C 6H 14 烷烃的各种异构体,并正确命名。
[化学]有机化学练习题以及答案
![[化学]有机化学练习题以及答案](https://img.taocdn.com/s3/m/922ed46603768e9951e79b89680203d8ce2f6a69.png)
有机化学各章习题及答案第一章绪论1. 在下列化合物中,偶极矩最大的是 ( )A.CH3CH2Cl B. H2C=CHCl C. HC≡CCl2. 根据当代的观点,有机物应该是 ( )A.来自动植物的化合物B. 来自于自然界的化合物C. 人工合成的化合物D. 含碳的化合物3. 1828年维勒(F. Wohler)合成尿素时,他用的是 ( )A.碳酸铵B. 醋酸铵C. 氰酸铵D. 草酸铵4. 有机物的结构特点之一就是多数有机物都以 ( )A.配价键结合B. 共价键结合C. 离子键结合D. 氢键结合5. 根椐元素化合价,下列分子式正确的是 ( )A.C6H13B. C5H9Cl2C. C8H16O D. C7H15O6. 下列共价键中极性最强的是 ( )A.H-CB. C-OC. H-OD. C-N7. 下列溶剂中极性最强的是 ( )A.C2H5OC2H5B. CCl4C. C6H6D. CH3CH2OH8. 下列溶剂中最难溶解离子型化合物的是 ( )A. H2O B. CH3OH C. CHCl3D. C8H189. 下列溶剂中最易溶解离子型化合物的是 ( )A.庚烷 B. 石油醚 C. 水 D. 苯10. 通常有机物分子中发生化学反应的主要结构部位是 ( )A.键B. 氢键C. 所有碳原子D. 官能团(功能基)第二章烷烃1. 在烷烃的自由基取代反应中,不同类型的氢被取代活性最大的是 ( )A.一级B. 二级C. 三级D. 那个都不是2. 氟、氯、溴三种不同的卤素在同种条件下,与某种烷烃发生自由基取代时,对不同氢选择性最高的是( )A.氟B. 氯C. 溴D.3. 在自由基反应中化学键发生 ( )A. 异裂B. 均裂C. 不断裂D. 既不是异裂也不是均裂4. 下列烷烃沸点最低的是 ( )A. 正己烷B. 2,3-二甲基戊烷C. 3-甲基戊烷D. 2,3-二甲基丁烷5. 在具有同碳原子数的烷烃构造异构体中,最稳定的是 ( )的异构体 ( )A. 支链较多B. 支链较少C. 无支链6. 引起烷烃构象异构的原因是 ( )A. 分子中的双键旋转受阻B. 分子中的单双键共轭C. 分子中有双键D. 分子中的两个碳原子围绕C-C单键作相对旋转7. 将下列化合物绕C-C键旋转时哪一个化合物需要克服的能垒最大 ( )A. CH2ClCH2Br B. CH2ClCH2I C. CH2ClCH2Cl D. CH2ICH2I8. ClCH2CH2Br中最稳定的构象是 ( )A. 顺交叉式B. 部分重叠式C. 全重叠式D. 反交叉式9. 假定甲基自由基为平面构型时,其未成对电子处在什么轨道 ( )A. 1sB. 2sC. sp2D. 2p10. 下列游离基中相对最不稳定的是 ( )A. (CH3)3C. B. CH2=CHCH2. C. CH3. D. CH3CH2.11. 构象异构是属于 ( )A. 结构异构B. 碳链异构C. 互变异构D. 立体异构12. 下列烃的命名哪个是正确的? ( )A、乙基丙烷 B. 2-甲基-3-乙基丁烷C. 2,2-二甲基-4-异丙基庚烷D. 3-甲基-2-丁烯13. 下列烃的命名哪个不符合系统命名法? ( )A.2-甲基-3-乙基辛烷 B. 2,4-二甲基-3-乙基己烷C. 2,3-二甲基-5-异丙基庚烷D. 2, 3, 5-三甲基-4-丙基庚烷14. 按沸点由高到低的次序排列以下四种烷烃①庚烷②2,2-二甲基丁烷③己烷④戊烷( )A. ③>②>①>④B. ①>③>②>④C. ①>②>③>④D. ①>②>③>④15. 异己烷进行氯化,其一氯代物有几种? ( )A. 2种B. 3种C. 4种D. 5种16. 化合物的分子式为C5H12一元氯代产物只有一种,结构式是 ( )A.C(CH3)4B. CH3CH2CH2CH2CH3C. (CH 3)2CHCH 2CH 317. 下列分子中,表示烷烃的是 ( )A. C 2H 2B. C 2H 4C. C 2H 6D. C 6H 6 18. 下列各组化合物中,属同系物的是 ( )A. C 2H 6和C 4H 8B. C 3H 8和C 6H 14C. C 8H 18和C 4H 10D. C 5H 12和C 7H 1419. 甲烷分子不是以碳原子为中心的平面结构,而是以碳原子为中心的正四面体结构,其原因之一是甲烷的平面结构式解释不了下列事实 ( )A. CH 3Cl 不存在同分异构体B. CH 2Cl 2不存在同分异构体 C .CHCl 3不存在同分异构体 D. CH 4是非极性分子20. 甲基丁烷和氯气发生取代反应时,能生成一氯化物异构体的数目是 ( )A. 1种B. 2种C. 3种D. 4种 21. 实验室制取甲烷的正确方法是 ( )A. 醇与浓硫酸在170℃条件下反应B. 电石直接与水反应C. 无水醋酸钠与碱石灰混和物加热至高温D. 醋酸钠与氢氧化钠混和物加热至高温第三章 烯烃1. 在烯烃与HX 的亲电加成反应中,主要生成卤素连在含氢较( )的碳上 ( )A. 好B. 差C. 不能确定2. 烯烃双键碳上的烃基越多,其稳定性越 ( )A. 好B. 差C. 不能确定3. 反应过程中出现碳正离子活性中间体,而且相互竟争的反应是 ( )A. SN2与E2B. SN1与SN2C. SN1与E14. 碳正离子a.R 2C=CH-C +R 2 、 b. R 3C +、 c. RCH=CHC +HR 、 d. RC +=CH 2稳定性次序为 ( )A. a >b >c >dB. b >a >c >dC. a >b ≈c >dD. c >b >a >d 5. 下列烯烃发生亲电加成反应最活泼的是 ( )A. (CH 3)2C=CHCH 3B. CH 3CH=CHCH 3C. CH 2=CHCF 3D. CH 2=CHCl 3 6. 下列反应中间体的相对稳定性顺序由大到小为( ) CH 2CH 3CH 3CHCH 3CH 3C CH 3CH 3+++A. B. C.A. A >B >CB. A >C >BC. C >B >AD. B >C >A 7. 1-己烯、顺-3-己烯和反-3-己烯三者相对稳定性的次序是 ( )A. 反-3-己烯>顺-3-己烯>1-己烯B. 1-己烯>顺-3-己烯>反-3-己烯C. 顺-3-己烯>1-己烯>反-3-己烯8. 在烯烃与HX 的加成反应中,反应经两步而完成,生成( )的一步是速度较慢的步骤( )A. 碳正离子B. 碳负离子C. 自由基 9. 分子式为C 5H 10的烯烃化合物,其异构体数为 ( )A. 3个B. 4个C. 5个D. 6个10. 在下列化合物中,最容易进行亲电加成反应的是 ( )A.CH 2=CHCH=CH 2B.CH 3CH=CHCH 3C.CH 3CH=CHCHOD.CH 2=CHCl 11. 马尔科夫经验规律应用于 ( )A. 游离基的稳定性B. 离子型反应C. 不对称烯烃的亲电加成反应D. 游离基的取代反应 12. 下列加成反应不遵循马尔科夫经验规律的是 ( )A. 丙烯与溴化氢反应B. 2-甲基丙烯与浓硫酸反应C. 2-甲基丙烯与次氯酸反应D. 2-甲基丙烯在有过氧化物存在下与溴化氢反应 13. 若正己烷中有杂质1-己烯,用洗涤方法能除去该杂质的试剂是 ( )A. 水B. 汽油C. 溴水D. 浓硫酸14. 有一碳氢化合物I ,其分子式为C 6H 12 ,能使溴水褪色,并溶于浓硫酸,I 加氢生成正己烷,I 用过量KMnO 4氧化生成两种不同的羧酸,试推测I 的结构 ( )A. CH 2=CHCH 2CH 2CH 2CH 2B. CH 3CH=CHCH 2CH 2CH 3C. CH 3CH 2CH=CHCH 2CH 3D. CH 3CH 2CH=CHCH=CH 215. 下列正碳离子中,最稳定的是 ( )CH 3CH 3CH 3CH 3CH 2CH 3++A. B.C.D.CH 3CH 3++16. 具有顺反异构体的物质是 ( )CH 3CH C CO 2HCH 3CH 3CH C CH 3CH 3CH 3C CH 3CHCH 2CH 3H 2C CH 2A. B.C. D.17. 分子式为C 4H 8的烯烃与稀、冷KMnO 4溶液反应得到内消旋体的是 ( )CH 2CHCH 2CH 3CH 2C(CH 3)2C CHHCH 3CH 3C CH CH 3HCH 3A. B.C. D.18. 下列反应进行较快的是( )A. B.CH 3CH 3Cl KOH/C H OHCH 3CH 3CH 3CH 3ClKOH/C H OHCH 3CH 319. 下列化合物稳定性最大的是 ( )A. B.C. D.H 3C CH 2H 3CCH 3H 3CCH 3H 3CCH 3CH 3第四章 炔烃和二烯烃1. 在含水丙酮中,p-CH 3OC 6H 4CH 2Cl 的水解速度是C 6H 5CH 2Cl 的一万倍,原因是 ( )A.甲氧基的-I 效应B. 甲氧基的+E 效应C. 甲氧基的+E 效应大于-I 效应D. 甲氧基的空间效应 2. 下列化合物中氢原子最易离解的为 ( )A. 乙烯B. 乙烷C. 乙炔D. 都不是3. 二烯体1,3-丁二烯与下列亲二烯体化合物发生Diels-Alder 反应时活性较大的是 ( )A. 乙烯B. 丙烯醛C. 丁烯醛D. 丙烯 4. 下列化合物中酸性较强的为 ( )A. 乙烯B. 乙醇C. 乙炔D. H 25. 在CH 3CH=CHCH 2CH 3化合物的自由基取代反应中, ( )氢被溴取代的活性最大A. 1-位B. 2-位及3-位C. 4-位D. 5-位 6. 下列物质能与Ag(NH 3)2+反应生成白色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔7. 下列物质能与Cu 2Cl 2的氨水溶液反应生成红色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔 8. 以下反应过程中,不生成碳正离子中间体的反应是 ( )A. SN1B. E1C. 烯烃的亲电加成D. Diels-Alder 反应 9. 在sp 3, sp 2, sp 杂化轨道中p 轨道成分最多的是( )杂化轨道( )A. sp 3B. sp 2C. sp10. 鉴别环丙烷,丙烯与丙块需要的试剂是 ( )A. AgNO 3的氨溶液;KMnO 4溶液B. HgSO 4/H 2SO 4; KMnO 4溶液C. Br 2的CCl 4溶液;KMnO 4溶液D. AgNO 3的氨溶液 11. 结构式为CH 3CHCICH=CHCH 3的化合物其立体异构体数目是 ( )A. 1B. 2C. 3D. 412. 1-戊烯-4-炔与1摩尔Br 2反应时,预期的主要产物是 ( )A. 3,3-二溴-1-戊-4-炔B. 1,2-二溴-1,4-戊二烯C. 4,5-二溴-2-戊炔D. 1,5-二溴-1,3-戊二烯13. 某二烯烃和一分子溴加成结果生成2,5-二溴-3-己烯,该二烯烃经高锰酸钾氧化得到两分子乙酸和一分子草酸,该二烯烃的结构式是 ( )A. CH 2=CHCH=CHCH 2CH 3B. CH 3CH=CHCH=CHCH 3C. CH 3CH=CHCH 2CH=CH 2D. CH 2 =CHCH 2CH 2CH=CH 2 14. 下列化合物无对映体的是 ( )H CH 3H 3C H 3CH 3C CH C CH CH 3H 5C 6CH C CHC 6H 5H 5C 6N CH 3C 2H 5C 3H 7I -+A.B.C. D.15. 下列炔烃中,在HgSO 4-H 2SO 4的存在下发生水合反应,能得到醛的是( )A. B.C. D.CH 3C C CH3CH 3C CHHC CHCH 3CH 2CH 2C CH16. 一化合物分子式为C 5H 8,该化合物可吸收两分子溴,不能与硝酸银的氨溶液作用,用过量的酸性高锰酸钾溶液作用,生成两分子二氧化碳和一分子丙酮酸推测该化合物的结构式( )A. B.C. D.CH 3C CCH 2CH 3HC C CHCH 3CH 3CH 2CHCH CHCH 3H 2C C CH CH 2CH 317. 下面三种化合物与一分子HBr 加成反应活性最大的是( )A. B. C.PhCH CH 2p O 2NC 6H 4CH CH 2p CH 3C 6H 4CH CH 2第五章 环烷烃1. 环已烷的所有构象中最稳定的构象是 ( )A. 船式B. 扭船式C. 椅式2. A. 环丙烷、B. 环丁烷、C. 环己烷、D. 环戊烷的稳定性顺序 ( )A. C>D>B>AB. A>B>C>DC. D>C>B>AD. D>A>B>C3. 下列四种环己烷衍生物其分子内非键张力(Enb )从大到小顺序应该( )A. B.C.D.(CH 3)3CCH 3(CH 3)3CCH 3C(CH 3)3CH 3C(CH 3)3CH 3A. A >B >C >DB. A >C >D >BC. D >C >B >AD. D >A >B >C 4. 1,3-二甲基环己烷不可能具有 ( )A. 构象异构B. 构型异构C. 几何异构D. 旋光异构 5. 环烷烃的环上碳原子是以哪种轨道成键的?( )A. sp 2杂化轨道 B. s 轨道 C. p 轨道 D. sp 3杂化轨道6. 碳原子以sp 2杂化轨道相连成环状,不能使高锰酸钾溶液褪色,也不与溴加成的一类化合物是( )A. 环烯烃B. 环炔烃C. 芳香烃D. 脂环烃7. 环烷烃的稳定性可以从它们的角张力来推断,下列环烷烃哪个稳定性最差? ( )A. 环丙烷B. 环丁烷C. 环己烷D. 环庚烷 8. 单环烷烃的通式是下列哪一个? ( )A. C n H 2nB. C n H 2n+2C. C n H 2n-2D. C n H 2n-69. 下列物质的化学活泼性顺序是①丙烯 ②环丙烷 ③环丁烷 ④丁烷 ( )A. ①>②>③>④B. ②>①>③>④C. ①>②>④>③D. ①>②>③=④ 10. 下列物质中,与异丁烯不属同分异构体的是 ( )A. 2-丁烯B. 甲基环丙烷C. 2-甲基-1-丁烯D. 环丁烷11.CH 2CH 3CH 3HH的正确名称是 ( )A. 1-甲基-3-乙基环戊烷B. 顺-1-甲基-4-乙基环戊烷C. 反-1-甲基-3-乙基戊烷D. 顺-1-甲基-3-乙基环戊烷12. 环己烷的椅式构象中,12个C-H 键可区分为两组,每组分别用符号( )表示 ( )A. α与βB. σ与πC. a 与eD. R 与S 13. 下列反应不能进行的是( )A. B.C.D.CH 3+KMnO 4/H ++H 2Ni 高温+Br2hv+KMnO 4/H 3O14.下列化合物燃烧热最大的是 ( )A.B.C.D.15. 下列物质与环丙烷为同系物的是 ( )A. B. C. D.CH 3CHCH316. 1,2-二甲基环己烷最稳定的构象是 ( )A.B.C.D.H CH 3CH 3HCH 3CH 3CH 3CH 3317. 下列1,2,3-三氯环己烷的三个异构体中,最稳定的异构体是 ( )A. B.C.ClClCl ClClClCl Cl Cl第六章 对映异构1. 下列物质中具有手性的为( )。
有机化学(第二版)课后答案

有机化学(第二版)课后习题参考答案第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
有机化学第二版(高占先)(全14章答案完整版)_第8-13章
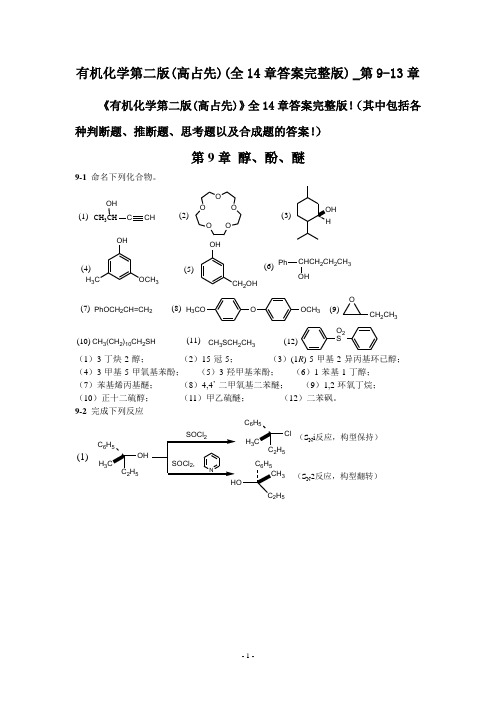
有机化学第二版(高占先)(全14章答案完整版) _第9-13章《有机化学第二版(高占先)》全14章答案完整版!(其中包括各种判断题、推断题、思考题以及合成题的答案!)第9章 醇、酚、醚9-1 命名下列化合物。
CH 3CHOHCCHO OO OO OHH 3COCH 3OHCH 2OHPhCHCH 2CH 2CH 3OHPhOCH 2CH=CH 2OOCH 3H 3COOCH 2CH 3CH 3(CH 2)10CH 2SHCH 3SCH 2CH 3O 2S(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(1)3-丁炔-2-醇; (2)15-冠-5; (3)(1R )-5-甲基-2-异丙基环已醇; (4)3-甲基-5-甲氧基苯酚; (5)3-羟甲基苯酚; (6)1-苯基-1-丁醇; (7)苯基烯丙基醚; (8)4,4’-二甲氧基二苯醚; (9)1,2-环氧丁烷; (10)正十二硫醇; (11)甲乙硫醚; (12)二苯砜。
9-2 完成下列反应(1)25H 3C 6H525H 3C 6H 52H 53(S N i 反应,构型保持)(S N 2反应,构型翻转)OH CH 3H PBr 3H CH 3Br(S N 2反应,构型翻转)(CH 3)3CCH 2OHH 2SO 4CrO 3,(CH 3)2C=CHCH 3(E1反应,碳架发生重排)HOOH CH 3NOOHCH 3(弱氧化剂不能氧化叔醇和双键)O3OH(S N 2反应,进攻位阻较小的碳原子)(2)(3)(4)(5)OHHCO 3H H 2O / H(6)OHH HOHOHH +(中间产物为环氧化物,亲核试剂进攻两碳原子的几率相等)CH 3AlCl 3(8)OH+CH 3OOHCO CH 3(Fries 重排,热力学控制产物)(7)OH OHOOO (频哪醇重排)(邻二醇氧化)222(10)O CH 2CH=CHCH 2CH 3OH(1) NaOH (9)OHOHOO (亲核取代反应)H 3CCH 3*OHH 3C3CH 2CH=CHCH 2CH 3*(发生两次Claisen 重排)OH OHC +(Reimer-Tiemann 反应)(11)C 2H 5SH(13)CH 3CH 2CHCH 2CH 3(15)CH 3Br +(12)OCH 3+CH 3CH 2CHCH 2CH 3OH+(S N 2反应)OHOBrHBr(S N 1反应)(CH 3)2CHCH 2CH 2CH 2Br+OH(CH 3)2CHCH 2CH 2CH 2SVH 2CH 3(S N 2反应)OH HClH H OH H OHOHHOHH (1) OH (2) H 2O(14)9-3 将下列各组组化合物按酸性由强至弱排列成序。
有机化学课后习题答案第九章

1、(1)4-甲基-3-氯戊酸 (2)(E)-2-羟基-3-戊烯酸 (3)4-甲基 1,3-苯二甲酸 (4)4-甲氧基苯乙酰氯 (5)苯甲酸苯甲酯 (6)α-乙基-γ-丁内酰胺 (7)2-甲基顺丁烯二酸酐 (8)2R,3S-3-甲基-2-羟基丁二酸单甲酯
第八章羧酸羧酸衍生物及其衍生物作业参考答案114甲基3氯戊酸2e2羟基3戊烯酸34甲基13苯二甲酸44甲氧基苯乙酰氯5苯甲酸苯甲酯6乙基丁内酰胺72甲基顺丁烯二酸酐82r3s3甲基2羟基丁二酸单甲酯hochcoohooo9hochcooh10ch3cch2coc2h511hooccch2coohocnhc12o21ohccoohcoohcoohhcoohcha3coohbcda
HO CH-COOH (9) HO CH-COOH
OO (10) CH3-C-CH2-C-OC2H5
O (11) HOOC-C-CH2-COOH
O
C NH
C
(12)
O
2、(1) O
H-C-COOH
a
COOH
COOH
b
HCOOH
c
CH3COOH
d
a
Ag(NH3)+2 : abc
:b
2, 4—
:a
b KMnO4
Ag: a c :c
c H+
d
:d
(2)
a FeCl3
b c
CH=CH-COOH
a
:c
COOH
b
KMnO4
: a b H+
COOH OH
c
:a :b
O
CH3-C-COOH
(3)
a
有机化学课后习题参考答案

《有机化学》习题参考答案引 言这本参考答案是普通高等教育“十二五”规划教材《有机化学》(周莹、赖桂春主编,化学工业出版社出版)中的习题配套的。
我们认为做练习是训练学生各种能力的有效途径之一,是对自己所学内容是否掌握的一种测验。
因此,要求同学们在学习、消化和归纳总结所学相关知识的基础上完成练习,即使有些可能做错也没有关系,只要尽心去做就行,因为本参考答案可为读者完成相关练习后及时核对提供方便,尽管我们的有些参考答案(如合成题、鉴别题)不是唯一的。
北京大学邢其毅教授在他主编的《基础有机化学习题解答与解题示例》一书的前言中写道:“解题有点像解谜,重在思考、推理和分析,一旦揭开了谜底,就难以得到很好的训练。
” 这句话很符合有机化学解题的特点,特摘录下来奉献给同学们。
我们以为,吃透并消化了本参考答案,将会受益匪浅,对于报考研究生的同学,也基本够用。
第一章 绪论1-1解:(1)C 1和C 2的杂化类型由sp 3杂化改变为sp 2杂化;C 3杂化类型不变。
(2)C 1和C 2的杂化类型由sp 杂化改变为sp 3杂化。
(3)C 1和C 2的杂化类型由sp 2杂化改变为sp 3杂化;C 3杂化类型不变。
1-2解:(1) Lewis 酸 H +, R +,R -C +=O ,Br +, AlCl 3, BF 3, Li +这些物质都有空轨道,可以结合孤对电子,是Lewis 酸。
(2)Lewis 碱 x -, RO -, HS -, NH 2, RNH 2, ROH , RSH这些物质都有多于的孤对电子,是Lewis 碱。
1-3解:硫原子个数 n=5734 3.4%6.0832..07⨯=1-4解:甲胺、二甲胺和三甲胺都能与水形成氢键,都能溶于水。
综合考虑烷基的疏水作用,以及能形成氢键的数目(N 原子上H 越多,形成的氢键数目越多),以及空间位阻,三者的溶解性大小为:CH 3NH 2 >(CH 3)2NH >(CH 3)3N1-5解: 32751.4%1412.0Cn ⨯==,327 4.3%141.0H n ⨯==,32712.8%314.0N n ⨯==,3279.8%132.0S n ⨯==, 32714.7%316.0O n ⨯==, 3277.0%123.0Na n ⨯==甲基橙的实验试:C 14H 14N 3SO 3Na 1-6解: CO 2:5.7mg H 2O :2.9mg第二章 有机化合物的分类和命名2-1解:(1) 碳链异构(2)位置异构(3)官能团异构(4)互变异构2-2解:(1) 2,2,5,5-四甲基己烷 (2 ) 2,4-二甲基己烷(3)1-丁烯-3-炔(4)2-甲基-3-氯丁烷(5)2-丁胺(6)1-丙胺(7)(E)-3,4-二甲基-3-己烯(8)(3E,5E)-3-甲基-4,5-二氯-3,5-辛二烯(9)2,5-二甲基-2,4-己二烯(10)甲苯(11)硝基苯(12)苯甲醛(13)1-硝基-3-溴甲苯(14)苯甲酰胺(15)2-氨基-4-溴甲苯(16)2,2,4-三甲基-1-戊醇(17)5-甲基-2-己醇(18)乙醚(19)苯甲醚(20) 甲乙醚 (21) 3-戊酮 (22 ) 3-甲基-戊醛(23)2,4-戊二酮(24)邻苯二甲酸酐(25)苯乙酸甲酯(26)N,N-二甲基苯甲酰胺(27)3-甲基吡咯(28)2-乙基噻吩(29)α-呋喃甲酸(30)4-甲基-吡喃(31)4-乙基-吡喃(32)硬脂酸(33)反-1,3-二氯环己烷(34)顺-1-甲基-2-乙基环戊烷(35)顺-1,2-二甲基环丙烷2-3解:(1)CH3CHCH3CH3CH3CHCH3CH3C(2)CH3CHCH3CH2CH2CH2CH3C2H5(3)CH3CHCH3CHCH2C2CH3C2H525 (4)C2H5HCH3H(5) H2252CH2CH3(6)(7)HCH3HCH3HH(8)3(9)52H5 (10)(11) CH3NO2NO2 (12)H3(13) (14)OHCOOHBr(15) BrCHOCH3CH3 (16)CH3CH2OH(17) OH (18)OH BrBr(19)OHSO3HNO2(20)OO O(21) O(22)O(23)HCH3HCHO(24)H33(25)NHCH3O(26)NH2NH(27)NHO(28)S(29)NCH2H5OCH2H5(30) CH3(CH2)7CH=CH(CH2)7COOH(31)NH2ONH2(32)H2N-CONH-C-NH2(33) OOO(34)OCHO2-4解:(1)C H3CH2CH3CH3CHCH3CH3C命名更正为:2,3,3-三甲基戊烷(2)C H3CH2CHCHCH3CH3CH3(3)(4)(5)(6)(7)(8)2-5解:可能的结构式2-6解:(1)(2)CH3C2H5CH2CH2CH3CH2CH2CH2CH3(3)CH3CH3CH2CH2CH3CH3C2H5C2H5C2H5CH2CH2CH3 2-7解:1,3-戊二烯 1,4-戊二烯H2CH2CH32CH3H31-戊炔 2-戊炔H2C2H5CH3CH CH31,2-戊二烯 2,3-戊二烯H2333-甲基-1,2-丁二烯第三章饱和烃3-1解:(1) 2,3,3,4-二甲基戊烷 (2) 3-甲基-4-异丙基庚烷(3) 3,3-二甲基戊烷 (4) 2,6-二甲基-3,6-二乙基辛烷 (5) 2,5-二甲基庚烷 (6) 2-甲基-3-乙基己烷(7)2-甲基-4-环丙基自己烷(8)1-甲基-3-乙基环戊烷3-2解:(1)H3332CH3(2)(3) H333(4)(5) (6)3-3解:(1) 有误,更正为:3-甲基戊烷(2) 正确(3) 有误,更正为:3-甲基十二烷(4) 有误,更正为:4-异丙基辛烷(5) 4,4-二甲基辛烷(6) 有误,更正为:2,2,4-三甲基己烷3-4解:(3) > (2) > (5) > (1) > (4)3-5解:BrHH HHBr BrHHHHBrBrHHBrHHBrHB rHH(A)对位交叉式 (B)部分重叠式 (C)邻位交叉式 (D)全重叠式A>C>B>D3-6解:(1)相同 (2)构造异构(3)相同(4)相同(5)构造异构体 (6)相同3-7解:由于烷烃氯代是经历自由基历程,而乙基自由基的稳定性大于甲基自由基,故一氯甲烷的含量要比一氯乙烷的含量要少。
有机化学课后习题答案(高教五版)第九章

第九章卤代烃1.用系统命名法命名下列各化合物(1)(2)(3)(4)(5)答案:解:⑴2,4,4-三甲基-2-溴-戊烷⑵2-甲基-5-氯-2-溴已烷⑶2-溴-1-已烯-4-炔⑷(Z)-1-溴-1-丙烯⑸顺-1-氯-3-溴环已烷2.写出符合下列名称的结构式⑴叔丁基氯⑵烯丙基溴⑶苄基氯⑷对氯苄基氯答案:解:3、写出下列有机物的构造式,有“*”的写出构型式。
(1)4-choro-2-methylpentane(2)*cis-3-bromo-1-ethylcycclonexane(3)*(R)-2-bromootane(4)5-chloro-3-propyl-1,3-heptadien-6-yne答案:(1)(2)(3)(4)4、用方程式分别表示正丁基溴、α-溴代乙苯与下列化合物反应的主要产物。
⑴NaOH(水)⑵ KOH(醇)⑶ Mg、乙醚⑷ NaI/丙酮⑸产物⑶+⑹ NaCN ⑺ NH3⑻ (9)、醇 (10)答案:5.写出下列反应的产物。
⑴⑵⑶⑷⑸⑹⑺⑻⑼⑽⑾⑿答案:解:6. 将以下各组化合物,按照不同要求排列成序:⑴水解速率⑶进行SN2反应速率:① 1-溴丁烷 2,2-二甲基-1-溴丁烷 2-甲基-1-溴丁烷 3-甲基-1-溴丁烷② 2-环戊基-2-溴丁烷 1-环戊基-1-溴丙烷溴甲基环戊烷⑷进行SN1反应速率:①3-甲基-1-溴丁烷 2-甲基-2-溴丁烷 3-甲基-2-溴丁烷②苄基溴α-苯基乙基溴β-苯基乙基溴③答案:解:⑴水解速率:b>a>c⑵与 AgNO3 -乙醇溶液反应的难易程度:d>b>c>a⑶进行S N2反应速率:① 1-溴丁烷>3-甲基-1-溴丁烷>2-甲基-1-溴丁烷>2,2-二甲基-1-溴丁烷a>d>c>b② 溴甲基环戊烷>1-环戊基-1-溴丙烷>2-环戊基-2-溴丁烷c>b>a⑷进行S N1反应速率:①2-甲基-2-溴丁烷>3-甲基-2-溴丁烷>3-甲基-1-溴丁烷b>c>a②α-苄基乙基溴>苄基溴>β-苄基乙基溴b>a>ca>c>b7.写出下列两组化合物在浓KOH醇溶液中脱卤化氢的反应式,并比较反应速率的快慢.3-溴环己烯 5-溴-1,3-环己二烯溴代环己烯答案:2>1>38、哪一种卤代烷脱卤化氢后可产生下列单一的烯烃?⑴⑵⑶⑷答案:9、卤代烷与氢氧化钠在水与乙醇混合物中进行反应,下列反应情况中哪些属于S N2历程,哪些则属于S N1历程?⑴一级卤代烷速度大于三级卤代烷;⑵碱的浓度增加,反应速度无明显变化;⑶二步反应,第一步是决定的步骤;⑷增加溶剂的含水量,反应速度明显加快;⑸产物的构型80%消旋,20%转化;⑹进攻试剂亲核性愈强,反应速度愈快;⑺有重排现象;⑻增加溶剂含醇量,反应速率加快.答案:解:⑴ S N2 ⑵ S N1 ⑶ S N1 ⑷ S N1⑸ S N2为主⑹ S N2 ⑺ S N1 ⑻ S N210、用简便化学方法鉴别下列几组化合物。
有机化学课后习题答案9第九章 卤代烃-答案
CH2Cl >
CH2CH2Cl
>
Cl
四.简答题 1. 下面所列的每对亲核取代反应中,哪一个反应更快,为什么?
(1) (CH3)3CBr + H2O △ (CH3)3C △ OH + HBr CH3 CH3 CH2 CH Br + H2O CH3CH2 CH + HBr OH
第一个更快,该反应属于 SN1 反应,其反应速率是三级卤代烃大于二级卤代烃。
第九章
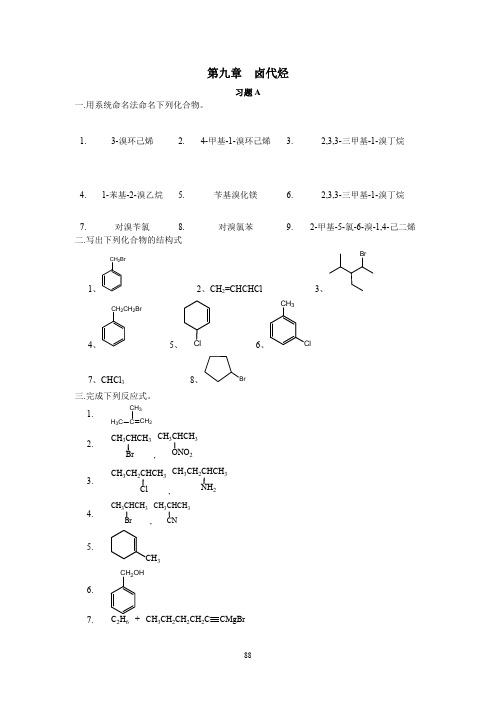
一.用系统命名法命名下列化合物。
卤代烃
习题 A
1.
3-溴环己烯
2.
4-甲基-1-溴环己烯
3.
2,3,3-三甲基-1-溴丁烷
4.
1-苯基-2-溴乙烷
5.
苄基溴化镁
6.
2,3,3-三甲基-1-溴丁烷
7. 对溴苄氯 8. 二.写出下列化合物的结构式
CH2Br
对溴氯苯
9.
2-甲基-5-氯-6-溴-1,4-己二烯
4. Ph3P + 3 MgBrCl 三.把下列两组化合物: CH2 CHCH2CH2Cl CH3CH CHCl 1. 2.
Cl CH2Cl
CH2 CHCH2Cl
CH2CH2Cl
(a) 按亲核取代反应的难易次序排列
CH2 CHCH2Cl > CH2 CHCH2CH2Cl > CH3CH CHCl
CH2Cl >
CH3 NaOH/H2O
CH3
1.
CH3
HCl, ZnCl2 CH3 CH2Cl CH3 CH2OH
2.
CH3CHCH3 KOH/C2H5OH Br
CH3CH=CH2
Cl2/hv
有机化学课后习题参考答案(全)

第一章绪论 (1)第二章饱和烃 (3)第三章不饱和烃 (7)第四章环烃 (14)第五章旋光异构 (22)第六章卤代烃 (27)第七章波谱分析 (33)第八章醇酚醚 (34)第九章醛、酮、醌 (41)第十章羧酸及其衍生物 (50)第十一章取代酸 (58)第十二种含氮化合物 (65)第十三章含硫和含磷有机化合物 (72)第十四章碳水化合物 (74)第十五章氨基酸、多肽与蛋白质 (78)第十六章类脂化合物 (82)第十七章杂环化合物 (88)第一章绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H H c.H N HHd.H S He.H O NO f.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OO H H或1.5 下列各化合物哪个有偶极矩?画出其方向。
有机化学第9章课后习题答案

1第9章习题答案9-1. (1) 3组,(2) 3组,(3) 5组或4组,C 3与C 4上的质子信号可能重叠。
9-2. (1) CH > CH 2 > CH 3,(2) CH 3F > CH 3Cl > (CH 3)2S > (CH 3)3P > (CH 3)3Si9-3. (1) 2组,(2) 4组,(3) 1组,(4) 3组,(5) 五种;(6) 三种:苯环上的4个H 是等价的,6个甲基H 原子是等价的,4个亚甲基氢是等价的;(7) 四种:Br 2CH a CH 2b CH 2c CH 2d Br9-4. 化合物分子的不饱和度为1,在1710cm -1处的红外吸收峰表明存在羰基,结合1H NMR 数据推断化合物为2–丁酮CH 3CH 2COCH 3。
9-5. 化合物分子的不饱和度为5,可能含苯环,在1720cm -1处的红外吸收峰表明存在羰基,1H NMR 数据表明存在异丁基和单取代苯环;化合物结构应为苯甲酸异丁酯。
COOCH 23CH 39-6. 化合物A 分子的不饱和度为5,红外光谱在1690 cm -1处有羰基的吸收峰,不能起碘仿反应表明没有甲基酮结构,乙基苯基甲酮。
化合物B 可以起碘仿反应存在甲基酮结构,结合1H NMR 数据推测化合物B 为甲基苄基甲酮。
C CH 2CH 3OCH 2C CH 3O9-7. 两个化合物的不饱和度为1,分子中含羰基;根据NMR 谱,可知化合物A 为3-甲基-2-丁酮;化合物B 为2-戊酮。
C H 3C H C H 3C C H 3O C H 3C H 2C H 2C O C H 39-8.a)(CH 3)3CH 23Ob)CH 32CH 23O Oc)CH 23O d)CH 23O Cle)2CH(OCH 3)2CH 3Of)(ph)23O9-9. 三种不同类型的H 原子的相对峰面积用1.4除,变为5 : 2 : 1。
有机化学习题课(1-9章)

e
a
反式异构体
e a
顺式异构体
反式异构体
e
e
顺式异构体 e e
反式异构体
不是最稳定构象
a
反式异构体
不是最稳定构象
e
COOH prefers an equatorial position more (1.41 kcal mol-1) than does Br (0.55 kcal mol-1).
反式异构体
X=卤素,磺酸基 一级,二级(三级发生消除反应)
酯的水解
三级卤代烷烃
② 醛酮的氢化物还原反应
2. 醇类的氧化反应
一级醇趋向于被过度氧化成羧酸
(3R,4S)-3,4 一级醇 醛 二级醇 酮
P265习题30. 评价下列每一种可能的醇的合成是好的,不太好的或者毫无价值的。
构体
相同
结构异构体
构象异构体
结构异构体
立体异构体(对映异构)
构象异构体
立体异构体(对映异构)
P169 32.对于下列每对结构,指出两者关系。
等同的分子
等同的分子 (手性碳,通过R/S绝对构型来判断。 两者均为R型)
结构异构体
对映异构体(手性碳,通过R/S绝对构型来判断。 前者为R型,后者为S型)
7.醚的制备 ① Williamson醚合成法(制混醚)
用烷氧基负离子和一级卤代烷烃或者磺酸酯在SN2条件下反应
② 无机酸的方法
③ 分子内Williamson反应合成环醚 ( SN2反应机理:立体专一性)
邻位交叉(×)
邻位交叉(×) 反位交叉(√) 亲核剂从离去基团反面进攻亲电的碳原子
P309习题39. 用醇和卤代烷烃制备下列醚的最好合成方法。
胡宏纹《有机化学》课后习题详解(9-15章)【圣才出品】

答:
1 / 31
2 / 31
第 10 章 醇和酚
1.推测下列反应的机理。
答:
3 / 31
2.如何完成下列转变?
答:
4 / 31
3.2,4,6-三叔丁基苯酚在醋酸溶液中与溴反应,生产化合物
22 / 31
(2)苯甲醚、苯甲酸和苯酚。 (3)丁酸、苯酚、环己酮和丁醚。 (4)苯甲醇、苯甲醛和苯甲酸。 答:(1)略。 (2)分别用 NaHCO3,NaOH 溶液使三者分开,再各自分离提纯。 (3)分别用 NaHCO3,NaOH 和饱和 NaHSO3 溶液使四者分开,再各自分离提纯。 (4)分别用 NaHCO3,饱和 NaHSO3 溶液使三者分开,再各自分离提纯。 3.推测下列反应的机理。
,产率
差不多是定量的。A 的红外光谱图中在 1630 cm-1 和 1650 cm-1 处有吸收峰,1H NMR 谱
图中有三个单峰,δH=1.19,1.26 和 6.90,其面积比为 9:18:2。试推测 A 的结构。
答:A 的结构为:
4.推测下列化合物的结构。
解:
不饱和度为 4,提示可能有苯环;IR,3350 cm-1 峰提示可能
有羟基,3070,1600,1490 cm-1 提示可能有苯环,830 cm-1 提示可能为对位二取代;1H
NMR 中δH:6.8(q,4H)与对位二取代苯相符合,其他的峰说明侧链为 CH2CH2CH3,δ
H:5.5 为羟基上的质子。
5 / 31
答:
6 / 31
(提示:分子内的 Claisen 反应称为 Dieckmann 反应,它与 Claisen 反应都是可逆反 应。)
高教第二版(徐寿昌)有机化学课后习题答案第9章

第九章卤代烃三、完成下列反应式:'、命名下列化合物。
1.CHCI 2CHCHCHCI3.1, 4 ——氯丁烷CICII2. CH=C CHCH=CH 2BHC H2—甲基一3 —氯一6 —溴一1 , 4—己二烯CHCH4. CHCHBrCHCHCHICH2—甲基一3 —乙基一4 —溴戊烷4—甲基一1—溴环己烯四氟乙烯、写出下列化合物的结构式1.烯丙基氯CH 二CHCHCI3. 4—甲基一5 —氯一2—戊炔 4, 一溴环戊烷Cf — L CCHCHCICH 35. 1—苯基—2—溴乙烷2。
苄溴7,二氟二氯甲烷 8,氯仿6,偏二氯乙烯 ^\^CHCHBrICLC 二CHCCI 2F 2HCC 3CH OH CH3 ClC2H5OH(CH s)3CBr + KCN ----------------- ►CH=C(CH)2PBr5AgNO/C2H s OHCHCHCH --------------- ► CHCHCH ------------------- ►Ch^CHCH1 I 1OH Br ONOC z H s MgBr +CHCFiCHCHG CH —►CHCH + Ch3Ch2Ch2Ch2^ CMgBrCHCOOHCICH=CHQCI +CHCOONa CICH=CHQOOCGH +NaCIC^=CH + 2CI2 ------------------------------------------ ► CbCHCHCI KOH(CH S OH)Cl H (1mol) C=Ccf ClCHCH=CH CH3CHCHIBrROORCH3CH=CH +HBr --------------------- ►CHCHCHBr500CCHCH=CH +Cl2 - ------ ►ClCF2CH=CH H20(K0H) ----- ►Cl2+H2O+ Cl2NaCNCH3CHCHCNCHCHCHOHClCHzCHCbClIOH2 KOH1.2.3.4.5.6.7.8.9.10.11.NBS一 .厂、Br KI」_PCI5CHCH CHCH ----------------CHCOCHNH CUCHCHCHCH NHI1O .HN(CH 3)2CH 3CHCHCHN(CH 3)212.NaCNCH 2C1NH3QHsONa Nal/CH s COCHfO,-OHCH 2 NfCH 2 OH四、用方程式表示CH s CH z CH z CH z Br 与下列化合物反应的主要产物1. KOH(H 2O)CHsCH 2CH 2CH>Br + _OH -------- CHjCfCHCfOH 2.KOH(C 2HOH)CfCHCHCHOH + KOH C2HsOHCH 3CH 2CH=C Hs .(A)Mg,C 2H S OCH 5,(B)(A)C 2H 5OQH 5CHCHCHCHBr+Mg -+HC CHHC ^CHCfCHCHCUMgBr -------------- 沪 CH 3CH 2CH 2CH 3 + HC CMg4.NaI/CH 3COCH 5.NH 3,6. NaCN,7. AgNC 3(C 2HsOH)8. CH 3-C CNa9. NaCHjCfCfCflCH 3CHCHCHNH CH 3CH 2CH 2CH 2CN CHjCHCfCfONO CH 3 C CCHCHCHCH 3 CHCH?CH?CHCHCHCH 2CH 3五、用化学方法区别下列化合物:1,CH3CH二CHCI, CH 2二CHCH2CI, CH 3CH2CH2CI2,苄氯,氯苯和氯代环己烷3, 1 —氯戊烷,2—溴丁烷和1—碘丙烷解:加入硝酸银氨溶液, 1 —氯戊烷反应生成白色氯化银沉淀, 2 —溴丁烷生成淡黄色沉淀, 1 -碘丙烷生成黄色碘化银沉淀。
有机化学第9章(醇、酚、醚)重、难点提示和辅导

有机化学第9章(醇、酚、醚)重、难点提示和辅导一.命名1.醇普通命名是在醇分子中烃基的名称后面加上“醇”字即可。
系统命名是选择含有羟基的最长碳链为主链,从靠近羟基的一端开始编号,根据主链碳原子数叫做“某醇”,再把取代基的位次和名称及羟基的位次放在醇的名称前面。
2.酚酚的命名是在芳环(苯、萘等)名称后面加上“酚”字,若芳环上有取代基,将取代基的位次和名称写再前面。
3.醚简单醚根据烃基命名单醚:称(二)某烃(基)醚,如甲醚、二苯醚。
混合醚:按照“次序规则”,较小基团放在前面,如甲乙醚;有芳基时,将芳基放在前面,如苯甲醚。
结构复杂的醚当作烃的烷氧基衍生物命名,即复杂的烃基为母体,简单的烃基与氧组成的烷氧基作为取代基。
如:叫3-甲氧基戊烷。
二.化学性质三.鉴别1.醇(1)用金属钠,有气泡产生,(鉴别六个碳原子以下的醇)。
注意排除水、酸、末端炔烃剂低级醛、酮中活泼氢的干扰。
(2)用卢卡斯试剂鉴别伯、仲、叔醇。
在伯、仲、叔醇的试管仲分别加入卢卡斯试剂,很快变浑浊的是伯醇,放置后变浑浊的是仲醇,加热才变浑浊的是叔醇,(此法适于鉴别六个碳原子以下的醇)。
2.酚(1)三氯化铁显色,鉴别酚类化合物。
(2)加溴水,生成白色沉淀,鉴别苯酚。
四.制备方法:(本章没有讲到,根据前面讲过的内容可以总结)1.醇(1)烯烃在酸催化下与水加成,不对称烯烃与水加成符合马氏规则。
(教材39页)(2)卤代烃的碱性水解(教材101页)(3)环氧乙烷与格氏试剂反应,可制备增加两个碳原子的伯醇(教材129页)(4)醛酮与格氏试剂加成后再酸性水解(教材142页)(5)醛酮还原(教材148页)2.醚卤代烃的醇解(教材101页)五.重要的名词、规则卢卡斯试剂:浓盐酸和无水氯化锌的混合液。
查依采夫规则(见8章辅导)六.练习题教材133页:习题二、134页:习题四、五、七、八。
有机化学 09章答案教学提纲

有机化学09章答案第九章核磁共振谱、红外光谱和质谱问题9.1 下列化合物的1H NMR谱图中各有几组吸收峰(1)1-溴丁烷(2)丁烷(3)1,4-二溴丁烷(4)2,2-二溴丁烷(5)2,2,3,3-四溴丁烷(6)1,1,4-三溴丁烷(7)溴乙烯(8)1,1-二溴乙烯(9)顺-1,2-二溴乙烯(10)反-1,2-二溴乙烯(11)烯丙基溴(12)2-甲基-2-丁烯提示:化合物中有几种化学不等价的质子,在1H NMR谱图中就有几组吸收峰。
首先写出这些化合物的结构式,然后再看各个质子是否等价。
答案:(1)CH3CH2CH2CH2Br 4组(2)CH3CH2CH2CH3 2组(3)BrCH2CH2CH2CH2Br 2组(4)CH3CBr2CH2CH3 3组(5)CH3CBr2C(Br)2CH3 1组(6)CHBr2CH2CH2CH2Br 4组(7)组(8)组(9)组(10)组(11)组(12) 4组问题9.2 下列化合物的1H NMR谱图中都只有一个单峰,试推测它们的结构。
(1) C8H18, δH = 0.9 (2) C5H10, δH = 1.5(3) C8H8, δH = 5.8 (4) C4H9Br, δH = 1.8(5) C2H4Cl2, δH = 3.7 (6) C2H3Cl3(7) C5H8Cl4, δH = 3.7提示: 1H NMR谱图中只有一个单峰,说明所有的氢质子都是等价的,即任何一个氢质子周围没有与之不等价的氢质子。
答案:问题9.3:推测C4H9Cl的几种异构体的结构(1)1H NMR谱图中有几组峰,其中在δH = 3.4处有双重峰。
(2)有几组峰,其中在δH = 3.5处有三重峰。
(3)有几组峰,其中在δH = 1.0处有三重峰,在δH = 1.5处有双重峰,各相当于三个质子。
提示:先写出C4H9Cl的几种异构体的结构,再根据1H NMR谱图的特征判断各是哪一种异构体。
答案:分子式为 C4H9Cl的化合物有四种异构体,结构式分别为:(1)根据n+1律,从上述结构式可以看出,结构B中的a-H为双重峰,结构C 中的a,c和d-H也都为双重峰,然后根据双重峰的化学位移为3.4 ppm,可判断应为与卤素直接相连的碳上的氢质子信号,即:结构C中a-H的质子信号。
有机化学(第三版马祥志主编)课后习题问题详解

第一章 绪论习题参考答案1. 某化合物的分子量为60,含碳40.1%、含氮6.7%、含氧53.2%,确定该化合物的分子式。
解:① 由各元素的百分含量,根据下列计算求得实验式1:2:133.3:7.6:34.3162.53:17.6:121.40== 该化合物实验式为:CH 2O② 由分子量计算出该化合物的分子式216121260=+⨯+该化合物的分子式应为实验式的2倍,即:C 2H 4O 22. 在C —H 、C —O 、O —H 、C —Br 、C —N 等共价键中,极性最强的是哪一个? 解:由表1-4可以查得上述共价键极性最强的是O —H 键。
3. 将共价键⑴ C —H ⑵ N —H ⑶ F —H ⑷ O —H 按极性由大到小的顺序进行排列。
解:根据电负性顺序F > O > N > C ,可推知共价键的极性顺序为: F —H > O —H > N —H > C —H4. 化合物CH 3Cl 、CH 4、CHBr 3、HCl 、CH 3OCH 3中,哪个是非极性分子?解:CH 4分子为高度对称的正四面体空间结构,4个C —H 的向量之和为零,因此是非极性分子。
5. 指出下列化合物所含官能团的名称和该化合物所属类型。
CH 3OH(2)碳碳三键,炔烃 羟基 ,酚(4)COOH酮基 ,酮 羧基 ,羧酸(6) CH 3CH 2CHCH 3OH (1) CH 3CH 2C CH(3) CH 3COCH 3(5) CH 3CH 2CHO醛基,醛羟基,醇(7) CH3CH2NH2氨基,胺6. 甲醚(CH3OCH3)分子中,两个O—C键的夹角为111.7°。
甲醚是否为极性分子?若是,用表示偶极矩的方向。
37. 什么叫诱导效应?什么叫共轭效应?各举一例说明之。
(研读教材第11~12页有关容)8. 有机化学中的离子型反应与无机化学中的离子反应有何区别?解:无机化学中的离子反应是指有离子参加的反应,反应物中必须有离子。
F.A.Carey-最全最完备的高等有机化学习题 详细解答与分析 完美版

Chapter 1 Effect of Substituted in Organic molecule1. 试判断下列各对基团,那一个具有强的-I 效应(即强的吸电子诱导效应):(1) -COOH , -COO -(2) C HN OCH 3 , C H N N(CH 3)2CH 3+(3) C OCH 3 , C CH 2CH 3, (4) SO 2H ,SO 3H(5) OCH 3 , SCH 3 (6) C H C H CH 3 ,C C CH 3(7) N (CH 3)2 , P(CH 3)2 (8) Si(CH 3)3 ,Si(CH 3)2CH 3(9)N(CH 3)3+,NH 2 (10) CN ,CH 2NH 2 (11) SiCH 3 , Cl (12) C C CH 3 ,C H C H CH 3(13),(14)NO 2,NO 2(15) O 2SCH 3, O 2SBr2. 指出下列各对酸中哪一个酸性强(1) H 3NCH 2CH 2COOH , HOCH 2CH 2COOH (2) HC C COOH ,H 2C C H COOH(3) C 6H 5COCH 2COOH , C 6H 5CHOHCH 2COOH(4) C 4H 9CHCOOn,C C CH 3CH 3CH 3CH 3COOHOOC(5) COOH OH, COOH OH(6) BrCH 2CH 2COOH , CH 3CHBrCOOH(7)(H 3C)2CH 2CHCOOH,H 2CC HCH 2COOH(8) HC C COOH , SCOOH(9) CH 2(COOH)2 ,HOOCH CCOOCl(10) CH 3OCH 2CH 2COOH , CH 3SCH 2CH 2COOH (11) CH 3SCH 2COOH ,CH 3SO 2COOH(12)OHCCOOH,COOHCHO(13)OHC(CH 3)3(H 3C)3C,OH3)3CH 3(H 3C)3C(14) H 3COCOOH ,OCH 3COOH(15) C 6H 5CH 2SeH ,H 3CSeH3. 预料以下各对化合物,何者具有更强的酸性? (1) CH 3NO 2 ,(CH 3)2CHNO 2(2) CH 2(SO 2C 6H 5)2 ,CH 2(SOC 6H 5)2(3) H 3CCH(C 6H 5)2,(C 6H 5)2CHCH 2C 6H 5 (4) CH 3COCH 2COOCH 3 ,CH 3COCH 2CONH 2 (5) CH 3COCH 2COCH 2F ,CH 3COCHFCOCH 3(6)NOCH 3,NO H 3C(7)SO 2O 2S ,OO(8) NO 2CH 3CH 3H 3C ,NO 2CH 3H 3CCH 3(9)CH3,CH3(10) CH(C 6H 5)2,CH(C 6H 5)2(11) (CH)3Se , (CH 3)2O(12) ,4. 解释以下现象:(1). 杯烯 (Calcene) 的偶极距很大,μ= 5.6 D.(2). 吡咯 μ = 1.80 D ,吡啶 μ = 2.25 D ,且极性相反,如图:NN H5. 比较下列化合物的碱性的强弱:NN(CH 3)2N(C 2H 5)2NH 2N6. 9,10-二氢蒽-1-羧酸(A )和9,10-乙撑蒽-1-羧酸(B )的酸性取决于8-位上取代基X的性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
式二取代,并且两边侧链的手性碳原子应具有相反的手性,由此推出其结构如图:
C6H5 HO C H
NH H C
HO
C6H5
2.7 Br 与溴丁烷发生 SN2 反应,所以构型翻转,产物的旋光反向与原来的方向相反,每 有一个分子的构型发生构型发生翻转,便可以和另一个分支的旋光性相互抵消(外消
旋体),所以旋光度减小的速率为*Br 结合的速率的两倍。 2.8 (Ⅰ)既有游离羟基的伸缩振动,又有分子内氢键缔合的伸缩振动。
CH3 NH2 H
CH2CH3
(R)- 2-丁胺
1)R 1R2*BH
2)H 2O2/OHCH3
OH
* * CH3
存在一对对映体
OH
OH
CH3 构型:R,R
CH3 构型:S,S
因硼氢化试剂具有手性,对烯烃平面加成的机会不均等,使对映体量不等,一种产物
占优势,所以混合醇油光学活性。
2.6 从(Ⅰ)的构造式可以看出它含有手性碳原子,但根据提议(Ⅰ)不具有旋光性,且不 能拆分,表明(Ⅰ)应具有内消旋体结构,分子内应有对称面,这要求(Ⅰ)在环上应为顺
t-Bu
t-Bu
H
O
OH
H
H
H
O
H
OH
t-Bu H
t-Bu
光学活性形式
内消旋形式
Ⅰ
Ⅱ
(Ⅱ)体积大的叔丁基彼此不能处于邻位交叉形式,而只能处于对对位交叉形式,量
羟基不能形成分子内氢键,并表现为化学等价,因吃只能观察到一种羟基的伸缩振动。
2.4
CH3
H3C
OH H
CH2CH3 (TsCl)
(R)- 2-丁醇
SO2Cl
CH3 OTs H
NaN3
CH3 H2/Pt
H
N3
CH3
H
NH2
CH2CH3
CH2CH3
CH2CH3
(S)- 2-丁胺
PCl5
CH3 NaN3 HH
CH2CH3
CH3 N3 H
H2/Pt
CH2CH3
2.5 取代环烯烃硼氢化氧化反应的特点是:顺式加成,反式产物。
CH3CH2CH2CHDBr+*Br→CH3CH2CH2CHD*Br+Br 2.8 2,2,5,5—四甲基—3,3—己二醇能以外消旋体和内消旋体两种形式存在,其中一
种的 IR 谱含有两个羟基的伸缩振动吸收,另一种却含有一种羟基的伸缩振动吸收, 请解释这一现象。
答案: 2.1 (1)①S ①Ⅰ;S Ⅱ;R ③R; ④S
(2)①(SE,6E,10Z)—3—甲基—10,11—环氧—3,7,11—三甲基十三碳二烯酸甲酯 ②(2S,3S)—2—甲基—2—烯丙基—3—羟基环戊酮
H O
H
F
H
H
H
邻位交叉式(形成氢键)
2.2 (1)
O
H
Ph
Ph
OH
R2N
NH2和 OH间 形 成 氢 键
(2)
2.3 (1)A 为赤式,B 为苏式 (2)A 可拆分为旋光的队映体,因它为手性轴化合物。 (3)(2S,3R)—2,3—丁二醇
立体化学原理
2.1 (1)用 R 或 S 标定每个寿星碳原子的构型。 HO
H
H
Ⅰ
H
CH3
Br
H
NH2
Ⅱ
O
① Ph
②
Br
③
O
H2CH2CH3C
P:
④
H3C
(2)命名
H2CH3C
H3C
①
O
O
CH3
CH3
CH3
CO2CH3
CH2
②
OH
2.2 写出下列化合物最稳定的构象式。 (1)HOCH2CH2F (2)苏式—2—(N,N—二甲氨基)—1,2—二苯乙醇 2.3 问答 (1)下列化合物何者为苏式,何者为赤式?
OH
OH
CH
H5C6
CH2
N
CH2
C6H5
H
2.7 卤素、碳及氢的放射性同位素 14C、3H 以及氢的非放射性同位素 D,经常用于反应历程 的研究。
当一个含有 D 的溴丁烷与放射性*Br 在一起加热时,则*Br 逐渐与样品结合。与此同时, 溴丁烷的旋光度逐渐减小,并且选关度减小的速度等于*Br 与样品结合的速度的二倍。试对 上述事实进行理论说明。
Cl H2COH
H
H H2COH
Cl
A:
H OHCH2O
B:
H OHCH2O
H3C (2)化合物A:
CHCH3
H3C B:
C C CHCH3
是否可拆分为旋光对映体?
CH3 HO H
H
(3)
OH
CH3 的名称(含 R/S 构型)
2.4 由(R)—2—2 丁醇分别转变为(R)—2—丁胺和(S)—2—丁胺? 2.5 1—甲基环戊烯用手性的有光学活性的硼氢化试剂(R1R2*BH)处理,然后进行氧化, 得到一种有旋光活性的混合醇。请写出这些醇的结构,在手性中心上标出构型(R/S),简要 说明为什么得到的混合醇油光学活性? 2.6 山梗烷啶(Ⅰ)是从印度烟叶中分离得到的一种化合物,已被用作商品戒烟剂,它没有 旋光性,也不可能拆分,试分析其应具有何种立体结构?
