进口药材申请流程
进口申报流程

进口申报流程进口申报流程是指将国外商品进口中国,并向海关进行申报、清关等一系列手续的过程。
以下是进口申报流程的步骤:1. 准备文件:首先,进口方需要准备一些必要的文件,包括进口合同、发票、提单、装箱单等。
这些文件是提交给海关的重要依据,用于确认和核准进口货物的信息。
2. 申报报关:将准备好的文件提交给进出口企业所在地海关,办理报关手续。
报关时需要填写进口统计单、进口报关单等表格,并提供相关文件。
一般情况下,海关会对货物进行查验,确认是否与文件所描述的一致。
3. 缴纳税费:根据货物的性质、价值等因素,进口方需要向海关缴纳相应的税费。
这些税费包括关税、增值税、消费税等。
进口方需要根据相关规定计算出应缴纳的税费金额,并向海关交纳。
4. 检验检疫:海关在查验货物时,会根据商品的性质进行相应的检验检疫,以确保进口的商品符合国家的质量、安全标准。
如果货物存在问题,海关有权退回或销毁商品,或者要求进口方进行改正。
5. 清关放行:经过海关的查验检疫后,如果货物符合相关规定,海关会发放进口通关单,放行货物。
进口方可以根据通关单提货或者进行进一步的流程处理。
6. 报关结算:根据进口合同的约定,进口方需要将货款支付给供应商。
同时,还需要向海关提交进口付款单、合同结汇核销单、跨境电子商务交易等相关文件,进行报关结算。
7. 后续流程:进口方还需要根据实际情况办理一些后续手续,比如将货物运输到目的地、申请退税等。
总结起来,进口申报流程包括准备文件、报关、缴纳税费、检验检疫、清关放行、报关结算和后续流程等环节。
这个流程需要进口方和海关密切合作,确保进口货物在合法、合规、安全的情况下顺利入境。
在整个过程中,合规合法、准确提供资料是至关重要的,以避免不必要的麻烦和风险。
美国入境药品申报流程

美国入境药品申报流程
美国是世界著名的药品销售国家,任何人想在美国境内销售药品、使用药品,都必须先经过美国药品和食品监督管理局(FDA)的审批或
申报。
下面为您介绍美国入境药品申报流程。
首先,准备药品导入资料和申报表格,包括但不限于业主报关单、凭证件、实验证明等。
其次是进行药品审核,这需要提交相关实验集
成报告(CMC),它们必须满足美国药品法规要求,并且内容全面准确
无误。
药品审核结松药品样品提交FDA实验环境,由FDA指定实验室
对其样品进行精密分析,分析报告维析药品是准确有效的。
接下来,业主应提交申报文件和费用,并将申报文件发给FDA,此时,FDA将会发送审查结果给申报人,审核后,药品可从邮政或船运发货到美国,由美国境内指定的清关单位报关、支付关税。
在药品进入境内后,美国药品和食品监督管理局将继续监督药品
的生产、流通和使用情况,以确保其合法性和安全性。
美国入境药品申报流程应当遵循以上步骤执行,严格遵守法规和程序,才能成功通过FDA的审查,为国内用户提供安全有效药品,保障消费者的用药安全。
药品进口流程

药品进口流程相关术语:第三十八条本办法所称进口单位,包括经营单位、收货单位和报验单位。
经营单位,是指对外签订并执行进出口贸易合同的中国境内企业或单位。
收货单位,是指购货合同和货运发票中载明的收货人或者货主。
报验单位,是指该批进口药品的实际货主或者境内经销商,并具体负责办理进口备案和口岸检验手续。
收货单位和报验单位可以为同一单位。
资质:报验单位应当是持有《药品经营许可证》的独立法人。
药品生产企业进口本企业所需原料药和制剂中间体(包括境内分包装用制剂),应当持有《药品生产许可证》。
注意:药品必须经由国务院批准的允许药品进口的口岸进口所需资料:进口药品必须取得国家食品药品监督管理局核发的《进口药品注册证》(或者《医药产品注册证》),或者《进口药品批件》后,方可办理进口备案和口岸检验手续。
进口麻醉药品、精神药品,还必须取得国家食品药品监督管理局核发的麻醉药品、精神药品《进口准许证》。
流程:药品的进口备案、报关、口岸检验以及进口,适用本办法。
详情如下:1、本办法所称进口备案,是指进口单位向允许药品进口的口岸所在地药品监督管理部门(以下称口岸药品监督管理局)申请办理《进口药品通关单》的过程。
麻醉药品、精神药品进口备案,是指进口单位向口岸药品监督管理局申请办理《进口药品口岸检验通知书》的过程。
2、本办法第十条规定情形以外的药品,口岸药品监督管理局审查全部资料无误后,准予进口备案,发出《进口药品通关单》。
同时向负责检验的口岸药品检验所发出《进口药品口岸检验通知书》,附本办法第十三条规定的资料一份。
对麻醉药品、精神药品,口岸药品监督管理局审查全部资料无误后,应当只向负责检验的口岸药品检验所发出《进口药品口岸检验通知书》,附本办法第十三条规定的资料一份,无需办理《进口药品通关单》。
【进口化学原料药及制剂(不含首次在中国销售的化学药品)在进口时不再逐批强制检验。
口岸所在地药品监督管理部门在办理进口化学药品备案时不再出具《进口药品口岸检验通知书》,口岸药品检验所不再对进口化学药品进行口岸检验。
欧盟中药及中药保健品进口程序及要求

欧盟中药及中药保健品进口程序及要求第一篇:欧盟中药及中药保健品进口程序及要求欧盟中药及中药保健品进口程序及要求2002-09-05 09:32一、关于法律法规以及规定。
在欧盟,所有(人用)药品的注册、生产以及进口、标签、包装、广告以及销售等必须满足2001/83/EC号《人用医药产品指令》所规定的各项要求,如必须提供物理化学试验、生物和微生物试验、药理学和毒性学试验以及临床试验报告等文件,文件资料的质量必须符合指令附件一所提到的详细要求;药品的生产和管理必须达到欧盟GMP(药品良好生产管理规范)标准。
指令附件一第三部分特别提到,毒性学试验必须按照GLP(Good Laboratory Practice)标准来进行;毒性学试验一般应完成单剂量毒性试验(single dose toxity)、重复剂量毒性试验(repeated dose toxity)、有机体突变试验(mutagenic potential)、致癌试验(carcinogenic potential)等内容;在某些情况下,还需作对生殖功能影响试验(examination of reproductive function)、对胚胎或胎儿以及围产期毒性试验(embryo/foetal and perinatal toxity)等。
该指令对中药产品出口欧盟市场的限制主要体现在:中药以及中药保健品如要作为药品在欧盟市场内销售使用,必须满足指令对药品的上述技术要求,并要求按照西药的注册登记程序注册。
由于欧盟对药品质量的严格要求,药品注册登记程序十分复杂,各项试验周期长,费用昂贵,我国内企业大多无力承担;而且中药与西药不同之处还在于,大多数中药是在实践应用中发展起来的传统草药制品,其性能难以通过科学试验以药理和毒理报告的形式加以说明,因此即使有力量进行注册,指令要求的科学报告也使企业无从下手。
该指令实际上对中药进入欧盟市场构成了一种几乎无法逾越的技术壁垒。
进口中药资质要求及申报手续

中药材是指药用植物、动物的药用部分,采收后经初加工形成的原料药材。
食药物质①是指传统作为食品,且列入《药典》的物质。
中药材(食药物质)进出境时,企业应当向主管海关申报预期用途,明确“药用”或者“食用”。
为便于表述,本节下文中“中药材(食药物质)”统称为“中药材”。
一、进口中药材申报为“药用”的进口中药材应为列入《药典》药材目录的物品。
进口药用的中药材由药品监督管理部门实施检验和检验监督管理。
海关依照《进出境中药材检疫监督管理办法》对进境药用的中药材实施检疫和检疫监督管理。
申报为“食用”的中药材应为法律、行政法规、规章、文件规定可用于食品的物品(即应当是已纳入《按照传统既是食品又是中药材的物质目录》②管理的物质)。
现行《按照传统既是食品又是中药材的物质目录》详见本节参考资料。
进口食药物质由海关依照进出口食品相关规定实施检验检疫和监督管理。
(一)资质要求1.准入要求:海关对进境中药材实施检疫准入制度。
2.境外生产企业注册登记海关总署对进出境中药材实施风险管理;对向境内输出中药材的境外生产、加工、存放单位(以下简称“境外生产企业”)实施注册登记管理。
海关总署根据风险分析的结果,确定需要实施境外生产、加工、存放单位注册登记的中药材品种目录。
海关总署对列入目录的中药材境外生产企业实施注册登记。
部分已注册的境外中药材生产企业可在海关总署网站查询:“新西兰输华鹿茸鹿角注册企业名单”可在海关总署动植物检疫司“企业信息”-“动物产品类”-“其他动物产品”栏目中查询;“希腊输华西红花注册企业名单”“老挝输华植物源性中药材注册企业名单”可在海关总署动植物检疫司“企业信息”-“植物产品类”-“其他植物产品”栏目中查询。
3.进境动植物检疫审批海关总署对进境中药材(动物源性中药材、植物源性中药材)实施检疫审批。
进境中药材需办理进境动植物检疫审批的,货主或者其代理人应当在签订贸易合同前,取得进境动植物检疫许可。
办理指南见本书第十三章第二节、第三节。
进口药材申请流程
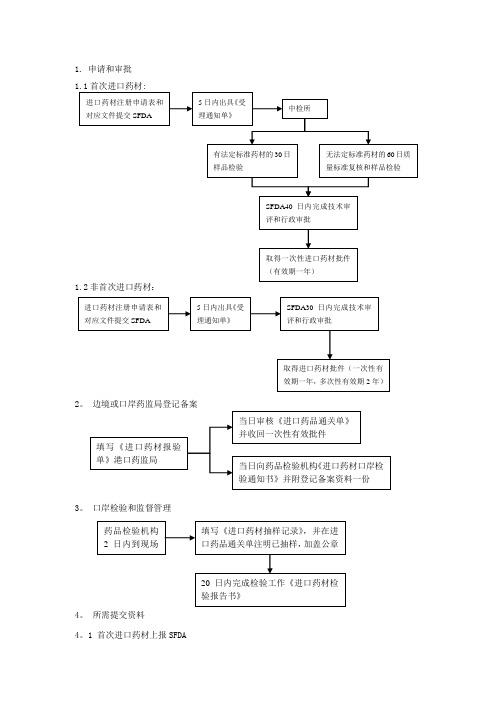
1. 申请和审批1.1首次进口药材:1.2非首次进口药材:23。
口岸检验和监督管理4。
所需提交资料4。
1 首次进口药材上报SFDA4。
1。
1物料部申请人需报送下列资料一式两份,分别提交国家食品药品监督管理局和中国药品生物制品检定所。
(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源.(六)药材基源研究证明资料(研究证明资料应由中国境内具有动、植物基源鉴定资质的机构提供)。
4。
1。
2如进口药材的质量标准来源于省、自治区、直辖市药材标准,物料部申请人除报送上述资料外,还应根据具体情况,对该标准作相应的提高工作,并报送有关研究资料;如进口药材无法定标准,物料部申请人除报送上述资料外,还应报送下述资料:(一)药材生态环境、生长特征、形态描述、栽培或者培植(培育)技术、产地加工等。
(二)药材质量标准起草说明。
(三)药理毒理研究资料综述。
(四)主要药效学试验资料及文献资料。
(五)一般药理研究的试验资料及文献资料。
(六)急性毒性试验资料及文献资料。
(七)我国批准的中成药处方中含有该药材的证明资料。
4.2 非首次进口药材上报SFDA物料部申请人需报送下述资料一式一份:(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或者《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
4.3 登记备案上报口岸药监局物料部申请人需报送下列资料一式两份:(一)《进口药材批件》复印件(和《进口药材补充申请批件》复印件)。
(二)本公司《药品经营许可证》或者《药品生产许可证》复印件。
(三)原产地证明复印件。
(四)购货合同复印件.(五)装箱单、提运单和货运发票复印件.(六)经其他国家或者地区转口的进口药材,应当同时提交从原产地到各转口地的全部购货合同、装箱单、提运单和货运发票。
进口药材批件核发受理审查指南(试行)

附件8进口药材批件核发受理审查指南〔试行〕国家食品药品监督管理总局2021年月目录一、适用范围 (1)二、资料受理部门 (1)三、申报资料根本要求 (1)〔一〕申请表的整理 (1)〔二〕申报资料的整理 (1)四、申请表审查要点 (2)五、申报资料审查要点 (4)〔一〕申报资料要求 (4)〔二〕资料审查内容 (4)六、受理审查决定 (5)〔一〕受理 (5)〔二〕补正 (6)〔三〕不予受理 (6)七、其他 (6)八、受理流程图 (6)附件:1.申报资料工程目录 (8)2.进口药材批件核发申报资料自查表 (9)进口药材批件核发受理审查指南〔试行〕一、适用范围首次进口药材批件核发;非首次进口药材批件核发。
二、资料受理部门由国家食品药品监督管理总局药品审评中心受理。
三、申报资料根本要求〔一〕申请表的整理1.种类与份数要求进口药材申请表原件一份。
2.依据?进口药材管理方法?要求,填写?进口药材申请表?后打印并保存电子文件〔确认所用版本为最新版[以最新发布的公告为准],所生成的电子文件的格式应为WORD文件〕。
申请表各页边缘应加盖申请人骑缝章。
3.填写应当准确、完整、标准,不得手写或涂改,并应符合填表说明的要求。
〔二〕申报资料的整理1.申报资料数量:1套完整申请资料,原件。
2.申报资料应逐项加盖申请人印章,封面印章应加盖在文字处。
加盖的印章应符合国家有关用章规定,并具法律效力。
3.整理装订要求申报资料目录:申报资料首页为申报资料工程目录〔见附件1〕,目录中申报资料工程按?进口药材管理方法?附件1顺序排列。
申报资料内容复印件应当与原件完全一致,应当由原件复制并保持完整、清晰。
申报资料中同一内容〔如药品名称、申请人名称、申请人地址等〕的填写应前后一致。
外文资料应翻译成中文,有译文的外文资料,译文在前,原文在后。
申请人应对翻译的准确性负责。
四、申请表审查要点确认表格各页边缘是否骑缝加盖负责办理所有申请人的公章。
各项内容填写应准确、完整、标准,不得手写或涂改,符合申请表“填报说明〞要求。
原料药进口注册流程相关问题

原料药进口注册流程相关问题进口化学药品注册证书核发,其分类按《药品注册管理办法》附件二注册分类,即:注册分类1、未在国内外上市销售的药品:注册分类3、已在国外上市销售但尚未在国内上市销售的药品:2进口原料药一般注册程序原料药进口注册,按照是否已有同类物质在中国上市销售,分为两种不同注册程序。
1.若拟进口原料药已有同类物质上市销售,则可按仿制要程序审批,较为快捷;2.若拟进口原料药位首次在中国上市销售,则必须按照新药程序审批,并使用该原料药制成的制剂进行临床试验(即必须与制剂捆绑注册),周期长,投资大。
API:进口原料药IDL:进口药品注册证CTP:药物临床试验批件一般程序第一步第二步准备注册SFDA获得IDL是申报资料受理和审评至少3个月9个月是否有同类API产品在中国上市否第一步第二步第三步第四步获得准备注册SFDA进行SFDA获得IDLCTP新药程序申报资料受理和审评临床试验受理和审评至少3个月9个月约1年9个月原料药进口注册流程药品注册法(局令28号)/WS01/CL0053/24529.html申报制剂用的进口原料必须经过国家批准的一次性进口获得一次性进口批件,开展制剂研究(从所在省局开始,省局同意后,再拿着省局同意的证明去国家局申报一次性批件速度很快的,国家费用在2000同时申报进口原料的IDL在获得临床批件或者生产批件前,取得进口原料的IDL生产临床用样品的进口原料.1.一次性进口原料药的程序及需准备哪些申报资料?有申报资料模板最好。
答:到国家局网站上下载一个一次性原料药进口的申请;其具体程序如下:首先打一个报告给省局,说明要进口的原料药原因、数量等等(数量要有明细说明);报告后面附公司资质、拟进口原料药的相关资质。
省局进行批复;省局批复后再报国家(连同省局批复和临时进口申请表),国家局审批后下发一次性进口药品注册批件,时间约2-3个月,审批费2000元。
2、国内可以采用原料和制剂同时申报,进口原料是不是一定要拿到注册证后才能用于研究?答:进口原料药用于研究(比如小试、质量研究中的方法学等)无须获得进口药品注册证,仅有一次性进口药品批件即可。
药品进口流程(PPT全屏播放)
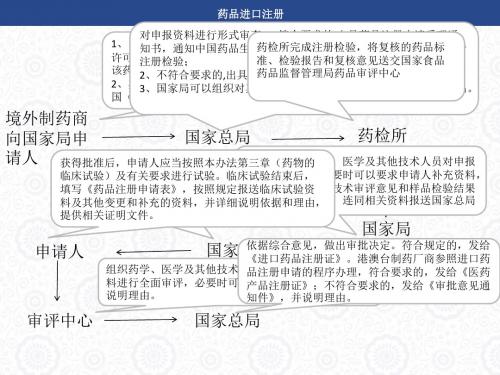
申请人
国家局 依据综合意见,做出审批决定。符合规定的,发给 审评中 国家总局 《进口药品注册证》。港澳台制药厂商参照进口药 组织药学、医学及其他技术人员对报送的临床试验等资 心 品注册申请的程序办理,符合要求的,发给《医药
料进行全面审评,必要时可以要求申请人补充资料,并 产品注册证》;不符合要求的,发给《审批意见通 说明理由。 知件》,并说明理由。
口岸药品监 报验单位 口岸药检所 口岸药品监督管理局发出《进口药品通关单》;不符合标准规定的,不予进口 督管理部门
备案,由口岸药品监督管理局发出《药品不予进口备案通知书》。对不予进口 备案的进口药品,进口单位应当予以退运。无法退运的,由海关移交口岸药品 监督管理局监督处理。
口岸药品监 督管理部门
境外制药商 药检所 国家总局 向国家局申 依据综合意见,做出审批决定。符合规 请人 获得批准后,申请人应当按照本办法第三章(药物的 审评中心组织药学、医学及其他技术人员对申报
定的,发给《药物临床试验批件》;不 资料进行审评,必要时可以要求申请人补充资料, 临床试验)及有关要求进行试验。临床试验结束后, 符合规定的,发给《审批意见通知件》, 并说明理由。依据技术审评意见和样品检验结果 填写《药品注册申请表》,按照规定报送临床试验资 并说明理由。 等,形成综合意见,连同相关资料报送国家总局 料及其他变更和补充的资料,并详细说明依据和理由, 提供相关证明文件。
进口药品分包 装的申请人
省、自治区、 直辖市食药 监局
国家总局
药品进口注册
按照《进口药品口岸检验通知书》规定的抽样地点,抽 持有《药品经营许可证》的独立法人。药品生产企业进 1、审查全部资料无误后,应当向负责检验的口岸药品 取检验样品,进行质量检验,并将检验结果送交所在地 口本企业所需原料药和制剂中间体(包括境内分包装用 口岸药品监督管理局。 检验所发出《进口药品口岸检验通知书》 制剂),应当持有《药品生产许可证》 2、向海关发出《进口药品抽样通知书》
中药材进口清关详细流程

中药材进口清关详细流程
中药材的进口清关流程包括以下几个步骤:
1. 准备进口资料,首先,进口商需要准备相关的进口资料,包括进口合同、发票、装箱单、产地证明、质量检验证明等。
2. 申报进口,进口商将准备好的进口资料提交给海关,并按照海关规定的方式进行申报。
申报时需要填写进口商品的详细信息,包括商品名称、规格、数量、价值等。
3. 缴纳关税和税费,根据进口商品的类别和价值,海关会对进口商品进行税费的计算。
进口商需要按照海关规定的税率和计算公式缴纳关税和税费。
4. 检验检疫,进口的中药材需要经过检验检疫部门的检验。
检验检疫部门会对中药材的质量、安全性、卫生标准等进行检测,确保其符合国家相关的标准和要求。
5. 抽样检验,在检验检疫过程中,抽样检验是常见的环节。
检验人员会从进口的中药材中随机抽取样品进行检测,以确保样品的
质量符合标准。
6. 检验合格放行,如果中药材经过检验检疫后符合国家相关的
标准和要求,海关将会发放放行通知,允许进口商将货物取走。
7. 缴纳增值税,除了关税和税费,进口商还需要按照国家规定
缴纳增值税。
增值税的税率和计算方式根据具体商品的类别和价值
而定。
8. 提货和配送,进口商可以凭借放行通知和相关证明文件,前
往指定的地点提货。
进口商可以选择自行配送或委托物流公司进行
配送。
需要注意的是,中药材的进口清关流程可能会因国家和地区的
不同而有所差异。
进口商在进行中药材进口时,应当了解并遵守当
地海关和检验检疫部门的规定和要求,确保顺利完成进口清关手续。
中药材进口所需要什么资料

中药材进口所需要什么资料
一、中药材进口清关需要的资料:
1、原产地证(与我国签订贸易协定国家可以享受协税)
2、卫生证(加工过和不同口岸海关要求不同)
3、植检证
4、薰蒸证(如植检证有熏蒸标识不用单独在提供)
5、成分检测报告
6、贸易合同
7、贸易fp
8、装箱单
9、标签及翻译件
10、申报要素
11、提单/空运单
二、中药材进口清关思路流程:
1、进口前确认所在国家是否准入
2、国外提供检测报告确认是否符合中国标准
3、国内公司药品资质确认是否能提供(没有可以找有资质公司代理)
4、确认合作预付订金
5、备货订舱报关出国外资料
6、到港前办通关单
7、换单申报缴税
8、抽样检测
9、放行送货
10、出卫生证销售
三、常见的进口中药材
1:西红花(藏红花),海关编码(HS):0910200000,
2:豆蔻,海关编码(HS):0908110000
3:八角茴香,海关编码(HS):0909611000
4:毕拨,海关编码(HS):0910990000
5:已磨丁香,海关编码(HS):0907200000
6:已磨肉桂及肉桂花,海关编码(HS):0906200000 7:肉豆蔻,海关编码(HS):0908110000
8:小茴香子,海关编码(HS):0909629010
9:姜黄,海关编码(HS):0910300000。
进口药品流程及注册程序

进口药品流程及注册程序引言:随着全球经济的发展与交流的增加,进口药品在各国市场的需求逐渐增加。
然而,由于药品的特殊性质和对人类健康的直接影响,各国在进口药品时往往需要遵循一定的流程和注册程序。
本文将介绍进口药品的一般流程和注册程序。
一、进口药品流程:1.准备文件和资料:进口药品时,首先需要收集并准备提交给监管机构的文件和资料。
这些文件和资料通常包括:-生产厂家提供的药品质量报告和产品说明书;-药品的原产国或生产厂家的许可证明文件;-药品的原产地检验报告和质量合格证明;-药品批号、规格、生产日期等详细信息。
2.申请进口许可:准备好文件和资料后,需要向目标国家的监管机构或药品管理部门申请进口许可。
申请时需要提交相关文件和资料,并缴纳一定的申请费用。
监管机构将对申请材料进行审核,并根据所申请药品的特性和风险进行评估。
3.进口许可审批:监管机构审批进口许可的时间会因国家和药品特性而异。
一般而言,监管机构会对进口药品进行审查、评估和检验。
审查的内容包括:药物的有效性、剂量、不良反应等。
评估的内容包括:产品的安全性、适应症和临床试验结果等。
监管机构还会进行抽样检验,以确保药品质量符合标准。
4.清关和仓储:一旦进口许可获得批准,药品可以运往目标国家并通过海关的清关程序。
清关需要提供必要的货物信息和相关证明文件,并缴纳进口关税和税费等。
之后,进口药品会经过仓储和分销等环节,以便供应给目标市场的药店、医院等机构。
二、进口药品注册程序:1.提交注册申请:进口药品需要在目标国家进行注册。
注册申请一般由进口药品的生产厂家或相关代理商提交给目标国家的药品管理部门。
注册申请需要包括药品的详细信息、产品说明书、药理学和毒理学研究数据、批准原产国的注册情况和产品质量控制等内容。
2.注册评估和审批:注册申请获得后,目标国家的药品管理部门将对申请进行评估和审批。
评估过程通常包括对药品的安全性、有效性和质量进行评估,以确保其符合该国家的法规要求。
上海市药品进口报关基本程序

药品进口报关基本程序:
1.首先,确认好相关进口资质问题,进口公司是否拥有进出口权以及销售药品的权利。
2.其次,单证齐全,箱单、合同、invoice、提货单。
3.进口药品大都需要出具《进口药品通关单》,这需要企业在货物到港前向药监局提交相关资料,审批下《进口药品通关单》方可。
若审批不通过则不能顺利清关。
注意:进口药品通关单的有限期限为15天,要把握好申请的时间以及清关的时间。
4.进口药品通关单审批下来后,等待货物到港,即可到船公司换单。
5.换完单,开始报检,报关,出税单,缴税(时间在3-5个工作日)
6.放行,我司配送或自行提取。
确认进口海关→签合同→付款→发货→到货→通关→入库。
中草药跨境贸易流程

中草药跨境贸易流程中草药作为传统中医药学的重要组成部分,拥有广泛的市场需求和丰富的资源。
跨境贸易是中草药行业的重要环节之一,其中涉及到一系列流程和环节,下面将对中草药跨境贸易的流程进行简要介绍。
首先,中草药跨境贸易的开始阶段是市场调研和资源寻找。
贸易商通过与国内合作伙伴、中草药种植企业或农户进行接触,在调研的基础上找到合适的中草药资源供应商。
他们会考察供应商的种植基地、生产设施和资源质量等因素,以确保供应链的可信度和稳定性。
第二步是供应商评估和选择。
贸易商会与供应商进行合作评估,对其质量标准、生产能力、产品认证和合规性进行审核。
他们还会考虑供应商的价格、交货能力和稳定性,以确保能够获得高质量和合适价格的中草药资源。
接下来是订单和合同签订。
一旦贸易商确定了合适的供应商,他们会与供应商商议订单细节,如产品规格、数量、价格和交货日期等。
然后,双方将签订正式的合同,明确双方的权益和责任。
第四步是物流和海关手续。
中草药作为易腐、易碎的商品,其物流需求相对较高。
贸易商与物流公司合作,安排中草药的运输和贮存。
同时,贸易商还需要办理相关的海关手续,如出口申报、报关和验放等,确保中草药能够顺利出入境。
最后一步是中草药产品的销售和售后服务。
贸易商将中草药产品销售给国内或国际的中草药批发商、药店或中草药制剂企业。
他们将与客户进行沟通,满足客户的需求,并提供售后服务,以建立长期合作关系。
总的来说,中草药跨境贸易流程包括市场调研和资源寻找、供应商评估和选择、订单和合同签订、物流和海关手续以及产品销售和售后服务等环节。
这些步骤需要跨境贸易商与供应商、物流公司和客户之间的紧密协作,以确保中草药的质量和可持续交易。
进口药品流程及注册程序

4
2021/10/10
1、法律管辖
根据《药品管理法》和《药品注册管理办法》,药 品在中国境内上市销售前,必须向国家食品药品监 督管理局(SFDA)提出注册申请,经SFDA审核批准 并颁发证书后方能在中国境内合法上市销售。
进口药品申请,是指境外生产的药品在中国境内上
市销售的注册申请。此处所述“境外”,包括香港、 澳门和台湾。经SFDA审评符合注册要求后,在外国 生产的药品获《进口药品注册证》,在香港、澳门 和台湾生产的药品获《医药产品注册证》,证书有 效期5年,如欲延续,必须在证书到期前6个月提出 再注册。
12) Certificate of Analysis (COA) of Sample Product.
14) Experiment Data and Information on the Research of Drug
Stability and Related Literatures.
15) Reasons for the Selection of the Kind of Direct Packaging
could provide appropriate literatures to substitute for
experiment information alternatively)
16) Summary of Pharmacology and Toxicology Study.
17) Primary Pharmacodynamics Study and Lite Data
7) Summary of Pharmaceutical Research,
8) Experiment Data and Information and Relevant Literatures on
进口药品注册管理办法及所需时间

进口药品注册管理办法及所需时间1、申请进口药品注册,应当填写《药品注册申请表》,报送有关资料和样品,提供相关证明文件,(证明性文件需向进口国的大使馆进行公证)向国家食品药品监督管理局提出申请。
2、国家食品药品监督管理局对申报资料进行形式审查需30 日,符合要求的, 出具药品注册申请受理通知书并通知中国药品生物制品检定所组织对3 个生产批号的样品进行注册检验。
3、中国药品生物制品检定所收到资料和样品后,应当在5 日内组织进行注册检验。
4、承担进口药品注册检验的药品检验所在收到资料、样品和有关标准物质后,应当在60 日内完成注册检验并将药品注册检验报告报送中国药品生物制品检定所。
特殊药品和疫苗类制品的样品检验和药品标准复核应当在90 日内完成。
5、中国药品生物制品检定所接到药品注册检验报告和已经复核的进口药品标准后,应当在20 日内组织专家进行技术审查,必要时可以根据审查意见进行再复核。
6、国家食品药品监督管理局药品审评中心应当在120 日内组织药学、医学及其他技术人员对申报资料进行审评,如需补充资料,审评中心发布补充资料通知,根据通知内容,需在4个月内一次性将资料补充完毕。
药品审评中心对补充资料进行审评需40 日。
7、国家食品药品监督管理局应当在20 日内作出审批决定;20 日内不能作出决定的,经主管局领导批准,可以延长10 日,并应当将延长时限的理由告知申请人。
8、国家食品药品监督管理局应当自作出药品注册审批决定之日起10 日内颁发、送达有关行政许可证件。
9、申请人拿到临床批件需向国家食品药品监督管理局提交临床方案等资料进行备案,然后进行临床试验6-8 个月。
10、将临床报告递交国家食品药品监督管理局。
国家食品药品监督管理局药品审评中心应当在120 日内组织药学、医学及其他技术人员对报送的临床试验等资料进行全面审评。
如需补充资料,审评中心发布补充资料通知,根据通知内容,需在4个月内一次性将资料补充完毕。
吉林省珲春中药材进出口办理流程

吉林省珲春中药材进出口办理流程一、进出口备案申请的条件无论在注册登记的内资企业还是外资企业,其经营范围里必须有进出口业务内容才可以申请进出口备案。
内资企业经营范围只要这句话即可提出申请,“专门从事货物及技术的进出口业务”。
无论是在注册外贸公司还是注册普通的有限公司,只要经营范围里有进出业务内容就能申请进出口备案。
如果公司经营范围里没有这一条,那么则需要先办理公司经营范围变更手续后再申请。
二、进出口备案提出申请流程1、外经委备案2、海外备案3、外汇登记4、检验检疫备案5、电子口岸登记6、出口退税备案三、进出口备案申请所需材料1、公司营业执照原件及复印件2、组织机构代码证原件及复印件3、税务登记证原件及复印件4、公司章程复印件5、公章、法人章、报检专用章6、公司基本帐户开户许可证7、法人与操作员身份证与照片8、其它材料需注意的就是,在获得进出口经营权后,企业必须享用出口退税政策,则必须必须提出申请通常纳税人资格。
在材料齐全的情况下,申请进出口备案所需的时间为30个工作日。
企业进出口经营资格证书的年审制度获得进出口经营权的企业必须申领进出口经营资格证书,每年要进行资格证书的年审。
通过资格证书年审的企业才继续拥有进出口经营权。
如果未按规定申领进出口企业资格证书或未参加年审的企业,均视为自动放弃进出口经营资格。
对无正当理由的,受权发证机关应注销其进出口企业资格证书,并且在一年内不再对其进出口企业经营资格予以核准登记。
1.年审的目的和机构年审进出口经营资格的目的是加强对各类外贸企业的后期管理,维护健康的外贸经营秩序,促进对外贸易的发展。
每年的1~4月进行年审,年审由各级授权发证机构执行。
2.年审的内容和范围(1)查验《资格证书》列明的企业名称、企业代码、企业进出口经营范围等项目是否变更。
凡所列项目已作变更的,授权发证机关必须在15个工作日内修改相应的计算机数据并通过网络上报外经贸部;(2)根据企业递交的年审材料以及海关、质量监督检验检疫、外汇管理、税务等部门提供更多的企业依法经营的材料,考核进出口企业依法经营隋况;(3)审核改制企业是否符合有关规定的进出口经营资格标准,确认企业是否具备继续从事进出口业务的资格;(4)清查、核对企业上报的各项数据是否准确、全面。
中药材报关流程

中药材报关流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!中药材是我国传统药材的重要组成部分,在国际市场上备受欢迎。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 申请和审批
1.1首次进口药材:
1.2非首次进口药材:
3. 口岸检验和监督管理
4. 所需提交资料
4.1 首次进口药材上报SFDA
4.1.1 物料部申请人需报送下列资料一式两份,分别提交国家食品药品监督管理局和中国药品生物制品检定所。
(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
(六)药材基源研究证明资料(研究证明资料应由中国境内具有动、植物基源鉴定资质的
机构提供)。
4.1.2 如进口药材的质量标准来源于省、自治区、直辖市药材标准,物料部申请人除报送上述资料外,还应根据具体情况,对该标准作相应的提高工作,并报送有关研究资料;如进口药材无法定标准,物料部申请人除报送上述资料外,还应报送下述资料:
(一)药材生态环境、生长特征、形态描述、栽培或者培植(培育)技术、产地加工等。
(二)药材质量标准起草说明。
(三)药理毒理研究资料综述。
(四)主要药效学试验资料及文献资料。
(五)一般药理研究的试验资料及文献资料。
(六)急性毒性试验资料及文献资料。
(七)我国批准的中成药处方中含有该药材的证明资料。
4.2 非首次进口药材上报SFDA
物料部申请人需报送下述资料一式一份:
(一)《进口药材申请表》。
(二)本公司《药品经营许可证》或者《药品生产许可证》、《营业执照》(复印件)。
(三)供货方合法登记证明文件(如《营业执照》等)(复印件)。
(四)购货合同(复印件)。
(五)药材质量标准及其来源。
4.3 登记备案上报口岸药监局
物料部申请人需报送下列资料一式两份:
(一)《进口药材批件》复印件(和《进口药材补充申请批件》复印件)。
(二)本公司《药品经营许可证》或者《药品生产许可证》复印件。
(三)原产地证明复印件。
(四)购货合同复印件。
(五)装箱单、提运单和货运发票复印件。
(六)经其他国家或者地区转口的进口药材,应当同时提交从原产地到各转口地的全部
购货合同、装箱单、提运单和货运发票。
(七)涉及濒危物种的药材,应当提供进出口双方国家濒危物种进出口管理机构证明文
件复印件。
上述各类复印件应当加盖申请人公章。
