氨基酸蛋白质和酶精品PPT课件
合集下载
《氨基酸和蛋白质》课件

《氨基酸和蛋白质》PPT课件
欢迎来到《氨基酸和蛋白质》课程,本课件将详细介绍关于氨基酸和蛋白质 的知识,让我们一起探索吧!
氨基酸
• 概述:氨基酸的定义和种类 • 氨基酸的结构:氨基、羧基、侧链 • 氨基酸的性质:酸碱性、光学异构体、等电点
蛋白质
• 概述:蛋白质的定义和组成 • 蛋白质的级别:一级结构、二级结构、三级结构、四级结构 • 蛋白质的功能:结构、酶、运输、抗体等 • 蛋白质的合成和折叠:翻译、修饰、折叠 • 蛋白质的失活:变性、超过氧化物酶、热失活
氨基酸和蛋白质的应用
• 保健品:氨基酸的补充和蛋白质的营养品 • 医药:蛋白质药物的研发和应用 • 工业:氨基酸和蛋白质在工业生产中的应用
总结
• 氨基酸和蛋白质的重要性Fra bibliotek应用前景 • 知识点回顾
欢迎来到《氨基酸和蛋白质》课程,本课件将详细介绍关于氨基酸和蛋白质 的知识,让我们一起探索吧!
氨基酸
• 概述:氨基酸的定义和种类 • 氨基酸的结构:氨基、羧基、侧链 • 氨基酸的性质:酸碱性、光学异构体、等电点
蛋白质
• 概述:蛋白质的定义和组成 • 蛋白质的级别:一级结构、二级结构、三级结构、四级结构 • 蛋白质的功能:结构、酶、运输、抗体等 • 蛋白质的合成和折叠:翻译、修饰、折叠 • 蛋白质的失活:变性、超过氧化物酶、热失活
氨基酸和蛋白质的应用
• 保健品:氨基酸的补充和蛋白质的营养品 • 医药:蛋白质药物的研发和应用 • 工业:氨基酸和蛋白质在工业生产中的应用
总结
• 氨基酸和蛋白质的重要性Fra bibliotek应用前景 • 知识点回顾
蛋白质的酶促降解和氨基酸代谢课件

在某些情况下,某些氨基酸可以促进 蛋白质的酶促降解,而蛋白质的酶促 降解也可以产生特定的氨基酸,从而 形成协同作用。
CATALOGUE
蛋白质的酶促降解和氨基酸代谢的疾病关 联
疾病状态下蛋白质的酶促降解和氨基酸代谢的变化
疾病状态下蛋白质的酶促降解和氨基酸代谢的变化 疾病状态下蛋白质的酶促降解和氨基酸代谢的变化 疾病状态下蛋白质的酶促降解和氨基酸代谢的变化
蛋白质的酶促降解 和氨基酸代谢课件
• 蛋白质的酶促降解 • 氨基酸代谢 • 蛋白质的酶促降解与氨基酸代谢的关系 • 蛋白质的酶促降解和氨基酸代谢的疾病关
联 • 研究展望
CATALOGUE
蛋白质的酶促降解
蛋白质的酶促降解概述
蛋白质的酶促降解是生物体内蛋白质 代谢的重要环节,通过酶的作用将蛋 白质分解成氨基酸,以满足机体对氨 基酸的需求。
蛋白质的酶促降解和氨基酸代谢的研究挑战
蛋白质的酶促降解和氨基酸代谢是一个非常复杂的生物学过程,涉及多 种酶和分子的相互作用,研究难度较大。
目前对于某些酶和分子的作用机制仍不完全清楚,需要进一步深入研究。
在实际应用方面,如何将研究成果转化为临床治疗方法和药物仍面临许 多挑战,需要加强基础研究和临床应用的结合。
蛋白质的酶促降解的生物学意义
维细胞内氨基酸平衡
促进营养物质的吸收
参与免疫反应
维持细胞功能
CATALOGUE
氨基酸代谢
氨基酸代谢概述
氨基酸是构成蛋白质的基本单 位,是生物体进行生命活动不 可或缺的物质。
氨基酸代谢是指氨基酸在生物 体内经过一系列化学反应被利 用、转化的过程。
氨基酸代谢与能量代谢、核苷 酸合成等密切相关,是生物体 内物质循环和能量转换的重要 环节。
CATALOGUE
蛋白质的酶促降解和氨基酸代谢的疾病关 联
疾病状态下蛋白质的酶促降解和氨基酸代谢的变化
疾病状态下蛋白质的酶促降解和氨基酸代谢的变化 疾病状态下蛋白质的酶促降解和氨基酸代谢的变化 疾病状态下蛋白质的酶促降解和氨基酸代谢的变化
蛋白质的酶促降解 和氨基酸代谢课件
• 蛋白质的酶促降解 • 氨基酸代谢 • 蛋白质的酶促降解与氨基酸代谢的关系 • 蛋白质的酶促降解和氨基酸代谢的疾病关
联 • 研究展望
CATALOGUE
蛋白质的酶促降解
蛋白质的酶促降解概述
蛋白质的酶促降解是生物体内蛋白质 代谢的重要环节,通过酶的作用将蛋 白质分解成氨基酸,以满足机体对氨 基酸的需求。
蛋白质的酶促降解和氨基酸代谢的研究挑战
蛋白质的酶促降解和氨基酸代谢是一个非常复杂的生物学过程,涉及多 种酶和分子的相互作用,研究难度较大。
目前对于某些酶和分子的作用机制仍不完全清楚,需要进一步深入研究。
在实际应用方面,如何将研究成果转化为临床治疗方法和药物仍面临许 多挑战,需要加强基础研究和临床应用的结合。
蛋白质的酶促降解的生物学意义
维细胞内氨基酸平衡
促进营养物质的吸收
参与免疫反应
维持细胞功能
CATALOGUE
氨基酸代谢
氨基酸代谢概述
氨基酸是构成蛋白质的基本单 位,是生物体进行生命活动不 可或缺的物质。
氨基酸代谢是指氨基酸在生物 体内经过一系列化学反应被利 用、转化的过程。
氨基酸代谢与能量代谢、核苷 酸合成等密切相关,是生物体 内物质循环和能量转换的重要 环节。
氨基酸-蛋白质和酶

§10.4氨基酸、蛋白质和酶
提取氨基酸
一般用水煮醇沉法从中草药中提取氨基 酸,滤除沉淀,浓缩至无醇味,再依次 通过强酸型阳离子交换树脂柱,用稀酸 或稀碱洗脱即可得到总氨基酸
§10.4氨基酸、蛋白质和酶
恩格斯曾说过这样的话:“生命是蛋白 质的存在方式,这种存在方式本质上就在于 蛋白质化学成分的不断自我更新。”
§10.4氨基酸、蛋白质和酶
酶的化学本质
• 大多数为蛋白质,少部分为RNA。
§10.4氨基酸、蛋白质和酶
酶的性质—促进水解
• 酶是一种活性蛋白质,除了具有蛋白质的通性外, 还具有促进中药化学成分水解的性质,如苷类。
• 酶的水解作用具有专属性,而这种酶往往与被水 节成分共存与同一植物内,大多数情况下,需防 止酶水解中药中欲提取的成分,必须使酶变性而 破坏其活性,如加热、加入电解质或重金属盐。
多数蛋白质可溶于水,形成胶 体,加热煮沸则变性凝结自水中析 出;不溶于有机溶剂,如中药制剂 生产中常用水煮醇沉法即可使蛋白 质沉淀除去
§10.4氨基酸、蛋白质和酶
检识蛋白质的方法
将蛋白质溶于 碱性水溶液中
少量 CU2SO4
紫色或紫红色
上述反应称为 双缩尿反应
§10.4氨基酸、蛋白质和酶
酶的发现
• 1773年,意大利科学家斯帕兰扎尼
§10.4氨基酸、蛋白质和酶
酶的分类
根据酶所催化的反应性质的不同,将酶分成六大类:
• 氧化还原酶类(oxidoreductase) • 转移酶类(transferases) • 水解酶类(hydrolases ) • 裂合酶类(lyases • 异构酶类(isomerases) • 合成酶类(ligase)
第十章 氨基酸、蛋白质和酶
生物化学第2章 氨基酸(共77张PPT)

• Ala Arg Asp
Asn
Cys Glu Gln Gly
His
Ile
Leu
Lys
Met Phe Pro
Ser
Thr
Trp
Tyr
Val
、 20种氨基酸可按其侧链分类
• 氨基酸的侧链可以按照它们的化学结构分为 三类,即:脂肪族氨基酸;芳香族氨基酸; 杂环氨基酸。
1)脂肪族氨基酸(中性)
甘氨酸 Glycine
非极性氨基酸(八种)
不带电何的极性氨基酸(八种)
带负电荷的氨基酸(2种)
带正电荷的氨基酸(2种)
➢第21种基本氨基酸是硒代半胱氨酸(Selenocysteine, Sec) ➢第22种基本氨基酸是吡咯赖氨酸(Pyrrolysine, Pyr) ➢两种罕见基本氨基酸是在特定生物的特定调控条件下生成。
O
H 2N CH C OH
CH 2
SH
C
( α-氨基-β-巯基丙酸 )
两个半胱氨酸氧化可生成胱氨酸
人头发的电子显微镜照片与模型
烫发过程:
1、加还原剂(巯基乙醇) 打开二硫键。
2、加氧化剂(双氧水) 重新生成错位二硫键。
1)、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine 甲硫氨酸 Methionine
O H 2N CH C OH
CH OH CH 3
T
( α-氨基-β-羟基丁酸 )
L-Threonine D-Threonine
L-alloThreonine
D-allo-
Threonine
苏氨酸的光学异构体
1)、脂肪族氨基酸(含羟基或硫)
蛋白质和酶专题.ppt
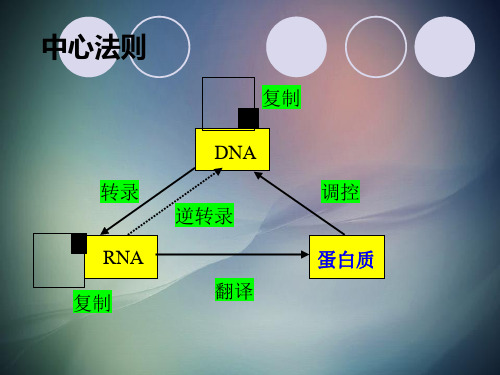
酶的本质是蛋白质,凡是影响蛋白质 生物学活性的因素都能影响酶的活性。
第三节 酶的作用机制及调节
( Mechanism and Adjustment of Enzyme-Catalyzed Reaction)
一、酶的活性中心(active center)
活性中心或称活性部位(active site),指 必需基团在空间结构上彼此靠近,组成具有 特定空间结构的区域,能与底物特异结合并 将底物转化为产物。
2. 催量单位 1催量(kat)是指在特定条件下,每 秒钟使1mol底物转化为产物所需的酶量。
3. kat与IU的换算: 1 IU=16.67×10-9 kat
第二节 酶催化作用的特点
(The Characteristic of Enzyme-Catalyzed Reaction)
酶与一般催化剂的共同点是:在反应前 后没有质和量的变化;只能催化热力学允许 的化学反应;只能加速可逆反应的进程,而 不改变反应的平衡点。
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸(甘氨酸除外)。
氨基酸的结构特点
COO-
CHRH3
C +NH3
H
R-侧链基团
L-氨基酸的丙甘通氨氨式酸酸
O
NH2-CH-C +
H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
-HOH
O
O
NH2-CH-C-N-CH-C
4、复性
若蛋白质变性程度较轻,去除变性因素 后,蛋白质仍可恢复或部分恢复其原有的构 象和功能,称为复性(renaturation) 。
蛋白质与医学的关系
由于各种原因(物理、化学、生物→基因突变等)导 致的蛋白质分子在结构或合成量上产生异常,从而引起机 体一系列病理改变,并产生功能障碍,从而引发某些疾病 产生。如血红蛋白病(镰形细胞贫血症、地中海贫血症)、 血浆蛋白病(血友病)、受体病(家族性高胆固醇血症)、 结构蛋白缺陷病(假肥大型营养不良)、膜转运蛋白病 (肝豆状核变性)等分子病。
第三节 酶的作用机制及调节
( Mechanism and Adjustment of Enzyme-Catalyzed Reaction)
一、酶的活性中心(active center)
活性中心或称活性部位(active site),指 必需基团在空间结构上彼此靠近,组成具有 特定空间结构的区域,能与底物特异结合并 将底物转化为产物。
2. 催量单位 1催量(kat)是指在特定条件下,每 秒钟使1mol底物转化为产物所需的酶量。
3. kat与IU的换算: 1 IU=16.67×10-9 kat
第二节 酶催化作用的特点
(The Characteristic of Enzyme-Catalyzed Reaction)
酶与一般催化剂的共同点是:在反应前 后没有质和量的变化;只能催化热力学允许 的化学反应;只能加速可逆反应的进程,而 不改变反应的平衡点。
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸(甘氨酸除外)。
氨基酸的结构特点
COO-
CHRH3
C +NH3
H
R-侧链基团
L-氨基酸的丙甘通氨氨式酸酸
O
NH2-CH-C +
H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
-HOH
O
O
NH2-CH-C-N-CH-C
4、复性
若蛋白质变性程度较轻,去除变性因素 后,蛋白质仍可恢复或部分恢复其原有的构 象和功能,称为复性(renaturation) 。
蛋白质与医学的关系
由于各种原因(物理、化学、生物→基因突变等)导 致的蛋白质分子在结构或合成量上产生异常,从而引起机 体一系列病理改变,并产生功能障碍,从而引发某些疾病 产生。如血红蛋白病(镰形细胞贫血症、地中海贫血症)、 血浆蛋白病(血友病)、受体病(家族性高胆固醇血症)、 结构蛋白缺陷病(假肥大型营养不良)、膜转运蛋白病 (肝豆状核变性)等分子病。
中药化学辅导——氨基酸、蛋白质和酶类

中药化学辅导——氨基酸、蛋白质和酶类
氨基酸(aminoacids)蛋白质(proteins)和酶类(enzymes)蛋白质是高分子量的化合物,由α一氨基酸组成。
这些氨基酸约有30 种,具r一ch(NH2)一COOH的通式。
有的氮在环中。
酶是生活有机体内具有特殊催化能力的蛋白质,它们大多能溶于水,不溶于乙醇等有机溶剂。
蛋白质的性质不稳定,遇酸、碱、热或某些试剂作用都可沉淀,例如将含蛋白质的水溶液加热至沸或在含蛋白质的溶液中加入乙醇等溶剂,或加入中性盐类(如氯化钠)或醋酸铅等试剂,都可使蛋白质沉淀,中草药中蛋白质可据此种性质提取或去除。
中草药中氨基酸与蛋白质成分的存在与否可用以下方法检查,药材冷水提取液1m1,加0.2%茚三酮试液2~3滴,摇匀,在沸水浴中加热5分钟,如显蓝、蓝紫或紫红色为正反应。
蛋白质与酶等在制备中草药制剂时一般都被视为杂质而除去,因糖浆中有大量蛋白质时就易霉坏,注射剂中有蛋白质时易产生混浊以及注射后产生疼痛或更强烈的副作用。
但最近也发现有一些蛋白质、氨基酸与酶都有生物活性作用,如从栝楼根(天花粉)中提得的天花粉蛋白质可用于人工引产与治疗绒毛膜上皮癌,(即恶性葡萄胎),蕨萝蛋白酶用于抗水肿与抗炎,南瓜子中提得的南瓜子氨酸(cucurbitine)可用于抑制血吸虫、绦虫、蛲虫的生长,使君子中的使君子氨酸(quisqualicacid)可驱蛔虫等。
蛋白质氨基酸PPT课件

凝固作用分两个阶段: 首先是变性; 其次失去规律性的肽链聚集缠绕在一起而凝固或结絮;
2021
33
蛋白质变性的应用
理论上:
研究蛋白质分子结构与功能,分子量测定,亚单位拆分;
生产生活中有利的一面:
食品加工,消毒灭菌等; 非蛋白生物物质提取纯化,终止酶促反应;
生产生活中不利的一面:
活性蛋白制品(酶、抗体)的分离提取和保存;
第二十四章
氨基酸和蛋白质
2021
1
2021
2
2021
3
2021
4
2021
5
2021
6
2021
7
【观察与思考】
【思 考】:从结构上看,其共同点是什么?
2021
8
氨基酸分子中均含有羧基(-COOH)和 氨基(-NH2)原子团。α-氨基酸分子中氨基 接在离羧基最近的碳原子上。
多个氨基酸分子可以在分子间脱水,而形成 多肽(多肽是螺旋状的长链),再构成蛋白质。
系统命名法 a-氨基乙酸
a-氨基丙酸
Hale Waihona Puke NH2谷氨酸 HOOC (CH2)2 CH COOH
NH2
a-氨基戊二酸
苯丙氨酸
NH2
CH2 CH COOH a-氨基β-苯基丙酸
2021
12
3.物理性质
。
4.化学性质
(1)氨基酸的两性
氨基-NH2:能接受H+,显碱性
羧基-COOH:能提供H+,显酸性
R CH COOH OH- R CH COOH OH- R CH COO-
NH3+
H+
NH2
H+
NH2
氨基酸、肽和蛋白质ppt课件

➢ 含pro,HO-pro多不易变性凝固; 亚氨基酸,阻止支链交联
温度
蔗糖
水分含量
pH
2、低温处理下的变化
食品的低温贮藏可延缓或阻止微生物的生 长并抑制酶的活性及化学变化。 冷却(冷藏) 冷冻(冻藏)
➢ 冰结晶,蛋白质变性 水化作用降低;
➢ 快速冷冻法。
蛋白质与氧化剂之间的相互作用
食品常用氧化剂 H2O2 过氧苯甲酰 次氯酸钠
影响因素
有机溶剂
导致蛋白质溶解度下降或沉淀
降低水介质的介电常数 提高静电作用力 静电斥力导致分子结构的展开 促进氢键的形成和反电荷间的静电吸引
4、蛋白质的胶凝作用(Gelation)
沉淀作用:是指由于蛋白质的溶解性完全或部分
丧失而引起的聚集反应。
絮凝:是指蛋白质未发生变性时的无规则聚集反
离子强度
影响蛋白质结合水的环境因素
蛋白质浓度 ➢ 5-10%,浓度,水合作用
➢ 15-20%,Pr沉淀
pH
➢ pH= pI 水合作用最低 ➢ 高于或低于pI,水合作用增强
(净电荷和推斥力增加) ➢ pH 9-10时水合能力较大
温度
温度,蛋白质结合水的能力 (变性蛋白质结合水的能力一般比天然
蛋白质高约10%)
起泡性质的评价
蛋白质的起泡力 测定泡沫稳定性
影响泡沫形成和稳定性的因素:
蛋白质的分子性质
有良好起泡力的蛋白质不具有稳定泡沫的能力, 而能产生稳定泡沫的蛋白质往往不具有良好的
起泡力。
影响泡沫形成和稳定性的因素:
蛋白质的浓度
2%一8%,随着浓度增加起泡性增加。 超过10%,气泡变小,泡沫变硬。
用、乳化和起泡性等,都取决于水-蛋白质的相 互作用。
温度
蔗糖
水分含量
pH
2、低温处理下的变化
食品的低温贮藏可延缓或阻止微生物的生 长并抑制酶的活性及化学变化。 冷却(冷藏) 冷冻(冻藏)
➢ 冰结晶,蛋白质变性 水化作用降低;
➢ 快速冷冻法。
蛋白质与氧化剂之间的相互作用
食品常用氧化剂 H2O2 过氧苯甲酰 次氯酸钠
影响因素
有机溶剂
导致蛋白质溶解度下降或沉淀
降低水介质的介电常数 提高静电作用力 静电斥力导致分子结构的展开 促进氢键的形成和反电荷间的静电吸引
4、蛋白质的胶凝作用(Gelation)
沉淀作用:是指由于蛋白质的溶解性完全或部分
丧失而引起的聚集反应。
絮凝:是指蛋白质未发生变性时的无规则聚集反
离子强度
影响蛋白质结合水的环境因素
蛋白质浓度 ➢ 5-10%,浓度,水合作用
➢ 15-20%,Pr沉淀
pH
➢ pH= pI 水合作用最低 ➢ 高于或低于pI,水合作用增强
(净电荷和推斥力增加) ➢ pH 9-10时水合能力较大
温度
温度,蛋白质结合水的能力 (变性蛋白质结合水的能力一般比天然
蛋白质高约10%)
起泡性质的评价
蛋白质的起泡力 测定泡沫稳定性
影响泡沫形成和稳定性的因素:
蛋白质的分子性质
有良好起泡力的蛋白质不具有稳定泡沫的能力, 而能产生稳定泡沫的蛋白质往往不具有良好的
起泡力。
影响泡沫形成和稳定性的因素:
蛋白质的浓度
2%一8%,随着浓度增加起泡性增加。 超过10%,气泡变小,泡沫变硬。
用、乳化和起泡性等,都取决于水-蛋白质的相 互作用。
第十章蛋白质的酶促降解及氨基酸代谢ppt课件

-CH=NH
H-CO-CH2OH -CH= -CH2-CH3
亚氨甲基 甲酰基 甲醇基 次甲基 亚甲基
甲基
• 一碳基团的转移由相应的一碳基团转移酶催化,
其辅酶为FH4
• 一碳基团和氨基酸代谢
叶酸和 四氢叶酸(FH4或THFA)
叶 酸
四
氢
H
叶
10
酸
5
H
CHOCH2
N5N,5-NC1H0-OC-HF2H-F4 H4
(His、 Arg)
二 十 种 氨 基 酸 的 生 物 合 成 概 况
_x0
00b
丝氨 酸族
His 和 芳香族
丙氨 酸族
天冬氨 酸族
谷氨酸族
氨基酸生物合成的分族情况
(1)丙氨酸族 丙酮酸 Ala、Val、Leu
(2)丝氨酸族 甘油酸-3-磷酸 Ser、Gly、Cys
(3)谷氨酸族 -酮戊二酸 Glu、Gln、Pro、Arg
Mg2+
谷氨酰胺合成酶
+H2O
+2H
谷氨酸合成酶
3、联合脱氨基作用
(1)概念 (2)类型
转氨基作用 和氧化脱氨基 作用联合进行 的脱氨基作用 方式。
a、转氨酶与L-谷氨酸脱氢酶作用相偶联 b、转氨基作用与嘌呤核苷酸循环相偶联
转氨酶与L-谷氨酸脱氢酶作用相偶联
α-氨基酸
α-酮戊二酸
转氨酶
NH3+NADH
1、氧化脱氨基作用
氨基酸在酶的催化下脱去氨基生成相应的α-酮酸 的过程称为氧化脱氨基作用。主要有以下两种类型:
COOH
CH2
CH2
+ H2O
L-谷氨酸脱氢酶
CH NH2 COOH
高中化学《氨基酸》课件

③特殊反应。
成盐 成酰氯 COOH 成酯 成酰胺 还原
成盐 与亚硝酸反应
NH2 与甲醛反应
酰化 烃基化
1、两性
(1) 氨基酸与强酸强碱都能成盐。
(2) 氨基酸本身就可以形成内盐(两性离子)。
氨基酸的高熔点(实际为分解点)、难 溶于非极性有机溶剂等性质说明氨基 酸在结晶状态是以正负离子存在的。
(3) 氨基酸在水溶液中能形成如下的平衡:
N C(COOC2H5)2
N C(COOC2H5)2
O
1. OH-/H2O 2. H3+O
O
1. OH-/H2O 2. H3+O
RCHCOOH
NH2
(dl)
HOOCCH2CHCHCOOH
R NH2
(dl)
5. 乙酰氨基丙二酸二乙酯法
在邻苯二甲酰亚胺丙二酸二乙酯的基础上,发展 了乙酰氨基丙二酸二乙酯法合成氨基酸,而且这种中 间产物具有较小的空间阻碍,对合成是非常有利的。
(1)中性氨基酸水溶液的pH是否等于7?为什么? (2)正负离子的量是否相等?
-COO- 结合质子的能力与-NH3+ 给出质子的能力不是 完全相同的。通常, -NH3+ 给出质子的能力>- COO- 结 合质子的能力。
因此,中性氨基酸水溶液的pH一般略小于7;负离子的 量对于正离子的量。
怎样使正负离子的量相等? Method:往体系中加酸,抑制-NH3+ 给出质子。
酶解法:
用羧肽酶处理多肽,水解只发生在C-端;用氨肽酶处 理多肽,水解只发生在N-端;
例如,某三肽结构的测定:
二肽 + 半胱氨酸 氨肽酶 某三肽 羧肽酶 色氨酸 + 二肽
N-端AA
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章 氨基酸、蛋白质和酶
§10.4氨基酸、蛋白质和酶
氨基酸(amino acid):含有氨基和羧基的
一类有机化合物的通称。生物功能大分子蛋白 质的基本组成单位,是构成动物营养所需蛋白 质的基本物质。是含有一个碱性氨基和一个酸 性羧基的有机化合物。氨基连在α-碳上的为 α-氨基酸。天然氨基酸均为α-氨基酸。
(L.Spallanzani,1729—1799)设计了一个巧妙的实验: 将肉块放入小巧的金属笼中,然后让鹰吞下去。过一段时 间他将小笼取出,发现肉块消失了。于是,他推断胃液中 一定含有消化肉块的物质。但是什么,他不清楚。 • 1836年,德国科学家施旺(1810—1882)从胃液中提取 出了消化蛋白质的物质。解开胃的消化之谜。
§10.4氨基酸、蛋白质和酶
酶的分类
根据酶所催化的反应性质的不同,将酶分成六大类:
• 氧化还原酶类(oxidoreductase) • 转移酶类(transferases) • 水解酶类(hydrolases ) • 裂合酶类(lyases • 异构酶类(isomerases) • 合成酶类(ligase)
§10.4氨基酸、蛋白质和酶
除构成蛋白质的氨基酸外,其他游离氨基酸也大 量存在于中药中,有些氨基酸为中药的有效成分
使君子
使君子氨酸
使君子中的使君子氨 酸具有驱蛔作用
§10.4氨基酸、蛋白质和酶
毛边南瓜子
NH2 COOH
N H
毛边南瓜子中的南瓜子氨 酸具有治疗丝虫病和血吸 虫病的作用
§10.4氨基酸、蛋白质和酶
多数蛋白质可溶于水,形成胶 体,加热煮沸则变性凝结自水中析 出;不溶于有机溶剂,如中药制剂 生产中常用水煮醇沉法即可使蛋白 质沉淀除去
§10.4氨基酸、蛋白质和酶
检识蛋白质的方法
将蛋白质溶于 碱性水溶液中
少量 CU2SO4
紫色或紫红色
上述反应称为 双缩尿反应
§10.4氨基酸、蛋白质和酶
酶的发现
• 1773年,意大利科学家斯帕兰扎尼
天冬
H2NCOCH2CHCOOH NH2
天冬、玄参、棉根中的天 冬门素具有镇咳和平喘作 用
§10.4氨基酸、蛋白质和酶
田七氨酸: C5H8N2O5 三七中的田基酸的检识
茚三酮试剂:灵敏度高,最为常用
吲哚醌试剂、1,2-萘醌-4-磺酸试剂:对不同的氨基酸 显示不同的颜色
§10.4氨基酸、蛋白质和酶
半夏蛋白
§10.4氨基酸、蛋白质和酶
天花粉
§10.4氨基酸、蛋白质和酶
氨基酸是组成蛋白质的基本单位
H
NH2 C COOH
H NH2 C COOH
H
甘氨酸
CH3
丙氨酸
H NH2 C COOH
CH2CH2COOH
谷氨酸
§10.4氨基酸、蛋白质和酶
H HN
H O H H O HH
C C N C C N C CO
R1
R2
R3 HN
H
H
C CO
R4 HN
CO C HN
Rn
肽链
CO C H R5
§10.4氨基酸、蛋白质和酶
蛋白质分子多样性
氨基酸种类不同 氨基酸数目不同 氨基酸序列不同 肽链空间结构不同
蛋白质 的结构 多样性
蛋白质 的种类 多样性
蛋白质功能的多样性
§10.4氨基酸、蛋白质和酶
这句话的意思是:没有蛋白质的存在,也 就没有生命。蛋白质是一切生命活动的体现者, 有什么样的蛋白质就能表现出什么样的生物性 状。
§10.4氨基酸、蛋白质和酶
蛋白质广泛存在于我们的生活中
动物蛋白
§10.4氨基酸、蛋白质和酶
黑
植物蛋白
大
豆
植 物 蛋 白 粉
§10.4氨基酸、蛋白质和酶
蛋白质大量存在于中草药中,在中药制 剂的工艺中,大多数情况将其作为杂质除 去。但近几十年来,随着对中药化学成分 的深入研究,陆续发现某些中草药的蛋白 质具有一定的生物活性。
§10.4氨基酸、蛋白质和酶
酶与疾病
• 酶的这些性质使细胞内错综复杂的物质代谢过程 能有条不紊地进行,使物质代谢与正常的生理机 能互相适应.若因遗传缺陷造成某个酶缺损,或 其它原因造成酶的活性减弱,均可导致该酶催化 的反应异常,使物质代谢紊乱,甚至发生疾 病.因此酶与医学的关系十分密切。
• 3、多样性:大约有4000多种; • 4、温和性:酶所催化的化学反应一般是在较温和的条件
下进行的。 • 5、活性可调节性:包括抑制剂和激活剂调节、反馈抑制
调节、共价修饰调节和变构调节等。 • 6.有些酶的催化性与辅因子有关。 • 7.易变性,由于大多数酶是蛋白质,因而会被高温、强酸、
强碱等破坏。
§10.4氨基酸、蛋白质和酶
酶的化学本质
• 大多数为蛋白质,少部分为RNA。
§10.4氨基酸、蛋白质和酶
酶的性质—促进水解
• 酶是一种活性蛋白质,除了具有蛋白质的通性外, 还具有促进中药化学成分水解的性质,如苷类。
• 酶的水解作用具有专属性,而这种酶往往与被水 节成分共存与同一植物内,大多数情况下,需防 止酶水解中药中欲提取的成分,必须使酶变性而 破坏其活性,如加热、加入电解质或重金属盐。
§10.4氨基酸、蛋白质和酶
提取氨基酸
一般用水煮醇沉法从中草药中提取氨基 酸,滤除沉淀,浓缩至无醇味,再依次 通过强酸型阳离子交换树脂柱,用稀酸 或稀碱洗脱即可得到总氨基酸
§10.4氨基酸、蛋白质和酶
恩格斯曾说过这样的话:“生命是蛋白 质的存在方式,这种存在方式本质上就在于 蛋白质化学成分的不断自我更新。”
§10.4氨基酸、蛋白质和酶
酶的发现
• 1926年,美国科学家萨姆钠(1887—1955)从刀豆种
子中提取出脲酶的结晶,并通过化学实验证实脲酶是一 种蛋白质。 • 20世纪30年代,科学家们相继提取出多种酶的蛋白质结 晶,并指出酶是一类具有生物催化作用的蛋白质。 • 20世纪80年代,美国科学家切赫(T.R.Cech,1947—)和 奥特曼(S.Altman,1939—)发现少数RNA也具有生物催 化作用。
• 但有时则要利用其水解的专属性,如强心灵的生 产工艺中,使黄夹苷甲和黄夹苷乙分子的葡萄糖 去掉,所得次生苷的强心作用提高5倍左右。
§10.4氨基酸、蛋白质和酶
酶的性质—催化作用
• 1、高效性:酶的催化效率比无机催化剂更高,使得反应 速率更快;
• 2、专一性:一种酶只能催化一种或一类底物,如蛋白酶 只能催化蛋白质水解成多肽;
§10.4氨基酸、蛋白质和酶
氨基酸(amino acid):含有氨基和羧基的
一类有机化合物的通称。生物功能大分子蛋白 质的基本组成单位,是构成动物营养所需蛋白 质的基本物质。是含有一个碱性氨基和一个酸 性羧基的有机化合物。氨基连在α-碳上的为 α-氨基酸。天然氨基酸均为α-氨基酸。
(L.Spallanzani,1729—1799)设计了一个巧妙的实验: 将肉块放入小巧的金属笼中,然后让鹰吞下去。过一段时 间他将小笼取出,发现肉块消失了。于是,他推断胃液中 一定含有消化肉块的物质。但是什么,他不清楚。 • 1836年,德国科学家施旺(1810—1882)从胃液中提取 出了消化蛋白质的物质。解开胃的消化之谜。
§10.4氨基酸、蛋白质和酶
酶的分类
根据酶所催化的反应性质的不同,将酶分成六大类:
• 氧化还原酶类(oxidoreductase) • 转移酶类(transferases) • 水解酶类(hydrolases ) • 裂合酶类(lyases • 异构酶类(isomerases) • 合成酶类(ligase)
§10.4氨基酸、蛋白质和酶
除构成蛋白质的氨基酸外,其他游离氨基酸也大 量存在于中药中,有些氨基酸为中药的有效成分
使君子
使君子氨酸
使君子中的使君子氨 酸具有驱蛔作用
§10.4氨基酸、蛋白质和酶
毛边南瓜子
NH2 COOH
N H
毛边南瓜子中的南瓜子氨 酸具有治疗丝虫病和血吸 虫病的作用
§10.4氨基酸、蛋白质和酶
多数蛋白质可溶于水,形成胶 体,加热煮沸则变性凝结自水中析 出;不溶于有机溶剂,如中药制剂 生产中常用水煮醇沉法即可使蛋白 质沉淀除去
§10.4氨基酸、蛋白质和酶
检识蛋白质的方法
将蛋白质溶于 碱性水溶液中
少量 CU2SO4
紫色或紫红色
上述反应称为 双缩尿反应
§10.4氨基酸、蛋白质和酶
酶的发现
• 1773年,意大利科学家斯帕兰扎尼
天冬
H2NCOCH2CHCOOH NH2
天冬、玄参、棉根中的天 冬门素具有镇咳和平喘作 用
§10.4氨基酸、蛋白质和酶
田七氨酸: C5H8N2O5 三七中的田基酸的检识
茚三酮试剂:灵敏度高,最为常用
吲哚醌试剂、1,2-萘醌-4-磺酸试剂:对不同的氨基酸 显示不同的颜色
§10.4氨基酸、蛋白质和酶
半夏蛋白
§10.4氨基酸、蛋白质和酶
天花粉
§10.4氨基酸、蛋白质和酶
氨基酸是组成蛋白质的基本单位
H
NH2 C COOH
H NH2 C COOH
H
甘氨酸
CH3
丙氨酸
H NH2 C COOH
CH2CH2COOH
谷氨酸
§10.4氨基酸、蛋白质和酶
H HN
H O H H O HH
C C N C C N C CO
R1
R2
R3 HN
H
H
C CO
R4 HN
CO C HN
Rn
肽链
CO C H R5
§10.4氨基酸、蛋白质和酶
蛋白质分子多样性
氨基酸种类不同 氨基酸数目不同 氨基酸序列不同 肽链空间结构不同
蛋白质 的结构 多样性
蛋白质 的种类 多样性
蛋白质功能的多样性
§10.4氨基酸、蛋白质和酶
这句话的意思是:没有蛋白质的存在,也 就没有生命。蛋白质是一切生命活动的体现者, 有什么样的蛋白质就能表现出什么样的生物性 状。
§10.4氨基酸、蛋白质和酶
蛋白质广泛存在于我们的生活中
动物蛋白
§10.4氨基酸、蛋白质和酶
黑
植物蛋白
大
豆
植 物 蛋 白 粉
§10.4氨基酸、蛋白质和酶
蛋白质大量存在于中草药中,在中药制 剂的工艺中,大多数情况将其作为杂质除 去。但近几十年来,随着对中药化学成分 的深入研究,陆续发现某些中草药的蛋白 质具有一定的生物活性。
§10.4氨基酸、蛋白质和酶
酶与疾病
• 酶的这些性质使细胞内错综复杂的物质代谢过程 能有条不紊地进行,使物质代谢与正常的生理机 能互相适应.若因遗传缺陷造成某个酶缺损,或 其它原因造成酶的活性减弱,均可导致该酶催化 的反应异常,使物质代谢紊乱,甚至发生疾 病.因此酶与医学的关系十分密切。
• 3、多样性:大约有4000多种; • 4、温和性:酶所催化的化学反应一般是在较温和的条件
下进行的。 • 5、活性可调节性:包括抑制剂和激活剂调节、反馈抑制
调节、共价修饰调节和变构调节等。 • 6.有些酶的催化性与辅因子有关。 • 7.易变性,由于大多数酶是蛋白质,因而会被高温、强酸、
强碱等破坏。
§10.4氨基酸、蛋白质和酶
酶的化学本质
• 大多数为蛋白质,少部分为RNA。
§10.4氨基酸、蛋白质和酶
酶的性质—促进水解
• 酶是一种活性蛋白质,除了具有蛋白质的通性外, 还具有促进中药化学成分水解的性质,如苷类。
• 酶的水解作用具有专属性,而这种酶往往与被水 节成分共存与同一植物内,大多数情况下,需防 止酶水解中药中欲提取的成分,必须使酶变性而 破坏其活性,如加热、加入电解质或重金属盐。
§10.4氨基酸、蛋白质和酶
提取氨基酸
一般用水煮醇沉法从中草药中提取氨基 酸,滤除沉淀,浓缩至无醇味,再依次 通过强酸型阳离子交换树脂柱,用稀酸 或稀碱洗脱即可得到总氨基酸
§10.4氨基酸、蛋白质和酶
恩格斯曾说过这样的话:“生命是蛋白 质的存在方式,这种存在方式本质上就在于 蛋白质化学成分的不断自我更新。”
§10.4氨基酸、蛋白质和酶
酶的发现
• 1926年,美国科学家萨姆钠(1887—1955)从刀豆种
子中提取出脲酶的结晶,并通过化学实验证实脲酶是一 种蛋白质。 • 20世纪30年代,科学家们相继提取出多种酶的蛋白质结 晶,并指出酶是一类具有生物催化作用的蛋白质。 • 20世纪80年代,美国科学家切赫(T.R.Cech,1947—)和 奥特曼(S.Altman,1939—)发现少数RNA也具有生物催 化作用。
• 但有时则要利用其水解的专属性,如强心灵的生 产工艺中,使黄夹苷甲和黄夹苷乙分子的葡萄糖 去掉,所得次生苷的强心作用提高5倍左右。
§10.4氨基酸、蛋白质和酶
酶的性质—催化作用
• 1、高效性:酶的催化效率比无机催化剂更高,使得反应 速率更快;
• 2、专一性:一种酶只能催化一种或一类底物,如蛋白酶 只能催化蛋白质水解成多肽;
