生物化学—氨基酸、蛋白质和酶98页PPT
合集下载
生物化学第2章 氨基酸(共77张PPT)

• Ala Arg Asp
Asn
Cys Glu Gln Gly
His
Ile
Leu
Lys
Met Phe Pro
Ser
Thr
Trp
Tyr
Val
、 20种氨基酸可按其侧链分类
• 氨基酸的侧链可以按照它们的化学结构分为 三类,即:脂肪族氨基酸;芳香族氨基酸; 杂环氨基酸。
1)脂肪族氨基酸(中性)
甘氨酸 Glycine
非极性氨基酸(八种)
不带电何的极性氨基酸(八种)
带负电荷的氨基酸(2种)
带正电荷的氨基酸(2种)
➢第21种基本氨基酸是硒代半胱氨酸(Selenocysteine, Sec) ➢第22种基本氨基酸是吡咯赖氨酸(Pyrrolysine, Pyr) ➢两种罕见基本氨基酸是在特定生物的特定调控条件下生成。
O
H 2N CH C OH
CH 2
SH
C
( α-氨基-β-巯基丙酸 )
两个半胱氨酸氧化可生成胱氨酸
人头发的电子显微镜照片与模型
烫发过程:
1、加还原剂(巯基乙醇) 打开二硫键。
2、加氧化剂(双氧水) 重新生成错位二硫键。
1)、脂肪族氨基酸(含羟基或硫)
丝氨酸 Serine 苏氨酸 Threonine 半胱氨酸 Cysteine 甲硫氨酸 Methionine
O H 2N CH C OH
CH OH CH 3
T
( α-氨基-β-羟基丁酸 )
L-Threonine D-Threonine
L-alloThreonine
D-allo-
Threonine
苏氨酸的光学异构体
1)、脂肪族氨基酸(含羟基或硫)
蛋白质和酶专题.ppt
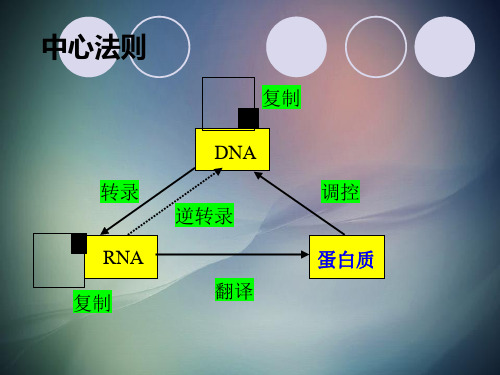
酶的本质是蛋白质,凡是影响蛋白质 生物学活性的因素都能影响酶的活性。
第三节 酶的作用机制及调节
( Mechanism and Adjustment of Enzyme-Catalyzed Reaction)
一、酶的活性中心(active center)
活性中心或称活性部位(active site),指 必需基团在空间结构上彼此靠近,组成具有 特定空间结构的区域,能与底物特异结合并 将底物转化为产物。
2. 催量单位 1催量(kat)是指在特定条件下,每 秒钟使1mol底物转化为产物所需的酶量。
3. kat与IU的换算: 1 IU=16.67×10-9 kat
第二节 酶催化作用的特点
(The Characteristic of Enzyme-Catalyzed Reaction)
酶与一般催化剂的共同点是:在反应前 后没有质和量的变化;只能催化热力学允许 的化学反应;只能加速可逆反应的进程,而 不改变反应的平衡点。
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸(甘氨酸除外)。
氨基酸的结构特点
COO-
CHRH3
C +NH3
H
R-侧链基团
L-氨基酸的丙甘通氨氨式酸酸
O
NH2-CH-C +
H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
-HOH
O
O
NH2-CH-C-N-CH-C
4、复性
若蛋白质变性程度较轻,去除变性因素 后,蛋白质仍可恢复或部分恢复其原有的构 象和功能,称为复性(renaturation) 。
蛋白质与医学的关系
由于各种原因(物理、化学、生物→基因突变等)导 致的蛋白质分子在结构或合成量上产生异常,从而引起机 体一系列病理改变,并产生功能障碍,从而引发某些疾病 产生。如血红蛋白病(镰形细胞贫血症、地中海贫血症)、 血浆蛋白病(血友病)、受体病(家族性高胆固醇血症)、 结构蛋白缺陷病(假肥大型营养不良)、膜转运蛋白病 (肝豆状核变性)等分子病。
第三节 酶的作用机制及调节
( Mechanism and Adjustment of Enzyme-Catalyzed Reaction)
一、酶的活性中心(active center)
活性中心或称活性部位(active site),指 必需基团在空间结构上彼此靠近,组成具有 特定空间结构的区域,能与底物特异结合并 将底物转化为产物。
2. 催量单位 1催量(kat)是指在特定条件下,每 秒钟使1mol底物转化为产物所需的酶量。
3. kat与IU的换算: 1 IU=16.67×10-9 kat
第二节 酶催化作用的特点
(The Characteristic of Enzyme-Catalyzed Reaction)
酶与一般催化剂的共同点是:在反应前 后没有质和量的变化;只能催化热力学允许 的化学反应;只能加速可逆反应的进程,而 不改变反应的平衡点。
存在自然界中的氨基酸有300余种,但组 成人体蛋白质的氨基酸仅有20种,且均属 L氨基酸(甘氨酸除外)。
氨基酸的结构特点
COO-
CHRH3
C +NH3
H
R-侧链基团
L-氨基酸的丙甘通氨氨式酸酸
O
NH2-CH-C +
H OH
甘氨酸
O NH-CH-C
H H OH
甘氨酸
-HOH
O
O
NH2-CH-C-N-CH-C
4、复性
若蛋白质变性程度较轻,去除变性因素 后,蛋白质仍可恢复或部分恢复其原有的构 象和功能,称为复性(renaturation) 。
蛋白质与医学的关系
由于各种原因(物理、化学、生物→基因突变等)导 致的蛋白质分子在结构或合成量上产生异常,从而引起机 体一系列病理改变,并产生功能障碍,从而引发某些疾病 产生。如血红蛋白病(镰形细胞贫血症、地中海贫血症)、 血浆蛋白病(血友病)、受体病(家族性高胆固醇血症)、 结构蛋白缺陷病(假肥大型营养不良)、膜转运蛋白病 (肝豆状核变性)等分子病。
生物化学-蛋白质、酶、氨基酸课件

*主要稳定因素:氢键、离子键
血红蛋白结构示意图
第三节 蛋白质结构与功能的关系
相似的一级结构有相同或相似的生物学功能
BB3B30030
蛋白质的一级结构决定其 空间结构,空间结构决定 其功能。
核糖核酸酶
变性 复性
蛋白质分子中关键氨基酸的缺失或被替代,则影响其功能。
镰刀状红细胞性贫血:β亚基N端的第6号氨基酸残基发生了 变异,Glu→Val,这种变异来源于基因上遗传信息的突变。
*蛋白质三级结构的稳定主要靠次级键,包括氢键、盐键、 疏水键以及范德华力(Van der Wasls力)等。
二硫键
(五)蛋白质的四级结构
二条或二条以上具有独立三级结构 的多肽链组成的蛋白质。其中,每 条具有独立三级结构的多肽链称为 亚基(subunit)。
*蛋白质的四级结构(quarternary structure):蛋白质分子中各个亚 基的空间排布及亚基接触部位的布 局和相互作用
3. 分类:按侧链的结构和理化性质可分为四类
非极性疏水性氨基酸
酸性氨基酸
极性、中性氨基酸
碱性氨基酸
非 极 性 疏 水 性 氨 基 酸
极 性 中 性 氨 基 酸
酸性氨基酸 碱性氨基酸
*营养必需氨基酸:
体内需要但不能自身合成,必须由食物供给的
氨基酸。
包括8种:甲硫氨酸(蛋) 色氨酸 赖氨酸 缬氨酸 异亮氨酸 亮氨酸 苯丙氨酸 苏氨酸。
正常HbA N端 苏 脯 谷 谷 赖
异常Hbs
苏 脯缬 谷 赖
假设来写一两本书
(三)氨基酸理化性质
1、两性解离及等电点
2、紫外吸收:280nm 芳香族氨基酸,共轭双键
3、茚三酮反应:570nm 蓝紫色,氨基酸定性、定量
生物化学 第三章 氨基酸(共92张PPT)

Tyrosine
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
色氨酸
Trytophan
氨基酸的结构
芳香族氨基酸
H 2N
O
CH
C
OH
CH 2 CH 2 CH 2 NH
C
NH
NH 2
氨基酸的结构
精氨酸 Arginine
碱性氨基酸
O H 2 N CH C OH
CH 2 CH 2 CH 2 CH 2 NH 2
氨基酸的结构
精氨酸 Arginine
赖氨酸 Lysine
光性。而且发现主要是L型的(也有D型的,但很少)。
-氨基酸的分子构型
1、氨基酸的分类
各种氨基酸的区别在于侧链R基的不同。
20种蛋白质氨基酸按R的极性可分为非极性氨基酸 、极性性氨基酸、酸性氨基酸和碱性氨基酸;按R基的结 构可分为脂肪族氨基酸、芳香族氨基酸及杂环氨基酸3大 类。
氨基酸的三字母简写符号必背熟,单字母符号 要求认识。
芳香族氨基酸: Phe Trp Tyr
1、氨基酸的分类
组成蛋白质的氨基酸按其α-碳原子上侧链R的结构
2缬.氨酸-羧分基V参a为l与ine的反2应0种,20种氨基酸按R的结构和极性的不同有以下
生成烷基咪唑衍生物,并引起酶活性的降低或丧失
两种分类方法。 酪氨酸 tyrosine
Try Y
提问:大 多 数 氨 基 酸 在 中 性(pH=7) 时, 带
[质子供体]
乙酸
+ H
COOH
-
COO
+ H
CO-O
+ K1
H3N CH2
+
H3N CH2
K2
H2N CH2
Gl+y
Gl+-y
