大学化学练习题3
大学基础化学考试(习题卷3)

大学基础化学考试(习题卷3)第1部分:单项选择题,共70题,每题只有一个正确答案,多选或少选均不得分。
1.[单选题]下列叙述中错误的是A)溶液中H+离子浓度越大,pH越低B)在室温下,任何水溶液中都有[H+][OH-]=10-14C)温度升高时,Kw值变大D)在浓HCl溶液中,没有OH-离子存在答案:D解析:2.[单选题]计量器具的检定标识为绿色说明A)合格,可使用B)不合格应停用C)检测功能合格,其他功能失效D)没有特殊意义答案:A解析:3.[单选题]下列盐水解后呈碱性的是( )A)CuSO4B)Na2SO4C)Na2CO3D)NH4NO3答案:C解析:4.[单选题]下列化合物中能形成分子内氢键的是( )A)邻硝基苯酚B)邻甲基苯酚C)间硝基苯酚D)对硝基苯胺答案:A解析:5.[单选题]称为氰基的是( )A)-SHB)-NH2C)-OHD)-CN答案:D解析:6.[单选题]下列关于二氧化氮的性质描述正确的是( )A)无毒答案:D解析:7.[单选题]ψ(3,2,1)代表的一个轨道是 ( )A)2p轨道B)3d轨道C)3p轨道D)4f轨道答案:B解析:8.[单选题]打开浓盐酸、浓硝酸、浓氨水等试剂瓶塞时,应在哪里中进行操作A)冷水浴B)走廊C)通风橱D)药品库答案:C解析:9.[单选题]化学反应速率随反应浓度增加而加快,其原因是()A)活化能降低B)反应速率常数增大C)活化分子数增加,有效碰撞次数增大D)活化分子百分数增加,有效碰撞次数增大答案:C解析:10.[单选题]能证明白磷和红磷是同素异形体的依据是( )。
A)白磷有剧毒,红磷无毒B)白磷易溶于水,红磷则不溶于水C)白磷在空气中能自燃,红磷在空气中不能自燃D)白磷和红磷燃烧后的产物相同,并且在一定条件下可以相互转化答案:D解析:11.[单选题]取用化学药品时,以下哪些事项操作是正确的?()A)取用腐蚀和刺激性药品时,尽可能带上橡皮手套和防护眼镜。
昆明理工大学有机化学A类试题3
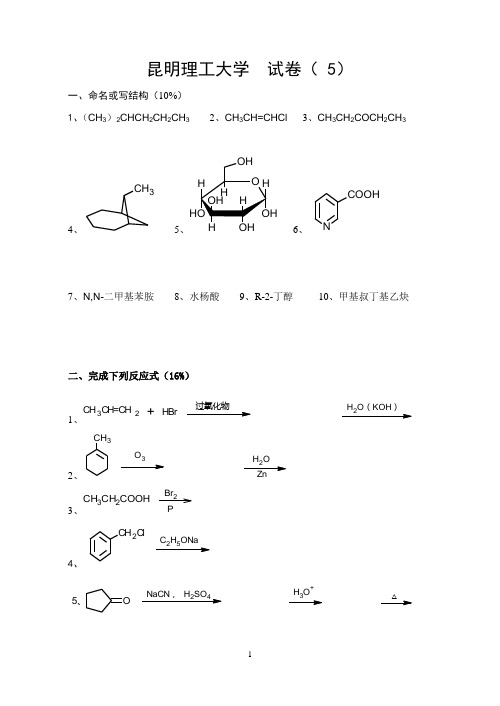
昆明理工大学 试卷( 5)一、命名或写结构(10%)1、(CH 3)2CHCH 2CH 2CH 32、CH 3CH=CHCl3、CH 3CH 2COCH 2CH 34、C H 35、H H 6、NCOOH7、N,N -二甲基苯胺 8、水杨酸 9、R-2-丁醇 10、甲基叔丁基乙炔二、完成下列反应式(16%) 1、HBrCH 3CH=CH2H 2O (KOH )+2、C H 3O 3H 2O3、CH 3CH 2COOHBr 2P4、CH 2ClC H ONa△24OH +O5、6、CHOCH 3浓NaOHHCHO+7、CH 3CH 2CCHHgSO 4/H 2SO 4OH 2 8、CH 3CCCH3热KMnO4溶液MgBr3+COCH3+9、10、C 15H 31CC lONH 3Br 2NaOH三、选择题(20%)1、下列化合物中有顺反异构体的是( ) A 、2-甲基-1-丁烯 B 、2-甲基-2-丁烯 C 、3-甲基-2-戊烯 D 、3-乙基-3-己烯2、下列化合物硝化反应比苯慢且硝化产物是邻、对位的是( )C lCH(CH3)2A 、B 、C 、D 、COOH COCH33、下列构象最稳定的是( )A 、B 、C 、D 、H C 2H 5HH 5C 2C 2H 5HHH 5C 2H HC 2H 5C 2H 5H 5C 2C 2H 5HH4、下列化合物用高锰酸钾氧化生成一元芳香酸的是( )CH(CH3)2CH 3C(CH 3)3C H 3A 、B 、C 、D 、CH 2CH 3CH 3CH 2CH 2CH 2CH 3CH 35、下列化合物在水中的溶解度从大到小排列次序正确的是( ) a 、正丁醇 b 、叔丁醇 c 、乙醚 d 、正戊烷A 、a >b >c >dB 、b >c >d >aC 、b >a >c >dD 、c >a >b >d 6、下列化合物中能发生碘仿反应的是( )CH 3O HCHCH 3O HCOCH2CH 3A 、B 、C 、D 、CH 3CH 2CH 2OH7、下列化合物按碱性强弱顺序排列正确的是( )a 、苯胺b 、对硝基苯胺c 、间硝基苯胺d 、2,4-二硝基苯胺 A 、a >b >c >d B 、a >c >b >d C 、b >c >a >d D 、d >c >b >a 8、下列化合物中能与重氮盐发生偶联反应的是( )A 、B 、C 、D 、N(CH 3)2COCH3CH 3NO 29、下列正碳离子最稳定的是( )CH 3+CH+C H 3CH 3CH 3CH 2+C+C H 3CH 3CH 3a 、b 、c 、d 、10、下列化合物能与托伦试剂反应的是( )A 、蔗糖B 、葡萄糖C 、淀粉D 、 纤维素四、用化学方法鉴别下列各组化合物(15%)1、CH 3CH 2CH 2CH 2 Cl 、CH 3CH 2CH=CHCl 、CH 3CH=CHCH 2Cl2、丙酮、苯乙酮3、葡萄糖、果糖、麦芽糖、蔗糖4、乙醇、正丁醇、乙醛、丙醛、甲酸、乙酸C≡CHCH=CH2CH 2CH 3,,5、五、合成题(24%)1、以乙炔为原料合成3-己醇。
山东大学生物化学试题(3)及答案

生物化学试题(3)一、名词解释(20)1、乙醛酸循环2、无效循环(futile cycle)3、糖异生作用4、Lesch-Nyhan综合症(Lesch-Nyhan syndrome)5、Klenow片段(Klenow fragment)6、错配修复(mismatch repair)7、外显子(exon)8、(密码子)摆动(wobble)9、魔点 10、Q循环二、填空题(20分)1.蛋白激酶对糖代谢的调节在于调节___与___。
2. 由半乳糖合成糖原时,半乳糖-1-磷酸先与___反应,生成___,然后在___酶的催化下转变成___再参与糖原合成。
3. 糖原的分解是从___开始,由糖原磷酸化酶催化生成___。
4.酮体是指___。
5.核苷三磷酸在代谢中起着重要的作用。
___是能量和磷酸基团转移的重要物质,___参与单糖的转变和多糖的合成___参与卵磷脂的合成,___供给肽链合成时所需要的能量6.在糖异生作用中由丙酮酸生成磷酸烯醇式丙酮酸,在线粒体内丙酮酸生成草酰乙酸是___酶催化的,同时要消耗___;然后在细胞质内经___酶催化,生成磷酸烯醇丙酮酸,同时消耗__ 。
7.提出三羧酸循环的生化学家是___,它还提出了___循环。
8.三羧酸循环中调控酶有___。
9.氨基酸转氨酸的辅酶是___,体内一碳单位的载体是___。
10.动物细胞中TCA循环的中间物不能从乙酰CoA来净合成,但这些中间物可以通过丙酮酸与___化合成生成,此反应需要___辅基参与。
11.原核生物基因调控的操纵子模型,其学说的最根本的前提是基因有两种类型,即___和结构基因12.以DNA为模板的转录是___转录,即一个特殊结构基因只能从___转录生成mRNA。
13.大肠杆菌RNA聚合酶全酶是由___亚基组成,其中核心酶是指___。
14. Beta-氧化生成的beta-羟脂酰CoA的立体异构是___型,而脂肪酸合成过程中生成的b-羟脂酰ACP的立体异构是___型。
甘肃农业大学有机化学练习题参考答案第三章 烯烃炔烃二烯烃

(2) H3CHC CCH3
CH3
Br2/H2O
(3) H3CHC CCH3
CH3
ICl
(4) H3CHC CCH3
CH3
HBr/H2O2
(5) H3CHC CCH3
CH3
H2SO4
(6) H3CHC CCH3
CH3 (7) H3CHC CCH3
KMnO4/H +
CH3COOH + CH3COCH3
H2C C CH CH2 CH3
(4) (6)
H2C CHCH2CH CH2
(5)
H3C H
C C
CH3 CH2CH2CH3
H3C H
H C C
C C H
CH3 H
4. 写出 2-甲基-2-丁烯与下列试剂作用的反应式:
CH3 (1) H3CHC CCH3 Br2/CCl4 CH3 Br CH3 CH3CHCCH3 Br Br CH3 CH3CHCCH3 OH I CH3 CH3CHCCH3 Cl Br CH3 CH3CHCCH3 H H CH3 CH3CHCCH3 OSO3H H2O H CH3 CH3CHCCH3 OH
12. 推导结构式: (A) CH3CH CHCH(CH3)2 (B) CH3 CH2 CH C(CH3 )2 (C) CH3CH2 CH2CH(CH3)2 13. 推导结构式: (A)
(CH3 )2CHCH2 C CH
(B) (H3C)2C CHCH CH2
PDF 文件使用 "ቤተ መጻሕፍቲ ባይዱdfFactory" 试用版本创建
H3C H3C C CHCH3
(2) CH3CHCH2CH CH2 或 CH3CHCH2C CH
大学 无机化学 练习题 全国高校 (3)

第15章d 区元素一、教学基本要求1. 了解d区元素的通性,即d电子化学的特征;2. 掌握钛单质、TiO2、TiCl4的性质和制备,钛合金的应用;3. 掌握铬单质的特性与制备,三价铬与六价铬在水溶液中的转变;4. 了解钼和钨的简单化合物及同多酸、杂多酸的基本概念;5. 掌握从软锰矿制备单质锰,锰的变价性质及其高氧化态的氧化性;6. 了解铁、钴、镍氧化还原性变化规律,掌握其氧化物和氢氧化物的性质;7. 掌握铜单质及其常见化合物的性质,着重了解Cu (I) 的歧化反应;8. 了解锌、镉、汞的单质及其重要化合物的性质。
二、要点1. 颜料(pigments)是指不溶解于粘合剂而只能以微粒状态分散于其中的着色剂。
2.染料(dyes)指可溶于粘合剂的着色剂。
3.电子跃迁(electron transition)电子跃迁在这里指低能级d轨道电子向高能级轨道(或低能级f轨道电子向高能级轨道)的跃迁,即跃迁发生在金属离子本身。
这种跃迁的强度通常都很弱。
4.荷移跃迁(charge transfer)电子从一个原子向另一个原子的转移过程。
常分为配位体-金属荷移跃迁(LMCT)和金属-配位体荷移跃迁(MLCT)。
荷移跃迁产生的谱带叫荷移谱带,如果配体孤对电子所处的能级与金属空轨道能级之间的能隙不是很大,荷移谱带就可能出现在可见光区,从而使化合物显色。
5. 同多酸和杂多酸(isopolyacid and heteropolyacid)指由第5、6族金属元素的含氧酸在酸性介质中缩合形成的聚合含氧酸。
只含有一种中心原子的称同多酸;除含有中心原子,还掺入P、As等杂原子的称杂多酸。
6. 锰结核(manganese nucleus)锰结核是聚集在四、五千米以下深海底的锰的矿体,十九世纪七十年代英国的考察队首先在太平洋、大西洋和印度洋中发现,本世纪五十年代末有关它的发生、构造和组成等方面的研究,才开始取得广泛的成果。
它是一种棕色或青褐色的球体或圆块体,又称锰矿球、锰团块和锰矿瘤。
东北大学21春学期《基础化学》在线作业3

21春学期《基础化学》在线作业3单选题判断题一、单选题(共 40 道试题,共 80 分。
)1. CaC2O4 的 Kspq 为2.6×10-9,在含0.020 mol·L-1 CaCl2的溶液中形成沉淀时,所需 C2O42-离子浓度至少应为()mol·L-1。
A. 1.1×10-9B. 1.3×10-7C. 2.2×10-5D. 2.2×10-7该小题参考选项是:B2. 下列离子中水解度最大的是()。
A. Mg2+B. Al3+C. Ga3+D. Mn2+该小题参考选项是:B3. 下列化合物中,在结构和性质上与CO2最相似的是( )A. CS2B. N2OC. SO2D. ClO2该小题参考选项是:A4. 对于任一过程,下列叙述正确的是()。
A. 系统所作的功与反应途径无关B. 系统的内能变化与反应途径无关C. 系统所吸收的热量与反应途径无关D. 以上叙述均不正确该小题参考选项是:B5. 下列各组元素中,性质最相似的两个元素是()。
A. Mg和AlB. Zr和HfC. Ag和AuD. Fe和Co该小题参考选项是:B6. 下列各对元素中化学性质最相似的()。
A. Be,AlB. Na,MgC. Al,SiD. Na,Li该小题参考选项是:A7. 下列各组混合液中,能作为缓冲溶液的是()。
A. 10 ml 0.2 mol·L-1 HCl 和 10 ml 0.1 mol·L-1 NaClB. 10 ml 0.2 mol·L-1 HAc 和 10 ml 0.3 mol·L-1 NaOHC. 10 ml 0.2 mol·L-1 HAc 和 10 ml 0.1 mol·L-1 NaOHD. 10 ml 0.2 mol·L-1 HCl 和 10 ml 0.2 mol·L-1 NaOH该小题参考选项是:C8. 铁原子(Z=26)在基态下未成对的电子数是()。
南京农业大学无机分析化学试题(三)

南京农业大学无机分析化学试题(三)一、选择题(40分,每小题2分)1.甲烷的燃烧热是-965.6kJ·mol -1,其相应热化学方程式( ) A: C(g)+ 4H(g) = CH4(g) c mH θ∆= -965.6kJ·mol -1 B: C(g)+ 2H 2(g) = CH4(g) c m H θ∆= -965.6kJ·mol -1C: CH 4(g)+ 3/2O 2(g) = CO(g)+2H 2O(l) c mH θ∆= -965.6kJ·mol -1 D: CH 4(g)+ 2O 2(g) = CO 2(g)+2H 2O(l) c mH θ∆= -965.6kJ·mol -12. 对于基元反应:2NO + O 2 = 2NO 2,若将体系的压力由原来的100kPa 增大到200kPa ,则正反应的速率为 原来的 ( )A :2倍 B: 4倍 C: 6倍 D:8倍3. Ca 3(PO 4)2的溶度积sp K θ的表示式为:( )A:234[][]sp r r K Ca PO θ+-= B:22324[][]sp r r K Ca PO θ+-= C:23324[][]sp r r K Ca PO θ+-=D:234[3][2]sp r r K Ca PO θ+-=4. 对于下列电极反应,222422MnO He Mn H O ++++=+,如果增大溶液的pH ,则该电极的电极电势( )A: 增大 B: 减小 C: 不变 D: 不能判断 5. 对于一个化学反应,下列说法正确的是( )A: G ∆越负,反应速率越快 B: H ∆越负,反应速率越快 C: 活化能越大,反应速率越快 D: 活化能越小,反应速率越快 6. 满足下列哪组条件的反应可自发进行?( )A: r m H ∆>0,r m S ∆>0,高温。
B :r m H ∆>0, r m S ∆>0,低温。
大学分析化学题库(带答案)第三章 酸碱滴定法

第三章酸碱滴定法一、选择题1.共轭酸碱对的Ka与Kb的关系是()(A)KaKb = 1 (B)KaKb =Kw (C)Ka/Kb =Kw (D)Kb /Ka =Kw2.H2PO4-的共轭碱是()(A)H3PO4 (B)HPO42-(C)PO43-(D)OH-3.NH3的共轭酸是()(A)NH2-(B)NH2OH2-(C)NH4+ (D)NH4OH4.下列各组酸碱组分中,属于共轭酸碱对的是()(A)HCN-NaCN (B)H3PO4-Na2HPO4(C)+NH3CH2COOH-NH2CH2COO-(D)H3O+-OH-5.下列各组酸碱组分中,不属于共轭酸碱对的是()(A)H2CO3-CO32-(B)NH3-NH2-(C)HCl-Cl-(D)HSO4--SO42-6.下列说法错误的是()(A)H2O作为酸的共轭碱是OH-(B)H2O作为碱的共轭酸是H3O+(C)因为HAc的酸性强,故HAc的碱性必弱(D)HAc碱性弱,则H2Ac+的酸性强7.按质子理论,Na2HPO4是()(A)中性物质(B)酸性物质(C)碱性物质(D)两性物质8.浓度为0.1 mol/L HAc(pKa=4.74)溶液的pH是()(A)4.87 (B)3.87 (C)2.87 (D)1.879.浓度为0.10 mol/LNH4Cl (pKb=4.74)溶液的pH是()(A)5.13 (B)4.13 (C)3.13 (D)2.1310.pH 1.00的HCl溶液和pH 13.00的NaOH溶液等体积混合后pH是()(A)14 (B)12 (C)7 (D)611.酸碱滴定中选择指示剂的原则是()(A)指示剂变色范围与化学计量点完全符合(B)指示剂应在pH 7.00时变色(C)指示剂的变色范围应全部或部分落入滴定pH突跃范围之内(D)指示剂变色范围应全部落在滴定pH突跃范围之内12.将甲基橙指示剂加到无色水溶液中,溶液呈黄色,该溶液的酸碱性为()(A)中性(B)碱性(C)酸性(D)不定13.将酚酞指示剂加到无色水溶液中,溶液呈无色,该溶液的酸碱性为()(A)中性(B)碱性(C)酸性(D)不定14.浓度为0.1 mol/L的下列酸,能用NaOH直接滴定的是()(A)HCOOH(pKa=3.45) (B)H3BO3(pKa=9.22)(C)NH4NO2(pKb=4.74) (D)H2O2(pKa=12)15.测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为()(A)NH3的Kb太小(B)(NH4)2SO4不是酸(C)NH4+的Ka太小(D)(NH4)2SO4中含游离H2SO416.标定盐酸溶液常用的基准物质是()(A)无水Na2CO3 (B)草酸(H2C2O4·2H2O)(C)CaCO3 (D)邻苯二甲酸氢钾17.标定NaOH溶液常用的基准物质是()(A)无水Na2CO3 (B)邻苯二甲酸氢钾(C)硼砂(D)CaCO318.已知邻苯二甲酸氢钾的摩尔质量为204.2 g/mol,用它来标定0.1 mol/L 的NaOH溶液,宜称取邻苯二甲酸氢钾()(A)0.25g左右(B)1 g左右(C)0.1 g左右(D)0.45 g左右19.作为基准物质的无水碳酸钠吸水后,标定HCL,则所标定的HCL浓度将()(A)偏高(B)偏低(C)产生随机误差(D)没有影响20.若将H2C2O4·2H2O基准物质长期保存于保干器中,用以标定NaOH溶液的浓度时,结果将()(A)偏高(B)偏低(C)产生随机误差(D)没有影响21.用NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中( )(A)氢离子浓度相等(B)H2SO4和HAc的浓度相等(C)H2SO4的浓度为HAc的1/2(D)两个滴定的PH突跃范围相同22.含NaOH和Na2CO3混合碱液,用HCl滴至酚酞变色,消耗V1 mL,继续以甲基橙为指示剂滴定,又消耗V2 mL,其组成为()(A)V1=V2 (B)V1>V2 (C)V1<V2 (D)V1=2V223.某混合碱液,先用HCl滴至酚酞变色,消耗V1mL,继以甲基橙为指示剂,又消耗V2mL,已知V1<V2,其组成为()(A)NaOH-Na2CO3 (B)Na2CO3(C)NaHCO3 (D)NaHCO3-Na2CO324.关于缓冲溶液,下列说法错误的是()(A)够抵抗外加少量强酸、强碱或稍加稀释,其自身pH值不发生显著变化的溶液称缓冲溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大学化学练习题(三)一、选择题1. 下列离子中,离子的磁矩最大的是…………………………………………………………( ) (原子序数:V 23, Cr 24, Mn 25, Ni 28) (A) V 2+(B) Ni 2+ (C) Cr 3+(D) Mn 2+2. 按鲍林(Pauling)的原子轨道近似能级图,下列各能级中,能量由低到高排列次序正确的是( )(A) 3d , 4s , 5p (B) 5s , 4d , 5p (C) 4f , 5d , 6s , 6p(D) 7s , 7p , 5f , 6d3. 按分子轨道理论,下列分子(离子)中键级等于2的是…………………………………………( )(A)-2O(B) CN -(C) Be 2(D) C 24. 元素周期表中第七周期零族元素的原子序数应是………………………………………( ) (A) 104 (B) 118 (C) 150 (D) 1725. 下列各组离子化合物的晶格能变化顺序中,正确的是………………………………( ) (A) MgO > CaO > Al 2O 3 (B) LiF > NaCl > KI (C) RbBr < CsI < KCl (D) BaS > BaO > BaCl 26. 下列分子或离子中,几何构型不是正四面体的一组是…………………………………( )(A) SO 42-,ClO 4-,PO 43-(B) SiCl 4,SnCl 4,CCl 4 (C) BF 4-,B(OH)4-,BH 4-(D) SF 4,XeF 4,SeF 47. 下列分子中属于非极性分子的是…………………………………………………………( ) (A) PH 3 (B) AsH 3 (C) BCl 3(D) CHCl 38. 在分子中衡量原子吸引成键电子的能力用……………………………………… ( ) (A) 电离能 (B) 电子亲和能 (C) 电负性 (D) 解离能9. 以符号4d 表示的电子的主量子数n ,角量子数l 和此轨道最多的空间取向种类分别为…( ) (A) 4, 3, 10(B) 4, 2, 5 (C) 3, 2, 5(D) 3, 3, 1010. 下列各组分子中,均有极性的一组是………………………………………………()(A) PF3,PF5(B) SF4,SF6(C) PF3,SF4(D) PF5,SF611. 下列各组元素的电负性大小次序正确的是…………………………………………… ()(A) S < N < O < F (B) S < O < N< F(C) Si < Na < Mg < Al (D) Br < H < Zn12. 下列关于-22O和-2O的性质的说法中,不正确的是……………………………………()(A) 两种离子都比O2分子稳定性小(B)-22O的键长比-2O键长短(C)-22O是反磁性的,而-2O是顺磁性的(D)-2O的键能比-22O的键能大13. 下列分子中含有两个不同键长的是………………………………………………… ()(A) CO2(B) SO3(C) SF4(D) XeF414. 测不准原理对于宏观物体的运动无实际意义,其原因是宏观物体……………………()(A) 运动速率大(B) 质量大(C) 位置难以确定(D) 动量难以确定15. 下列离子或化合物中,具有顺磁性的是………………………………………………()(A) Ni(CN)-24(B) CoCl-24(C) Co(NH3)+36(D) Fe(CO)516. 下列各组判断中,不正确的是……………………………………………………………()(A) CH4,CO2,BCl3非极性分子(B) CHCl3,HCl,H2S极性分子(C) CH4,CO2,BCl3,H2S非极性分子(D) CHCl3,HCl极性分子17. 凡是中心原子采用sp3d2杂化轨道成键的分子,其空间构型可能是……………………()(A) 八面体(B) 平面正方形(C) 四方锥(D) 以上三种均有可能18. 下列物质中沸点最高的是…………………………………………………………………( ) (A )NH 3 (B )PH 3 (C )AsH 3 (D )SbH 319. Li 、Be 、B 原子失去一个电子,所需要的能量相差不是很大, 但最难失去第二个电子的原子估计是 ( )(A) Li (B) Be (C) B (D) 都相同20. 下列分子中的电子为奇数的分子是 …………………………………………………( ) (A) F 2O (B) NO 2 (C) CO (D) Cl 2O 721. 下列各组表示核外电子运动状态的量子数中合理的是 ……………………………( )(A) n = 3,l = 3 ,m = 2,m s = 21- (B) n = 2,l = 0 ,m = 1,m s =21 (C) n = 1,l = 0 ,m = 0,m s =21 (D) n =0,l = 0 ,m = 0,m s =21- 22. [Ni(en)3]2+离子中镍的价态和配位数是 ………………………………………………( ) (A) +2,3(B) +3,6(C) +2,6 (D) +3,323. 下列分子中,中心原子采取SP 2杂化的是…………………………………………………( ) A 、NH 3 B 、BF 3 C 、CHCl 3 D 、H 2O 24. 按分子轨道理论,最稳定的顺磁性微粒( )(A )O 2+ (B )O 22+ (C )O 2 (D )O 2-25. 下列哪一种物质处于液态时只需要克服色散力就能使之沸腾……………………………( ) (A )CS 2 (B )HF (C )Fe (D )CHCl 326. 下列配合物中,属于螯合物的是……………………………………………………………( ) (A) [Ni(en)2]Cl 2 (B) K 2[PtCl 6] (C) (NH 4)[Cr(NH 3)2(SCN)4](D) Li[AlH 4]27. 核外某电子的角量子数l = 2,它的磁量子数m 可能取值有…………………………………( )(A) 1个(B) 3个(C) 5个 (D) 7个28. 下列各组元素中,电负性依次减小的是………………………………………………………()(A) K > Na > Li (B) O > Cl > H(C) As > P > H (D) 三组都对29. 下列各组原子轨道中不能叠加成键的是……………………………………………………()(A) p x–p x (B) p x–p y(C) s–p x(D) s–p z30. 已知某元素+3价离子的电子排布式为1S22S22P63S23P63d5,该元素在周期表中属于………()(A)ⅤB族(B)ⅢB族(C)Ⅷ族(D)ⅤA族31. 多电子原子的能量E是由()决定的(A)主量子数n (B)n、l (C)n、m、l (D)l32. 在[Ru(NH3)4Br2]+中,Ru的氧化数和配位数分别是……………………………………………()(A) +2和4 (B) +2和6 (C) +3和6 (D) +3和433. 下列各组原子和离子半径变化的顺序,不正确的一组是……………………………………()(A) P3- > S2- > Cl- > F-(B) K+> Ca2+ > Fe2+ > Ni2+(C) Co > Ni > Cu > Zn (D) V > V2+ > V3+ > V4+34. 原子序数为 19 的元素的价电子的四个量子数为…………………………………………()(A) n=1,l=0,m=0,m s=+21(B) n=2,l=1,m=0,m s=+21(C) n=3,l=2,m=1,m s=+21(D) n=4,l=0,m=0,m s=+2135. 下列各组元素的电负性大小次序正确的是…………………………………………………()(A) S < N < O < F (B) S < O < N< F(C) Si < Na < Mg < Al (D) Br < H < Zn36. 在下列原子中第一电离能最大的是…………………………………………………………()(A)B (B)C (C)Al (D)Si37. 屏蔽效应起着……………………………………………………………()(A)对核电荷的增强作用(B)对核电荷的抵消作用(C)正负离子间的吸引作用(D)正负离子间电子层的排斥作用38. 某原子2P轨道上有两个电子,描述其中一个电子运动状态的四个量子数是(2,1,0,+½),则描述另一个电子运动状态的四个量子数是………………………………………………() A、(2,1,0,-½) B、(2,1,-1,-½)C、(2,1,1,-½)D、(2,1,1,+½)39. A、B、C为同周期相邻元素,A原子最外层主量子数n = 4,角量子数L=1的轨道为半充满,且电负性A<B<C,则A、B、C为…………………………………………………………()A、As, Se, BrB、N, O, FC、P, S, ClD、Ga, Se, As40. 下列化合物及离子中,中心原子不具有弧电子对的是…………………………………()(A)NH3(B)NH4+(C)H2O (D)OH-41. 在K[Co(NH3)2Cl4]中,Co的氧化数和配位数分别是…………………………………()(A) +2和4 (B) +4和6 (C) +3和6 (D) +3和442.Cu 的原子序数为29,Cu+的电子排布式为………………………………………()(A) [Ar] 3d10(B) [Ar] 3d5(C) [Kr] 4d10(D) [Ar] 3d94s1二、填空题1. 至今没有得到FeI3这种化合物的原因是______________________________________________。
2.将CoCl2水溶液不断加热,其颜色由红色Co(H2O)+26变成蓝色CoCl-24。
如果后者是四面体结构,按晶体场理论,两配离子中钴离子的d电子排布分别为:________________________________________和__________________________________。
