新药临床前研究内容有哪些方面
新药开发的临床前研究与评价

新药开发的临床前研究与评价临床前研究是指在新药开发过程中,药物在动物模型及体外细胞测试中的实验研究阶段。
这个阶段的研究主要包括药物的药代动力学、药物在体内的代谢途径、毒理学研究、安全性评价等内容。
正确的临床前研究对于新药在临床应用中的有效性和安全性至关重要。
本文将介绍新药开发的临床前研究与评价的重要性、方法和应用。
一、临床前研究与评价的重要性临床前研究是新药开发的关键一环,在药物研发的早期阶段就能够评估其安全性和有效性,为进一步的临床试验提供有效依据。
它的重要性主要表现在以下几个方面:1. 预测有效性:通过临床前研究,可以评估药物的有效性,即药物是否能够达到预期的治疗效果。
该评估能够帮助研发人员及时发现药物的潜在问题,并在药物设计阶段进行修正,提高药物研发的成功率。
2. 评估安全性:临床前研究能够全面评估药物的毒性及可耐受性。
特别是在动物模型中进行的实验研究可以帮助研究人员发现药物的不良反应、毒性和副作用等问题,有效减少新药在临床应用中的风险。
3. 确定剂量:临床前研究可以帮助确定药物的最佳剂量范围,从而保证药物在治疗过程中的有效性和安全性。
通过动物模型和体外试验,可以评估药物的药代动力学和药效学参数,为临床应用提供指导。
二、临床前研究与评价的方法1. 药代动力学研究:药代动力学研究是评估药物吸收、分布、代谢和排泄等过程的实验研究。
通过药物在体内的代谢途径和动力学参数,可以预测药物在人体内的药效学特性,包括药物的生物利用度、半衰期等。
这些参数对于药物的剂量和用药方案的确定非常重要。
2. 毒理学研究:毒理学研究是评估药物在体内的毒性和不良反应的实验研究。
通过动物模型和体外试验,可以评估药物对组织器官的毒性和可逆性。
此外,毒理学研究还可以帮助确定药物的最大耐受剂量和安全剂量范围。
3. 安全性评价:安全性评价是评估药物在人体内的安全性和可耐受性的研究。
通过动物模型和体外试验,可以评估药物对人体的影响,包括心血管系统、消化系统和神经系统等方面。
新药临床前药理毒理研究的主要内容

➢阴性及阳性对照
2020/3/2
22
生殖毒性研究
❖Ⅰ段 一般生殖毒性试验
✓雌性受孕、分娩、活胎与死胎、外观、骨骼与内脏等 ✓雄性生育能力
❖Ⅱ段 致畸敏感期毒性试验 胚胎毒性和潜在的致畸性
❖Ⅲ段 围产期毒性试验 子代动物
2020/3/2
23
致癌性研究
创新药 ❖ 短期致癌试验
Effect Level
最小毒性反应剂量 最大耐受量(MTD):Maximal Tolerance Dose 最小致死剂量(MLD):Minimal Lethal Dose 半数致死量(LD50):Median Lethal Dose
2020/3/2
12
长期毒性研究
相关动物 给药途径 剂量 毒代动力学——药代研究在毒理学研究的延伸 阶段性——以不同给药期限的长期毒性研究来 分别支持药物进入Ⅰ 期、Ⅱ期或Ⅲ期临床试验 (生产)
物进行试验 4. 通常没有免疫原性 5. 要求进行遗传毒性研究 6. 要求进行代谢研究 7. 要求进行两年的致癌性试验 8. 有仿制品
2020/3/2
26
第二节 药物生殖和发育毒性作用
2020/3/2
27
2020/3/2
28
生殖过程
生殖细胞的发生形成 精 合子形成 着床 发育 分娩 哺乳
生殖毒性学 发育毒性学
试验研究和文献资料; 22、复方制剂中多种成份药效、毒性、药代动力 学相互影响的试验
资料及文献资料; 23、致突变试验资料及文献资料; 24、生殖毒性试验资料及文献资料; 25、致癌试验资料及文献资料; 26、依赖性试验资料及文献资料; 27、动物药代动力学试验资料及文献资料;
新药研究中的临床前研究

新药研究中的临床前研究近年来,随着医疗技术的迅速发展,新药的研究也日益受到重视。
然而,在一款新药能够到达临床阶段之前,需要经历一系列的临床前研究。
本文将探讨新药研究中的临床前研究的重要性及其具体内容。
一、临床前研究的重要性临床前研究是新药研究的基础,它的目的是在动物实验、体外实验以及体外研究中评估新药的安全性和有效性。
通过临床前研究,药物研发企业可以先行进行初步的筛选,减少药物研发过程中的时间、资金和人力资源的浪费。
此外,临床前研究还可以为临床试验的设计提供有力的依据,为研发成功提供更高的成功率。
二、临床前研究的内容1. 毒性实验毒性实验是临床前研究中重要的环节之一。
它通过对实验动物进行长期或短期的药物给予,观察和评估新药对生物体的毒性作用。
毒性实验主要包括急性毒性实验、亚急性毒性实验、慢性毒性实验等。
实验结果将评估新药的副作用和毒性程度,为进一步的研究提供重要参考。
2. 药代动力学研究药代动力学研究是针对新药在体内转化和分布的过程进行评估和研究的科学。
通过研究新药在动物体内的吸收、分布、代谢和排泄过程,药代动力学研究可以帮助科研人员了解新药的药物代谢途径、代谢产物以及药物在不同种类动物体内的行为差异等信息,为进一步的药物研发提供基础。
3. 疗效实验疗效实验是评价新药临床前研究的又一重要环节。
通过在动物模型中观察新药对某种疾病的疗效,科研人员可以初步判断新药的疗效和治疗潜力。
疗效实验的结果将为临床试验的设计提供依据,同时也为决定是否继续开展新药研究提供重要参考。
4. 安全性评估安全性评估是新药临床前研究中必不可少的一环。
通过对新药在动物体内的表面和内脏器官的影响评估,可以初步判断新药的安全性和潜在毒副作用。
安全性评估通常包括新药对心血管系统、神经系统、免疫系统等重要器官和系统的影响,以此为依据决定是否继续推进新药的研究。
三、新药研究中的临床前研究的挑战和前景临床前研究是一项复杂而艰巨的任务,它需要多个科研领域的专业知识和技能的综合运用。
新药临床研究各期内容及目的

新药临床研究各期内容及目的【新药临床研究各期内容及目的】一、前期研究1.1 预临床研究预临床研究是在实验室和动物实验基础上,对候选新药进行初步评估,包括药物代谢、药动学、毒性学等方面的评估。
1.2 临床前研究临床前研究是将候选新药应用于非人类对象,如细胞、动物等,评估其安全性、毒性、有效性等指标,进一步确定其在人体临床试验中的安全性和有效性。
二、临床试验阶段2.1 临床试验第一期临床试验第一期主要评估新药在健康志愿者中的安全性、耐受性和药动学特性,确定其适宜的剂量范围。
2.2 临床试验第二期临床试验第二期是在小规模患者中进行的,旨在进一步评估新药的有效性和安全性,确定其用药方案。
2.3 临床试验第三期临床试验第三期是在大规模患者中进行的,旨在充分评估新药的治疗效果、安全性和不良反应情况,为新药的上市申请提供充分的临床数据。
三、后期研究3.1 新药上市后研究新药上市后研究是指在新药上市后对其进行长期、大样本的监测,以评估新药在实际临床应用中的疗效和安全性。
3.2 优化研究优化研究是在新药上市后,根据实际应用情况,对其用药方案、剂量等进行进一步优化的研究。
【附件】本文档附件包括:2:研究报告撰写指南;3:伦理委员会审查表格;4:临床试验数据统计分析方法介绍;5:研究药物使用及剂量说明书。
【法律名词及注释】1:新药:指未经全球上市或本国市场批准销售的药物。
2:预临床研究:在正式进行临床试验之前,通过离体实验和动物实验评估新药的性质和效果。
3:临床前研究:在进行人体临床试验之前,通过动物模型等评估新药的安全性和有效性。
4:药代动力学:研究药物在体内的吸收、分布、代谢和排泄等过程。
5:毒性学:评估药物对生物体的毒性和危害性,包括急性毒性、亚急性毒性、慢性毒性等。
6:药物耐受性:指机体对药物的适应性和耐受能力。
7:有效性:指药物对治疗对象的治疗效果和疗效。
8:不良反应:指使用药物后出现的不良的生理或心理反应。
新药临床前研究内容有哪些方面

新药临床前研究内容有哪些方面新药的临床前研究是指在将药物应用于人类之前进行的各种实验室研究和动物试验。
其目的是评估药物的安全性和有效性,为进一步进行临床试验和上市应用提供科学依据。
新药的临床前研究内容包括以下几个方面:1.药物化学研究:这一方面的研究主要涉及药物的化学结构鉴定、合成路线设计、纯化和物理化学性质的测定等。
通过这些研究,可以确定药物的物化性质,并为后续药物研究提供基础。
2.药代动力学研究:药代动力学是指药物在体内的吸收、分布、代谢和排泄过程。
药代动力学研究的目标是了解药物在体内的动态变化规律,包括药物在体内的浓度变化、药物与受体的结合等。
通过药代动力学研究,可以确定药物的最佳给药途径、给药剂量和给药频次。
3.药物作用机制研究:药物作用机制研究主要是探索药物与生物体之间的相互作用机制。
通过研究药物与靶标的结合方式、药物对细胞信号传递的影响等,可以了解药物的作用机制,为药物的设计和优化提供依据。
4.药物安全性评价:药物的安全性评价是新药临床前研究中非常重要的一项内容。
包括体外毒性实验和体内毒性实验。
体外毒性实验通常采用细胞毒性实验和生化指标检测等方法,用于评估药物对细胞的毒性和损伤程度。
体内毒性实验则通过动物试验评估药物在体内的毒性反应和副作用。
5.药物药效学评价:药物药效学评价主要是评估药物的疗效和有效性。
通过进行动物模型实验,观察药物对疾病模型的治疗效果、改善生理指标等,以确定药物的有效性,并确定其适用范围和剂量。
6.药物稳定性评价:药物的稳定性评价是评估药物在不同条件下(如温度、光照、湿度等)的稳定性和降解情况。
通过稳定性评价,可以确定药物的储存条件和有效期限,以保证药物的质量。
7.药物制剂优化:药物制剂优化是通过改变药物的制剂、给药途径等来提高药物的溶解度、生物利用度和药效持续时间等。
通过对药物制剂的优化研究,可以提高药物的生物利用度和降低副作用,改善药物的临床疗效。
综上所述,新药的临床前研究内容十分广泛,涵盖了药物化学、药代动力学、作用机制、安全性评价、药效学评价、稳定性评价和制剂优化等多个方面。
新药临床前的实验方案的内容包括哪些

新药临床前的实验方案的内容包括哪些?
为申请药品注册而进行的药物临床前研究,包括药物的合成工艺、提取方法、理化性质及纯度、剂型选择、处方筛选、制备工艺、检验方法、质量指标、稳定性、药理、毒理、动物药代动力学研究等。
中药制剂还包括原药材的来源、加工及炮制等的研究;生物制品还包括菌毒种、细胞株、生物组织等起始原材料的来源、质量标准、保存条件、生物学特征、遗传稳定性及免疫学的研究等。
实验方案的主要内容如下:(一)研究专题的名称或代号及研究目的;(二)非临床研究机构和委托单位的名称及地址;(三)专题负责人和参加实验的工作人员姓名;(四)供试品和对照品的名称、缩写名、代号、批号、有关理化性质及生物特性;(五)实验系统及选择理由;(六)实验动物的种、系、数量、年龄、性别、体重范围、来源和等级;(七)实验动物的识别方法;(八)实验动物饲养管理的环境条件;(九)饲料名称或代号;(十)实验用的溶媒、乳化剂及其它介质;(十一)供试品和对照品的给药途径、方法、剂量、频率和用药期限及选择的理由;(十二)所用毒性研究指导原则的文件名称;(十三)各种指标的检测频率和方法;(十四)数据统计处理方法;(十五)实验资料的保存地点。
药理学临床前研究的内容

药理学临床前研究的内容药理学临床前研究是研究药物在体内的作用和药物与生物体之间的相互作用的学科。
它是新药开发的重要环节,旨在评估药物的疗效、安全性、药代动力学以及药效学等方面的特性,为药物的临床应用提供依据。
以下是药理学临床前研究的主要内容:1.药物的药理学研究:药物的药理学研究是药理学临床前研究的基础。
通过体内和体外实验,研究药物在机体内的作用机制、药物与受体之间的结合特性、药物的药效学特点等。
这些研究对于了解药物的作用方式、靶点以及药物剂量的选择具有重要意义,能为临床治疗提供理论依据。
2.药物的药代动力学研究:药代动力学研究药物在体内的吸收、分布、代谢和排泄规律。
这些过程对药物的疗效、副作用及药物相互作用等方面起着重要作用。
药代动力学研究可以从体内外实验中获得血药浓度-时间曲线,通过计算药物的药物动力学参数(如半衰期、最大浓度Cmax、作用持续时间等),进而预测药物在人体内的表现。
3.药物的安全性评价:药物的安全性评价是药理学临床前研究中的重要内容之一,旨在评估药物的毒性和不良反应。
通过体内和体外实验,研究药物的急性中毒作用、亚急性、慢性毒性以及致癌、致畸等长期效应。
安全性评价可提供用药时剂量的选择,以保证药物的安全性和疗效。
4.药物的药物相互作用研究:药物在体内会相互作用,可能导致药物的疗效增强或减弱,或者产生不良反应。
药理学临床前研究中的药物相互作用研究旨在评估药物与其他药物、食物或生物体的相互作用,例如通过体外实验研究药物代谢酶的相互作用,预测药物与药物之间的相互作用。
5.药物的代谢和排泄研究:药物在体内的代谢和排泄是药理学临床前研究中的重要内容。
通过体内和体外实验,研究药物在体内的代谢途径、代谢产物的特点以及主要的排泄途径。
这些研究对于了解药物在体内的代谢规律、剂量的选择和剂量调整等方面具有重要意义。
综上所述,药理学临床前研究是研究药物在体内的作用机制、药代动力学、药效学、安全性评价等方面的学科,为药物的临床应用提供理论依据。
临床前的各项研发工作总结

临床前的各项研发工作总结在医药领域,临床前的研发工作是非常重要的一环,它为新药的研发奠定了坚实的基础。
临床前研发工作包括药物发现、药物设计、药物筛选、药效评价等多个环节,每一个环节都至关重要。
在本文中,我们将对临床前的各项研发工作进行总结和分析。
首先,药物发现是临床前研发工作的第一步。
通过对疾病的深入了解和分子生物学、生物化学等领域的研究,科研人员可以发现新的靶点,并设计出具有潜在治疗作用的化合物。
这一阶段需要大量的实验室工作和科学研究,以确保新药的有效性和安全性。
其次,药物设计是临床前研发工作的关键环节。
在药物发现的基础上,科研人员需要进行药物的结构设计和优化,以提高药物的生物利用度和药效。
这一阶段需要利用计算机辅助设计、分子模拟等技术手段,对候选化合物进行筛选和优化,以确保最终的药物能够达到预期的治疗效果。
接着,药物筛选是临床前研发工作的又一重要环节。
在药物设计完成后,科研人员需要进行大量的体外和体内实验,对候选化合物进行筛选和评价。
这一阶段需要建立完善的实验体系和评价指标,以评估药物的活性、毒性和药代动力学等特性。
最后,药效评价是临床前研发工作的最后一步。
在药物筛选完成后,科研人员需要进行动物实验和临床前药效评价,以验证药物的治疗效果和安全性。
这一阶段需要严格遵守伦理规范和法律法规,确保实验的科学性和合法性。
总的来说,临床前的各项研发工作是新药研发过程中不可或缺的一部分。
通过药物发现、药物设计、药物筛选和药效评价等多个环节的努力,科研人员可以最终研发出安全有效的新药,为人类健康做出贡献。
希望未来能有更多的科研人员投身到临床前研发工作中,共同推动医药领域的发展和进步。
创新药物学 临床前药理研究

• 为了使动物实验结果尽量与人接近,开始时应多 选几种动物。用比较药效学的方法,对动物在不 同种动物中的反应做定性与定量比较。然后选择 最合适的动物模型来做实验。
➢ 有的反应只出现于动物,而有的反应只出现于人, 如甲醇对动物的毒性小,因为动物体内有甲醇转 变成低毒甲酸盐的特异性酶;二硝基酚对动物毒 性也很小,但1935-1337年美国将其作为减肥药在 治疗人的肥胖症是能引起人的白内障、骨髓抑制 甚至死亡。
• 应经统计学处理。结合客观实际恰当下结论。
二、主要药效学研究
主要药效学研究
一、内容
➢ 药效评价一方面是发现新药,另一方面是评选新 药。
• 发现新药就是用各种方法将原来作用不明的化合 物的有效药理作用暴露出来;
• 评选新药就是通过系列严密的科学设计将已发现 有效的药物的优缺点弄清楚,从而决定弃取。
目录
1
前言
2 临床前药理评价的基本要求
3 主要药效学研究
4 安全药理学研究
5 复方药理学研究
6
作用机制研究
一、临床前药理学研究的目的和主要内容
前言
临床前药理学研究的目的
➢ 判断一个新药是否有预防、治疗和诊断疾病的作 用,即是否有效,有效程度如何;
➢ 和已知现有药物比较有何特长; ➢ 通过药理作用机制的探讨为进一步了解药物作用
• 家兔对体温变化十分灵敏,适宜发热、解热等研 究;大鼠垂体-肾上腺功能发达,适宜作应急反应、 垂体、肾上腺等内分泌实验研究;豚鼠易于致敏。 适宜作过敏试验研究;鸭可用于引起白内障的药 物研究;鸽子能用于引起呕吐的药物试验;筛选 抗癌药物经常用一些特殊的小鼠;作用于皮肤的 药物则最好用小型猪。
新药临床研究

疗效标准
我国的4级评定标准:①痊愈(cure)症状、体征、检查、特异指标等4项指标恢复正常;②显效(markedly improvement)尚有一项未恢复正常;③进步(improvement)2项未恢复正常;④无效(failure)治疗3天后患者无改善,反而加重。 有效(率) = 痊愈+显效
双盲法(double blind method) 试验者和受试者双方均不知所用的药物是受试药还是对照药。避免试验者与受试者主观偏因的影响。
双盲、双模拟法(double-b1ind,double-dunmy trial technique) A药组加B药安慰剂,B药组加A药安慰剂,则两组均分别用一真一假两种药,外观与气味均无不同
安全指标
不良事件(异常症状、体征、检查或特殊检查) ①是否符合此类药常见不良反应类型;②与用药发生的时间关系;③停药后是否缓和;④复用时是否重现;⑤排除其他非药物因素(原发病、并发症、合并用药…)
不良事件相关5级标准: ①肯定有关:合理的时间顺序,符合药物已知反应类型,减停反应消失,能排除其他因素;②很可能有关:减停反应明显改善;③可能有关:减停反应有改善,不能排除其他因素;④可能无关:不太合理的时间顺序,不太符合药物已知反应类型,减停后反应改善不明显,非药物因素可解释该反应;⑤肯定无关:不符合时间顺序,不符合药物已知反应类型,减停后反应无改善,非药物因素去除后反应明显减轻。①-③为不良反应。
2、初始剂量的确定 一般可用同类药物临床治疗量的1/10开始。 新类型新药可用下列方法: (1)Blach well法: 敏感动物 LD50的1/600或最低有毒量的 1/60 (2)改良Blach well法 (考虑安全性): 两种动物急毒试验 LD50的1/600 及两种动物长期毒性实验中出现毒性剂量的 1/60 以四者中最低者为起始剂量 (3)Dollry法 (考虑有效性): 最敏感动物最小有效量的 1/50-1/100
新药临床前研究内容有哪些方面

新药临床前研究内容有哪些方面新药临床前研究内容包括以下方面:1.药物研发目的和背景详细介绍研发该药物的目的和研究背景。
2.化学特性研究对该药物的化学特性进行研究,包括物理性质、化学结构等。
3.药物药代动力学研究对该药物在体内的吸收、分布、代谢和排泄等药物动力学特性进行研究。
4.药物毒理学研究对该药物的毒性进行研究,包括急性毒性、慢性毒性、致癌性、生殖毒性等。
5.药物药效学研究通过动物模型研究该药物的药效,评估其治疗效果和副作用。
6.药物安全性评价研究对该药物的临床试验前的安全性进行评价,包括药物的耐受性、不良反应等。
7.药物制剂研究根据该药物的特性,研究合适的药物制剂形式,如片剂、胶囊等。
8.药物稳定性研究对该药物在不同条件下的稳定性进行研究,包括温度、湿度等因素对药物的影响。
9.药物生物利用度研究通过动物模型研究该药物在体内的生物利用度,评估其在体内的有效浓度。
10.药物与体液的相互作用研究研究该药物与血浆蛋白、细胞膜等体液成分的相互作用,评估其药物效应的影响。
11.药物相容性研究研究该药物与其他药物、食物等的相容性,评估其联用和食物干扰的影响。
12.药物贮存条件研究研究该药物在不同贮存条件下的稳定性和有效性,确定合适的贮存条件。
附件:本文档涉及的附件包括:1.化学特性研究数据表2.药物动力学研究报告3.毒理学研究报告4.药效学研究数据表5.安全性评价报告6.制剂研究报告7.稳定性研究报告8.生物利用度研究报告9.相互作用研究数据表10.相容性研究报告11.贮存条件研究报告法律名词及注释:1.临床前研究:指在进行人体临床试验前,对药物进行的一系列实验和研究。
2.药物动力学:研究药物在体内的吸收、分布、代谢和排泄等过程。
3.慢性毒性:指长期接触某种物质所导致的毒性效应。
4.致癌性:指某种物质可能引起癌症的能力。
5.生殖毒性:指某种物质对生殖系统及其功能的影响。
6.药效:指药物在体内产生的治疗效果。
新药临床前药理毒理研究的主要内容

致癌性研究
总结词
致癌性研究旨在评估新药是否具有潜在的致 癌作用。
详细描述
致癌性研究采用动物模型,通过观察新药对 动物肿瘤发生率的影响,对新药的致癌性进 行评估。同时,还需要对新药的化学结构、 代谢产物以及致癌机制等方面进行研究和分 析。
04
CATALOGUE
安全药理学研究
心血管系统安全性评价
要点一
详细描述
生殖系统安全性评价旨在评估新药对生殖系统的潜在 影响。通过观察新药对性激素水平、生殖器官形态和 功能等指标的影响,可以初步判断新药是否可能引发 生殖系统的不良反应。这些数据有助于为临床试验提 供安全依据,保护受试者的生殖健康。
05
CATALOGUE
临床前综合评价与新药申报
数据汇总与分析
汇总药理、毒理、药效学等数据
新药临床前药理毒理研究 的主要内容
汇报人:
202X-01-06
CATALOGUE
目 录
• 药效学研究 • 药代动力学研究 • 毒理学研究 • 安全药理学研究 • 临床前综合评价与新药申报
01
CATALOGUE
药效学研究
药物作用机制研究
01
药物作用靶点
确定新药的作用靶点,了解药物 如何与靶点相互作用,从而发挥 治疗作用。
急性毒性研究
总结词
急性毒性研究旨在评估新药在单次给 药后短期内对生物体的毒性作用。
详细描述
急性毒性研究通常采用动物模型,通 过观察给药后动物的行为、生理指标 、生化指标以及组织病理学变化,对 新药的毒性进行初步评估。
长期毒性研究
总结词
长期毒性研究旨在评估新药在多次给药 后对生物体的长期毒性作用。
详细描述
神经系统安全性评价是新药临床前药理毒理 研究的重要组成部分。通过观察新药对行为 、认知、运动等功能的影响,可以初步判断 新药对神经系统的潜在风险。这些数据有助 于预测新药在临床试验中可能引发的神经系
临床前研究

临床前研究一、概述在药物研发过程中,临床前研究是一个至关重要的阶段。
临床前研究主要包括药物的发现、药效评价、毒性学评价等内容,是确保新药安全有效上市的前提。
本文将从临床前研究的定义、意义、常见方法和重要性等方面进行阐述。
二、临床前研究的定义临床前研究是指在将新药用于临床治疗之前所进行的一系列综合性研究,旨在确定新药的药效、毒性、药代动力学特征等,为新药的安全性和有效性提供实验依据。
三、临床前研究的意义临床前研究是药物研发过程中的重要环节,其意义主要包括以下几点:1.筛选优秀的药物候选物: 通过临床前研究,可以筛选出具有潜在疗效的药物候选物,从而减少后续临床试验的失败率。
2.确定药效和剂量: 临床前研究可以帮助确定药物的药效和最佳剂量,为临床试验的设计提供依据。
3.评估毒性和安全性: 临床前研究可以评估药物的毒性和安全性,避免潜在的不良反应风险。
4.优化药物的药代动力学特性: 通过临床前研究,可以优化药物的代谢、吸收、分布、排泄等药代动力学特性。
四、临床前研究的常见方法1.体外研究: 包括药物筛选、药效评价、毒性评价等实验室研究。
2.动物试验: 在小鼠、大鼠、狗等动物模型上进行药物的毒性、药代动力学特性和效力研究。
3.体外-体内相关性研究: 结合体外实验和动物试验,评估药物在体内的作用。
五、临床前研究的重要性临床前研究在药物研发过程中起着至关重要的作用,其重要性主要表现在以下几个方面:1.保障患者安全: 通过临床前研究,可以尽早发现药物的潜在风险,保障患者的安全。
2.提高药物研发效率: 临床前研究可以帮助提前筛选出不合格的药物候选物,减少研发过程中的时间和成本。
3.指导临床试验设计: 临床前研究的结果可以为临床试验的设计提供数据支撑,提高临床试验的成功率。
4.促进药物研发进程: 临床前研究是药物研发的前提和基础,对推动药物研发进程具有重要意义。
六、结论综上所述,临床前研究是药物研发过程中不可或缺的一环,其对于新药的安全性和有效性至关重要。
药物临床前研究范文

药物临床前研究范文药物临床前研究是指在将新药物推向临床试验之前进行的一系列研究,目的是评估新药物的药效、毒性、安全性等方面的特性,为进一步的临床研究和上市提供必要的依据。
这些研究包括体外实验、体内实验和动物实验等。
下面将详细介绍药物临床前研究的内容和重要性。
1.药物化学特性研究:包括对化学结构的分析、合成方法的研究、药物的纯度和稳定性等方面的研究。
这些研究可以确保药物的质量和有效性。
2.药物药理学研究:通过体外和体内实验,评估药物的作用机制、药理学特性和活性。
这些研究可以揭示药物对人体的作用方式,为进一步的研究提供理论基础。
3.药物动力学研究:通过体内实验和动物实验,研究药物的吸收、分布、代谢和排泄等药物动力学特性。
这些研究可以确定药物在人体内的命运和代谢途径,为合理设计用药方案提供依据。
4.药物毒理学研究:通过动物实验,评估新药物的毒性和安全性。
这些研究可以发现潜在的毒副反应和安全问题,防止不良事件的发生。
1.为临床试验提供依据:药物临床前研究可以全面评估新药物的药理学特性、药代动力学特性和毒性安全性等方面的信息,为决定是否进行临床试验提供依据。
2.优化药物设计:通过药物临床前研究,可以获取关于药物的吸收、分布、代谢和排泄等信息,从而优化药物设计,提高药物的疗效和治疗安全性。
3.预测临床疗效:药物临床前研究可以通过体外和动物实验,评估药物的活性和作用机制,根据这些信息可以预测药物在人体内的疗效。
4.预测不良反应:药物临床前研究可以通过动物实验评估药物的毒性和安全性,发现可能的不良反应和风险,从而提前预防和管理药物的毒副反应。
总结起来,药物临床前研究是一项非常重要的工作,在将新药物推向临床试验之前,对新药物的药理学特性、药代动力学特性和毒性安全性等进行全面评估,为进一步的临床研究提供重要依据。
药物临床前研究的目的是优化药物设计,预测药物疗效和不良反应,并为合理应用新药物提供科学的依据。
药理学临床前研究的内容

药理学临床前研究的内容作为你的文章写手,我将以药理学临床前研究的内容为主题,为你撰写一篇深度且广度兼具的中文文章。
1. 介绍药理学临床前研究的背景和重要性药理学临床前研究是指在将新的药物应用于人体之前的一系列实验和研究工作。
这个阶段的研究对于保证药物的安全性、有效性以及药物在人体内的作用机制的理解非常重要。
药理学临床前研究的内容主要包括药物的药理学性质、药代动力学、毒理学、药物相互作用等方面的研究。
这些研究为药物的临床应用提供了必要的依据,能够减少潜在的药物风险,保证药物的治疗效果。
2. 药理学临床前研究的主要内容和方法在药理学临床前研究中,药物的药理学性质是一个重要的研究内容,它包括药物的药效学、药物的作用机制、药物对人体的影响等。
药物的药效学研究主要考察药物的治疗效果和安全性,并确定适当的给药途径和剂量。
药物的作用机制研究则关注药物与生物体内靶点的相互作用,以揭示药物在分子水平上的作用原理。
药物对人体的影响研究还包括药物的药代动力学、组织分布、毒性学等方面的内容。
在药理学临床前研究中,常用的研究方法包括体外实验、动物实验和计算机模拟等。
体外实验可以提供药物在体外的活性测定和细胞水平上的机制研究。
动物实验是进行药物的毒性研究和药效学评估的重要手段,通过选择适当的动物模型进行实验,从而预测药物在人体内的表现。
3. 药理学临床前研究的意义和前景药理学临床前研究对于新药研发的成功非常重要。
通过深入了解药物的作用机制和影响因素,可以更好地设计和优化新药的结构。
药理学临床前研究还可以提供药物与其他药物的相互作用信息,以避免药物间的不良相互作用。
未来,药理学临床前研究将更加注重创新技术的应用和研究方法的改进。
计算机模拟和虚拟筛选等技术已经成为研究药物和作用机制的重要手段,并在研究和开发新药方面发挥了重要作用。
基因编辑和细胞技术的发展也将为药理学临床前研究提供更加精确和个性化的研究平台。
4. 对药理学临床前研究的个人观点和理解药理学临床前研究在新药研发中起着关键的作用,为药物的安全和有效性提供了重要的依据。
新药临床前药理毒理研究的主要内容

三、药理毒理研究资料
16、药理毒理研究资料综述; 17、主要药效学试验资料及文献资料; 18、一般药理研究的试验资料及文献资料; 19、急性毒性试验资料及文献资料; 20、长期毒性试验资料及文献资料; 21、过敏性(局部、全身和光敏毒性)、溶血性和 局部(血管、皮肤、
粘膜、肌肉等)刺激性等主要与局部、全身给 药相关的特殊安全性
Effect Level
最小毒性反应剂量 最大耐受量(MTD):Maximal Tolerance Dose 最小致死剂量(MLD):Minimal Lethal Dose 半数致死量(LD50):Median Lethal Dose
2020/3/2
12
长期毒性研究
相关动物 给药途径 剂量 毒代动力学——药代研究在毒理学研究的延伸 阶段性——以不同给药期限的长期毒性研究来 分别支持药物进入Ⅰ 期、Ⅱ期或Ⅲ期临床试验 (生产)
脏器系数:12项 组织病理学检查:30项(非啮齿类33项) 恢复期
2020/3/2
15
局部用药特殊毒性研究
刺激性 给药部位的可逆性炎症改变
过敏性(变态反应或超敏反应)
特异性免疫反应,表现为组织损伤或生理功能紊乱,异常或病理性的
Ⅰ型,快发或速发过敏型,IgE介导 Ⅱ型,细胞毒型或溶细胞型,IgG介导 Ⅲ型,免疫复合物型或血管炎型,IgG、IgM介导 Ⅳ型,迟发型或结核菌素型,T淋巴细胞介导 光敏性
二、药学研究资料
7、药学研究资料综述; 8、原料药生产工艺的研究资料及文献资料;制剂处 方及工艺的研料及文献资料; 10、质量研究工作的试验资料及文献资料; 11、药品标准草案及起草说明,并提供标准品或者对 照品; 12、样品的检验报告书; 13、辅料的来源及质量标准; 14、药物稳定性研究的试验资料及文献资料; 15、直接接触药品的包装材料和容器的选择依据及质 量标准;
药物临床研究的内容

药物临床研究的内容药物临床研究是指通过对人体进行临床观察和实验研究,评价药物的安全性和有效性,为药物的上市和应用提供科学依据。
药物临床研究的内容丰富而复杂,包括研究设计、样本选择、药物给药、研究结果分析等多个方面。
本文将围绕药物临床研究的内容展开论述。
一、研究设计研究设计是药物临床研究的起点和基础,决定了研究的科学性和可靠性。
常见的研究设计包括随机对照试验、非随机对照试验、开放试验等。
在研究设计中,需要明确研究的目的、研究对象、研究方法和评价指标等,以确保研究的可行性和准确性。
二、样本选择样本选择是药物临床研究的重要环节,直接影响研究结果的可靠性和推广性。
研究中的样本应具备代表性,通常采用随机抽样的方法进行选择,以减少选择偏差。
此外,样本的数量也需要经过合理计算,以保证研究结果的统计学意义和临床应用价值。
三、药物给药药物给药是药物临床研究的核心内容之一。
不同药物具有不同的给药途径和剂型,如口服、注射、贴皮等。
给药方法的选择需要考虑药物的特性和疾病的特点,以确保药物在体内的吸收、分布、代谢和排泄等过程符合研究的需要。
四、研究结果分析研究结果分析是药物临床研究的重要环节,对评价药物的安全性和有效性具有决定性影响。
在分析研究结果时,需要运用统计学的方法进行数据处理和解读,以获取可靠和科学的结论。
常见的研究结果分析方法包括描述性统计分析、方差分析、生存分析等。
在药物临床研究中,还需要充分尊重病患的知情同意和隐私保护,确保研究的伦理合规性。
此外,研究过程中还需要进行系统的文献查阅和数据收集,以增加研究的可信度和可靠性。
综上所述,药物临床研究的内容包括研究设计、样本选择、药物给药和研究结果分析等多个方面。
只有在这些内容的科学规范下,才能获得具有科学依据的药物临床研究结果,为新药的上市和应用提供可靠和有效的支持。
随着医学科技的不断进步,药物临床研究的内容也在不断发展和完善,为改善人类健康提供了有力的保障。
药物的临床前研究和临床研究管理
第四章 仪器设备和实验材料
第九章 附则
第五章 标准操作规程
三、GLP和GCP
(二)《药物临床试验质量管理规范》
GCP:Good Clinical Practice 2003年6月4日经SFDA通过,自2003年9月1日起施行。
目的
为保证药物临床试验过程规范,结果科学可靠, 保护受试者的利益,并保障其安全 。
二、药物的临床研究
(二)药品注册中需要进行临床研究的情况
申药T请注ehxet新册rein •必须进行临床试验
•
一般不需要进行临床试验;需要进行临床试验的:化学 药品一般进行生物等效性试验;需要用工艺和标准控制
药品质量的药品,应当进行临床试验
申请仿制 药注册
申请进口 •按照国内相应药品注册类别要求进行临 药品注册 床试验。
•已上市药品增加新的适应症或者生产工艺等 药品补
有重大变化的,需要进行临床试验
充申请
二、药物的临床研究
(三)药物临床试验场所
药物临床试验批准后,申请人应当从 具有药物临床试验资格的机构中,选择承担 药物临床试验的机构,商定临床试验的负责 单位、主要研究者及临床试验参加单位。
二、药物的临床研究
(四)药物临床试验方案的备案
包括临床试验和 生物等效性试验
二、药物的临床研究
(一)临床试验的分期及最低病例数要求
Ⅰ期临 床试验
初步的临床药 理学及人体安 全性评价试验 最低病例数:
20至30例
IV期临
III期临
床试验
II期临
床试验
床试验
•新药上市后由申
•治疗作用确证 阶段;
请人进行的应用 研究阶段
•治疗作用初步评 •进一步验证治 •考察广泛使用药
新药临床前研究内容有哪些方面

. 问:新药临床前研究内容有哪些方面?新药临床研究分为几期,各期研究的目的
是什么?
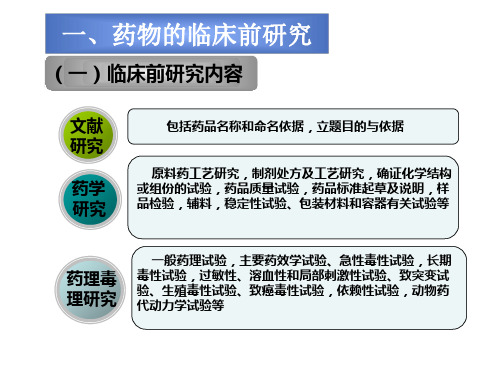
答:一、新药临床前研究内容:
1、文献研究(药品名称和命名依据,立题目的与依据)
2、药学研究(原料药工艺研究、制剂处方与工艺研究等)
3、药理毒理研究(一般药理实验、主要药效学实验、急性毒性实验、长期毒性实验等)
二、新药临床研究的分期及研究目的:
I 期临床试验(安全性):初步的临床药理学及人体安全性评价试验。
观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据。
II 期临床试验(有效性):治疗作用初步评价阶段。
其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量方案的确定提供依据。
此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。
III 期临床试验:治疗作用确证阶段。
其目的是进一步验证药物对目标适应症患者的
治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。
试验一般应为具有足够样本量的随机盲法对照试验。
IV 期临床实验:新药上市后应用研究阶段。
其目的是考察在广泛使用条件下药物的疗效和不良反应,评价在普通或特殊人群中使用的利益与风险关系一级改进给药剂量等。
生物等效性试验,是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验。
'.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问:新药临床前研究内容有哪些方面?新药临床研究分为几期,各期研究的目的是什么?
答:一、新药临床前研究内容:
1、文献研究(药品名称和命名依据,立题目的与依据)
2、药学研究(原料药工艺研究、制剂处方与工艺研究等)
3、药理毒理研究(一般药理实验、主要药效学实验、急性毒性实验、长期毒性实验等)
二、新药临床研究的分期及研究目的:
I 期临床试验(安全性):初步的临床药理学及人体安全性评价试验。
观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据。
II 期临床试验(有效性):治疗作用初步评价阶段。
其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量方案的确定提供依据。
此阶段的研究设计可以根据具体的研究目的,采用多种形式,包括随机盲法对照临床试验。
III 期临床试验:治疗作用确证阶段。
其目的是进一步验证药物对目标适应症患者的
治疗作用和安全性,评价利益与风险关系,最终为药物注册申请的审查提供充分的依据。
试验一般应为具有足够样本量的随机盲法对照试验。
IV 期临床实验:新药上市后应用研究阶段。
其目的是考察在广泛使用条件下药物的疗效和不良反应,评价在普通或特殊人群中使用的利益与风险关系一级改进给药剂量等。
生物等效性试验,是指用生物利用度研究的方法,以药代动力学参数为指标,比较同一药物的相同或者不同剂型的制剂,在相同的试验条件下,其活性成分吸收程度和速度有无统计学差异的人体试验。
