药品停售通知单
药品质量查询制度

药品质量查询制度1.质量查询是指对药品进、存、销等各环节中所发现的有关药品质量问题,向供货企业提出关于药品质量及其处理的调查与追询的文书公函,以及进货单位向公司进行的药品质量调查与追询。
2.本制度适用的范围:进货验收、储存养护、发货复核、运输等环节发生的药品质量查询。
3、进货验收时,对来货不符合法定标准或合同质量条款的,应将药品暂存在待验区,并于到货日起3个工作日内,向供货方发出质量查询函件。
待接到供货方回复后,按回复意见进行相应处理。
4.储存养护环节药品的质量查询:4.1若发现药品有质量问题,应及时标黄色标牌,填写“药品停售通知单”,暂停发货及门店销售,通知质管部进行复查;4.2复查确认无质量问题的药品,应签发“解除停售通知单”,去除待验标志,恢复发货并通知储运部;4.3复查确认药品存在质量问题时,应将药品移至不合格药品区,标示不合格品标志(红色标牌),并于质量确认后5个工作日内,向供货企业提出质量查询。
5.出库、复核、运输环节药品的质量查询:5.1在对已发送药品的质量跟踪、调查访问过程中,发现药品存在质量问题,应立即通知销售部、开票室和储运部暂停发货与销售,等待复查;5.2经复查确认不存在质量问题时,立即通知销售部、开票室和储运部发货与销售;质量不合格时,应及时通知销售部和储运部召回该批号药品,并向供货方联系质量查询及退货事宜;5.3在用户投诉中反映的药品质量问题,应按“质量投诉管理制度”进行相应处理,然后根据具体情况进行质量查询。
6.对外质量查询方式,可以传真或电子邮件方式通知供货企业,然后在5个工作日内将加盖本企业原印章的查询原件邮寄给供货企业,并做好查询函件记录备查。
7.质量查询函件一式六联,分别为通知供货单位联、供货单位处理回复联、仓库备查联、验收待处理联、财务代账联、通知采购部联。
8.在药品有效期内发现药品有质量问题,应向供货企业进行质量查询,超过药品有效期限的药品一般不应再进行查询,但在购货合同中另注明条款的药品除外。
GSP记录表格2018-6月修改

岗位人员花名册员工健康检查汇总表编号: 年度: 年表---3 员工个人健康档案编号: 建档时间:表---4 培训计划一览表表---5 培训实施记录员工个人培训教育档案编号:设施设备一览表养护设备使用记录首营企业审批表合格供货方档案表编号: 建档时间:首营品种审批表药品拒收报告表---15 不合格药品报告表药品停售通知单年第号 :以下药品存在质量疑问, 请立即采取有效控制措施, 停止销售, 等待通知。
药品通用名称规格产品批号有效期生产日期生产企业经手人复核人停售原因年月日解除停售通知单年第号 :如下药品质量复查结果合格, 撤消年第号“药品停售通知单”, 请恢复正常出库发货及销售使用, 特此告知。
药品通用名称规格产品批号有效期生产日期生产企业经手人复核人停售原因年月日表---18 药品质量处理通知单不合格药品报损审批表表---20 不合格药品台帐药品拆零销售记录表药品陈列与储存环境条件自查记录表②尘埃度以“大、一般、合格”来表示, 肉眼可见尘土飞扬为“大”, 空调的为“合格”, 其余的为“一般”。
③污染物是指是否远离垃圾、污水等, 填“无”或“不合格”。
④严密度是指防鼠、飞虫等进入, 填“合格”或“不合格”。
⑤光照度是指是否受阳光直射, 有否采取遮阳措施等。
有采取的填写“合格”。
⑥串味药分开度, 有分开的填写“合格”, 否则填写“不近效期药品催销表中药饮片清斗、装斗复核记录药店质量管理制度执行检查考核表表---31 顾客意见及投诉受理卡药品陈列/储存环境温湿度记录表批准人: 见证人: 经手人:。
千方药品效期录错解除停售步骤

解除停售步骤
我们在做采购流程的时候,有时候会不小心把药品的有效期录错,导致商品处于暂停销售状态,如图
出现这个情况的时候我们要如何处理呢?
下面是操作的步骤:
1.首先在系统维护--超级用户--系统设置--录账设置下点GSP控制设置,并把里面的实效商品自动停售取消勾选。
然后保存。
2.GSP管理--不合格产品管理,然后打开药品停售通知单,如图
可以看到暂停销售的药品会自动生成一张停售通知单,如果没有找到单据的话,可以直接点添加来添加暂停销售的药品。
然后双击打开这个停售通知单,把负责人和经手人签字后并审核。
(注:审核会提示生成同价调拨单,这张单据不用管直接在其他--业务草稿中删除)
3.做解除停售通知单,直接点添加去选择要解除停售的药品。
并把负责人和经手人签字后并审核。
4.在库存管理下打开批号修改单,直接选择对应的药品把现有效期等改正确。
并过账即可。
某医药公司药品储存与养护、出库与运输操作规程

药品储存与养护、出库与运输操作规程目的:规范药品在库储存养护与出库运输过程,保证在库药品的安全和质量。
适用范围:适用于药品储存与养护、出库与运输操作管理。
责任部门:质量管理部、储运部药品入库操作规程:1、仓库保管员收到入库验收员签字的入库单后,应立即到待验区将药品与入库单所列内容逐项进行核对,对待入库药品的通用名称、规格、批号、数量等核对无误后,在入库单上签收,办理入库手续,并建立库存记录;2、仓库保管员在收货时,对货与单不符、质量异常、包装不牢或破损、标志模糊等情况,有权拒收,并填写“药品拒收报告单”报告质量管理部门进行处理;3、对办理了入库手续的药品,仓库保管员按规定将储存药品按剂型实行分类、专库(区)保管与储存:3.1药品与非药品、外用药与其他药品分开存放,易串味药品、危险品等应与其他药品分开存放;蛋白同化制剂、肽类等专门要求的特殊管理药品应当按照国家有关规定储存;拆除外包装的零件药品应当集中存放;不合格药品存放于不合格药品库(区);3.2在库药品实行色标管理,待验药品库(区)、退货药品库(区)为黄色;合格药品库(区)、待发药品库(区)、零货称取区为绿色;不合格药品库(区)为红色;4、仓库保管员在进行专库、分类存放的原则下,根据药品的质量特性对药品进行合理储存,并符合以下要求:4.1按包装标示的温度要求储存药品,包装上没有标示具体温度的,按照《中华人民共和国药典》规定的贮藏要求进行储存;4.2药品按温、湿度要求储存,冷库2~10℃,如其中有一个药品储藏要求为2~8℃时冷藏设备应设置为2~8℃。
阴凉库不得高于20℃,常温库0~30℃;储存药品相对湿度为35%~75%;5、搬运和堆垛应严格遵守药品外包装图式标志的要求,堆码高度符合包装图示要求,避免损坏药品包装;正确搬运堆码作业,轻拿轻放,严禁倒置;6、药品按批号堆码,不同批号的药品不得混垛,垛间距不小于5厘米,与库房内墙、顶、温度调控设备及管道等设施间距不小于30厘米,与地面间距不小于10厘米;7、销后退回药品,凭“销后退回通知单”收货,存放于退货药品库(区),并做好退货记录。
不合格处理流程
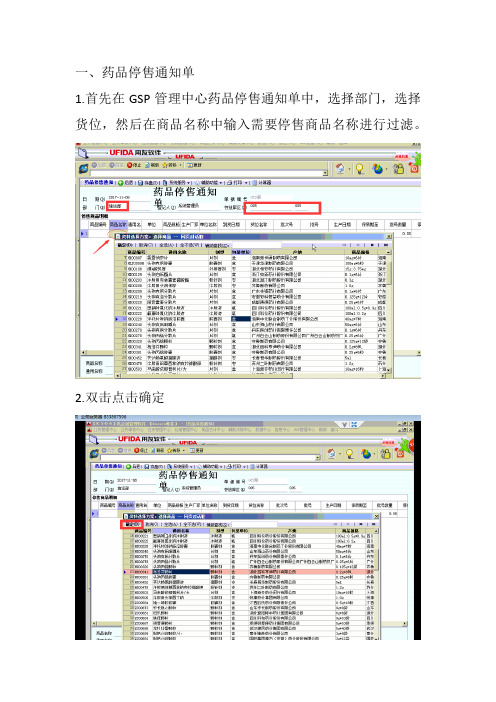
一、药品停售通知单
1.首先在GSP管理中心药品停售通知单中,选择部门,选择货位,然后在商品名称中输入需要停售商品名称进行过滤。
2.双击点击确定
3.明细落下来以后双击选择批次号
4.填写停售数量
例如我需要停售15个。
二、质量复查通知单
1.打开药品质量复查通知单,在辅助功能下面提取药品停售通知单。
2.找到要停售的药品双击选择。
3.填写复查原因,反馈人和日期,以及复查部门。
4.单据存盘
三、药品质量复查报告单
1.在gsp管理中心中找到药品质量复查报告单打开
2.在药品质量复查报告单表单上面如图点击提取质量复查通知单,找到复查过的商品。
3.填写复查结论与处理意见,审核人和审核日期。
然后保存单据。
四、不合格药品登记
1.在gsp管理中心中打开待处理药品登记。
2.在辅助功能下面提取质量复查后商品。
3.填写部门和不合格原因,然后存盘。
五、不合格药品登记审批
1.打开表单点击查询记录
2.选择处理意见和处理结果,然后填写审批人和审批意见
3.选中单据,点击审批确认。
六、不合格药品报损审批表
1.提取不合格品
2.填写各部门意见,选择相关负责人,报告单位以及部门
3.存盘
七:不合格药品销毁申请
填写好信息点击存盘
不合格药品销毁审批
点击审批,填写经理意见,存盘结束。
药易通单体常用功能使用说明
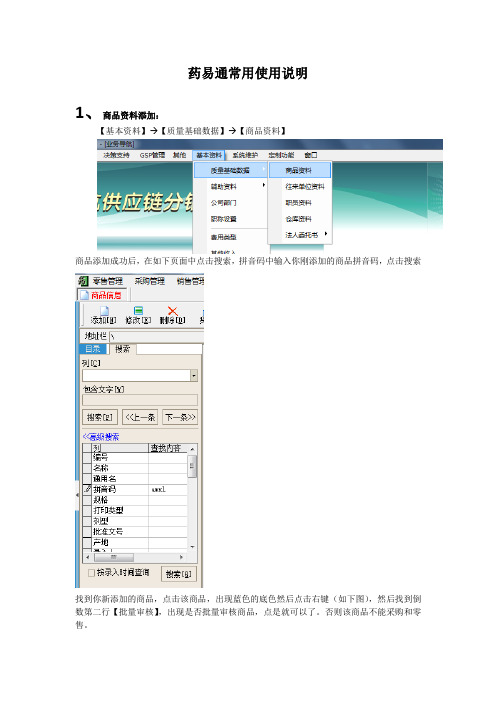
药易通常用使用说明1、商品资料添加:【基本资料】→【质量基础数据】→【商品资料】商品添加成功后,在如下页面中点击搜索,拼音码中输入你刚添加的商品拼音码,点击搜索找到你新添加的商品,点击该商品,出现蓝色的底色然后点击右键(如下图),然后找到倒数第二行【批量审核】,出现是否批量审核商品,点是就可以了。
否则该商品不能采购和零售。
2、供应商资料添加(即往来单位资料):【基本资料】→【质量基础数据】→【往来单位资料】新增的往来单位同样需要审核,审核方式同3、【基本资料】中常用到的一些设置GSP属性设置记得要加上{冷链} 这个属性(除非你店里没有冷链产品)经营范围和诊疗范围要填写完整4、批次禁销禁采设置,近效期禁销禁采设置以及特殊商品每单限量设置的位置在:【GSP管理】目录下的【其他设置】中。
5、系统用户添加、权限设置及密码修改:【系统维护】→【系统管理】→【用户口令及权限设置】6、药品养护及相关养护报表:【GSP管理】 【GSP历程】点击打开如图:双击打开《储存与养护》养护方面必做的几个表:a、重点养护药品品种确认表b、近效期药品催销月报表c、库存药品养护检查计划<针对批发>d、陈列药品养护检查计划<针对药店>e、药品养护档案卡f、药品停售通知单g、解除停售通知单各表的具体使用:重点养护药品品种确认表:点击重点养护药品品种确认表,然后点击<添加>按钮,出现下图点击右下角<重点养护药品>按钮,出现提示框,点<是>按钮。
哪些是重点养护的药品?这需要在商品资料里<养护>这个选项中选择的。
近效期药品催销月报表:点击近效期药品催销月报表,然后点击<添加>按钮,出现下图点击<向导>按钮,出现下图点击<下一步>这里全部不填,代表所有的仓库和货位,继续点<下一步>商品选择不填写代表所有商品,剂型选择所有剂型,库存数量填1 ,然后点击下一步。
药品验收程序

一、药品验收程序1、货到存放于待验区,清点件数。
2、验收员检查随货凭证,并根据随货凭证检查药品包装质量。
3、验收员打开包装检查药品品名、规格、生产企业、批号、数量、有效期等是否与随货凭证相符。
4、检查药品的标签说明书是否符合规定。
5、进口药品应检查有无浙江大宇医药有限公司质管科盖章的进口药品注册证,口岸检验报告书复印件或注明已抽样并加盖公章的进口药品通关单。
6、检查完符合规定要求的由验收员详细逐批、分类记录药品验收台帐。
7、验收检查中发现不合格药品由验收员填写医药商品拒收报告单,报药店质管员联系后退回磐安分公司,不合格药品移入待处理区,并记录不合格商品台帐。
验收员根据随货凭证货到处理区符合规定的检查品名规格、生产企业、批号、清点数量、检查包装质量有效期、数量是否与随货凭证一致符合规定上柜销售验收员填医药商品拒不合格收报告单报质管员记录不合格质管员与磐安及时退回磐药品不合格药品移商品台帐分公司联系后安分公司入待处理区馈单报药店质管员查询查询后仍无说明书的由验收员填医药商品拒收报告单后,及时退回磐安分公司二、药品养护程序1、养护员对柜台陈列药品按月循环检查养护。
2、养护员做好详细检查养护记录。
3、检查养护合格的继续销售。
4、养护过程中发现有问题药品摆放暂停销售标志牌并由养护员填写不合格商品确认表报质管员确认,确认为不合格的由养护员填医药商品停售通知单停止销售(不合格药品移入待处理区),并记录不合格商品台帐,由质管员联系后退回磐安分公司,确认为合格的药品摘除暂停销售标志牌,并开具解除停售通知单继续销售。
格继续销售柜台陈列药品按月养护放暂停报质管员确认由养护员填不合销售牌格商品确认表摘除暂停销售牌继续销售开具解除停售通知单由养护员填医药商品停售通知单停止销售记录不合格商品台帐不合格药品移入待处理区三、退货药品管理程序1、对于滞销药品由药店经理填进货退出通知单通知退出。
2、对于验收中发现的不合格药品由质管员联系后及时退回磐安分公司3、对于验收过程中发现货单不符的药品质管员应立即与磐安分公司联系并退回。
通知书之药品停售通知单

药品停售通知单
【篇一:药品停售通知单】
重庆乡乡通医药有限公司药品停售通知单
重庆乡乡通医药有限公司药品停售通知单
如下药品质量复查结果合格,撤消年月日“药品停售通知单”,请恢
质量管理员:
年月日
重庆乡乡通医药有限公司解除停售通知单
如下药品质量复查结果合格,撤消年月日“药品停售通知单”,请恢
质量管理员:年月日
重庆乡乡通医药有限公司解除停售通知单
如下药品质量复查结果合格,撤消年月日“药品停售通知单”,请恢
质量管理员:年月日
【篇二:药店药品停售通知单】
附表005
ⅩⅩ药店药品停售通知单
附表006
ⅩⅩ药店解除停售通知单
如下药品质量复查结果合格,撤消年号“药品停售通知单”,请恢质量管理员:年月日
ⅩⅩ药店不合格药品确认报告表
ⅩⅩ药店不合格药品报损审批表
ⅩⅩ药店药品质量档案表
附表013
ⅩⅩ药店质量信息汇总表
年
【篇三:药品停售、解除停售通知单】
药品停售通知单
年第号
解除停售通知单
年第号
如下药品质量复核结果合格,撤消年第号“药品停售通知单”,请恢复正常销售使用,特此告知。
不合格药品管理制度

不合格药品管理制度编号:SMP-FW-011-04范围:不合格药品的管理。
职责和权限:1.各部门在药品经营过程中发现质量可疑或存在质量问题的药品,应及时上报质量部确认,并根据确认结果进行处理。
2.储运部还要做好不合格药品的储存管理、报损和销毁等工作,并做好记录。
3.质量部负责不合格药品的确认,对不合格药品的处理过程实施监督。
受训人员:公司全体人员内容:1.存在质量问题的药品是指不合格的药品,包括假劣药品、包装质量不合格(包括包装、标签和说明书破损、污染、模糊、脱落、渗液、封条损坏等)的药品以及公司提前报损的药品。
2.质量可疑的药品是指在经营过程中发现可能存在质量问题但尚未经质量部门确认的药品。
3.不合格药品不得采购、入库和销售。
4.公司对质量不合格药品进行控制性管理,具体按照《不合格药品确认和处理操作规程》执行。
5.采购到货药品收货时,收货人员发现存在质量问题或质量可疑的药品,应当拒收,存放于待处理区或设置待处理状态标志,并及时填写《药品拒收报告单》,通知储运部并报质量部,按照《药品质量查询管理制度》向供货单位查询,明确质量责任后及时处理。
对于其中因包装破损拒收的,收货人员及时将拒收情况上报储运部采购人员,收货人员负责将拒收的药品退回供货单位,不需要质量部签署意见。
6.采购到货药品验收时,验收人员发现存在质量问题或质量可疑的药品,存放于待处理区或设置待处理状态标志,并及时填写《质量问题/质量可疑药品报告单》,通知储运部并报质量部,按照《药品质量查询管理制度》向供货单位查询,明确质量责任后及时处理。
7.销后退回药品验收时,发现存在质量问题或质量可疑的药品,验收人员应当及时填写《质量问题/质量可疑药品报告单》,上报质量部确认后处理;对于包装破损的问题,不需要填报。
8.储存、养护、出库过程发现存在质量问题或质量可疑的药品,储存、养护人员应立即在计算机系统中锁定,采取停售措施,并填写在库药品质量报告,上报质量部确认后处理。
GSP不合格药品质量管理程序

GSP不合格药品质量管理程序一、目的:通过制定实施不合格药品处理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。
二、适用范围:适用于不合格药品处理的全过程。
三、责任者:质量管理部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。
四、管理程序:1.在药品入库验收和退货药品验收过程中,验收员发现不合格品时,应:A、拒收,不得入库;B、填写“不合格药品报告单”,并报质量管理部确认;C、确认为不合格品的药品应存放于不合格品库,挂红牌标志;D、及时通知供货方,并按国家有关规定进行处理。
2.在检查、养护库存药品或出库复核过程中发现不合格品时,应:A、填写“不合格药品报告单”、并报质量管理部确认;B、确认为不合格品的,质量管理部应出具“不合格药品停售通知单”,立即停止销售,同时,按销售记录追回销出的不合格品;C、将不合格品移入不合格区,挂红牌标志。
3.上级药监部门抽查、检验判定为不合格品,或上级药监、药检部门公告、发文、通知查处不合格品时,应:A、立即停止销售,并按销售记录追回已售出的不合格品;B、将不合格品移入不合格品库(区),挂红牌标志。
4.不合格品的报损、销毁,应按以下规定进行:A、不合格品的报损由仓储部门填写“不合格药品报损审批表”,经报质量管理部门确认B、不合格药品报损后需作销毁处理时,应在质量管理部、综合办公室和其他有关部门的监督下进行,填写“报损药品销毁记录”。
销毁特殊管理药品时应经药品监督管理部门批准后监督销毁。
C、对质量不合格的药品,应查明原因,分清责任,及时制定和采取纠正和预防措施。
5.不合格药品的上报A、仓储部门应及时做好药品质量报损登记,并按季填写“不合格药品报损报表”送质量管理部统计汇总;B、公司质量管理部对不合格品情况每半年进行一次汇总,上报总经理。
6.记录要求A、记录应按规定及时、完整、逐项填写清楚,不得用铅笔填写,不得撕毁或任意涂改。
确实需要更改的,应在更改处加盖本人名章;B、签名、盖章必须用全名;记录、签名、盖章均用兰色或黑色或红色;C、不合格药品处理记录应保存五年。
通知书之药品召回通知单

通知书之药品召回通知单药品召回通知单【篇一:药品召回通知单】湖北鼎力药业有限公司(hbdl-rc-060)药品追回通知单编号:_______________公司:我公司对下列药品实施追回,请立即停止使用和销售该药品,并以最快的方式寄回我公司,并及时反馈药品从贵处走向情况,以便我公司完成对该药品追回。
以下是追回药品的相关信息。
公司地址:联系电话:传真:总经理:(签字)湖北鼎力药业有限公司(盖章)60【篇二:全国通用药品召回通知单】药品召回通知单单位:xxxxxx药业有限责任公司我公司于xxxx 年 xx 月 xx 日发往您处的药品(产品):xxxxxx注射液规格: 1ml:30mg/支、10支/盒批号:,存在质量问题,希望在接到本通知时,立即把已售出的药品(产品)收回,未售出的就地封存,并对已售出使用的药品(产品)采取下列补救或预防措施,我方将派人前往处理,特此通知。
补救或预防措施:根据反馈的情况,全部销售产品经销商均未售出,已通知客户及业务负责人该批次库存产品停止发货,就地封存,全部即刻召回。
xxxxxxxx有限公司xxxx 年 xx 月 xx 日【篇三:召回药品通知】召回药品通知年号由于原因,公司需对下列药品实行召回,请各部门配合做好召回工作。
1.销售部在收到通知即日起立即停止下列药品的销售;并根据销售记录立即通知相关客户,于月日前将下列药品退回。
2.采购部立即停止下列药品的采购,并挂黄牌积极与供应商协商处理事项。
3.储运部将下列药品的挂黄牌停止发货待处理,并做好退回药品的接收工作,将退货记录汇总,上报销售部、采购部和质管部。
质量管理部:日期:召回药品通知年号由于原因,公司需对下列药品实行召回,请各部门配合做好召回工作。
1.销售部在收到通知即日起立即停止下列药品的销售;并根据销售记录立即通知相关客户,于2.采购部立即停止下列药品的采购,并挂黄牌积极与供应商协商处理事项。
将退货记录汇总,上报销售部、采购部和质管部。
GSP认证不合格药品的确认及处理程序

1目的:通过制定不合格药品处理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。
2适用范围:适用于不合格药品处理的全过程。
3职责:3.1各有关部门、岗位人员负责对本部门或岗位,所发现的不合格药品情况向质管部门报告;3.2质量管理部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。
4不合格药品的范围界定按《不合格药品的管理制度》的规定来界定。
5不合格药品处理程序:5.1在药品入库验收和销后退回药品验收过程中,验收员发现不合格品时,应:5.1.1属购进药品的,拒收,不得入库;并填写“药品拒收报告单”。
5.1.2属销后退回的,填写“药品质量问题报告单”,报质量管理部确认;5.1.3确认为不合格品的药品应存放于不合格品库(区)。
5.2在检查、养护库存药品或出库复核过程中发现不合格品时,应:5.2.1填写“药品质量问题报告单”、并报质量管理部确认;5.2.2确认为不合格品的,质量管理部应出具“药品停售通知单”,立即停止销售,同时,按销售记录追回销出的不合格品;5.2.3将不合格药品移入不合格品库(区)。
5.3上级药监部门抽查、检验判定为不合格品,或上级药监、药检部门公告、发文、通知查处为不合格品时,应:5.3.1立即停止销售,并按销售记录追回已售出的不合格品;5.3.2将不合格品移入不合格品库(区)。
5.4销售过程发现的不合格品:5.4.1售后发现的不合格品,经质量管理部确认属不合格品的,如果还有库存药品,质量管理部应出具“药品停售通知单”,立即停止销售,同时,按销售记录追回销出的不合格品;5.4.2属质量投诉的,按《质量投诉管理制度》进行处理。
5.4.3将不合格药品移入不合格品库(区)。
6发现的不合格品应及时通知供货方,并按国家有关的规定进行处理。
7不合格品的报损、销毁,应按以下规定进行:7.1不合格品除符合退货或换货条件的,可进行退换货外,其余不合格品均应进行报损销毁,包括:7.1.1因本企业责任而导致的不合格药品;7.1.2属供货方责任而导致的不合格品,且供货方已委托本公司进行销毁的不合格品;7.2不合格品的报损由储运部填写“不合格药品报损审批表”,经部门经理审核批准后,报质管部确认和审核,公司分管领导批准后储运部执行处理;7.3不合格药品报损后需作销毁处理时,应在质量管理部的监督下进行,填写“报损药品销毁记录”。
医药行业相关表格模板

表7 合格供货方档案表
表8 药品质量档案表
注:材料附后。
注:材料附后。
表12 药品拒收报告单
表15 解除药品停售通知单
解除停售通知单
年月日
:
如下药品质量复查结果合格,撤销年第号“药品停售通知单”,请恢复正常出库发货及销售使用,特此通知。
药品通用名称规格
产品批号有效期
生产日期生产企业
经手人复核人
停售原因
质量管理员
年月日
(一式三联:质管员、柜组、采购各一联)
表14 药品停售通知单
药品停售通知
年月日
:
以下药品存在质量疑问,请即采取有效措施控制,停止销售,等待通知。
药品通用名称规格
产品批号有效期
生产日期生产企业
经手人复核人
停售原因
质量管理员
年月日
(一式三联:质管员、柜组、采购各一联)表16 药品质量处理通知单
表17 不合格药品报告表
表19 不合格药品报损审批表
表20 不合格药品销毁记录
表25 药品养护档案表
表27 药品列/储存环境温湿度监测记录表
表28 温湿度调控设施设备使用记录
表30 药品拆零销售记录表。
药品下架通知函

药品下架通知函尊敬的合作伙伴:您好!我们衷心感谢您长期以来对我公司的支持与厚爱,您的信任是我们前进的动力。
本着对消费者负责、确保市场药品安全的原则,我公司决定自即日起对部分药品进行下架处理。
现将具体情况通知如下:一、下架药品信息请您注意,以下药品将于通知发出之日起开始下架:1. 药品名称:XXX规格:XX生产批号:XXXXXX生产厂家:XXXXXX2. 药品名称:XXX规格:XX生产批号:XXXXXX生产厂家:XXXXXX(注:以上仅为部分下架药品信息,具体下架药品详情请参照附件。
)二、下架原因本次药品下架系因生产厂家在药品生产过程中发现潜在的质量风险,为确保广大消费者的用药安全,我公司决定主动对这些药品进行下架处理。
同时,我们将密切关注生产厂家的调查结果,一旦问题得到解决,我们会及时恢复销售。
三、相关措施1. 请您立即停止销售上述下架药品,并妥善处理库存,避免给消费者带来不便。
2. 请您配合我公司的相关工作,按照我公司要求的时间节点,将下架药品的相关信息反馈给我们。
3. 我公司将对下架药品进行召回,请您协助我们做好召回工作,确保消费者权益。
四、后续服务为确保您的利益,我公司将对此次下架药品给您带来的损失进行合理补偿。
具体补偿方案将在调查结束后第一时间通知您。
同时,我们将持续关注此次事件,及时向您通报相关进展。
如有疑问,请随时拨打我公司客服热线:XXXXXXXXXXX,我们将竭诚为您解答。
五、温馨提示请您务必重视此次药品下架通知,严格按照要求执行,共同维护药品市场秩序,确保广大消费者的用药安全。
再次感谢您对我们公司的支持与理解,我们将以此次事件为契机,加强管理,提高服务质量,为消费者提供更加安全、有效的药品。
敬请关注并相互转告,谢谢!顺祝商祺!贵公司名称日期:XXXX年XX月XX日附件:下架药品详细信息列表.xlsx。
