江苏省高一化学 周练九 镁 铝及其化合物
高一化学镁铝及其化合物试题答案及解析

高一化学镁铝及其化合物试题答案及解析1.下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。
已知:SiO2能和氢氧化钠反应,不和盐酸反应。
回答下列问题:(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有。
(2)固体A的主要成分是。
(3)进行操作Ⅱ时,为了达到分离要求,加入的NaOH应该。
(4)进行操作Ⅲ时,一般通入过量CO2,其反应的化学方程式是。
(5)溶液X和盐酸反应的离子方程式为。
【答案】(1)Fe3+、Al3+、H+(2)SiO2(3)过量(4)NaAlO2+2H2O+CO2====NaHCO3+Al(OH)3↓(5)HC+H+====H2O+CO2↑【解析】铝土矿中的Fe2O3、Al2O3溶于盐酸,得到的阳离子是Fe3+、Al3+,由于是酸性溶液,所以阳离子还有H+,过滤得到的滤渣是SiO2。
在进行操作Ⅱ时,需要加入过量的NaOH溶液,发生反应Fe3++3OH-====Fe(OH)3↓、Al3++4OH-====Al+2H2O,过滤分离出Fe(OH)3,利用NaAlO2弱酸盐的性质,制取Al(OH)3。
过滤后的滤液中含有NaHCO3和NaCl。
【考点】铝的氧化物与氢氧化物从铝土矿中提取铝2.除去镁粉中的少量铝粉,可选用()A.硫酸B.氨水C.盐酸D.氢氧化钠溶液【答案】D【解析】镁、铝都与硫酸、盐酸反应,都不与氨水反应;铝与NaOH溶液反应,而镁不反应,故选D。
【考点】铝及铝合金3.海水中含有氯化镁,是镁的重要来源之一。
下列从海水中提取镁涉及的化学方程式中,不正确的是()A.制石灰乳:CaO+H2O====Ca(OH)2B.制Mg(OH)2:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2C.制MgCl2:Mg(OH)2+2HCl====MgCl2+2H2OD.制Mg,在MgCl2溶液中加Na:MgCl2+2Na====2NaCl+Mg【答案】D【解析】氧化钙和水反应生成氢氧化钙,氢氧化钙溶解度小可以形成悬浊液,反应化学方程式为CaO+H2O====Ca(OH)2,故A正确;氯化镁和氢氧化钙反应生成更难溶的氢氧化镁沉淀:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2,故B正确;用氢氧化镁和盐酸可以制取MgCl2:Mg(OH)2+2HCl====MgCl2+2H2O,故C正确;在MgCl2溶液中加Na,钠是活泼金属,在水溶液中和水剧烈反应生成氢氧化钠和氢气,氢氧化钠和氯化镁反应生成氢氧化镁沉淀,得不到金属镁,金属镁一般用电解熔融氯化镁得到,故D错误。
镁铝及其化合物高考试题

镁铝高考试题1.〔2019年广东卷〕把Ba(OH)2溶液滴入明矾溶液中,使SO42ˉ全部转化成BaSO4沉淀,此时铝元素的主要存在形式是A、Al3+B、Al(OH)3C、AlO2ˉD、Al3+和Al(OH)32.铝镁合金因坚硬、轻巧、美观、干净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。
以下与这些用途无关的性质是〔〕。
A.不易生锈 B.导电性好 C.密度小 D.强度高3.(2019年全国)假设某金属跟足量盐酸充分反响,放出〔标准状况〕氢气,那么该金属是〔〕A.Al B.Mg C.Fe D.Zn4.〔2019年广东〕铊〔Tl〕是某超导材料的组成元素之一,与铝同族,位于第6周期。
Tl3+与Ag在酸性介质中发生反响:Tl3++ 2Ag ==Tl+ + 2Ag+。
以下推断正确的选项是A.Tl+ 的最外层有1个电子 B.Tl3+ 的氧化性比Al3+弱 C.Tl能形成+3价和+1的化合物 D.Tl+ 的复原性比Ag强5.〔2019年江苏〕氮化铝〔AlN〕具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。
在一定条件下,氮化铝可通过如下反响合成:Al2O3 + N2 + 3 C 高温 2 AlN + 3 CO 以下表达正确的选项是A.在氮化铝的合成反响中,N2是复原剂,Al2O3是氧化剂B .上述反响中每生成2 mol AlN ,N 2得到3 mol 电子C .氮化铝中氮元素的化合价为—3D .氮化铝晶体属于分子晶体6.(2019年江苏)向一定量的以下物质的溶液中逐滴参加氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解.这种物质是〔 〕A .MgS04B .NaAl02C .A1C13D .FeCl 37、〔2021年广东卷〕一样质量的以下物质分别与等浓度的NaOH 溶液反响,至体系中均无固体物质,消耗碱量最多的是A.AlB.Al(OH)3 Cl 32O 38、〔2019年天津〕〔14分〕锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。
高中化学专项训练镁铝附答案

高中化学专项训练《镁、铝》一、单选题1.下列关于镁及其化合物的叙述正确的是()A.H+与Mg反应产生气体,OH-与Mg反应产生沉淀B.Mg质地柔软,所以不适合制作高强度的合金材料C.Mg能在Cl2、CO中燃烧,说明不是只有Q才有助燃性D.Mg是金属,是电的良导体,所以Mg常被用来制造导线2.下列有关物质性质与用途具有对应关系的是()A.NaHCO s受热易分解,可用于制胃酸中和剂B.SiO2熔点高硬度大,可用于制光导纤维C.Al2O3是两性氧化物,可用作耐高温材料D.CaO能与水反应,可用作食品干燥剂3.下列化学方程式中,不能正确表达反应颜色变化的是()A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4=Cu+ZnSO4B.澄清的石灰水久置后出现白色固体Ca(OH)2+CO2=CaCO sJ+HOC.Na2O2在空气中放置后由淡黄色变为白色2Na2O2=2Na2O+O2fD.向Mg(OH)2悬浊液中滴加足量盐酸,悬浊液变澄清:Mg(OH)2+2HCl=MgCl2+2H2O4.下列各组离子一定能大量共存的是()A.加入铝粉有氢气产生的溶液中:Na>/、SO2—、Cl-、HCO「B.含有大量硝酸根离子的溶液中:H+、Fe2+、SO2—、Cl-C.使紫色石蕊试液变红的溶液:Fe2+、Md+、NO『、Cl-D.常温下pH=1的溶液中:MnO]、NOT、SO2-'Na>Fe3+5.碱式碳酸铝镁[Mg a Al b(OH)(CO s)xH2。
]常用作塑料阻燃剂,在一定条件下相关转化如下图所示。
下列说法正确的是()城式然酸华4小心吠L溶液皿服/一应|幻篌溶液N'I体。
川式八一回A.工业上用CO还原Al2O3的方法制取金属AlB.气体Q可能为NH3C.碱式碳酸铝镁用作阻燃剂是因为其分解吸收大量热且产生熔点较高的物质D操彳1为过滤,操作2为加热蒸发6.在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是()A.NaOH的浓度为0.6mol/LB.图中线段oa:ab=5:1C.在a点处溶液中的溶质为NaClD.在b点处溶液中的溶质只有Na[Al(OH)4]7.下列各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是()选项X Y Z箭头上为反应条件或试剂A Fe FeCl2FeCl3①通入少量Cl2B W2CO3NaCl NaHCO3②先通CO2,再通过量NH3—⑵Y.」EC MgO MgCl2Mg(OH)2③加热D NaAlO2Al(OH)3Al2O3④加水A.AB.BC.CD.D8.铝热反应的实验装置如图。
镁、铝及其重要化合物 专题训练及答案

镁、铝及其重要化合物专题训练及答案一、选择题(本题包括8小题,每题6分,共48分)1.易拉罐的主要成分以铝铁合金和铝镁合金最为常见。
现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是【解析】选D;铝、铁、镁三种金属中只有铝能与NaOH溶液反应产生无色气体,B错误;氢氧化镁与氢氧化铝均为白色沉淀,C错误;用盐酸溶解后生成的亚铁离子在空气中易被氧化成Fe3+,加入KSCN溶液呈红色,D正确。
2.把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示,下列叙述正确的是( )A.A点的沉淀物的化学式为Al(OH)3B.AB段发生的反应是Al3++3OH-Al(OH)3↓C.原混合物中MgCl2的质量是1.90 gD.AlCl3的质量是1.335 g【解析】选C。
在浊液中加入HCl溶液至10 mL,沉淀质量一直为1.16 g,说明浊液显碱性,A点的沉淀物是Mg(OH)2,A 错误;在AB段Al错误!未找到引用源。
,转变为Al(OH)3沉淀,B错误;原混合物中:m(MgCl2)=错误!未找到引用源。
×95 g·mol-1=1.90 g,C正确;根据AlCl3~Al错误!未找到引用源。
~HCl,n(AlCl3)=1 mol·L-1×(30-10)×10-3 L=0.02 mol,m(AlCl3)=0.02 mol×133.5 g·mol-1=2.67 g,D错误。
【加固训练】室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列说法正确的是( )A.a点,离子方程式为Al3++3OH-Al(OH)3↓B.a~b段,溶液pH增大,促进了氢氧化铝的碱式电离C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀D.d点时,Al(OH)3沉淀开始溶解【解析】选C。
2019高三化学(苏教版)一轮课时规范练:9钠、镁及其化合物.docx

课时规范练9钠、镁及其化合物(时间:45分钟满分:100分)-、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)1.下列事实及其解释不正确的是()A.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气B.用洁净的玻璃管向包有NazOz的脱脂棉吹气,脱脂棉燃烧,说明CO?、H2O与NazO?的反应是放热反应C.滴有酚瞅的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCOs分解生成了Na2CO3D.钠长期暴露在空气中的产物是NazCCh,原因是钠与氧气生成的Na2O与水和二氧化囁反应2.有关碱金属元素,下列说法正确的是()A.单质沸点随原子序数的递增而升高B.周期表第一列是第I A族元素,又称碱金属元素C.金属锂常用于制造锂电池,这跟它还原性强、密度小有关D.金属锂在空气中燃烧,产物是Li2O23.(2017辽宁鞍山一中一模)下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是()①金属钠投入FcCb溶液中②过量的NaOH溶液和明矶溶液反应③少量CaO投入过量的NaHCOs溶液中@Na26投入到CuSO4溶液中A.①③B.③④C.①④D.②③4.一块表面已被氧化为Na2O的钠块10.8各将其投入100 g水中,产生0.2 g的比,则被氧化的钠是()A.9.2 g B」0.6 g C.6.2 g D.4.6 g5.(2017北京中央民族大学附属中学周练)用等质量的金属钠进行下列实验,产生氢气最多的是()A.将钠放入足塑的稀盐酸中B.将钠放入足量的稀硫酸中C.将钠放入足量的氯化钠溶液中D.将钠用铝箔包好,并刺一些小孔,放入足量的水中6.(2017山西怀仁一中月考)在一定条件下,使CO和02的混合气体26 g充分反应,所得混合物在常温下跟足量的N^Ch固体反应,结果固体增重14 g,则原混合气体中和CO的质量比可能是()A.9 : 4 B」:1 C.7 : 6 D.6 : 77.(2018湖南师大附中月考)有关Na2CO3和NaHCCh的性质,下列叙述错误的是()A.相同温度下,等浓度的NazCOs和NaHCO3溶液的碱性比较,前者更强B.常温时水溶性:Na2CO3>NaHCO3C.在酒精灯加热的条件下,前者不分解,后者分解D.将澄清石灰水分别加入Na2CO3和NaHCCh溶液中,前者产生沉淀:后者无现象8.(2017河北衡水冀州中学期中)Na2O2是中学化学常用试剂,下列说法错误的是()A.0.1 mol Na2O2与足量CO2反应转移的电子的物质的量为0.1 molB.将Na2O2粉末加入到饱和NaOH溶液中,反应后溶液中OET浓度一定不变C.等物质的量的阻。
2019届高三化学《镁铝及其重要化合物》专题卷

镁铝及其重要化合物1.下列关于铝及其化合物的叙述正确的是()A.氧化铝坩埚可用于熔融NaOH实验B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氧化铝熔点很高,可作耐火材料D.明矾用作净水剂,可以除去废水中的铜离子答案 C2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。
反应中镁和铝的()A.物质的量之比为3∶2B.质量之比为3∶2C.摩尔质量之比为2∶3D.反应速率之比为2∶3答案 A3.下列各组物质能相互反应得到Al(OH)3的是()A.Al跟NaOH溶液共热B.Al(NO3)3跟过量的NaOH溶液反应C.Al2O3和水共热D.Al2(SO4)3和过量的氨水反应答案 D4.下列有关金属镁的说法不正确的是()A.Mg在CO2中燃烧生成MgO和C,是放热反应B.工业上通过电解MgCl2溶液制取金属镁C.Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率D.镁可以用来制造信号弹和焰火,MgO可以作耐高温材料答案 B5.下列物质组合中,既能和酸反应又能和碱反应的化合物共有()①(NH 4)2CO 3 ②Al 2O 3 ③Al 2(SO 4)3 ④Al ⑤NaHSO 3 ⑥Al(OH)3 A .3种 B .4种 C .5种 D .6种 答案 B6.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )答案 A7.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。
工业制备镓的流程如图所示。
下列判断不合理的是( )A .Al 、Ga 均处于第ⅢA 族B .Ga 2O 3可与盐酸反应生成GaCl 3C .Ga(OH)3可与NaOH 溶液反应生成NaGaO 2D .由流程图可知酸性:Al(OH)3>Ga(OH)3 答案 D8.工业上用铝土矿(主要成分为Al 2O 3,含SiO 2、Fe 2O 3等杂质)为原料冶炼铝的工艺流程如图所示。
高一化学镁铝及其化合物试题

高一化学镁铝及其化合物试题1.现有镁铝合金共3.9克,与500 mL 2 mol·L-1盐酸(足量)反应,生成的气体在标准状况下体积为4.48 L,若反应后所得溶液的体积仍为500 mL,求:(1)镁铝合金中铝的物质的量。
(2)镁铝合金中镁的质量分数。
(3)反应后溶液中Cl-的物质的量浓度。
【答案】(1)0.1 mol(2)30.8%(3)2 mol·L-1【解析】(1)4.48 L氢气的物质的量为=0.2 mol,令金属中Mg的物质的量为xmol、Al的物质的量为ymol,则:Mg+2HCl====MgCl2+H2↑,xmol xmol2Al+6HCl====2AlCl3+3H2↑ymol 1.5ymol所以,解得:x=0.05,y=0.1(2)3.9 g合金中Mg的质量为0.05 mol×24 g·mol-1=1.2 g,镁铝合金中镁的质量分数=×100%=30.8%;(3)Cl-没有参加反应,Cl-浓度不变,等于开始盐酸的浓度,故c(Cl-)="2" mol·L-1。
【考点】铝及铝合金2.实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。
发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是()A.Fe2O3和MnO2B.MnO2和V2O5C.Cr2O3和V2O5D.Fe3O4和FeO【答案】A、D【解析】 9 g铝粉可以提供1 mol电子,则氧化物中的金属元素每得到1 mol电子对应的质量就应该是18 g。
三价铁得到1 mol电子对应的质量为18.7 g,四价锰得到1 mol电子对应的质量为13.8 g,故A项正确。
五价钒得到1 mol电子对应的质量为10.2 g,三价铬得到1 mol电子对应的质量为17.3 g,B、C两项,即使9 g铝粉全部反应,得到金属单质的质量也不到18 g,故都错误。
高三复习镁铝及其化合物习题

铝及其化合物①__________________________________________ ②___________________________________________ ③_________________________________________________________________________________________ ④_________________________________________________________________________________________ ⑤_________________________________________________________________________________________ ⑥_________________________________________________________________________________________ ⑦_________________________________________________________________________________________ ⑧_________________________________________________________________________________________ ⑨________________________________________________________________________________________ ⑩________________________________________________________________________________________ ⑾_________________________________________________________________________________________ ⑿_________________________________________________________________________________________ ⒀_________________________________________________________________________________________ ⒁_________________________________________________________________________________________ 偏铝酸钠溶液与氯化铝溶液混合_______________________________________________________________ 偏铝酸钠溶液与碳酸轻钠溶液混合_____________________________________________________________ 硫酸铝溶液与碳酸氢钠溶液混合_______________________________________________________________② ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 2 AlCl 3 ⒀⒁【练习】1.有关铝和它的化合物的说法错误的是( )A.用于熔化烧碱的坩埚,可用Al2O3这种材料制成B.铝能在空气中稳定存在是因为其表面覆盖着一层氧化铝薄膜C.氧化铝是一种难熔物质,是一种较好的耐火材料D.氢氧化铝能中和胃酸,可用于制胃药2.镁粉在焰火、闪光粉、鞭炮中是不可少的原料。
苏教版 第一讲 镁和铝 镁的化合物 专项课堂练习 doc

第一讲镁和铝镁的化合物班级学号姓名等第.1. 镁和铝都是较活泼金属,下列叙述正确的是( )①镁易溶于冷水,而铝难溶于冷水镁溶于碱溶液,而铝难溶于碱液常温下镁难溶于浓硫酸,而铝易溶于浓硫酸镁易溶于氯化铵溶液,而铝难溶于氯化铵溶液A.①②B.③C.④D.全部2. 把铝粉和Fe3O4粉末配成铝热剂并分成两份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( )A.1∶1B.9∶8C.3∶4D.4∶33.下列说法正确的是( )A.铝在空气中耐腐蚀,所以铝是不活泼金属B.点燃的镁条插入盛二氧化碳的集气瓶中,迅速熄灭C.铝在高温下能还原锰、铁、铬等金属的氧化物D.因为镁和铝在空气中都能形成氧化膜,所以镁和铝都不溶于浓硝酸4. 对于铝和烧碱溶液的反应,下列说法不正确的是( ) A.铝是还原剂B.H2O是氧化剂C.NaOH与H2O是氧化剂D.偏铝酸钠是氧化产物5. 某无色溶液加入铝可以生成氢气, 则在该溶液中不可能大量存在的离子组是( )A.K+、Cu2+、NO3-、Cl-B.Na+、K+、SO42-、Cl-C.NH4+、K+、HCO3-、Cl-D.Na+、Ba2+、Br-、Cl-6.下列各金属的混合物2.5 g和足量的盐酸反应,放出的H2在标准状况下体积为2.24 L,其中可能的是( )A.Zn和Fe B.Mg和Zn C.Al和Mg D.Cu和Fe7.托盘天平两盘内分别放入一个质量相同的烧杯,烧杯里有200ml 1.00mol/L的盐酸,天平平衡。
向烧杯中分别加入下列各组中的两种金属(每个烧杯只放其中一种金属),反应结束后,天平仍保持平衡的是( )A.8g Mg和8g Zn B.1g Mg和1g ZnC.0.1mol Mg和0.1mol Zn D.6.5g Mg和0.1mol Zn8.向同浓度同质量的稀硫酸中分别放入适量的(a)Mg(b)MgO(c)Mg(OH)2(d)MgCO3(e)MgS反应完全后(反应物皆反应完全),溶液的浓度相同的是( )A.(a)(c)B.(a)(b)C.(c)(e)D.(b)(d)9. 下列各组试剂在溶液中反应,两种试剂的量发生改变时,不能用同一离子方程式表示的是( )A.氯化镁、氢氧化钠B.硫酸钠、氢氧化钡C.氧化镁、盐酸D.溴化亚铁、氯水★10. 右图表示相同质量的Mg、Al分别跟一定量相同浓度的稀H2SO4溶液反应的情况,下列叙述可能符合图示的有( )A.Mg、Al均过量B.Mg、Al都恰好与酸完全反应C.Ⅰ表示Mg与稀H2SO4反应D.Ⅱ表示Mg与稀H2SO4反应12. 某无色透明溶液与铝反应放出H2,该溶液中可能含有大量的:H+、K+、Mg2+、Cl-、OH-、NO3-、CO32-等离子,试推断:第一种情况:一定有离子,可能有离子。
江苏省高三名校化学试题汇编(镁铝及化合物4)
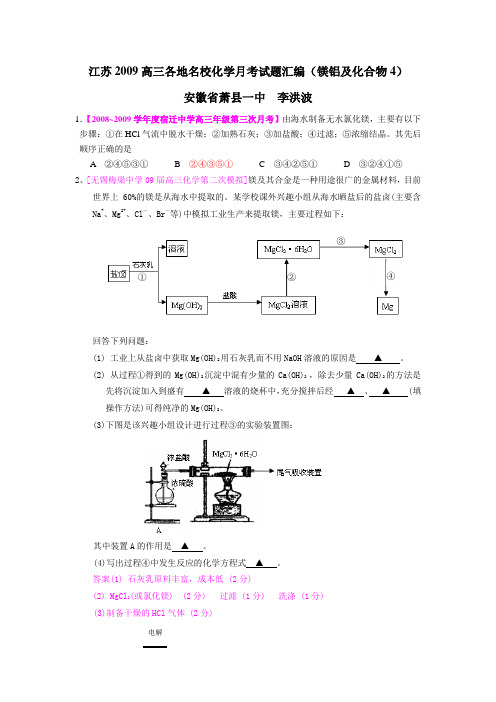
江苏2009高三各地名校化学月考试题汇编(镁铝及化合物4)安徽省萧县一中 李洪波1.【2008~2009学年度宿迁中学高三年级第三次月考】由海水制备无水氯化镁,主要有以下步骤:①在HCl 气流中脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。
其先后顺序正确的是A ②④⑤③①B ②④③⑤①C ③④②⑤①D ③②④①⑤2、[无锡梅梁中学09届高三化学第二次模拟]镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。
某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na +、Mg 2+、Cl -、Br -等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH 溶液的原因是 ▲ 。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 ▲ 溶液的烧杯中,充分搅拌后经 ▲ 、 ▲ (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:其中装置A 的作用是 ▲ 。
(4)写出过程④中发生反应的化学方程式 ▲ 。
答案(1) 石灰乳原料丰富,成本低 (2分)(2) MgCl 2(或氯化镁) (2分) 过滤 (1分) 洗涤 (1分)(3)制备干燥的HCl 气体 (2分)① ② ③ ④电解(4)2AlCl3 (熔融) 2Al +3Cl2↑(2分)3.[2009届无锡市高三期中调研试卷]将足量的铝粉分别投入等物质的量浓度的NaOH溶液和盐酸中,待反应结束后,两者产生的气体在相同状况下占有相同的体积。
下列叙述不正确的是【BD 】A.消耗铝的质量相等B.NaOH溶液和盐酸的体积相等C.两反应中转移的电子数相等D.反应后两溶液混合会产生白色沉淀且溶液中的溶质只有NaCl4.[徐州市第三十六中学2008-2009学年高三第一学期期中考试](12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。
江苏省扬州市2019届高考化学一轮复习《镁、铝及其化合物 课件 学镁、铝及其化合物

镁、铝及其化合物〖复习目标〗1.了解镁、铝及其重要化合物的主要性质和重要应用。
2.了解常见不同类型化合物之间转化的条件和方法,认识金属矿物等自然资源综合利用方面的重要作用。
〖知识清单〗考点一镁及其化合物一.镁的提取⑴向海水中加入石灰乳:。
⑵制取MgCl2·6H2O:。
⑶加热蒸干MgCl2:。
⑷电解MgCl2:。
二.镁的性质⑴物理性质⑵化学性质①能与O2、Cl2、N2等非金属单质反应,产物分别为、、。
②与CO2反应方程式为:。
③与酸反应镁与非氧化性酸如稀硫酸、盐酸等反应生成氢气,离子方程式为:。
镁与氧化性酸如浓H 2SO 4、稀HNO 3、浓硝酸在常温下也能反应,但不生成H 2。
④与盐溶液反应与Zn 的盐溶液反应,其离子方程式为: 。
⑶用途〖典型例析〗例1.海水的综合利用可以制备金属镁,其流程如下图所示:(1)若在空气中加热MgCl 2·6H 2O ,生成的是Mg(OH)Cl 或MgO ,写出相应反应的化学方程 。
用电解法制取金属镁时,需要无水氯化镁。
在干燥的HCl 气流中加热MgCl 2·6H 2O 时,能得到无水MgCl 2,其原因是 。
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
。
(3)【2016届南通三调】下列物质的转化在给定条件下能实现的是( )A .NaCl(aq)――→CO 2NaHCO 3(s)――→△Na 2CO 3(s)B .CuCl 2――→NaOH (aq )Cu(OH)2――→葡萄糖△CuC .Al ――→NaOH (aq )NaAlO 2(aq)――→△NaAlO 2(s)D .MgO(s)――→HNO 3(aq ) Mg(NO 3)2(aq)――→电解Mg(s)考点二铝及其化合物一、铝在元素周期表中的位置、结构及性质1.与非金属单质反应①与O2反应:②在点燃或加热的条件下与Cl2、S反应,化学反应方程式分别为;。
苏教版高中化学必修一《镁和铝》综合练习.doc

【例题精选】 例1、向MgSO 4和Al 2(SO 4上述反应的是(横坐标表示加入解析: (1)应为()Mg 2OH Mg oH 22+-+=↓ ()Al OH OH AlO 2H O 322+=+--(2)从(1)可以分析得出, NaOH 溶液中)最终有Mg(OH)2 例2、下列叙述中, A C解析: (1)从金属共性: 还原剂。
强弱。
金属原子越易失电子, 原性强弱)与失电子数目无关, (2)强不难得出C 有沉淀生成的是 HCl、HNO 3, 提Na +、, ∴不为此题答案。
+这些离子仍可以共存, 不会相n(Cl -)∶n(Na +)∶n(CO 32-)∶CO CaCO 323-+=↓, ∴为此题答n(Cl -)∶n(Ba 2+)∶n(OH -)∶+) = 1∶2∶1, ∵) 答案: C 、D, 又能与强碱Al(OH)3④弱酸⑤弱酸的铵盐如: (NH 4)2S 、NaOH Na CO H O 3232+=+2NaAlO H O 22=+)NaOH NaAlO 2H O 322+=+⑤Al2Al 3H SO Al 242+= ∴D 为正确答案 例5、镁、铝、碱溶液, 再过滤, A .AlO 2-B .Cu 2+解析:(1)审题是关键, 应有清楚的分析(2)涉及到反应Mg2++Mg 、Al 、Cu Mg 2H Mg H 22+=+↑++ 2Al 6H +()Al 3OH Al OH 33+-+=↓Al 4OH AlO 2H O 322+--+=+铝盐→偏铝酸盐 ∴A 例6、 A .①②③B 解析:(1)本题首先应明确②镁在空气中燃烧 ③镁在二氧化碳中燃烧(2)本题解题应注重技巧: MgO 质量与Mg 3N 2解此题, 等质量Mg ①Mg ~MgO ②4MgO 2C ⎧⎨⎩增重 = 4×16 + 2×12(g) = 88g答案: D NaOH (aq )中振荡, 现象为沉(aq )中振荡, 现象为沉淀(aq )中振荡, 现象为沉淀3(aq )中振荡, 现象为沉淀, 我们NaOH 溶液试管AlCl 3就应有沉淀生成, 0.075V m o l 0.025V 3m o l> , 整个过程示意图象为B 操作顺序为振荡沉淀溶解(NaOH 溶液过量Al 4OH AlO 1mol4mol 0.1Vmol0.4Vmol32+--+=+C 实验操作顺序表示为分析过程同A D 实验操作顺序表示为(AlCl 3过量)发生反应Al0.1Vmol3++沉淀继续增多Al 3+ ~ 3OH -∵n(NaOH) = 0.4V -()Al OH OH AlO 2H O 322+=+--0.1Vmol 0.1Vmol 例8、某无色溶液里, HCO OH NO 33---、、(1)若溶液跟Al 反应后有有大量的 离子。
高一化学镁铝及其化合物试题

高一化学镁铝及其化合物试题1.不用其他试剂,只借助试管和胶头滴管就可以鉴别的是A.Al2(SO4)3和NaOH B.NaHCO3和稀盐酸C.NaCl和AgNO3D.盐酸和Ba(OH)2【答案】A【解析】将NaOH逐滴加入Al2(SO4)3时先生成沉淀,随着NaOH的继续加入,沉淀又逐渐溶解,将Al2(SO4)3逐滴加入NaOH时,开始无沉淀后来有,因此可以鉴别;NaHCO3和稀盐酸无论滴加顺序如何,均有气体生成,无法区分;NaCl和AgNO3相互滴加均有白色沉淀产生,无法区分;D项中盐酸和Ba(OH)2反应没有明显现象。
【考点】铝的氧化物与氢氧化物从铝土矿中提取铝2.取镁条的灰黑色“外衣”进行实验:实验1:取样,加过量盐酸全部溶解为无色溶液,并产生能使澄清石灰水变浑浊的气体实验2:取样,加热,试管壁有水珠生成,所得气体也能使澄清石灰水变浑浊则下列说法正确的是()A.该样品可能是Mg2(OH)2CO3B.该样品一定是MgCO3C.该样品可能是氧化镁的水化物(MgO·H2O)D.该样品中一定含有单质碳【答案】A【解析】因为能使澄清石灰水变浑浊的气体是二氧化碳,该物质与盐酸反应能生成二氧化碳,说明该物质中含有碳酸根离子,再根据该物质加热,试管壁有水珠生成,所得气体也能使澄清石灰水变浑浊,说明分解能生成水和二氧化碳,所以该物质中含有氢元素,还含有碳酸根离子。
因为Mg2(OH)2CO3与盐酸反应能产生二氧化碳,加热分解生成氧化镁、水、二氧化碳,所以该物质符合要求,故A正确;因为碳酸镁受热分解时不能生成水,故B错;由于氧化镁的水化物中不含有碳元素,与盐酸反应不可能生成二氧化碳,故C错;该样品中一定含有碳元素,不能说一定含有单质碳,故D错。
【考点】镁的提取及应用3.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后再加入适量盐酸。
这种试剂不能是()A.NH3·H2O B.Mg(OH)2C.MgO D.MgCO3【答案】A【解析】加入氨水能够和MgCl2反应生成Mg(OH)2沉淀,并且引入新的杂质。
江苏专用2020版高考化学大一轮复习专题二第2讲镁铝及其重要化合物夯基提能作业含解析20191106

第2讲镁、铝及其重要化合物一、单项选择题1.(2018扬州宝应中学第一次月考)实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的的是( )A.用装置甲制取NH3B.用装置乙制备Al(OH)3C.用装置丙过滤并洗涤Al(OH)3D.用装置丁灼烧Al(OH)3得Al2O3答案 A B项,NH3通入AlCl3溶液中制备Al(OH)3应采用防倒吸装置,故错误。
C项,过滤、洗涤沉淀时应用玻璃棒引流,故错误。
D项,灼烧Al(OH)3固体应选用坩埚,不能用蒸发皿,故错误。
2.(2018南京高淳期末)下列有关物质用途的叙述不正确的是( )A.用铝制餐具长时间存放碱性食物B.纯碱溶液可用于去除油污C.氧化铁常用作红色油漆和涂料D.明矾可用作净水剂答案 A A项,铝能够与碱性物质发生反应,用铝制餐具长时间存放碱性食物,会腐蚀铝制餐具,错误;B 项,纯碱溶液显碱性,油脂在碱性条件下发生水解,所以纯碱溶液可用于去除油污,正确;C项,氧化铁是红棕色固体,可作为红色油漆和涂料,正确;D项,明矾在水中电离出的Al3+水解,生成氢氧化铝胶体,具有吸附性,可以吸附水里悬浮的杂质,故可用作净水剂,正确。
3.(2018盐城期末)要使氯化铝溶液中的Al3+完全转化成Al(OH)3沉淀,应选用的最佳试剂是( )A.NaOH溶液B.稀盐酸C.氨水D.AgNO3溶液答案 C A项,氢氧化钠溶液是强碱溶液,沉淀Al3+时生成的氢氧化铝沉淀能溶解在过量的强碱溶液中,所以Al3+不能全部转化成沉淀,不符合题意;B项,稀盐酸与氯化铝不反应,不符合题意;C项,氨水与氯化铝反应生成氢氧化铝沉淀,氨水是弱碱溶液,不能溶解Al(OH)3,可以使Al3+完全转化成Al(OH)3沉淀,符合题意;D项,氯化铝与硝酸银溶液反应生成氯化银沉淀,不符合题意。
4.(2018泰州中学高三上学期开学考试)在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )A.S SO3 H2SO4B.Al2O3 NaAlO2(aq) Al(OH)3C.Mg(OH)2 MgCl2(aq)无水MgCl2D.Fe Fe2O3 FeCl3答案 B A项,硫在氧气中点燃只能生成SO2,错误;B项,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,偏铝酸钠溶液中通入CO2可生成氢氧化铝沉淀,正确;C项,镁离子在溶液中会水解,直接蒸发氯化镁溶液得不到氯化镁固体,错误;D项,铁与水蒸气在高温下反应生成氢气和四氧化三铁,错误。
2020届高三化学一轮复习专题2第9讲镁、铝及其化合物练习(含解析)苏教版

第9讲镁、铝及其化合物一、单项选择题1. 下列叙述正确的是 ( )A. 常温下铝跟浓硫酸、浓硝酸、浓盐酸都不反应B. 两份相同质量的铝粉,分别与足量的盐酸和氢氧化钠溶液反应,产生氢气的质量前者多C. 工业上常利用铝热反应来冶炼难熔金属,如Cr、V、Mn等D. 铝的活泼性比钠弱,故可用金属钠将铝从它的盐溶液中置换出来2. (2018·河南新乡模拟)既能与HCl反应又能与NaOH反应的是( )A. Al(OH)3B. Na2CO3C. MgOD. MgCl23. 下列离子方程式不正确的是 ( )A. 铝片碱洗时常有气泡:2Al+2OH-+2H2O2Al-+3H2↑B. Al2O3溶于稀氨水:Al2O3+2OH-2Al-+H2OC. AlCl3溶液中加入过量NaOH溶液:Al3++4OH-Al-+2H2OD. 实验室用Al2(SO4)3溶液制Al(OH)3:Al3++3NH3·H2O Al(OH)3↓+3N4. Al2(SO4)3溶液分别与下列物质反应,能用Al3++3OH-Al(OH)3↓表示的是( )A. 少量氨水B. 少量NaOH溶液C. 少量石灰乳D. 少量Ba(OH)2溶液5. (2018·黄山模拟)下列各项操作过程中,发生“先产生沉淀,后沉淀又溶解”现象的是( )①向Fe(OH)3胶体中逐滴加入过量的稀硫酸②向AlCl3溶液中通入过量的NH3③向Ba(OH)2溶液中通入过量CO2④向NaAlO2溶液中逐滴加入过量的盐酸A. ①②B. ①③④C. ①③D. ③④6. (2018·福建南平模拟)微粒甲与微粒乙在溶液中的转化关系如下图所示,则微粒甲不可能是( )A. AlB. HS-C. ND. CO27. (2018·天山模拟)下列各组物质,不能按 (“→”表示反应一步完成)关系转化的是( )8. (2017·福建漳州八校)海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示),下列有关说法正确的是( )A. 第①步除去粗盐中S-、Ca2+、Mg2+、Fe3+等杂质离子,加入药品的顺序:Na2CO3溶液→NaOH 溶液→BaCl2溶液→过滤后加盐酸B. 第②步结晶出的MgCl2·6H2O可在HCl气流中加热分解制无水MgCl2C. 在第③④⑤步中溴元素均被氧化D. 第⑤步涉及的分离操作有过滤、萃取、蒸馏9. 工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:下列说法错误的是( )A. 试剂X选用稀硝酸最合适B. 滤渣Y的主要成分为Fe2O3C. 反应Ⅰ发生的反应之一为Al2O3+2OH-2Al-+H2OD. 减压蒸发不能改为蒸发结晶10. (2017·深圳三校联考)某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的的是( )A. 将铝片加入浓硫酸中,探究Al的活泼性B. 将NaOH溶液缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成及溶解C. 将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D. 将Al(OH)3沉淀转入蒸发皿中,加足量稀盐酸,加热蒸干得无水AlCl3固体11. (2018·福建龙岩新罗模拟)蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
周练九 ---------之镁 铝及其化合物(时间45分钟,满分100分) 命题人:王华朗 审核:王启迪一、选择题(本题包括14小题,每小题5分,共60分) 请将选项写在每题的题号的前面..............12.设N A 为阿伏加德罗常数的值,下列说法不正确的是 A.标准状况下,22.4L 的氖气含约N A 个氖原子。
B.常温常压下,1mol 氨气中含有10 N A 个电子。
C.标准状况下,22.4L 二氧化碳中含有3 N A 个原子核。
D. 0.3mol •L -1的K 2SO 4溶液中含有K +和SO 42—总数为0.9N A3.工业上制造镁粉是将镁蒸气在气体中冷却。
可作为冷却气体的是 ①空气 ②CO 2 ③Ar ④H 2 ⑤N 2A .①②B .②③C .③④D .④⑤ 4.下列关于金属铝的叙述中,说法正确的是 A .Al 是地壳中含量最多的元素B .Al 是比较活泼的金属,在化学反应中容易失去电子,表现氧化性C .Al 箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落D . 与Al 反应产生H 2的溶液一定呈酸性 5.下列关于Al(OH)3的性质叙述错误的是A . Al(OH)3能凝聚水中的悬浮物,也能吸附色素B .Al(OH)3是难溶于水的白色胶状物质C .Al(OH)3是两性氢氧化物D .Al(OH)3既溶于NaOH 溶液、氨水,又能溶于盐酸6.(2011·扬州中学高一期末)下列物质①NaHCO 3 ②(NH 4)2SO 4 ③Al 2O 3 ④(NH 4)2CO 3 ⑤Mg(OH)2中,既可以和盐酸反应也可以和Ba(OH)2溶液反应的是 A .①③④ B .①②③④ C .②③④ D .①③④⑤ 7.将NaOH 溶液逐滴加入用盐酸酸化了的AlCl 3溶液中,若用y 轴表示Al(OH)3沉淀量,x 轴表示NaOH 溶液的体积,下列图象正确的是8.把一定量的Ba(OH)2溶液滴入明矾[KAl(SO 4)2·12H 2O]溶液中,使SO 2-4全部转化成BaSO 4沉淀,此时铝元素的主要存在形式是A .Al 3+B .Al(OH)3C .AlO -2D .Al 3+和Al(OH)3 9.在下列各溶液中,离子一定能大量共存的是A .强碱性溶液中:K +、Al 3+、Cl -、SO 2-4B .含有Fe 3+的溶液中:K +、Mg 2+、OH -、NO -3C .含有Ca 2+的溶液中:Na +、K +、CO 2-3、Cl -D .pH =1的溶液中:Na +、Al 3+、Cl -、SO 2-4 10、下列的离子方程式正确的是A .用大理石跟稀盐酸制二氧化碳:CO 32-+ 2H += H 2O + CO 2↑ B .Cu 丝伸入到AgNO 3溶液中: Cu + 2Ag + = Cu 2+ + 2AgC.H2SO4溶液中滴入Ba(OH)2溶液:Ba2+ + OH-+ H+ +SO42-= BaSO4↓+ H2OD.铝溶于NaOH溶液:2Al + 2OH- = 2AlO2-+3H2↑11.将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H22.8L(标准状况),则原混合物的质量可能是A.2g B.4g C.10g D.24g12.用1L1mol·L-1NaOH溶液吸收0.8molCO2,求所得溶液中Na2CO3和NaHCO3的物质的量之比A.1︰3 B.1︰2 C.2︰3 D.3︰2二、非选择题(本题包括4小题,共40分)13.(10分)图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):A_________;B_________;C_________;D_________;E__________.14.(8分)阅读材料,回答下列问题.材料:近年来,科技人员研究得到一种新型材料——泡沫铝.它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场.(1)下列关于泡沫铝的说法错误的是________.A.泡沫铝即是铝单质泡沫 B.泡沫铝是一种合金C.泡沫铝是一种优质的建筑材料和轻质材料 D.泡沫铝可用于飞机制造(2)铝制成铝箔作食品包装,是利用它的哪一性质________.A.金属光泽B.延展性 C.导电性D.导热性(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:与盐酸反应的离子方程式:______________________________________________与氢氧化钠溶液反应的离子方程式:_____________________________________15.(14分)A、B、C是常见单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:(1)写出下列物质的化学式.A___________ _____,B________________,乙___________ _____,丁________________.(2)写出下列变化的化学方程式.①A与NaOH溶液反应的化学方程式:________________________________________________________________________.②甲与NaOH溶液反应的离子方程式___________________________________ __乙溶液与过量CO2反应的离子方程式________________________________________(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为______________,转移电子的物质的量为__________.16.(8分)镁和铝的合金5.1g恰好完全溶于100mL的稀硫酸中,充分反应后得到标况下的氢气5.6 L,求(1)合金中铝的质量(2)稀硫酸的物质的量浓度。
参考答案:1。
D2.D3.C4.C 解析:Al是地壳中含量最多的金属元素,地壳中含量最多的是氧元素.Al失电子,表现还原性,Al可以与NaOH溶液反应产生H2.A、B、D都不正确.Al的熔点比氧化铝的熔点低.答案:C5.D 解析:Al(OH)3可溶于强酸或强碱溶液,但不能溶于氨水.答案:D6.A 解析:五种物质中(NH4)2SO4只与Ba(OH)2反应,Mg(OH)2只与盐酸反应,NaHCO3、Al2O3、(NH4)2CO3与二者都反应.答案:A7.D 解析:当溶液中既有H+,又有Al3+时,加入OH-则先与H+反应,而后才与Al3+发生反应.所以在生成沉淀前加入的NaOH与H+反应,无沉淀生成.答案:D8.C 解析:Ba(OH)2和KAl(SO4)2以物质的量比2∶1反应时,才能使SO2-4全部转化成BaSO4,此时铝元素全部转化为AlO-2,反应方程式为2Ba(OH)2+KAl(SO4)2===2BaSO4+KAlO2+2H2O.答案:C9.D 解析:A项,强碱性即有大量OH-,Al3+不能大量共存;B项,Fe3+与I-因发生氧化还原反应而不能大量共存;C项,Ca2+和CO2-3因生成沉淀CaCO3而不能大量共存;D项正确.答案:D10。
B11。
B12。
A13。
解析:五种物质的焰色反应均呈黄色,说明都含有钠元素,而A能与水剧烈反应,说明A是钠单质,D为Na2O2,根据Na及其化合物之间的相互转变,可以推知B为Na2O,C为NaOH,E为Na2CO3.答案:Na Na2O NaOH Na2O2Na2CO314。
解析:(1)泡沫铝是把发泡剂加到熔融的铝合金中制成的,故不是铝单质.(3)Al2O3是两性氧化物,可以与酸、碱反应生成盐和水.答案:(1)A (2)B (3)Al2O3+6H+===2Al3++3H2O Al2O3+2OH-===2AlO-2+H2O15。
解析:常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,可能是Al2O3,则丙是H2O,B即是O2.根据NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓得丁是Al(OH)3.答案:(1)Al O2NaAlO2Al(OH)3(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑②Al2O3+2OH-===2AlO-2+H2O(3)0.1 mol 0.3 mol16。
(1)合金中铝的质量是2。
7g (2)稀硫酸的物质的量浓度为:2。
5mol•L-1。
