钠镁铝及其化合物的相关计算
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
钠镁铝及其化合物

钠、镁、铝及其化合物金属钠的性质与应用1.钠的物理性质:银白色、有金属光泽、质软的固体具有金属的通性:有延展性、易导电、导热2.化学性质(1)与氧气反应常温:4Na + O2 = 2Na2O (白色)点燃:2Na +O2 2Na2O2(淡黄)2Na2O2 + 2H2O== 4NaOH + O2↑2Na2O2 + 2CO2 == 2Na2CO3 + O2(2)与水反应现象:“浮”、“熔”、“游”、“响”、“红”2Na + 2H2O = 2NaOH + H2↑(3)与盐溶液反应:2Na + 2H2O = 2NaOH + H2↑2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4(4)钠的保存:密封保存在煤油中二、钠的用途(1)制过氧化钠—和氧气反应(3)高压钠灯—黄光射程远,透雾能力强碳酸钠与碳酸氢钠的性质比较镁性质及应用一、镁的性质1、物理性质:密度较小,熔点较低,硬度较小,银白色金属。
2、化学性质(具有较强的还原性)①与非金属单质的反应2Mg +O2点燃2MgO Mg +Cl2 点燃2MgCl23Mg +N2点燃Mg3N22、与氧化物反应2Mg +CO2点燃2MgO +CMg +2H2O = Mg(OH)2+H2↑(反应缓慢)3、与酸反应Mg +2H+= Mg2++H2↑练习:1.将少量金属钠放入盛有CuSO4溶液的烧杯中,剧烈反应,有蓝色沉淀及无色气体产生。
则烧杯中发生的反应是( )①2Na+CuSO4====Na2SO4+Cu;②Cu+2H2O====Cu(OH)2↓+H2↑;③2Na+H2O====2NaOH+H2↑;④2NaOH+CuSO4====Cu(OH)2↓+Na2SO4A. ①B. ①②C. ③④D. ①③2.下列六种物质:①Na2O ②Na2O2 ③NaCl ④Na2CO3溶液⑤NaOH ⑥NaHCO3,其中不能与CO2反应的是( )A.①④B.②③C.③⑥D.⑤⑥3.钠着火时,可用于灭火的材料或器材是()A盐酸B沙子C煤油D泡沫灭火器4.一块表面已被氧化为Na2O的钠块10.8 g,将其投入100 g水中,产生H2 0.2 g,则被氧化的钠是( )A.9.2 g B.10.6 g C.6.2 g D.4.6 g5. 在溶液中加入足量Na2O2后仍能大量共存的离子组是( )A.NH4+、Ba2+、Cl-、NO3-B.K+、AlO2-、Cl-、SO42-C.Ca2+、Mg2+、NO3-、HCO3-D.Na+、Cl-、CO32-、SO326.下列离子方程式书写正确的是( )A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑B.金属铝溶于氢氧化钠溶液:Al+2OH-=2AlO+H2↑C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑D.铁跟稀硫酸反应:Fe+2H+=Fe3++H2↑7.将Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为( ) A.4∶3∶2 B.1∶2∶1 C.2∶1∶1 D.1∶1∶18. 在密闭容器中充入体积比为1∶1的CO2和CO的混合气体,这时测得容器内的压强为p1,若控制容器的体积不变,加入足量的Na2O2固体,不断用电火花燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为p2,则p1和p2之间的关系是()A.p1=8p2B.p1=4p2C.p1=2p2D.p1=p9.2.1g平均分子质量为7.2的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加()A.2.1 g B.3.6 g C.7.2 g D.无法确定10.16 g CH4完全燃烧将生成物全部通过过量的Na2O2,Na2O2将增重() A.16 g B.32 g C.4 g D.无法判断11. 在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( ) A.4:9 B.1∶1 C.7∶6 D.6∶712.16.8 g NaHCO3和7.8 g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃。
高三化学钠 镁 铝
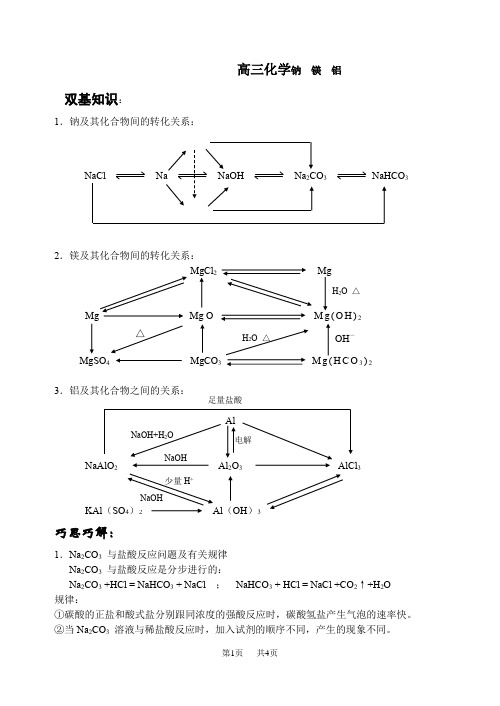
高三化学钠 镁 铝双基知识:1.钠及其化合物间的转化关系: NaCl Na NaOH Na 2CO 3 NaHCO 3 2.镁及其化合物间的转化关系: MgCl 2 MgMg Mg O M g (O H )2MgSO 4 MgCO 3 M g H C O 3)23AlNaAlO 2 Al 2O 3 AlCl 3(SO 4)2 Al (OH )3巧思巧解:1.Na 2CO 3 与盐酸反应问题及有关规律Na 2CO 3 与盐酸反应是分步进行的:Na 2CO 3 +HCl = NaHCO 3 + NaCl ; NaHCO 3 + HCl = NaCl +CO 2↑+H 2O规律:①碳酸的正盐和酸式盐分别跟同浓度的强酸反应时,碳酸氢盐产生气泡的速率快。
②当Na 2CO 3 溶液与稀盐酸反应时,加入试剂的顺序不同,产生的现象不同。
△ H 2O △ OH ―H 2O △ NaOH少量H +电解足量盐酸 NaOH+H 2O NaOH利用上述现象,可以不用任何试剂鉴别碳酸钠溶液和强酸溶液。
2.有关Al (OH )3沉淀的图象规律:① 向一定量的AlCl 3 溶液中逐滴加入NaOH 溶液至过量。
见 图(a )有关离子方程式为: Al 3+ + 3OH - = A l (O H )3 ↓A l (O H )3 +OH - = AlO 2― +2 H 2O② 向一定量的NaOH 溶液中逐滴加入AlCl 3 溶液至过量。
见图 (b )有关离子方程式为: Al 3+ + 4OH - = AlO 2― +2H 2OAl 3+ + 3AlO 2― + 6H 2O = 4A l (O H )3 ↓③ 向一定量的NaAlO 2 溶液中逐滴加入稀盐酸溶液至过量。
见图 (c )有关离子方程式为: AlO 2― +H + +H 2O = A l (O H )3 ↓A l (O H )3 +3H + = Al 3+ +3H 2O④ 向一定量的盐酸 溶液中逐滴加入NaAlO 2 溶液至过量。
钠镁铝及其化合物的相关计算

知识点归纳:一、钠原子结构从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na+)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm3),熔点低,是电和热的良导体。
钠的化学性质由于钠原子最外层只有一个电子,所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1. 与非金属反应(1)与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O2=2Na2O在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
(2)与硫反应2Na+S=Na2S(研磨易爆炸)(3)与氯气反应(发出黄色火焰,产生白烟)2. 与水反应钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑该反应的实质是钠原子与水电离出的H+发生氧化还原反应,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
3. 与酸反应钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应2Na+2HCl=2NaCl+H2↑钠与稀硫酸反应2Na+H2SO4=Na2SO4+H2↑钠与酸溶液反应的实质是:钠与酸电离出来的H+直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。
因为钠与水反应时,得电子的是水电离的H+,而酸中H+浓度大于水中H+的浓度。
4. 与盐的反应将一小粒钠投入硫酸铜溶液中,除观察到与水反应相同的现象外,还看到蓝色沉淀生成。
这是因为钠先与水反应,生成的NaOH再与盐CuSO4发生复分解反应生成氢氧化物——Cu(OH)2沉淀。
其反应式为:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓(蓝色)+Na2SO4总反应式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑故钠与盐溶液反应,不能置换出盐中的金属。
高考钠、镁、铝试题的解题方法与技巧

2019高考钠、镁、铝试题的解题方法与技巧!高考对钠及其化合物的考查重点是钠的氧化物和钠盐的性质、推断、计算和实验探究。
钠的化合物的转化关系是联系生产、生活实际的重要切入点。
常以框图题形式出现在综合题中,应用心体会。
镁、铝及其化合物的知识点丰富,性质应用广泛,命题空间大。
以实验为手段,以工业生产为背景,以图像分析和计算为重点,题型灵活、是高考的热点。
预计2018年仍以实际情景为依托,以元素化合物知识为载体,融元素化合物、化学基本理论、化学实验、化学计算、图像分析等知识于一体,既考查考生对知识的整合能力,又考查新课标的三种能力,并提高从化学视角分析和解决实际问题的能力。
题型有选择题和填空题;以选择题形式考查Na、Mg、Al单质及其化合物的性质和应用,在Ⅱ卷中与化学反应原理结合考查综合推断,实验探究和无机化工流程图,以填空题形式考查。
一、钠及其化合物1.氧化钠和过氧化钠:Na2O和Na2O2的比较2.碳酸钠与碳酸氢钠1.金属钠与酸溶液反应:Na与H2O反应的实质是Na置换H2O电离出的H +。
酸溶液中H +主要由酸电离得到,所以Na投入酸溶液中时,首先与酸反应,且比在纯水中反应剧烈,只有当酸反应完后,才与水反应。
例如少量Na投入盐酸中先发生反应:2Na+2HCl=2NaCl+H2↑。
2.钠与盐溶液的反应:钠与盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触,所以钠先与水反应,然后生成的碱再与盐反应。
例如钠与氯化铁溶液反应:2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
3.过氧化钠的特性及计算规律:(1)Na2O2的强氧化性:①Na2O2与SO2反应:Na2O2+SO2=Na2SO4。
②Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀。
钠镁铝及其化合物计算题

11届高三化学第一轮练习:钠镁铝及其化合物计算题1. 某容器中通入V LCO2,再加入少量Na2O2后,气体体积缩小到W L,则被吸收的CO2的体积是(均为相同条件下)( B )A.(V—W)L B.2(V—W)L C.(2V—W)L D.2W L2. 在一定温度下,向饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静置,最终所得晶体的质量为( B )A.等于1.06g B.大于2.86g C.等于2.86g D.大于1.06g小于2.86g 3. 2.1g平均相对分子质量为7.2g的CO与H2组成的混合气体与足量的O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( A )A.2.1g B.3.6g C.7.2g D.不可求4.有KOH和KHCO3混合物26.2g,在250℃下煅烧,冷却后称量,质量减少4.65g,则原混合物中KOH和KHCO3的关系是( B )A.KOH>KHCO3 B.KOH<KHCO3 C.KOH = KHCO3 D.任意比混合5. 一块表面已被氧化为氧化钠的钠块10.8g,投入100g水中,最多能产生0.2g气体,则原来被氧化的钠是(C )A.2.3g B.3.1g C.4.6g D.6.2g6. 现有2.8g碱金属(R)及其氧化物(R2O)组成的混合物与足量水反应形成3.58g碱,则该金属为( B )A.Na B.K C.Li D.Rb7. 将100mL 0.6mol/L氯化铝溶液跟0.4mol/L苛性钠溶液混合后,得到3.9g Al(OH)3沉淀,此时消耗苛性钠溶液的体积是( BC )A. 250mLB. 375mLC. 475mLD. 500mL8. (06·上海)已知Ba(AlO2)2可溶于水。
下图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。
下列有关叙述正确的是(可能有多个答案)( BD )A. a → b时沉淀的物质的量:A1(OH)3比BaSO4多B. c → d时溶液中离子的物质的量:AlO-比Ba2+多C. a → d时沉淀的物质的量:BaSO4可能小于A1(OH)3D. d → e时溶液中离子的物质的量:Ba2+可能等于OH-[解析] A答案错误,a-b时生成的Al(OH)3和BaSO4的物质的量之比恒为2∶3;B答案正确,b-d时溶液中的溶质只有Ba(AlO2)2,所以,AlO 比Ba2+多;C 答案错误,a-b时Al(OH)3和BaSO4的物质的量之比恒为2∶3;b-d时Al(OH)3逐渐减少而BaSO4保持不变,所以,BaSO4的物质的量一直多于Al(OH)3;D答案正确,d点时溶液中有Ba2+无OH-,d点后加入的Ba2+与OH-的物质的量之比为1∶2,所以,有可能出现Ba2+与OH-物质的量相等的情况。
高中化学碱金属的有关计算知识点分析人教版学案

专题 碱金属的有关计算碱金属元素是中学化学中最为重要的一族金属元素,以钠为代表的碱金属有关计算问题非常典型,这类计算过程复杂,而且计算难度也比较大,但理解了碱金属元素及其化合物之间内在的量的关系,掌握了有关计算的方法,也可以化难为易。
碱金属的计算主要有以下几种类型:一.碱金属、镁、铝等金属与酸或水反应后氢气量的计算解题方法:⑴钠先与酸反应,剩余的钠与水反应。
故钠一定可以消耗完全。
2Na+2HCl =2NaCl+H 2↑ 2Na+2H 2O =2NaOH+H 2↑∴2Na ——H 2↑ H 2的量只由钠的质量决定⑵镁、铝只与酸反应。
当酸不足时,氢气的量由酸决定;当金属不足时氢气的量由金属决定。
在含HCl 的量不同的两份盐酸中,分别加入等量的金属钠,完全反应后,两份盐酸中产生的氢气( )A 、一样多B 、含HCl 多的产生气体多C 、含HCl 少的产生气体多D 、反应剧烈的产生气体多二.Na 、Na 2O 、Na 2O 2、NaOH 溶解于水后形成的溶液的有关计算解题方法:先根据方程式计算(表示)出生成的NaOH 的质量。
m(溶液)=m(固体)+m(水)-m(气体)NaOH%=m(NaOH) / m(溶液) ×100%2.3g 的Na 、6.2g 的Na 2O 、7.8g 的Na 2O 2和4gNaOH 溶解于100g 的水中,分别得到甲、乙、丙和丁溶液。
则四种溶液的质量分数的大小关系是解:设四种物质溶解于水得到的NaOH 的质量分别为x 、y 、z 、w 。
2Na + 2H 2O = 2NaOH+ H 2↑46 80 2 46/2.3g = 80/x → x = 4g2.3g x m(H 2) 46/2.3g = 2/m(H2) → m(H 2) = 0.1gNa 2O+H 2O =2NaOH 2Na 2O 2+2H 2O =4NaOH+O 2↑62 80 158 160 326.2g y7.8g z m(O 2)62/6.2g = 80/y 158/7.8g = 160/z 158/7.8g = 32/ m(O 2)y = 8g z = 8g m(O 2) = 1.6gS+100 S= m(NaOH)m(溶液)∴ 丁<甲<乙=丙 注意:请根据例2复习根据方程式进行计算的有关步骤和表示方法。
钠镁铝所有方程式总结【最全】

钠及其化合物的方程式总结一、Na 单质1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na + O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O + O 2 2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二、Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O + 2HCl = 2NaCl + H 2O7、2Na 2O 2 +4HCl = 4NaCl + 2H 2O + O 2 ↑ 三、NaHCO 3与Na 2CO 31、小苏打受热分解: 2NaHCO 3Na 2CO 3 + H 2O +CO 2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOHNa 2CO 3 + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO 3+NaOH = Na 2CO 3+H 2O HCO 3-+OH - = H 2O +CO 32- 4、向NaOH 溶液中通入少量CO 2 :2NaOH + CO 2 = Na 2CO 3 + H 2O△△△△5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑7、Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O6、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O 2NaAlO2+3H2↑2Al+2OH-+2H2O 2AlO2-+3H2↑7、铝和浓硝酸共热:Al+6HNO3 Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu 2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4 Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2O Al2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al 2O 3 4Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应: 2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应: Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合: Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性: Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液: Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓ Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH2NaAlO 2+3Na 2SO 4+4H 2O Al 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)22Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 43Ba 2++6OH -+2Al 3++3SO 42-3BaSO 4 ↓+2Al(OH)3 ↓冰晶石电解8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O Al(OH)3+NaOH AlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl AlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O AlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓铁及其化合物的化学方程式和离子方程式一、Fe单质1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]4、高温条件铁与氧气(Fe过量)反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2 ↑ Fe+2H+Fe2++H2 ↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2 ↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓) Fe(NO3)3+3NO2 ↑+3H2O Fe+6H++3NO3-Fe3++3NO2 ↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑ +2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag Fe+2Ag+Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O2 2Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O FeO+2H+Fe2++H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2 ↑+2H2O FeO+4H++NO3-Fe3++NO2 ↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+Fe2++2Fe3++4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2 ↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2 ↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑ +5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O Fe3O4+8H+3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O Fe2O3+6H+2Fe3++3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O Fe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O Fe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2 ↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2 ↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑ +8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑ +8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe 2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl2ZnCl2+Fe Zn+Fe2+Zn2++Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3 ↓ 12Fe2++3O2+6H2O8Fe3++4Fe(OH)3 ↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O 4Fe2++O2+4H+4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl Fe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2 ↓+2NaCl Fe2++2OH-Fe(OH)2 ↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2 ↓+2Al(OH)3 ↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3 ↓+Fe(OH)2 ↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓Ag++Cl-AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl Fe2++S2-FeS↓13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O 2Fe2++H2O2+2H+2Fe3++2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3 ↓+8NaCl+O2 ↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O218、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe 3Zn+2Fe 3+3Zn 2++2Fe3、铁与氯化铁溶液反应:Fe +2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl Fe3++3OH-Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O Fe(OH)3↓+3NH4+9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl 2Fe 3++H 2S 2Fe 2++S ↓+2H +14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl 2Fe3++2I-2Fe2++I215、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl 2Fe3++S2-2Fe2++S ↓16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl 2Fe3++3S2-2FeS+S ↓17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl 2Fe3++2I-2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓ +Fe(NO3)3Ag++Cl-AgCl↓19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl Fe3++3SCN-Fe(SCN) 320、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3。
有关钠、镁、铝计算题常见解题技巧例析

有关钠、镁、铝计算题常见解题技巧例析
秦宗余
【期刊名称】《中学生数理化(尝试创新版)》
【年(卷),期】2009(000)011
【摘要】@@ 一、极值法rn例1 在一定条件下,将Na与O2反应的生成物1.5 g 溶于水,所得溶液恰好能被80 mL 0.50 mol·L-1的HCl溶液中和,则该生成物的成分是( ). rnA.Na2O B.Na2O2rnC.Na2O和Na2O2 D.Na2O2和NaO2 rn解析:本题主要考查Na与O2反应产物的判断及极值法的应用.Na与O2反应的产物可能是Na2O或Na2O2或NaO2和Na2O2的混合物.无论哪一种情况,与盐酸反应后都生成NaCl,即n(Na1)=0.08 L×0.50mol·L-1=0.04mol.
【总页数】2页(P64-65)
【作者】秦宗余
【作者单位】
【正文语种】中文
【相关文献】
1.钠的重要化合物典型计算题例析 [J], 杨明生
2.巧用守恒速解有关镁、铝、铁知识的计算题 [J], 黄建平
3.化学计算题常见解题技巧及解析 [J], 刘银生
4.化学计算题常见解题技巧及解析 [J], 刘银生
5.例析高中化学计算题的解题技巧 [J], 花俊
因版权原因,仅展示原文概要,查看原文内容请购买。
钠镁铝及其化合物

钠及其化合物一、钠的化学性质①与非金属单质的反应②与活性氢反应A.与水的反应(水中先滴入酚酞)2Na+2H 2O=2NaOH+H 2↑B.与非氧化性强酸的反应:2Na+2HCl=2NaCl+H 2↑C.与乙醇反应:2CH 3CH 2OH+2Na→2CH 3CH 2ONa+H 2↑D.与苯酚反应:2C 6H 5OH+2Na→2C 6H 5ONa+H 2↑③与盐反应A.和盐溶液反应先:2Na+H 2O=2NaOH+H 2↑后:2NaOH+CuSO 4=Cu(OH)2↓+Na 2SO 4 B.和熔融盐反应:④Na 久置于空气:二、钠的氧化物1Na2O2的强氧化性A.Na2O2与二氧化硫:B.Na2O2与二氧化氮:C.Na2O2与氢硫酸:2Na2O2+2H2S==2Na2S+2H2O+O2↑D.Na2O2与FeCl2溶液:2Na2O2的漂白性A.品红:褪色B.酚酞:先变红再褪色C.石蕊:先变蓝再褪色3Na2O2与CO2与H2O反应先后顺序CO2与H2O的混合气体与一定量的Na2O2反应时,可认为Na2O2先与CO2反应,待完全反应后,Na2O2再与H2O反应。
三、碳酸钠与碳酸氢钠四、鉴别与除杂五、侯式制碱法铝及其化合物一、铝1.铝的原子结构和物理性质:元素符号原子结构原子半径化合价颜色密度(g·cm-3)熔点℃沸点℃硬度13Al 1.43×10-10m+3银白色 2.70660.42467较软2.化学性质(1)与非金属反应:a、铝与氧气的反应:4Al+3O22Al2O3b、与其它非金属反应:2Al+3S Al2S32Al+3Cl22AlCl3(2)与酸反应:(3)与碱反应2Al+2H2O+2NaOH=2NaAlO2+3H2↑2Al+2H2O+2OH-=2AlO2-+3H2↑(4)铝热反应:Al+M x O y Al2O3+xM铝热反应的应用:冶炼高熔点金属,如Fe、V、Cr、Mn等或焊接钢轨。
钠镁铝及其化合物重要方程式小结

钠镁铝及其化合物重要方程式小结1.4Na+O2=2Na2O 2Na2O+O2△2Na2O2 2Na+O2点燃Na2O2注:Na2O2为淡黄色固体粉末2.2Na+2H2O=2NaOH+H2↑(钠与水反应的现象:浮、熔、游、嘶、红)Na与水反应的实质,若与稀硫酸、盐酸反应呢?Na与硫酸铜溶液反应呢?3.Mg+Cl2点燃MgCl2 Mg+Br2=MgBr2Mg+S △2Mg+O2点燃2MgO4.2Al+3Cl2点燃2AlCl34Al+3O2点燃2Al2O3(钝化)5.2Al+6HCl=2AlCl3+3H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑6.2Al+6H2SO4(浓)△Al2(SO4)3+3SO2↑+6H2O(Al、Fe、C在冷、浓的H2SO4、HNO3中钝化)7.Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O8.3Fe+4H2O(g)高温Fe3O4+4H29.2NaOH(过量)+CO2=Na2CO3+H2O NaOH+CO2(过量)=NaHCO32NaOH+SO2(少量)=Na2SO3+H2O NaOH+SO2(足量)=NaHSO310.Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑注:此反应分两步Na2O2+2H2O=2NaOH+H2O2 ;2H2O2=2H2O+O2↑11.Na2O+2HCl=2NaCl+H2O(金属氧化物与盐酸、稀硫酸反应通常生成盐和水)2Na2O2+4HCl==4NaCl+2H2O+O2↑12.Na2O+CO2==Na2CO3 2Na2O2+2CO2=2Na2CO3+O2(无气体符号)注意:对比氧化钠、过氧化钠分别与水、二氧化碳及盐酸反应的特征。
13.MgO+H2SO4=MgSO4+H2O Al2O3+3H2SO4=Al2(SO4)3+3H2O注:Al2O3是两性氧化物Al2O3+2NaOH=2NaAlO2+H2O14.2Al+2NaOH+2H2O=2NaAlO2+3H2↑Al2O3+2NaOH=2NaAlO2+H2OAl(OH)3+NaOH=NaAlO2+2H2O注:⑴产物均有NaAlO2,⑵当金属铝无论是与盐酸、稀硫酸等非氧化性酸,还是与氢氧化钠等强碱溶液反应时,均为2mol铝生成3mol H2。
钠镁铝及其化合物的化学方程式和离子方程式(定)

化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
钠、镁、铝计算

一、钠溶于水的计算:1、将2.3 g纯净的金属钠投入97.8 g水中,不考虑水的挥发,求所得溶液的溶质质量分数?解:2、将4.6 g钠投入95.4 g水中,求所得溶液的溶质质量分数?解:3、将2.3 gNa分别放入下列溶液:①100mL水;②1000mL 1mol/LNaCl溶液;③50mL0.5mol/LCuSO4溶液;④200mL0.1mol/L HCl;⑤300mL 1mol/LNaOH溶液。
则放出H2的物质的量() A.②中最多 B.③中最少 C.一样多 D.无法计算【小结】①钠遇某某溶液反应:有酸先与酸反应,无酸则先与水反应:及钠永远不会过量,因此计算H2时,应用2Na~H2二、钠、镁、铝分别与酸的反应:反应原理:2Na + 2HCl=2NaCl + H2↑Mg + 2HCl =MgCl2 + H2↑2Al + 6HCl=2AlCl3 +3 H2↑例1:将Na、Mg、Al各0.3mol分别放入足量稀盐酸中,同温同压下,产生H2的体积比为【关系式法小结】例2:将23gNa、18 g铝、56gFe分别投入盛有200 g7.3%的盐酸中,在相同状况下,回答:①反应速率由快到慢顺序是:②产生氢气的体积比是:解:例3:将0.4molNa、Mg、Al分别投入3个盛有1000mL 1mol/L的盐酸的大烧杯中,反应所产生的H2的体积比(同温同压下测定)分析:例4:将一定量的Na、Mg、Al分别投入足量盐酸的大烧杯中,若所产生的H2的体积相同(同温同压下测定),则反应的Na、Mg、Al的物质的量比,质量比为三、铝分别与盐酸、NaOH溶液反应的计算:原理:2Al + + 6HCl=2AlCl3 + 3 H2↑2Al + 2NaOH + 2H2O=2NaAlO2 + 3 H2↑1、称取两份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱。
若同温同压下放出相同体积的气体,则两份铝粉的质量比:;消耗HCl与NaOH的物质的量比2、足量的两份铝粉,分别与等物质的量的盐酸和NaOH溶液反应,则产生H2(同温同压)的体积比3、等量的两份铝A g,分别与含等B mol的HCl和NaOH反应,若产生的H2满足如下关系:1:3<V盐酸(H2)/V氢氧化钠(H2)<1:1,则必定满足一句话是酸中铝过量,碱中碱过量例:甲、乙两烧杯中各盛有100mL3mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体的体积比为1:2,则加入的铝粉质量为分析:四、极端假设思想:1、例:2.3g纯净的金属钠在干燥空气中被氧化后得到3.5g固体,由此判断其氧化后产物是Na2O和Na2O2的混合物;此结论的计算、分析过程如下:【原子量:Na:23 O:16】分析:2、将一定质量的Mg、Al、Zn混合物与足量稀硫酸反应,生成2.8L(标准状况)H2。
镁铝的有关计算总结1

(一、公式法铝及其化合物常见题型的计算公式如下: I. +3Al 与NaOH 反应生成沉淀的质量①当3:1)OH (n :)Al (n 3≥-+时,)g )(OH (n 26783)OH (n ])OH (Al [m 3--=⨯=。
②当3:1)OH (n :)Al (n 4:13<<-+时,)g )](OH (n )Al (n 4[78])OH (Al [m 33-+-=。
③当4:1)OH (n :)Al (n 3≤-+时,0])OH (Al [m 3=。
II. -2AlO 与强酸(+H )反应生成沉淀的质量①当1)H (n :)AlO (n 2≥+-时,)g )(H (n 78])OH (Al [m 3+=。
②当1)H (n :)AlO (n 4:12<<+-时,26])OH (Al [m 3=)g )](H (n )AlO (n 4[2+--。
③当4:1)H (n :)AlO (n 2<+-时,0])OH (Al [m 3=。
III. ++32Al Mg 、的混合溶液与-OH 反应时,求++32Al Mg 、的物质的量。
若++32Al Mg 、与-OH 的反应关系如下图,则 ①mol )a b ()Al (n 3-=+ ②mol 2b3a 4)Mg (n 2-=+IV . 明矾]O H 12)SO (KAl [224⋅溶液与2)OH (Ba 溶液反应生成沉淀的质量。
①当32])OH (Ba [n n 2≥明矾时,])OH (Ba [n 285m 2=沉淀; ②当32])OH (Ba [n n 212<<明矾时,明矾沉淀n 312])OH (Ba [n 77m 2+=; ③当32])OH (Ba [n n 2≤明矾时,明矾沉淀n 466m =。
例1:将100mL 1L mol 6.0-⋅氯化铝溶液跟1L mol 4.0-⋅苛性钠溶液混合后,得到3)OH (Al g 9.3沉淀,此时消耗苛性钠溶液的体积是( )A. 250mLB. 375mLC. 475mLD. 500mL解析:由I 中公式①可得:mL 375L mL 1000Lmol 4.0mol15.0)NaOH (V mol 15.0)OH (n 11=⋅⨯⋅==---, 由I 中公式②可得:mol 19.0])OH (Al [n )Al (n 4)OH (n 33=-=+-mL 475L mL 1000Lmol 4.0mol 19.0)NaOH (V 11=⋅⨯⋅=--。
钠、镁、铝及其化合物教案配习题

钠、镁、铝及其化合物教案配习题经典第一章:钠元素及其化合物1.1 钠的电子排布和物理性质钠的原子结构钠的密度、熔点、沸点钠的反应性及其与水的反应1.2 钠的重要化合物氧化钠(Na2O)过氧化钠(Na2O2)氢氧化钠(NaOH)碳酸钠(Na2CO3)氯化钠(NaCl)1.3 钠的化合物性质及应用氢氧化钠的腐蚀性和应用碳酸钠的用途,如玻璃制造、洗涤剂等氯化钠的盐电解和食盐生产第二章:镁元素及其化合物2.1 镁的电子排布和物理性质镁的原子结构镁的密度、熔点、沸点镁的反应性及其与酸的反应2.2 镁的重要化合物氧化镁(MgO)氢氧化镁(Mg(OH)2)碳酸镁(MgCO3)氯化镁(MgCl2)2.3 镁的化合物性质及应用氧化镁的耐火材料应用氢氧化镁的农业应用碳酸镁的制备方法和应用氯化镁的用途,如卤水提取和金属镁生产第三章:铝元素及其化合物3.1 铝的电子排布和物理性质铝的原子结构铝的密度、熔点、沸点铝的表面氧化层及其保护作用3.2 铝的重要化合物氧化铝(Al2O3)氢氧化铝(Al(OH)3)硫酸铝(Al2(SO4)3)氯化铝(AlCl3)3.3 铝的化合物性质及应用氧化铝的耐火材料和高铝土矿的提炼氢氧化铝的胃药成分硫酸铝的净水剂应用氯化铝的有机合成催化剂和阻燃剂应用第四章:钠、镁、铝的化学反应4.1 钠的化学反应钠与氧气的反应钠与水的反应钠与酸的反应4.2 镁的化学反应镁与氧气的反应镁与酸的反应镁与其他金属的置换反应4.3 铝的化学反应铝与氧气的反应铝与水的反应(缓慢)铝与其他金属的置换反应第五章:钠、镁、铝及其化合物的实验操作5.1 钠及其化合物的实验操作钠的切割和储存钠与水反应的实验操作氢氧化钠的制备和性质测试5.2 镁及其化合物的实验操作镁的切割和储存氢氧化镁的制备和性质测试碳酸镁的燃烧实验5.3 铝及其化合物的实验操作铝的切割和储存氧化铝的制备和性质测试氯化铝的水解反应实验第六章:钠、镁、铝的化合物分析方法6.1 钠、镁、铝的化合物分析方法概述原子吸收光谱法原子荧光光谱法电感耦合等离子体质谱法6.2 钠、镁、铝的化合物分析实验操作样品的前处理方法分析仪器的操作和校准数据分析与处理6.3 钠、镁、铝的化合物分析应用实例钠、镁、铝在地质样品分析中的应用钠、镁、铝在环境样品分析中的应用钠、镁、铝在生物样品分析中的应用第七章:钠、镁、铝及其化合物的工业应用7.1 钠及其化合物的工业应用钠在铝冶炼中的应用钠在化工工业中的应用钠在核工业中的应用7.2 镁及其化合物的工业应用镁在航空航天中的应用镁在汽车工业中的应用镁在建筑材料中的应用7.3 铝及其化合物的工业应用铝在包装材料中的应用铝在电力设备中的应用铝在交通运输中的应用第八章:钠、镁、铝及其化合物的安全与环保8.1 钠、镁、铝及其化合物的危险性钠的火灾风险镁的爆炸性铝的腐蚀性和氧化性8.2 钠、镁、铝及其化合物的安全操作规程储存和运输安全措施实验室安全操作规程应急处理方法8.3 钠、镁、铝及其化合物的环保问题废料处理和回收利用环境影响评估环保法规和标准第九章:钠、镁、铝及其化合物的教学案例与习题9.1 钠、镁、铝及其化合物的教学案例钠在水中的爆炸性反应案例镁在氧气中燃烧制备氧化镁案例铝的腐蚀与防护案例9.2 钠、镁、铝及其化合物的习题设计选择题、填空题和判断题计算题和应用题实验操作题和案例分析题9.3 钠、镁、铝及其化合物的教学评价学生习题完成情况的评价学生实验操作技能的评价学生综合分析能力的评价第十章:钠、镁、铝及其化合物的教学资源与拓展阅读10.1 钠、镁、铝及其化合物的教学资源教材和教学参考书网络教学资源和视频教学模型和实验器材10.2 钠、镁、铝及其化合物的拓展阅读科学研究论文和综述文章工业应用案例和技术进展相关领域的科普读物和杂志10.3 钠、镁、铝及其化合物的教学反思与改进教学方法的探讨与改进教学内容的更新与拓展教学评价体系的完善与优化重点解析本文档涵盖了钠、镁、铝及其化合物的教案内容,包括它们的电子排布、物理性质、化学反应、分析方法、工业应用、安全与环保、教学案例与习题以及教学资源与拓展阅读。
钠镁铝及其化合物的计算

计算题常用的解题方法松江校区王佳基本方法一、变式求同法进行化学计算,有时需在处理化学式上做文章。
利用比例关系,将化学式同比例的放大或缩小进行变形,变成有相同的部分,然后加以比较,迅速得出答案的一种解题方法称为变式求同法。
等效代换法是指在解答一些化学问题时,对题目中的某些量、化学式、原子或基团进行等效替换,使繁杂问题简单化,从而达到快速巧解题目的一种创造性思维方法。
二、残基法有机物的分子式算出后,可以有许多不同的结构,可先将已知的官能团的式量或所含原子数扣除,剩下的式量或原子数就是属于残余基团,再讨论可能结构就便捷得多。
区间公式法:已知有机物的相对分子质量,可用该法求解分子式,使用非常方便。
原理如下:C x H y:M=12x+y,2 < y < 2x+2,2 < M-12x < 2x+2,(M-2)/14 < x < (M-2)/12。
三、差量法差量法是依据化学反应前后的某些变化找出所谓的理论差量(固体质量差、液体质量差、气体体积差、气体物质的量之差等),与反应物或生成物的变化量成正比而建立的一种解题方法。
此法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,其他解题步骤与按化学方程式列比例解题完全一样。
在根据化学方程式的计算中,有时题目给的条件不是某种反应物或生成物的质量,而是反应前后物质的质量的差值,解决此类问题用差量法十分简便。
此法的关键是根据化学方程式分析反应前后形成差量的原因(即影响质量变化的因素),找出差量与已知量、未知量间的关系,然后再列比例式求解。
和量法:为解决问题方便,有时需要将多个反应物(或生成物)合在一起进行计算的方法称为和量法。
和量法的原理是:若A1/A2=B1/B2,则有A1/A2=B1/B2=(A1+B1)/(A2+B2),一般遇到以下情形,可尝试用和量法解题:(1)已知混合物反应前后质量,求混合物所含成分质量分数时;(2)已知反应前后混合气体的体积,求混合物所含成分体积分数时;(3)求反应前后气体的压强比、物质的量比或体积比时。
钠镁铝铁及其化合物方程式和离子方程式锦集

Na 、Mg 、Al 、Fe 及其化合物的化学方程式和离子方程式一、Na 及其化合物的化学方程式和离子方程式 (1)Na 的反应 1、钠和水反应:方程式: 2Na+2H 2O=2NaOH+H 2↑ 离子方程式: 2Na+2H 2O=2Na +2OH -+H 2↑ 2.钠分别和氧气、硫、氯气:2Na+O 2Na 2O 2 (或加热) 4Na+O 2 = 2Na 2O 2Na+S =Na 2S 2Na+Cl 22NaCl 3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式: 2Na+H 2SO 4=Na 2SO 4+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑方程式:2Na+2CH 3COOH=2CH 3COONa+H 2↑ 离子方程式: 2Na+2CH 3COOH=2CH 3COO -+2Na ++H 2↑ 4.钠分别和硫酸铜溶液、氯化铁溶液方程式: 2Na +2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 离子方程式: 2Na +2H 2O+Cu 2+=Cu(OH)2↓+2Na ++H 2↑ 方程式: 6Na +6H 2O+2FeCl 3=2Fe(OH)3↓+6NaCl+3H 2↑ 离子方程式: 6Na +6H 2O+2Fe 3+=2Fe(OH)3↓+6Na ++3H 2↑(2)Na 的氧化物反应 1.氧化钠分别与水、盐酸方程式: Na 2O+H 2O=2NaOH 离子方程式: Na 2O+H 2O=2Na ++2OH - 方程式: Na 2O+2HCl=2NaCl+H 2O 离子方程式: Na 2O+2H +=2Na ++H 2O 2.过氧化钠分别与盐酸、水方程式: 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 离子方程式: 2Na 2O 2+4H + =4Na ++2H 2O+O 2↑ 方程式: 2Na 2O 2+2H 2O=4NaOH+O 2↑ 离子方程式: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ 3.过氧化钠分别与二氧化碳:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (3)Na 2CO 3、NaHCO 3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na 2CO 3、NaHCO 3的方法)碳酸钠受热不分解 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ 2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na 2CO 3+HCl =NaHCO 3 +NaCl CO 32-+H +=HCO 3-NaHCO 3+HCl =NaCl+CO 2↑+H 2O HCO 3-+H +=CO 2↑+H 2O过量的盐酸时:Na 2CO 3+2HCl =2NaCl+CO 2↑+H 2O CO 32-+2H +=CO 2↑+H 2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+ Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或 CO2+ Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合 (类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH 2Cl-+2H2OCl2↑+H2↑+2OH- 9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3+ OH-溶液呈碱性二、Mg、Al及其化合物的化学方程式和离子方程式(1)Mg的反应1.镁在空气中燃烧2Mg + O2 2MgO 3Mg +N2 Mg3N2 2Mg + CO2 2MgO + C2.镁能溶解在氯化铵溶液中Mg + 2NH4Cl = MgCl2 + H2↑+ NH3↑ Mg + 2NH4+= Mg2+ + H2↑+ NH3↑(2) Al的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O2=2Al2O3在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
钠和铝及其化合物方程式总结

钠及其化合物的反应方程式1.金属钠的化学性质:钠露置空气中变暗:4Na+O2=2Na2O(白色)钠的燃烧:2Na+O2Na2O2(淡黄色) (反应条件不同,产物不同)钠与氯气反应:2Na+ Cl2===2NaCl钠与硫单质反应:2Na+S=Na2S钠投入水中:2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH–+H2↑(现象:浮、熔、游、响、红)钠与盐酸(先酸后水):2Na+ 2HCl===2NaCl+H2↑2Na+ 2H+===2Na++H2↑钠与硫酸铜溶液(先水后盐):①2Na+2H2O=2NaOH+H2↑②2NaOH+CuSO4=Cu(OH)2↓+Na2SO42Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(总式)2.氧化钠的化学性质:氧化钠与水:Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH–氧化钠与二氧化碳:Na2O+CO2=Na2CO3(不在水溶液中进行)氧化钠与盐酸:Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O3.过氧化钠的化学性质(漂白性、强氧化性):过氧化钠与水:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O24.碳酸钠与碳酸氢钠的化学性质:碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑碳酸钠与酸的反应:Na2CO3+HCl =NaCl+ NaHCO3(酸少量)CO32–+ H+= HCO3-Na2CO3+2HCl=2NaCl+H2O+CO2↑(酸足量)CO32–+ 2H+=CO2↑+H2O 碳酸氢钠与澄清石灰水反应:2NaHCO3+Ca(OH)2(过量)=CaCO3↓+2NaOH+H2O2NaHCO3+Ca(OH)2(少量)=CaCO3↓+Na2CO3+H2O碳酸氢钠与酸的反应:NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O 碳酸钠转换成碳酸氢钠(Na2CO3→NaHCO3):①通入CO2:Na2CO3+H2O+CO2=2NaHCO3CO32–+H2O+CO2=2HCO3-②加入适量稀盐酸:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-碳酸氢钠转换成碳酸钠(NaHCO3→Na2CO3):①碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)②加入适量氢氧化钠:NaHCO3+NaOH= Na2CO3 + H2O HCO3-+OH-=CO32–+H2O铝及其化合物的反应方程式5.金属铝的化学性质:铝在空气中常温或加热条件下都生成致密的氧化膜:4Al+3O2=2Al2O3铝与稀盐酸的反应:2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑铝与氢氧化钠的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+2OH–+2H2O=2AlO2–+3H2↑6.氧化铝的化学性质:(物理性质:难溶于水,熔点高,硬度大)氧化铝与稀盐酸的反应:Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O 氧化铝与氢氧化钠的反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH–=2AlO2―+H2O氢氧化铝的热稳定性差,受热易分解:2Al(OH)3Al 2O 3+3H 2O铝三角①少量OH - AlCl 3+3NaOH==Al(OH)3↓+3NaCl Al 3++3OH -==Al(OH)3↓ 加入NH 3·H 2O Al 2(SO 4)3+6NH 3·H 2O==2Al(OH)3↓+3(NH 4)2SO 4 Al 3++3NH 3·H 2O==Al(OH)3↓+3NH 4+②少量H +(除CO 2) Al(OH)3+3HCl==AlCl 3+3H 2O Al(OH)3+3H +==Al 3++3H 2O ③过量H + NaAlO 2+4HCl==AlCl 3+NaCl+2H 2O AlO 2-+4H +==Al 3++2H 2O ④过量OH - AlCl 3+4NaOH==NaAlO 2+3NaCl+2H 2O Al 3++4OH -==AlO 2-+2H 2O ⑤加入OH - Al(OH)3+NaOH==NaAlO 2+2H 2O Al(OH)3+OH -==AlO 2-+2H 2O ⑥少量H + NaAlO 2+HCl+H 2O==Al(OH)3↓+NaCl AlO 2-+H ++H 2O==Al(OH)3↓ 加入Al 3+ 3NaAlO 2+AlCl 3+6H 2O==4Al(OH)3↓+3NaCl 3AlO 2-+Al 3++6H 2O==4Al(OH)3↓ Al 3+ AlO 2-Al(OH)3 ① OH -(少量)/NH 3·H 2O ②H +(除CO 2) ④OH -(过量) ③H +(过量) ⑤OH - ⑥H +(少量)/Al 3+/CO 2通入CO2(CO2少量时) 2NaAlO2+CO2+3H2O==2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-(CO2过量时)NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-Welcome To Download !!!欢迎您的下载,资料仅供参考!。
钠、镁、铝金属及其化合物

知识点一 钠与碱金属
二碱金属元素 焰色反应
1.碱金属单质、化合物的相似性与递变性
碱金属除 Cs 略带金色光泽外,其他都是
物 相同 _银__白___色有金属光泽的固体,密度 较小 , 理 点 硬度 较小,熔、沸点 较低 ,导电、导热
性
性较强
质 递变 从 Li→Cs 密度逐渐增大 (Na、K 反常),熔、
溶液变浑浊
Na2O2+H2S===2NaOH+S↓
知识点二 含钠的化合物
与Na2SO3 溶液
Na2O2+Na2SO3+H2O===Na2SO4+2NaOH
与品红 溶液
品红溶液褪色
与酚酞 溶液
溶液先变红后褪色,同时产生无色气泡
知识点二 含钠的化合物
①若遇到具有还原性的物质,Na2O2 通常只体现出氧化性,如 Na2O2+ CO===Na2CO3 , Na2O2 + 2NO===2NaNO2 , 3Na2O2+ Fe2O3===2Na2FeO4+Na2O(可制备 Na2FeO4)。 ②若遇到非还原剂,如 CO2、H2O、H+,Na2O2 往往发生自身 的氧化还原反应,既作氧化剂又作还原剂。 ③若遇到 KMnO4 等强氧化剂时,Na2O2 表现出还原性,氧化 产物为 O2。
知识点一 钠与碱金属
②钠与盐溶液反应的分析方法 第一步:钠与水反应生成 NaOH 和 H2; 第二步:生成的 NaOH 如果能与溶质反应,则发生的是 NaOH 与溶质的复分解反应。
生成气 体型
钠与NH4Cl溶液反应生成H2和NH3
生成沉 钠与铜盐、铁盐等溶液反应生成Cu(OH)2 淀型 或Fe(OH)3 复杂型 钠与AlCl3稀溶液反应,如果钠量较多,则
氧化钠(Na2O)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
知识点归纳:从钠的原子核外电子排布看,其最外电子层上只有一个电子,因此,极易将这一电子失去,而达到稳定结构,形成+1价的钠阳离子(Na+)。
即金属钠的原子结构决定了其性质的活泼。
因其易失电子被氧化,故金属钠是还原剂。
钠的物理性质钠是银白色金属,质软(可用刀切割),密度小(0.97g/cm3),熔点低,是电和热的良导体。
钠的化学性质由于钠原子最外层只有一个电子,所以钠的化学性质极活泼,具有强还原性,是强还原剂,具有金属的典型性质。
1. 与非金属反应(1)与氧气的反应常温下能与空气中的氧气化合,表面变暗。
4Na+O2=2Na2O在空气或氧气中燃烧,发出黄色火焰,生成淡黄色固体。
(2)与硫反应2Na+S=Na2S(研磨易爆炸)(3)与氯气反应(发出黄色火焰,产生白烟)2. 与水反应钠与水反应的实验现象及现象解释如下:注:钠与水反应在钠的周围有白雾生成,此白雾是氢气燃烧产生的水蒸气。
钠与水反应的化学方程式为:2Na+2H2O=2NaOH+H2↑该反应的实质是钠原子与水电离出的H+发生氧化还原反应,其离子方程式为:2Na+2H2O=2Na++2OH-+H2↑注:钠与水反应的现象可概括为“浮、熔、游、响、红”,并结合钠的性质进行记忆。
3. 与酸反应钠与酸反应比与水反应更加激烈,极易爆炸。
钠与盐酸反应2Na+2HCl=2NaCl+H2↑钠与稀硫酸反应2Na+H2SO4 =Na2SO4 +H2↑钠与酸溶液反应的实质是:钠与酸电离出来的H+直接反应,而不是钠先与水反应,生成的氢氧化钠再和酸溶液反应。
因为钠与水反应时,得电子的是水电离的H+,而酸中H+浓度大于水中H+的浓度。
4. 与盐的反应将一小粒钠投入硫酸铜溶液中,除观察到与水反应相同的现象外,还看到蓝色沉淀生成。
这是因为钠先与水反应,生成的NaOH再与盐CuSO4发生复分解反应生成氢氧化物——Cu(OH)2沉淀。
其反应式为:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Cu(OH)2↓(蓝色)+Na2SO4总反应式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑故钠与盐溶液反应,不能置换出盐中的金属。
凡是活动性很强的金属(如K、Ca、Na)与盐溶液反应都与此类似,只有在熔融状态下,才有可能发生金属之间的置换反应。
由于钠的性质十分活泼,所以钠元素以化合态如NaCl、Na2SO4、Na2CO3、NaNO3等形式存在于自然界中。
由于钠很容易与空气或水反应,所以保存钠时应隔绝空气和水。
因为煤油不与钠反应,且煤油的密度小于钠的密度,所以通常将钠保存在煤油里。
虽然汽油的密度也小于钠的密度,但由于汽油易挥发,所以不能用汽油保存钠。
由于四氯化碳的密度大于钠的密度,所以不能用四氯化碳保存钠。
二、镁镁质软,熔点较低,成银白色。
镁是一种柔软有光泽的金属。
具有比较强的还原性,能与热水反应放出氢气,燃烧时能产生眩目的白光,镁与氟化物、氢氟酸和铬酸不发生作用,也不受苛性碱侵蚀,但极易溶解于有机和无机酸中。
1.与非金属单质的反应:2Mg+O2==2MgO 3Mg+N2=Mg3N22.与水的反应:Mg+2H2O=Mg(OH)2+H2(加热)3.与酸的反应:Mg+2HCl=MgCl2+H24.与氧化物的反应:2Mg+CO2=2MgO+C(点燃)三、铝铝是银白色的轻金属,较软,铝和铝的合金具有许多优良的物理性质,得到了非常广泛的应用。
纯铝的导电性很好,仅次于银、铜,在电力工业上它可以代替部分铜作导线和电缆。
铝是热的良导体,在工业上可用铝制造各种热交换器、散热材料和民用炊具等。
铝有良好的延展性。
和氧气反应、非金属、热水反应、和较不活动金属氧化物反应(铝热反应),和酸反应:在常温下浓硫酸和浓硝酸可使铝钝化。
盐酸和稀硫酸可跟铝发生置换反应,生成盐并放出氢气。
和碱溶液反应:主要和NaOH、KOH强碱溶液反应,可看做是碱溶液先溶解掉铝表面氧化铝保护膜铝和水发生置换反应。
典型例题:例1、将7.8gMg Al合金溶于120ml 4mol/L H2SO4中,当合金完全溶解后,再加入120 ml 8mol/L的NaOH溶液,得到沉淀的质量为21.4g,则加入H2SO4时产生的氢气的物质的量为()A、0.4 molB、0.6molC、0.8molD、1.0mol例2、常温下取金属钠、铝、铁各n g,分别加入1mol/L的硫酸V L,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V和n的数值大小关系()A、n/46<V<n/56B、V≤n/46C、V≤n/56D、V≥n/18例3、用铝热法从下列氧化物中还原出物质的量相同的金属所消耗的铝最少的是()A.Fe3O4B.MnO2C.V2O5D.Cr2O3例4.将0.1mol Al 投入3mol/L NaOH溶液100mL中,充分反应后再滴加1mol/L H2SO4溶液,若要得到最多沉淀,需要加入1mol/L H2SO4溶液A.100mL B.150mL C.200mL D.300mL例5、铜和镁的合金4.6g完全溶解于足量的硝酸后,再加入过量的氢氧化钠溶液,产生9.7g沉淀,则合金与硝酸反应时,放出的气体可能是A.0.1 mol的NO B.0.2 mol的NO2和0.05 mol的N2O4 C.0.2 mol的N2O D.NO、NO2和N2O4各0.1 mol例6.将2.4gFe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体V L(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。
则收集到的气体体积V的值不可能为A.0.64 B.0.896 C.1.00 D.1.12例7.a g Mg 、Al 合金完全溶解在C 1 mol·L -1、V 1L HCl 溶液中,产生b g H 2。
再向反应后的溶液中加入C 2 mol·L -1、V 2 L NaOH 溶液,恰好使沉淀达到最大值,且沉淀质量为d g 。
下列关系错误的是A .34d a b =+B .C 1=C 2V 2/V 1C .铝为 (24b-a)/9 molD .与金属反应后剩余盐酸为11(2)C V b - mol例8 、向m g 镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L 。
向反应后的溶液中加入c mol/L 氢氧化钾溶液V mL ,使金属离子刚好沉淀完全,得到的沉淀质量为n g 。
再将得到的沉淀灼烧至质量不再改变为止,得到固体p g 。
则下列关系不正确的是( )。
A.100011.2b c V =B.125Vc p m =+C.n=m+17VcD. p=53m例9、 把铝粉与Fe 3O 4的混合物,分为两等份。
前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH 溶液充分反应。
前后两种情况下生成的气体在同温同压下的体积比是 A. 1:1 B. 3:4 C. 9:8 D. 4:3例10、自然界中存在一种尖晶石,化学式为MgAl 2O 4,已知该尖晶石中混有Fe 2O 3。
现取一定量样品5.68 g ,恰好与100 mL 一定浓度的盐酸反应。
该盐酸的浓度可能为A .2.2 mol ·L -1B .3.3 mol ·L -1C .3.0 mol ·L -1D .1.8 mol ·L -1一、选择题练习1、将2.3g钠投入97.7g水中,所得溶液的质量分数为()A. 2.3%B. 大于2.3%C. 4%D. 大于4%2、在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL 浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是()A. Na2OB. Na2O2C. Na2O 和Na2O2D. Na2O2 和NaO23、有100mL3mol/LNaOH溶液和100mL1mol/LAlCl3溶液,按如下两种方法进行实验:①将NaOH溶液分多次加到AlCl3溶液中,②将AlCl3溶液分多次加到NaOH 溶液中,比较两次实验的结果()A.现象相同,沉淀量相等B.现象相同,沉淀量不相等C.现象不同,沉淀量不等D.现象不同,沉淀量相等4、将0.1mol Al 投入3mol/L NaOH溶液100mL中,充分反应后再滴加1mol/LH2SO4溶液,若要得到最多沉淀,需要加入1mol/L H2SO4溶液A.100mL B.150mL C.200mL D.300mL 5、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为A.3:1 B.2:1 C.1:1 D.1:36、某溶液中含MgCl2和AlCl3各0.01mol,向其中逐滴滴加1mol/L的NaOH溶液至过量,下列关系图正确的是A .B.C .D .7、取500mL Na 2CO 3溶液与300mL l mol .L -1盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3:2。
则碳酸钠溶液的物质的量浓度为A .0.4 mol ·L -1B .0.3 mol ·L -1C .0.2 mol ·L -1D .0.5mol ·L -18、已知Ba(AlO 2)2可溶于水。
右图表示的是向A12(SO 4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y 与加人Ba(OH)2的物质的量x 的关系。
下列有关叙述正确的是 A .a —b 时沉淀的物质的量:A1(OH)3比BaSO 4多 B .c —d 时溶液中离子的物质的量:AlO 2-比Ba 2+多 C .a —d 时沉淀的物质的量: BaSO 4可能小于A1(OH)3D .d —e 时溶液中离子的物质的量:Ba 2+可能等于OH -n(n(n(9、将9.2gNa和5.4gAl同时放入一定量的水中,充分反应后得到200mL澄清溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列结果正确的是A.最终得到7.8g的沉淀B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)C.反应过程中得到6.72L的气体(标准状况下)D.最终得到的溶液中c(NaCl)=1.5mol/L10、取500mL Na2CO3溶液与300mL 1 mol·L-1盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3 : 2 。
