选修四化学反应原理原电池课件
合集下载
化学选修4:第四章第一节《原电池》原创课件

上述装置中能形成原电池的是 B , 该原电池工作时,负极发生 氧化反应 , - ==Cu2+ Cu – 2e 电极反应式为 ; 正极发生 还原反应 , + + 2e- ==2Ag 2Ag 电极反应式为 ;
电池总反应式为
Cu + 2Ag+ ==Cu2+ + 2Ag 。
3、原电池的工作原理
4、电极方程式
练习:
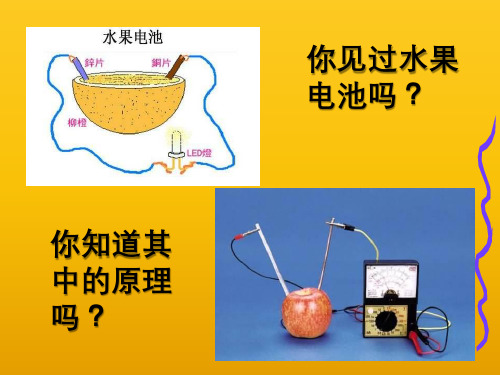
画出“Zn – Cu - H2SO4”原电池 和“Fe – C - AgNO3”原电池 的装置图,
并标出正负极、电子移动方向,书写其电 极方程式和总方程式。
思考:
提出问题: 左图是原电池,如果用 它做电源,不但效率低, 而且时间稍长电流就很 快减弱,因此不适合实 际应用。
这是什么原因造成的呢?
2+
铜 半 电 池
(氧化反应)
正极(铜片): Cu2+ + 2e - = Cu (还原反应)
电池反应(总化学方程式):Zn + Cu2+ = Zn 2+ + Cu 电池符号: Zn ︱ ZnSO4‖ CuSO4 ︱ Cu
负极
盐桥
正极
三、原电池的应用
思考讨论:
利用此氧化还原反应来设计原电池, 写出电极反应式。并画出装置图
3、把a、b、c、d四块金属片浸入稀硫酸 中,用导线两两相连组成原电池。若a、b 相连时,a为负极;c、d相连时,电流由d 到c;a、c相连时,c极上产生大量气泡, b、d相连时,b上有大量气泡产生,则四 种金属的活动性顺序由强到弱的为 ( ) A. a > b > c > d B. a > c > d > b C.c > a > b .> d D.b > d > c > a
高中化学人教选修四 4-1 原电池 课件(14张)

Cu
Zn
C
酒精
D
实验现象
CuSO4 溶 液
分析实验现象
电极反应: 负极: Zn - 2e - = Zn 2+ (氧化反应) 正极: Cu 2+ + 2e - = Cu (还原反应) 总电池反应方程式为: 2+ = Zn 2+ + Cu Zn + Cu 思考:如何才能 CuSO4 溶液
得到持续稳定 的电流? 在原有实验基础上进行改进,
练习:.依据氧化还原反应:2Ag+ (aq) + Cu(s) == Cu 2+ (aq) + 2Ag(s)设计的原电 池如图所示。 请回答下列问题:
铜
AgNO
3 (1)电极X的材料是 正 _________;电解质溶 液Y 是____; 2Ag+ +2e-=2Ag Cu-2e(2)银电极为电池的Cu _______极,发生的电 Ag =Cu2+ 极反应为_____________;X电极上发生 的电极反应为_; (3)外电路中的电子是从_____电极流向 ______电极。
设计成一个能产生持续稳定
实验探究
在原有实验基础上进行改进,设 计成一个能产生持续稳定电流的 原电池。 提示: 1、能否设法阻止溶液 中的 Cu2+在锌表面还原。 2、如何选择电解质溶 液。
CuSO4
3、如何才能形成闭合 回路。
• 汇报实验方案及 现象并进行分析
m A
负 极
Zn —
内电 离子通 路 道
外电 路
SO4 2- 盐 K 22+ 2+ Cu 氧化 Zn + 还原 2+ Zn C
离子库 + SO4
高中化学人教版选修四 4-1 原电池 课件(37张)
负极
Zn-2e=Zn2+
铜锌原电池 正极
Cu2++2e- =Cu
阴离子
电解质 溶液
盐桥
阳离子
内电路
2019/2/15
原电池
原电池的组成——两个半电池
盐桥
锌 半 电 池
铜 半 电 池
利用同样的原理,可以把其它氧化还原反应设计成 各种原电池。
2019/2/15
原电池
1、Cu、Fe作两极,稀硫酸作电解质溶液的原电池中: 负 极 ①Cu作____ 正 极, ②Fe作____ 电极反应式是:负极____________ Fe-2e-=Fe2+ 2H++2e-=H2↑ 正极_____________ Fe+H2SO4=FeSO4+H2↑ 总反应式是___________________________ 如将稀硫酸改为浓硝酸则: 负 极, ②Fe作____ 正 极 ①Cu作____ Cu-2e-=Cu2+ 电极反应式是:负极____________ 2NO3-+4H++2e-==2NO2 ↑ +2H2O 正极_____________________ Cu+4HNO3(浓)=Cu(NO3)2+2NO2 ↑ +2H2O 总反应式是_______________________________
2019/2/15
原电池
请写出图片中原电池的电极反应式和 电池反应方程式。
负极: (锌片)
Zn - 2e- = Zn2+
氧化反应
(铜片) 2H+ + 2e- = H2↑ 正极:
还原反应
稀H2SO4
人教版高二化学选修4教学课件:第四章4.1 原电池(共12张PPT)

例:写出下列装置的电极反应式
二、设计原电池
设计思路
1. 写出电极反应式 将已知的氧化还原反应拆分为氧化反应和还原
反应两个半反应。 2. 确定电极材料
以两极反应原理为依据,确定电极材料。 如,发生氧化反应的物质为金属单质,可用该 金属直接作负极;用较不活泼的金属(或能导电的惰 性材料)作正极。 3. 确定电解质溶液 一般选用总反应式中的电解质溶液;若有盐桥 ,阳离子与电极相对应,电极不与电解质溶液反应
2. 工作原理
电极反Байду номын сангаас式的书写
(1)遵循离子方程式书写规则。 注意:生成难溶物沉积在电极上,不标“↓”。
(2)方法步骤 标变价→列物质→注得失→配守恒
负极:氧化反应,还原剂 − ne- ══ 氧化产物 正极:还原反应,氧化剂 + ne- ══ 还原产物 电池反应 = 负极反应式 + 正极反应式
注意:同时书写正负极反应式,以得失电子数 相等配平;书写单个电极反应式,化为最简整数比 。
第四章 电化学基础
第一节 原电池
一、原电池
−
+
1. 装置
盐桥:装有含琼胶的KCl饱和溶液 盐桥的作用: ① 构成闭合回路。 ② 平衡电荷。盐桥中的阴、阳离子定向迁移(溶液中的离子不能通过盐桥),使电
解质溶液保持电中性,反应持续进行,能长时间稳定放电。 ③ 避免电极与电解质溶液直接反应,最大程度地将化学能转化为电能。
达标练习
教材 P73 习题
课后作业
学法 P105-106
这一 样个 的人 人所 才受 有的 学教 问育 。超
过 了 自 己 的 智 力 ,
You made my day!
我们,还在路上……
人教版化学选修四 原电池ppt课件

)
A.Mg
B.Fe
C.Al
D.Cu
B
2.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH(
)
A.不变
CB先变大后变小
C逐渐变大
D.逐渐变小
14
牛刀小试
原电池的判断
1.下列装置中能组成原电池形成电流的是(
)
C
A
Cu
Cu
A
Zn
Cu
A
B
H2SO4
A
Zn
Cu
C
D
H2SO4
酒精
A
Zn
Cu
H2SO4
H2SO4
2Al3+ + 8OH- =2AlO2- + 4H2O
负极总反应: 2Al +8OH- -6e- =2AlO2- + 4H2O
正极:总反应-负极反应
6H2O +6e- =6OH—+ 3H2↑
33
二、 电极材料本身均不参与反应 两电极均为惰性电极,常见于燃料电池。 1、酸性介质 氢氧燃料电池 2H2+O2=2H2O 负极:2H2 - 4e-=4H+ 正极:O2+ 4H+ + 4e-=2H2O a. 应考虑电解质对电极反应的影响 b. 介质为酸性溶液时,反应式两边不能出现OH-离子 c. H+写在正极的反应物中
20
把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
mA
负 极
Zn
—
氧化
SO4 2Zn2+
盐 K+
桥
反应 Zn2+
Cl-
+ SO4 2Cu2+ 还原
人教版 高中化学(选修四) 第四章 第一节《原电池》 (共25张PPT)
⑵、 将Cu片插入H2SO4溶 液中有什么现象?为什么?
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
⑶、将一Zn片,Cu片平行插入 稀象H?2为SO什4溶么液?中,有什么现
(4)、若将Zn片,Cu片用一 导线连接,导线间接一电流 计,再浸在稀H2SO4溶液中, 有什么现象?为什么?
原 电 池 的 工 作 原 理
定向移动方向:电子、离子
原电池
盐电池
反应:
Cu2++Zn=Zn2++Cu
根据检流计指针偏转方向 知电流方向: Cu→Zn
盐桥:在U型管中装 满用饱和KCl溶液 和琼胶作成的冻 胶。
盐桥的作用:
使Cl-向锌盐方向移动, K+向铜盐方向移动,使 Zn盐和Cu盐溶液一直保 持电中性,从而使电子 不断从Zn极流向Cu极。
正、负两极分别发 生的反应,称为电 极反应。
小心的向烧杯中央滴入CuSO4溶液,片刻后
可观察到的现象是
A. 铁圈和银圈左右摇
(D )
摆不定;
B. 保持平衡状态;
C. 铁圈向下倾斜;
D. 银圈向下倾斜;
4、我国发射的神州五号载人飞 船是采用先进的甲烷电池为电能 的,该电池以KOH溶液为电解 质,其总反应的化学方程式为: CH4+2O2+2OH-=CO32-+3H2O
正极(铜电极): Cu2+ + 2e- = Cu 负极(锌电极): Zn = Zn2+ + 2e-
Cu2++Zn=Zn2++Cu
2、原电池形成的条件: 1.两个活泼性不同的电极
2. 电解质溶液 3.能自发地发生氧化还原反应 4.形成闭合回路
3、电极判断:
负极:电子流出的一极,发生氧化反应
人教版高中化学选修4第四章第一节原电池课件

2.工作原理:
锌半电池 负极: Zn -2e - = Zn 2+
铜半电池 正极: Cu2+ + 2e - = Cu
电池反响:Zn + Cu2+ = Zn 2+ + Cu
思考: 1.改进后的装置为什么能够持续、稳定 的产生电流? 2.盐桥在此的作用是什么?
认识盐桥
〔1〕盐桥的成分:饱和的KCl溶液和琼脂 〔2〕盐桥的作用:
练习:
利用Fe + Cu2+=Fe2+ +Cu设计一个原 电池,画出示意图,写出电极反响。
Fe Fe Cu Cu
负极:Fe – 2e- =Fe2+
CuSO4 FeSO4 CuSO4
正极:Cu2+ +2e- =Cu
二、原电池正负极判断
1.由组成原电池的电极材料判断 2.根据电子〔电流〕流动的方向判断 3.根据电极反响类型判断
负极-- 失 电子,发生 氧化 反响
正极-- 得 电子,发生 复原 反响
三、原电池原理的应用
1.设计原电池
2.判断金属的活动性
3. 加快反响速率 (1)实验室制取氢气,用锌与稀硫酸反响。 锌用纯锌好,还是用粗锌好〔杂质为碳〕? (2)如果只有纯锌、稀硫酸和硫酸铜,怎 么4.防办止?金属被腐蚀
例:镀锌铁比镀锡铁耐用
练1.(07海南)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s) 设计的原电池如图所示。
请回答下列问题: (1)电极X的材料是 Cu ;电解质溶液Y是AgNO3溶液 (2)银电极为电池的 正 极,发生的电极反应为2Ag++ 2e- = 2Ag
锌半电池 负极: Zn -2e - = Zn 2+
铜半电池 正极: Cu2+ + 2e - = Cu
电池反响:Zn + Cu2+ = Zn 2+ + Cu
思考: 1.改进后的装置为什么能够持续、稳定 的产生电流? 2.盐桥在此的作用是什么?
认识盐桥
〔1〕盐桥的成分:饱和的KCl溶液和琼脂 〔2〕盐桥的作用:
练习:
利用Fe + Cu2+=Fe2+ +Cu设计一个原 电池,画出示意图,写出电极反响。
Fe Fe Cu Cu
负极:Fe – 2e- =Fe2+
CuSO4 FeSO4 CuSO4
正极:Cu2+ +2e- =Cu
二、原电池正负极判断
1.由组成原电池的电极材料判断 2.根据电子〔电流〕流动的方向判断 3.根据电极反响类型判断
负极-- 失 电子,发生 氧化 反响
正极-- 得 电子,发生 复原 反响
三、原电池原理的应用
1.设计原电池
2.判断金属的活动性
3. 加快反响速率 (1)实验室制取氢气,用锌与稀硫酸反响。 锌用纯锌好,还是用粗锌好〔杂质为碳〕? (2)如果只有纯锌、稀硫酸和硫酸铜,怎 么4.防办止?金属被腐蚀
例:镀锌铁比镀锡铁耐用
练1.(07海南)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s) 设计的原电池如图所示。
请回答下列问题: (1)电极X的材料是 Cu ;电解质溶液Y是AgNO3溶液 (2)银电极为电池的 正 极,发生的电极反应为2Ag++ 2e- = 2Ag
高中化学 人教版选修4 课件:第四章 第一节 原 电 池(36张PPT)

要点二 原电池的设计
理论上,能自发进行的氧化还原反应均能设计成原电池, 实际设计时应注意以下几方面: 提供 (1) 用 还原性较强 ________ 的物质作为负极,向外电路 ________ 得到 电子;用 氧化性较强 ________ 的物质作为正极,从外电路 ________ 电子。
阴阳离子的定向移动 (2) 将两极浸在电解质溶液 ________ 中,通过 __________________ 形成内电路。 导线 流向正极,再通过 (3) 放电时负极上的电子通过 ________ 溶液中离子移动形成的内电路构成闭合回路,其中阳离子移 向________ 正 正 极,阴离子移向________ 负 极。
负极——电子流出极,电流流入极或阴离子定向移向极
正极——电子流入极,电流流出极或阳离子定向移向极
栏 目 链 接
3.根据两极发生的变化判断
负极——失去电子,化合价升高,发生氧化反现象判断
负极——会逐渐溶解,质量减小
正极——有气泡逸出或质量增加
栏 目 链 接
三、原电池正负极的判断方法
负极:活泼性__强__的金属,发生__氧化__反应。
正极:活泼性__弱__的金属或导体,发生__还原__反应。 原电池正负极判断: 1.根据电极材料判断 负极——活泼性较强的金属
栏 目 链 接
正极——活泼性较弱的金属或能导电的非金属
注意:活泼金属不一定做负极,如Mg、Al在NaOH溶液中, Al做负极。 2.根据电子流动方向或电流方向或电解质溶液内离子 的定向移动方向判断
栏 目 链 接
(1) 将氧化还原反应拆成氧化反应和还原反应两个半反应,
(2)确定电极材料。
如发生氧化反应的物质为金属单质,可用该金属直接作负
人教化学选修4第四章第一节 原 电 池(共21张PPT)

N a C l溶 液
Zn C u Zn Cu
Fe
Cu
Zn
Cu
√E
F
M
N
CCuu2SSOO 44
酒精
N a C l溶 液
H2SO4 H2SO4
三.简单原电池的工作原理:
外电路
负极
电子沿导线传递,产生电流 正极
活泼金属
A
失去电子 Zn-
不活泼金属或石墨
Cu 溶液中阳离子
氧化反应
得到电子
Zn- 2e- = Zn2+
相同点:电极反应本质相同 不同点: 构造不同
优点: 1.有效避免了电极材料与电解质溶液的直接反应, 增加了原电池的使用寿命。
2.离子在盐桥中作定向移动,使离子移动更加有序, 电流持续稳定 ,提高了原电池的使用效率。
练习三
(高考真题)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)
第四章 电化学基础
第1节 原电池
• 实验:将锌片和铜片用导线连接(导线中间 接入一个电流表),平行插入盛有稀硫酸 的烧杯中,观察现象
[实验现象]:铜片上有气泡产生,锌片不断溶解 ,电流表的指针发生偏转。 [实验结论]:导线中有电流通过
为什么会出现上面的现象?
一、原电池: 是将化学能转化为电能的装置
1、构成原电池的条件 2、探究“单液电池”,寻找 改进方法—“双液电池” 3、具有盐桥原电池的反应原 理作用
二、原电池的构成条件
1.两种不同的金属 (或一种金属与石墨或金属氧化物) 做电极
2.用导线相连(或直接接触)形成闭合回路
3.电极插入电解质溶液里
选修4《原电池原理》优秀教学课件

盐桥原电池工作微观原理
化学
盐桥中Cl-向锌盐方向移动,K+向铜盐方向移动, 使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断 从Zn极流向Cu极,使电流持续传导。
Zn-2e-=Zn2+
Cu2++2e-=Cu
单液、双液原电池原理本 质上是完全相同的。
Zn
Cu
总反应:Zn+ Cu2+ = Zn2+ + Cu
盐桥双液原电池优点:
化学
1.有效避免了电极材料与电解质溶液的直接反应, 增加了原电池的使用寿命
2.离子在盐桥中作定向移动,减少了离子的混乱, 使离子移动更加有序,电流持续稳定 , 提高了原电池的使用效率
设计盐桥原电池的思路:
化学
Zn+2Ag+=Zn2++2Ag
1、还原剂和氧化产物为负极 的半电池
。
2、电极材料:
1、电解液:溶性铜盐溶液
3、电极反应式 :
2、电极材料:
负极:
。
负极:锌,
正极:铜、石墨或比 正极:
。
锌不活泼的其他金属
Cu-Zn-CuSO4原电池
化学
负极:Zn-2e- =Zn2+(氧化反应) 正极:Cu2++2e- =Cu(还原反应) 总反应: Zn+Cu2+=Zn2++Cu
2、氧化剂和还原产物为正极 的半电池
3、根据电极反应确定合适的电极材料和电 解质溶液
外电路用导线连通,可以接用电器 内电路是将电极浸入电解质溶液中,并
通过盐桥沟通内电路
练习:
化学
标出正负极;电子流向和盐桥内部离子移动流方向
选修四:4.1原电池 (共14张PPT)

再探原电池
形成雾霾的ቤተ መጻሕፍቲ ባይዱ素? 工业排放、汽车尾气等
倡议:绿色出行
电动车
电池的发展对电动车的影响
据资料显示,目前国产比亚迪电动汽车续航里程 可达600KM
原电池将化学能转变为电能的装置
原电池工作原理: 氧化还原反应
Zn + Cu2+ = Zn2+ + Cu
原电池的构成条件:
两极 一液 一线 一反应
怎样隔离?
学习任务2 改进原电池
G
改进
G
? 盐桥
12
硫酸铜溶液
? ZnSO1243溶液 CuSO4溶液
1.盐桥电池 盐桥的成分:琼脂-KCl饱和溶液
能持续稳定的产生电流
阴离形子成分移闭析向合盐负回桥极路 阳离子平的移衡作向电用正荷?极
负极:氧化反应 Zn - 2e- = Zn2+ 正极:还原反应Cu2+ + 2e- = Cu
判断离子的移动的方向 ①利用电荷守恒分析离子移动情况
②离子交换膜对阴阳离子移动的限制
(2016浙江高考11题改编)金属(M)–空气电池(如图) 具有原料易得、能量密度高等优点,有望成为新能源汽车 和移动设备的电源。该类电池放电的总反应方程式为: 4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是____
强化练习
(2015•天津理综,4)如图锌铜原电池装置如图所 示,其中阳离子交换膜只允许阳离子和水分子 通过。判断下列说法是否正确?
(1)铜电极上发生氧化反应( × ) (2)电池工作一段时间后,甲池的c(SO42-)减小( × ) (3)电池工作一段时间后,乙池溶液的总质量增加(√ ) (4)阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡(×)
形成雾霾的ቤተ መጻሕፍቲ ባይዱ素? 工业排放、汽车尾气等
倡议:绿色出行
电动车
电池的发展对电动车的影响
据资料显示,目前国产比亚迪电动汽车续航里程 可达600KM
原电池将化学能转变为电能的装置
原电池工作原理: 氧化还原反应
Zn + Cu2+ = Zn2+ + Cu
原电池的构成条件:
两极 一液 一线 一反应
怎样隔离?
学习任务2 改进原电池
G
改进
G
? 盐桥
12
硫酸铜溶液
? ZnSO1243溶液 CuSO4溶液
1.盐桥电池 盐桥的成分:琼脂-KCl饱和溶液
能持续稳定的产生电流
阴离形子成分移闭析向合盐负回桥极路 阳离子平的移衡作向电用正荷?极
负极:氧化反应 Zn - 2e- = Zn2+ 正极:还原反应Cu2+ + 2e- = Cu
判断离子的移动的方向 ①利用电荷守恒分析离子移动情况
②离子交换膜对阴阳离子移动的限制
(2016浙江高考11题改编)金属(M)–空气电池(如图) 具有原料易得、能量密度高等优点,有望成为新能源汽车 和移动设备的电源。该类电池放电的总反应方程式为: 4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是____
强化练习
(2015•天津理综,4)如图锌铜原电池装置如图所 示,其中阳离子交换膜只允许阳离子和水分子 通过。判断下列说法是否正确?
(1)铜电极上发生氧化反应( × ) (2)电池工作一段时间后,甲池的c(SO42-)减小( × ) (3)电池工作一段时间后,乙池溶液的总质量增加(√ ) (4)阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡(×)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.a > b > c > d C.c > a > b .> d B.a > c > d > b D.b > d > c > a
3. 设计原电池。原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+ 要求:画出有盐桥连接的该原电池的装置示意图;标明正 负极及所用材料;写出原电池电极反应和总反应。
如何判断原电池正、负极?
电子流出的极 ——负极 ①根据电子流动方向 电子流入的极 ——正极 较活泼的电极材料 ②根据电极材料
——负极
较不活泼的电极材料 ——正极 发生氧化反应的极 ——负极
③根据原电池电极发生 发生还原反应的极 ——正极 的反应
质量减少的电极 ——负极
④根据电极增重还是减 工作后 质量增加的电极 ——正极 重
第四章 电化学基础
• 本章前言:我们已经知道化学能与热能等形式的能量可
以相互转换,严格遵循能量守恒定律。化学能与热能可以直 接转换,例如燃料的燃烧。化学能和电能之间的相互转换则 必须通过一定的装置,例如火力发电站及生活中常用的化学 电源—各种电池。电池的实用性,主要体现在能量的转换 效率。如何设计出满足生产生活需要的化学电源,是电化学 学在实际应用中要解决的重要课题。研究化学能与电能相互 装换的装置、过程和效率的科学,就是电化学。 • 从反应物与电流的关系来区分,电化学反应过程(及其 装置)可以分为两大类:产生电流的反应(发生在化学电池 中,自发的,向外输送能量)和借助电流而发生的 反应 (发生在电解池中,由外界的能量推动)。电化学的应用十 分广泛,在分析、合成等领域应用很广,由此形成的工业也 很多,如电解、电镀、电冶金、电池制造等。下面就让我们 一道来学习电化学的一些基础知识。
电能与其它能量形式转化实例
火力发电站
三峡大坝
太阳能光伏发电厂
电解铝厂
氯碱工业
生活中常见电池
普通干电池手机电池
钮扣电池
“神七”用 太阳能电池
日产新型燃料电池
笔记本电脑 专用电池
电动车专用铅蓄电池
第一节:原电池
[教学目标]:
知识与技能:1.理解原电池的工作原理,能正确书写电极(半电池)反应式; 2.理解原电池溶液阴阳离子的移动方向; 3.了解盐桥在原电池中的应用; 4.体验化学能与电能转化的探究过程 过程与方法:本节课教学可采用实验探究。通过对原电池实验的探究,引导学 生从电子转移角度理解化学能向电能转化的本质,联系实际了这 种能量转化的实际应用价值。借助实验,创设问题情景,鼓励学 生思考交流,加深理解对知识的理解。 情感态度 价值观:通过探究过程培养学生自主学习的能力和勇于探究科学知识的 精神,通过交流讨论培养学生的合作意识,通过对知识的探究 过程,使学生体验到乐趣,从而激发他们学习的兴趣。
⑤根据电极有气泡冒出:工作后,有气泡冒出的电极为正极
[问题]图(1)装置中,可以观 察到什么现象? [现象]纯锌片上有红色物质生 成,铜片上无现象。
CuSO4 溶液
(1)
CuSO4 溶液 (2)
[问题]图(2)电流表指针发生偏转 吗?指 针稳定吗?两个电极上都有什 么现象? [现象]电流表指针发生偏转,铜片表面 有红色的铜析出。随着时间的延续,电流 计指针不稳定,偏转角度变小,回到原 位,无电流产生。同时锌片表面也逐渐被 红色的铜覆盖。
图(2)中,为什么铜片和锌片上都有气红色的金属铜 产生?为什么电流计指针会很快回到原位?说明了什 么?如何对该原电池进行改进?
分析:由于锌片与CuSO4 溶液直接接触,反应
一段时间后难以避免溶液中有Cu2+在锌片表面 析出,即在负极锌表面构成了原电池,进一步加 速了铜在负极表面析出,导致电路中输出电流减 弱。当锌片表面完全被铜覆盖后,反应终止,无 电流产生。该装置中,两电极直接与CuSO4 溶液 接触,降低了原电池的供电效率。所以要想产生 持续稳定的电流,必须对该原电池装置进行改进。
4
Zn
Cu
Zn
Cu
V
Cu 2SO4
X
酒精
XNaCl溶液 V
H 2S O 4
将化学能转化成电能的装置—原电池 的构成条件
1、有两种活动性不同的金属或非金属作电极 。 负极:电子流出的一极、发生氧化反应 正极:电子流入的一极、发生还原反应 2、电极材料均插入电解质溶液中 3、两极相连形成闭合电路。 4.(本质)有自发进行的氧化还原反应。
1.课本72页制作原电池 2.73页课后习题
负极:( C) Cu - 2e- =Cu2+ 正极:(Cu) 2Fe3+ + 2e- =2Fe2+ 总反应:2Fe3+ + Cu=2Fe2+ + Cu2+
4.
原电池是利用自发的氧化还原反应将化学能转 化成电能的装置。那么电能能转化成化学能么? 你能从生活实际中找出实际例子吗?
答:电能和化学能能相互转化。实际生产生活中如蓄电池放电完毕后充 电过程,利用电能电解冶炼铝和氯碱工业等。
【交流●改进 如何改进原电池?在原有实验基础上进行改进,设 】
计成一个能产生持续稳定电流的原电池。
改 进
改 进
双液原电池
盐桥:在U型管中装满用饱和KCl溶液和
琼胶作成的冻胶。用棉花塞住两端,将U形 管倒置于两电解质溶液之间,代替两溶液 的直接接触,就构成了盐桥。这样使两个 烧杯中的溶液连成一个通路。
电池总反应式:Zn+Cu2+=Cu+Zn2+
双液原电池的工作原理 1、构造特点:
由两个半电池组成,氧化还原反应的还 原剂与氧化剂分别位于两个半电池中, 中间通过盐桥连接形成闭合回路。 2、电极反应: 负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Cu):Cu2++2e-=Cu(还原反应) 电池反应: Zn+Cu2+=Zn2++Cu 3、电子、电流的流向 电子由负极(Zn片)流向正极(Cu片); 电流由正极(Cu片)流向负极(Zn片); 内电路:阳离子移向正极(Cu片);阴离子移向负极(Zn片)。 外电路:
4、盐桥的作用
盐桥的作用:(1)使整个装置构成通路,代替两
溶液直接接触
(2)让溶液始终保持电中性使电极反应得以
继续进行 在整个装置的电流回路中,溶液中的电流通路是靠离子 迁移完成的。取出盐桥,Zn失去电子形成的Zn 2+ 进入ZnSO4 溶 液,ZnSO 4 溶液因Zn 2+ 增多而带正电荷。同时,CuSO 4 则由于 Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中 性,这两种因素均会阻止电子从锌片流向铜片,造成电流中 断 。 由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶 液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别 中和过剩的电荷,保持溶液的电中性,因而放电作用不间 断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几 乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀, 可用NH4NO3代替KCl作盐桥。
[教学重点]:进一步了解原电池的工作原理,能够书写电级反 应式和电池反应式 [教学难点]:电极(半电池)反应、电池反应方程式的书写
下列哪几个装置能构成原电池? 回顾原电池的构成条件?
Zn Cu
Fe
Cu
Zn
Zn Zn
Cu
V H SO
2
V
H2SO4
X
H 2 SO 4
Fe
ห้องสมุดไป่ตู้Cu
X
H2SO4 H2SO4
Cu
板书设计
• 一、正负极材料选取及判断
• 二、两级电极反应书写 • 三、原电池的工作原理
• 四、盐桥及其作用
1.判断下列哪些装置是原电池?若不是,请说明理由; 若是,请指出正负极材料,并写出电极反应式.
练 习
(× )
(√ ) 负极:Fe - 2e- = Fe2+
正极: 2H+ + 2e- = H2↑ 总反应: Fe + 2H+ = Fe2+ + H2↑ 2.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连 组成原电池。若a、b相连时,a为负极;c、d相连时,电流 由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b 上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 (A )
【实验三】 教材P71“实验4-1”
实验现象: Zn ①盐桥存在时电流计指针偏转,且指针偏 转角度随时间的延续几乎保持不变; ②Zn片溶解,无红色物质析出,Cu片上 ZuSO4 有红色物质析出; 溶液 ③取出盐桥电流计指针回到零点。
G
盐桥
Cu
CuSO4 溶液
实验结论: Zn—Cu—ZnSO4溶液—CuSO4溶液—盐桥构成了 原电池,能产生持续、稳定的电流;取出盐桥时没 有电流产生,不能形成原电池. 负 极:Zn-2e-=Zn2+ 正 极:Cu2++2e-=Cu
原 电 池工作 原 理
外电路
失e,沿导线传递,有电流产生
氧化反应
还原反应
负极
Zn-2e=Zn2+
阴离子
铜锌原电池 正极
Cu2++2e- =Cu
阳离子
阳离子 电解质
溶液
内电路
电 负极: Zn-2e- =Zn2+ (氧化反应) 极 正极:Cu2++2e- =Cu (还原反应) 反 (离子方程式) 总反应: Zn+Cu2+=Zn2++Cu 应 Zn+CuSO4=ZnSO4+Cu (化学方程式)
3. 设计原电池。原电池总反应式为:Cu+2Fe3+=Cu2++2Fe2+ 要求:画出有盐桥连接的该原电池的装置示意图;标明正 负极及所用材料;写出原电池电极反应和总反应。
如何判断原电池正、负极?
电子流出的极 ——负极 ①根据电子流动方向 电子流入的极 ——正极 较活泼的电极材料 ②根据电极材料
——负极
较不活泼的电极材料 ——正极 发生氧化反应的极 ——负极
③根据原电池电极发生 发生还原反应的极 ——正极 的反应
质量减少的电极 ——负极
④根据电极增重还是减 工作后 质量增加的电极 ——正极 重
第四章 电化学基础
• 本章前言:我们已经知道化学能与热能等形式的能量可
以相互转换,严格遵循能量守恒定律。化学能与热能可以直 接转换,例如燃料的燃烧。化学能和电能之间的相互转换则 必须通过一定的装置,例如火力发电站及生活中常用的化学 电源—各种电池。电池的实用性,主要体现在能量的转换 效率。如何设计出满足生产生活需要的化学电源,是电化学 学在实际应用中要解决的重要课题。研究化学能与电能相互 装换的装置、过程和效率的科学,就是电化学。 • 从反应物与电流的关系来区分,电化学反应过程(及其 装置)可以分为两大类:产生电流的反应(发生在化学电池 中,自发的,向外输送能量)和借助电流而发生的 反应 (发生在电解池中,由外界的能量推动)。电化学的应用十 分广泛,在分析、合成等领域应用很广,由此形成的工业也 很多,如电解、电镀、电冶金、电池制造等。下面就让我们 一道来学习电化学的一些基础知识。
电能与其它能量形式转化实例
火力发电站
三峡大坝
太阳能光伏发电厂
电解铝厂
氯碱工业
生活中常见电池
普通干电池手机电池
钮扣电池
“神七”用 太阳能电池
日产新型燃料电池
笔记本电脑 专用电池
电动车专用铅蓄电池
第一节:原电池
[教学目标]:
知识与技能:1.理解原电池的工作原理,能正确书写电极(半电池)反应式; 2.理解原电池溶液阴阳离子的移动方向; 3.了解盐桥在原电池中的应用; 4.体验化学能与电能转化的探究过程 过程与方法:本节课教学可采用实验探究。通过对原电池实验的探究,引导学 生从电子转移角度理解化学能向电能转化的本质,联系实际了这 种能量转化的实际应用价值。借助实验,创设问题情景,鼓励学 生思考交流,加深理解对知识的理解。 情感态度 价值观:通过探究过程培养学生自主学习的能力和勇于探究科学知识的 精神,通过交流讨论培养学生的合作意识,通过对知识的探究 过程,使学生体验到乐趣,从而激发他们学习的兴趣。
⑤根据电极有气泡冒出:工作后,有气泡冒出的电极为正极
[问题]图(1)装置中,可以观 察到什么现象? [现象]纯锌片上有红色物质生 成,铜片上无现象。
CuSO4 溶液
(1)
CuSO4 溶液 (2)
[问题]图(2)电流表指针发生偏转 吗?指 针稳定吗?两个电极上都有什 么现象? [现象]电流表指针发生偏转,铜片表面 有红色的铜析出。随着时间的延续,电流 计指针不稳定,偏转角度变小,回到原 位,无电流产生。同时锌片表面也逐渐被 红色的铜覆盖。
图(2)中,为什么铜片和锌片上都有气红色的金属铜 产生?为什么电流计指针会很快回到原位?说明了什 么?如何对该原电池进行改进?
分析:由于锌片与CuSO4 溶液直接接触,反应
一段时间后难以避免溶液中有Cu2+在锌片表面 析出,即在负极锌表面构成了原电池,进一步加 速了铜在负极表面析出,导致电路中输出电流减 弱。当锌片表面完全被铜覆盖后,反应终止,无 电流产生。该装置中,两电极直接与CuSO4 溶液 接触,降低了原电池的供电效率。所以要想产生 持续稳定的电流,必须对该原电池装置进行改进。
4
Zn
Cu
Zn
Cu
V
Cu 2SO4
X
酒精
XNaCl溶液 V
H 2S O 4
将化学能转化成电能的装置—原电池 的构成条件
1、有两种活动性不同的金属或非金属作电极 。 负极:电子流出的一极、发生氧化反应 正极:电子流入的一极、发生还原反应 2、电极材料均插入电解质溶液中 3、两极相连形成闭合电路。 4.(本质)有自发进行的氧化还原反应。
1.课本72页制作原电池 2.73页课后习题
负极:( C) Cu - 2e- =Cu2+ 正极:(Cu) 2Fe3+ + 2e- =2Fe2+ 总反应:2Fe3+ + Cu=2Fe2+ + Cu2+
4.
原电池是利用自发的氧化还原反应将化学能转 化成电能的装置。那么电能能转化成化学能么? 你能从生活实际中找出实际例子吗?
答:电能和化学能能相互转化。实际生产生活中如蓄电池放电完毕后充 电过程,利用电能电解冶炼铝和氯碱工业等。
【交流●改进 如何改进原电池?在原有实验基础上进行改进,设 】
计成一个能产生持续稳定电流的原电池。
改 进
改 进
双液原电池
盐桥:在U型管中装满用饱和KCl溶液和
琼胶作成的冻胶。用棉花塞住两端,将U形 管倒置于两电解质溶液之间,代替两溶液 的直接接触,就构成了盐桥。这样使两个 烧杯中的溶液连成一个通路。
电池总反应式:Zn+Cu2+=Cu+Zn2+
双液原电池的工作原理 1、构造特点:
由两个半电池组成,氧化还原反应的还 原剂与氧化剂分别位于两个半电池中, 中间通过盐桥连接形成闭合回路。 2、电极反应: 负极(Zn):Zn-2e-=Zn2+(氧化反应) 正极(Cu):Cu2++2e-=Cu(还原反应) 电池反应: Zn+Cu2+=Zn2++Cu 3、电子、电流的流向 电子由负极(Zn片)流向正极(Cu片); 电流由正极(Cu片)流向负极(Zn片); 内电路:阳离子移向正极(Cu片);阴离子移向负极(Zn片)。 外电路:
4、盐桥的作用
盐桥的作用:(1)使整个装置构成通路,代替两
溶液直接接触
(2)让溶液始终保持电中性使电极反应得以
继续进行 在整个装置的电流回路中,溶液中的电流通路是靠离子 迁移完成的。取出盐桥,Zn失去电子形成的Zn 2+ 进入ZnSO4 溶 液,ZnSO 4 溶液因Zn 2+ 增多而带正电荷。同时,CuSO 4 则由于 Cu2+变为Cu,使得SO42-相对较多而带负电荷。溶液不保持电中 性,这两种因素均会阻止电子从锌片流向铜片,造成电流中 断 。 由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶 液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别 中和过剩的电荷,保持溶液的电中性,因而放电作用不间 断地进行,一直到锌片全部溶解或 CuSO4溶液中的 Cu2+几 乎完全沉淀下来。若电解质溶液与KCl溶液反应产生沉淀, 可用NH4NO3代替KCl作盐桥。
[教学重点]:进一步了解原电池的工作原理,能够书写电级反 应式和电池反应式 [教学难点]:电极(半电池)反应、电池反应方程式的书写
下列哪几个装置能构成原电池? 回顾原电池的构成条件?
Zn Cu
Fe
Cu
Zn
Zn Zn
Cu
V H SO
2
V
H2SO4
X
H 2 SO 4
Fe
ห้องสมุดไป่ตู้Cu
X
H2SO4 H2SO4
Cu
板书设计
• 一、正负极材料选取及判断
• 二、两级电极反应书写 • 三、原电池的工作原理
• 四、盐桥及其作用
1.判断下列哪些装置是原电池?若不是,请说明理由; 若是,请指出正负极材料,并写出电极反应式.
练 习
(× )
(√ ) 负极:Fe - 2e- = Fe2+
正极: 2H+ + 2e- = H2↑ 总反应: Fe + 2H+ = Fe2+ + H2↑ 2.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连 组成原电池。若a、b相连时,a为负极;c、d相连时,电流 由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b 上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 (A )
【实验三】 教材P71“实验4-1”
实验现象: Zn ①盐桥存在时电流计指针偏转,且指针偏 转角度随时间的延续几乎保持不变; ②Zn片溶解,无红色物质析出,Cu片上 ZuSO4 有红色物质析出; 溶液 ③取出盐桥电流计指针回到零点。
G
盐桥
Cu
CuSO4 溶液
实验结论: Zn—Cu—ZnSO4溶液—CuSO4溶液—盐桥构成了 原电池,能产生持续、稳定的电流;取出盐桥时没 有电流产生,不能形成原电池. 负 极:Zn-2e-=Zn2+ 正 极:Cu2++2e-=Cu
原 电 池工作 原 理
外电路
失e,沿导线传递,有电流产生
氧化反应
还原反应
负极
Zn-2e=Zn2+
阴离子
铜锌原电池 正极
Cu2++2e- =Cu
阳离子
阳离子 电解质
溶液
内电路
电 负极: Zn-2e- =Zn2+ (氧化反应) 极 正极:Cu2++2e- =Cu (还原反应) 反 (离子方程式) 总反应: Zn+Cu2+=Zn2++Cu 应 Zn+CuSO4=ZnSO4+Cu (化学方程式)
