浙教版初中科学化学部分综合练习
浙教版八年级上册科学1.5物质的溶解综合练习(答案)

1.5 物质的溶解目录:一、知识点回顾二、基础题(一)溶解时的吸放热情况(二)饱和溶液的判断(三)饱和溶液与不饱和溶液的转化(四)溶解度概念理解(五)溶解度影响因素(六)溶质质量分数基础计算(七)溶液配制操作练习三、培优题(一)概念辨析(二)图像分析(三)溶液配制误差分析四、拓展题一、知识点回顾1.物质的溶解性(1)定义:表示物质在一种特定溶剂中的溶解能力的大小。
(2)比较不同物质的溶解性实验:必须在一定的温度、一定量的溶剂及该物质不能再继续溶解的条件下进行比较。
(3)影响物质溶解性的因素:溶质性质、溶剂性质、温度等。
(4)溶于水时的吸放热情况:①放热:氢氧化钠固体、生石灰、浓硫酸②吸热:硝酸铵③不吸热也不放热:蔗糖、食盐2.饱和溶液(1)定义:饱和溶液:一定温度下,一定量的溶剂里,不能..继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
不饱和溶液:一定温度下,一定量的溶剂里,还能..继续溶解某种溶质的溶液,称为这种溶质的饱和溶液。
(2)饱和溶液与不饱和溶液的相互转化(3)注意:溶液浓稀指的是溶质含量的多少,饱和与否看的是是否还能继续溶解该种溶质。
所以二者无必然联系。
3.物质的溶解度(1)定义:定量的表示物质的溶解能力。
即在一定温度下.....,某物质在100g....的溶剂中达到饱.和状..态.时所溶解的质量..为该物质在这种溶剂里的溶解度。
(2)溶解性等级:(3)溶解度的影响因素➢固体:温度(大多数固体溶解度随温度上升而上升;氢氧化钙的溶解度随温度上升而下降)➢气体:温度、压强(气体的溶解度随温度上升而下降;随压强的增大而增大)4.溶质质量分数(1)定义:表示一定量的溶液中有多少溶质,即表示溶液的浓度。
(2)计算方法:溶质质量分数=溶质质量溶液质量×100%=溶质质量溶质质量+溶剂质量×100%(3)配制溶液步骤:(如:配制质量分数为10%的氯化钠溶液50g)①计算:需要氯化钠5g;水45g(通过密度公式计算得出体积为45ml)②称量和量取:用托盘天平称量固体;用量筒量取液体③溶解:溶解时将氯化钠放入烧杯中,再倒水,用玻璃棒搅拌至完全溶解④装瓶:装入试剂瓶中,贴好标签。
化学实验探究综合练习-浙教版九年级上册科学
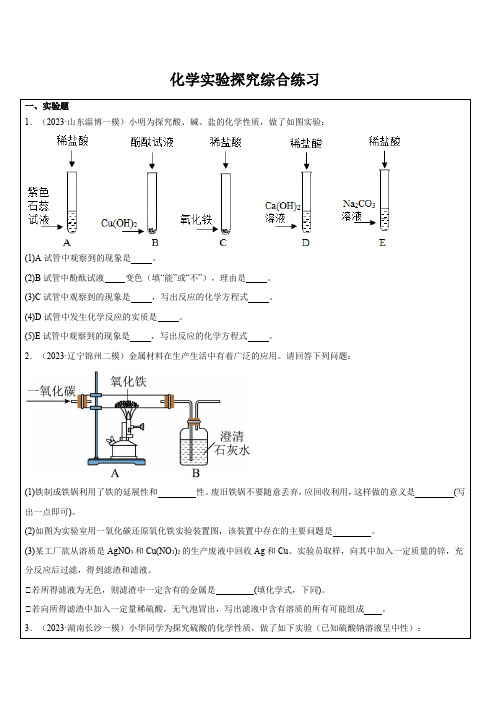
化学实验探究综合练习一、实验题1.(2023·山东淄博一模)小明为探究酸、碱、盐的化学性质,做了如图实验:(1)A试管中观察到的现象是。
(2)B试管中酚酞试液变色(填“能”或“不”),理由是。
(3)C试管中观察到的现象是,写出反应的化学方程式。
(4)D试管中发生化学反应的实质是。
(5)E试管中观察到的现象是,写出反应的化学方程式。
2.(2023·辽宁锦州二模)金属材料在生产生活中有着广泛的应用。
请回答下列问题:(1)铁制成铁锅利用了铁的延展性和性。
废旧铁锅不要随意丢弃,应回收利用,这样做的意义是(写出一点即可)。
(2)如图为实验室用一氧化碳还原氧化铁实验装置图,该装置中存在的主要问题是。
(3)某工厂欲从溶质是AgNO3和Cu(NO3)2的生产废液中回收Ag和Cu。
实验员取样,向其中加入一定质量的锌,充分反应后过滤,得到滤渣和滤液。
①若所得滤液为无色,则滤渣中一定含有的金属是(填化学式,下同)。
①若向所得滤渣中加入一定量稀硫酸,无气泡冒出,写出滤液中含有溶质的所有可能组成。
3.(2023·湖南长沙一模)小华同学为探究硫酸的化学性质,做了如下实验(已知硫酸钠溶液呈中性):【实验现象】(1)试管C 中的现象是 。
【实验结论与分析】(2)反应后试管B 中一定含有的离子是 。
(写离子符号)(3)上述试管中发生的反应属于复分解反应的是 。
(填试管编号)(4)分析上述反应,说明硫酸能与酸碱指示剂、活泼金属、金属氧化物、某些碱和某些 反应。
【实验拓展】实验结束后小华同学将试管D 、E 中的废液缓缓倒入同一个烧杯中,发现沉淀增加了。
(5)小华认为反应后试管E 中的溶质一定含Na 2SO 4、Na 2CO 3,请你判断他的说法是否正确,并说明理由: 。
(6)请你设计实验证明反应后试管E 中的溶质是什么物质: 。
4.(2023·陕西西安模拟)春晚舞蹈《只此青绿》源于宋代名作《千里江山图》,它是我国传世名画之一,宋代画家王希孟创造性地将炭黑、赭石、孔雀石、蓝铜矿、赤铁矿等矿物颜料用在不同的画层。
初中科学练习卷:九年级科学化学综合试题卷1(2021年初中科学浙教版)

九年级科学化学综合试题卷1一、选择题1.材料与人类生活紧密相关,下列物品所用材料不属于金属材料的是()A.人造骨—钛合金B.马踏飞燕—青铜C.钻石—金刚石D.金饰品—黄金2.下列物质:①空气②硫酸③氧气④硫酸钠⑤水⑥氢氧化钠⑦天然气⑧生铁⑨碳酸钙,对其分类完全正确的是()A.混合物:①⑥⑦⑧B.酸:②④C.氧化物:③⑤D.盐:④⑨3.XYZ三种金属及其化合物间可发生反应:Y+ZCl2=Z+YCl2、X+ZCl2=Z+XCl2、Y+2HCl=YCl2+H2↑、X+2HCl不反应。
则X、Y、Z三种金属活动性由强至弱的顺序的是()A.X>Y>ZB.Z>X>YC.Y>X>ZD.Y>Z>X4.医疗上,用小苏打治疗胃酸过多的原理是:NaHCO3+HCl=NaCl+H2O+CO2↑,该反应的基本类型是() A.化合反应 B.复分解反应 C.置换反应 D.分解反应5.下列说法正确的是()A.铁钉在潮湿的空气中容易生锈B.钢铁是钢和铁熔合在一起制得的具有金属特性的合金C.铜粉在空气中加热后固体质量增加,因此这个反应不遵守质量守恒定律D.处理金属废弃物的方法是填埋法6.下列物质不能与BaCl2溶液发生反应的是()A.CuSO4B.AgNO3C.CaCl2D.Na2CO37.下列各组物质中,通常情况下不能发生化学反应的是()A.铁与硫酸铜溶液B.氢氧化镁与稀盐酸C.碳酸钠与稀硫酸D.氮气和氧气8.在检验某未知蓝色溶液的成分时,向样品中滴加氯化钡溶液,有白色沉淀产生,不同的实验者分别就此溶液的成分提出了下列四种不用的假设,其中比较合理的是()A.Cu(NO3)2、Na2SO4、NaOHB.Cu(NO3)2、KCl、NaNO3C.Cu(NO3)2、H2SO4、K2SO4D.Cu(NO3)2、AgNO3、HCl9.下列各组物质,能在PH=1.5的溶液中大量共存,且形成无色溶液的是()A.NaCl、BaCl2、Na2SO4B.Na2CO3、NaCl、Na2SO4C.CuSO4、NaCl、NaNO3D.Na2SO4、HCl、KCl10.除去下列物质中的杂质,所选用的试剂和操作方法都正确的是()选项物质杂质(少量)试剂及操作方法A 石灰石氧化钙加入稀盐酸,过滤B 氮气水蒸气通入足量的氢氧化钠固体干燥剂C 氯化钠碳酸钠加入足量的水,溶解、蒸发、结晶D 稀盐酸稀硝酸加入过量的硝酸银溶液,过滤11.如图所示实验,一段时间后,不能观察到的现象是()A.甲图中,浸入浓硫酸的火柴梗变黑B.乙图中,浸入硫酸铜溶液部分的铁丝表面出现红色物质C.丙图中,铁钉水面处部分生锈D.丁图中,试纸变蓝色12.比较归纳是科学学习中的常用方法。
浙教版九年级科学—化学综合实验探究题
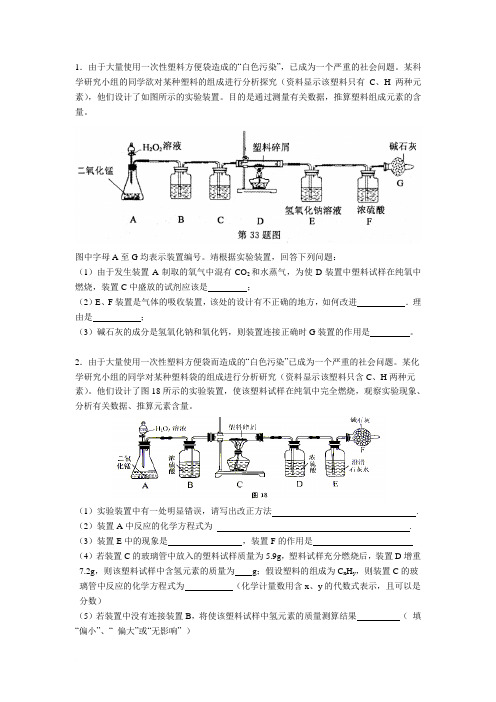
1.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。
某科学研究小组的同学欲对某种塑料的组成进行分析探究(资料显示该塑料只有C、H两种元素),他们设计了如图所示的实验装置。
目的是通过测量有关数据,推算塑料组成元素的含量。
图中字母A至G均表示装置编号。
靖根据实验装置,回答下列问题:(1)由于发生装置A制取的氧气中混有CO2和水蒸气,为使D装置中塑料试样在纯氧中燃烧,装置C中盛放的试剂应该是;(2)E、F装置是气体的吸收装置,该处的设计有不正确的地方,如何改进.理由是;(3)碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时G装置的作用是。
2.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题。
某化学研究小组的同学对某种塑料袋的组成进行分析研究(资料显示该塑料只含C、H两种元素)。
他们设计了图18所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请写出改正方法. (2)装置A中反应的化学方程式为. (3)装置E中的现象是,装置F的作用是(4)若装置C的玻璃管中放入的塑料试样质量为5.9g,塑料试样充分燃烧后,装置D增重7.2g,则该塑料试样中含氢元素的质量为g;假设塑料的组成为C x H y,则装置C的玻璃管中反应的化学方程式为(化学计量数用含x、y的代数式表示,且可以是分数)(5)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果(填“偏小”、“ 偏大”或“无影响” )(6)若此塑料为聚氯乙烯则生成物中会有_____检验此物质应在____和____之间加______ ___3.某化学兴趣小组的同学在活动中展示了一套如下图所示实验装置(假设每步均完全反应,氧化铁样品中的杂质不参加反应)。
查阅资料:草酸在浓硫酸存在时加热发生如下反应:OH CO CO O C H 22422+↑+↑−−→−∆浓硫酸通过讨论,同学们对这套装置有了多种认识。
期中复习:化学专题浙教版九年级科学上学期
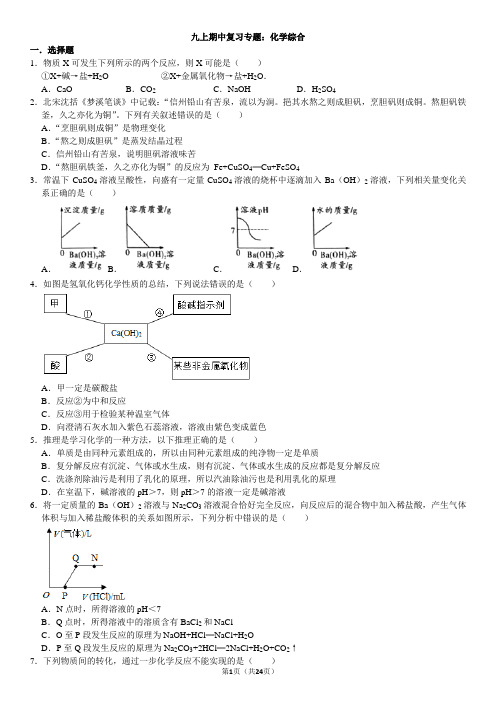
九上期中复习专题:化学综合一.选择题1.物质X可发生下列所示的两个反应,则X可能是()①X+碱→盐+H2O ②X+金属氧化物→盐+H2O.A.CaO B.CO2C.NaOH D.H2SO42.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是()A.“烹胆矾则成铜”是物理变化B.“熬之则成胆矾”是蒸发结晶过程C.信州铅山有苦泉,说明胆矾溶液味苦D.“熬胆矾铁釜,久之亦化为铜”的反应为Fe+CuSO4═Cu+FeSO43.常温下CuSO4溶液呈酸性,向盛有一定量CuSO4溶液的烧杯中逐滴加入Ba(OH)2溶液,下列相关量变化关系正确的是()A.B.C.D.4.如图是氢氧化钙化学性质的总结,下列说法错误的是()A.甲一定是碳酸盐B.反应②为中和反应C.反应③用于检验某种温室气体D.向澄清石灰水加入紫色石蕊溶液,溶液由紫色变成蓝色5.推理是学习化学的一种方法,以下推理正确的是()A.单质是由同种元素组成的,所以由同种元素组成的纯净物一定是单质B.复分解反应有沉淀、气体或水生成,则有沉淀、气体或水生成的反应都是复分解反应C.洗涤剂除油污是利用了乳化的原理,所以汽油除油污也是利用乳化的原理D.在室温下,碱溶液的pH>7,则pH>7的溶液一定是碱溶液6.将一定质量的Ba(OH)2溶液与Na2CO3溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体体积与加入稀盐酸体积的关系如图所示,下列分析中错误的是()A.N点时,所得溶液的pH<7B.Q点时,所得溶液中的溶质含有BaCl2和NaClC.O至P段发生反应的原理为NaOH+HCl═NaCl+H2OD.P至Q段发生反应的原理为Na2CO3+2HCl═2NaCl+H2O+CO2↑7.下列物质间的转化,通过一步化学反应不能实现的是()A.H2→H2O→O2B.Mg→MgO→MgCl2C.NaCl→NaNO3→Na2CO3D.CaO→CaCl2→CaCO38.等质量的a和b两种金属(已知:a和b在生成物中的化合价均为+2价)分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如图所示。
浙教版科学中考复习化学综合计算题(56张)

举一反三
• (3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌, • 此时发生的反应为:Na2CO3 + HCl=NaHCO3 + NaCl ; • 当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。请在“下图”中画出产
生气体的曲线。
22
举一反三
• (4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
浙教版科学中考复习:化学综合计算 题 (56页)-PPT执教课件【推荐】
11
浙教版科学中考复习:化学综合计算 题 (56页)-PPT执教课件【推荐】
重难点突破
• 例2:过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂 以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:
浙教版科学中考复习:化学综合计算 题 (56页)-PPT执教课件【推荐】
7
浙教版科学中考复习:化学综合计算 题 (56页)-PPT执教课件【推荐】
重难点突破
• 例1:某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO3)样品4.0 g投入200.0 g水中, 充分搅拌,通入足量CO2,溶液质量与反应的CO2质量的关系如图所示。则:
18
举一反三
• (3)向106 g 上述溶液中逐滴加入10%的盐酸并不断搅拌, • 此时发生的反应为:Na2CO3 + HCl=NaHCO3 + NaCl ; • 当Na2CO3 全部转化为NaHCO3后,再加入盐酸才开始放出CO2 。请在“下图”中画出产
生气体的曲线。
19
举一反三
• (4)另取10% Na2CO3溶液边搅拌边加入10%的盐酸,有关反应物与生成物的量如下表:
浙教版中考科学化学冲刺:化学综合训练(较难-有答案)
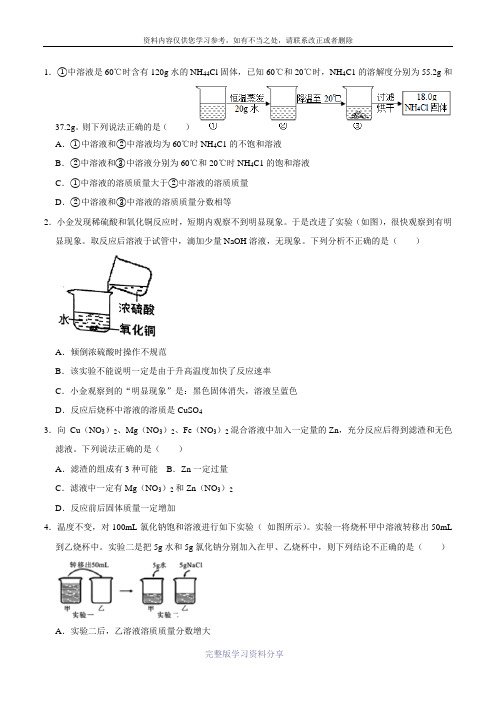
1.①中溶液是60℃时含有120g水的NH44Cl固体,已知60℃和20℃时,NH4C1的溶解度分别为55.2g和37.2g。
则下列说法正确的是()A.①中溶液和②中溶液均为60℃时NH4C1的不饱和溶液B.②中溶液和③中溶液分别为60℃和20℃时NH4C1的饱和溶液C.①中溶液的溶质质量大于②中溶液的溶质质量D.②中溶液和③中溶液的溶质质量分数相等2.小金发现稀硫酸和氧化铜反应时,短期内观察不到明显现象。
于是改进了实验(如图),很快观察到有明显现象。
取反应后溶液于试管中,滴加少量NaOH溶液,无现象。
下列分析不正确的是()A.倾倒浓硫酸时操作不规范B.该实验不能说明一定是由于升高温度加快了反应速率C.小金观察到的“明显现象”是:黑色固体消失,溶液呈蓝色D.反应后烧杯中溶液的溶质是CuSO43.向Cu(NO3)2、Mg(NO3)2、Fe(NO3)2混合溶液中加入一定量的Zn,充分反应后得到滤渣和无色滤液。
下列说法正确的是()A.滤渣的组成有3种可能B.Zn一定过量C.滤液中一定有Mg(NO3)2和Zn(NO3)2D.反应前后固体质量一定增加4.温度不变,对100mL氯化钠饱和溶液进行如下实验(如图所示)。
实验一将烧杯甲中溶液转移出50mL 到乙烧杯中。
实验二是把5g水和5g氯化钠分别加入在甲、乙烧杯中,则下列结论不正确的是()A.实验二后,乙溶液溶质质量分数增大B.实验一后,甲和乙中溶质质量分数相等C.实验二后,甲溶液变为不饱和溶液D.实验二后,甲和乙溶液中溶质质量相等5.已知20℃时硝酸钾的溶解度为31.6g,分析下列实验过程,可以作出的正确判断是()实验操作实验结果①20℃时,取100g水,加入25g硝酸钾,搅拌全部溶解,得到溶液甲②再加25g硝酸钾,充分搅拌得到溶液乙③加热全部溶解,得到溶液丙④冷却至20℃析出晶体,得到溶液丁A.溶液甲的质量分数为25% B.溶液丁的质量分数与溶液乙的质量分数相等C.溶液丙一定是不饱和溶液D.溶液乙的质量为150克6.检测氢氧化钙性质的实验后,某试管废液中含有盐酸和氯化钙,科学兴趣小组的同学对此溶液进行进一步探究。
化学选择题综合练习-浙教版九年级上册科学

化学选择题综合练习一、单选题1.能解释“古代铁制品保存至今的很少”的理由是A.铁元素在地壳的含量少B.铁易生锈,铁锈对铁制品无保护作用C.铁易置换出其他金属D.冶炼铁的原料少,且冶炼困难2.(2021·四川乐山二模)甲、乙、丙为初中化学常见物质,它们之间的转化关系如下图所示(反应条件,部分反物和生成物已略去,“→”表示直接转化关系)。
推断正确的是A.若甲为碳酸钙,乙为氧化钙,则丙一定为水B.若甲为氧化铁,乙为铁,则丙可以为硫酸亚铁C.若丙为水,乙为二氧化碳,则甲可以为酸、盐、氧化物D.若甲为盐酸,乙为氯化亚铁,则丙可以为氯化铜3.(2021·内蒙古鄂尔多斯中考真题)对于反应NH4NO3+NaOH===NaNO3+NH3↑+H2O,相关说法正确的是A.上述反应属于复分解反应B.排放在空气中的氨气不会造成大气污染C.铵态氮肥与碱性物质混用,不会降低肥效D.在N.H4N.O3中,氮元素化合价相同4.(2023·西藏·统考中考真题)将粗细相同的X、Y、Z三种金属丝分别放入质量和浓度相同的稀盐酸中,根据下图所示的实验现象,三种金属的活动性强弱顺序正确的是A.Y>Z>X B.X>Z>Y C.Z>Y>X D.Z>X>Y5.下列关于资源的叙述正确的是A.回收一个金属饮料罐比制造一个新的要便宜20%,还可以节约金属资源和95%的能源B.我国的金属矿藏比较丰富,其中金、银都以单质的形式存在C.钛和钛合金是21世纪重要的金属材料D.目前世界上已有90%以上的铁和50%以上的金得到了回收利用6.(2023·河北沧州模拟)将一定质量的锌粉加入含硝酸银和硝酸铜的混合溶液中,充分反应。
反应过程中固体质量与加入锌粉的质量关系如图所示。
下列说法正确的是A.a点固体为锌和银B.b点固体中加入稀盐酸有气泡产生C.c点溶液为无色D.d点固体为银和铜7.(2023·湖北襄阳二模)化学兴趣小组的同学为确定某铁合金样品是生铁还是钢,他们取22.6g铁合金样品盛放到锥形瓶中,将100g稀硫酸分成5等份,分5次加入锥形瓶,充分反应后记录实验数据如下表所示:(假设铁合金样品中只含有铁、碳两种元素),以下说法不正确的是次数第1次第2次第3次第4次第5次加入稀硫酸的质量(g)2020202020瓶中物质总质量(g)m82C.第3次加入的稀硫酸完全反应D.该铁合金样品中铁的质量分数为65%8.(2021秋·江苏苏州·九年级校考阶段练习)如图是某化学兴趣小组设计的观察铁制品锈蚀的实验装置。
浙教版科学九年级上:化学综合拔高训练带答案

化学综合1一.选择题1.在氢氧化钠溶液中加入一定量的稀硫酸后,下列哪种情形说明两者恰好完全中和?()A.滴入适量FeCl3溶液,溶液变黄,但无沉淀生成B.测得反应后溶液中Na+与SO42﹣的个数比为2:1C.滴入几滴酚酞试液,酚酞试液不变色D.滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀2.10克20%的氢氧化钠溶液和10克20%的稀硫酸充分混合,混合后的溶液pH值()A.等于7 B.小于7 C.大于7 D.等于03.某同学在学习了金属及其化合物之间的转化规律后,绘制了可以通过一步反应制取MgSO4的思维导图,其中所选用的物质错误的是()A.①一Mg B.②﹣Mg(NO3)2C.③﹣H2SO4D.④﹣Mg(OH)24.相同条件下,离子浓度越大,溶液导电性越强。
将含有酚酞的Ba(OH)2溶液平均分成两份置于两个烧杯中并插入电导率传感器,往其中一份滴加硫酸铜溶液,往另一份滴加硫酸钠溶液,测得溶液的导电性变化如图所示。
下列说法正确的是()A.甲曲线对应氢氧化钡与硫酸钠反应B.M点时甲曲线的烧杯中的固体和液体中均没有离子C.乙过程中溶液始终为红色D.乙过程中溶液中四种离子数目都减少5.下列对于氢氧化钠溶液样品是否变质进行的相关实验中,实验现象及结论均合理的是()A.取少量样品,加入几滴酚酞试液,溶液由无色变红色,证明氢氧化钠溶液没有变质B.若样品部分变质,滴入稀盐酸,立即有大量气体产生C.取少量样品,加入过量的氯化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞试液,溶液不变色,证明氢氧化钠溶液完全变质D.取少量样品,加入过量的氢氧化钡溶液,有白色沉淀生成,过滤,向滤液中加入几滴酚酞试液,溶液由无色变红色,证明氢氧化钠溶液部分变质6.已知①中盛有一定量的碳酸钠溶液,根据如图所示的实验过程,下列说法不正确的是()A.②中溶液为红色B.③中溶液的溶质一定含有的是氢氧化钠C.④中溶液中存在大量的Cl﹣、Na+、Ca2+、H+D.加入过量稀盐酸后,③中观察到沉淀消失,溶液的颜色没有变化、同时产生大量气泡7.小乐完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀,则下列说法中,正确的是()A.甲实验结束后,试管中的废液含稀盐酸和CaCl2B.乙实验结束后,试管中的废液只含NaCl溶质C.最终,废液缸中一定含NaCl、CaCl2两种溶质D.最终,废液缸中一定含NaCl、Na2CO3两种溶质8.常温下,乙既能与甲反应又能与丙反应的是()选项物质甲物质乙物质丙A HCl Zn AgClB HSO4Fe2O3NaCl2C Ba(OH)Na2CO3CaCl22D HSO4Ba(OH)2KNO32A.A、B.B、C.C、D.D、9.下列各组所示的化学变化中,不可能实现的是()A.Cu E F CuOB.Fe2(SO4)3滤液X沉淀Y Fe2(SO4)3C.CuO R滤液J Cu(OH)2D.BaCO3M滤液Q BaCO310.向CuSO4溶液中加入一定量的铁粉充分反应,下列情况可能出现的是()①溶液中有Fe2+,不溶物为Fe、Cu②溶液中有Fe2+、Cu2+,不溶物为Fe③溶液中有Fe2+、Cu2+④溶液中有Cu2+,不溶物为FeA.②③B.①④C.①③D.③④11.向AgNO3、Cu(NO3)2和Fe(NO3)2的混合溶液中加入一定量的Zn粉,充分反应后过滤,将滤渣洗涤、干燥、称量,发现滤渣的质量等于加入Zn粉的质量。
(完整word版)浙教版初中科学化学部分综合练习

化学部分综合练习一、选择题:2. 发射“嫦蛾一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N2+2N2O4=3X+2CO2+4H2O,则X的化学式为( )A.N2 B.H2C.O2D.CO3. 氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )A.化合反应B.分解反应C.置换反应D.复分解反应4. (08广东)右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是( )6.某物质在空气中完全燃烧生成8.8g二氧化碳和5.4g水,则关于这种物质的组成描述正确的是( )A.该物质只含有碳元素和氢元素B.该物质中碳元素与氯元素的质量比为12︰1C.该物质一定含有碳元素和氢元素,可能含有氧元素D.该物质的分子中碳原子与氢原子的个数比为1︰27. 下列化学方程式符合题意且书写正确的是( )A.正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3B.医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+HCl=MgCl2+H2OC.工业上用高温煅烧石灰石的方法制生石灰:CaCO3高温CaO+H2OD.证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑8.煤气中添加少量有特殊臭味的乙硫醇(C2H5SH),可以提醒人们预防煤气泄露。
乙硫醇在煤气燃烧过程中也可充分燃烧,其反应方程式为2C2H5SH +9O2点燃4CO2+ 2X + 6H20,则 X 的化学式为:( )A.SO3 B.SO2C.COD.H2SO49. CO2是产生温室效应的罪魁祸首,只用C、CO、CuO、CaCO3、稀盐酸五种物质,进行单一(一种反应物)或两两反应,可写出产生CO2的化学方程式有:( )A.2个B.3个C.4个D.5个12. 将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:物质 a b c d反应前质量(g) 6.4 3.2 4.0 0.5反应后质量(g) 待测 2.56 7.2 0.5 下列说法中错误的是( )A.a和b是反应物,d可能是催化剂。
浙教版九年级科学上册 第一章《物质及其变化》综合练习(含答案)

浙教版九年级科学第一章《物质及其变化》章节综合练习一、单选题1.在①氢氧化铁、②硝酸钡、③稀盐酸、④氢氧化钠四种物质中。
跟硫酸钠、硫酸镁都能发生反应且体现“硫酸盐通性”的组合是()A. ①②③④B. ①②③C. ②D. ①②2.我国研制的大型激光器“神光二号”用了磷酸二氢钾(化学式为KH2PO4)晶体.下列说法正确的是( )A. 磷酸二氢钾可作复合肥料B. 磷酸二氢钾是一种酸C. 磷酸二氢钾中含有4个元素D. 磷酸二氢钾中磷元素的化合价为+3价3.向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。
下列说法正确的是()A. a点溶液中含有两种溶质B. bc段发生反应的类型为置换反应C. d点浓液中主要存在的离子为Na+、Cu2+、OH-、SO42-D. 根据图中数据可以计算出氢氧化钠溶液的浓度4.下列有关酸的叙述中正确的是()A. 冷的浓盐酸可以用铁桶存放B. 硫酸溶液中K+、Ca2+、OH-、Cl-可以大量共存C. 稀盐酸能跟硝酸银反应体现了酸的通性D. 稀硝酸能跟铁反应,但不生成氢气5.分析推理是科学学习和研究中常用的思维方法。
下列分析推理正确的是( )A. 中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应B. 碱溶液的pH都大于7,因此pH大于7的溶液一定是碱溶液C. 硫酸溶液与BaCl2溶液能反应产生白色沉淀,因此能与BaCl2溶液反应产生白色沉淀的一定是硫酸溶液D. 稀硫酸滴入石蕊试液后溶液变红色,因此盐酸滴入石蕊试液也变红色6.下列四组溶液,不用其他试剂,无法将其鉴别出来的是( )A. BaCl2、Na2SO4、K2CO3、KNO3B. H2SO4、KOH、Ba(OH)2、CuSO4C. HCl、Ba(NO3)2、NaCl、Na2CO3D. HCl、H2SO4、BaCl2、Na2CO37.某同学在科学晚会上为大家现场作了一幅《镜湖灯影》的景色画:他在白纸上用干净的毛笔蘸取甲溶液“画上”一串灯影,再用另一支毛笔蘸取乙溶液在灯影周围“画上”一片湖水,将白纸挂在墙上,待晾干后,用装有丙溶液的喷雾器向白纸上喷洒,结果出现了“蓝色的湖面上倒映着红色的灯影”的画面。
期末复习专题1:化学综合(2024年)浙教版科学九年级上册(含答案)

期末复习 化学专题 一、选择题1.电脑芯片的制作要用到高纯度的硅。
目前广泛采用石英砂(主要成分是SiO 2)为原料制取,其中一步反应为SiO 2 +2C高温Si+2CO ↑。
对该反应分析正确的是( )2.A .该反应属于置换反应B .碳发生了还原反应C .碳元索化合价由0价变为+4价D .该反应利用了CO 的还原性2.一定质量的Zn 加入到含有Fe(NO 3)2和AgNO 3两种物质的混合溶液中,充分反应后过滤液仍为浅绿色,下列叙述正确的是( )①滤液中一定有Zn 2+、Fe 2+①滤液中可能有Ag +①滤渣中一定有Ag ,可能有Fe A .①① B .①① C .①① D .①①①3.将砂纸打磨过的铝丝插入硫酸铜溶液中,经研究发现该反应的微观示意图如图所示(图中微粒未完全画出),则下列说法中不正确的是( )A .酸铜溶液中含有的微粒是Cu 2+、24SO -B .反应过程实际是金属铝与铜离子的反应,硫酸根离子反应前后没有改变C .反应的微观实质是:2Al+3Cu 2+=2Al 3++3CuD .硫酸溶液呈蓝色,硫酸铝溶液为无色,说明蓝色与Cu 2+有关4.有一包固体,可能由硝酸铜、硫酸钠、氯化钠、碳酸氢钠、氢氧化钠中一种或几种组成。
为了探究该固体的组成,某化学小组设计并开展以下实验:已知,步骤Ⅰ中固体全部消失,溶液呈蓝色。
无气泡产生。
步骤Ⅱ、Ⅲ中均可观察到有白色沉淀生成。
则下列说法正确的是( )A .氯化钠一定是原固体中含有的物质B .原固体中一定不含氢氧化钠、碳酸氢钠C .原固体中一定含有的物质是硝酸铜、硫酸钠、氯化钠D .步骤Ⅲ所得蓝色滤液中一定含有的溶质是4种5.分别把下列各组中的物质加入水中,最终可能得到无色澄清溶液的是( ) A .2MgCl NaOH 24H SO B .()32Ba NO 24Na SO HCl C .KOH 4CuSO HClD .3AgNO NaCl 3HNO6.在“甲+乙→丙+丁”的反应中。
浙教版九年级科学上册酸碱盐部分知识归纳及综合题

浙教版九年级科学上册酸碱盐部分知识归纳及综合题1.概念:1.酸由氢离子和酸根离子组成。
2.碱由金属离子(或铵根)和氢氧根离子组成。
3.盐由金属离子(或铵根)和酸根离子组成。
4.复分解反应是指由两种化合物互相交换成分,生成另外两种化合物的反应,反应方程式为XXX。
5.稀释浓硫酸的方法是把浓硫酸沿着器壁慢慢地注入水中,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中。
6.酸和碱反应生成盐和水的反应称为中和反应。
二、常见元素和原子团的化合价口诀:1.正价:一氢钾钠银,二钙镁钡锌,XXX、四硅、五氮磷。
2.负价:负一价:氟、氯、溴、碘;负二价:氧和硫。
3.可变正价:一二铜汞,二三铁,二四碳,四六硫。
4.原子团的化合价:负一价:氢氧根(OH)、硝酸根(NO3)、氯酸根(ClO3)、高锰酸根(MnO4);负二价:硫酸根(SO4)、碳酸根(CO3)、亚硫酸根(SO3)、锰酸根(MnO4);负三价:磷酸根(PO4);正一价:铵根(NH4)。
三、反应方程式:1.酸的性质:(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色;(2)酸+碱=盐+水;(3)酸+某些金属氧化物=盐+水;(4)酸+活泼金属=盐+氢气;(5)酸+盐=新盐+新酸。
2.反应方程式:锌和稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑,有气泡产生,锌粒逐渐减少。
锌和稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑。
铁和稀盐酸反应:Fe + 2HCl = FeCl2 + H2↑,有气泡产生,铁逐渐减少。
铁和稀硫酸反应:Fe + H2SO4 = FeSO4 + H2↑,溶液变成浅绿色。
铁锈和稀盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O,红色铁锈逐渐消失。
铁锈和稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O,溶液变成黄色。
氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O,黑色氧化铜逐渐消失。
综合练习浙教版科学九年级上册

2.12.2综合练习——20232024学年浙教版九年级上册科学一、单选题1.《天工开物》中记载了用炉甘石与木炭混合加热后得到锌的方法,其主要化学方程式是C+2ZnO高温2zn+CO2↑。
该反应属于()A.化合反应B.分解反应C.置换反应D.复分解反应2.硅是重要的半导体材料,SiHCl₃+H2一定条件3HCl+Si(高纯)是工业制硅流程中的化学反应之一,从基本反应类型角度,该反应属于()A.化合反应B.分解反应C.置换反应D.复分解反应3.下列现象和事实,可用金属活动性顺序作出合理解释的是()①金属镁在空气中比铝更易点燃,说明镁比铝活动性强;②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;③硫酸铜、石灰乳配制农药波尔多液,不宜用铁制容器;④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。
A.①②B.③④C.①③④D.①②③④4.光亮的铁钉在下列几种情况下(如图所示),最不容易生锈的是()A.B.C.D.5.某学生将沾有清水的细铁丝放在如图的装置中,经过几天后能观察到的现象是()A.铁丝不变,导管中水面上升B.铁丝不变,导管中水面不变C.铁丝生锈,导管中水面上升D.铁丝生锈,导管中水面不变6.向下表中的甲物质中逐滴加入相应的乙溶液至过量,反应过程中产生的气体或沉淀的质量与加入质量关系,符合下图曲线描述的是()A.A B.B C.C D.D7.向一定量的硝酸亚铁、硝酸铜的混合溶液中加入一定量的镁粉,充分反应后过滤,将过滤得到的固体洗涤、干燥后加入稀盐酸,无气泡产生,则滤液中一定存在的金属离子是()A.Mg2+、Fe2+B.Mg2+、Cu2+C.Fe2+、Cu2+D.只有Mg2+8.北斗系统的全面建成彰显了中国航天的力量,在航天科技中会用到大量金属材料。
下列有关金属材料的说法正确的是()A.合金中一定只含金属元素B.纯铜比黄铜的硬度更大C.生锈的钢铁制品没有回收价值D.钛和钛合金被广泛用于火箭、导弹等9.锌与稀硫酸发生反应时,容器中溶液质量随时间的变化曲线如图所示,不考虑水分的损失。
浙教版九年级科学_化学综合实验探究题

1.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。
某科学研究小组的同学欲对某种塑料的组成进行分析探究(资料显示该塑料只有C、H两种元素),他们设计了如图所示的实验装置。
目的是通过测量有关数据,推算塑料组成元素的含量。
图中字母A至G均表示装置编号。
靖根据实验装置,回答下列问题:(1)由于发生装置A制取的氧气中混有CO2和水蒸气,为使D装置中塑料试样在纯氧中燃烧,装置C中盛放的试剂应该是;(2)E、F装置是气体的吸收装置,该处的设计有不正确的地方,如何改进.理由是;(3)碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时G装置的作用是。
2.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题。
某化学研究小组的同学对某种塑料袋的组成进行分析研究(资料显示该塑料只含C、H两种元素)。
他们设计了图18所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请写出改正方法 .(2)装置A中反应的化学方程式为 .(3)装置E中的现象是,装置F的作用是(4)若装置C的玻璃管中放入的塑料试样质量为5.9g,塑料试样充分燃烧后,装置D增重7.2g,则该塑料试样中含氢元素的质量为 g;假设塑料的组成为C x H y,则装置C的玻璃管中反应的化学方程式为(化学计量数用含x、y的代数式表示,且可以是分数)(5)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果(填“偏小”、“ 偏大”或“无影响” )(6)若此塑料为聚氯乙烯则生成物中会有_____检验此物质应在____和____之间加______ ___3.某化学兴趣小组的同学在活动中展示了一套如下图所示实验装置(假设每步均完全反应,氧化铁样品中的杂质不参加反应)。
查阅资料:草酸在浓硫酸存在时加热发生如下反应:OHCOCOOCH22422+↑+↑−−→−∆浓硫酸通过讨论,同学们对这套装置有了多种认识。
浙教版九年级上册科学化学复习--专题一:酸、碱、盐综合练习(难度中等偏上)含答案

点燃九上化学复习--专题一:酸、碱、盐综合练习(难度中等偏上)一、选择题1.关于下列实验现象的描述正确的是( )A. 10g10%的稀盐酸和10g10%的NaOH 溶液混合,充分反映后,滴入紫色石蕊试剂颜色变为蓝色B. 红热的铁丝在空气中剧烈燃烧,火星四射C. 将浓硫酸缓慢注入水中,水立刻沸腾,液滴飞溅D. 硫在氧气中燃烧,发出明亮蓝紫色火焰,并产生有刺激性气味的SO 2气体2.10g10%的稀盐酸和10g10%的NaOH 溶液混合,充分反映后,滴入紫色石蕊试剂颜色变为A . 一定质量的AgNO 3和Cu (NO 3)2的混合溶液中加入铁粉B . 等质量的碳酸钙与足量溶质质量分数相同的稀盐酸反应C . 等质量的铁粉和锌粉分别与足量溶质质量分数相同的稀硫酸反应D . 高温条件下一氧化碳还原氧化铁3.下列各组四种无色溶液,只用酚酞就能鉴别的是( ) A.KNO 3、KCl 、HCl 、K 2SO 4 B.MgCl 2、NaOH 、HCl 、NaCl C.Na 2SO 4、NaCl 、NaOH 、HCl D.NaOH 、KOH 、NaCl 、H 2SO 44.下列实验中,能够达到实验目的的是( ) A.制备Cu (OH )2固体:用CuO 与适量NaOH 溶液混合 B.鉴别稀H 2SO 4和稀盐酸:取样,分别滴加Ba (NO 3)2溶液 C.除去CO 中少量CO 2气体:将气体通过灼热的CuO 粉末 D.分离MnO 2和KCl 固体混合物:加入足量的水溶解,过来吧5.向一定质量的CuSO 4溶液中滴加NaOH 溶液一段时间后,改为滴加稀盐酸,所得溶液质量随加入试剂总体积的变化趋势,如图所示,下列有关说法错误的是()A .b 点时所加试剂一定是稀盐酸B .加入试剂总体极为V 1时,溶液中不存在NaOHC . c 点时溶液中的溶质都是盐D .a 点时溶液中一定不存在Cu 2+6.下列说法中不正确的是( )A .含铵根离子的氮肥与碱性物质混合,能产生有刺激性气味的气体B .将燃着的木条伸入集气瓶中,木条火焰熄灭,证明集气瓶中的气体一定是二氧化碳C .检验氢氧化钠溶液中含有氯化钠的实验步骤是:先加入过量的稀硝酸,再加入硝酸银溶液D .可用水来鉴定无水硫酸铜、碳酸钙、硝酸铵、氯化钠四种白色固体7.下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( )A .用熟石灰制生石灰 CaO+H2O=Ca (OH )2 化合反应B .用氯酸钾和二氧化锰制取氧气分解反应C .用天然气作燃料 CH4+2O 2 CO 2+2H 2O 氧化反应D .用纯碱制烧碱 2KOH+Na 2CO 3=K 2CO 3+2NaOH 复分解反应8.在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持仪器已略去),引起同学们的兴趣.如图是四位同学对实验中的部分现象进行的预测,预测正确的是A. 打开活塞K ,装置①中会有气泡冒出,黑色固体消失B. 打开活塞K ,装置②中会看到液面上升,产生蓝色沉淀C. 打开活塞K ,装置②中会有气泡冒出D. 打开活塞K ,装置③中会有液体流入,产生蓝色沉淀A. NH 4+、Na +、NO 3-、CO 32- B. NO 3-、Cu 2+、SO 42-、OH - C. Mg 2+、K +、SO 42-、Cl - D. Ca 2+、Na +、HCO 3-、Cl -14.在不用指示剂的条件下,欲将含有盐酸的氯化钙溶液由酸性变为中性,应选用的试剂是( ) A. 澄清石灰水 B. 硝酸银溶液 C. 石灰石粉末 D. 生石灰粉末 15.下列各组物质的溶液,不另加试剂就能鉴别出来的一组是( ) A.Na 2CO 3 、HCl 、H 2SO 4 B.KCl 、NaCl 、Na 2SO 4 C.FeCl 3、NaOH 、KNO 3 D.HCl 、NaOH 、Ca (OH )2 16.下列实验操作、现象与结论对应关系正确的是 17.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m 的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是( )1. 铜跟浓硫酸的反应原理是:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ,某小组同学用如图所示装置制取硫酸铜.请回答以下问题:(1)图中B 装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,请将B 装置中的导管补画完整.(2)图中C 装置的作用是___ ,装置D 的作用是___ .(3)充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、用滤液做了如下实验.实验1:用pH试纸测试滤液pH,其中pH约为1实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象.你认为___ 可以说明明矾有剩余(选填“实验1”或“实验2”)(4)以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有___ (答出1点即可).三、实验探究题1.将一定量的K2CO3溶液与BaCl2溶液混合,过滤反应后的混合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学部分综合练习一、选择题:2. 发射“嫦蛾一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N2+2N2O4=3X+2CO2+4H2O,则X的化学式为( )A.N2 B.H2C.O2D.CO3. 氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:4HF+SiO2=SiF4↑+2H2O,该反应属于( )A.化合反应B.分解反应C.置换反应D.复分解反应4. 右图所示微观变化的化学反应类型,与下列反应的反应类型一致的是6.某物质在空气中完全燃烧生成8.8g二氧化碳和5.4g水,则关于这种物质的组成描述正确的是( )A.该物质只含有碳元素和氢元素B.该物质中碳元素与氯元素的质量比为12︰1C.该物质一定含有碳元素和氢元素,可能含有氧元素D.该物质的分子中碳原子与氢原子的个数比为1︰27. 下列化学方程式符合题意且书写正确的是( )A.正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3B.医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+HCl=MgCl2+H2OC.工业上用高温煅烧石灰石的方法制生石灰:CaCO3高温CaO+H2OD.证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl=2FeCl3+3H2↑8.煤气中添加少量有特殊臭味的乙硫醇(C2H5SH),可以提醒人们预防煤气泄露。
乙硫醇在煤气燃烧过程中也可充分燃烧,其反应方程式为2C2H5SH +9O2点燃4CO2+ 2X + 6H20,则 X 的化学式为:( )A.SO3 B.SO2C.COD.H2SO49. CO2是产生温室效应的罪魁祸首,只用C、CO、CuO、CaCO3、稀盐酸五种物质,进行单一(一种反应物)或两两反应,可写出产生CO2的化学方程式有:( )A.2个B.3个C.4个D.5个12. 将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下:物质 a b c d反应前质量(g) 6.4 3.2 4.0 0.5反应后质量(g) 待测 2.56 7.2 0.5 下列说法中错误的是( )A.a和b是反应物,d可能是催化剂。
B.反应后a物质的质量为4.64gC.c物质中元素的种类,一定等于a、b二种物质中元素的种类D.若物质a与物质b的相对分子质量之比为2:1,则反应中a与b的化学计量数之比为2:114. 在反应2A+5B=2C+4D中,C、D的相对分子质量之比为9:22。
若2.6gA与B完全反应后,生成8.8 gD。
则在此反应中,B与D的质量比为( )A.4:9B.8:11C.10:11D.31:4416. 下图是某兴趣小组设计的四个实验装置,其中实验能够成功的是20. 对反应X+3NaOH=3Y+Fe(OH)3↓的分析,错误的是( )A.X中含有三价元素B.X可能是Fe2(SO4)3C.Y中一定含有Na元素D.Y可能是NaNO39. 下列实验操作不当的是( )A.将烧碱放在已知质量的烧杯里用托盘天平称量B.将试管夹从试管底部往上套,夹在试管的中上部C.振荡试管时.用手紧握试管,拇指堵住试管口,上下晃动D.滴加液体时,滴瓶滴管的尖端不能触及已加过其它试剂的试管壁17.)化学实验过程中要规操作,注意实验安全,如果发生意外也要冷静处理。
1. 下列有关食品加工的做法不会影响人体健康的是( )A.用甲醛的水溶液浸泡海产品B.用碳酸氢钠焙制糕点C.用淀粉、蔗糖、奶香精配成奶粉D.用工业石蜡涂抹在瓜子表面增加光泽3. 下列有关媒体的报道与化学知识不相违背的( )A.某洗发水不含任何化学物质B.科研人员发明了一种特殊催化剂,可以使水变为汽油C.有关部门利用明矾对饮用水进行消毒杀菌,从而解决了灾民饮水难的问题D.科研机构发明了一种用植物秸秆生产乙醇的新工艺10.人体备注中钾元素偏低会影响肌肉和神经功能。
下列物质中适合人体补充钾元素的是( )C.KOHD.KCN(氰化钾)A.KClB.KNO314.日常生活中的下列做法存在安全隐患的是( )①机动车推广使用乙醇汽油;②液化石油气罐中残留液体倒入下水道;③为降低居室甲醛含量,新装修住房应紧闭门窗,并放置一盆水;④虾仁等水产品用甲醛的稀溶液进行处理,延长保鲜时间;⑤节日大量燃放烟花爆竹,增加喜庆气氛。
A.全部 B .除①外 C .除①③外 D .除③⑤外3. 向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,分反应后过滤。
以下判断错误的是( )A.滤纸上可能含有铜B.滤液中可能含有硫酸亚铁C.滤液中可能含有硫酸铜D.滤纸上可能含有氧化铜4.(2008年市)质量相同的下列金属,分别加入到足量的稀盐酸中充分反应,放出氢气最多的是( ) CA.MgB.AlC.CuD.Zn10.下列说确的是( )A.铁在潮湿的空气中容易生锈B.金属的活动性:Zn>Ag>CuC.合金属于纯净物D.铝是地壳中含量最多的元素16.向一定量的铁粉中逐滴加入稀硫酸至过量,下图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示()A.消耗铁粉的质量 B生成硫酸亚铁的质量C溶液的总质量 D生成氢气的质量17.(2008年市)印刷铜制电路板的“腐蚀液”为FeCl3溶液。
已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。
现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说确的是A.溶液中一定含FeCl3,固体一定是铁和铜B.溶液中一定含FeCl2,固体一定含铜C.溶液中一定含FeCl2、CuCl2,固体一定含铜D.溶液中一定含FeCl2,固体一定是铁和铜33.2008年奥运会主体育场的外形好似“鸟巢”(The Bird Nest),有一类物质也好似鸟巢,如化学式是B5H9的五硼烷(见右图)。
下列有关五硼烷的说法错误的是A.五硼烷属于化合物B.五硼烷的相对分子质量是64C.五硼烷中硼元素和氢元素的质量比为5∶9D.1个五硼烷分子由5个硼原子和9个氢原子构成1.向200C的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )A.溶液温度末冷却到200C时,溶液一定是饱和溶液B.溶液温度末冷却到200C时,溶质质量分数比甲溶液大C.溶液温度恢复到200C时,溶液质量比甲溶液小D.溶液温度恢复到200C时,溶液的溶质质量分数和甲溶液的相等5. 已知KNO3的溶解度随温度的升高而增大。
下图各图是某KNO3饱和溶液的浓度随温度升高而变化的图像(不考虑溶剂的质量变化),其中正确的是( )17.图为甲、乙两种固体物质在水中的溶解度曲线。
下列说法错误的是( ) A.甲物质的溶解度随温度的升高而增大 B.在t 1℃时,甲、乙两物质的溶解度相等 C.在t 2℃时,N 点表示甲物质的不饱和溶液D.在t 1℃时,100g 乙物质的饱和溶液中溶质的质量是25g26.A 图是物质M 和N 的溶解度曲线。
B图中甲、乙试管分别盛有M 、N 的饱和溶液,试管底均有未溶解的M 、N 固体。
向烧杯中加入一种物质后,甲中的固体减少,乙中的固体增加,则加入的物质不可能是 A.浓硫酸 B.硝酸铵固体 C.氧化钙 D.氢氧化钠固体5.某工厂拟选用下列物质处理含硫酸的废水。
现花最少的钱中和等量的废水应选择 ( ) A.NaCl B.CaCO 3 C.Ca(OH)2 D.NaOH7. 下列图象对应叙述关系正确的是( )物 质 NaCl CaCO 3 Ca(OH)2 NaOH 市场参考价(元/kg) 1.2 1.82.0 11.5A.向PH=3的溶液中加水B.一定质量的稀盐酸与锌粒反应C.向H2SO4和CuSO4混合溶液中加NaOH溶液 D.煅烧一定质量的石灰石9. 下列鉴别物质的方法中,切实可行的是( )A.用酚酞溶液鉴别NaCl溶液和盐酸B.用燃着的木条鉴别CO2和N2C.用石蕊溶液鉴别稀盐酸和稀硫酸D.用水鉴别NaOH和CaCO3固体10. 下列物质的转化能实现的是( )A.H2SO4HCl B.CO Na2CO3C.Cu(OH)2 NaOH D.NaNO3Ba(NO3)11.氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区别三种化肥,在农业生产中具有实用性。
区别下列相关化肥的方法可行的是( )A.NH4Cl与KCl:观察外观 B.NH4HCO3与KCl:加水C.K2SO4与Ca3(PO4)2:闻气味 D.(NH4)2SO4与K2SO4:加熟石灰研磨后闻气味13.右下图中连线两端的物质在通常情况下可以相互反应。
下列四组选项中,符合该图要求的是( )16.下面右图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中符合图示关系的是( )甲乙丙丁18.向装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。
有关量的变化情况见下图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。
其中肯定不正确的是( )19.下列说确的是( )A.验证NaOH溶液中是否含有SO42-,先加入稀硫酸,再加入BaCl2溶液,有白色沉淀,证明含有SO42-B.测定溶液的pH,先用水润湿pH试纸,然后将试纸插入待测液中C.向某无色溶液中滴入酚酞试液呈红色,说明该溶液一定是碱溶液D.点燃可燃性气体时,要先检验气体纯度,后点燃20. 下列离子能在pH=2的无色溶液量共存的是( )A.SO42-、Fe3+、Na+、OH- B.K+、SO42-、Cu2+、NO3-C.Cl-、K+、SO42-、Na+ D.Ca2+、Cl-、CO32-、Na+21.已知某固体粉末是由NaCl、Ba(NO3)2、CuSO4、Na2SO4、Na2CO3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO3溶液产生白色沉淀,对原固体粉末的判断正确的是( )A Na2CO3H2SO4Ba(OH)2石蕊B Na2CO3HCl Ca(OH)2CuSO4C Na2SO4HCl Ba(OH)2石蕊D HCl Na2CO3Ca(OH)2酚酞A.可能含CuSO4和Na2CO3B.一定含NaCl,可能含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4C.一定含NaCl、Ba(NO3)2、Na2SO4,一定不含Na2CO3,可能含CuSO4D.可能含NaCl,一定含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO426.(2008年市)下列图象正确反映对应的变化关系的是 ( ) (双选) ADA.向一定量的氢氧化钠溶液中滴加稀硫酸至过量B.向一定量的硫酸和硫酸镁混合溶液中滴加氢氧化钡溶液C.将足量碳酸镁和氧化镁固体分别加入相同质量、相同质量分数的稀盐酸中D.在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌30.(2008年达州市)用一种试剂一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区别开来的是( ) CA.无色酚酞试液B.二氧化碳气体C.碳酸钠溶液D.氯化钡溶液3. 下列实验方案中,可行的是 ( )A.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物B.将白醋滴在润湿的pH试纸上,测定其pHC.用氢氧化钠溶液除去CO2中的HCl气体D.用BaCl2溶液除去KNO3溶液中少量的K2SO44. 除去KCl溶液中混有的少量K2CO3,选用的试剂是( )A.H2SO4溶液 B.稀盐酸 C.K2SO4溶液 D. AgNO3溶液5.6. 下列除杂方确的是 ( )A.用NaOH除去CO2中混有的HCl B.用点燃的方法除去CO2中混有少量的COC.用水除去MnO2中混有的KCl D.用硝酸除去NaCl中混有的Na2CO313.17.下列实验方案设计不合理的是 ( )A.粗盐提纯:溶解→过滤→蒸发B.除去NaOH溶液中混有的Na2CO3:加适量稀HClC.除去KCl溶液中混有的K2CO3:加适量稀HClD.除去CaCO3中混有的CaCl2:加水→过滤→洗涤→干燥物质杂质除杂所用的试剂和方法A. CaO固体CaCO3固体加入适量的稀盐酸B. NaOH溶液Ca(OH)2溶液先加入过量的Na2CO3溶液,再过滤C. CO2气体CO气体点燃D. H2气体HCl气体先通过NaOH溶液,再通过浓硫酸二、简答题:6. 金属钛及钛的合金被认为是21世纪重要的金属材料,地壳中的钛矿石主要是金红石(TiO2),TiO2中钛的化合价是________。
