氨基酸结构、分类与命名及应用
氨基酸命名的由来

氨基酸命名的由来氨基酸是生命中的基本分子,它们是构成蛋白质的基本单元。
氨基酸的名称来源于其化学结构,这些化学结构反映了氨基酸的特征和性质。
让我们深入探讨氨基酸名称的由来,以了解其背后的科学历史和原理。
氨基酸的基本结构氨基酸是有机分子,其基本结构包括一个氨基(Amino)官能团和一个羧基(Carboxyl)官能团。
这两个官能团赋予了氨基酸其特殊性质,使它们成为构建蛋白质链的基本组成单位。
让我们更深入地了解这两个官能团以及它们如何影响氨基酸的性质。
1. 氨基(Amino)官能团:氨基官能团由一个氮原子(N)和两个氢原子(H)组成,通常表示为"NH2"。
这个官能团在氨基酸中是共同存在的,使氨基酸具有碱性特性。
氨基酸中的氨基团可以接受质子(H+),因此在水中,它可以与水中的氢离子结合形成氢氧根离子(OH-),从而在水中释放氢离子,使其呈碱性。
这是氨基酸名称中"Amino"这个部分的来源。
2. 羧基(Carboxyl)官能团:羧基官能团由一个碳原子(C)、一个氧原子(O)和一个氢原子(H)组成,通常表示为"COOH"。
这个官能团使氨基酸具有酸性特性。
羧基酸中的羧基团可以释放质子(H+),从而形成羧酸根离子(COO-),使其呈酸性。
这是氨基酸名称中"Carboxyl"这个部分的来源。
氨基酸的命名氨基酸的命名是基于其结构和性质。
在命名氨基酸时,使用一个标准的系统,包括以下几个元素:氨基和羧基的存在,因为它们是氨基酸的标志性官能团。
侧链或R基团,这是与每种氨基酸独特相关的部分,它决定了每种氨基酸的身份和性质。
举例来说,考虑天然氨基酸中的一种,丙氨酸(Proline)。
丙氨酸的名称来源于其结构和侧链:"Pro" 表示氨基酸的种类。
"Line" 来源于其特殊的侧链结构。
丙氨酸的侧链形成一个环状结构,这使得它在蛋白质中的位置和作用非常独特。
氨基酸的结构与命名

氨基酸的结构与命名氨基酸是构成蛋白质的基本组成单元,它通过肽键的形成相互连接在一起。
在生物体内,氨基酸承担着重要的生理功能,因此了解氨基酸的结构和命名对于理解蛋白质的合成与功能具有重要意义。
一、氨基酸的结构氨基酸的结构主要由两个部分构成:氨基(-NH2)和羧基(-COOH),它们与一个中心碳原子(称为α碳)连接在一起。
此外,氨基酸还有一个侧链(R基团),它的结构和化学性质决定了不同氨基酸之间的差异性。
具体来说,氨基酸的结构可以用以下示意图表示:H|N|H3N+-C-COO-|R其中,H3N+表示氨基,C表示中心碳原子,COO-表示羧基,R表示氨基酸的侧链。
每个氨基酸都有不同的侧链结构,决定了其特定的物理性质和化学性质。
二、氨基酸的命名氨基酸的命名通常按照IUPAC(国际纯粹和应用化学联合会)的命名规则进行,一般是由以下几个部分组成:1. 基本名称:根据氨基酸的化学性质和结构特点,通常以拉丁字母的缩写来表示,比如甘氨酸(Gly)表示甘氨酸基本名称为“Gly”。
2. 位点号码:位点号码用来标识氨基酸侧链上的特定原子或基团,通常用阿拉伯数字表示。
例如,对甘氨酸来说,如果侧链上的氢原子被替换为羟基(-OH),那么甘氨酸的命名就是“Ser”(基本名称)加上位点号码“16”表示羟基的位置。
3. 修饰物:在氨基酸命名中,有时会加上一些修饰物来表示某些特定功能的氨基酸。
例如,磷酸化的丝氨酸可以被命名为“pSer”或“Ser(P)”,其中“p”表示磷酸化。
综上所述,按照IUPAC的命名规则,氨基酸的命名可以通过基本名称、位点号码和修饰物等部分组成,以准确地描述氨基酸的结构和特性。
结论氨基酸作为构成蛋白质的基本组成单元,具有多样的结构和命名规则。
了解氨基酸的结构和命名对于深入理解蛋白质的合成和功能至关重要。
通过掌握氨基酸的结构与命名,我们能够更好地理解生物体内蛋白质的组成和相关生理功能,为进一步的研究提供有力支持。
氨基酸概述

第三节氨基酸氨基酸是一类具有特殊重要意义的化合物。
因为它们中许多是与生命活动密切相关的蛋白质的基本组成单位,是人体必不可少的物质,有些则直接用作药物。
α-氨基酸是蛋白质的基本组成单位。
蛋白质在酸、碱或酶的作用下,能逐步水解成比较简单的分子,最终产物是各种不同的α-氨基酸。
水解过程可表示如下:蛋白质→月示→胨→多肽→二肽→α-氨基酸由蛋白质水解所得到的α-氨基酸共有20多种,各种蛋白质中所含氨基酸的种类和数量都各不相同。
有些氨基酸在人体内不能合成,只能依靠食物供给,这种氨基酸叫做必需氨基酸(见表18-3,*)。
一、氨基酸的构造、构型及分类、命名(一)氨基酸的构造和构型分子中含有氨基和羧基的化合物,叫做氨基酸。
由蛋白质水解所得到的α-氨基酸,可用通式表示如下:除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。
天然氨基酸均为L-氨基酸。
L-氨基酸(二)α-氨基酸的分类和命名氨基酸有脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
在α-氨基酸分子中可以含多个氨基和多个羧基,而且氨基和羧基的数目不一定相等。
因此,天然存在的α-氨基酸常根据其分子中所含氨基和羧基的数目分为中性氨基酸、碱性氨基酸和酸性氨基酸。
所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。
但氨基的碱性和羧基的酸性不是完全相当的,所以它们并不是真正中性的物质,只能说它们近乎中性。
分子中氨基的数目多于羧基时呈现碱性,称为碱性氨基酸;反之,氨基的数目少于羧基时呈现酸性,称为酸性氨基酸。
氨基酸的系统命名方法与羟基酸一样,但天然氨基酸常根据其来源或性质多用俗名。
例如胱氨酸是因它最先来自尿结石;甘氨酸是由于它具有甜味而得名(见表18-3)。
表18-3 常见的α-氨基酸二、氨基酸的性质>α-氨基酸都是无色晶体,熔点一般都较高(常在230-300℃之间),熔融时即分解放出二氧化碳。
α-氨基酸都能溶于酸性或碱性溶液中,但难溶于乙醚等有机溶剂。
氨基酸基本知识

第22章氨基酸§1 .氨基酸的结构、命名和分类1、蛋白质水解所得的氨基酸除个别例子外,都是α—氨基酸或其衍生物(脯氨酸)。
用酸或酶使蛋白质水解时,得到α—氨基酸,除甘氨酸以外,都是旋光的,并且都属于L型。
D型α—氨基酸也存在于自然界,例如存在于某些抗生素中。
2、天然产氨基酸多用习惯名称,即按其来源或性质命名。
例如门冬氨基酸最初是由天门冬的幼苗中发现的;甘氨酸是因为具有甜味而得名。
天然产的氨基酸目前知道的已超过一百种。
但在生物体内作为合成蛋白质原料的只有二十种,这二十种氨基酸象无机符号一样,都有国际通用的符号来表示,3、氨基酸可分为链状、芳香族、杂环氨基酸。
如:根据R的不同可分为六种(R为烃基、含羟基、含氨基、含硫,含羧基,还有结构比较特殊的脯氨酸)§2.氨基酸的性质1、氨基酸的酸碱性氨基酸分子中的氨基是碱性的,而羧基则是酸性的但它们的酸碱解离常数比起一般的羧基-COOH和氨基-NH2来都低的很。
例如:甘氨酸:Ka=1.6×10-10,Kb=2.5×10-12大多数的羧酸:Ka=10-5这说明氨基酸在一般情况下不是以游离态的羧基和氨基存在的,而是以内盐的形式存在(内盐:偶极离子),H3N+ _CHRCOO- 。
如果把测得氨基酸的Ka值看成是代表甘氨酸中铵离子的酸度:Ka~ -NH3+把测得甘氨酸的Kb值看成是代表甘氨酸中羧酸根离子的碱度:Kb ~-COO-则其酸碱度与其测得的相符合。
因为在水溶液中一个共轭酸和它的共轭碱的关系式是:Ka×Kb=10-14那么,-NH3+的共轭碱是-NH2-COO-的共轭酸是-COOH。
根据上式可以算出甘氨酸-NH2的Kb=6.3×10-5,同样-COOH的Ka=4×10-3。
前者对一个脂肪胺来说,后者对一个有强吸电子基(-NH3+)的羧酸来说,其酸碱度是合理的数值(有强吸电子基时,酸性增强)。
总之,在简单氨基酸如甘氨酸中,它的酸性基是-NH3+而不是-COOH,它的碱性基团是-COO-而不-NH2。
有机化学氨基酸
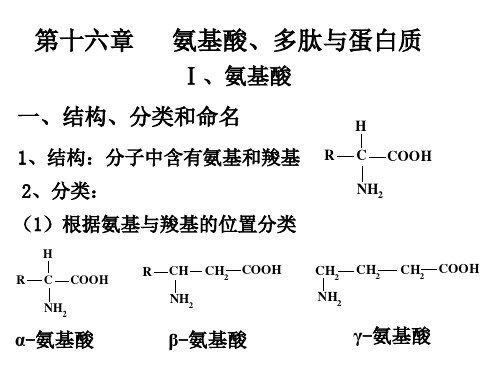
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
氨基酸

氨基酸氨基酸——具有NH2和COOH的一类含有复合官能团的化合物。
氨基酸已知超过300种,生物体内作为合成蛋白质的原料只有20余种,其中8种为人体必须氨基酸(表15-1,记忆最常用的几个)。
一、分类命名和结构(一)分类1、根据R的不同可分为脂族、芳族、杂环氨基酸;2、根据氨基与羧基的数目可分为中性(氨基与羧基数目相等)、酸性(氨基数少于羧基数)、碱性氨基酸(氨基数大于羧基数),其中中性氨基酸水溶液呈微酸性(因羧基的解离略大于氨基)。
(二)命名氨基酸的命名主要有俗名(根据其来源及用途,最常用)、系统命名(以酸为母体,常用α、β来注明氨基、取代基位置)以及国际通用符号等命名法。
例如:1、HO CH2CHCOOHNH22、N HCH2CHCOOH23、NHCOOH4、HS CH2CHCOOH25、CH2CHCOOH26、3NH2COOHH(D/L)解:1、酪氨酸2、色氨酸3、脯氨酸4、半胱氨酸5、苯丙氨酸6、L-丙氨酸(三)结构20种均为 -氨基酸,除甘氨酸都有旋光性;以相对构型来标记多为L-型;以绝对构型来标记,除半胱氨酸都为S-型。
氨基酸通式:R CH COOH2*甘氨酸(无旋光):NH2CH2COOH构型表示:HCOOHNH2(相对构型均为L,绝对构型除半胱氨酸均为S)半胱氨酸:COOH2SHHH 2N(R)(巯甲基比羧基优先大,故为R 构型)二、氨基酸的化学性质 (一) 两性和等电点 1、两性R CH COOHNH 2R CH COONH 2R CH COOHNH 3H氨基酸是两性化合物,常以内盐形式存在(熔点高、难溶于有机溶剂,易溶于酸和碱):H 3NHC COOR2、等电点R CH COOHNH 3R CH COONH3R CH COONH2R CH COOH2OH 荷电状态与pH 有关负离子两性离子正离子pH > pI pH =pI pH ﹤ pI 向阳极不移动向阴极带等量正负电荷(1)氨基酸是两性化合物,在溶液中,其带电状态与溶液的pH 值有关,即pH 会影响羧基和氨基的解离程度,当羧基解离程度大于氨基时,将带负电荷;反之,氨基解离程度大于羧基时,将带正电荷;(2)改变pH 值,使氨基和羧基的解离程度相等,此时氨基酸带的正负电荷相等,此时溶液的pH 值称为“等电点”,用pI 表示;(3)调节p H <pI ,将抑制COOH 的解离,促进NH 2的解离,氨基酸带正电荷; (4)调节p H >pI ,将抑制NH 2的解离,促进COOH 的解离,氨基酸带负电荷;(5)在pI 的溶液中插入电极,氨基酸因带等量的正负电荷对外不显示电量,故不移动; 在p H <pI 的溶液中插入电极,氨基酸因带正电荷而向阴极(负极)移动; 在p H >pI 的溶液中插入电极,氨基酸因带负电荷而向阳极(正极)移动。
氨基酸的结构与功能

氨基酸的结构与功能
氨基酸是生物体内蛋白质的基本组成单元,也是维持生命活动的重要
物质。
每个氨基酸分子都由一个氨基组团(-NH2)、一个羧基组团(-COOH)、一个中央的碳原子和一个特异侧链组成。
根据侧链结构的不同,
氨基酸可以分为20种不同的类型。
氨基酸的功能包括构建蛋白质、补充能量、参与新陈代谢、作为信号
分子以及提供身体所需的重要物质等。
首先,氨基酸通过共价键的形式连接在一起,形成蛋白质的链状结构。
这种连接称为肽键,通过肽键的形成,氨基酸能够形成多肽链或多肽链与
其他生物分子形成的复合物。
蛋白质分子的结构决定了其特定的功能,例
如酶、抗体、结构蛋白等。
其次,氨基酸可以通过代谢途径提供能量。
由于氨基酸分子的组成结构,其可以进行氧化分解,产生能量供给生物体内的各种代谢需求。
氨基酸还可以作为重要的代谢产物。
例如,丝氨酸和组氨酸是组成蛋
白质的必需氨基酸,是身体正常生长和发展所必需的。
组氨酸还可以作为
神经递质,参与调节中枢神经系统的功能。
一些氨基酸还具有荷尔蒙样的作用。
例如,酪氨酸是合成多巴胺、去
甲肾上腺素和肾上腺素的前体物质,具有调节中枢神经系统功能的作用;
色氨酸是合成5-羟色胺的前体物质,也是晚上产生褪黑素的必需物质。
此外,氨基酸还可以通过转化为其他物质来参与生物体的正常功能。
例如,苏氨酸和蛋氨酸可以转化为泛酸,参与DNA和RNA的合成。
半胱氨
酸可以作为两个氨基酸分子之间的连接剂,构成蛋白质分子的二硫键。
素
氨酸被转化为肌氨酸,参与调节尿色素的合成和转化。
氨基酸的简介

2、苯异硫氰酸酯(PITC)与氨基得反应。 (Edman试剂,测定氨基酸序列)
3、丹磺酰氯与氨基酸得反应(生成荧光 性强和稳定得磺胺衍生物,常用于蛋白质 和氨基酸得微量分析)
非极性氨基酸(八种)
不带电何得极性氨基酸(八种)
带负电荷得氨基酸(2种)
带正电荷得氨基酸(2种)
1、2、3 不常见蛋白质氨基酸和非蛋白质氨基 酸
有些蛋白质中还含有少数特殊得氨基酸,称为蛋 白质得稀有氨基酸。这些氨基酸都就是正常氨 基酸得衍生物,如弹性蛋白和胶原蛋白中得4-羟 基脯氨酸和5-羟基赖氨酸;肌球蛋白和组蛋白中 含有6-N-甲基赖氨酸;凝血酶原中存在γ-羧基谷 氨酸;酪蛋白中存在磷酸丝氨酸;哺乳动物得肌肉 中存在N-甲基甘氨酸等。蛋白质中得稀有氨基 酸在遗传上就是特殊得,因为她们没有三联体密 码,所有已知得稀有氨基酸都就是在蛋白质合成 后,在常见得氨基酸得基础上经过化学修饰而形 成得。
氨基酸的简介
1、1 氨基酸得一般结构 1、2 氨基酸得分类 1、3 氨基酸得酸碱化学 1、4 氨基酸得特征化学反应 1、5 氨基酸得光学活性和光谱性质 1、6 氨基酸混合物得分离分析
1、1 氨基酸得一般结构
特征: α-碳(与羧酸相邻得碳,Cα )上都有一个氨 基( α-氨基酸 ),此外, Cα 还结合着一个H原子和 一个侧链基团(R)
甘氨酸得解离与等电点——滴定曲线
当甘氨酸在酸性溶液中,她就是以带净得正电荷得形 式存在得,可以看作就是一个二元弱酸,具有两个可 解离得H+,即-COOH和-NH3+上得H+。根据上述 甘氨酸得解离方程可得到:
K1、K2为解离常数,当达到等电点时, [Gly+ ]= [Gly- ],即:
则:K1K2=[H+]2 方程两边取负对数: pH=1/2*(PK1+PK2)
氨基酸结构

氨基酸结构下面这篇文章为大家讲解多肽合成中20种常见氨基酸的结构总得来说氨基酸结构有亲水性、疏水性何中性,其中亲水性氨基酸又分酸性和碱性。
亲水性(碱性)H His Histidine 组氨酸化学式为C6H9N3O2,分子量为155。
组氨酸在1896年由德国物理学家艾布瑞契·首次分离出来。
在营养学的范畴里,组氨酸被认为是一种人类必需的,主要是儿童。
在发育多年之后,人类开始可以自己合成它,在这时便成为了。
在慢性患者的膳食中添加少量的组氨酸,氨基酸结合进入的速度增加,肾原性贫血减轻,所以组氨酸也是尿毒症患者的必需氨酸。
在的作用下,组氨酸脱羧形成组胺。
具有很强的血管舒张作用,并与多种变态反应及发炎有关。
此外,组胺会刺激与胃酸。
R Arg Arginine 精氨酸化学式为C6H14N4O2,分子量为174.20。
是类化合物。
在人体内参与,促进的形成,使人体内产生的氨经鸟氨酸循环转变成无毒的尿素,由尿中排出,从而降低浓度。
有较高浓度的氢离子,有助于纠正肝性脑病时的酸碱平衡。
与,共同为[1]。
K Lys Lysine 赖氨酸(Lysine)的化学名称为2,6-二。
赖氨酸为碱性。
由于谷物食品中的赖氨酸含量甚低,且在加工过程中易被破坏而缺乏,故称为第一。
亲水性(酸性)D Asp Aspartic Acid 天门冬氨酸又称天冬氨酸,是一种,天门冬氨酸的左旋异构物是20种之一,即为蛋白质的构造单位,它的密码子是GAU和GAC。
它与谷氨酸同为。
天冬氨酸普遍存在于作用中。
它是生物体内赖氨酸、苏氨酸、、蛋氨酸等氨基酸及嘌呤、的合成前体。
它可作为K+、Mg2+离子的载体向心肌输送电解质,从而改善心肌收缩功能,同时降低氧消耗,在冠状动脉循环障碍缺氧时,对心肌有保护作用。
它参与,促进氧和生成尿素,降低血液中氮和二氧化碳的量,增强肝脏功能,消除疲劳。
E Glutamic Acid 谷氨酸,化学式为C5H9NO4,分子量为147.13,是一种。
各种氨基酸的结构式

各种氨基酸的结构式氨基酸是组成蛋白质的基本单位,其分子结构由一个氨基基团(NH2)、一个羧基基团(COOH)和一个侧链基团组成。
在自然界中,已发现了20种常见的氨基酸,它们可以根据侧链基团的不同分为两类:极性氨基酸和非极性氨基酸。
以下是各种氨基酸的结构式及详细说明:极性氨基酸:1. 赖氨酸(Lysine)- 具有一羧基、一个氨基和一个较长的极性侧链基团。
其侧链基团中含有一个氨基(NH2)和一个亲水基。
赖氨酸是重要的生理活性物质,参与体内蛋白质的合成以及其他多种生物代谢过程。
结构式:H2N-(CH2)4-CH(NH2)-COOH2. 精氨酸(Arginine)- 含有一个羧基、一个氨基和一个含有三个氨基(NH2)的侧链基团。
精氨酸是一种重要的氨基酸,在细胞生长和修复过程中起着重要作用。
结构式:H2N-(CH2)3-CH(NH2)-(CH2)3-NH-C(NH2)-COOH3. 酪氨酸(Tyrosine)- 含有一个羧基、一个氨基,以及一个含有苯环和羟基(OH)的侧链基团。
酪氨酸在体内发挥多种重要功能,例如参与神经传导、激素合成和免疫反应等。
结构式:HOOC-CH2-C6H4-OH4. 苯丙氨酸(Phenylalanine)- 含有一个羧基、一个氨基和一个含有苯环的侧链基团。
苯丙氨酸是体内蛋白质的组成成分之一,也是合成多种重要物质的前体。
结构式:H2N-CH2-C6H55. 色氨酸(Tryptophan)- 含有一个羧基、一个氨基和一个复杂的环状侧链基团。
色氨酸是合成5-羟色胺和维生素B3(烟酸)的重要物质。
结构式:H2N-(CH2)3-C8H6N6. 苏氨酸(Cysteine)- 含有一个羧基、一个氨基和一个含有硫原子的侧链基团。
苏氨酸在蛋白质结构中起着关键作用,形成了强大的二硫键。
结构式:HS-CH2-CH(NH2)-COOH非极性氨基酸:1. 丙氨酸(Alanine)- 含有一个羧基、一个氨基和一个短的非极性侧链基团。
氨基酸的结构教学设计教案

氨基酸的结构教学设计教案第一节:教学目标1. 掌握氨基酸的基本概念和结构特征;2. 理解氨基酸在生命体内的重要作用;3. 能够分辨和命名不同类型的氨基酸;4. 了解氨基酸的衍生物和功能。
第二节:教学内容2.1 氨基酸的基本概念和结构特征2.1.1 概念:氨基酸是构成蛋白质的基本组成单位,在生命活动中具有重要功能。
2.1.2 结构特征:氨基酸由氨基(NH2)、羧基(COOH)和侧链组成,侧链的差异使得各种氨基酸具有不同的性质和功能。
2.2 氨基酸在生命体内的重要作用2.2.1 构建蛋白质:氨基酸通过肽键连接成多肽链,进而形成功能性蛋白质。
2.2.2 调节生理功能:氨基酸可以作为生理调节剂,影响神经传递、免疫功能等。
2.2.3 提供能量:部分氨基酸可被分解为能量物质,供机体代谢使用。
2.3 分辨和命名不同类型的氨基酸2.3.1 按结构分类:根据侧链结构的不同,可以将氨基酸分为非极性氨基酸、极性氨基酸和带电氨基酸。
2.3.2 氨基酸的命名:按国际通用方法,氨基酸命名顺序为侧链、羧基和氨基。
2.4 氨基酸的衍生物和功能2.4.1 肽链:两个或多个氨基酸通过肽键连接而成的化合物,构成蛋白质的基本结构单元。
2.4.2 氨基酸衍生物:包括酰胺、酮酸、亮氨酸、色氨酸等,具有特殊的生理功能。
第三节:教学方法与手段3.1 教学方法3.1.1 讲授法:通过教师讲解氨基酸的基本概念、结构和重要作用来传授知识。
3.1.2 对比法:比较不同类型的氨基酸的结构特征和功能,加深学生对氨基酸的理解。
3.1.3 实验法:进行氨基酸的营养学实验,观察其在不同条件下的变化。
3.2 教具和材料3.2.1 投影仪和电脑:用于教师演示氨基酸的结构和衍生物。
3.2.2 实验室器材和试剂:用于进行氨基酸的营养学实验。
第四节:教学流程4.1 导入:通过引入蛋白质和氨基酸的概念,激发学生的学习兴趣。
4.2 学习氨基酸的基本概念和结构特征,包括氨基酸的组成和侧链的差异。
氨基酸

由于螺旋圈的直径是一定的,因此两条链上的碱基以一定规律 相互配对。在DNA双螺旋结构中只能A与T、G与C之间配对, 这一规律称碱基配对原则或叫碱基互补原则。
碱基配对
DNA的双螺旋结构
三、α-氨基酸的化学性质
1、两性性质和等电点 2、与亚硝酸反应 3、与甲醛反应 4、氧化脱氨反应 5、脱羧反应 6、配位反应 7、与茚三酮反应
1、两性性质和等电点
氨基酸分子中含有 氨基和 羧基,可与酸反应生成铵盐, 又可与碱反应生成羧酸盐,因此氨基酸具有酸、碱两性性 质。
R CH COOH
NH2
米隆试剂是硝酸、亚硝酸、硝酸汞、亚硝酸汞的混合溶液。
蛋白质的颜色反应可用于蛋白质的定性和定量分析。
核酸 (nucleic acid)
核酸分为核糖核酸(RNA)和脱氧核糖核酸(DNA) 。 RNA主要存在于细胞质中,参与生物体内蛋白质的合成。 DNA主要分布在细胞核中,它决定着生物体的繁殖、遗 传和变异。
蛋白质水解得到的α-氨 基酸几乎都是L构型。
COOH
H 2N
H
CH3
L-α-丙氨酸
脂肪族氨基酸
α-氨基酸根据R基分为 芳香族氨基酸
根据氨基、羧基的数目分为
杂环氨基酸
中性氨基酸 氨基数 = 羧基数
碱性氨基酸 氨基数 > 羧基数 赖、组、精
酸性氨基酸 氨基数 < 羧基数 谷、天冬(氨酸)
名称(俗名) 中文缩写 英文缩写(表15-1)
蛋白质和氨基酸一样,也具有两性和等电点。不同的pH
条件下,蛋白质可主要以正离子、负离子或偶极离子形式
第一章氨基酸

第一章氨基酸(amino acid)的结构与性质第一节氨基酸的结构与分类一、氨基酸的结构组成蛋白质的基本单位是氨基酸。
如将天然的蛋白质完全水解,最后都可得到约二十种不同的氨基酸。
从氨基酸的结构通式可以看出:构成蛋白质的氨基酸均为L—α—氨基酸。
除R 为H(甘氨酸)外,其余氨基酸均具有旋光性。
*在空间各原子有两种排列方式:L—构型与D—构型,它们的关系就像左右手的关系,互为镜像关系,下图以丙氨酸为例:二、氨基酸的分类:1.按氨基酸分子中羧基与氨基的数目分:酸性氨基酸:一氨基二羧基氨基酸,有天冬氨酸、谷氨酸;碱性氨基酸:二氨基一羧基氨基酸,有赖氨酸、精氨酸、组氨酸;中性氨基酸:一氨基一羧基氨基酸,有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸。
2.按侧基R 基的结构特点分:脂肪族氨基酸芳香族氨基酸:苯丙氨酸、色氨酸、酪氨酸杂环氨基酸:脯氨酸、组氨酸3.按侧基R 基与水的关系分:非极性氨基酸:有甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、半胱氨酸、苯丙氨酸、色氨酸、酪氨酸、脯氨酸;极性不带电氨基酸:天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸;极性带电氨基酸:天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸。
4. 按氨基酸是否能在人体内合成分:必需氨基酸:指人体内不能合成的氨基酸,必须从食物中摄取,有八种:赖氨酸、色氨酸、甲硫氨酸、笨丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苏氨酸。
非必需氨基酸:指人体内可以合成的氨基酸。
有十种。
半必需氨基酸:指人体内可以合成但合成量不能满足人体需要(特别是婴幼儿时期)的氨基酸,有两种:组氨酸、精氨酸。
三、稀有氨基酸:参加天然蛋白质分子组成的氨基酸,除了上述20 种有遗传密码的基本氨基酸之外,在少数蛋白质分子中还有一些不常见的氨基酸,称为稀有氨基酸。
它们都是在蛋白质分子合成之后,由相应的常见氨基酸分子经酶促化学修饰而成的衍生物。
18种氨基酸的作用

15
上一页 首页 退出
பைடு நூலகம் 5、谷氨酸 (GLU)
1、降低血氨,有解氨毒的作用 2、参与脑的蛋白和塘代谢,促进氧化,改善中枢神经活动, 有维持和促进脑细胞功能的作用,促进智力的增加
3、对严重肝功能不全,肝昏迷,酸中毒,癫痫精神分裂症、
神经 衰弱等有治疗效果
4、对治疗胃溃疡、胃液缺乏、消化不良、食欲不振有效果
26
上一页 首页 退出
27
上一页 首页 退出
色氨酸可提高肝脏丙氨酸转氨酶的活性,色氨酸降低肝脏
中脂肪的作用,可使甘油三酯显著下降。色氨酸使肝脏脂肪 和血清胆固醇、甘油三酯及游离脂肪酸降低.因此色氨酸降 低肝脂的作用机理可能是减少肝脏脂肪合成。色氨酸作为吡 啶羧酸的前体,促进人体对锌的吸收。
12
上一页 首页 退出
3、赖氨酸
一、赖氨酸是合成体蛋白不可缺少的成分。在酶蛋白、生殖细胞、骨 骼肌及血红蛋白等的形成中有非常重要的作用,同时也是某些多肽激素 的组分之一。 二、参与体内能量代谢过程。赖氨酸是生酮氨基酸之一。当体内缺乏碳 水化合物时,可被分解为葡萄糖或胴体来提供能量,赖氨酸也是酯代谢 中肉毒碱的前体物质,在脂肪代谢中发挥着重要的生理作用。 三、缺乏 日粮中赖氨酸缺乏容量导致猪生产性能的下降.家禽生在缓慢,体重、
18
上一页 首页 退出
9、缬氨酸(VAL)
1、促使神经系统功能正常 2、如果缺乏时,会造成触觉敏感度特
别提高,肌肉的共济运动失调
3、可作为肝昏迷的治疗药物
上一页 首页 退出
19
10、天门冬氨酸(ASP)
1、降代血氨,对肝有保护作用 2、对肌肉有保护作用,可治疗心绞痛, 对心肌梗塞等有防治效果 3、增加鲜味,促进食欲
氨基酸命名及分类 -回复

氨基酸命名及分类-回复氨基酸是构成蛋白质的基本单元,它们在生物体内发挥着至关重要的作用。
氨基酸的命名和分类是了解它们的特性和功能的重要基础。
本文将一步一步回答关于氨基酸命名及分类的问题,以帮助读者更好地理解这个主题。
1. 什么是氨基酸?氨基酸是一类有机化合物,它们由氨基(NH2)和羧基(COOH)组成。
氨基酸的核心是一个碳原子,它与一个氢原子、一个氨基和一个羧基连接在一起。
氨基酸是构成蛋白质的基本单元,它们通过肽键连接在一起形成蛋白质链。
2. 氨基酸的命名规则是什么?氨基酸的命名通常遵循一定的规则。
就以标准20种氨基酸为例,它们的命名通常由两部分组成:第一部分是氨基酸名称的缩写,由英文字母表示;第二部分是氨基酸的全名,由拉丁或希腊字母表示。
例如,丙氨酸的缩写为Ala,全名为Alanine。
3. 氨基酸如何分类?氨基酸可以按照多种方式进行分类,下面介绍几种常见的分类方法:3.1 极性分类:根据氨基酸的化学性质,可以将其分为极性氨基酸和非极性氨基酸两类。
极性氨基酸具有局部部分或全部带电性质,它们能够在水中溶解并与其他极性分子发生相互作用。
非极性氨基酸则在水中不易溶解。
丙氨酸和缬氨酸属于非极性氨基酸,而精氨酸和谷氨酸属于极性氨基酸。
3.2 酸碱性分类:氨基酸的酸碱性取决于羧基和氨基的酸碱性质。
酸性氨基酸具有酸性羧基,而碱性氨基酸具有碱性氨基。
例如,谷氨酸和天冬氨酸属于酸性氨基酸,而精氨酸和赖氨酸属于碱性氨基酸。
3.3 构象分类:氨基酸的构象是指它们的空间结构和形状。
氨基酸可以分为两类构象:手性氨基酸和不对称氨基酸。
手性氨基酸是指它们的结构中含有一个或多个手性中心(也称为手性碳原子),因此它们具有非对称性。
不对称氨基酸则没有手性中心,因此它们是对称的。
丙氨酸是对称氨基酸中的一个例子,而甲硫氨酸是手性氨基酸中的一个例子。
4. 氨基酸的分类对其功能有何影响?氨基酸的分类对其在生物体内的功能发挥有明显影响。
不同极性的氨基酸能够在蛋白质的结构中形成不同类型的相互作用,从而影响蛋白质的折叠和稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
L-氨基酸
COOH
H2N
氨基酸的结构、分类和命名及应用
H CH2SH
下列氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
I、中性 (*为必要氨基酸,人体内不能合成,只能从食物中得到)
NH2CH2COOH
甘酸
Gly
5.97
NH2 H3CHC COOH
丙氨酸
Ala
6.00
NH2 (H3C)2HCCHCOOH
氨基酸的结构、分类和命名及应用
内盐
在水溶液中
在酸性溶液中,主要以正离子的形式存在。 在碱性溶液中,主要以负离子的形式存在。 氨基酸的等电点
在一定的pH值溶液中,正离子和负离子数量相等, 且浓度都很低,而偶级离子浓度最高,此时电解,以 偶级离子形式存在的氨基酸不移动。这溶液的pH值就 叫做氨基酸的等电点。
9.74 10.76 7.59
19-1-2 氨基酸的性质
α-氨基酸都是无色晶体,易溶于水而难溶于无水乙 醇乙醚,由蛋白质水解所得α-氨基酸,除甘氨酸外,都 具有旋光性。他们的α碳原子的结构类型都与L-甘油醛 相同,固都属于L型。
若用R-S标记法,这些α-氨基酸的α碳原子的构型
都是S型。
氨基酸的结构、分类和命名及应用
天冬氨酸
Asp
NH2 HO O C(CH2)2CHCO O H
III 碱性
谷氨酸
Glu
NH2 H2N (CH2)4CHCOOH
NH2 HN CHN(CH2)2CH COOH
NH3
*赖氨酸 精氨酸
Lys Arg
H2N N NH2 CH2CH COO
组氨酸
His
氨基酸的结构、分类和命名及应用
等电点
2.77 3.22
氨基酸分子中含有氨基和羧酸。他们具有氨基和 羧基的典型性质。例如,羧基可以发生脂化反应,氨 基可以发生酰基化反应;氨基与亚硝酸作用可转变为 羟基。
O
O H C 6 H 5C C l H
R 'O H H
C 6 H 5 C H N R C C O O H酰 基 化 H 3 N R C C O O酯 化 H 2 N R C C O O R '
氨基酸的结构、分类和命名及应用
γ-或δ-氨基酸受热后,容易分子内脱区一分子水。
分子中氨基和羧基相隔更远时,受热后可以多 分子脱水,生成聚酰胺。
氨基酸的结构、分类和命名及应用
19-1-3 氨基酸的制备
氨基酸的结构、分类和命名及应用
• 等电点不是中性点; • 氨基酸在等电点时的溶解度最小. (2) 水合茚三酮反应
这个颜色反应通常用于α-氨基酸的比色测定和色 层分析的显色。
氨基酸的结构、分类和命名及应用
与
水 含 茚 三
O OH OH
R CH COOH +
NH2
- 2H2O
O R
N CHCOOH
酮
H N O 2
R C H C O O H
R C H C O O H+ N 2 + H 2 O
N H 2
O H
用于定量分析,根据放出的N2的体积,可以算出样 品的伯氨基的含量。
氨基酸的结构、分类和命名及应用
氨基酸还有一些特殊的性质。
(1) 酸碱性——两性和等电点 R
α-氨基酸可以通过用通式NH2CHCOOH 表示 实际上是以偶级离子的形式存在的:
O
O
的
O
O
反 -CO2 应
R N CH2
H
R
H 2O
N CH
历 程
O
O
O
O
OH
O
OH
O
RCHO +
H
O
H
NH2
N
O
O
O
H
N
O
O
O O
紫色物质,用于α-氨基酸 的比色测定和纸层析显色
氨基酸的结构、分类和命名及应用
(3) 受热后的反应 α-氨基酸受热后,能在两分子之间发生脱水反应。
α-氨基酸受热后,容易脱去一分子氨,生成α,β不饱和 羧酸。
NH2 HOCH2CHCOOH
*蛋氨酸 丝氨酸
HO
COOH
脯氨酸
N
H
NH2 CH2CHCOOH
酪氨酸
Met Ser pro
Tyr
NH2 CH2CH COOH
N H
*色氨酸
Trp
氨基酸的结构、分类和命名及应用
等电点
5.47 5.68 6.30
5.66 5.89
结构
名称
缩写
II 酸性
NH2 HOOCCH2CHCOOH
氨基酸的结构、分类和命名及应用
天然氨基酸:
H
R COOH
蛋白质水解后得到的氨基酸都是
NH2
α-氨基酸。天然产氨基酸(除甘氨酸)都有旋光性,
绝大多数为L构型,
(少数微生物代谢产物是D构型)。
COOH HO H
CH3 L-乳酸
COOH H2N H
R
用 R、S 命名的则 L 构型 的氨基酸多为 S 型,只有 L-半光氨酸为 R 型。
Cys
NH2 H3CHC CH COOH
OH
*苏氨酸
Thr
O
NH2
H2NC (CH2)2CHCOOH
谷氨酸
Gln
O NH2 H2NC CH2CHCOOH
天冬氨酸 Asn
氨基酸的结构、分类和命名及应用
等电点
6.02 5.48 5.07 5.6
5.56 5.07
结构
名称
缩写
NH2 CH3S(CH2)2CHCOOH
蛋白质水解后都生成氨基酸
氨基酸的结构、分类和命名及应用
19-1 氨基酸
一、结构 羧酸分子中羟基上的一个或几个氢原子被氨基取
代的化合物叫做氨基酸。它们是构成蛋白质分子的基 础。 二、分类、命名
可分为α-氨基酸、β-氨基酸、γ-氨基酸。 氨基酸可以按照系统命名法,以羧酸为母体,氨基 酸为取代基来命名。但α-氨基酸通常按其来源或性质所 得的俗名来称呼。例如:
氨基酸的结构、分 类和命名及应用
氨基酸的结构、分类和命名及应用
蛋白质: 含氮的天然高聚物,生物体内一切组织的基本组
成部分除水外,细胞内80%都是蛋白质。在生命现象 中起重要的作用。人类的主要营养物质之一。
如: 酶(球蛋白)——机体内起催化作用 激素(蛋白质及其衍生物)——调解代谢 血红蛋白——运输O22 抗原抗体——免疫作用
氨基酸的结构、分类和命名及应用
NH2CH2COOH HOOC—CH2—CH2—CH—COOH
α-氨基乙酸 甘氨酸
NH2CH2CH2COOH
NH2 α-氨基戊二酸
谷氨酸
NH2CH2CH2CH2CH2CHCOOH
β-氨基丙酸 丙氨酸
NH2 α,ε二氨基已酸
赖氨酸
蛋白质水解可以得到各种α-氨基酸的混合物。
*颉氨酸
Val
5.96
NH2 C2H5HC CH COOH
CH3
*异亮氨酸 Ile
氨基酸的结构、分类和命名及应用
5.98
结构
名称
缩写
N H 2
(H 3C )2H C H 2CC HC O O H *亮氨酸
Leu
NH2
C6H5H2CCHCOOH *苯丙氨酸 Phe
NH2 HSH2C CH COOH
半光氨酸
