初级中学化学四大基本反应类型知识清单
初中化学四大基本反应类型归纳

初中化学四大基本反应类型归纳四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应。
点燃1、非金属单质与氧气生成非金属氧化物。
如 2H2+O2===H2O其它非金属如硫、磷、碳等都可以与氧气反应生成非金属氧化物。
点燃2、金属与氧气反应生成金属氧化物。
如 3Fe+2O2====Fe3O4其它金属如铝、锌、铜也可以与氧气发生类似反应,生成相应的金属氧化物。
3、金属氧化物与水反应,生成相应的碱。
如CaO+H2O= Ca(OH)2其它金属氧化物Na2O、K2O、BaO都可以与水反应生成相应的碱4、非金属氧化物与水反应,生成相应的酸。
如 CO2+H2O= H2CO3其它非金属氧化物SO2、 SO3也可以与水生成相应的酸。
点燃5、其它如2CO+ O2 =====2CO2等。
二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。
高温1、不溶性碳酸盐高温分解如CaCO3====CaO+CO2↑加热2、不溶性碱受热分解,如Cu(OH)2 =====CuO + H2O加热3、某些酸式盐受热分解(了解)如B、2NaHCO3 =====Na2CO3+CO2↑+H2O加热4、某些碱式盐受热分解(了解)如 Cu2(OH)2CO3=====2CuO+ CO2↑+ H2O其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换反应。
1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸)例如Fe+2HCl=FeCl2+H2↑Mg+ 2HCl = MgCl2+ H2↑ H2SO4+ Fe = FeSO4+ H2↑2HCl + Zn = ZnCl2+ H2↑H2SO4+ Zn = ZnSO4+ H2↑2、金属与盐反应,生成新盐与新金属。
盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。
初中化学四大基本反应类型

初中化学四大基本反应类型一、化合反应1、镁在空气中燃烧:2Mg + O2 =点燃= 2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2 =△= 2CuO 现象:铜丝变黑。
4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧:S + O2 =点燃= SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2 =点燃= CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO10、二氧化碳通过灼热碳层:C + CO2 =高温= 2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO4 13、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH氧化钾溶于水:K2O + H2O=2KOH氧化钡溶于水:BaO + H2O=Ba(OH)214、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O二、分解反应:1、水在直流电的作用下分解:2H2O= 通电= 2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
初中化学四大基本反应类型

初中化学考点——四大基本反应类型四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应1、非金属单质与氧气生成非金属氧化物。
如2H2+O2点燃H2O2、金属与氧气反应生成金属氧化物。
如3Fe+2O2点燃Fe3O43、金属氧化物与水反应,生成相应的碱。
如CaO+H2O= Ca(OH)2注:K2O、Na2O、BaO、CaO能与水反应,生成相应的碱,其他不能。
4、非金属氧化物与水反应,生成相应的酸。
如CO2+H2O= H2CO3注:能发生此反应的非金属氧化物有CO2、SO2、SO35、其它如2CO+ O2点燃2CO2二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。
1、不溶性碳酸盐高温分解如CaCO3高温CaO+CO2↑2、不溶性碱受热分解如Cu(OH)2△CuO + H2O注:除KOH、NaOH、Ba(OH)2之外,都能分解生成相应的氧化物和水3、某些酸式盐受热分解(了解)如 2NaHCO3=====Na2CO3+CO2↑+H2O4、某些碱式盐受热分解(了解)如 Cu2(OH)2CO3△ 2CuO+CO2↑+H2O其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫做置换反应。
1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸)例如:Fe+2HCl=FeCl2+H2↑Mg+ 2HCl = MgCl2+ H2↑H2SO4 + Fe = FeSO4+ H2↑2HCl + Zn = ZnCl2 + H2↑ H2SO4 + Zn = ZnSO4+ H2↑注:这里的酸,一般只稀盐酸和稀硫酸。
硝酸与金属反应不生成氢气。
2、金属与盐反应,生成新盐与新金属。
盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)例如:Fe+CuSO4===FeSO4+Cu 2AgNO3+ Cu= Cu(NO3)2 +2 Ag注:反应物中的盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。
四大化学基本反应类型

四大化学基本反应类型
初中化学的四大基本反应类型分别是:化合反应、分解反应、置换反应、复分解反应。
1、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应。
初中
常见化合反应主要有:非金属单质与氧气生成非金属氧化物;金属与氧气反应生成金属氧
化物;金属氧化物与水反应,生成相应的.碱;非金属氧化物与水反应,生成相应的酸。
2、水解反应:由一种物质分解成两种或两种以上其他物质的化学反应叫作水解反应。
初中常用水解反应存有:不溶性碳酸盐高温水解;不溶性碱受到热分解;酸式盐受到热分解;碱式盐受到热分解。
3、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫置换
反应。
初中常见的置换反应有:活泼金属(金属活动顺序中氢以前的)与酸反应;盐+活
泼金属——较不活泼金属+可溶于水的盐;氢气还原金属氧化物;碳还原金属氧化物。
4、为丛藓科扭口藓水解反应:两种化合物相互交换成分,分解成另外两种化合物的
反应,叫复水解反应。
初中常用的为丛藓科扭口藓水解反应存有:酸+碱性氧化物——盐
+水;酸+碱——盐+水(中和反应);酸+盐――新酸+崭新盐;碱+盐——崭新碱+
崭新盐;盐a+盐b——崭新盐c+崭新盐。
初中化学方程式汇总四种基本反应类型

初中化学方程式汇编一、化合反应一、金属 + 氧气-------- 金属氧化物1、镁在空气中燃烧:2Mg+O22MgO剧烈燃烧,耀眼白光,放热,生成白色固体2、铁在氧气中燃烧:3Fe+2O2Fe3O4 剧烈燃烧,火星四射,放热,生成黑色固体3、铝在空气中燃烧:4Al+3O22Al2O3银白金属变为白色固体4、铜在空气中受热:2Cu+O2 2Cu红色金属变为黑色固体5、汞在空气中受热:2Hg+O22HgO由银白液体,生成红色固体二、非金属 + 氧气-------- 非金属氧化物6、氢气在空气中燃烧:2H2+O22H2O淡蓝火焰,放热,生成使无水CuSO4变蓝的液体7、红磷在空气中燃烧:4P+5O22P2O5剧烈燃烧,放热,放出大量白烟8、硫粉在空气中燃烧: S+O2SO2 剧烈燃烧,放热,生成有刺激味气体;在空气中淡蓝色火焰,在氧气中蓝紫色火焰9、碳在氧气中充分燃烧:C+O2CO2剧烈燃烧,发出白光,放热,生成使澄清石灰水变浑浊的气体10、碳在氧气中不充分燃烧:2C+O22CO三、金属氧化物 + 水-------- 碱可溶性11、生石灰溶于水:CaO+H2O==CaOH2 放热12、氧化钠溶于水:Na2O+H2O==2NaOH 放热四、非金属+ 水-------- 非金属氧化物13、二氧化碳和水反应:CO2+H2O==H2CO3二氧化碳通入紫色石蕊试液,溶液变红,说明二氧化碳溶于水显酸性14、二氧化硫溶于水:SO2+H2O==H2SO315、三氧化硫溶于水:SO3+H2O==H2SO4五、其他16、二氧化碳通过灼热碳层: C+CO22CO17、一氧化碳在氧气中燃烧煤气燃烧:2CO+O22CO2蓝色火焰18、钠在氯气中燃烧:2Na+Cl2 2NaCl剧烈燃烧,黄色火焰19、氯气在氢气中点燃共价化合物的形成、制备盐酸: H2+Cl22HCl 苍白色火焰,瓶口白雾20、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O 白色固体变蓝二、分解反应21、氧化汞受热分解:2HgO 2Hg+O2↑ 红色固体变为银白液体,生成使带火星木条复燃的气体22、双氧水制氧气实验室制备氧气:2H2O2 2H2O+O2↑23、加热高锰酸钾实验室制备氧气:2KMnO4 K2MnO4+MnO2+O2↑24、加热氯酸钾有少量的二氧化锰实验室制备氧气:2KClO3 2KCl+3O2↑25、水在直流电的作用下分解:2H2O 2H2↑+O2↑26、碳酸不稳定而分解:H2CO3==H2O+CO2↑27、高温煅烧石灰石二氧化碳工业制法:CaCO3 CaO+CO2↑28、硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O蓝色晶体变为白色粉末29、碱式碳酸铜铜绿受热分解:Cu2OH2CO3 2CuO+H2O+CO2↑绿色固体变黑色固体,生成使澄清石灰水变浑浊气体和使无水CuSO4变蓝的液体30、碳酸氢铵受热分解碳酸氢铵长期暴露空气中会消失:NH4HCO3NH3↑+H2O+CO2↑白色固体消失,有刺激性气味的气体生成,且能使湿润的PH试纸变蓝,生成使澄清石灰水变浑浊气体三、置换反应一定属于氧化还原反应一、金属单质 + 酸 -------- 盐 + 氢气31、锌和稀硫酸反应实验室制氢气:Zn+H2SO4==ZnSO4+H2↑32、铁和稀硫酸反应:Fe+H2SO4==FeSO4+H2↑溶液由无色变为浅绿色33、铝和稀硫酸反应:2Al+3H2SO4==Al2SO43+3H2↑34、镁和稀硫酸反应:Mg+H2SO4==MgSO4+H2↑35、锌和稀盐酸:Zn+2HCl==ZnCl2+H2↑36、铁和稀盐酸:Fe+2HCl==FeCl2+H2↑溶液由无色变为浅绿色37、铝和稀盐酸:2Al+6HCl==2AlCl3+3H2↑38、镁和稀盐酸:Mg+2HCl==MgCl2+H2↑二、非金属单质+金属氧化物-------- 金属单质 + 水39、氢气还原氧化铜:H2+CuO Cu+H2O黑色固体逐渐变为红色,生成使无水硫酸铜变蓝的液体40、氢气还原氧化铁: 3H2+ Fe2O3 2Fe+3H2O 红色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体41、氢气还原四氧化三铁:4H2+ Fe3O4 3Fe+4H2O 黑色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体42、木炭还原氧化铜:C+2CuO 2Cu+CO2↑黑色固体逐渐变为红色,生成使澄清石灰水变浑浊的气体43、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑44、水蒸气通过灼热碳层:C + H2Og H2+CO 产物是水煤气的主要成分三、金属单质 + 盐溶液 ------- 另一种金属 + 另一种盐45、铁和硫酸铜溶液反应湿法炼铜、镀铜原理:Fe+CuSO4==FeSO4+Cu银白色金属表面覆盖一层红色物质46、锌和硫酸亚铁溶液反应:Mg+FeSO4==Fe+MgSO4溶液由浅绿色变为无色47、锌和硫酸铜溶液反应镀铜:Zn+CuSO4==ZnSO4+Cu青白色金属表面覆盖一层红色物质48、铜和硝酸汞溶液反应:Cu+HgNO32==CuNO32+Hg49、铜和硝酸银溶液反应镀银: Cu+2AgNO3==2Ag+CuNO32红色金属表面覆盖一层银白色物质四、复分解反应一、碱性氧化物金属氧化物 +酸 -------- 盐 + 水50、氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O51、氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2SO43+3H2O红色固体铁锈溶解,溶液呈黄色52、氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O黑色固体溶解、溶液呈蓝色53、氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O黑色固体溶解、溶液呈蓝色54、氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O白色固体溶解55、氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O白色固体溶解56、氧化钠和稀盐酸反应Na2O+2HCl==2NaCl+H2O白色固体溶解二、酸 + 碱 -------- 盐 + 水中和反应57、盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O58、盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O59、盐酸和氢氧化铜反应:2HCl+CuOH2==CuCl2+2H2O蓝色沉淀溶解,溶液呈蓝色60、盐酸和氢氧化钙反应:2HCl+CaOH2==CaCl2+2H2O61、盐酸和氢氧化铁反应:3HCl+FeOH3==FeCl3+3H2O红褐色沉淀溶解,溶液呈黄色62、氢氧化铝药物治疗胃酸过多:3HCl+AlOH3==AlCl3+3H2O63、硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O64、硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O65、硫酸和氢氧化铜反应:H2SO4+CuOH2==CuSO4+2H2O66、硫酸和氢氧化铁反应:3H2SO4+2FeOH3==Fe2SO43+ 6H2O67、硫酸和氢氧化钡反应:H2SO4+BaOH2==BaSO4↓+2H2O生成不溶解于稀硝酸的白色沉淀,应用于检验硫酸根68、硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O三、酸 + 盐 -------- 另一种酸 + 另一种盐69、石灰石或大理石与稀盐酸反应二氧化碳的实验室制法,除水垢:CaCO3+2HCl==CaCl2+H2O+CO2↑70、碳酸钠与稀盐酸反应泡沫灭火器的原理: Na2CO3+2HCl==2NaCl+H2O+CO2↑71、碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑72、盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO3生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子73、硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑74、硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根四、碱 + 盐 -------- 另一种碱 + 另一种盐75、氢氧化钠与硫酸铜:2NaOH+CuSO4==CuOH2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液76、氢氧化钠与氯化铁:3NaOH+FeCl3==FeOH3↓+3NaCl溶液黄色褪去,有红褐色沉淀生成77、氢氧化钠与氯化镁:2NaOH+MgCl2==MgOH2↓+2NaCl有白色沉淀生成78、氢氧化钠与氯化铜:2NaOH+CuCl2==CuOH2↓+2NaCl溶液蓝色褪去,有蓝色沉淀生成79、氢氧化钙与碳酸钠:CaOH2+Na2CO3==CaCO3↓+2NaOH80、氢氧化钠与硝酸铵:NaOH + NH4NO3 ==NaNO3+NH3↑+H2O生成使湿润石蕊试纸变蓝色的气体,应用于检验溶液中的铵根离子五、盐 + 盐 ----- 两种新盐81、氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子82、硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根其他不属于四种基本反应类型一有机物的燃烧83、甲烷在空气中燃烧甲烷和天然气的燃烧: CH4+2O2 CO2+2H2O蓝色火焰,放热,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体84、酒精乙醇在空气中燃烧氧炔焰、焊接切割金属: C2H5OH+3O2 2CO2+3H2O蓝色火焰,放热,有黑烟,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体二还原剂和氧化物反应85、一氧化碳还原氧化铜:CO+CuO Cu+CO286、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO2 黑色固体逐渐变红色,生成使澄清石灰水变浑浊的气体三酸性氧化物 +碱 -------- 盐 + 水87、氢氧化钠和二氧化碳反应苛性钠暴露在空气中变质除去二氧化碳:2NaOH+CO2==Na2CO3+H2O88、氢氧化钠吸收二氧化硫气体处理硫酸工厂的尾气SO2:2NaOH+SO2==Na2SO3+H2O89、氢氧化钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O90、二氧化碳通过澄清石灰水消石灰放在空气中变质检验二氧化碳:CaOH2+CO2==CaCO3↓+H2O91、氢氧化钙熟石灰,消石灰吸收二氧化硫:CaOH2+SO2==CaSO3↓+H2O。
初中四大基本反应类型

初中四大基本反应类型
《初中四大基本反应类型》
1、化合反应(Combination Reaction):
是指某些原子或分子之间发生化学反应,形成新的化合物的反应过程,一般都需要有明显热量能量,才可以使反应发生,最终形成的物质也发生了变化。
常见的化合反应有:水的结合反应,硝酸铵反应,氢氧化钠反应,氢氧化钾反应,硫酸铵反应,氯化钡反应,氯化锰反应,氯化钙反应等。
2、分解反应(Decomposition Reaction):
是指一种化合物在热量作用下,分解为多个原子或分子组成的反应,可以得到多种物质。
常见的分解反应有:氧化亚铁反应,火山灰块的消化反应,氯化氢反应,氢氧化钠反应,氢氧化钾反应,硫酸钠反应,电解溶液反应等。
3、消去反应(Elimination Reaction):
是指在某种特定的条件下,有效离子从某种物质中消去的反应,它往往产生两种新的物质。
常见的消去反应有:烧碱反应,硫酸铵消去反应,氢氧化钠消去反应,硝酸钠消去反应,硫酸钠消去反应,硫酸铝消去反应,碳酸钠消去反应等。
4、置换反应(Substitution Reaction):
是指某些物质中的某些原子或分子部分发生化学反应,形成新物质的反应。
常见的置换反应有:碳酸氢钠反应,氯化钠反应,氯化钙反应,氯化钡反应,硝酸铵反应,氯化锰反应,氢氧化钠反应,氢氧
化钾反应等。
初中化学四大基本反应类型

初中化学四大基本反应类型初中化学四大基本反应类型包括:化合反应、分解反应、置换反应、复分解反应一、化合反应1.概念化合反应是由两种或两种以上物质生成另一种物质的反应。
2.特点(多变一)A+B+...=C (化合价可变可不变)(1)生成物是一种物质。
(2)反应物不止一种物质。
(3)生成物一定要有固定组成,是纯净物。
3.判断判断一个反应是不是化合反应要着重于化合反应的概念及反应特点。
若要判断一个反应化学方程式是否属化合反应,要以此反应能够发生为前提,然后与化合反应的所有特点相对照,只有同时具有三个反应特点,才能确定为化合反应。
否则,不能列入化合反应。
二、分解反应1.概念分解反应是由一种物质生成两种或两种以上其他物质的反应。
2.特点(一变多)A= B+C+...(化合价可变可不变)(1)反应物是一种物质。
(2)生成物不止一种物质。
(3)反应物有固定组成,是纯净物。
3.判断反应能发生的前提下,看此反应是否具有分解反应的三个特点。
三、置换反应1.概念置换反应是由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应。
2.特点A+BC=AC+B 简记为“一换一”。
(1)反应物和生成物都是两种物质。
(2)反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物。
3.判断注意:(1)反应物一定是单质与化合物;但有单质和化合物参加的反应不一定是置换反应。
如CH4+2O2CO2+2H2O。
(2)生成物一定是单质与化合物。
但有单质和化合物生成的反应不一定是置换反应。
如CO+CuOCu+CO2。
如:Zn+2HCl=ZnCl2+H2↑(2)溶液中的置换反应:金属+盐溶液=盐+金属,如:Fe+CuSO4=FeSO4+Cu(3)干态下的置换反应:初中所学的有还原氧化铜的反应。
CuO+H2△Cu+H2O 2CuO+C高温2Cu+CO2↑置换反应的美丽动图~Zn+Pb(NO3)2=Pb+Zn(NO3)2Zn + 2AgNO3=Zn(NO3) 2+ 2AgZn + CuSO4 =ZnSO4 + CuZn + 2AgNO3=Zn(NO3) 2+ 2AgZn+Pb(NO3)2=Pb+Zn(NO3)2 四、复分解反应1.概念复分解反应是由两种化合物互相交换成分,生成另外两种化合物的反应。
[实用参考]初中化学四大基本反应类型
![[实用参考]初中化学四大基本反应类型](https://img.taocdn.com/s3/m/5b7c31ccf705cc17552709e5.png)
初中化学四大基本反应类型一、化合反应1、镁在空气中燃烧:2Mg+O2=点燃=2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe+2O2=点燃=Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu+O2=△=2CuO现象:铜丝变黑。
4、铝在空气中燃烧:4Al+3O2=点燃=2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2+O2=点燃=2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P+5O2=点燃=2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧:S+O2=点燃=SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C+O2=点燃=CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C+O2=点燃=2CO10、二氧化碳通过灼热碳层:C+CO2=高温=2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO+O2=点燃=2CO2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O===H2CO3现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸如:SO2+H2O===H2SO3SO3+H2O===H2SO413、生石灰溶于水:CaO+H2O===Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O+H2O=2NaOH氧化钾溶于水:K2O+H2O=2KOH氧化钡溶于水:BaO+H2O=Ba(OH)214、钠在氯气中燃烧:2Na+Cl2=点燃=2NaCl15、无水硫酸铜作干燥剂:CuSO4+5H2O====CuSO4•5H2O二、分解反应:1、水在直流电的作用下分解:2H2O=通电=2H2↑+O2↑现象:(1)电极上有气泡产生。
(完整)初中化学四大基本反应类型

初中化学考点——四大基本反应类型四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应1、非金属单质与氧气生成非金属氧化物。
如2H2+O2点燃H2O2、金属与氧气反应生成金属氧化物。
如3Fe+2O2点燃Fe3O43、金属氧化物与水反应,生成相应的碱。
如CaO+H2O= Ca(OH)2注:K2O、Na2O、BaO、CaO能与水反应,生成相应的碱,其他不能。
4、非金属氧化物与水反应,生成相应的酸。
如CO2+H2O= H2CO3注:能发生此反应的非金属氧化物有CO2、SO2、SO35、其它如2CO+ O2点燃2CO2二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。
1、不溶性碳酸盐高温分解如CaCO3高温CaO+CO2↑2、不溶性碱受热分解如Cu(OH)2△CuO + H2O注:除KOH、NaOH、Ba(OH)2之外,都能分解生成相应的氧化物和水3、某些酸式盐受热分解(了解)如 2NaHCO3=====Na2CO3+CO2↑+H2O4、某些碱式盐受热分解(了解)如 Cu2(OH)2CO3△ 2CuO+CO2↑+H2O其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫做置换反应。
1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸)例如:Fe+2HCl=FeCl2+H2↑Mg+ 2HCl = MgCl2+ H2↑H2SO4 + Fe = FeSO4+ H2↑2HCl + Zn = ZnCl2 + H2↑ H2SO4 + Zn = ZnSO4+ H2↑注:这里的酸,一般只稀盐酸和稀硫酸。
硝酸与金属反应不生成氢气。
2、金属与盐反应,生成新盐与新金属。
盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)例如:Fe+CuSO4===FeSO4+Cu 2AgNO3+ Cu= Cu(NO3)2 +2 Ag注:反应物中的盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。
化学】反应类型总结及规律

初中化学反应类型总结及规律一、基础知识(一)化学反应类型1、按照反应物与生成物的种类, 可把化学反应分为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。
(1)化合反应:由两种或两种以上的物质生成另一种物质的反应。
①金属与非金属的化合反应。
例如:2Na + Cl2点燃2NaCl 3Fe + 2O2点燃Fe3O4②非金属跟非金属的化合反应。
例如:4P + 5O2点燃2P2O5H2 + Cl2点燃2HCl③某些碱性氧化物跟水的化合反应。
例如:CaO + H2O == Ca(OH)2Na2O + H2O == 2NaOH ④某些酸性氧化物跟水的化合反应。
例如:CO2 + H2O == H2CO3SO3 + H2O == H2SO4⑤酸性氧化物跟碱性氧化物的化合反应。
例如:SiO2 + CaO 高温CaSiO3MgO + SO3 == MgSO4⑥多种物质之间的化合反应。
例如:2Cu + O2 + CO2 + H2O == Cu2(OH)2CO3CaCO3 + CO2 + H2O == Ca(HCO3)2 (2)分解反应:由一种物质生成两种或两种以上其它物质的反应。
①某些氧化物的分解反应。
例如:2H2O 通电2H2↑+ O2↑2HgO∆2Hg + O2↑②某些含氧酸的分解反应。
例如:H2CO3 == H2O + CO2↑2HClO 光照2HCl + O2↑(次氯酸)③难溶性碱的分解反应。
例如:Cu(OH)2∆CuO + H2O 2Fe(OH)3∆Fe2O3 + 3H2O④某些含氧酸盐的分解反应。
例如:CaCO3高温CaO + CO2↑2KMnO4∆K2MnO4 + MnO2 + O2↑(3)置换反应:由一种单质跟一种化合物起反应, 生成另一种单质和另一种化合物的反应。
①金属与酸的置换反应。
例如:Zn + 2HCl == ZnCl2 + H2↑Fe + H2SO4(稀) == FeSO4 + H2↑②金属与盐溶液的置换反应。
《四种基本反应类型》 知识清单

《四种基本反应类型》知识清单化学变化中,物质发生反应的类型多种多样,但从宏观角度可以归纳为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。
接下来,咱们就详细聊聊这四种反应类型。
一、化合反应化合反应,简单来说,就是由两种或两种以上的物质生成一种新物质的反应。
其特点可以总结为“多变一”。
比如,氢气和氧气在点燃的条件下生成水,化学方程式为:2H₂+O₂点燃 2H₂O 。
再比如,碳在氧气中充分燃烧生成二氧化碳,C +O₂点燃CO₂。
还有很多常见的化合反应,像金属单质与氧气的反应,比如铁在氧气中燃烧生成四氧化三铁,3Fe + 2O₂点燃 Fe₃O₄。
化合反应在日常生活和工业生产中有着广泛的应用。
例如,在炼铁过程中,一氧化碳和氧化铁的反应就是化合反应,生成铁和二氧化碳,这是炼铁的重要原理。
二、分解反应分解反应与化合反应正好相反,它是由一种物质生成两种或两种以上其他物质的反应。
特点是“一变多”。
比如,水在通电的条件下分解生成氢气和氧气,2H₂O 通电 2H₂↑+ O₂↑ 。
还有实验室制取氧气常用的方法,加热高锰酸钾分解生成锰酸钾、二氧化锰和氧气,2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑ 。
分解反应在实际应用中也非常重要。
例如,发酵粉中的碳酸氢钠受热分解产生二氧化碳,使面团膨胀,用于制作糕点、馒头等。
三、置换反应置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。
根据不同的分类标准,可以分为金属与酸的置换反应、金属与盐溶液的置换反应等。
金属与酸的置换反应,比如锌和稀硫酸反应生成硫酸锌和氢气,Zn + H₂SO₄= ZnSO₄+ H₂↑ 。
金属与盐溶液的置换反应,比如铁和硫酸铜溶液反应生成硫酸亚铁和铜,Fe + CuSO₄= FeSO₄+ Cu 。
置换反应在金属的冶炼和提纯中有着重要的作用。
比如,工业上用焦炭还原氧化铁来炼铁,3C + 2Fe₂O₃高温 4Fe + 3CO₂↑ 。
初中化学四大基本反应类型

分解反应:1、水在直流电的作用下分解:2H2O 通电2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
H2:O2=2:1正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰2、加热碱式碳酸铜:Cu2(OH)2CO3 △ 2CuO + H2O + CO2↑现象:绿色粉末变成黑色,试管内壁有水珠生成,澄清石灰水变浑浊。
3、加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2 2KCl + 3O2 ↑4、加热高锰酸钾:2KMnO4 △K2MnO4 + MnO2 + O2↑5、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑现象:有气泡产生,带火星的木条复燃。
6、加热氧化汞:2HgO 2Hg + O2↑7、锻烧石灰石:CaCO3 CaO+CO2↑(二氧化碳工业制法)8、碳酸不稳定而分解:H2CO3 === H2O + CO2↑现象:石蕊试液由红色变成紫色。
9、硫酸铜晶体受热分解:CuSO4•5H2O 加热CuSO4 + 5H2O复分解反应1、碱性氧化物+酸→盐+H2OFe2O3+6HCl==2FeCl3+3H2O Fe2O3+3H2SO4==Fe2(SO4)3+3H2OCuO+H2SO4==CuSO4+H2O ZnO+2HNO3==Zn(NO3)3+H2O2、碱+酸→盐+H2OCu(OH)2+2HCl==CuCl2+2H2O Cu(OH)2+H2SO4==CuSO4+2H2ONaOH+HCl==NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O Mg(OH)2+2HNO3==Mg(NO3)2+2H2OBa(OH)2+H2SO4==BaSO4↓+2H2O3、酸+盐→新盐+新酸CaCO3+2HCl==CaCl2+H2O+CO2↑Na2CO3+2HCl==2NaCl+H2O+CO2↑ HCl+AgNO3==AgCl↓+HNO3H2SO4+BaCl2==BaSO4↓+2HClBa(NO3)2+H2SO4==BaSO4↓+2HNO3NaHCO3+HCl==NaCl+H2O+CO2↑ 4、盐1+盐2→新盐1+新盐2KCl+AgNO3==AgCl↓+KNO3NaCl+AgNO3==AgCl↓+NaNO3Na2SO4+BaCl2==BaSO4↓+2NaCl BaCl2+2AgNO3==2AgCl↓+Ba(NO3)2 5、盐+碱→新盐+新碱CuSO4+2NaOH==Cu(OH)2↓+Na2SO4FeCl3+3NaOH==Fe(OH)3↓+3NaCl Ca(OH)2+Na2CO3==CaCO3↓+2NaOH NaOH+NH4Cl==NaCl+NH3↑+H2O化合反应:1、镁在空气中燃烧:2Mg + O2 点燃2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 点燃Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
常见的化学反应类型知识点

常见的化学反应类型知识点常见的化学反应类型知识点1.四种化学反应基本类型:(1)化合反应:由两种或两种以上物质生成一种物质的反应。
化合反应一般释放出能量。
如:A + B = AB(2)分解反应:由一种物质生成两种或两种以上其他物质的反应,是化合反应的逆反应。
如:AB = A + B(3)置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应。
如:A + BC = AC + B(4)复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
如:AB + CD = AD + CB2.还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)。
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型)。
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应。
自燃:由缓慢氧化而引起的自发燃烧。
3.催化剂:在化学变化里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学变化前后都没有变化的物质。
4.质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。
(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)5.溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物溶液的组成:溶剂和溶质。
(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其他为溶质。
)6.固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度。
化学的六大反应类型知识点总结1、基本反应类型①化合反应:由两种或两种以上物质生成另一种物质的反应②分解反应:由一种反应物生成两种或两种以上其他物质的反应③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应2、氧化还原反应氧化反应:物质得到氧的反应还原反应:物质失去氧的反应氧化剂:提供氧的物质还原剂:夺取氧的物质(常见还原剂:H2、C、CO)3、中和反应:酸与碱作用生成盐和水的反应4、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO45H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl5、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+O2↑16、加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑6、置换反应20、铁和硫酸铜溶液反应:Fe+CuSO4=FeSO4+Cu21、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑22、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑23、氢气还原氧化铜:H2+CuO加热Cu+H2O24、木炭还原氧化铜:C+2CuO高温2Cu+CO2↑25、甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O+C高温H2+CO27、焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2↑怎么学化学1.上课认真听,不管多么枯燥。
初中化学基本反应类型

初中化学基本反应类型化合反应、分解反应、置换反应、复分解反应1、化合反应:多种反应物生成一种生成物,简称多变一2、分解反应:一种反应物生成多种生成物,简称一变多3、置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物4、复分解反应:两种化合物互相交换成分生成另外两种化合物(生成物中有沉淀或有气体或有水生成时复分解反应才能发生)1、化合反应的特点:“多变一”,即反应后多种化合物转变成一种化合物。
2、分解反应的特点:由一种物质分解成多种物质“一变多”。
3、置换反应特点:一换一(即一种单质置换出另一种单质:A+BC=B+AC其中A, B为单质,BC为化合物)4、复分解反应的特点:反应前后不会有化合价的变化条件:一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生成物中有沉淀析出或有气体放出,或有水生成初中化学的基本反应类型有四种,即化合、分解、置换和复分解反应,这四种基本的反应类型,作为初中化学的重要组成部分,贯穿了整个教材,将初中化学知识串为一起,所以,加强对这部分知识的归纳梳理和对比分析,非常有利于学生对化学用语的突破及整个初中化学知识的理解掌握。
一、化合反应用字母可以表达为:A+B+..…C=D ,用文字可以表达为:即由多种物质生成一种物质的化学反应,在初中教材中,主要有以下几种类型:1、金属单质+氧气==金属氧化物金属活动性顺序表中的绝大部分金属单质,都可以和氧气在点燃、加热或高温的条下反应生成金属氧化物,而且,金属越活泼,与氧气的反应也就越容易。
如: Mg+O2 Al+O2==Fe+O2== Cu+O2==2、非金属单质+氧气==非金属氧化物,许多非金属单质如C、Si、S、P、H2、N2等都可以和氧气在点燃、加热等条件下反应生成非金属氧化物。
如:S+O2== P+O2==H2+O2== C+O2==3、碱性氧化物+水==碱在常温下,只有可溶性碱对应的氧化物才能与水反应生成碱,而不溶性碱对应的氧化物则不能能与水反应,如 CaO+H2O== K2O+H2O==BaO+H2O== NaO+H2O==而Fe(OH)3 Cu(OH)2 对应的氧化物如Fe2O3 CuO则不能与水发生化学反应。
初中化学反应类型总结及规律

初中化学反应类型总结及规律一、基础知识(一)化学反应类型1、按照反应物与生成物的种类, 可把化学反应分为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。
(1)化合反应:由两种或两种以上的物质生成另一种物质的反应。
①金属与非金属的化合反应。
例如:2Na + Cl2点燃2NaCl 3Fe + 2O2点燃Fe3O4②非金属跟非金属的化合反应。
例如:4P + 5O2点燃2P2O5H2 + Cl2点燃2HCl③某些碱性氧化物跟水的化合反应。
例如:CaO + H2O == Ca(OH)2 Na2O + H2O == 2NaOH ④某些酸性氧化物跟水的化合反应。
例如:CO2 + H2O == H2CO3SO3 + H2O == H2SO4⑤酸性氧化物跟碱性氧化物的化合反应。
例如:SiO2 + CaO 高温CaSiO3MgO + SO3 == MgSO4⑥多种物质之间的化合反应。
例如:2Cu + O2 + CO2 + H2O == Cu2(OH)2CO3CaCO3 + CO2 + H2O == Ca(HCO3)2 (2)分解反应:由一种物质生成两种或两种以上其它物质的反应。
①某些氧化物的分解反应。
例如:2H2O 通电2H2↑+ O2↑2HgO∆2Hg + O2↑②某些含氧酸的分解反应。
例如:H2CO3 == H2O + CO2↑2HClO 光照2HCl + O2↑(次氯酸)③难溶性碱的分解反应。
例如:Cu(OH)2∆CuO + H2O 2Fe(OH)3∆Fe2O3 + 3H2O④某些含氧酸盐的分解反应。
例如:CaCO3高温CaO + CO2↑2KMnO4∆K2MnO4 + MnO2 + O2↑(3)置换反应:由一种单质跟一种化合物起反应, 生成另一种单质和另一种化合物的反应。
①金属与酸的置换反应。
例如:Zn + 2HCl == ZnCl2 + H2↑Fe + H2SO4(稀) == FeSO4 + H2↑②金属与盐溶液的置换反应。
四种基本反应类型是哪四种

四种基本反应类型是哪四种化学反应有四种基本反应类型四大基本反应类型,如下:化合反应:化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
可简记为A+B=AB.分解反应:由一种物质生成两种或两种以上其它的物质的反应叫分解反应。
简称一分为二,表示为AB=A+B。
只有化合物才能发生分解反应。
置换反应:一种单质与化合物反应生成另外一种单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
可简记为AB+C=A+CB.复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
其实质是:发生复分解反应的两种物质在水溶液中相互交换离子,结合成难电离的物质—-沉淀、气体、水(弱电解质),使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行。
可简记为AB+CD=AD+CB。
扩展资料反应条件:指化学反应所必须或可提高反应速率的方法,如:加热(△)、点燃、高温、电解、通电(电解)、紫外线或催化剂等。
反应速率受到下列因素的影响:1.反应物浓度:如果增加,反应通常会加快。
2.活化能:定义为反应开始或自然发生所需的最低能量。
活化能越高,反应越难启动,反应速度越慢。
3.反应温度:温度的升高会加速反应,因为温度越高,能量越多,使反应容易发生。
4.催化剂:催化剂是一种通过改变活化能来改变反应速率的物质。
而且催化剂在反应过程中不会被破坏或改变,可以重复使用。
初中化学里常见的四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应,现在将它们在课本及习题中的呈现形式归纳如下:1.化学反应:两种或两种以上物质形成另一种物质的反应称为化学反应。
初中常见的化学反应主要有:1、非金属单质与氧气生成非金属氧化物。
如 2H2+O2 = H2O其他非金属如硫、磷和碳能与氧反应生成非金属氧化物。
2、金属与氧气反应生成金属氧化物。
初中化学四大基本反应类型知识清单
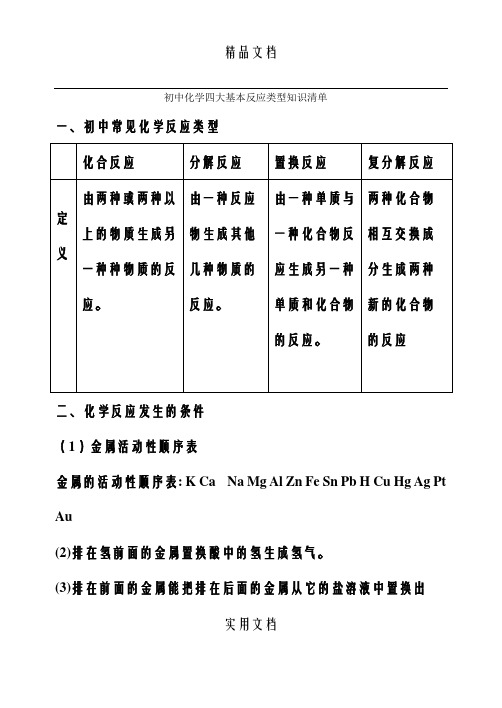
初中化学四大基本反应类型知识清单一、初中常见化学反应类型二、化学反应发生的条件(1)金属活动性顺序表金属的活动性顺序表: K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au(2)排在氢前面的金属置换酸中的氢生成氢气。
(3)排在前面的金属能把排在后面的金属从它的盐溶液中置换出实用文档来。
(一般不使用K、Ca、Na)(3)Fe与排在其后的金属的盐溶液反应也只能生成亚铁盐。
(4)复分解反应发生的条件:一般要有气体或沉淀或水生成。
三、常见化学反应方程式(一)、化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃SO27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2C + O2点燃2CO9、二氧化碳通过灼热碳层:C + CO2高温2CO实用文档10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl15、氧化钠溶于水:Na2O + H2O === 2NaOH16、三氧化硫溶于水:SO3 + H2O === H2SO4⒘Na2O+CO2==Na2CO3(二)、分解反应18、实验室用双氧水制氧气:2H2O2MnO22H2O + O2↑19、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑20、水在直流电的作用下分解:2H2O 2H2↑ + O2↑21、碳酸不稳定而分解:H2CO3△H2O + CO2↑22、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO +实用文档CO2↑23、加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑24、加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2和△2KCl + 3O2↑25、硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O (三)、置换反应26、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu27、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO4 + H2↑28、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑29、氢气还原氧化铜:H2 + CuO △Cu + H2O30、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑31、水蒸气通过灼热碳层:H2O + C 高温H2 + CO32、焦炭还原氧化铁:3C + 2Fe2O高温4Fe + 3CO2↑实用文档33、Ca(HCO3)2==== CaCO3 + H2O + CO2↑(四)、复分解反应34、盐酸和烧碱起反应:HCl + NaOH === NaCl + H2O35、盐酸和氢氧化钾反应:HCl + KOH === KCl + H2O36、盐酸和氢氧化铜反应:2HCl + Cu (OH)2 === CuCl2 + 2H2O37、盐酸和氢氧化钙反应:2HCl + Ca (OH)2 === CaCl2 + 2H2O38、盐酸和氢氧化铁反应:3HCl + Fe(OH)3 === FeCl3 + 3H2O39、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 === AlCl3 + 3H2O40、硫酸和烧碱反应:H2SO4 + 2NaOH === Na2SO4 + 2H2O41、硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 === CuSO4 + 2H2O42、硫酸和氢氧化铁反应:3H2SO4+ 2Fe(OH)3=== Fe2(SO4)3+ 6H2O43、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑44、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑45、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑实用文档46、盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO347、硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑48、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 === BaSO4↓+ 2HCl49、氢氧化钠与硫酸铜:2NaOH + CuSO4 === Cu(OH)2↓ + Na2SO450、氢氧化钠与氯化铁:3NaOH + FeCl3 === Fe(OH)3↓ + 3NaCl51、氢氧化钠与氯化镁:2NaOH + MgCl2 === Mg(OH)2↓ + 2NaCl52、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH53、氯化钠溶液和硝酸银溶液:NaCl + AgNO3=== AgCl↓ + N aNO354、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓ + 2NaCl二、几个氧化还原反应55、氢气还原氧化铜:H2△Cu + H2O56、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑实用文档57、焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑58、焦炭还原四氧化三铁:2C + Fe3O4高温3Fe + 2CO2↑59、一氧化碳还原氧化铜:CO + CuO △Cu + CO260、一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO261、一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO2三、自然界中的水:62.电解水:2H2O 通电2H2↑+ O2 ↑63.生石灰溶于水:CaO + H2O = Ca(OH)264.二氧化碳可溶于水:H2O + CO2=H2CO3四、质量守恒定律:65.镁在空气中燃烧:2Mg + O2 点燃2MgO66.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu实用文档实用文档73.煤炉的上部蓝色火焰的产生:2CO + O2点燃2CO2(3)二氧化碳的制法与性质:74.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑75.碳酸不稳定而分解:H2CO3 = H2O + CO2↑76.二氧化碳可溶于水:H2O + CO2=H2CO377.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑78.石灰水与二氧化碳反应:Ca(OH)2 + CO2 = CaCO3↓+ H2O CaCO3+H2O+CO2=Ca(HCO3)2(4)一氧化碳的性质:79.一氧化碳还原氧化铜:CO+ CuO △Cu + CO2实用文档86.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O487. 铜在空气中受热:2Cu + O2 △2CuO88. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 (2)金属单质+ 酸-------- 盐+ 氢气(置换反应)89. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑90. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑91铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑92. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐93. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu实用文档94. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu95. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg (3)金属铁的治炼原理:96.3CO+ 2Fe2O3高温4Fe + 3CO2↑八、酸、碱、盐97. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O98. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O99. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O100. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O (3)酸+ 碱-------- 盐+ 水(中和反应)实用文档101.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O102. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O 103. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 104. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐105.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑106.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑107.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑实用文档108. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水109.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 110.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 111.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 112.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 113. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O (2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐实用文档114. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH 3、盐的化学性质实用文档(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐115. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐116.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl =2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐117. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐118.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 =AgCl↓+ NaNO3119.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl实用文档如有侵权请联系告知删除,感谢你们的配合!28975 712F 焯24426 5F6A 彪23979 5DAB 嶫40862 9F9E 龞Y37459 9253 鉓25319 62E7 拧P21469 53DD 叝30677 77D5 矕23086 5A2E 娮N25765 64A5 撥@432040 7D28 紨d35781 8BC5 诅.{26766 688E 梎26851 68E3 棣)w`}21046 5236 制33826 8422 萢实用文档。
初中化学反应基本类型

初中化学反应基本类型初中化学有四大基本反应类型,是化学反应中十分重要的反应类型,为化合反应,分解反应,置换反应和复分解反应。
化合反应化合反应指的是由两种或两种以上的物质反应生成一种新物质的反应。
其中部分反应为氧化还原反应,部分为非氧化还原反应。
此外,化合反应一般释放出能量。
可简记为A+B=AB。
1.3Fe+2O2=点燃Fe3O4现象:铁在氧气中剧烈燃烧,产生大量火花,集气瓶底有黑色固体产生2.C+O2=点燃CO2现象:碳在充足的氧气中燃烧,发红光,放热。
3.2C+O2=点燃2CO现象:碳在不充足的氧气中燃烧4.S+O2=点燃SO3现象:硫在空气中发淡蓝色火焰,在氧气中发蓝紫色火焰,生成刺激性气体。
5.4P+5O2=点燃2P2O5现象:磷在氧气中燃烧,生成大量白烟分解反应由一种物质生成两种或两种以上其它的物质的反应叫分解反应。
简称一分为二,表示为AB=A+B。
只有化合物才能发生分解反应。
1.水在直流电的作用下分解:2H2O=通电2H2↑+O2↑现象:电极上有气泡产生。
H₂:O₂=2:1正极产生的气体能使带火星的木条复燃。
负极产生的气体能在空气中燃烧,产生淡蓝色火焰2.加热碱式碳酸铜:Cu2(OH)2CO3=Δ2Cu0+H2O+CO2↑现象:绿色粉末变成黑色,试管内壁有水雾或水珠生成,澄清石灰水变浑浊。
3.加热氯酸钾和二氧化锰制氧气:2KClO3=MnO2 Δ 2KCI+3O2↑4.加热高锰酸钾制氧气:KMnO4=ΔK2MnO4+MnO2+O2↑5.实验室用双氧水制氧气:H2O2=MnO2 H2O+O2↑现象:有气泡产生,带火星的木条复燃。
置换反应一种单质与化合物反应生成另外一种单质和化合物的化学反应,是化学中四大基本反应类型之一,包括金属与金属盐的反应,金属与酸的反应等。
可简记为AB+C=A+CB。
1.锌和稀硫酸反应:Zn + H₂SO₄ === ZnSO₄ + H₂↑2.镁和稀硫酸反应:Mg + H₂SO₄ === MgSO₄ + H₂↑3.铝和稀硫酸反应:2Al + 3H₂SO₄ === Al₂(SO₄)₃ + 3H₂↑4.锌和稀盐酸反应:Zn + 2HCl === ZnCl₂ + H₂↑5.镁和稀盐酸反应:Mg+ 2HCl === MgCl₂ + H₂↑复分解反应由两种化合物互相交换成分,生成另外两种化合物的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学四大基本反应类型知识清单一、初中常见化学反应类型二、化学反应发生的条件(1)金属活动性顺序表金属的活动性顺序表: K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au(2)排在氢前面的金属置换酸中的氢生成氢气。
(3)排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
(一般不使用K、Ca、Na)(3)Fe与排在其后的金属的盐溶液反应也只能生成亚铁盐。
(4)复分解反应发生的条件:一般要有气体或沉淀或水生成。
三、常见化学反应方程式(一)、化合反应1、镁在空气中燃烧:2Mg + O2点燃2MgO2、铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43、铝在空气中燃烧:4Al + 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 + O2点燃2H2O5、红磷在空气中燃烧:4P + 5O2点燃2P2O56、硫粉在空气中燃烧:S + O2点燃SO27、碳在氧气中充分燃烧:C + O2点燃CO28、碳在氧气中不充分燃烧:2C + O2点燃2CO9、二氧化碳通过灼热碳层:C + CO2高温2CO10、一氧化碳在氧气中燃烧:2CO + O2点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312、生石灰溶于水:CaO + H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 + 5H2O === CuSO4·5H2O14、钠在氯气中燃烧:2Na + Cl2点燃2NaCl15、氧化钠溶于水:Na2O + H2O === 2NaOH16、三氧化硫溶于水:SO3 + H2O === H2SO4⒘Na2O+CO2==Na2CO3(二)、分解反应18、实验室用双氧水制氧气:2H2O2MnO22H2O + O2↑19、加热高锰酸钾:2KMnO4△K2MnO4 + MnO2 + O2↑20、水在直流电的作用下分解:2H2O 2H2↑+ O2↑21、碳酸不稳定而分解:H2CO3△H2O + CO2↑22、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO + CO2↑23、加热碱式碳酸铜:Cu2(OH)2CO3△2CuO + H2O + CO2↑24、加热氯酸钾(有少量的二氧化锰):2KClO3 MnO2和△2KCl + 3O2↑25、硫酸铜晶体受热分解:CuSO4·5H2O △CuSO4 + 5H2O (三)、置换反应26、铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu27、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 === ZnSO4 + H2↑28、镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑29、氢气还原氧化铜:H2 + CuO △Cu + H2O30、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑31、水蒸气通过灼热碳层:H2高温H2 + CO32、焦炭还原氧化铁:3C + 2Fe2O高温4Fe + 3CO2↑33、Ca(HCO3)2==== CaCO3 + H2O + CO2↑(四)、复分解反应34、盐酸和烧碱起反应:HCl + NaOH === NaCl + H2O35、盐酸和氢氧化钾反应:HCl + KOH === KCl + H2O36、盐酸和氢氧化铜反应:2HCl + Cu (OH)2 === CuCl2 + 2H2O37、盐酸和氢氧化钙反应:2HCl + Ca (OH)2 === CaCl2 + 2H2O38、盐酸和氢氧化铁反应:3HCl + Fe(OH)3 === FeCl3 + 3H2O39、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 === AlCl3 + 3H2O40、硫酸和烧碱反应:H2SO4 + 2NaOH === Na2SO4 + 2H2O41、硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 === CuSO4 + 2H2O42、硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3 === Fe2(SO4)3 + 6H2O43、大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑44、碳酸钠与稀盐酸反应:Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑45、碳酸镁与稀盐酸反应:MgCO3 + 2HCl === MgCl2 + H2O + CO2↑46、盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓+ HNO347、硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑48、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 === BaSO4↓+ 2HCl49、氢氧化钠与硫酸铜:2NaOH + CuSO4 === Cu(OH)2↓+ Na2SO450、氢氧化钠与氯化铁:3NaOH + FeCl3 === Fe(OH)3↓+ 3NaCl51、氢氧化钠与氯化镁:2NaOH + MgCl2 === Mg(OH)2↓+ 2NaCl52、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH53、氯化钠溶液和硝酸银溶液:NaCl + AgNO3 === AgCl↓+ NaNO354、硫酸钠和氯化钡:Na2SO4 + BaCl2 === BaSO4↓+ 2NaCl二、几个氧化还原反应55、氢气还原氧化铜:H2△Cu + H2O56、木炭还原氧化铜:C + 2CuO 高温2Cu + CO2↑57、焦炭还原氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑58、焦炭还原四氧化三铁:2C + Fe3O4高温3Fe + 2CO2↑59、一氧化碳还原氧化铜:△Cu + CO260、一氧化碳还原氧化铁:3CO + Fe2O3高温2Fe + 3CO261、一氧化碳还原四氧化三铁:4CO + Fe3O4高温3Fe + 4CO2三、自然界中的水:七、金属(1)金属与氧气反应:85.镁在空气中燃烧:2Mg + O2点燃2MgO 86.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O487. 铜在空气中受热:2Cu + O2 △2CuO88. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 (2)金属单质+ 酸-------- 盐+ 氢气(置换反应)89. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑90. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑91铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑92. 镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑(3)金属单质+ 盐(溶液)------- 新金属+ 新盐93. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu94. 锌和硫酸铜溶液反应:Zn + CuSO4 =ZnSO4 + Cu95. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2= Cu(NO3)2 + Hg (3)金属铁的治炼原理:96.3CO+ 2Fe2O3高温4Fe + 3CO2↑八、酸、碱、盐97. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl3 + 3H2O98. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O99. 氧化铜和稀盐酸反应:CuO + 2HCl =CuCl2 + H2O100. 氧化铜和稀硫酸反应:CuO + H2SO4 =CuSO4 + H2O(3)酸+ 碱-------- 盐+ 水(中和反应)101.盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O102. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O 103. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O104. 硫酸和烧碱反应:H2SO4 + 2NaOH =Na2SO4 + 2H2O(4)酸+ 盐-------- 另一种酸+ 另一种盐105.大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑106.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑107.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑108. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱+ 非金属氧化物-------- 盐+ 水109.苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 110.苛性钠吸收二氧化硫气体:2NaOH + SO2 =Na2SO3 + H2O 111.苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 112.消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3↓+ H2O 113. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3↓+ H2O(2)碱+ 酸-------- 盐+ 水(中和反应,方程式见上)(3)碱+ 盐-------- 另一种碱+ 另一种盐114. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)+ 金属单质------- 另一种金属+ 另一种盐115. 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)盐+ 酸-------- 另一种酸+ 另一种盐116.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl =2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl= NaCl + H2O + CO2↑(3)盐+ 碱-------- 另一种碱+ 另一种盐117. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2NaOH (4)盐+ 盐----- 两种新盐118.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 =AgCl↓+ NaNO3。
