大肠杆菌表达系统与蛋白表达纯化(参考资料)
CGGBP1蛋白在大肠杆菌中的表达及其纯化

CGGBP1蛋白在大肠杆菌中的表达及其纯化【关键词】 CGGBP1;基因表达;纯化0引言脆性X综合征(fragile X syndrome, FXS)是一种最多见的遗传性智力发育不全综合征,有超过99%的FXS是由脆性X智障基因1(fragile X mental retardation, FMR1)中5′端非编码区CGG三核苷酸重复序列不稳固扩增及其CpG岛异样甲基化致使. FMR1基因的表达产物FMRP的缺乏致使FXS的发生[1-2]. 本实验对编码基因存在于3号染色体[3],能与FMR1 基因5′ d (CGG)n3′重复序列特异性结合的蛋白CGGBP1进行原核表达,并对其DNA结合活性进行研究.1材料和方式材料大肠杆菌DH5α, BL21( DE3)和表达载体pRSET A均为本实验室保留. 质粒提取试剂盒购自Sigma公司;限制性内切酶BamH I 和KpnI购自宝生物工程公司;T4 DNA连接酶购自Promega公司; Ni2+NTA金属螯合蛋白质纯化系统购自Qiagen公司;链酶亲和素磁珠购自Dynal公司;低分子质量蛋白标准购自上海西巴斯生物技术.方式表达载体的构建依照CGGBP1基因起始密码子和终止子临近序列设计PCR引物:CGGBP1F CGC GGA TCC GAG CGA TTG TAG TAA CAG CA,CGGBP1R GGG GTA CCT CAA CAA TCT TGT GAG TTG AG. 其上游及下游引物别离加入BamHI和KpnI酶切识别位点序列(引物序列下划线部份). PCR反映以人淋巴细胞cDNA文库为模板,扩增编码CGGBP1的基因序列. 设计PCR 扩增体系25 μL,灭菌去离子水10 μL,10×反映缓冲液μL,25 mmol/L MgCl2 μL,DMSO μL,4× dNTP混合物(每种 mmol/L)2 μL,CGGBP1F和CGGBP1R各10 pmol,模板μL(50 ng/μL), Taq DNA (5 μ/μL)聚合酶μL. 扩增条件:95℃预变性5 min,再94℃ 30 s, 53℃ 1 min,72℃ 1 min循环40次,最后72℃终末延伸产物10 min. PCR产物经琼脂糖电泳分离,用胶回试剂盒回收目的基因. 用BamHI和KpnI酶切PCR产物和pRSET A,酶切产物电泳后回收,在T4连接酶作用下,目的片段定向克隆至pRSET A的BamHI和KpnI克隆位点. 将重组质粒转入大肠杆菌DH5α,接种到含氨苄青霉素的LB培育基平板并挑取单菌落.融合蛋白的诱导表达将测序正确的重组质粒转入BL21( DE3). 挑取携带目标质粒的单菌落接种于含100 mg/L氨苄青霉素的LB培育基中, 37℃振荡培育12 h,按10 mL/L比例转接于新鲜培育基,37℃振荡培育至对数生长期时,加入IPTG至终浓度1 mmol/L,32℃诱导振荡培育4 h,离心搜集菌体,SDS PAGE分析重组蛋白的表达.蛋白表达形式的分析取5 mL菌液离心,用500 μL的裂解液(10 mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L磷酸二氢钠 pH )重悬,加溶菌酶至终浓度为1 mg/mL,冰浴30 min,超声波裂菌,离心后别离将上清和沉淀进行SDS PAGE分析.融合蛋白的纯化将1 mL 500 mL/L Ni2+NTA悬液和4 mL细菌裂解上清液轻轻混匀4℃放置60 min,直接过柱. 过柱终止后,用4 mL漂洗液(20 mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L 磷酸二氢钠 pH ),洗脱未和Ni珠结合的杂蛋白. 通过2次漂洗后再用 mL洗脱液(250mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L 磷酸二氢钠 pH 3次洗脱特异结合的目的蛋白,分步搜集. 取搜集液,进行SDS PAGE 分析.与(CGG)29重复序列双链DNA结合实验取10 μL磁珠用1 mL的无RNA酶的三蒸水清洗磁珠2次,除去防腐剂. 1×生物素亲和素结合缓冲液(10 mmol/L Tris HCl,2 mol/L NaCl,1 mmol/L EDTA,1 g/L Tween 20)15 μL重悬磁珠,各5 μL分3组实验. 其中一组加入25 μL(100 ng/μL)生物素化的(CGG)29重复序列双链DNA,另外两组别离加入25 μL(100 ng/μL)非生物素化的(CGG)29重复序列双链DNA和25 μL三蒸水做对照;三组别离再加入2×生物素亲和素结合缓冲液30 μL,25℃轻摇1 h. 经磁力吸附后,弃上清. 重复上述步骤3次;加入纯化后CGGBP1(500 μg/mL)15 μL 和2×核酸蛋白结合缓冲液(20 mmol/L HEPES,100 mmol/L NaCl, mmol/L DTT,100 g/L甘油)20 μL,室温下静置30 min;经磁力吸附后,弃上清;用1×核酸蛋白结合缓冲液清洗磁珠2次;加三蒸水10 μL,滚水煮10 min,进行SDS PAGE 分析.2结果原核表达载体的构建及鉴定扩增产物在15 g/L的琼脂糖凝胶电泳,可观看到一条约504 bp的条带(图1);重组质粒pRSET A/CGGBP1及质粒pRSET A别离用BamHI和KpnI酶切,pRSET A/CGGBP1分为两个片段,别离为 ku和504 bp(图2),均与估量结果相同. 的表达用BamHI和KpnI双酶切pRSET A/CGGBP1表达质粒,挑选阳性重组质粒. 携带有pRSET A/CGGBP1质粒的 BL21(DE3)菌株,经IPTG 诱导后,在Mr 约25 000处显现1条表达条带;而未经IPTG诱导的菌体那么无此条带. 诱导后的菌体经溶菌酶及超声波裂解,离心后分为上清和沉淀两部份. 经SDS PAGE分析说明,CGGBP1部份存在于细菌裂解液的上清中,为可溶性蛋白,上清液中的目标蛋白相对较少(图3).蛋白纯化在表达质粒pRSET A多克隆酶切位点的上游,插入有持续6个组氨酸的序列—(His )6 tag. 重组质粒经诱导表达后,(His )6 tag 能够和外源插入片段一起表达. 利用(His )6 tag 和金属Ni2+的螯合所设计的固定化金属配体亲和柱层析方式,是纯化目的蛋白的一种高效而简单的方式. SDS PAGE显示,CGGBP1取得较高程度的纯化(图4).与5′d(CGG)293′重复序列双链DNA结合实验生物素化的5′d(CGG)29 3′重复序列双链DNA被固定到链酶亲和素磁珠上,非生物素化的5′d(CGG)293′重复序列双链DNA因无法固定到链酶亲和素磁珠上而被洗脱掉. 同理,加入CGGBP1后,未和5′ d (CGG)293′重复序列双链DNA 结合的蛋白也被洗脱(图5).3讨论关于微卫星的产生机制,普遍以为是DNA复制进程中DNA聚合酶的滑动[4],或DNA复制和修复时滑动链与互补链碱基错配,致使一个或几个重复单位的插入或缺失. 已发觉微卫星可能是一种超级活跃的碱基序列,通常各类简单的重复序列成簇地聚集在一个染色体区域,那个染色体区形成特异染色体结构的能力将会增强. 这些区域在核糖体RNA基因中超级复杂,同时这些重复序列所折叠形成的结构还能与特异的蛋白质相结合,成为“染色质折叠密码”[5-6],参与遗传物质的结构改变,基因调控及细胞分化等进程. 脆性X综合征是Igarashi等[7]研究报导的与三核苷酸重复片段扩增突变有关的7种神经变性疾病其中的一种. 该蛋白只和(CGG)n重复序列发生特异性结合,而与其它类型的三核苷酸重复序列不结合[8]. 因此,对该蛋白功能的研究具有重要的理论研究意义.本实验成功地构建了含CGGBP1的重组质粒,以可溶性蛋白形式取得较高表达. 通过Ni2+NTA柱纯化,取得纯化的目标融合蛋白质,同时证明了该蛋白能和人FMR1基因5′d (CGG)293′重复序列双链DNA特异性结合. 这将为进一步开展真核生物蛋白CGGBP1功能的研究和阐释CGG三核苷酸动态突变的致病机理奠定基础.【参考文献】[1]Wells RD, Warren ST. Genetic Instabilities and Hereditary Neurological Disorders [M]. Academic Press, San Diego,1998:46-96.[2]Cleary JD, Nichol K, Wang YH, et al. Evidence of cis acting factors in replication mediated trinucleotide repeat instability in primate cells[J]. Nat Genet, 2002, 31(1):37-46.[3]Deissler H, Wilm M, Genc B, et al. Rapid protein sequencing by tandem mass spectrometry and cDNA cloning of CGGBP1[J].Biol Chem, 1997,272(27):.[4]Sinden RR, Potaman VN, Oussatcheva EA, et al. Triplet repeat DNA structures and human genetic disease: Dynamic mutations from dynamic DNA [J]. Bioscience, 2002,27(1 Suppl 1):53-65.[5]Wahls WP. Meiotic recombination hot spots: Shapping the genome and insight into hypervariable minisatellite DNA change[J].Curr Top Dev Bio1, 1998,37:37-75.[6]Wahls WP, Moore PD. Recombination hotspot activity of hypervariable minisatellite DNA requires minisatellite DNA binding proteins[J].Somat Cell Mol Genet, 1998,24(1):41-51.[7]Igarashi S, Tsuji S. The molecular mechanisms of the instability of the CAG repeat[J]. Nippon Rinsho,1998,56(4):1064-1073.[8]Deissler H, Behn Krappa A, Doerfler W. Purification of nuclear proteins from human HeLa cells that bind specifically to the unstable tandem repeat (CGG)n in the human FMR1 gene[J]. Biol Chem, 1996,271(8):4327-4334.。
生物医药中的蛋白质表达与纯化

生物医药中的蛋白质表达与纯化蛋白质是生命体中最重要的有机物之一,它们参与了几乎所有的生命相关过程,包括代谢、细胞信号转导、免疫防御等。
因此,在许多生物医药研究领域中,研究蛋白质表达和纯化已经成为当今的热门研究方向之一。
一、蛋白质表达技术蛋白质表达是指在细胞中合成蛋白质的过程,其主要方法是利用表达载体将目标蛋白质基因导入宿主细胞中,使其能够大规模表达出来。
其中最常用的表达系统是大肠杆菌表达系统和哺乳动物细胞表达系统。
1、大肠杆菌表达系统大肠杆菌通常被用作表达外源蛋白质的宿主细胞,因为其细胞生长快速且易于操作。
该表达系统通常利用大肠杆菌基因组的一部分来连接目标蛋白质基因并实现蛋白质表达。
遗憾的是,大肠杆菌常常会形成蛋白质的不溶性体,这是由于你的质量比较大,难以被合适地折叠成稳定的构象。
因此,提取可溶性蛋白质是这一表达系统的主要问题之一。
2、哺乳动物细胞表达系统与大肠杆菌表达系统不同,哺乳动物细胞表达系统可用于表达复杂的蛋白质,如具有复杂糖基化模式的蛋白质。
这种表达系统通常是通过将目标蛋白质基因导入哺乳动物细胞中,使其在细胞内表达目标蛋白质。
二、蛋白质纯化技术蛋白质纯化是指将目标蛋白质从复杂的生物混合物中分离出来的过程。
该过程是一系列分离和纯化步骤的组合,其中包括固定化金属离子亲和层析、凝胶过滤层析和离子交换层析等技术。
1、固定化金属离子亲和层析固定化金属离子亲和层析(IMAC)是目前蛋白质纯化的一种最常用技术。
该技术利用一种含有带有金属离子配体分子的树脂(如Ni2+或Zn2+),并利用这些金属离子与蛋白质中暴露的组氨酸或半胱氨酸结合的特性来实现目标蛋白质的分离纯化。
2、凝胶过滤层析凝胶过滤层析(gel filtration chromatography)也称为大小排除层析,将会把分子根据大小过滤排除,这是一种基于分子大小差异原理的蛋白质纯化技术。
通过大小排除层析,低分子量目标蛋白质可以快速流过呈大小孔隙的树脂颗粒,而高分子量物质则在树脂颗粒中保留更长时间,以实现目标蛋白质与其他分子的分离。
大肠杆菌系统表达和纯化流程
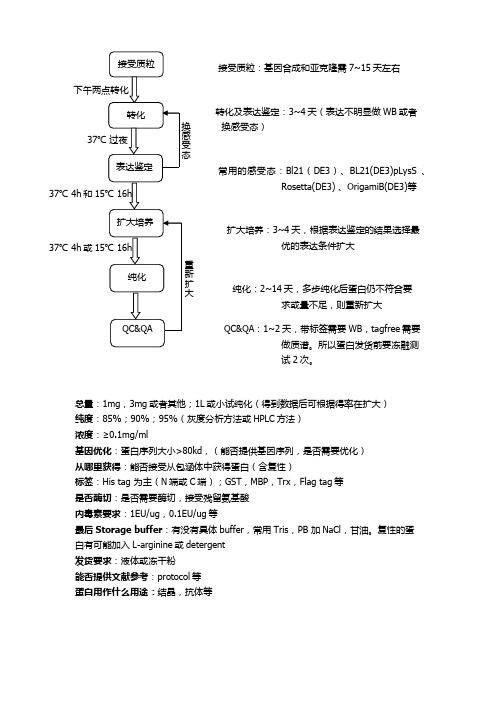
转化及表达鉴定:3~4天(表达不明显做WB或者
换感受态)
常用的感受态:Bl21(DE3)、BL21(DE3)pLysS 、
Rosetta(DE3) 、OrigamiB(DE3)等
扩大培养:3~4天,根据表达鉴定的结果选择最
优的表达条件扩大
纯化:2~14天,多步纯化后蛋白仍不符合要
求或量不足,则重新扩大
:1~2天,带标签需要WB,tagfree需要
做质谱。
所以蛋白发货前要冻融测
试2次。
总量:1mg,3mg或者其他;1L或小试纯化(得到数据后可根据得率在扩大)
纯度:85%;90%;95%(灰度分析方法或HPLC方法)
浓度:≥0.1mg/ml
基因优化:蛋白序列大小>80kd,(能否提供基因序列,是否需要优化)
从哪里获得:能否接受从包涵体中获得蛋白(含复性)
标签:His tag 为主(N端或C端);GST,MBP,Trx,Flag tag等
是否酶切:是否需要酶切,接受残留氨基酸
内毒素要求:1EU/ug,0.1EU/ug等
最后Storage buffer:有没有具体buffer,常用Tris,PB 加NaCl,甘油。
复性的蛋
白有可能加入L-arginine或detergent
发货要求:液体或冻干粉
能否提供文献参考:protocol等
蛋白用作什么用途:结晶,抗体等。
蛋白体外表达与纯化

蛋白体外表达与纯化随着后基因组时代的到来,蛋白质组成为科学研究的热点。
蛋白质作为生命机体的主要活动的承担者,其体外表达与纯化在研究相应基因的功能上有重要意义。
蛋白体外表达系统按其表达宿主可分为原核表达系统,真核表达系统和哺乳动物细胞表达系统。
一:原核表达系统原核表达系统的宿主菌主要以大肠杆菌为代表,大肠杆菌表达体系是目前应用最广泛的外源基因表达体系,这也是外源基因表达的首选体系。
该表达体系的优点:遗传学和生理学背景清楚;容易培养;外源基因经常可以高效表达及操作简单、周期短、成本低等。
其不足之处是不能进行典型真核细胞所具有的复杂的翻译后修饰;广泛的二硫键的形成及外源蛋白组装成蛋白复合体的能力也受到限制;另外外源基因产物在大肠杆菌中易形成不溶的包涵体;有时由于真核mRNA的结构特性及密码子使用频率与大肠杆菌的差异,而的不到足够的产物。
二:真核表达系统真核表达系统的宿主菌主要以酵母表达系统为代表,酵母基因表达系统的载体通常既能在酵母中进行复制也能在大肠杆菌中进行复制,形成所谓酵母菌――大肠杆菌穿梭载体。
因以大肠制备质粒DNA较方便,通常利用大肠杆菌系统构建酵母载体以简化手续,缩短时间。
作为基因表达系统的宿主应该具备以下条件:安全无毒,不致病;遗传背景较清楚,容易进行遗传操作;容易进行载体DNA的导入;培养条件简单;有良好的蛋白分泌能力;有类似高等真核生物的蛋白翻译后修饰功能。
三:哺乳动物细胞表达系统由于本专业不涉及哺乳动物细胞表达系统的应用,故此不赘述。
表达载体的种类及相应的分离纯化方法作为表达载体必须具备以下特征:稳定的遗传复制、传代能力,无选择压力下能存在于宿主细胞内;具有显性的筛选标记;启动子的转录是可调控的;启动子的转录的mRNA能够在适当的位置终止;具有外源基因插入的多克隆位点。
在原核表达系统中常用的表达载体有:PET-载体系列,用这类载体表达出的外源蛋白在N端或C端或两端均具有his tag。
重组蛋白质的表达与纯化技术

重组蛋白质的表达与纯化技术蛋白质是生命体活动的重要组成部分,对于生命体的生长、繁殖和免疫功能起着至关重要的作用。
而重组蛋白质则是利用基因工程技术,将人工合成的外源基因导入到特定的宿主细胞中,通过细胞表达和纯化技术得到的转录翻译产物。
这种技术不仅可以生产天然蛋白质,还可以生产人工合成的新型蛋白质,对于疾病的治疗和新药的研发有着重要的意义。
一、蛋白质表达技术蛋白质表达是获得大量重组蛋白质的重要方法。
选择适当的宿主细胞和表达载体是获得高水平表达的关键。
常用的宿主细胞包括大肠杆菌、酵母菌、昆虫细胞、哺乳动物细胞等。
1.大肠杆菌表达系统大肠杆菌表达系统具有生长快、表达量高等优点,广泛应用于重组蛋白质的表达和纯化。
其表达载体主要有pET和pBAD两种,pET系统一般用于产生可以形成包涵体的重组蛋白,pBAD系统用于在分泌表达中产生滞留蛋白。
2.昆虫细胞表达系统昆虫细胞表达系统包括SF9、Sf21、HighFive等细胞系,常用的表达载体为pIB/V5-His、pFastBac等。
昆虫细胞表达系统通常用于表达大分子蛋白质,如糖蛋白、膜蛋白等。
3.哺乳动物细胞表达系统哺乳动物细胞表达系统是目前表达规模最大、表达产物最接近人体蛋白质的一种表达系统。
其表达载体主要有pCDNA3.1、pCI 等,常用于表达与人体有关的蛋白质,如抗体、生长因子等。
二、蛋白质纯化技术蛋白纯化是重组蛋白质生产的重要环节,其目的是得到高质量的、纯度较高的蛋白质样品。
常见的纯化方法包括亲和层析法、离子交换层析法、凝胶过滤层析法、逆流式层析法等。
1.亲和层析法亲和层析法是指因与载体中固定的亲和剂相互结合而纯化目标蛋白质的一种方法。
亲和剂通常是与目标蛋白质有特异性结合作用的化合物,如亲和标签、酶底物、抗体等。
常见的亲和层析方法有亲和柱层析、亲和膜层析等。
2.离子交换层析法离子交换层析法是根据蛋白质带有正或负电荷的差异性进行分离的一种方法。
离子交换层析的柱填充物常为离子交换树脂,其一般分为阴离子交换树脂和阳离子交换树脂两种。
大肠杆菌表达纯化蛋白

大肠杆菌表达纯化蛋白大肠杆菌是一种常见的细菌,广泛应用于生物学研究中。
它具有较高的生长速度、易于培养和操作的特点,被广泛用于表达和纯化蛋白。
本文将从大肠杆菌的选择、蛋白表达、纯化等方面介绍如何利用大肠杆菌表达纯化蛋白。
一、大肠杆菌的选择在大肠杆菌中选择合适的表达宿主菌株至关重要。
一般而言,常用的宿主菌株有BL21(DE3)、Rosetta(DE3)、Origami(DE3)等。
这些菌株具有较高的蛋白表达能力和稳定性,适合用于表达多种蛋白。
根据所需表达的蛋白的特点(例如毒性、折叠状态等),选择合适的宿主菌株是必要的。
二、蛋白表达蛋白表达是指通过转化目标基因到大肠杆菌中,使其表达目标蛋白。
一般采用的方法有原核表达和真核表达两种。
原核表达是将目标基因插入表达质粒,然后转化到大肠杆菌中,利用大肠杆菌的细胞机制进行蛋白表达。
真核表达则是将目标基因转化到真核细胞中,利用真核细胞的转录和翻译系统进行蛋白表达。
在大肠杆菌中进行蛋白表达时,需要选择适当的表达质粒。
常用的表达质粒有pET系列、pGEX系列等。
这些质粒通常含有启动子、多克隆位点、选择标记等功能元件,能够实现高效的蛋白表达。
在构建表达质粒时,需要将目标基因插入适当的位点,确保目标蛋白能够被正常表达。
三、蛋白纯化蛋白表达后,需要对目标蛋白进行纯化。
常用的纯化方法包括亲和层析、离子交换层析、凝胶过滤层析等。
亲和层析是利用蛋白与亲和树脂之间的特异性相互作用进行纯化的方法。
离子交换层析则是利用蛋白与离子交换树脂之间的电荷相互作用进行纯化的方法。
凝胶过滤层析则是利用蛋白在凝胶中的分子大小差异进行纯化的方法。
在进行蛋白纯化时,需要根据目标蛋白的特性选择合适的纯化方法。
不同的纯化方法具有不同的选择条件和操作步骤,需要根据实际情况进行选择。
此外,为了提高纯化效果,还可以采用多步骤的纯化策略,如串联多个纯化方法,以获得更高纯度的蛋白。
四、蛋白质结构分析在蛋白纯化后,可以对目标蛋白进行结构分析。
大肠杆菌表达重组蛋白的超声破碎及纯化

大肠杆菌表达重组蛋白的超声破碎及纯化大肠杆菌表达重组蛋白的超声破碎及纯化一可溶性蛋白的纯化(一)菌体的破碎1. 仪器与材料:-80℃冰箱;超声波细胞破碎仪;50mM PBS或50mM Tris-HCl pH 7.5;50ml 离心管;冷冻高速离心机2. 方法2.1反复冻融2.1.1收集菌液500ml,等分10份,4000 r/min 4℃离心15min,弃上清。
2.1.2 菌体沉淀中加入相同菌液体积的50mM PBS 或50mM Tris-HCl(选择使蛋白稳定的缓冲液和pH)重悬洗涤一次。
2.1.3 然后按原菌液体积的1/4加入缓冲液重悬菌体,并加入蛋白酶抑制剂PMSF 和EDTA(带His标签不加),PMSF终浓度为100μg/ml, EDTA的终浓度为。
取20μl重悬菌液进行电泳,检测蛋白表达的情况(是否表达,是可溶性表达还是包涵体表达)。
2.1.4 将菌液(经检测有表达)在-80度冰冻,室温融解,反复几次(反复冻融三次),由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。
2.2 超声波处理(对超声波及热敏感的蛋白慎用)2.2.1 将反复冻融的菌液(必要时可加入1mg/ml 溶菌酶,缓冲液pH>8.0,加入后需静置20min),进行超声破碎,超声条件:400W,工作5秒,间隔5秒,重复一定次数,(根据我们的仪器找出一个比较好的工作条件)。
直至菌体溶液变清澈为止,大约花费时间。
2.2.2 取少量经超声破碎后的菌液,10000rpm离心10分钟,分别对上清和沉淀进行检测,并用全菌作为阳性对照,检测菌体破碎程度及目标条带占总蛋白的含量。
注意事项:(1)超声破碎具体条件可根据实验情况而定,要掌握好功率和每次超声时间,降低蛋白被降解的可能。
(2)功率大时,每次超声时间可缩短,不能让温度升高,应保持在4度左右,超声时保持冰浴。
(3)菌体破碎后总蛋白浓度的测定可用Bradford 法或者紫外吸收法。
蛋白质的表达纯化

400ul
750ul
1800ul
50ul
10ul
灌完浓缩胶,插入梳子。等到浓缩胶自然凝聚后,将装置放入电泳槽内,加入电泳缓冲液,小心地拔出梳子,如果拔出梳子后加样孔之间的间隔发生扭曲,可以用注射器针头小心地加以整理。
01
加样:取大肠杆菌和BSA蛋白样品加样,每个加样孔加样不宜过多,一般每孔加样10L。
1.装配制胶用的玻璃板(由助教演示)。 2.制分离胶:按所需的浓度配制12.5%分离胶。 灌完分离胶后在胶面上小心加水封(注意不要冲坏胶面),等胶自然凝聚后(这时候在胶面与水封之间可以看见清晰的界限)
5ml
3ml
4ml
120ul
20ul
30%Arc-Bis
Tris-HCl pH 6.7
H2O
10%AP
6
稀释5×SDS/电泳缓冲液至1×浓度灌入电泳槽,需800毫升。
7
注意事项
将红色玻璃夹子底座朝下、卡口打开呈直角状,放入厚薄两片玻璃,薄玻璃朝向自己。注意厚玻璃箭头向上,旁边两条小玻璃条与薄玻璃接触,使之形成一个间隙。 在平整的桌面上放下玻璃与夹子,使玻璃和夹子的底面完全对齐,向外扳动塑料卡口,关紧夹子。
氯霉素酰基转移酶重组蛋白的分离,纯化
重组蛋白的变性裂解:在冰浴中冻融50ml菌体沉淀,加入5mL上样缓冲液GLB, 用吸管抽吸重悬, 4 ℃ 12000rpm 离心 30 min, 将上清(总蛋白细胞裂解液)吸至一个干净的容器中,并弃沉淀。
NTA层析柱的准备:在层析柱中加入1mL NTA介质,并分别用8mL 去离子水,8mL上样缓冲液GLB洗涤。(调速0.5ml/3分钟 ) 。
氨苄青霉素:100mg/mL
Washing Buffer(UWB): 100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3
(完整版)1-大肠杆菌重组蛋白表达提取及纯化实验

第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200µlAMP(1:1000)、60µl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200µlAMP,摇床培养1小时左右。
2、诱导(超净台)加40µlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300µl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20µl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20µl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
大肠杆菌蛋白表达系统

大肠杆菌蛋白表达系统
大肠杆菌蛋白表达系统是一种常用的生物技术手段,用于在大肠杆菌细胞中表达外源蛋白质。
该系统主要包括以下步骤:
1. 克隆外源基因:将要表达的外源基因克隆至适合大肠杆菌表达的载体中。
2. 转化大肠杆菌:将重组的载体导入大肠杆菌内,并使其稳定地继承到细胞内。
3. 诱导表达:通过添加易于诱导的物质如IPTG等刺激载体内的传导子启动表达过程。
4. 收获蛋白:通过破细胞壁等方法收获蛋白质。
该系统的优点是表达效率高、成本低、操作简便。
缺点是存在蛋白质降解、折叠不正常等问题,需要通过优化表达条件等方法提高表达质量。
大肠杆菌系统蛋白表达纯化流程

大肠杆菌系统蛋白表达纯化流程英文回答:Introduction:The expression and purification of proteins in Escherichia coli (E. coli) is a commonly used method in molecular biology research. E. coli is a well-studied and easily manipulated organism, making it an ideal host for protein expression. In this article, we will discuss the general workflow for the expression and purification of proteins in E. coli.Expression of the target protein:1. Gene cloning: The first step is to clone the gene encoding the target protein into an expression vector. This vector contains a promoter that drives the expression of the gene in E. coli.2. Transformation: The recombinant expression vector is then introduced into E. coli cells through a process called transformation. This results in the production of many E. coli cells carrying the target gene.3. Expression induction: The transformed E. coli cells are grown in a suitable culture medium until they reach a specific growth phase. At this point, expression of the target gene is induced by adding a chemical inducer or by changing the growth conditions.4. Protein expression: The induced E. coli cells produce the target protein, which can either be present in the soluble fraction or form insoluble aggregates called inclusion bodies.Protein purification:1. Cell lysis: The E. coli cells are harvested by centrifugation and then lysed to release the proteins. Various methods can be used for cell lysis, such as sonication, freeze-thaw cycles, or enzymatic digestion.2. Removal of cell debris: The cell lysate is then clarified by centrifugation to remove cell debris and insoluble material. The resulting supernatant contains the target protein along with other cellular components.3. Protein purification: Different purification techniques can be employed to isolate the target protein from the crude lysate. These techniques include affinity chromatography, ion exchange chromatography, size exclusion chromatography, and hydrophobic interaction chromatography. The choice of purification method depends on the properties of the target protein.4. Protein concentration: After purification, thetarget protein is often in a dilute solution. Concentration can be achieved by using techniques such as ultrafiltration or precipitation with ammonium sulfate.5. Protein characterization: The purified protein should be characterized to confirm its identity and purity. Techniques such as SDS-PAGE, western blotting, and massspectrometry can be used for protein analysis.Conclusion:The expression and purification of proteins in E. coli is a well-established and widely used technique in molecular biology research. The workflow involves gene cloning, protein expression, cell lysis, protein purification, concentration, and characterization. By following this general procedure, researchers can obtain purified proteins for further analysis and functional studies.中文回答:简介:大肠杆菌(E. coli)中的蛋白表达和纯化是分子生物学研究中常用的方法。
大肠杆菌蛋白表达体系的构建实验报告

⼤肠杆菌蛋⽩表达体系的构建实验报告⼤肠杆菌蛋⽩表达系统的构建与蛋⽩质的分离纯化●实验⽬的:1.学会氯化钙制备⼤肠杆菌DH10B感受态细胞及掌握质粒转化感受态细胞的操作⽅法2.转化BL21(DE3)并在合适条件下诱导表达蛋⽩,掌握蛋⽩质诱导表达的原理,学习蛋⽩质诱导表达的⽅法3. 学会使⽤镍柱分离纯化蛋⽩质,利⽤PEPC试剂盒测定PEPC的活⼒。
●实验原理:1. 钙转法:Ca2+能与加⼊的DNA分⼦结合,形成抗DNA酶(DNase)的羟基-磷酸钙复合物,并黏附在细菌细胞膜的外表⾯上。
当42℃热刺激短暂处理细菌细胞时,细胞膜的液晶结构发⽣剧烈扰动,并随之出现许多间隙,为DNA分⼦提供了进⼊细胞的通道。
2. 诱导BL21(DE3)表达蛋⽩质的原理:E. coli BL21(DE3)其DE3是整合在细菌基因组上的⼀种携带T7 RNA聚合酶基因和lacI 基因的λ噬菌体,lacI编码的阻遏蛋⽩与lac操纵基因结合,从⽽不能进⾏外源基因的转录和表达,此时宿主菌正常⽣长。
IPTG 为乳糖类似物,不能被细胞利⽤,可以特异结合阻遏蛋⽩,阻遏蛋⽩不能与操纵基因结合,则外源基因⼤量转录并⾼效表达。
3. 六聚组氨酸纯化蛋⽩的原理:亲和层析是⼀种通过⽣物分⼦之间的特异性的相互作⽤来分离物质的层析⽅法。
组氨酸是具有杂环的氨基酸,每个组氨基酸含有⼀个咪唑基团,这个化学结构带有很多额外电⼦,对于带正电的化学物质有静电引⼒,亲和层析是利⽤这个原理来进⾏吸附的,亲和配体(也就是填料)上的阳离⼦(⼀般是镍离⼦)带正电对组氨酸有亲和作⽤。
组氨酸标签是原核表达载体上6个组氨酸的区段,这个标签在PH8.0时不带电,且⽆免疫原性,对蛋⽩质的分泌,折叠,功能基本上⽆影响.能⾼度亲和镍离⼦,⽤于蛋⽩质的亲和纯化.4. ⽬标蛋⽩:磷酸烯醇丙酮酸羧化酶(Phosphoenolpyruvate carboxykinase,PEPC.酸羧化酶的催化下,草酰⼄酸转变为磷酸烯醇式丙酮酸和⼆氧化碳。
大肠杆菌表达系统与蛋白表达纯化

⼤肠杆菌表达系统与蛋⽩表达纯化8.⼤肠杆菌表达系统与蛋⽩表达纯化⼤肠杆菌表达系统遗传背景清楚,⽬的基因表达⽔平⾼,培养周期短,抗污染能⼒强等特点, 是分⼦⽣物学研究和⽣物技术产业化发展进程中的重要⼯具。
因此熟练掌握并运⽤⼤肠杆菌表达系统的基本原理和常规操作是对每⼀个研究⽣来说是⾮常必要的。
本章节介绍了实验室常⽤的⼤肠杆菌表达系统的构成特点,归纳了利⽤⼤肠杆菌表达系统纯化重组蛋⽩的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1⼤肠杆菌表达系统的选择与构建8.1.1表达载体的选择根据启动⼦的不同这些载体⼤致可以分为热诱导启动⼦,如λPL,cspA 等和另外⼀类就是⼴泛使⽤的IPTG诱导的启动⼦,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋⽩质的类型可分为单纯表达载体和融合表达载体。
融合表达是在⽬标蛋⽩的N端或C端添加特殊的序列,以提⾼蛋⽩的可溶性,促进蛋⽩的正确折叠,实现⽬的蛋⽩的快速亲和纯化,或者实现⽬标蛋⽩的表达定位。
常⽤的⽤于亲和纯化融合标签包括 Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP等。
其中His-Tag 和GST-Tag 是⽬前使⽤最多的。
His Tag ⼤多数是连续的六个His 融合于⽬标蛋⽩的N端或C端,通过His 与⾦属离⼦:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作⽤⽽实现亲和纯化,其中Ni2+是⽬前使⽤最⼴泛的。
His 标签具有较⼩的分⼦量,融合于⽬标蛋⽩的N端和C端不影响⽬标蛋⽩的活性,因此纯化过程多不需要去除。
⽬前常使⽤的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性⾕胱⽢肽S-转移酶是另⼀种实验室常⽤的融合标签。
它可以通过还原性⾕胱⽢肽琼脂糖亲和层析⽽快速纯化。
1-大肠杆菌重组蛋白表达提取及纯化实验(最新整理)

第一天1、配置LB培养基:酵母粉15g、胰蛋白胨30g、氯化钠30g,定容至3000ml。
调节PH至7.4(2M NaOH),高压蒸汽灭菌20分钟,37℃保存。
分装成15瓶(每瓶200ml)。
2、接种(超净台要提前杀菌通风)取4瓶上述培养基,每瓶加200µlAMP(1:1000)、60µl菌液。
37℃过夜。
第二天1、扩大培养(超净台)4瓶扩至16瓶,每瓶培养基加200µlAMP,摇床培养1小时左右。
2、诱导(超净台)加40µlIPTG,加完后去除封口的除牛皮纸,扎口较松。
25℃摇床培养4小时。
3、离心获取菌体4℃,8000rpm离心25分钟。
注意配平。
4、超声波破碎菌体离心后去上清,向沉淀加入(600mlPB裂解液、300µl溶菌酶、3mlPMSF)。
将菌液转入2个烧杯中,冰浴超声波破菌,400W,75次,每次6秒,间隔2秒。
离心收集上清液。
600mlPB裂解液:20mM/L PB,10mM/L EDTA,5%甘油,1mM/L DTT,调节PH至7.4。
超声波破碎:首先用去离子水清洗探头,再将盛有菌液的小烧杯置于有冰水混合物的大烧杯中,冰水界面略高于菌液面即可。
探头浸没于菌液中,不可伸入过长。
注意破菌过程中由于冰的融化导致的液面变化。
5、抽滤(双层滤纸)洗胶(GST)。
将上述上清液抽滤,滤液与GST胶混合,磁力搅拌过夜。
第三天1、抽滤蛋白-胶混合液,滤液取样20µl,留电泳。
2、洗杂蛋白,用1×PBS+PMSF(1000:1)约400ml,洗脱若干次,用移液枪吸去上层泡沫(杂蛋白),至胶上无泡沫为止。
3、洗脱目的蛋白,洗脱液加50ml,分3次进行(15+15+15),每次加入后间歇搅拌,自然静置洗脱15分钟,抽滤,勿使胶干,合并洗脱液,取样20µl,留电泳。
用洗脱液调零,测OD280。
(OD值达到1.5为佳)4、将洗脱液置于透析袋中(透析袋应提前煮好),将透析袋置于2L透析液1中,加入磁珠置于4℃冰箱内磁力搅拌器上,4小时后换为透析液2。
蛋白质表达与纯化技术研究

蛋白质表达与纯化技术研究近年来,随着基因工程和蛋白质领域的快速发展,蛋白质表达与纯化技术成为了研究人员经常使用的技术手段。
可以说,蛋白质表达和纯化是蛋白质学领域中最关键的环节之一。
在本文中,我将就蛋白质表达与纯化技术的研究进展进行阐述。
一、蛋白质表达技术蛋白质表达技术是指利用重组DNA技术将DNA重组体转移到表达宿主细胞中,进而通过该宿主细胞"工厂"产生目标重组蛋白的过程。
一般来说,蛋白质表达技术可以分为两种:原核表达和真核表达。
1. 原核表达原核表达是利用大肠杆菌(E. coli)等非真核生物,来表达人工制造出的外源蛋白。
大肠杆菌是一种常见的原核生物,因其便于培养和操作,被广泛应用于生物学、医学和工业等领域。
但此类细胞通常只能产生简单的蛋白质,复杂蛋白质则难以表达成功。
比如,人体内的重组蛋白质包含多个高级别的结构和翻译后修饰,这些都很难在外源宿主里表达出来。
2. 真核表达与原核表达不同,真核表达利用真核生物或真核细胞表达重组蛋白质。
常用的真核生物宿主主要有哺乳动物细胞、昆虫细胞和真菌细胞等。
与原核表达相比,真核表达的宿主细胞是高度复杂的,蛋白质表达的过程也需要考虑多个酶和底物的协同作用。
在实际应用中,对于两种表达方式,需要考虑多个因素,如表达载体、菌株和宿主细胞等。
此外,还需要合理的表达调节和蛋白结构优化等方面的计划。
二、蛋白质纯化技术蛋白质纯化是从复杂混合物中提取纯化目标蛋白的过程。
其主要作用是从经过表达的生物物质中分离出目的蛋白质,以便进行更深入的研究和应用。
一般来说,蛋白质纯化可以分为几个步骤:固定、溶解、层析、凝胶过滤和电泳等。
1. 溶解溶解是将生物物质中的蛋白质迅速分解为水溶液的过程。
这个过程最终会产生蛋白质,但这些蛋白质会成为含有多种其他杂质的复杂混合物。
2. 声明声明是通过加入化学物质或温度应力等方法将蛋白质释放出来,并使其与溶液中的其他组分分开。
声明的方法包括力学声明(如超声波或高压),化学声明和生物声明等。
大肠杆菌表达系统

大肠杆菌表达系统本文主要介绍了大肠杆菌蛋白表达原理、具体操作步骤、大肠杆菌表达系统及其与其他系统的比较等。
诱导原理:Lac阻遏物是一种具有4个相同亚基的四级结构蛋白,都有一个与诱导剂结合的位点。
在没有乳糖存在时,lac操纵子(元)处于阻遏状态,Lac阻遏物能与操纵基因O结合,阻碍RNA聚合酶与P序列结合,抑制转录起动。
而当有诱导剂与阻遏蛋白结合后,其蛋白构象就发生变化,导致阻遏物从操纵基因O上解离下来,RNA聚合酶不再受阻碍,发生转录。
大肠杆菌表达系统步骤不包括基因构建等上游操作和蛋白纯化部分。
基因构建参考密码子优化,蛋白纯化参考蛋白纯化专题。
以下内容主要包括蛋白表达鉴定:1.表达鉴定第一天的任务,常用抗性选择根据感受态细胞选择•拿到质粒,离心(3000r/min;2min)•在质粒中加入TE(使质粒最终加入到110μL感受态细胞中的量为80-100ng,据此确定加入TE的量),一般为(1μg质粒加20μLTE;2μg质粒加50μLTE;5μg质粒加100μL TE)•将质粒与TE混匀,加入2μL混液于感受态细胞中•将感受态细胞放入冰箱(4℃)中,30min•取出后立即放入水浴锅中(42℃),热激90s,•再次放入冰箱(4℃)中,3min•拿出后取200μL的LB液体培养基加入到已转入质粒的感受态细胞中•放入摇床(37℃; 195r)中, 30nim至60min; (最佳45min)•取出离心(3000r/min;2min)•去掉200μL的上清,留100μL左右上清悬浮沉淀,吸取50μL 悬液涂平板,(先将对应抗性的平板放入培养箱(37℃)中预热20min)•把平板放入培养箱(37℃),过夜(12h至16h)2. 表达鉴定第二天的任务,注意Pcold的表达温度•每个平板挑取单菌落至4支对应抗性的L(4ml)试管中,编号为“0”“1”“2”“3”•将试管放入摇床(37℃;195r)中,(单抗3h左右;双抗4左右;刚开始用可见分光光度计测OD值;熟练后可目测(背光下,以试管中的枪头为例,刚刚看不见枪头即可)),测OD值(0.6至0.8)•从“0”号管中取700μL悬液加入到100μL(C=80%)的保种甘油中,震匀,放入冰箱(-20℃)冻存•在每组菌的“1”“2”“3”号试管中分别加入2μL的IPTG(终浓度0.5mM最适)•视不同的载体选择适合的表达环境(PET/PGEX:15℃表达过夜;25℃表达6h;37℃表达3h至4h(4支试管,“0”“1”号试管15℃表达过夜;“2”“3”试管37℃表达3h至4h)。
生物化学中的蛋白质表达和纯化

生物化学中的蛋白质表达和纯化蛋白质是细胞中最基本的生物大分子之一,具有重要的结构和功能作用。
在生化实验研究中,常常需要大量的蛋白质作为实验材料。
蛋白质表达和纯化技术是生物化学研究中的关键技术之一。
本文将简要介绍蛋白质表达和纯化的原理和方法。
一、蛋白质表达技术蛋白质表达是将目的基因转录成RNA后再翻译成蛋白质的过程。
蛋白质表达主要有原核细胞和真核细胞两种方法。
原核细胞表达系统主要利用大肠杆菌,真核细胞表达系统则使用哺乳动物细胞,其主要的表达技术有以下几种:(一)重组蛋白质大规模表达重组蛋白质是指人为构建的同源或异源蛋白序列,利用基因工程技术将其导入到表达宿主中进行高效表达的蛋白质。
大肠杆菌是目前最常用的宿主。
一般来说,要将目的基因插入到选择性表达载体中,选用合适的启动子和终止子,将目的蛋白质与标签结合。
表达宿主随后被转化,蛋白质在生长过程中表达出来,随后进行纯化和鉴定。
(二)GST融合蛋白表达GST融合蛋白是利用GST (glutathione S-transferase)标签的蛋白质,将GST和目的蛋白质融合在一起表达,然后通过Glutathione 亲和层析纯化方法纯化目的蛋白质。
GST融合蛋白可以提高目的蛋白质的稳定性和可溶性,使得其在细胞内表达更加稳定。
(三)His标签蛋白表达His标签是一种聚组氨酸标签,可以与Ni2+螯合,因此可采用Ni2+亲和层析的方法纯化。
His标签融合蛋白表达时选择了较少的氨基酸标签,对目标蛋白的生物学性质和功能影响较小。
二、蛋白质纯化技术蛋白质表达和纯化是蛋白质生物化学研究的关键。
通常情况下,表达宿主细胞中的蛋白质必须经过纯化才能得到纯净的蛋白质,获得足够高纯度的蛋白质可用于测定其结构和功能。
(一)离子交换层析法离子交换层析法是利用蛋白质负荷(或正荷)的离子性质与相应的离子交换质团之间进行选择性结合的纯化方法。
离子交换层析法分为阴离子交换层析和阳离子交换层析两种。
蛋白表达纯化

精品课件
6
步骤1. 目标基因全基因合成:
1.从基因库中搜索目标蛋白的cDNA序列。 2.根据选用的表达系统对cDNA进行密码子,mRNA二级结构等的优 化。 3.合成设计好的基因序列,将目标基因亚克隆到合适的复制质粒上。
提取mRNA,逆转录PCR得到cDNA
精品课件
7
步骤2. 目标基因亚克隆:
1.扩增并抽提含有目标基因的载体质粒。 2.将目标基因亚克隆到合适的表达质粒上。 3.测序验证构建质粒的准确性。
精品课件
10
蛋白质纯化常用层析方法
1、凝胶过滤。根据分子大小和形状进行分离的一种方法,分子量较大 的先出峰,分子量小的后出峰。 2、离子交换色谱。蛋白质、多肽均属于两性电解质,在缓冲液pH小于 其等电点时,带净正电荷,而在缓冲液pH大于其等电点时,带净负电 荷。阴离子交换凝胶本身带有正电荷基团,阳离子交换凝胶本身带负 电荷基团。由于静电相互作用而使样品结合到凝胶上,再采用盐浓度 梯度或者更换缓冲液的pH值进行洗脱。对于等电点小于5.0的酸性蛋白 质,推荐使用阴离子交换,对于等电点大于7.0的碱性蛋白质,推荐使 用阳离子交换。 3、疏水作用色谱。利用蛋白质、多肽在高盐存在下,可以结合疏水凝 胶,而在盐浓度降低时又可以解脱的原理实现分离。 4、亲和色谱。利用蛋白质、多肽与配基的特异性相互作用而进行分离。 5、反相色谱。常用于蛋白质、多肽的HPLC分析,以及多肽的精细制 备分离,分辨率极高。
真核表达系统
可进行分泌表达,有天然立体结构及翻译后修饰 表达量较低,培养成本较高,操作较复杂
表达系统选择:目的蛋白性质,研究目的
精品课件
3
大肠杆菌表达形式
可溶性表达:目的蛋白含有二硫键且需要正确的立体结构 包涵体表达:无活性要求,温度和诱导剂浓度影响 融合表达:小分子蛋白
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点, 是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
8.1大肠杆菌表达系统的选择与构建8.1.1表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括 Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP等。
其中His-Tag 和GST-Tag 是目前使用最多的。
His Tag 大多数是连续的六个His 融合于目标蛋白的N端或C端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His 标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen 提供的pET 系列和Qiagen 公司提供的pQE 系列。
除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。
此外,与His 相比,GST 很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his 标签表达易形成包涵体的蛋白,可以尝试用GST融合表达来改进。
当然,GST 具有较大的分子量(26kDa),可能对目的蛋白的活性有影响,因此很多时候切除GST是必须的。
目前,GST融合表达系统主要是由GE Healthcare (原Amersham)提供。
8.1.2宿主菌的选择重组质粒的构建一般选择遗传稳定,转化效率高,质粒产量高的菌株作为受体菌,常用的有E.coli DH5α,E.coli JM 109,E.coli DH 10B ,E.coli NovaBlμe等rec A–和end A–型细胞。
作为表达宿主菌必须具备几个基本特点:遗传稳定,生长速度快,表达蛋白稳定。
具体操作过程中,根据所使用的表达载体的特点,目的基因密码子的组成等选择特定的表达宿主菌。
以下是实验室常用的几种表达宿主:BL2: lon和ompT 蛋白酶缺陷型,避免了宿主对外源蛋白的降解。
是经典的使用最广泛的表达受体。
适用于Tac,Trc,Lac,λPL,cspA等作为启动子的载体。
BL21(DE3): DE3噬菌体溶源于BL21 形成的带有染色体T7 RNA 聚合酶基因大肠杆菌。
IPTG 诱导的lac ΜV5 启动子控制T7 RNA 聚合酶基因表达T7 RNA 聚合酶,进而控制T7 表达系统表达目的蛋白。
BL21(DE3)衍生系列:在经典的T7表达系统BL21(DE3)的基础上,Novagen 公司开发了一些特殊的表达宿主细胞。
比如:Origami (DE3),Origami B(DE3)和Rosetta-gami (DE3)菌株带有 trxB和gor双突变。
拥有trxB和gor突变的菌株比单具,trxB突变的菌株更有可能促进二硫键的形成,使蛋白可溶性更好,活性更高。
Rosetta™系列:是经过修饰,专用于带有大肠杆菌稀有密码子的真核蛋白表达的菌株。
经提高稀有tRNA 水平,可以提高一些真核基因表达效率(更多信息可参考相应公司的资料)。
BL21-Codon Plus系列:包括BL21-CodonPlus®(DE3)-RIPL,BL21-CodonPlμs®-RIL,BL21-CodonPlμs®(DE3)-RIL, BL21-CodonPlμs®-RP,BL21- CodonPlus®(DE3)-RP等。
这些受体菌添加了大肠杆菌中编码精氨酸(R),亮氨酸(L),异亮氨酸(I)和脯氨酸(P)稀有密码子的tRNA基因,更多用于表达一些真核生物的基因。
其中RIL系列常用于AT 含量高的基因,而RP系列主要用于GC含量高的基因(更多信息参考Stratagene 公司资料)。
M15/SG13009:自身表达T5 RNA polymerase,主要用于pQE系列载体的表达。
另一个需要考虑的是大肠杆菌的密码子及其偏爱性。
表1 大肠杆菌密码子使用频率统计8.2表达条件的建立为了方便后续的纯化操作, 保持目标蛋白的活性,提高蛋白的得率,我们在进行蛋白的大量制备之前应该首先确定目标蛋白的最佳表达条件。
首先,保证表达蛋白稳定,尽量避免蛋白酶的降解,我们可以通过使用一些蛋白酶缺陷性的表达宿主,其次在表达的过程中可以在培养体系中添加一些蛋白酶抑制剂等来解决。
与实现外源蛋白的稳定表达相比,更多时候保证目标蛋白的可溶性表达,是建立表达条件的主要工作。
很多外源基因在大肠杆菌表达时很容易形成不可容的包涵体,其原因可能有:表达量过高,研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体;蛋白合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确配对;过多蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。
目前对包涵体的形成和复性过程中发生聚集的机制尚不清楚, 但已经报道了很多用于优化表达以增加目标蛋白可溶性的方法。
8.2.1确定表达状况转化构建好的质粒至表达宿主感受细胞,挑取单克隆子至5ml 含有相应抗性的LB 培养基中,37℃,200 rpm,培养至OD600=0.5左右,加入IPTG至终浓度0.2mM,转移至28℃,200 rpm 继续诱导培养,可以在2h,4h,6h 分别取样以分析表达状况。
将取出的1ml 菌液12000 rpm 离心1min,收集菌体,加入1ml PBS 缓冲液重悬沉淀,同样离心1min。
再加入300~500ml PBS重悬细胞。
超声破碎细胞(具体见操作细胞破碎)将破碎液体4℃,12000 rpm 离心10min,分离上清和沉淀。
SDS-PAGE 分析上清和沉淀的蛋白分布(具体操作参考SDS-PAGE)。
若在上清中有明显的目的蛋白的条带,即可以放大培养进而纯化目标蛋白。
若目标蛋白的表达主要分布于沉淀,则可以尝试一下几种方法来改善表达。
改变表达载体下手,像GST,NΜS,MBP, TrxA等融合标签能够提高很多蛋白在大肠杆菌中表达的可溶性,此外一些分泌标签如ompA,Pet-22b上的pelB也能够将目标蛋白运输至细胞的周质空间,从而提高目标蛋白的可溶性。
降低表达速度,可采取低温诱导,如15℃诱导过夜,或者采用弱启动子表达载体。
尝试一些特殊设计的表达宿主Origami:thioredoxin redμctase/glμtathione redμctase 双突变适合带thioredoxin redμctase的融合表达载体,帮助形成更多的二硫键。
对于一些蛋白可能无法实现可溶性表达,这时候溶解包涵体后再纯化是唯一的解决办法。
8.2.2聚丙烯酰胺凝胶电泳(SDS-PAGE)大肠杆菌表达纯化外源蛋白,SDS-PAGE是必不可少的操作。
可以用来检测蛋白的表达情况(表达量,表达分布等),用来分析纯化的目的蛋白的纯度。
本小节列出SDS-PAGE 操作中一些试剂的配置及其基本的操作过程。
8.2.2.1主要试剂的配置(1)30%丙烯酰胺贮存液:29g丙烯酰胺和1g N,N’-亚甲双丙烯酰胺溶于100ml热水中,验证其pH值不大于7.0。
置棕色瓶中,4℃保存。
丙烯酰胺具有很强的神经毒性并可以通过皮肤吸收,其作用具累积性。
称量丙烯酰胺和亚甲双丙烯酰胺时应戴手套和面具。
可认为聚丙烯酰胺无毒,但也应谨慎操作,因为它还可能会含有少量未聚合材料。
建议实验室划出专门的台面,设置单独的配置器皿进行SDS-PAGE 的相关实验。
(2)1.5mol/L Tris(pH8.8)溶液。
(3)10% SDS溶液:SDS 10.0g 加入ddH2O ToTo100。
(4)10%过硫酸铵:新鲜配制。
(5)TEMED溶液:4℃保存。
(6)1.0 mol/L Tris(pH6.8)溶液。
(7)2×样品溶解液:2%SDS,5%巯基乙醇,10%甘油,0.02%溴酚蓝,0.01mol/L Tris-HCl(pH8.0)缓冲液。
(8)5×Tris-甘氨酸电极缓冲液: 15.1g Tris,94g甘氨酸和5g SDS定容到1000ml(建议每次电泳用新稀释的缓冲液)。
(9)考马斯亮蓝R染色液:每100ml甲醇、水、冰乙酸混合物(9:9:2)中,溶解0.25g考马斯亮蓝R,搅拌溶解。
(10)脱色液:10%冰醋酸(可加如乙醇,建议不要使用甲醇)。
8.2.2.2主要操作步骤1、凝胶制备(1)安装洗涤干净的玻璃板、板条,并将玻璃板固定在电泳槽中。
(2)配制10%的分离胶(具体参考表2):迅速在两玻璃板间隙中灌注分离胶,直至剩余的板宽比梳子长度多1cm。
小心在胶上覆盖一薄层异丙醇或水。
(3)在分离胶聚合的过程(可置于37℃,约10min)中,配制5%的积层胶(参考表格3)。
(4)分离胶聚合完全后,倒去异丙醇或水,用滤纸吸干胶面上的残余。
(5)灌注积层胶,立即插入干净的梳子,避免产生气泡。
(6)积层胶聚合完全后,小心拔出梳子,拨去封胶用的塑料条,固定于电泳槽。
(7)在上下电泳槽中加入足够的电泳缓冲液。
2、样品的制备在蛋白溶液中加入等体积的2×样品溶解液,混合液在沸水浴中加热5min,冷却后即可上样。
3、上样用微量移液器上样,每加入一种样品,上样量根据根据具体的样品浓度确定,未知浓度一般用10微升。
4、电泳对于一块胶,在浓缩胶中电流设置在15~20mA, 当染料进入分离胶后可设置电压至电流约为25~30mA,继续电泳直至染料到达离凝胶底部1cm处。
5、后处理(1)染色:加入染色液(用量同上),室温染色30min~1h。
Tip:染色前可将染色液在微波炉里加热至沸,然后摇床震荡染色约10min即可。
(2)脱色:将染色后的胶块用水洗涤三次去除表面染料,然后加入脱色液脱色,其间更换脱色液3~4次至条带清晰。
