上海交通大学无机与分析化学期终试卷B节选
上海交通大学2005-2006学年《无机与分析化学》补考试题(节选)

9.( )已知下列反应在标准状态下,皆正向自发进行:
2Fe2+ + Cl2 =2Fe3+ + 2Cl-
2Fe3+ + 2I- = 2Fe2+ + I2
则有关ϕΘ 的大小顺序正确的是:
A、ϕΘI2/I->ϕΘFe3+/Fe2+> ϕΘCl2/Cl-
B、ϕΘFe3+/Fe2+>ϕΘI2/I-> ϕΘCl2/Cl-
反应
Δ r Hmθ/ kJ·mol-1
Δ r Smθ/ J·mol-1·K-1
① CaCO3 (s)
CaO(s) + CO2 (g)
177.85
164.04
② N2 (g) + 3H2 (g)
2NH3 (g)
-92.38
-201.38
2. 已知[Ni(CN)4]2-是反磁性的,而[Ni(H2O)4]2+是顺磁性的;[Fe(CN)6]3-仅有一个单电子, 而[Fe(H2O)6]3+有五个单电子。试画出示意图和运用相关理论来进行解释。
(A)指示剂为有色物质。
(B)指示剂为弱酸或弱碱。
(C)指示剂为弱酸或弱碱,且其酸式或碱式结构具有不同颜色。
(D)指示剂在酸、碱溶液中可呈现不同的颜色。
6.( )在含有大量固体 CaSO4 的溶液中,能使 Ca2+进入溶液的最有效方法是:
(A)加入过量的 H2SO4;
(B)加入过量的 HNO3;
(C)加入 BaCl2 溶液;
11.(
)在下列配离子中,其中分裂能最大的是:
(A)Fe(SCN)63-;(B)Fe(CN)63-;(C)Fe(CN)64-;(D)FeCl4-
二、是非题
( )1. 催化剂能显著的提高反应速率,而且还能改变反应的焓变。
上海交通大学无机化学复习题

一、选择题1.恒容下,一定量得理想气体,当温度升高时内能将(B)。
A. 降低B. 增加C. 不变D.不能确定2. 对于一定量得理想气体,下列过程:(1)对外做功,同时放热(2)体积不变,而温度升高,并且是绝热过程,无体积功(3)恒压下绝热膨胀(4)恒温下绝热膨胀可能发生的是(A)A. (1)(4)B. (2)(3)C. (3)(4)D. (1)(2)3. 对于一化学反应而言,下列说法正确的是(D)。
A.Δr H mθ越负,其反应速率越快B.Δr G mθ越负,其反应速率越快C.活化能越大,其反应速率越大D.活化能越小,其反应速率越大4.在300K时新鲜牛奶大约4小时变酸,但在277K的冰中可以保持48小时,则对牛奶的变酸反应,其活化能Ea(kJ•mol-1)是多少?T1=277K, T2=300K,由题意V∝k,V∝1/t, 故 k∝1/t,所以k2∝1/t2,k1∝1/t1; lgk2/k1=Ea/2.303R(T2-T1/T2T1)Lg48/4= Ea/2.303*8.314(300-277/300*277)Ea=74.66 kJ•mol-15. 某反应的速率常数k=4.62×10-2min-1, 则初始浓度为0.1 mol•dm-3,反应的半衰期t1/2为(B)A. 21 minB. 15 minC. 30 minD. 无法计算6. 今有两个反应A和B,当温度从T1升高到T2时,反应A的速率升高了1倍,反应B的速率升高了3倍,若反应A的活化能为E1,反应B的活化能为E2,则E1/E2=()7.某个非一级反应在300K时完成20%需要12.6分钟,而在340K时完成20%需要3.20分钟,求此反应的活化能。
8.已知下列反应的平衡常数:SO2(g) + 1/2O2(g) === SO3(g) K1θNO(g) + 1/2O2(g) === NO2(g) K2θ则反应NO2(g) + SO2(g) === NO(g) + SO3(g) 的平衡常数为( B )9.某反应在298K及100kPa正反应能自发进行,高温时逆反应能自发进行,说明该反应( C )。
(NEW)上海交通大学化学化工学院808无机与分析化学历年考研真题汇编(含部分答案)

2009年华中科技大学873无机及分析化学考研真题
2012年四川大学613无机及分析化学(含仪器分 析)考研真题
2011年四川大学613无机及分析化学考研真题
2010年四川大学613无机及分析化学考研真题
2005年复旦大学无机化学和分析化学考研真题
2004年复旦大学无机化学与分析化学考研真题及详解 2003年复旦大学无机化学和分析化学考研真题及详解
第一部分 上海交通大学808无机与分析化 学考研真题
2004年上海交通大学433无机与分析化学考研 真题
2003年上海433无机与分析化学考研真题
目 录
第一部分 上海交通大学808无机与分析化学考研真题 2004年上海交通大学433无机与分析化学考研真题 2003年上海交通大学433无机与分析化学考研真题 2002年上海交通大学433无机与分析化学考研真题 2001年上海交通大学433无机与分析化学考研真题
第二部分 兄弟院校无机及分析化学考研真题(含部分答案) 2007年武汉大学640无机及分析化学考研真题 2006年武汉大学495无机及分析化学考研真题 2005年武汉大学814无机及分析化学考研真题 2010年华中科技大学873无机及分析化学考研真题 2009年华中科技大学873无机及分析化学考研真题 2012年四川大学613无机及分析化学(含仪器分析)考研真题 2011年四川大学613无机及分析化学考研真题 2010年四川大学613无机及分析化学考研真题 2005年复旦大学无机化学和分析化学考研真题
2004年复旦大学无机化学与分析化学考研真题及 详解
2003年复旦大学无机化学和分析化学考研真题及 详解
2001年上海交通大学433无机与分析化学考研真题
第二部分 兄弟院校无机及分析化学考研 真题(含部分答案)
大学《无机及分析化学》试题及答案

大学《无机及分析化学》试题及答案大学《无机及分析化学》试题及答案一、判断题 (每小题1分共10分 )1.σ键和π键在分子中均可单独存在。
()2.系统误差是不可测的。
()3.极性分子间仅存在取向力,非极性分子间只存在色散力。
()4.等价轨道处于全充满、全空、半充满状态时原子能量较低。
()5.施肥过多造成的“烧苗”现象,是由于植物细胞液的渗透压小于土壤溶液的渗透压引起的。
()6.醋酸溶液经稀释后其解离度增大,因而可使其H+ 浓度增大。
()7.BF3和NH3都具有平面三角形的空间结构。
()8.CO2与CH4的偶极矩均为零。
()9.共价键和氢键均有饱和性与方向性。
()10.在消除了系统误差之后,测定结果的精密度越高,准确度也越高。
()三、填空题 ( 共 25分 )1.命名[Cr(NH3)4Cl2]NO3为______________ ,中心离子为 ___________,配位原子为 ___________ ,配位数为___________,配体包括 ___________ 。
2.在含有AgCl(s)的饱和溶液中加入0.1 mol·L-1 的AgNO3 ,AgCl的溶解度将______________,这是由于______________________的结果。
3.NH3分子中N的杂化方式为 ___________杂化,空间构型为___________。
BCl3分子中B的杂化方式为 ______杂化,空间构型为___________。
4.原电池中,发生还原反应的电极为______极,发生氧化反应的电极为____极。
5.常用于标定HCl溶液的基准物质有 ___________ 、___________常用于标定NaOH溶液的基准物质有___________ 、 ___________ 。
6.24号元素的核外电子排布为________ 它位于元素周期表第________周期________族________区。
《无机及分析化学》期末考试试卷附答案

《无机及分析化学》期末考试试卷附答案一、单项选择题(每空2分.共40分)1、已知 A+B = M+N, Δr H m=35kJ∙mol-1; 2M + 2N = 2D, Δr H m=-80kJ∙mol-1.则A+B = D的Δr H m= kJ∙mol-1。
2、已知分析天平能称准至±0.1mg, 要使试样的称量误差不大于1‰,则至少要称 g。
3、按有效数字规则计算 2.187×0.852 +9.82/3.425= 。
4、溶液中某物质X的浓度为2×10-5mol∙L-1, 用1 cm比色皿在465nm处测得吸光度为0.400, 则此配合物在465nm 处的摩尔吸光系数为 L·mol-1·cm-1。
5、计算0.10 mol∙L-1Na2HPO4溶液的pH值,选择最简计算公式为[H+]= (H3PO4的逐级解离常数为K a1、K a2、K a3)。
6、Ac–的分布系数与HAc的总浓度无关,取决于HAc的和溶液的。
7、加入沉淀剂后,被沉淀的离子在溶液中残留量不超过 mol∙L-1叫沉淀完全。
= 0.09961 g·mL-1, 则8、已知: Cr2O72- + 6I- + 14H+ = 2Cr3+ + 3I2 + 7H2O , M KI=166.01, T KI/K2Cr2O7C K= moL·L-1。
2Cr2O79、将反应2Ag+ 2I- + 2H+ = 2AgI↓ + H2组成原电池,则原电池符号为。
10、已知Pb2+的浓度为10-2mol·L-1,在pH=4.0时,lg Y(H)=8.44,10、lg K PbY=18.04,则Pb2+ (填“能”或“不能”) 被EDTA标准溶液准确滴定。
11、配合物:[Cu(NH3)4][PtCl4]的名称是(用系统命名法命名)。
12、用EDTA滴定Zn2+时,Al3+有干扰,可在合适的pH值下,加入NH4F使Al3+ [AlF6]3-配离子,属于掩蔽法。
上海交通大学20032004学年《无机与分析化学》期终考试(中医药大学 节选)

上海交通大学《无机及分析化学》期终考试试卷(节选)(2003-2004学年第一学期)中医药大学班级学号姓名任课教师题号一二三四五成绩得分一、单项选择题 15%()1、某溶液的pH=0.04,则其中H+的浓度为:A、 0.912mol/LB、0.91mol/LC、0.9mol/LD、1.1 mol/L()2、将BaSO4分别放置于纯水、1.0mol/L NaCl、1.0mol/L BaCl2三种溶液中,溶解度分别为s1、s2、s3;则三者的关系为:A、s1 > s2 >s3B、s3 > s1 > s2C、s2 > s1 >s3D、s2 > s3 > s1()3、下列电极反应中,若其他条件不变,将有关的离子浓度减少一倍,则电极电势增加的是:A、Fe3++e- Fe2+B、 Ag++e-AgC、2H++2e-H2(g)D、 Cl2(g)+2e-2Cl-()4、用EDTA标准溶液滴定金属离子M,若要求测定相对误差小于0.1%,则准确滴定的条件是:A、 lg[c(M)·K(MY)]≥6B、 lg[c(M)·K'(MY)]≥6C、c(M)·K(MY)≥6D、c(M)·K'(MY)≥6()5、 MnO4—与H2O2反应很慢,但一旦反应开始后,反应会逐渐加快,这是因为:A、诱导效应B、加和效应C、自动催化效应D、催化作用()6、在AgCl白色沉淀中加入KI溶液,沉淀的颜色发生了变化,其原因是:A、发生分步沉淀B、发生沉淀的转化C、沉淀溶解D、生成配合物()7、已知HCN的Ka为4.93×10-10,则其共轭碱的碱常数K b为(A) 4.93×10-10, (B) 2.03×10-5, (C) 2.03×10-10, (D) 9.86×10-10()8、下列磷酸盐溶液中pH最小的是(A) 0.10 mol/dm3 Na3PO4, (B) 0.10 mol/dm3 Na2HPO4(C) 0.10 mol/dm3 NaH2PO4, (D) 0.20 mol/dm3 NaH2PO4()9、0.10 mol/dm3弱酸溶液的pH是(a) 小于1, (b) 大于1, (c) 等于1, (d) 不能确定()10、根据ϕ (Fe3+/Fe2+)=0.77 V,ϕ (Sn2+/Sn)=-0.14 V,ϕ (Cu2+/Cu)=0.34V,判断下列不能共存的物质是:A Cu2+和Fe2+B Cu2+ 和Fe3+C Cu2+和SnD Cu和Fe2+二、填空题 20%1、命名或写出配合物的化学式[Al(H 2O)(NH 3)(OH)2]Cl ; K 3[Co(CN)6] ;六氰合铁(II )酸铁 ;一氯·一硝基·一氨合铂(II ) 。
上海交通大学《无机与分析化学》期终试卷(A)

4. 完成下表:5 分
滴定方法 测定对象
沉淀滴定法 Cl-
配位滴定法 自来水总硬度
高锰酸钾法 草酸
酸碱滴定法 混合碱
标准溶液
指示剂
K2CrO4
溶液介质
碱性
中性
5.液氨、乙二胺等碱性溶剂对于
6.氧化物的氧化性和溶液的酸度有很大关系,如图所示。
要使 PbO2+ 2Cl- + 4H+ = Pb2+ + Cl2 + H2O 反
的摩尔含量不变。用过量的 AgNO3 处理该化合物的溶液,每摩尔 Co 可得 2molAgCl 沉淀,
这种化合物应该是: A)[Co(NH3)4]Cl3;B) [Co(NH3)4Cl3];C)[Co(NH3)4Cl2]Cl;D)[Co(NH3)4Cl(H2O)]Cl2
第1页共3页
上海交通大学《无机与分析化学》期终试卷(A)
上海交通大学《无机与分析化学》期终试卷(A)
上海交通大学《无机与分析化学》期终试卷(A)
(2006~2007 学年第一学期)………环境专业
班级 题号 得分
学号
一
二
姓名
三
四Hale Waihona Puke 得分 五一、选择题:
1. (
)在 H3PO4 溶液中加入一定量的强碱后,溶液的 pH=14.00,下列物种中浓度
最大的是:
A)H3PO4;B) H2PO4-;C) HPO42-;D)PO43-;
第2页共3页
上海交通大学《无机与分析化学》期终试卷(A)
2.市售的用作干燥剂的蓝色硅胶,常加入带有蓝色的 Co2+离子同 Cl-键合的配合物,用久后 变为粉红色则无效。 (1)试用晶体场理论解释颜色变化的原因并画出相关的能级图。(提示:固体无水 CoCl2 可视为四面体场的配合物,水合以后为八面体场的配合物) (2)失效后的粉红色硅胶能否再生?如何再生?
2006-07化学卷子

7、(
)若[ML4]2+的 Kf=a,[MY4]2-的 Kf=b,则反应
[ML4]2+ + 4Y- = [MY4]2- + 4L 的平衡常数 K 为:
A、ab
B、a/b
C、a+b
D、b/a
8、(
)H3PO4 的 pKa1、pKa2、pKa3 分别是 2.12、7.12、12.32,在下列不同 pH 值的溶
Kspθ(Mg(OH)2) = 5.61×10-12, 显然,AgCl 在水中溶解度更小。
4、(
)按照晶体场理论,强场配体和弱场配体与同一金属离子配位时,其晶体场稳
定化能总是强场的比弱场的大(指绝对值)。
5、(
)在氧化还原电对的半反应中,氧化态和还原态也是一种共轭关系。因此,氧
化态物质的氧化性强其对应的还原态物质的还原性必然也强。
9、完成下表:已知 Fe、Ni 和 Ag 的原子序数分别为 26、28 和 47。(每 2 空 1 分)
物质
中心离子 杂化类型
配离子 空间构型
内轨或外轨
磁矩(B.M.)
[Ni(CN)4]2-
平面正方型
0
[Fe(H2O)6]3+
sp3d2
[Ag(CN)2]-
外轨型
三、简答题(20%) 1、请用适当的滴定分析方法鉴定下列混合物中的各组分的含量,并简要说明理由、滴定方法、 滴定剂、指示剂及各组分含量计量关系式。(H3PO4 的 pKa1、pKa2、pKa3 分别是 2.12、7.12、 12.32)
第5页共6页
上海交通大学《无机与分析化学》期末考题(A)
在周期表中,钴和铁相邻,所以有常见氧化态+2 和+3;
下面是钴的系列实验,为了说明以下四个问题:①CoCl2·6H2O 的乙醇溶液与水溶液的 颜色及物种的结构;②Co(Ⅱ)难溶物的转化;③CO(Ⅱ)、Co(Ⅲ)的单盐与配合物的氧化还原稳
无机与分析化学(二)_上海交通大学中国大学mooc课后章节答案期末考试题库2023年

无机与分析化学(二)_上海交通大学中国大学mooc课后章节答案期末考试题库2023年1.在酸碱滴定中,选择强酸强碱作为滴定剂的理由是答案:使滴定突跃尽量大2.在HC1滴定NaOH时,一般选择甲基橙而不是酚酞作为指示剂,主要是由于答案:甲基橙终点时CO2影响小3.某温度下,La2(C2O4)3 饱和溶液的溶解度为1.1×10-6 mol/L ,则其溶度积(符号“^”后数字代表幂指数)为 ( )答案:1.7×10^-284.以Fe3+为指示剂,NH4SCN为标准溶液滴定Ag+时,应在()条件下进行。
答案:酸性5.由电极MnO4-/Mn2+和Fe3+/Fe2+组成的原电池。
若加大溶液的酸度,原电池的电动势将答案:增大6.两锌片分别插人不同浓度的ZnSO4水溶液(分别以I和II表示)中,测得电极电势EI=-0.70V,EⅡ=-0.76V,说明两溶液中锌离子浓度是答案:Ⅰ的Zn2+浓度> Ⅱ的Zn2+浓度7.对相同的中心离子,其外轨型配合物与内轨型配合物相比,稳定程度大小为答案:无法比较8.用 AgNO3处理[FeCI(H2O)5]Br溶液,将产生沉淀,主要是AgBr9.某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+ ,今在pH为10时,加人三乙醇胺后以EDTA滴定,用铬黑T为指示剂,则测出的是答案:Ca2+、Mg2+总量10.在酸性介质中,用KMnO4溶液滴定草酸钠时,滴定速度答案:开始慢中间逐渐加快最后慢11.间接碘量法一般是在中性或弱酸性溶液中进行,这是因为答案:Na2S2O3在酸性溶液中容易分解12.用K2Cr2O7法测定钢铁试样中铁含量时、加入H3PO4的主要目的是使Fe3+生成Fe(HPO4)+ ,降低铁电对电极电势13.在下列溶液中加入1mol的HCl(忽略加入前后体积变化),pH值变化最小的是答案:1mol/L氨水+1mol/L氯化铵等体积混合14.下列各组化合物和离子中为共轭酸碱对的是答案:H2O和OH-15.Na2HPO4水溶液的质子条件式为答案:[H+]+[H2PO4-]+2´[H3PO4]=[OH- ]+[PO43-]16.已知AgBr的pKsp=12.30,Ag(NH3)2+的lgK稳=7.40,则AgBr在1.00mol/LNH3溶液中的溶解度(单位:mol/L,符号“^”后数字代表幂指数)为答案:10^-2.517.测得[Co(NH3)6]2+配离子的磁矩为4.26B.M.,则该配离子的晶体场稳定化能绝对值为答案:8Dq18.[Co (en)2Cl2]+配离子的配位数为答案:619.利用EDTA的酸效应曲线(林邦曲线),可查出答案:各金属离子准确滴定的最小pH值20.BaSO4的分子量为 233g/mol,pKsp = 10 ,把 1.0 mmol 的 BaSO4配成10dm3 溶液,BaSO4没有溶解的量是答案:0.21 g21.配制好的HCl通常需贮存于( )中答案:白色磨口塞试剂瓶22.若将 AgNO2放入 1.0 dm3 pH = 3.00 的缓冲溶液中,AgNO2溶解的物质的量是( )。
上海交通大学无机与分析化学期终试卷B节选

4、命名或写出下列配合物的名称:
1) [Co(NH3)5H2O]Cl3 :_
__________________________;
2) 二(硫代硫酸根)合银(I)酸钠
5、25℃时,ϕθ(MnO4-/Mn2+)=1.51 V,ϕθ(SO42-/H2SO3)=0.20 V,若将上两电极组成原电
池,写出:
液中,溶解度分别为 s1、s2、s3;则三者的关系为:
A、 s1>s2>s3
B、s3> s1 > s2
C、 s2> s1 >s3
D、s2> s3 > s1
4、(
)某金属离子在八面体弱场中磁矩为 4.90 B.M.,而在八面体强场中磁矩为零,
该金属离子可能是:
A、Cr(III) B、 Mn(II) C、 Co(II)
2、(
)H3PO4 的 pKa1、pKa2、pKa3 分别是 2.12、7.12、12.32,在下列不同 pH 值的溶
液中,溶液中 HPO42-的平衡浓度最大的是:
A、 7.21
B、10
C、12.32
D、14
3、(
)将 BaSO4 分别放置于纯水、1.0mol·dm-3 NaCl、1.0mol·dm-3 BaCl2 三种溶
6
4.8
7
3.4
3、已知下列原电池: (-)Zn | Zn2+(1.0mol·dm-3)|| Ag+(1.0mol·dm-3)| Ag(+) (1)先向右半电池中通入过量 NH3 气,使游离 NH3 的浓度达到 1.0mol·dm-3,此时测得电 动势 E1=1.13V,求 Kƨf ,[Ag(NH3)2+](假定 NH3 的通入不改变溶液的体积)。 (2)然后在右半电池中继续加入过量的固体 Na2S,使 c(S2-)=1.0mol·dm-3,求原电池的电 动势 E2。(假定加入固体 Na2S 不改变溶液的体积);(已知ϕƨ,Zn2+/Zn=-0.763V,Ag+/Ag= 0.8V,Ksp(Ag2S)=1.0×10-49)
大学《无机化学与化学分析》期末试卷B卷 附答案

二、单选题:(每题2分,共30分)
(说明:将正确答案填写在下表中,不要写在题后)
分数
评卷人
1
2.用分子轨道法讨论C2-2、B2+2、N–2、O+2的稳定性和磁性
3.为什么CO2的熔沸点低于SiO2?
五、计算题:(每题分数见题后,共25分)
分数
评卷人
1.范特霍夫观察到,对于室温下大多数化学反应,温度每上升10K,反应速率增大2~4倍。试估算这些化学反应活化能。(5分)
2.CaF2在pH=1.0时溶解度为1.0×10-4mol·dm-3,已知Kөsp(CaF2)=4.0×10-14,求HF的解离常数。(8分)
(2)溶液为HAc-Ac-缓冲体系,此时[H+]=,因此[Ac-]===0.18
NaAc质量=0.18×1.0×82.0=15g
C.各物质浓度不再随时间改变D.k正=k逆
7.下列溶液浓度相同时,pH值最大的是:
A、NaNO3B.NaAcC.Na2SO4D.NH4Ac
8.关系式=Kөa1Kөa2的应用条件是:
A.只适用于饱和H2S溶液B.只适用于不饱和H2S溶液
C.只适用于酸性溶液D.上述3种情况都适用
9.在氨水中加入少量固体NH4Ac后,溶液的pH值将:
B2+ 2:(σ1s)2(σ* 1s)2(σ2s)2(σ*2s)2,键级=0,不能存在,反磁性
N– 2:(σ1s)2(σ* 1s)2(σ2s)2(σ*2s)2(π2py)2(π2pz)2(σ2px)2(π*2py)1,键级=2.5,稳定性弱于N2,顺磁性
无机及分析化学期末考试卷及答案-B

宁波大学科技学院2006/2007学年第二学期期末考试试卷课程名称:无机及分析化学A 课号:X01G10A 试卷编号:B 考试方式:闭卷 班级: 姓名: 学号: 成绩:一、判断题。
(每题1分,共10分)( )1.电负性综合地表征了原子得失电子的能力。
( )2.酸碱指示剂在酸性溶液中呈酸色,在碱性溶液中呈碱色。
( )3.速率常数大小总是与系统中所有物质的浓度无关。
( )4.当可逆反应达到平衡时,反应即停止,且反应物和生成物的浓度相等。
( )5.强碱滴定强酸的滴定突跃范围决定于溶液的浓度。
( )6.色散作用只存在于非极性分子之间。
( )7.非极性分子中有极性键。
( )8.液体的蒸气压与温度无关。
( )9.某一元酸越强,则其共轭碱越弱。
( )10.偏差的大小可表示分析结果的准确度。
二、单项选择题。
(每题2分,共20分)1. 下列数据中有效数字为3位的是:( )A .0.030%B .pH =2.03 C.0.0234 D.8.9×10-42. 根据有效数字运算规则,算式01120.010.3514.21031.0⨯⨯计算结果正确的是:( )A .2×103 B.2.1×103 C.2.05×103 D.2.054×103 3. 理想气体是指:( )A.气体分子本身体积和相互之间的作用力均可忽略B.气体分子本身体积不可忽略,相互之间的作用力可以忽略C.气体分子本身体积可忽略,相互之间存在着作用力D.气体分子本身体积和相互之间的作用力均不可以忽略4. 增大压强,能使化学平衡向正反应方向移动的反应是:()A.N2O4(g) 2NO2(g) B.Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g) C.CaCO3(s) CaO(s) + CO2(g) D.2NO(g) + O2(g) 2NO2 (g)5. 下列可逆反应2HI(g) H2(g) + I2 (g) - Q在密闭容器中进行,当达到平衡时,欲使混合气体的颜色加深,应采取的措施是:()A.减少容器体积B.降低温度C.加入催化剂D.充入HI气体6. [Co(SCN)4]2-离子中钴的价态和配位数分别是:()(A) -2,4 (B) +2,4 (C) +3,2 (D) +2,127. 下列各组元素中,有一组元素原子的第一电离能分别为1086 kJ/mol、1402 kJ/mol和1314 kJ/mol,该组元素为:()A.C N O B.F Ne Na C.Be B C D.S Cl Ar 8. 比较O,S,As三种元素的电负性和原子半径大小的顺序,正确的是:()A.电负性O>S>As 原子半径O<S<AsB.电负性O<S<As原子半径O<S<AsC.电负性O<S<As 原子半径O>S>AsD.电负性O>S>As原子半径O>S>As9. 电子构型相同的阳离子,其极化力最强的是:()A.高电荷和半径大的离子B.低电荷和半径大的离子C.高电荷和半径小的离子D.低电荷和半径小的离子10. 共价键最可能存在于:()A.金属原子之间B.非金属原子之间C.金属原子和非金属原子之间D.电负性相差很大的元素的原子之间三、填空题。
%B9%B4《无机与分析化学》期中考试(节选)

(1)A2
k1 k2
A + A (快速平衡)
(2)A + A + B2 k3 2AB(控速步骤)(频率因子=4.00×1013s-1)
已知反应(1)的反应热ΔrHm0=64kJ·mol-1。 试求 1°反应(2)的活化能 Ea3 以及它的速率常数 k3;
2°此复杂反应的速率方程表达式。 *4.医学上输液时要求输入液体和血液的渗透压相等(即等渗溶液)。临床上用的是葡萄糖等 渗液的冰点降低值为 0.543℃,试求此葡萄糖的百分浓度和血液的渗透压。(水的 Kf 为 1.86, 葡萄糖分子量为 180)
5. (
)化合物 FeCl2 有三种水合物,它们的脱水反应的 Kp 分别为
FeCl2·3H2O(s)
FeCl2·2H2O(s) + H2O(g) Kp1
FeCl2·2H2O(s)
FeCl2·H2O(s) + H2O(g) Kp2
FeCl2·H2O(s)
FeCl2(s) + H2O(g) Kp3
为使 FeCl2·2H2O(s)晶体保持稳定(不风化也不潮解),容器中水蒸汽压强 PH2O 应为:
reaction occurs: H2S(aq.) + Cl2(aq.) →S(s) + 2H+(aq.) + 2Cl-(aq.) The rate of this reaction is first order in each reactant. The rate constant for disappearance of H2S at 28℃ is 3.5×10-2 L·mol-1·s-1. If at a given time the concentration of H2S is 1.6×10-4mol·L -1 and that of Cl2 is 0.070mol L-1·,what is the rate of formation of Cl-?
《无机与分析化学》期末考试试卷

《无机与分析化学》期末考试试卷一、单项选择题(每小题3分,共60分)1. 取同浓度的Zn2+-EDTA配合物的溶液A、B两份。
A份:用NaOH溶液控制pH=10.0,其表观稳定常数记作K'ZnY,A;B份:用氨-氯化铵缓冲溶液控制pH=10.0,其表观稳定常数记作K'ZnY,B。
则: [单选题] *(A) K'ZnY,A = K'ZnY,B(B) K'ZnY,A > K'ZnY,B(正确答案)(C) K'ZnY,A < K'ZnY,B(D) 无法确定2. 佛尔哈德法测定Cl-时,使用的指示剂是: [单选题] *A) Ag2CrO4B) 二氯荧光黄C) 甲基橙D) FeNH4(SO4)2(正确答案)3. 在下列物质中,不能将KI氧化成I2的是: [单选题] *A) KIO3B) FeNH4(SO4)2C) Fe(NH4)2(SO4)2(正确答案)D) CuSO44. 下列说法正确的是: [单选题] *A) 非构晶离子的盐浓度越大,沉淀溶解度越大(正确答案)B) 非构晶离子的盐浓度越大,沉淀溶解度越小C) 两种沉淀的溶度积相比,溶度积小的溶解度也一定小D) 同种类沉淀的溶解度越大,溶度积越小[单选题] *(A) -1.02 V(B) -1.74 V(C) -0.89 V(正确答案)(D) -1.16 V6. 在配离子[Co(C2O4)2(en)]-中(en为H2N-CH2-CH2-NH2),中心离子Co3+的配位数是: [单选题] *(A) 3(B) 4(C) 5(D) 6(正确答案)7. 用Na2C2O4标定KMnO4,加入第一滴KMnO4时,KMnO4的紫红色不会立即退去,这是因为反应速度不够快,若使第一滴KMnO4很快退色,最有效的措施是: [单选题] *A) 加大Na2C2O4浓度(B) 加大酸度(C) 事先加入Mn2+(正确答案)D) 加快滴KMnO4的速度8. 下列混合离子能用氨水分离的是: [单选题] *A) Cr3+和Cu2+(正确答案)B) Cu2+和Zn2+C) SO42-和Cl-D) Fe3+和Al3+9. 在酸性溶液中,以0.1000 mo l•L-1的Ce4+溶液滴定0.1000 mo l•L-1的Fe2+溶液,化学计量点的电位为1.06V,对此滴定最适宜的指示剂是: [单选题] *(A) 次甲基蓝(φo=0.53V)(B) 二苯胺磺酸钠(φo=0.84V)(C) 邻二氮菲亚铁(φo=1.06V)(正确答案)(D) 硝基邻二氮菲亚铁(φo=1.25V)[单选题] *(A) 3.0(B) 4.0(C) 5.0(正确答案)(D) 6.011. Fe2+有6个3d电子,配合物[Fe(CN)6]4-的晶体场分裂能△o = 395 kJ·mol-1;电子成对能Ep = 213 kJ·mol-1。
《无机及分析化学》试卷B及参考答案

第 1页,共 4页无机及分析化学试卷B 卷适用专业: 考试日期:试卷所需时间:120分钟 闭卷 试卷总分100分一、选择题(选择正确序号填写在括号内,每题2分,共50分)1.有关道尔顿分压定律表示错误的是(p i 和V i 分别表示分压和分体积)( )A. p 总=∑p iB. p i V i =n i RTC. p i V 总=n i RTD. p i / p 总=n i / n 总 2.下列溶质质量相同,体积相同的溶液,凝固点降低最多的是 ( )A. C 6H 12O 6B. C 12H 22O 11C. CO(NH 2)2D. C 2H 5OH 3. 下列各组量子数中,合理的一组是 ( )A. n=3 l =1 m= +1 m s =+1/2B. n=4 l =5 m=-1 m s =+1/2C. n=3 l =3 m=+1 m s =-1/2D. n=4 l =2 m=+3 m s =-1/24. 下列液体只需要克服色散力就能使之沸腾的物质是 ( ) A. O 2 B. SO 2 C. HF D. H 2O5.下列叙述错误的是 ( )A. 胶体是热力学不稳定体系B. 乳状液是粗分散体系C. 高分子溶液是真溶液D. 固体分散在气体中不能形成溶胶6. 反应H 2(g)+I 2(g)=2HI(g)的质量作用定律的表达式为22I H c kc v ⋅=,则该反应一定 为( )A. 一级B. 二级C. 三级D. 不能确定7. 对同一反应,已知T 1<T 2,则升高100 K,下列关系式正确的是 ( )A.1001002211++>T T T T k k k k B.1001002211++<T T T T k k k kC.1001002211++=T T T T k k k k D. 不能确定8.等温、等压只作体积功的条件下,化学反应自发进行的判据是 ( )A. Δr Gθm < 0 B. Δr G m < 0C. Δr H m < 0D. Δr S m > 09.下列等式正确的是 ( )A. Δr G θ=-RT lnK θB. ΔG =nF EC. Δf H m θ(CO 2,g)= Δc H m θ(C 金刚石) D. S m,298θ(H 2,g)=010.浓度为0.10mol·L -1的NaHCO 3溶液的c (H +)近似等于(K a1θ和K a2θ分别代表H 2CO 3的一级和二级电离常数) ( )A. θa2θa1K K ⋅ B. 10.0θa1⋅KC.10.0)/(θa1θw ⋅K K D.θ210.0a K ⋅11.pH =10的NH 3-NH 4+缓冲溶液c (NH 4+)/c(NH 3)的比值为[p K b θ(NH 3)=4.75] ( )A. 100.25B. 100.75C. 10-0.25三级 D. 10-0.7512. Ag 3PO 4在水中的溶解度为S mol·L -1,则其K sp θ等于 ( )A. 4θsp27K S = B. 3θsp 4K S = C. 4θsp 3K S = D. 3θsp 27K S =13. MnO 4-+Cl -+H +→ Mn 2++Cl 2+H 2O 上述配平反应中反应物的系数依次是( )院系: 专业班级: 姓名: 学号:装 订 线第 2页,共 4页A. 2、10、16、2、5、8B. 1、10、16、1、5、8C. 2、5、8、2、10、16D. 1、5、8、1、10、1614.下列物理量不为零的是 ( )A.2/H Hθϕ+ B. Δc H m θ(CO 2,g) C. Δf H m θ(C ,金刚石) D. Δf H m θ(H +,aq)15.下列配合物不能被H +所破坏(Y :EDTA) ( )A. [Cu(en)2]2+B. [Fe(CN)6]3-C. [HgI 4]2-D. [CaY]2- 16. 下列叙述错误的是 ( )A. 精密度好是准确度高的必要条件B. 精密度好则准确度一定会高C. 平均偏差d 和标准偏差s 都可用来衡量一组数据精密度的优劣,但后者更好D. 精密度是指在相同条件下测定结果的再现程度17.检验和消除系统误差的方法是 ( )A. 对照试验B. 空白试验C. 校准仪器D. A 、B 、C 都可以 18.在用邻苯二甲酸氢钾标定氢氧化钠时,得到以下五个数据:0.1021,0.1018,0.1010,0.1020,0.1021mol·L -1.查表得n=5时,Q 0.90=0.64,从而判断可以弃舍的数据是( )A. 0.1021B. 0.1018C. 0.1010D. 0.1020 19.试样中Fe 2O 3的百分含量为82.23%,则用Fe 3O 4%表示为( )A. 79.47%B. 57.72%C. 82.23%D. 84.41% 20.T HAc/NaOH =0.005327g ·ml -1,下列有关叙述不.正确的是( ) A. 滴定时每消耗1mLNaOH 标准溶液相当于含有HAc0.005327g B. NaOH 溶液的浓度为0.08871mol ·L -1C. 1mLNaOH 标准溶液含有NaOH0.003548gD. 滴定时每消耗1mLHAc 标准溶液相当于含有NaOH0.005327g 21. pH =0.02,其有效数字位数为 ( )A. 1B. 2C. 3D. 不能确定22.随机误差服从的规律是 ( )A. 大小相等的正负误差出现的几率相等B. 小误差出现的几率高于大误差出现的几率C. 特别大的误差出现的几率近似于零D. A 、B 、C23.下列基准物可用于标定HCl 的是 ( )A. Na 2CO 3B. Na 2B 4O 7·10H 2OC. KHC 8H 4O 4D. A 、 B 24. Na 3PO 4的K b1θ等于 ( )A. K w θ/K a1θ(H 3PO 4) B. K w θ/K a2θ(H 3PO 4) C. K w θ/K a3θ(H 3PO 4) D. K a3θ(H 3PO 4) / K w θ25.下面关于指示剂变色点说法错误的是 ( )A. 指示剂在变色点时,[HIn]=[In]B. 指示剂在变色点时,pH =p K HIn θC. 指示剂的变色范围是变色点的pH±1D. 指示剂的变色点与温度无关二、是非题(正确的划 “√”,错误的划 “√”,每题1分,共20分)1、1O Cr Fe/K mL g 005585.0722-⋅=T ,如果一次滴定中消耗了20.00mlK 2Cr 2O 7标准溶液,则被测物质中铁的质量为0.1117g 铁。
《无机及分析化学》期中考试卷(13-14)
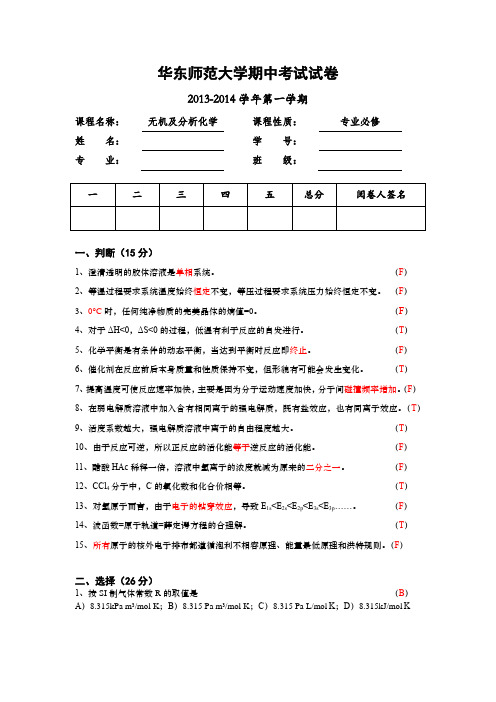
华东师范大学期中考试试卷2013-2014学年第一学期课程名称:无机及分析化学课程性质:专业必修姓名:学号:专业:班级:一、判断(15分)1、澄清透明的胶体溶液是单相系统。
(F)2、等温过程要求系统温度始终恒定不变,等压过程要求系统压力始终恒定不变。
(F)3、0°C时,任何纯净物质的完美晶体的熵值=0。
(F)4、对于ΔH<0,ΔS<0的过程,低温有利于反应的自发进行。
(T)5、化学平衡是有条件的动态平衡,当达到平衡时反应即终止。
(F)6、催化剂在反应前后本身质量和性质保持不变,但形貌有可能会发生变化。
(T)7、提高温度可使反应速率加快,主要是因为分子运动速度加快,分子间碰撞频率增加。
(F)8、在弱电解质溶液中加入含有相同离子的强电解质,既有盐效应,也有同离子效应。
(T)9、活度系数越大,强电解质溶液中离子的自由程度越大。
(T)10、由于反应可逆,所以正反应的活化能等于逆反应的活化能。
(F)11、醋酸HAc稀释一倍,溶液中氢离子的浓度就减为原来的二分之一。
(F)12、CCl4分子中,C的氧化数和化合价相等。
(T)13、对氢原子而言,由于电子的钻穿效应,导致E1s<E2s<E2p<E3s<E3p……。
(F)14、波函数=原子轨道=薛定谔方程的合理解。
(T)15、所有原子的核外电子排布都遵循泡利不相容原理、能量最低原理和洪特规则。
(F)二、选择(26分)1、按SI制气体常数R的取值是(B)A)8.315kPa m3/mol K;B)8.315 Pa m3/mol K;C)8.315 Pa L/mol K;D)8.315kJ/mol K2、现有1mol理想气体,若它的摩尔质量为M,密度为d,在温度T下体积为V,下述关系正确的是(D)A)PV=(M/d) RT;B)PVd = RT;C)PV=(d/n)RT;D)PM/d = RT3、同温同体积的两杯蔗糖溶液,浓度分别为1 mol/L和1 mol/kg,则溶液中的蔗糖含量应是(C)A)一样多;B)1 mol/kg中多;C)1 mol/L 中多;D)不确定4、质量摩尔浓度的溶液是指1 mol 溶质溶于(D)A)1 L溶液;B)1000 g 溶液;C)1 L溶剂;D)1000 g 溶剂5、稀溶液依数性中起决定性的性质是(A)A)溶液的蒸气压下降;B)溶液的沸点升高:C)溶液的凝固点降低;D)溶液具有渗透压6、不属于状态函数的是(C)A)U;B)H;C)W;D)S7、下列各组物质熵值比较正确的是(C)A)O2(g)>O3(g); B)Cl2(g)>Br2(g);C)C2H5OH(g)>CH3-O-CH3(g);D)H2O(s)>H2O(l)8、下列关于反应级数说法错误的是(D)A)反应级数可以为分数; B)不存在四级反应; C)一级反应的半衰期与浓度无关; D)二级反应的半衰期与浓度无关9、根据酸碱质子理论,下列物质中既是酸又是碱的是(C)A)HAc;B)CO32-;C)HPO42-;D)Ac-10、关于缓冲溶液说法错误的是(D)A)总浓度越大,缓冲容量越大;B)为获得最大缓冲容量,选择缓冲对其弱酸的pKao应正好或接近于所要求配置的pH;C)缓冲溶液都是由弱酸及其共轭碱组成的混合溶液;D)共轭酸碱对的比值一般在0.01~100之间11、有关氧化数叙述,下列哪项不正确(B)A)单质氧化数为0;B)氢的氧化数只为+1;C)多原子离子中各原子氧化数之和为离子的电荷数;D)多原子分子中各原子氧化数之和为012、下列各组量子数中哪一组是正确的(C)A )n=4,l=1,m = -2;B )n=4,l= -1,m = 0;C )n=3,l=2,m = -2;D )n=3,l=3,m = -313、下列元素中原子半径最小的是(D )A )Na ;B )Mg ;C )Al ;D )Si三、填空(14分)1、25°C 时将相同压力....的5.0L 氮气和15L 氧气压缩到一个10.0L 的真空容器中,测得总压为150kPa ,则两种气体的初始压力1215010.0(5.015.0)75.0kPa⨯+∴=+⇒=⇒=p V pV pV p p RT RT RT RT RT总总混合前后物质的量不变。
大学《无机及分析化学》试题及答案

大学《无机及分析化学》试题及答案大学《无机及分析化学》试题及答案一、判断题 (每小题1分共10分 )1.σ键和π键在分子中均可单独存在。
()2.系统误差是不可测的。
()3.极性分子间仅存在取向力,非极性分子间只存在色散力。
()4.等价轨道处于全充满、全空、半充满状态时原子能量较低。
()5.施肥过多造成的“烧苗”现象,是由于植物细胞液的渗透压小于土壤溶液的渗透压引起的。
()6.醋酸溶液经稀释后其解离度增大,因而可使其H+ 浓度增大。
()7.BF3和NH3都具有平面三角形的空间结构。
()8.CO2与CH4的偶极矩均为零。
()9.共价键和氢键均有饱和性与方向性。
()10.在消除了系统误差之后,测定结果的精密度越高,准确度也越高。
()三、填空题 ( 共 25分 )1.命名[Cr(NH3)4Cl2]NO3为______________ ,中心离子为 ___________,配位原子为 ___________ ,配位数为___________,配体包括 ___________ 。
2.在含有AgCl(s)的饱和溶液中加入0.1 mol·L-1 的AgNO3 ,AgCl的溶解度将______________,这是由于______________________的结果。
3.NH3分子中N的杂化方式为 ___________杂化,空间构型为___________。
BCl3分子中B的杂化方式为 ______杂化,空间构型为___________。
4.原电池中,发生还原反应的电极为______极,发生氧化反应的电极为____极。
5.常用于标定HCl溶液的基准物质有 ___________ 、___________常用于标定NaOH溶液的基准物质有___________ 、 ___________ 。
6.24号元素的核外电子排布为________ 它位于元素周期表第________周期________族________区。
上海交大无机分析化学八试题

上海交大无机分析化学八试题第八章1、磷酸二氢根离子的共轭碱是(B)A:磷酸B:磷酸一氢根C:磷酸根D:氢氧根E:氢离子2、氨气的共轭酸是(C)A:氨负离子B:四氢化二氮C:氨正离子D:氨水3、按照质子理论,磷酸氢二钠属于(D)A:中性物质B:酸性物质C:碱性物质D:两性物质E:酸碱惰性物质4、按照质子理论,下列物质中哪个具有两性?(B)A:碳酸根离子B:碳酸氢根离子C:磷酸根离子D:硝酸根离子E:硫离子5、下列说法中准确的是(D)A:某种盐的水溶液呈中性,可以推断这种盐不水解B:氯酸钾和硝酸银反应可以生成氯化银沉淀C:在水溶液中电离度大的物质,溶解度也大D:氯化氢气体在干燥条件下不能使蓝色石蕊试纸变红6、下列说法中哪些是正确的(E)A:碳酸氢钠中含有氢,所以其水溶液呈现酸性B:浓醋酸(17摩尔每升)的酸度大于17摩尔每升硫酸水溶液的酸度C:摩尔浓度相等的一元酸和一元碱反应以后,其溶液呈中性D:弱酸溶液越稀,其电离度越大,因而酸度也越大E:当氢离子浓度大于氢氧根离子浓度的时候,溶液呈现酸性7、下列说法中哪个是正确的(B)A:分析浓度就是平衡浓度B:分析浓度是指一定体积的溶液中所含有溶质的物质的量,其中包括已经离解和尚未离解的两部分C:分布系数是指酸碱平衡体系中某种存在形式的平衡浓度占尚未离解物质浓度的分数D:分布系数与氢离子浓度间的关系曲线称为分布曲线8、浓度相同的下列物质的水溶液,其pH值最高的是:(B)A:醋酸钠B:碳酸钠C:氯化铵D:氯化钠E:醋酸铵9、在1摩尔每升的醋酸溶液中,欲使氢离子浓度增大,可以采取下列那种方法?(D)A:加水B:加醋酸钠C:加氢氧化钠D:加0.1摩尔每升氯化氢10、用纯水将下列溶液稀释10倍的时候,其中pH值变化最大的是(B)A:0.1摩尔每升氯化氢+0.1摩尔每升氢氧化钠B:1摩尔每升氨水C:1摩尔每升醋酸+1摩尔每升醋酸钠D:1摩尔每升氨水+1摩尔每升氯化铵11、讨论缓冲溶液的缓冲容量大小有关的因素是(C)A:缓冲溶液的pH范围B:缓冲溶液的体积C:缓冲溶液组分的浓度比D:外加的酸量E:外加的碱量12、人体血液的pH值总是保持在7.35到7.45之间,这是因为(B)A:人体内含有大量水分B:血液中的碳酸和碳酸氢根离子起到缓冲作用C:血液中含有一定量的钠离子D:血液中含有一定量的氧气13、0.0095摩尔每升氢氧化钠溶液的pH值为(C)A:12 B:12.05 C:11.98 D:2.02 E:11.97714、将PH分别为13的强碱溶液与1的强酸溶液等体积混合,混合后溶液的PH值为(C)A:12 B:10 C:7 D:615、在一升纯水中,室温下加入0.1毫升1摩尔每升氢氧化钠溶液,则这种溶液的PH值为(D)A:1 B:4 C:7 D:1016、酸碱滴定中选择指示剂的原则是(B)A:指示剂的变色范围与等当点完全符合B:指示剂的变色范围全部或部分落入滴定的PH突越范围之内C:指示剂变色范围应当完全落在滴定的PH突越范围之内D:指示剂应当在PH为7的时候变色17、pH为3的硫酸溶液和pH为10的NaOH溶液相混合,若使混合后溶液的pH为7,则硫酸溶液和NaOH溶液的体积比为(B)A:1:2 B:1:10 C:1:20 D:1:1218、标定氢氧化钠常用的基准物有(B)A:无水碳酸钠B:邻苯二甲酸氢钾C:硼砂D:碳酸钙E:草酸钠19、用HCl标定NaOH时,如果滴定速度过快,读数过早时,则测定NaOH的结果将(B)A:偏高B:偏低C:无影响D:不能确定20、为了区分盐酸,高氯酸,硫酸,硝酸中酸的强度大小,可以采用下列那种溶剂(C)A:水B:吡啶C:冰醋酸D:乙二胺21、在非水酸碱滴定中,常常使用高氯酸的冰醋酸溶液,标定这种溶液的基准物为(D)A:无水碳酸钠B:硼砂C:苯甲酸D:邻苯二甲酸氢钾E:碳酸钙22、用某种拉平性溶剂可以将高氯酸,硫酸,盐酸,硝酸的酸度拉平到同一个强度(称之为拉平效应)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
K2CrO4 溶液,先生成
沉淀,最后生成
沉淀。
(已知:Ksp, Ag2CrO4=1.1×10-12,Ksp, PbCrO4=2.8×10-13,Ksp,BaCrO4=1.2×10-10)
4、命名或写出下列配合物的名称:
1) [Co(NH3)5H2O]Cl3 :_
__________________________;
1、(
)某溶液的 pH=0.04,则其中 H+的浓度为:
A、 0.912mol·dm-3
B、0.91mol·dm-3
C、 0.9mol·dm-3
D、1.1 mol·dm-3
2、(
)H3PO4 的 pKa1、pKa2、pKa3 分别是 2.12、7.12、12.32,在下列不同 pH 值的溶
液中,溶液中 HPO42-的平衡浓度最大的是:
A、 7.21
B、10
C、12.32
D、14
3、(
)将 BaSO4 分别放置于纯水、1.0mol·dm-3 NaCl、1.0mol·dm-3 BaCl2 三种溶
液中,溶解度分别为 s1、s2、s3;则三者的关系为:
A、 s1>s2>s3
B、s3> s1 > s2
C、 s2> s1 >s3
D、s2> s3 > s1
Kspθ(Mg(OH)2) = 5.61×10-12, 显然,AgCl 在水中溶解度更小。
2、(
)按照晶体场理论,强场配体和弱场配体与同一金属离子配位时,其晶体场稳
第1页共1页
上海交通大学《无机与分析化学》期末试卷(B)
定化能总是强场的比弱场的大(指绝对值)。
3、(
)强酸在水中完全电离,显然 1.0×10-8 mol/dm3 HCl 溶液中[H+] = 1.0×10-8
6
4.8
7
3.4
3、已知下列原电池: (-)Zn | Zn2+(1.0mol·dm-3)|| Ag+(1.0mol·dm-3)| Ag(+) (1)先向右半电池中通入过量 NH3 气,使游离 NH3 的浓度达到 1.0mol·dm-3,此时测得电 动势 E1=1.13V,求 Kƨf ,[Ag(NH3)2+](假定 NH3 的通入不改变溶液的体积)。 (2)然后在右半电池中继续加入过量的固体 Na2S,使 c(S2-)=1.0mol·dm-3,求原电池的电 动势 E2。(假定加入固体 Na2S 不改变溶液的体积);(已知ϕƨ,Zn2+/Zn=-0.763V,Ag+/Ag= 0.8V,Ksp(Ag2S)=1.0×10-49)
上海交通大学《无机与分析化学》期末试卷(B)
3、[Fe(CN)6]3-仅有一个单电子,而[Fe(H2O)6]3+有五个单电子。试画出在晶体场中 d 电子排布 示意图并计算晶体场稳定化能(CFSE),据此判断何种配合物更稳定。
*4、新分离的红细胞放在 0.10mol·dm-3 NaCl 中,将有何现象发生?简述其原因。(血液的
滴定剂、指示剂及各组分含量计量关系式。
(1)Na3PO4+Na2HPO4(H3PO4 的 pKa1、pKa2、pKa3 分别是 2.12、7.12、12.32) (2)自来水中钙、镁含量测定(lgKMY:CaY=10.69,MgY=8.69;Ksp,Mg(OH)2=5.61×10-12)
第2页共2页
2) 二(硫代硫酸根)合银(I)酸钠
5、25℃时,ϕθ(MnO4-/Mn2+)=1.51 V,ϕθ(SO42-/H2SO3)=0.20 V,若将上两电极组成原电
池,写出:
标准状态原电池符号为_________________________________________________。 标准电动势 Eθ为:__________。标准平衡常数 Kθ为:_______________________。
(已知:lgKf,FeY=25.1;CoY=16.31, Ksp,Fe(OH)3=1.60×10-36,Co(OH)2=1.6× 10-15。EDTA 的 lgαY(H)值:
pH
lgαY(H)
pH
lgαY(H)
pH
lgαY(H)
pH
lgαY(H)
0
24.0
1
17.1
2
13.8
3
10.8
4
8.3
5
6.6
[Ni(CN)4]2-
平面正方型
0
[Fe(H2O)6]3+
sp3d2
四、简答题:20% 1、0.1mol·dm-3 的 Cu2+溶液中含有 0.01mol·dm-3 Fe3+。通过计算说明是否可用调节 pH 值 的办法除去 Fe3+离子而 Cu2+仍留在溶液中。(已知:Ksp,Fe(OH)3=1.60×10-36,Cu(OH)2=2.6 ×10-19) 2、请用适当的滴定分析方法鉴定下列混合物中的各组分的含量,并简要说明理由、滴定方法、
mol/dm3。
4、(
)在氧化还原电对的半反应中,氧化态和还原态也是一种共轭关系。因此,氧
化态物质的氧化性强,其对应的还原态物质的还原性必然也强。
5、(
)在用佛尔哈德法测定 Cl-时,溶液中未加硝基苯,由于 NH4SCN 标准溶液会
与 AgCl 发生沉淀转化,以使消耗 NH4SCN 的量增大,从而使测定结果偏低。
A、负极通入 H2S 气体;B、正极加入 CuSO4 溶液;C、负极加水稀释;D 上述三种都可以。
6、(
)已知某金属指示剂在水溶液中发生如下电离,
H3In (紫红)
pKa1=3
H2In- pKa2=6 (绿色)
HIn2- pKa3=12In3(橙色) (蓝色)
它
与
众
多
的
金
属
离
子
形
成
的
配
合
物
的
颜
色是酒红色, 如用 EDTA 滴定 Mn2+,用该指示剂指示终点,合适的酸度范围是:
2) 计量点时溶液的 pH 值
3) 若以甲基红为指示剂,滴定到 pH=5.0 为终点,则终点误差为多少?
2、某试液含 Fe3+和 Co2+浓度均为 0.02000mol·dm-3,今欲用同浓度的 EDTA 分别滴定。问
(1)有无可能分别滴定?
(2)滴定 Fe3+的合适的酸度范围;
(3)滴定 Fe3+后,是否还有可能滴定 Co2+,求滴定 Co2+的合适的酸度范围。
6、配平下列方程式: ZnS + NO3- + Cl- → ZnCl42- + NO2 + S (酸性介质) 氧化反应:
还原反应:
总反应:
7、完成下表:已知 Fe、Ni 和 Ag 的原子序数分别为 26、28 和 47。(每 2 空 1 分)
物质
中心离子 杂化类型
配离子 空间构型
内轨或外轨
磁矩(B.M.)
4、(
Байду номын сангаас
)某金属离子在八面体弱场中磁矩为 4.90 B.M.,而在八面体强场中磁矩为零,
该金属离子可能是:
A、Cr(III) B、 Mn(II) C、 Co(II)
D、 Fe(II) E、 以上都不是
5、( 是:
)要想增加电池(-)Zn|ZnSO4(c1)|| CuSO4(c2)|Cu(+)的电动势,应采取的办法
A、pH<3
B、3<pH<6
C、6<pH<12
D、pH>12
*7(
)某一有色溶液浓度为 c,测得其透光率为 T0。把浓度增加到原来的 2 倍,在相
同的条件下测得的透光率为:
A、(T0)2
B、(T0)1/2 C、T20 D、2 T0
二、是非题:5%
1、(
)溶度积常数可以衡量难溶电解质在水中的溶解度,Kspθ(AgCl) = 1.77×10-10,
上海交通大学《无机与分析化学》期末试卷(B)
上海交通大学《无机与分析化学》期终试卷(B) (节选)
(2003~2004 学年第一学期)………生命、环境、农学、医药专业
班级
学号
姓名
题号
一
二
三
四
得分
注意:带 * 的题目,除环境、药学专业外,不用做。
得分 五
一、选择题:15%(每题只有一个正确答案,每题 1.5%)
等渗溶液是 0.9%NaCl 溶液,Mr. NaCl=58.44)
五、计算题:40%
1、0.1000mol·dm-3 的 HCl 溶液滴定 20.00dm3 的 0.1100 mol·dm-3 的一元弱碱 B 溶液,当加入
HCl 溶液 18.00cm3 时,溶液的 pH 值为 8.60,试计算
1) 该一元弱碱的 pKb 值
第3页共3页
三、填空题:20%
1、按有效数字运算规则计算 0.0122+22.64+1.25786+0.0121×22.64×125.782 = _______。
2、写出(NH4)2(HPO4)的质子条件等衡式(PBE):
质子条件式
;零水准
;
3、在某混合溶液中含有 Ag+、Pb2+和 Ba2+,各离子的浓度均为 0.1mol·dm-3 的,逐滴加入
