测序常见问题分析与解答
基因组测序数据分析中常见问题及解决策略

基因组测序数据分析中常见问题及解决策略基因组测序是一项重要的技术,已经广泛应用于生物医学研究、疾病诊断和个体化治疗等领域。
然而,基因组测序数据分析过程中常会遇到一些问题,正确解决这些问题对于准确地分析基因组数据至关重要。
本文将探讨基因组测序数据分析中常见的问题,并提出解决策略。
一、质量控制问题质量控制是基因组测序数据分析的第一步,主要目的是检查测序数据的质量,并去除质量较差的数据。
常见的质量控制问题包括低质量碱基、接头污染和重复序列等。
针对这些问题,可以采取以下策略。
首先,使用质量评估工具(如FastQC)检查测序数据的质量分布。
对于低质量碱基,可以通过Trimming或过滤掉具有低质量碱基的序列来解决。
接头污染可以通过使用Trimming工具删除接头序列来解决。
对于重复序列,可以利用特定软件(如Prinseq)去除这些序列,以保证数据的准确性和可靠性。
二、序列比对问题在基因组测序数据分析中,序列比对是其中一个关键步骤,目的是将测序数据与参考基因组进行比对,并得到每个位置的reads覆盖度。
常见的问题包括参考基因组选择和序列比对比对率等。
针对这些问题,可以考虑以下解决策略。
首先,对于参考基因组的选择,应根据具体研究目的和样本特点选择最适合的参考基因组。
对于高变异的样本,可以选择一致性较高的参考基因组进行比对。
其次,比对率低的问题可以通过选择合适的比对工具来解决。
目前常用的比对工具包括Bowtie、BWA等,根据具体情况选择适合的工具进行比对。
三、变异检测问题基因组测序数据分析的主要目的之一是检测样本中的变异,包括单核苷酸变异(SNV)、插入缺失变异(Indel)等。
常见的变异检测问题包括假阳性和假阴性。
针对这些问题,可以考虑以下策略。
首先,采用多个变异检测工具进行分析,不仅能够减少假阳性结果的产生,更能提高结果的准确性。
其次,对于假阴性结果,可以根据实验的目的进行进一步的验证,如采用Sanger测序等验证方法来提高结果的可信度。
一代测序常见问题及解决策略知识分享

一代测序常见问题及解决策略知识分享测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
一代测序常见问题及解决策略

测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR 扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
测序常见问题分析解答

测序常见问题分析主讲人: 张隽辉LOGO1. 序列结构对测序的影响图例:poly结构原因: 主要原因是在polyT结构后,测序酶容易在模板上 滑动,导致随后的峰型变乱 或者移码解决办法: 此类样品通过对其反向互补序列进行测序,通过 拼接可以得到模板全长序列.图例:重复结构原因: 重复结构会导致测序复制框的滑移,另外测序试剂采用 了I, U 代替G, T, 与模板结合能力较弱, 测序酶很难延伸, 信号会迅速衰减或峰谱很乱解决办法: 使用反向引物对模板进行测序,测到重复序列反向互 补位置时,即可完成模板全长的拼接,一般测A\C重复 序列比G\T要容易一些图例:回文结构位点94至137碱基前后互补, 形成回文结构,该结构导致 后面的信号衰减,出现错误的判读。
图例: 特殊结构现象: 信号在73bp(信号峰图2700处)突然中断, 测序PCR反应终止原因: 变性后的单链在该处很可能互补或在全序列中有大的 特殊结构,造成严重的二级结构,使dNTP 和 ddNTP不 能和模板结合, 测序酶无法正常延伸解决方法: 酶切,做亚克隆测序2.测序常见图谱分析图例:双克隆1现象: T载体序列峰图正常, 连接位置处出现套峰原因: 1.有插入片段的载体和空载体同时存在 2.PCR产物用T载体进行连接时,其片段能以正反两个方向 插入T载体解决办法: 重新挑取单克隆备注: 重新进行PCR反应或者酶切鉴定仅能证明该克隆含有插入片段, 并不足以证明模板的单一图例:双克隆2现象: 载体序列及插入片段前半部分峰图单一,套峰出现在插入片段中间原因: 1. pcr产物不纯,且产物的引物结合区以及峰图单一的序列 都一样 2. 部分模板碱基发生突变,双峰出现的位点是由碱基突变 的位置决定的,有时会一端正常一端双峰(插入片断超过一 个反应测序长度(800~900bp)), 或者两个反应都双峰解决方法: 重新挑单克隆图例:非特异扩增现象: 峰图起始即双峰 原因及解决方法: 1. 对于质粒样品, 引物在序列上有两个结合位点(载体上和插入片段上),换一个引物测序 2.对于PCR产物,有两个模板,且两个模板都能和引物结合扩增, 换引物或克隆测序图例:等位基因双模板现象:序列的80bp到120bp之间有两套峰存在,没有发生移码突变解决方法: 采取克隆的方法将两套模板分开,分别进行测序图例:碱基缺失碱基缺失常见在PCR产物中,特别是从基因组中扩增得到的PCR片段, 上图的186位缺失两个连续的T。
一代测序常见问题及解决策略

测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR 扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
测序常见问题解答

测序常见问题解答1.为什么需要新鲜的菌液?首先,新鲜的菌液易于培养,可以获得更多的DNA,同时最大限度地保证菌种的纯度.2.如何提供菌液?如果您提供新鲜菌液,用封口膜封口以免泄漏;也可以将培养好的4—5ml菌液沉淀下来,倒去上清以方便邮寄。
同时邮寄时最好用盒子以免邮寄过程中压破.3.如何制作穿刺菌?用灭菌过1.5ml或2ml离心管加入LB琼脂(7g/L)斜面凝固,用接种针挑取分散良好的单菌落穿过琼脂直达管底,不完全盖紧管盖适当温度培养过夜,然后盖紧盖子加封口膜,室温或4度保存。
4.PCR产物直接测序有什么要求?1).扩增产物必须特异性扩增,条带单一.如果扩增产物中存在非特异性扩增产物,一般难以得到好的测序结果;.2)必须进行胶回收纯化;3)DNA纯度在16—2.0之间.浓度50ng/ul以上.5.为什么PCR产物直接测序必须进行Agarose胶纯化?如果不进行胶纯化而直接用试剂盒回收,经常会导致测序出现双峰甚至乱峰。
这主要是非特异性扩增产物或者原来的PCR引物去除不干净所导致。
大多所谓的PCR"纯化试剂盒"实际上只是回收产物而不能起到纯化的作用的。
对于非特异性扩增产物肯定无法去除,而且通常他们不能够完全去除所有的PCR引物,这会造成残留的引物在测序反应过程中参与反应而导致乱峰。
6.如何进行PCR产物纯化?PCR产物首先必须用Agarose胶电泳,将特异扩增的条带切割下,然后纯化。
使用凝胶回收试剂盒回收.产物用ddH2O溶解。
7.PCR产物直接测序的好处?A) PCR产物直接测序可以反映模板的真实情况.B) 省去克隆的实验费用和时间.C) PCR产物测序正确的片段进行下一步克隆实验使结果更有保障.D) 混合模板进行PCR的产物直接测序可以发现其中的点突变.8.对用于测序的质粒DNA的要求有哪些?对测序模板DNA的一般要求:1).DNA纯度要求高,1.6—2.0之间,不能有混合模板,也不能含有RNA,染色体DNA,蛋白质等;2).溶于ddH2O中,溶液不能含杂质,如盐类,或EDTA等螯合剂,将干扰测序反应正常进行。
PCR测序常见问题
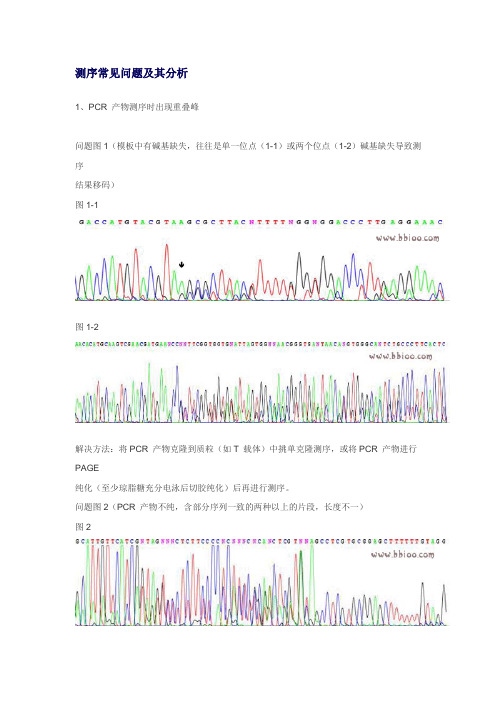
测序常见问题及其分析1、PCR 产物测序时出现重叠峰问题图1(模板中有碱基缺失,往往是单一位点(1-1)或两个位点(1-2)碱基缺失导致测序结果移码)图1-1图1-2解决方法:将PCR 产物克隆到质粒(如T 载体)中挑单克隆测序,或将PCR 产物进行PAGE纯化(至少琼脂糖充分电泳后切胶纯化)后再进行测序。
问题图2(PCR 产物不纯,含部分序列一致的两种以上的片段,长度不一)图2解决方法:主要原因是PCR 产物没有纯化,含有部分序列一致的两种以上长度不一的片段,将PCR 产物进行PAGE 纯化(至少琼脂糖充分电泳后切胶纯化)后再进行测序,便可解决。
问题图3(测序引物有碱基缺失)测序引物有碱基缺失(一般是引物的5'端缺失),和模板的碱基缺失即图1 有些类似,所不同的是模板碱基缺失一般是在一段正常测序序列后才出现移码,而引物碱基缺失的话,则从测序一开始就出现移码,表面在图形上便是一开始就是严重的峰形重叠。
解决方法:重新合成引物,或将引物进行PAGE 纯化2、克隆测序时出现峰形重叠原因:所挑选的重组子不是单克隆,所提供的测序用质粒中含有两种以上插入片段不同的质粒;或是是送测序的菌液污染解决方法:重新挑单克隆的菌落(划线分离单菌落),提质粒或送菌液再次测序。
3、样品有杂合/突变位点模板中有杂合型突变,也就说模板本身在这个位点出现突变;或者是从基因组中扩增出来的杂合位点。
如果模板有杂合(突变或缺失),那么测序图形中其他的位點一般都是單一的峰形,然后突然在某一個位點出現重叠峰(如图中箭頭所示)。
解决方法:建议将DNA 片段克隆到载体再测序。
4、polyA/T 和C/G cluster 导致的套峰和测序信号衰减图4-1图4-3图4-4RACE 测序时经常遇到图4-1 和图4-4 的情形,解决方法:从另一端测序;但如果这样的序列出现在中间,呵呵,目前还没有很好的解决方法,要看测序公司的本事了。
C/G cluster 在PrV 基因组测序时遇到过。
测序常见问题及其分析
测序常见问题及其分析[复制链接]查看:593回复:21#字体大小: t T发表于 2009-05-04 16:29 |只看楼主1、PCR 产物测序时出现重叠峰问题图1(模板中有碱基缺失,往往是单一位点(1-1)或两个位点(1-2)碱基缺失导致测序结果移码)图1-1图1-2解决方法:将PCR 产物克隆到质粒(如T 载体)中挑单克隆测序,或将PCR 产物进行PAGE 纯化(至少琼脂糖充分电泳后切胶纯化)后再进行测序。
问题图2(PCR 产物不纯,含部分序列一致的两种以上的片段,长度不一)图2解决方法:主要原因是PCR 产物没有纯化,含有部分序列一致的两种以上长度不一的片段,将PCR 产物进行PAGE 纯化(至少琼脂糖充分电泳后切胶纯化)后再进行测序,便可解决。
问题图3(测序引物有碱基缺失)测序引物有碱基缺失(一般是引物的5'端缺失),和模板的碱基缺失即图1 有些类似,所不同的是模板碱基缺失一般是在一段正常测序序列后才出现移码,而引物碱基缺失的话,则从测序一开始就出现移码,表面在图形上便是一开始就是严重的峰形重叠。
解决方法:重新合成引物,或将引物进行PAGE 纯化2、克隆测序时出现峰形重叠原因:所挑选的重组子不是单克隆,所提供的测序用质粒中含有两种以上插入片段不同的质粒;或是是送测序的菌液污染解决方法:重新挑单克隆的菌落(划线分离单菌落),提质粒或送菌液再次测序。
3、样品有杂合/突变位点模板中有杂合型突变,也就说模板本身在这个位点出现突变;或者是从基因组中扩增出来的杂合位点。
如果模板有杂合(突变或缺失),那么测序图形中其他的位點一般都是單一的峰形,然后突然在某一個位點出現重叠峰(如图中箭頭所示)。
解决方法:建议将DNA 片段克隆到载体再测序。
4、polyA/T 和C/G cluster 导致的套峰和测序信号衰减图4-1图4-3图4-4RACE 测序时经常遇到图4-1 和图4-4 的情形,解决方法:从另一端测序;但如果这样的序列出现在中间,呵呵,目前还没有很好的解决方法,要看测序公司的本事了。
一代测序常见问题及解决策略知识分享

测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
DNA测序常见问题分析及解决办法

DNA测序常见问题分析及解决办法常见问题具体情况可能原因处理办法备注样品准备问题菌培养不好或失败抗性不对或菌体已死核对抗性,尽可能提供载体信息和新鲜菌液。
.菌培养条件特殊重新提供新鲜菌液,或提供2ug纯化质粒。
质粒提不出或产量很低质粒拷贝数极低客户自己采取大量提取的方法提供2ug纯化质粒,特殊情况请在测序订单上备注。
.培养方式不当自带质粒或已纯化PCR产物量极低是否为电泳法定量质粒:电泳检测浓度大于100ng/ul,体积大于20ul;已纯化PCR产物:根据片段长度提供足够量的模板,一般100ng/反应/Kb,进行多个反应的应相应增加量。
只测OD值不可靠总量是否足够测序出现双峰双峰重复序列,如polyT、polyA或几个碱基重复建议用反向引物测互补链。
此类问题主要与样品有关质粒测序在插入序列中出现套峰可能样品为非单克隆,挑其他克隆测序。
PCR产物测序中,某一点后序列变乱可能是存在移码突变,这是正常的,建议克隆后测序。
.PCR产物中一个或多个位置有套峰序列中存在突变,这是正常的,建议克隆后进行测序。
PCR产物测序前部分双峰引物二聚体污染或产物不纯,更换引物重新PCR或克隆后测序。
质粒测序时整个结果双峰引物特异性不好,改用其他引物测序。
质粒和PCR产物测序出现双峰引物不纯,测序时只要单一引物,请不要将双向PCR引物混合;合成的引物没有纯化或纯化不好。
重新合成引物测序。
信号信号迅速衰减或中断模板GC二级结构区后难以得到好的测序结果,亚克隆成较小的片段进行测序模板GT二级结构区后测反向互补序列,AC结构不影响测序严重的重复结构测反向互补序列模板特性决定的根据具体情况决定信号极弱或无信号信号极弱或无信号模板质量差重新提供菌液或纯化PCR产物质粒样品:引物不符尽量提供载体详细信息,核查引物引物不适宜测序测序引物比PCR引物要求高,随机引物和简并引物不能用于测序,较长的PCR引物也不能用于测序。
重新设计引物测序,对PCR产物而言建议克隆到载体上用通用引物进行测序质粒产量极低客户自己提供2ug纯化好的质粒PCR产物定量极低重新电泳检测已纯化的PCR产物,确认有足够的量,或提供PCR原液由公司进行纯化测序结果正常,与预期不符找不到引物质粒模板检测是否为空载体,从其互补链上寻找,克隆位点离测序引物太近,长插入片段未测通。
一代测序常见问答及解决策略

测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
一代测序常见问题及解决策略

测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR 扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
测序常见问题分析与解答

测序常见问题分析与解答1、DNA测序样品用什么溶液溶解比较好?答:溶解DNA测序样品时,用灭菌蒸馏水溶解最好。
DNA的测序反应也是Taq酶的聚合反应,需要一个最佳的酶反应条件。
如果DNA用缓冲液溶解后,在进行了测序反应时,DNA溶液中的缓冲液组份会影响测序反应的体系条件,造成Taq酶的聚合性能下降。
有很多客户在溶解DNA测序样品时使用TE Buffer。
的确,TE Buffer能增加DNA样品保存期间的稳定性,但TE Buffer对DNA测序反应有影响,根据我们的经验,我们还是推荐使用灭菌蒸馏水来溶解DNA测序样品。
2、提供DNA测序样品时,提供何种形态的比较好?答:我们推荐客户提供菌体,由我们来提取质粒,这样DNA样品比较稳定。
如果您要以提供DNA样品,我们也很欢迎,但一定要注意样品纯度和数量。
提供的测序样品为PCR产物时,特别需要注意DNA的纯度和数量。
PCR产物应该进行切胶回收,否则无法得到良好的测序效果。
有关DNA测序样品的详细情况请严格参照“DNA测序样品准备及注意事项”部分的说明。
3、提供的测序样品为菌体时,以什么形态提供为好?答:一般菌体的形态有:平板培养菌、穿刺培养菌,甘油保存菌或新鲜菌液等。
我们提倡寄送穿刺培养菌或新鲜菌液。
平板培养菌运送特别不方便,我们收到的一些平板培养菌的培养皿在运送过程中常常已经破碎,面目全非,需要用户重新寄样。
这样既误时间,又浪费客户的样品。
一旦是客户非常重要的样品时,其后果更不可设想。
而甘油保存菌则容易污染。
制作穿刺菌时,可在1。
5ml的Tube管中加入琼脂培养基,把菌体用牙签穿刺于琼脂培养基(固体)中,37℃培养一个晚上后便可使用。
穿刺培养菌在4℃下可保存数个月,并且不容易污染,便于运送。
4、与测序引物有关的问题:答:对于通用测序引物,只要正确使用,一般不会有太大问题,测序引物问题主要发生在客户自己提供的PCR引物上。
应该明确的一点是并不是所用的用于PCR的引物都可以用来作测序,以下几种PCR引物将是不适合用作测序引物的:(1)简并引物,简并引物必然要在测序模板上有多个结合位点,直接影响测序结果。
测序常见问题分析

测序常见问题分析测序常见问题分析1.图谱无信号1.1、质粒培养,转化或其他随机原因使质粒上引物序列发生变化,导致无结合位点1.1.1同一模板两端引物测序均无信号,浓度不好安排重抽,反之停止实验,建议客户确认后重新送样1.1.2同一模只一端无信号,确认不是空载体,安排重新实验或换同序列其他引物,两次测序无信号则停止实验,客户要求测通的安排单向测通。
反之建议客户单向测通1.1.3客户提供序列我司合成引物,二次实验仍无信号则停止实验,建议客户提供载体图谱或目的基因我处给他设计引物测序1.1.4客户提供序列我司设计并合成引物核实设计无误可安排重新实验,仍不成功则停止实验,请客户确认提供的序列是否和模板相匹配1.1.5我司设计并合成的步行引物核实设计无误可安排重新实验,仍不成功可重设引物或换另一端测通。
1.1.6某一通用引物测序无信号先查看当天该引物的其他实验或近期该引物的实验情况,均无信号则换管引物重新实验,当天该引物的其他实验有成功的,该反应重做1.1.7一订单多样品用同一对引物测序,某条引物测序均无信号,若为客户提供引物则停止实验。
若为通用引物有同序列其他引物,在确认不是空载载体的情况下,安排换引物试作三至四个反应,效果好全部安排用该引物测序;效果不好都停止实验。
客户要求测通的安排单向测通,反之建议单向测通。
1.1.8重摇重抽测序无信号则取消,建议重新提供样品1.1.9客户提供质粒直接测序无信号则停止实验,建议客户提供新鲜菌液1.1.10用PCR引物测序无信号可换备用引物测序,无备用引物停止实验,建议用载体上引物测序。
1.2、PCR 产物1.2.1同一模板两端引物测序均无信号则停止实验,建议客户克隆后测序1.2.2 同一模只一端无信号,安排重新实验, 仍无信号则停止实验,客户要求测通的安排单向测通,反之建议步行测通2. 图谱信号弱可参考原始峰图,对不能出报告的峰图的处理如下:2.1 同一模板某一端,可安排提高浓度梯度重新实验2.2 某一模板或一订单多个模板中的一个模板2.2.1 鉴定浓度正常可安排提高浓度梯度重新实验,效果仍不好可作弱stop处理2.2.2 一次抽提出的质粒亮度弱,可安排重新抽提质粒后测序2.2.3 二次抽提出的质粒亮度弱,可停止实验,建议重新提供样品3 双峰3.1 PCR 产物测序3.1.1 引物不纯,引物客户提供该结果可出,引物我司合成安排重合引物3.1.2 引物特异性差,有双或多结合位点,可换备用引物测序,无备用引物即出结果3.1.3 polyT/A/G/C 出结果,单向建议客户换另一端测序。
测序常见问题及其分析

图2
解决方法:主要原因是PCR产物没有纯化,含有部分序列一致的两种以上长度不一的片段,将PCR产物进行PAGE纯化(至少琼脂糖充分电泳后切胶纯化)后再进行测序,便可解决。
问题图3(测序引物有碱基缺失)
测序引物有碱基缺失(一般是引物的5'端缺失),和模板的碱基缺失即图1有些类似,所不同的是模板碱基缺失一般是在一段正常测序序列后才出现移码,而引物碱基缺失的话,则从测序一开始就出现移码,表面在图形上便是一开始就是严重的峰形重叠。
解决方法:重新合成引物,或将引物进行PAGE纯化
2、克隆测序时出现峰形重叠
原因:所挑选的重组子不是单克隆,所提供的测序用质粒中含有两种以上插入片段不同的质粒;或是是送测序的菌液污染
解决方法:重新挑单克隆的菌落(划线分离单菌落),提质粒或送菌液。
测序常见问题分析的解答

测序常见问题分析主讲人: 张隽辉LOGO1. 序列结构对测序的影响图例:poly结构原因: 主要原因是在polyT结构后,测序酶容易在模板上 滑动,导致随后的峰型变乱 或者移码 解决办法: 此类样品通过对其反向互补序列进行测序,通过 拼接可以得到模板全长序列.图例:重复结构原因: 重复结构会导致测序复制框的滑移,另外测序试剂采用 了I, U 代替G, T, 与模板结合能力较弱, 测序酶很难延伸, 信号会迅速衰减或峰谱很乱 解决办法: 使用反向引物对模板进行测序,测到重复序列反向互 补位置时,即可完成模板全长的拼接,一般测A\C重复 序列比G\T要容易一些图例:回文结构位点94至137碱基前后互补, 形成回文结构,该结构导致 后面的信号衰减,出现错误的判读。
图例: 特殊结构现象: 信号在73bp(信号峰图2700处)突然中断, 测序PCR反应终止原因: 变性后的单链在该处很可能互补或在全序列中有大的 特殊结构,造成严重的二级结构,使dNTP 和 ddNTP不 能和模板结合, 测序酶无法正常延伸 解决方法: 酶切,做亚克隆测序2.测序常见图谱分析图例:双克隆1现象: T载体序列峰图正常, 连接位置处出现套峰原因: 1.有插入片段的载体和空载体同时存在 2.PCR产物用T载体进行连接时,其片段能以正反两个方向 插入T载体 解决办法: 重新挑取单克隆备注: 重新进行PCR反应或者酶切鉴定仅能证明该克隆含有插入片段, 并不足以证明模板的单一图例:双克隆2现象: 载体序列及插入片段前半部分峰图单一,套峰出现在插入片段中间原因: 1. pcr产物不纯,且产物的引物结合区以及峰图单一的序列 都一样 2. 部分模板碱基发生突变,双峰出现的位点是由碱基突变 的位置决定的,有时会一端正常一端双峰(插入片断超过一 个反应测序长度(800~900bp)), 或者两个反应都双峰 解决方法: 重新挑单克隆图例:非特异扩增现象: 峰图起始即双峰原因及解决方法: 1. 对于质粒样品, 引物在序列上有两个结合位点(载体上 和插入片段上),换一个引物测序 2.对于PCR产物,有两个模板,且两个模板都能和引物结合 扩增, 换引物或克隆测序图例:等位基因双模板现象:序列的80bp到120bp之间有两套峰存在,没有发生移码突变解决方法: 采取克隆的方法将两套模板分开,分别进行测序图例:碱基缺失碱基缺失常见在PCR产物中,特别是从基因组中扩增得到的PCR片段, 上图的186位缺失两个连续的T。
一代测序常见问题及解决策略说课讲解

一代测序常见问题及解决策略测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
一代测序常见问题及解决策略

一代测序常见问题及解决策略测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR 扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR 方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引图1分析后无干扰峰的常规序列图为:图2常见问题有:1.钉子峰图3产生原因:样品或毛细管内有气泡或灰尘、结晶等固体小颗粒反射激光,所以信号很高,而且所有波长(4色)都有。
一代测序常见问题及解决策略说课讲解

一代测序常见问题及解决策略测序常见问题及解决策略一、PCR常见问题1.假阴性,不出现扩增条带PCR出现假阴性结果,可从以下几个方面来寻找原因:1)模板:①模板中有杂蛋白;②模板中有Taq酶抑制剂;③在提取制备模板时丢失过多;④模板核酸变性不彻底。
2)酶:酶失活或反应时忘了加酶。
3)Mg2+浓度:Mg2+浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
4)反应条件:变性对PCR扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR扩增效率。
5)靶序列变异:靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR扩增是不会成功的。
2.假阳性假阳性:出现的PCR扩增条带与目的靶序列条带一致,有时其条带更整齐,亮度更高。
常见原因有:1)引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR扩增时,扩增出的PCR产物为非目的性的序列。
靶序列太短或引物太短,容易出现假阳性。
需重新设计引物。
2)靶序列或扩增产物的交叉污染:这种污染有两种原因:一是整个基因组或大片段的交叉污染,导致假阳性。
这种假阳性可用以下方法解决:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
二是空气中的小片段核酸污染,这些小片段比靶序列短,但有一定的同源性。
可互相拼接,与引物互补后,可扩增出PCR产物,而导致假阳性的产生,可用巢式PCR方法来减轻或消除。
3.出现非特异性扩增带PCR扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带。
非特异性条带的出现,其原因:一是引物与靶序列不完全互补、或引物聚合形成二聚体。
二是Mg2+离子浓度过高、退火温度过低,及PCR循环次数过多有关。
三是酶的质和量,往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
测序常见问题分析与解答1、DNA测序样品用什么溶液溶解比较好?答:溶解DNA测序样品时,用灭菌蒸馏水溶解最好。
DNA的测序反应也是Taq酶的聚合反应,需要一个最佳的酶反应条件。
如果DNA用缓冲液溶解后,在进行了测序反应时,DNA溶液中的缓冲液组份会影响测序反应的体系条件,造成Taq酶的聚合性能下降。
有很多客户在溶解DNA测序样品时使用TE Buffer。
的确,TE Buffer能增加DNA样品保存期间的稳定性,但TE Buffer对DNA测序反应有影响,根据我们的经验,我们还是推荐使用灭菌蒸馏水来溶解DNA测序样品。
2、提供DNA测序样品时,提供何种形态的比较好?答:我们推荐客户提供菌体,由我们来提取质粒,这样DNA样品比较稳定。
如果您要以提供DNA样品,我们也很欢迎,但一定要注意样品纯度和数量。
提供的测序样品为PCR产物时,特别需要注意DNA的纯度和数量。
PCR产物应该进行切胶回收,否则无法得到良好的测序效果。
有关DNA测序样品的详细情况请严格参照“DNA测序样品准备及注意事项”部分的说明。
3、提供的测序样品为菌体时,以什么形态提供为好?答:一般菌体的形态有:平板培养菌、穿刺培养菌,甘油保存菌或新鲜菌液等。
我们提倡寄送穿刺培养菌或新鲜菌液。
平板培养菌运送特别不方便,我们收到的一些平板培养菌的培养皿在运送过程中常常已经破碎,面目全非,需要用户重新寄样。
这样既误时间,又浪费客户的样品。
一旦是客户非常重要的样品时,其后果更不可设想。
而甘油保存菌则容易污染。
制作穿刺菌时,可在1。
5ml的Tube管中加入琼脂培养基,把菌体用牙签穿刺于琼脂培养基(固体)中,37℃培养一个晚上后便可使用。
穿刺培养菌在4℃下可保存数个月,并且不容易污染,便于运送。
4、与测序引物有关的问题:答:对于通用测序引物,只要正确使用,一般不会有太大问题,测序引物问题主要发生在客户自己提供的PCR引物上。
应该明确的一点是并不是所用的用于PCR的引物都可以用来作测序,以下几种PCR引物将是不适合用作测序引物的:(1)简并引物,简并引物必然要在测序模板上有多个结合位点,直接影响测序结果。
(2)随机引物,如RAPD引物,随机引物一般都比较短,所用退火温度低,在测序反应的条件下,不能很好地与模板结合。
(3)过长的引物,一般要求测序引物不大于24bp,最长不能超过30bp。
过长的引物在测序反应的较低的条件下容易在测序模板上有多个结合位点,导致测序结果背景增高。
另外,较长的引物纯度也将难以保证。
通常用于测序的引物纯度要在90%以上,引物纯度低时,测序反应的背景将明显增大,直接影响到测序结果。
(4)有特殊标记的引物,该情况主要指荧光标记的引物。
我们测序反应的四种碱基都是荧光标记的,这样,荧光标记的引物将产生干扰。
另外,其他一些有大的标记基团的引物也最好不要用于测序。
引物上大的标记基团将直接影响到DNA 片段的迁移率,导致测序结果峰型不好或错误。
(5)不纯的引物,测序引物对纯度的要求很高,合成的引物中非全长的片段可以造成较强的背景。
以一个20bp的测序引物为例,直接脱盐纯化的话,纯度至多在70%左右,也就是说将有30%的引物将作为背景噪音,这必将严重影响测序结果。
一般经PAGE或OPC法纯化的引物基本能达到测序的要求。
5、怎样选择(设计)测序用引物?答:测序用引物要求非常严格,不同于PCR用引物。
PCR用引物一般只要能和模板结合,3’端的几个碱基能完全配对,即使引物长达80~100多个碱基,只要调整PCR反应条件,也能成功进行PCR反应。
而测序用引物便不一样了,必须严格符合以下要求。
本公司的测序用引物全用引物设计软件Primer设计。
在本公司测序时,我们可免费帮助设计测序用引物。
(1)长度在15~25个碱基左右,一般选择20个碱基(根据GC含量作适当调整),(2)3’端尽量选择G或C碱基(但不绝对),以增加与模板的结合能力。
(3)Tm温度应选择50℃~70℃左右。
(4)GC含量应选择在50%左右,尽量避开A、T、G、C的连续结构。
(5)避开引物自身形成发夹结构或引物二聚体结构等复杂结构。
(6)保证引物和模板100%匹配,特别是3’端的几个碱基一定要100%匹配。
同时必须严格保证引物和模板之间只能有一个结合位点。
6、PCR片段直接测序和PCR片段经克隆后测序的结果有何区别?答: 众所周知,PCR圹增过程中会出现很多错配现象,但不可能所有的错配都发生在同一位置。
PCR片段直接测序时,其结果是PCR片段众多分子的混合物的结果。
如果在某一个点上出现了几十次错配现象,但大多数分子(或许是几十万个分子)在这个点上应该还是正确的,在测序时,错配现象也就是反映不出来了。
因此,PCR片段直接测序的结果反映的是PCR用模板最原始的结果。
而PCR片段经克隆后测序是测定了某一个分子的DNA序列。
在几十个循环的PCR扩增过程中,很难保证某一个分子的任何点都不发生错配。
因此,PCR片段经克隆后的测序结果,往往存在着一些错配的序列,和PCR片段直接测序的结果相比有些碱基会有所不同。
这种错配现象的多少取决于PCR扩增时使用的DNA聚合酶的保真性能。
要减少PCR扩增过程中的错配现象,在PCR反应时,请选用保真性能高的DNA聚合酶。
7、测序结果不到800Bases,还照常收费了,为什么?答:如在DNA样品中的DNA序列分布匀称,没有复杂结构时,正常的测序反应能保证达到800Bases以上。
但有一些DNA样品立体结构复杂,造成聚合酶延伸反应终止,测序信号突然减弱或消失,或者测序结果出现套峰现象,出现这些现象的原因由DNA模板本身所造成(公司保证进行2次以上的测序工作)。
对这些结果,公司会根据具体测序情况,进行收费(详细见收费约定)。
出现这些情况的原因分析如下:(1)G/C rich、G/C Cluster。
这种情况一般表现为测序信号突然减弱或消失(图1,图2)图1 G/C rich引起的信号减弱图2 G/C rich引起的信号消失(2)A,T的连续结构。
这种情况一般表现为A、T连续结构后面的测序结果出现套峰。
根据文献记载。
原因在于聚合酶进行聚合反应时,由于A或T的连续,聚合酶难以识别完整的每个A或T,在某个A或T的后面便开始进行A或T连续结构以后序列的聚合反应(打滑现象),造成测序结果紊乱,出现套峰。
一般在多少个A或T的后面能出现这种情况呢?现在还没有这方面的报道。
根据我们的经验,这一情况的出现和A或T的连续结构后面的序列的排列情况有着直接的关系。
有时10多个A或T的连续结构后面便出现套峰,但有时60~70个A 或T的连续结构后面的序列也一样可以完整地读出来。
具体情况还有待考证。
一般来说,PCR片段直接测序时,A或T的连续结构后面的序列测序结果都会出现套峰。
原因在于测序时经历了PCR反应及测序反应(测序反应本身也是PCR 反应)二次聚合酶的打滑现象。
图3 polyA引起的套峰(3)原因不明的复杂结构,测序结果出现突然信号减弱或消失。
从序列上看,DNA碱基排列并无特别异常。
估计是DNA整体出现复杂结构,从某一位置开始聚合酶的聚合反应便无法进行。
图4 复杂结构引起的信号中断8、出现套峰的原因是什么?答:在测序反应中,模板或引物的原因都可能造成套峰的形成,归结其形成原因有以下几点:(1)测序引物在模板上有两个结合位点(图5);(2)模板不纯,如果是质粒或是菌液,原因是非单克隆(图6),如果是PCR,原因为非特异性条带(图7);(3)模板序列的特殊结构,如poly结构、发卡结构等(图8);(4)引物降解,或引物不纯(图9,图10)。
(5)信号值过低或无信号(图11)。
图5 双引物结合位点引起的套峰图6 由于质粒或菌液为非单克隆引起的套峰图7 PCR为非特异性条带引起的套峰图8 模板特殊结构引起的套峰图9 引物轻微降解或引物不纯引起的套峰图10 引物严重降解或引物不纯引起的套峰图11 测序信号值太弱或无信号引起的套峰9、我为什么找不到我的PCR引物?答:以下几种情况,我们将无法找到做PCR时的引物序列(1)用PCR引物作为测序引物进行测序时,所测序列是从引物3’末端后第一个碱基开始的,所以自然就找不到您的引物序列了。
有两种方法可以得到您的引物序列。
对于较短的PCR产物(<800bp),可以用另一端的引物进行测序,从另一端测序可以一直测到序列的末端,就可以在序列的末端得到的引物的反向互补序列。
对于较长的序列,一个测序反应测不到头,因此就只能将您的PCR产物片段克隆到适当的载体中,用载体上的通用引物进行测序。
由于载体上的通用引物与您的插入序列之间有一段距离,因此就可以得到您的完整的引物序列。
由于在测序的起始端总会有一些碱基无法准确读出,因此,您如果想得到您的PCR产物的完整序列,最好克隆后进行测序。
(2)PCR产物用T载体克隆后,由于克隆的方向是随机的,因此,当您在一条链上找不到您的引物序列时,试图在互补链上寻找您的引物序列。
(3)当测序引物离您的插入片段很近时,有时可能也无法找到您的引物的全序列。
这主要是因为有时序的起始端由于未去除的染料或引物二聚体的干扰,造成起始区的序列不好,可能无法找到您的引完整序列。
(4)有时,质粒做模板进行测序时,由于某些原因,质粒上没有插入外援片段,为空载体,所测的序完全为载体序列,此时自然也找不到引物序列。
10、我的基因序列与标准序列为什么有差别?答:一段基因序列经扩增后,克隆到载体中进行测序。
在两个层次上可能导致序列发生变化。
首先在PCR扩增过程中就可能产生错误。
将片段克隆到载体中也有可能发生突变。
其次,测序的准确率问题。
ABI公司承诺其仪器的测序精度在一定范围内可以达到98。
5%以上。
由于仪器准确率的限制,在一个较长的序列中发生碱基序列错误是难以避免的。
在确认克隆无误的情况下,通过双向测序可以最大限度减少测序的错误。
您如果想得到您的最准确的序列,进行双向测序是很有必要的。
只进行简单的单向测序,我们无法保证所测序列的完全准确性,这是由仪器的精度决定的。
11、过短的PCR产物为什么不适于直接测序?答:首先过短的PCR产物纯化困难,一般的PCR产物纯化试剂盒都要求PCR产物片段大于150bp,过短的PCR产物纯化和准确定量都非常困难。
因此我们要求用于测序的PCR产物一般不低于150bp长度。
其次,由于测序技术本身的限制,测序反应对环境的干扰比较敏感,模板太短的PCR测序受外界的干扰更大,很容易造成测序失败。
12、用测序的方法检测点突变可靠吗?答:有的客户想用测序的方法检测点突变体,我认为该方法可靠性不高。
主要有以下两个原因。
首先,们并不清楚突变的序列与正常的序列的比例是多少。
测序反应的信号强度直接与模板的量有关,如果突变的模板所占的比例很少,将直接作为背景噪音了,很难检测出来。
