蛋白同化制剂
我国批准上市的蛋白同化制剂、肽类激素品种培训讲学

我国批准上市的蛋白同化制剂、肽类激素品种
一、蛋白同化制剂
序号
英文名
通用名
上市品种
1
clenbuterol
克仑特罗
盐酸克仑特罗
盐酸克仑特罗片
盐酸克仑特罗含片
盐酸克仑特罗栓
盐酸克仑特罗膜
盐酸克仑特罗气雾剂
2
danazol
达那唑
达那唑
达那唑胶囊
达那唑栓
达那唑胶丸
3
dehydroepiandrosterone
乙酰水杨酸孕烯诺龙片
苯丙酸诺龙
苯丙酸诺龙注射液
9
oxymetholone
羟甲烯龙
羟甲烯龙
10
stanozolol
司坦唑醇
司坦唑醇
司坦唑醇片
11
testosterone
睾酮
睾酮
丙酸睾酮
丙酸睾酮注射液
十一酸睾酮
十一酸睾酮注射液
十一酸睾酮胶囊
12
tiboline
替勃龙
替勃龙
替勃龙片
二、肽类激素
序号
英文名
通用名
(DHEA)
普拉睾酮
硫酸普拉睾酮钠
注射用硫酸普拉睾酮钠
4
furazabol
夫拉扎勃
trinone
孕三烯酮
孕三烯酮
孕三烯酮胶囊
6
methandienone
美雄酮
美雄酮
美雄酮片
7
methyltestosterone
甲睾酮
甲睾酮
甲睾酮片
8
nandrolone
诺龙
癸酸诺龙
乙酰水杨酸孕烯诺龙
蛋白同化制剂与肽类激素管理制度

蛋白同化制剂与肽类激素管理制度蛋白同化制剂与肽类激素是一类被广泛应用于运动员和健身爱好者的营养补充剂,其主要作用是增加肌肉质量和促进恢复。
然而,如果不正确使用或滥用这些补充剂,可能会对健康产生负面影响。
因此,建立一套科学的管理制度,对蛋白同化制剂与肽类激素的使用进行规范,是非常必要的。
一、蛋白同化制剂与肽类激素的分类蛋白同化制剂是由蛋白质分解出来的氨基酸结合在一起形成的复合物,可以提供肌肉生长和恢复所需的原料。
肽类激素是由氨基酸组成的短链肽,可以通过模拟人体内的天然激素提高肌肉生长和修复速度。
根据其来源和制备方法的不同,可将其分为以下几类:1、动物衍生的肽类激素和蛋白同化制剂,如促性腺激素、生长激素、雄激素等;2、人工制备的合成肽类激素和蛋白同化制剂,如IGF-1、IGF-2、IGF-BP等。
二、蛋白同化制剂与肽类激素管理制度的内容为有效防止滥用蛋白同化制剂与肽类激素带来的风险,需要通过制度化管理进行规范。
具体措施如下:1、明确管理部门和责任人。
运动员和健身爱好者的使用需由其所在的运动组织或健身场所、教练或营养师进行指导和管理。
2、制定使用规范。
运动员和健身爱好者在使用这些补充剂前,应进行全面的健康检查,了解其身体情况和偏好,以在规定中适当调整并合理安排剂量和使用时间。
同时,应严格禁止未成年人使用。
3、加强质量控制。
量化蛋白同化制剂与肽类激素中的营养成分含量,保证其安全性和良好质量,严禁使用未经审批的补充剂。
4、加强监管。
定期检查各运动组织和健身场所的所售补充剂,并对发现违规情况处以严厉罚款和相关责任人处罚。
5、加强宣传指导。
广泛进行有关蛋白同化制剂与肽类激素使用的知识普及,提高运动员和健身爱好者对于其安全性和副作用的认识。
三、结论建立科学的蛋白同化制剂与肽类激素管理制度对于保证运动员和健身爱好者的健康和安全至关重要。
我们需要认识到这些补充剂是辅助性营养品,必须在科学指导下合理应用,并在日常运动过程中加强身体锻炼和合理饮食,才能真正达到其肌肉生长和恢复的效果。
蛋白同化制剂肽类激素目录

蛋白同化制剂、肽类激素目录一、蛋白同化制剂品种1、雄烯二醇 androstenediol2、雄烯二酮 androstenedione3、雄烯二醇异构体 androst-4-ene-3α,17α-diol4、雄-4-烯-3α,17β-二醇 androst-4-ene-3α,17β-diol5、雄-4-烯-3β,17α-二醇 androst-4-ene-3β,17α-diol6、雄-5-烯-3α,17α-二醇 androst-5-ene-3α,17α-diol7、雄-5-烯-3α,17β-二醇 androst-5-ene-3α,17β-diol8、雄-5-烯-3β,17α-二醇 androst-5-ene-3β,17α-diol9、雄-4-烯二醇 4-androstenediol androst-4-ene-3β,17β-diol10、雄烯二酮异构体 5-androstenedione11、阿法雄烷二醇5α-androstane-3α,17α-diol12、倍他雄烷二醇异构体5α-androstane-3α,17β-diol13、雄烷二醇异构体5α-androstane-3β,17α-diol14、倍他雄烷二醇5α-androstane-3β,17β-diol15、勃拉睾酮双甲睾酮 bolasterone16、勃地酮宝丹酮 boldenone17、1,4-雄二烯-3,17-二酮 boldione18、卡普睾酮 calusterone19、克仑特罗 clenbuterol20、氯司替勃氯斯太宝 clostebol21、达那唑 danazol22、脱氢氯甲基睾酮 dehydrochloromethyltestosterone23、雄-1-烯-3,17-二酮 deltal-androstene-3,17-dione24、Δ雄烯二醇 deltal-androstenediol25、普拉雄酮 dehydroepiandrosteroneDHEA26、去氧甲基睾酮 desoxymethyltestosterone27、双氢睾酮 dihydrotestosterone28、屈他雄酮羟甲雄酮 drostanolone29、5α-雄烷-3β,17β-二醇 drostanediol30、表双氢睾酮 epi-dihydrotestosterone31、乙烯雌醇 ethylestrenol32、氟甲睾酮 fluoxymesterone33、甲酰勃龙醛甲宝龙 formebolone34、呋咱甲氢龙夫拉扎勃 furazabol35、孕三烯酮 gestrinone36、4-羟基睾酮 4-hydroxytestosterone37、4-羟基诺龙 4-hydroxy-19-nortestosterone38、3α-羟基-5α-雄烷-17-酮3α-hydroxy-5α-androstan-17-one39、3β-羟基-5α-雄烷-17-酮3β-hydroxy-5α-androstan-17-one40、美雄诺龙 mestanolone41、美睾酮 mesterolone42、美雄酮 methandienone43、2α,17α-二甲基-5α-雄烷-3-酮-17β-醇 methasterone44、17α-甲基-17β-羟基雌-4,910-二烯-3-酮 methyldienolone45、甲基-1-睾酮 methyl-1-testosterone46、甲基去甲睾酮 methylnortestosterone47、17α-甲基-17β-羟基雌-4,9,11-三烯-3-酮 methyltrienolone48、美替诺龙 metenolone49、美雄醇 methandriol50、甲睾酮 methyltestosterone52、诺龙 nandrolone53、19-去甲雄烯二醇 19-norandrostenediol54、19-去甲雄烯二酮 19-norandrostenedione55、去甲雄酮 19-norandrosterone56、诺勃酮 norboletone57、诺司替勃 norclostebol58、诺乙雄龙乙基诺龙 norethandrolone59、19-去甲本胆烷醇酮 19-noretiocholanolone60、羟勃龙氧宝龙 oxabolone61、氧雄龙氧甲氢龙 oxandrolone62、羟甲睾酮 oxymesterone63、羟甲烯龙 oxymetholone64、3,2-c吡唑-5α-苯别胆烷-17β-4氢吡喃醇 prostanozol65、奎勃龙 quinbolone66、司坦唑醇 stanozolol67、司腾勃龙 stenbolone69、睾酮 testosterone70、四氢孕三烯酮 tetrahydrogestrinone71、替勃龙 tibolone72、群勃龙追宝龙 trenbolone73、折仑诺 zeranol74、齐帕特罗 zilpaterol二、肽类激素品种75、促皮质素 Corticotrophins76、促红细胞生成素EPO ErythropoietinEPO77、促性腺激素 GonadotrophinsLH,hCG78、生长激素 Growth hormonehGH79、胰岛素 Insulin80、胰岛素样生长因子 1 Insulin-lkie Growth FactorIGF-181、生长因子素 Mechano Growth Factors MGFs 注:1.目录所列物质包括其可能存在的盐及光学异构体;2.目录所列物质包括其原料药及单方制剂;3.目录所列蛋白同化制剂品种包括其可能存在的盐、酯、醚及光学异构体;4.括号内为参考译名,带为暂译。
蛋白同化制剂品种
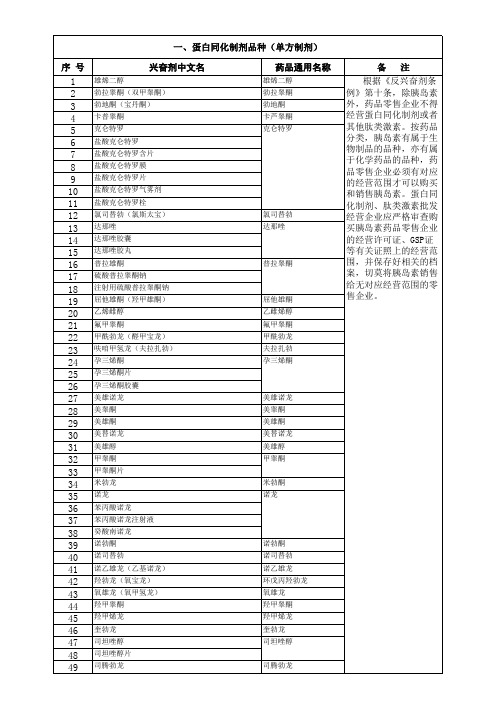
根据《反兴奋剂条 例》第十条,除胰岛素 外,药品零售企业不得 经营蛋白同化制剂或者 其他肽类激素。按药品 分类,胰岛素有属于生 物制品的品种,亦有属 于化学药品的品种,药 品零售企业必须有对应 的经营范围才可以购买 和销售胰岛素。蛋白同 化制剂、肽类激素批发 经营企业应严格审查购 买胰岛素药品零售企业 的经营许可证、GSP证 等有关证照上的经营范 围,并保存好相关的档 案,切莫将胰岛素销售 给无对应经营范围的零 售企业。
药品通用名称
雄烯二醇 勃拉睾酮 勃地酮 卡8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49
一、蛋白同化制剂品种(单方制剂) 序 号 兴奋剂中文名
雄烯二醇 勃拉睾酮(双甲睾酮) 勃地酮(宝丹酮) 卡普睾酮 克仑特罗 盐酸克仑特罗 盐酸克仑特罗含片 盐酸克仑特罗膜 盐酸克仑特罗片 盐酸克仑特罗气雾剂 盐酸克仑特罗栓 氯司替勃(氯斯太宝) 达那唑 达那唑胶囊 达那唑胶丸 普拉雄酮 硫酸普拉睾酮钠 注射用硫酸普拉睾酮钠 屈他雄酮(羟甲雄酮) 乙烯雌醇 氟甲睾酮 甲酰勃龙(醛甲宝龙) 呋咱甲氢龙(夫拉扎勃) 孕三烯酮 孕三烯酮片 孕三烯酮胶囊 美雄诺龙 美睾酮 美雄酮 美替诺龙 美雄醇 甲睾酮 甲睾酮片 米勃龙 诺龙 苯丙酸诺龙 苯丙酸诺龙注射液 癸酸南诺龙 诺勃酮 诺司替勃 诺乙雄龙(乙基诺龙) 羟勃龙(氧宝龙) 氧雄龙(氧甲氢龙) 羟甲睾酮 羟甲烯龙 奎勃龙 司坦唑醇 司坦唑醇片 司腾勃龙 司腾勃龙 诺勃酮 诺司替勃 诺乙雄龙 环戊丙羟勃龙 氧雄龙 羟甲睾酮 羟甲烯龙 奎勃龙 司坦唑醇 米勃酮 诺龙 美雄诺龙 美睾酮 美雄酮 美替诺龙 美雄醇 甲睾酮 屈他雄酮 乙雌烯醇 氟甲睾酮 甲酰勃龙 夫拉扎勃 孕三烯酮 普拉睾酮 氯司替勃 达那唑
蛋白同化制剂肽类激素管理制度

目的:为贯彻执行《反兴奋剂条例》等法律法规,进一步落实兴奋剂管理的有关规定,制定本制度。
范围:适用于本公司蛋白同化制剂、肽类激素药品经营过程的控制和管理。
责任:质量管理部、采购部、销售部、储运部对本制度实施负责。
内容:1、蛋白同化制剂是指所有的合成雄性激素类固醇都有与睾酮相似的化学结构。
这类药物除具有增加肌肉块头和力量,并在主动或被动减轻体重时保持肌肉体积的作用外,还具有雄激素的作用。
为此应加强对蛋白同化制剂、肽类激素药品控制。
对蛋白同化制剂、肽类激素药品购销业务实行专人和全程计算机管理,并建立专账。
2、采购蛋白同化制剂、肽类激素药品,只能从具备经营条件,并经食品药品监督管理部门批准的药品生产企业、药品经营企业购进,不得从任何非法渠道采购;采购人员负责收集供货单位相关证照及合法资质材料,查验所在地药品监督管理部门批准的专门从事蛋白同化制剂、肽类激素的证明文件,录入计算机系统提交质管部和质量副总审核批准,作为基础数据,建立合格供货方档案,并随时掌握变动情况;指定专人签订采购合同和质量保证协议书,并加盖公章、注明交货方式和交货地点。
3、本公司只能向具有蛋白同化制剂、肽类激素经营资格的医疗机构和药品批发企业供应蛋白同化制剂、肽类激素;本公司只能向药品零售企业供应肽类激素中的胰岛素,其他蛋白同化制剂及肽类激素的药品不得向药品零售企业供货;销售人员负责收集购货单位合法资格的资质文件,核实购货单位采购人员或提货人员的身份证明等,并应经质管部审核。
通过计算机系统自动识别和控管证照期限和经营范围;销售部负责建立购货单位档案,随时掌握购货单位变动情况。
档案内容包括:购货单位被指定为蛋白同化制剂、肽类激素药品经营单位的批准文件、医疗机构的合法证照等资质证明材料、采购人员身份证明(与原件核对)、法人委托书(注明授权范围、期限)等;蛋白同化制剂、肽类激素药品禁止使用现金进行交易,但可实行刷卡销售。
4、蛋白同化制剂、肽类激素药品的收货验收、储存保管、养护、出库复核及运输的管理:蛋白同化制剂、肽类激素药品实行双人验收,验收合格后,移交专管员储存于专用仓库内。
蛋白同化制剂和肽类激素目录

65
甲二烯诺龙
66
甲诺睾酮
67
甲睾酮
68
美曲勃龙
69
米勃酮
70
诺龙
71
诺勃酮
72
诺司替勃
73
诺乙雄龙
74
羟勃龙
75
氧雄龙
76
羟甲睾酮
77
羟甲烯龙
78
普拉睾酮
79
前列他唑*
80
奎勃龙
81
3-甲基-4-[[(1R,2S)-1-[5-(4-氰基苯基)-1,3,4-噁二唑-2-基]-2-羟基丙基]氨基]-2-氯苯甲腈
一、蛋白同化制剂目录
序号
名称
别名
1
1-雄烯二醇
2
1-雄烯二酮
3
1-雄酮
3α-羟基-5α-雄甾-1-烯-17-酮
4
1-表雄酮
3β-羟基-5α-雄甾-1-烯-17-酮
5
1-睾酮
6
2-雄烯醇
5α-雄甾-2-烯-17-醇
7
2-雄酮
5α-雄烷-2-烯-17-酮
8
3-雄烯醇
5α-雄甾-3-烯-17-醇
9
3-雄烯酮
雄甾-5-烯-3β,17β-二醇
33
4-雄烯二酮
雄甾-4-烯-3,17-二酮
34
雄酮
35
勃拉睾酮
36
勃地酮
37
1,4-雄烯二酮
雄甾-1,4-二烯-3,17-二酮
38
卡芦睾酮
39
克仑特罗
40
氯司替勃
41
达那唑
42
去氢氯甲睾酮
43
(脱氢氯甲睾酮)
44
蛋白同化制剂、肽类激素管理制度

蛋白同化制剂、肽类激素管理制度蛋白同化制剂和肽类激素是现代运动员和健身爱好者常用的增肌、减脂工具。
它们能够提高肌肉合成和蛋白质同化作用,帮助人们更快地增加肌肉质量和改善身体组成。
然而,滥用蛋白同化制剂和肽类激素的行为也存在一定的风险,需要制定相应的管理制度来保障运动员和健身爱好者的健康。
本文将从蛋白同化制剂和肽类激素的基本概念入手,介绍其用途和作用机制。
随后,将详细讨论现行的管理制度并提出改进方案。
最后,结合国际经验和相关研究,给出一些使用蛋白同化制剂和肽类激素的健康建议。
一、蛋白同化制剂和肽类激素的基本概念1. 蛋白同化制剂蛋白同化制剂是一类通过摄入外源性的蛋白质或氨基酸来促进肌肉合成和蛋白质同化作用的物质。
常见的蛋白同化制剂有乳清蛋白粉、氨基酸片剂和肌酸等。
它们通过提供充足的氨基酸供体,帮助身体更好地吸收和利用蛋白质,从而提高肌肉合成的速度和效果。
2. 肽类激素肽类激素是一类生物活性肽,通过促进内分泌系统的调节和作用机制来增加肌肉质量和改善身体组成。
常用的肽类激素有生长激素、胰岛素样生长因子-1(IGF-1)和促性腺激素释放激素(GnRH)等。
它们通过直接或间接地调节体内的生长激素和雄激素水平,促进肌肉合成和蛋白质同化。
二、蛋白同化制剂和肽类激素的管理制度1. 国际体育比赛场合的管理制度国际奥委会(IOC)和国际大众体育协会(IFBB)等组织为保障比赛的公平性和运动员的健康,制定了严格的管理制度。
根据这些制度,运动员在国际比赛中使用蛋白同化制剂和肽类激素需要遵守以下规定:(1)提交使用申请:运动员需要提前向组织委员会或反兴奋剂机构提交使用蛋白同化制剂和肽类激素的申请,附加医疗证明和相关实验报告。
(2)尿液检测:组织委员会或反兴奋剂机构会对运动员进行尿液检测,以确保其没有滥用禁用物质。
如果尿液检测呈阳性,运动员将被取消参赛资格并面临处罚。
(3)禁用物质清单:国际奥委会和国际大众体育协会等组织会定期更新禁用物质清单,明确禁用蛋白同化制剂和肽类激素的使用。
蛋白同化制剂_英语_解释说明以及概述

蛋白同化制剂英语解释说明以及概述1. 引言1.1 概述蛋白同化制剂是一种在运动、健身、医疗和养老保健等领域广泛应用的营养补充品。
它通过提供高质量蛋白质以及其他必需的营养物质,促进人体对蛋白质的吸收和利用,并帮助维持身体组织的正常生理功能。
本文将着重探讨蛋白同化制剂的定义、原理、应用领域以及其优缺点。
1.2 文章结构本文共分为五个部分进行讨论。
引言部分主要概述了文章内容,介绍了蛋白同化制剂的基本情况。
接下来,第二部分将详细阐述蛋白同化制剂的定义和原理,包括其在人体内发挥作用的机制以及各类蛋白同化制剂的分类情况。
第三部分将探讨蛋白同化制剂在运动与健身、医疗以及养老保健领域中的应用情况,并列举相关实例进行说明。
第四部分将从优点和缺点两个方面对蛋白同化制剂进行分析,以便读者全面了解其利弊。
最后,结论部分将对本文所述内容进行总结,并提出相关启示。
1.3 目的本文旨在深入探讨蛋白同化制剂这一营养补充品的定义、原理、应用领域以及优缺点,并为读者提供更全面的知识和了解。
希望通过本文的阐述,能够使读者对蛋白同化制剂有更清晰的认识,从而在实际应用场景中做出明智的决策。
2. 蛋白同化制剂的定义和原理2.1 定义蛋白同化制剂是指通过加工处理,将蛋白质提取、分离、浓缩等技术手段应用于食品或药物中,以增强蛋白质的利用率和吸收效果。
它们通常被设计成含有高浓度的优质蛋白质,并且易于消化和吸收。
2.2 蛋白同化过程当人体摄取蛋白质后,消化系统会将其分解成小分子的氨基酸,然后通过肠道壁进入血液循环系统。
这些氨基酸会被身体利用来修复和合成组织,以及其他重要的生物过程。
蛋白同化制剂则在这个过程中起到了促进作用。
2.3 蛋白同化制剂的分类根据来源不同可以将蛋白同化制剂分为动物源性和植物源性两类。
动物源性蛋白同化制剂主要来源于奶制品(如乳清蛋白)、动物肌肉组织(如鱼肉、禽肉)等。
这些制剂含有丰富的必需氨基酸,尤其是支链氨基酸(BCAA),对于肌肉修复和生长非常重要。
我国批准上市的蛋白同化制剂
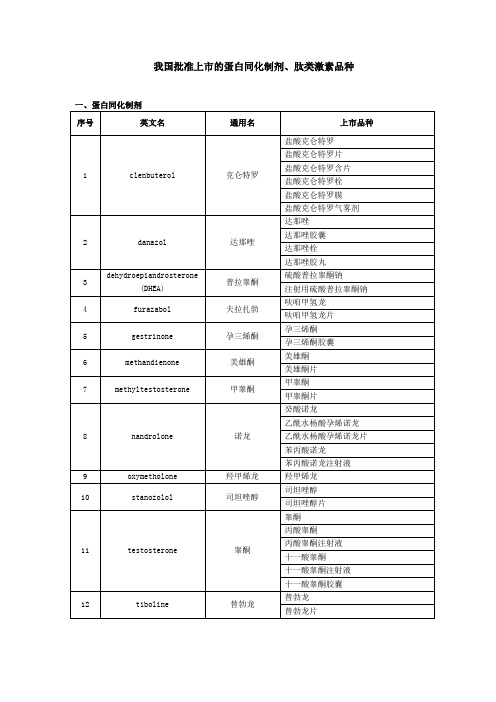
一、蛋白同化制剂
序号
英文名
通用名
上市品种
1
clenbuterol
克仑特罗
盐酸克仑特罗
盐酸克仑特罗片
盐酸克仑特罗含片
盐酸克仑特罗栓
盐酸克仑特罗膜
盐酸克仑特罗气雾剂
2
danazol
达那唑
达那唑
达那唑胶囊
达那唑栓
达那唑胶丸
3
dehydroepiandrosterone
(DHEA)
普拉睾酮
硫酸普拉睾酮钠
注射用硫酸普拉睾酮钠
4
furazabol
夫拉扎勃
呋咱甲氢龙
呋咱甲氢龙片
5
gestrinone
孕三烯酮
孕三烯酮
孕三烯酮胶囊
6
methandienone
美雄酮
美雄酮
美雄酮片
7
methyltestosterone
甲睾酮
甲睾酮
甲睾酮片
8
nandrolone
诺龙
癸酸诺龙
乙酰水杨酸孕烯诺龙
精蛋白锌胰岛素注射液
精蛋白重组人胰岛素注射液
精蛋白锌重组人胰岛素混合注射液
低精蛋白锌胰岛素注射液
低精蛋白重组人胰岛素注射液
生物合成人胰岛素注射液
精蛋白生物合成人胰岛素注射液
注射用重组人生长激素
17
Insulin
胰岛素
胰岛素
重组人胰岛素
重组赖脯胰岛素
胰岛素注射液
重组人胰岛素注射液
常规重组人胰岛素注射液
30/70混合重组人胰岛素注射液
50/50混合重组人胰岛素注射液
中性胰岛素注射液
蛋白同化制剂

附件1:蛋白同化制剂、肽类激素品种名单一、蛋白同化制剂品种:1.雄烯二醇2.雄烯二酮*3.雄烯二醇(异构体)4.雄-4-烯-3α,17β-二醇*5.雄-4-烯-3β,17α-二醇*6.雄-5-烯-3α,17α-二醇*7.雄-5-烯-3α,17β-二醇*8.雄-5-烯-3β,17α-二醇*9.雄-4-烯二醇*10.雄烯二酮异构体11.阿法雄烷二醇12.倍他雄烷二醇异构体13.雄烷二醇异构体14.倍他雄烷二醇15.勃拉睾酮(双甲睾酮)16.勃地酮(宝丹酮)17.1,4-雄二烯-3,17-二酮*18.卡普睾酮19.克仑特罗20.氯司替勃(氯斯太宝)21.达那唑22.脱氢氯甲基睾酮*23.雄-1-烯-3,17-二酮*24.(Δ)雄烯二醇25.普拉雄酮*26.脱氧甲基睾酮*27.双氢睾酮28.屈他雄酮(羟甲雄酮)29.5α-雄烷-3β,17β-二醇*30.表双氢睾酮31.乙烯雌醇32.氟甲睾酮33.甲酰勃龙(醛甲宝龙)34.呋咱甲氢龙(夫拉扎勃)35.孕三烯酮36.4-羟基睾酮37.4-羟基诺龙38.3α-羟基-5α-雄烷-17-酮*39.3β-羟基-5β-雄烷-17-酮*40.美雄诺龙41.美睾酮42.美雄酮43.2α,17α-二甲基-5α-雄烷-3-酮-17β-醇44.17α-甲基-17β-羟基雌-4,9(10)-二烯-3-酮*45.甲基-1-睾酮*46.甲基去甲睾酮*47.17α-甲基-17β-羟基雌-4,9,11-三烯-3-酮*48.美替诺龙49.美雄醇50.甲睾酮51.米勃龙*52.诺龙53.19-去甲雄烯二醇*54.19-去甲雄烯二酮*55.去甲雄酮56.诺勃酮57.诺司替勃58.诺乙雄龙(乙基诺龙)59.19-去甲本胆烷醇酮*60.羟勃龙(氧宝龙)61.氧雄龙(氧甲氢龙)62.羟甲睾酮63.羟甲烯龙64.[3,2-c]吡唑-5α-苯别胆烷-17β-4氢吡喃醇*65.奎勃龙66.司坦唑醇67.司腾勃龙68.1-睾酮69.睾酮70.四氢孕三烯酮71.替勃龙72.群勃龙(追宝龙)73.折仑诺74.齐帕特罗二、肽类激素品种1.促皮质素2.促红细胞产生素(EPO)3.促性腺激素4.生长激素5.胰岛素6.胰岛素样生长因子17.生长因子素注:1.目录所列物质包括其可能存在的盐及光学异构体;2.目录所列物质包括其原料药及单方制剂;3.目录所列蛋白同化制剂品种包括其可能存在的盐、酯、醚及光学异构体;4.括号内为参考译名,带*为暂译名;5.蛋白同化制剂和肽类激素项下具有商品编码的品种,进出口时需办理进出口准许证。
蛋白同化制剂和肽类激素单方制剂目录

蛋白同化制剂和肽类激素单方制剂目录一、蛋白同化制剂品种(单方制剂)兴奋剂中文名药品通用名称雄烯二醇雄烯二醇勃拉睾酮(双甲睾酮)勃拉睾酮勃地酮(宝丹酮)勃地酮卡普睾酮卡芦睾酮克仑特罗克仑特罗盐酸克仑特罗盐酸克仑特罗含片盐酸克仑特罗膜盐酸克仑特罗片盐酸克仑特罗气雾剂盐酸克仑特罗栓氯司替勃(氯斯太宝)氯司替勃达那唑达那唑达那唑胶囊达那唑胶丸普拉雄酮普拉睾酮硫酸普拉睾酮钠注射用硫酸普拉睾酮钠屈他雄酮(羟甲雄酮)屈他雄酮乙烯雌醇乙雌烯醇氟甲睾酮氟甲睾酮甲酰勃龙(醛甲宝龙)甲酰勃龙呋咱甲氢龙(夫拉扎勃)夫拉扎勃孕三烯酮孕三烯酮孕三烯酮片孕三烯酮胶囊美雄诺龙美雄诺龙美睾酮美睾酮美雄酮美雄酮美替诺龙美替诺龙美雄醇美雄醇甲睾酮甲睾酮甲睾酮片米勃龙米勃酮诺龙诺龙苯丙酸诺龙苯丙酸诺龙注射液癸酸南诺龙诺勃酮诺勃酮诺司替勃诺司替勃诺乙雄龙(乙基诺龙)诺乙雄龙羟勃龙(氧宝龙)环戊丙羟勃龙氧雄龙(氧甲氢龙)氧雄龙羟甲睾酮羟甲睾酮羟甲烯龙羟甲烯龙奎勃龙奎勃龙司坦唑醇司坦唑醇司坦唑醇片司腾勃龙司腾勃龙睾酮睾酮丙酸睾酮丙酸睾酮注射液庚酸睾酮十一酸睾酮十一酸睾酮胶囊十一酸睾酮胶丸十一酸睾酮软胶囊十一酸睾酮注射液替勃龙替勃龙替勃龙片群勃龙(追宝龙)群勃龙折仑诺泽仑诺齐帕特罗齐帕特罗二、肽类激素品种(单方制剂)兴奋剂中文名药品通用名称促皮质素促皮质素注射用促皮质素促红细胞生成素(EPO)重组人促红素重组人促红素注射液促性腺激素绒促性素注射用绒促性素生长激素重组人生长激素重组人生长激素溶液重组人生长激素注射液注射用重组人生长激素胰岛素胰岛素重组赖脯胰岛素重组人胰岛素胰岛素注射液中性胰岛素注射液精蛋白锌胰岛素注射液(30%)精蛋白锌胰岛素注射液重组人胰岛素注射液精蛋白重组人胰岛素注射液赖脯胰岛素注射液精蛋白锌重组人胰岛素混合注射液精蛋白锌重组赖脯人胰岛素混合注射液(25R) 常规重组人胰岛素注射液30/70混合重组人胰岛素注射液精蛋白生物合成人胰岛素注射液门冬胰岛素注射液双时相低精蛋白锌重组人胰岛素注射液低精蛋白锌胰岛素注射液重组赖脯胰岛素注射液重组甘精胰岛素注射液中性胰岛素注射液低精蛋白重组人胰岛素注射液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白同化制剂、肽类激素进出口管理办法暂行局令第25号2006年07月28日发布《蛋白同化制剂、肽类激素进出口管理办法(暂行)》经过国家食品药品监督管理局、中华人民共和国海关总署、国家体育总局审议通过,现以国家食品药品监督管理局局令顺序号发布。
本办法自2006年9月1日起施行。
国家食品药品监督管理局中华人民共和国海关总署局长:邵明立署长:牟新生国家体育总局局长:刘鹏二○○六年七月二十八日蛋白同化制剂、肽类激素进出口管理办法(暂行)第一条为规范蛋白同化制剂、肽类激素的进出口管理,根据《中华人民共和国药品管理法》、《中华人民共和国海关法》、《反兴奋剂条例》等法律、行政法规,制定本办法。
第二条国家对蛋白同化制剂、肽类激素实行进出口准许证管理。
第三条进口蛋白同化制剂、肽类激素,进口单位应当向国家食品药品监督管理局提出申请。
第四条进口供医疗使用的蛋白同化制剂、肽类激素,进口单位应当报送以下资料:(一)药品进口申请表;(二)购货合同或者订单复印件;(三)《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)复印件;(四)进口单位的《药品经营许可证》、《企业法人营业执照》、《进出口企业资格证书》(或《对外贸易经营者备案登记表》)、《组织代码证书》复印件;药品生产企业进口本企业所需原料药和制剂中间体(包括境内分包装用制剂),应当报送《药品生产许可证》、《企业法人营业执照》、《组织代码证书》复印件;(五)《进口药品注册证》(或者《医药产品注册证》)持有者如委托其他公司代理出口其药品的,需提供委托出口函。
上述各类复印件应当加盖进口单位公章。
第五条因教学、科研需要而进口蛋白同化制剂、肽类激素的,进口单位应当报送以下资料:(一)药品进口申请表;(二)购货合同或者订单复印件;(三)国内使用单位合法资质的证明文件、药品使用数量的测算依据以及使用单位出具的合法使用和管理该药品保证函;(四)相应科研项目的批准文件或相应主管部门的批准文件;(五)接受使用单位委托代理进口的,还需提供委托代理协议复印件和进口单位的《企业法人营业执照》、《进出口企业资格证书》(或《对外贸易经营者备案登记表》)、《组织代码证书》复印件。
上述各类复印件应当加盖进口单位公章。
第六条境内企业因接受境外企业委托生产而需要进口蛋白同化制剂、肽类激素的,除需报送本办法第五条第一款第(一)项、第(三)项、第(五)项规定的资料外,还应当提供已向所在地省、自治区、直辖市(食品)药品监督管理部门备案的证明文件。
上述各类复印件应当加盖进口单位公章。
第七条国家食品药品监督管理局收到进口申请及有关资料后,应当于15个工作日内作出是否同意进口的决定;对同意进口的,发给药品《进口准许证》;对不同意进口的,应当书面说明理由。
第八条进口单位凭国家食品药品监督管理局核发的药品《进口准许证》向允许药品进口的口岸海关申报,海关凭药品《进口准许证》验放。
进口蛋白同化制剂、肽类激素无需办理《进口药品通关单》。
第九条进口供医疗使用的蛋白同化制剂、肽类激素(包括首次在中国销售的),进口单位应于进口手续完成后,及时填写《进口药品报验单》,持《进口药品注册证》(或者《医药产品注册证》)原件(正本或者副本)、药品《进口准许证》原件,向进口口岸(食品)药品监督管理部门报送下列资料一式两份,申请办理《进口药品口岸检验通知书》:(一)《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)和药品《进口准许证》复印件;(二)进口单位的《药品生产许可证》或者《药品经营许可证》复印件,《企业法人营业执照》复印件;(三)原产地证明复印件;(四)购货合同复印件;(五)装箱单、提运单和货运发票复印件;(六)出厂检验报告书复印件;(七)药品说明书及包装、标签的式样(原料药和制剂中间体除外)。
上述各类复印件应当加盖进口单位公章。
第十条口岸(食品)药品监督管理部门接到《进口药品报验单》及相关资料,审查无误后,将《进口药品注册证》(或者《医药产品注册证》)(正本或者副本)原件、药品《进口准许证》原件交还进口单位,并应当于当日向负责检验的口岸药品检验所发出《进口药品口岸检验通知书》,附本办法第九条规定的资料一份。
口岸药品检验所接到《进口药品口岸检验通知书》后,应当在2个工作日内与进口单位联系,到存货地点进行抽样,抽样完成后,应当在药品《进口准许证》原件第一联背面注明“已抽样”字样,并加盖抽样单位的公章。
第十一条因教学、科研需要而进口的蛋白同化制剂、肽类激素以及境内企业接受境外企业委托生产而需要进口的蛋白同化制剂、肽类激素,予以免检。
第十二条有下列情形之一的,口岸(食品)药品监督管理部门应当及时将有关情况报告国家食品药品监督管理局:(一)口岸(食品)药品监督管理部门根据《药品进口管理办法》(国家食品药品监督管理局、海关总署令第4号)第十七条规定,不予发放《进口药品口岸检验通知书》的;(二)口岸药品检验所根据《药品进口管理办法》第二十五条规定,不予抽样的。
口岸(食品)药品监督管理部门对符合前款规定并已进口的全部药品,应当采取查封、扣押的行政强制措施,并于查封、扣押之日起7日内作出准予退运决定,通知进口单位按照本办法规定的蛋白同化制剂、肽类激素出口程序办理药品《出口准许证》,将进口药品全部退回原出口国。
进口单位收到准予退运决定之日起10日内不答复或者未明确表示退运的,已查封、扣押的药品由口岸(食品)药品监督管理部门监督销毁。
第十三条进口的蛋白同化制剂、肽类激素经口岸药品检验所检验不符合标准规定的,进口单位应当在收到《进口药品检验报告书》后2日内,将全部进口药品流通、使用的详细情况,报告所在地口岸(食品)药品监督管理部门。
口岸(食品)药品监督管理部门收到《进口药品检验报告书》后,应当及时采取对全部药品予以查封、扣押的行政强制措施,并在7日内做出是否立案的决定。
进口单位未在规定时间内提出复验或者经复验仍不符合标准规定的,口岸(食品)药品监督管理部门应当作出准予退运决定,通知进口单位按照本办法规定的蛋白同化制剂、肽类激素出口程序办理药品《出口准许证》,将进口药品全部退回原出口国。
进口单位收到准予退运决定之日起10日内不答复或者未明确表示退运的,由口岸(食品)药品监督管理部门监督销毁。
经复验符合标准规定的,口岸(食品)药品监督管理部门应当解除查封、扣押的行政强制措施。
口岸(食品)药品监督管理部门应当将按照本条第二款、第三款、第四款规定处理的情况及时报告国家食品药品监督管理局,同时通告各省、自治区、直辖市(食品)药品监督管理部门和其他口岸(食品)药品监督管理部门。
第十四条国内药品生产企业、经营企业以及医疗机构采购进口蛋白同化制剂、肽类激素时,供货单位应当提供《进口药品注册证》(或者《医药产品注册证》)复印件、药品《进口准许证》复印件和《进口药品检验报告书》复印件,并在上述各类复印件上加盖供货单位公章。
第十五条出口蛋白同化制剂、肽类激素,出口单位应当向所在地省、自治区、直辖市(食品)药品监督管理部门提出申请,报送下列资料:(一)药品出口申请表;(二)进口国家或地区的药品管理机构提供的进口准许证正本(或者复印件及公证文本)。
如进口国家或地区对蛋白同化制剂、肽类激素进口尚未实行许可证管理制度,需提供进口国家的药品管理机构提供的该类药品进口无需核发进口准许证的证明文件(正本)以及以下文件之一:1.进口国家或地区的药品管理机构提供的同意进口该药品的证明文件正本(或者复印件及公证文本);2.进口单位合法资质的证明文件和该药品用途合法的证明文件正本(或者复印件及公证文本);(三)购货合同或者订单复印件(自营产品出口的生产企业除外);(四)外销合同或者订单复印件;(五)出口药品如为国内药品生产企业经批准生产的品种,须提供该药品生产企业的《药品生产许可证》、《企业法人营业执照》及药品的批准证明文件复印件;出口药物如为境内企业接受境外企业委托生产的品种,须提供已向所在地省、自治区、直辖市(食品)药品监督管理部门备案的证明文件复印件;(六)出口企业的《企业法人营业执照》、《进出口企业资格证书》(或《对外贸易经营者备案登记表》)、《组织代码证书》复印件。
上述各类复印件应当加盖出口单位公章。
第十六条按照本办法第十二条、第十三条规定退运的,申请药品《出口准许证》时,应当提供下列资料:(一)出口国原出口单位申请退货的证明材料;(二)药品《进口准许证》。
第十七条省、自治区、直辖市(食品)药品监督管理部门收到出口申请及有关资料后,应当于15个工作日内作出是否同意出口的决定;对同意出口的,发给药品《出口准许证》;对不同意出口的,应当书面说明理由。
对根据本办法第十六条规定申请办理药品《出口准许证》的,发证机关应当在药品《出口准许证》上注明“原货退回”字样。
第十八条出口单位凭省、自治区、直辖市(食品)药品监督管理部门核发的药品《出口准许证》向海关办理报关手续。
海关凭药品《出口准许证》验放。
第十九条进出口单位在办理报关手续时,应多提交一联报关单,并向海关申请签退该联报关单。
海关凭药品《进口准许证》、《出口准许证》在该联报关单上加盖“验讫章”后退进出口单位。
海关按照出证的相关规定收取工本费。
进出口完成后1个月内,进出口单位应当将药品《进口准许证》、《出口准许证》的第一联、海关签章的报关单退回发证机关。
取得药品进出口准许证后未进行相关进出口贸易的,进出口单位应当于准许证有效期满后1个月内将原准许证退回发证机关。
第二十条药品《进口准许证》有效期1年。
药品《出口准许证》有效期不超过3个月(有效期时限不跨年度)。
药品《进口准许证》、《出口准许证》实行“一证一关”,只能在有效期内一次性使用,证面内容不得更改。
因故延期进出口的,可以持原进出口准许证办理一次延期换证手续。
第二十一条药品《进口准许证》、《出口准许证》如有遗失,进出口单位应立即向原发证机关书面报告挂失。
原发证机关收到挂失报告后,通知口岸海关。
原发证机关经核实无不良后果的,予以重新补发。
第二十二条药品《进口准许证》、《出口准许证》由国家食品药品监督管理局统一印制。
第二十三条以加工贸易方式进出口蛋白同化制剂、肽类激素的,海关凭药品《进口准许证》、《出口准许证》办理验放手续并实施监管。
确因特殊情况无法出口的,移交货物所在地(食品)药品监督管理部门按规定处理,海关凭有关证明材料办理核销手续。
第二十四条保税区、出口加工区及其他海关特殊监管区域和保税监管场所与境外进出及海关特殊监管区域、保税监管场所之间进出的蛋白同化制剂、肽类激素,免予办理药品《进口准许证》、《出口准许证》,由海关实施监管。
从保税区、出口加工区及其他海关特殊监管区域和保税监管场所进入境内区外的蛋白同化制剂、肽类激素,应当办理药品《进口准许证》。
