高三化学原子结构和化学键专题
原子结构和化学键

形成条件
在金属晶体中,自由电子在金属 原子之间流动,形成金属键。
特点
金属键没有方向性和饱和性,其 强度较弱。
分子间作用力与氢键
定义
分子间作用力是分子之间的相互作用力,包括范德华力、 诱导力和色散力;氢键是水分子之间通过氢原子和氧原子 之间的相互作用力形成的。
特点
分子间作用力较弱,而氢键的强度相对较强。
STEP 01
STEP 02
STEP 03
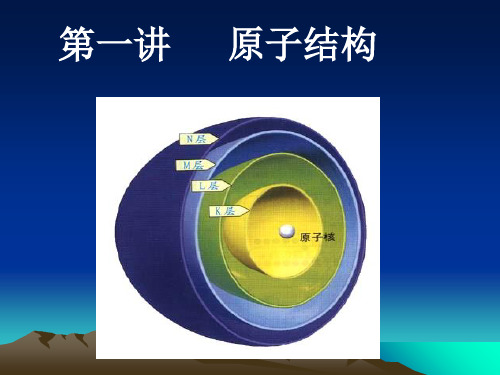
原子核具有正电荷,其电荷数 等于质子数,与核外电子数相 匹配,因此整个原子呈电中性 。
质子数决定了元素的种类, 而中子数则决定了同位素 的存在。
原子核是原子的核心部分, 由质子和中子组成。
电子云与电子轨道
电子云是描述电子在 原子周围空间分布的 概率密度。
电子云和电子轨道描 述了电子在原子周围 的空间位置和运动状 态。
形成条件
分子间作用力广泛存在于各种分子之间;氢键只存在于特 定的分子之间,如水分子和氨分子。
实例
气体、液体和固态物质中的分子之间的相互作用都是分子 间作用力;水分子之间的相互作用是氢键的一个实例。
Part
03
原子结构与化学键的关系
电子排布与化学键类型
电子排布
原子的电子排布决定了其化学性质,进而影响化学键的形成。例如,稀有气体元素的外 层电子数通常为全满或半满状态,因此不易形成化学键。
力,通过正负离子的静电作用
力来连接两个原子或分子。
实例 4
食盐、氢氧化钠等化合物
中的化学键都是离子键。
形成条件
2
当金属原子失去电子或非
金属原子获得电子时,离
子键形成。
特点
3
离子键具有方向性,其强
高三化学原子结构化学键及分子结构晶体结构

证对市爱幕阳光实验学校高三化学原子结构、化学键及分子结构、晶体结构【本讲信息】 一. 教学内容:物质结构⎪⎩⎪⎨⎧晶体结构化学键及分子结构原子结构二. 教学要求:1. 掌握原子构成的初步知识。
2. 掌握原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与中子数、质子数之间的相互关系。
3. 掌握核外电子排布规律。
4. 掌握离子键、共价键、金属键的涵义。
5. 理解键的极性与分子极性的关系。
6. 了解分子间作用力、氢键的概念。
7. 掌握几种晶体类型的结构特点和性质。
三. 教学:1. 原子核外电子的排布规律。
2. 离子键、共价键的概念,能用电子式表示离子化合物和共价化合物及其形成过程。
3. 三种晶体的结构和性质。
四. 知识分析:1. “六种量〞及其涵义〔1〕质子数:即原子核内质子个数,也称为原子序数,它是决元素品种的重要因素。
〔2〕中子数:即原子核内中子个数。
当质子数相同,而中子数不同时,便提出了同位素的概念。
〔3〕核外电子数:原子中,质子数于电子数,因此整个原子不显电性;当质子数>电子数时,该微粒是阳离子,当质子数<电子数时,该微粒为阴离子。
〔4〕质量数:将原子核内所有质子和中子的相对质量取近似值之和为质量数,用“A 〞表示。
由于电子质量忽略不计,质量数可以近似地表示相对原子质量的大小。
〔5〕同位素的相对原子质量:其意义是某同位素的一个原子质量与C 12原子质量121的相比照值。
初中化学所学的相对原子质量实质上是同位素的相对原子质量。
例如:O 168的一个原子质量为kg 2610657.2-⨯,一个C 126的质量为kg 2610993.1-⨯ O 168的相对原子质量〔6〕元素的相对原子质量:其意义是各种天然同位素的相对原子质量与它的原子所占的原子个数百分比的乘积之总和。
氧元素的相对原子质量[])(O Ar759.999949.15⨯=%+037.09991.16⨯%+204.09992.17⨯%注:我们在题中常用质量数代替同位素的相对原子质量,以此求得的结果称为元素的近似相对原子质量,如: 氧元素的近似相对原子质量759.9916⨯=%037.017⨯+%204.018⨯+%2. 晶体类型与化学键、分子极性之间的关系:由上可知:① 离子晶体〔或离子化合物〕一含离子键。
高考化学二轮复习 专题6 原子结构 化学键练习

第一部分 专题六 原子结构 化学键一、选择题1.(2015·江苏单科)下列有关氯元素及其化合物的表示正确的是( ) A .质子数为17、中子数为20的氯原子:2017ClB .氯离子(Cl -)的结构示意图C .氯分子的电子式:∶Cl ····∶Cl ····∶ D .氯乙烯分子的结构简式:H 3C —CH 2Cl解析:A 项,元素符号的左上角应为质量数,该氯原子应表示为3717Cl ;B 项,Cl -的结构示意图为;D 项,氯乙烯分子的结构简式为CH 2===CHCl 。
答案:C2.(2015·山西师大附中月考)某元素的一个原子形成的离子可表示为b a X n -,下列说法中正确的是( )A .b a X n -中含有的中子数为a +b B .b a X n -中含有的电子数为a -n C .X 原子的质子数为a +b +aD .1个X 原子的质量约为bN Ag解析:b a X n -的质子数为a ,电子数为a +n ,中子数为b -a ,A 、B 、C 错误。
答案:D3.(2015·广东实验中学月考)假设R 元素无同位素,元素R 原子的质量数为A ,R m -的核外电子数为x ,则W g R m -所含中子的物质的量为( )A .(A -x +m ) molB .(A -x -m ) molC .W A (A -x +m ) molD .W A(A -x -m ) mol解析:根据n (R m -)=质量摩尔质量≈W Amol ,又R m -的质子数为x -m ,则中子数为A -(x -m ),所以W g R m -所含中子的物质的量为WA(A -x +m ) mol 。
答案:C4.(2015·淄博期末)下列各组物质混合后,一定能形成离子键的是( ) A .H 2、F 2B .NO 、O 2C .稀硫酸与NaCl 溶液D .BaCl 2溶液与纯碱溶液解析:H 2、F 2混合后反应生成共价化合物HF ,NO 、O 2混合后反应生成共价化合物NO 2,C 项物质不反应,D 项生成了离子化合物BaCO 3和NaCl 。
专题六原子结构与化学键__必修)

高三化学专题训练(13)(原子结构与化学键 必修)班别___________ 姓名____________ 座号 ____________ 评分 __________一、选择题(本题包括10小题,每小题3分,共30分,每小题只有1个答案符合题意)1.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的4526Fe 原子,有关4526Fe 的说法正确的是A .它是一种新元素B .4526Fe 与5626Fe 互为同素异形体C .它是一种新原子D .这种铁原子发生衰变放出两个质子后变成4326Fe2.核磁共振(NMR )技术已广泛应用于复杂分子结构的测定和医学论断等高科技领域。
已知只有质子数或中子数为奇数的原子核才有NMR 现象。
试判断下列哪组原子均可产生NMR 现象 A .18O 、31P 、119Sn B .27Al 、19F 、12CC .元素周期表中V A 族所有元素的原子D .元素周期表中第一周期所有元素的原子 3.下列各项中表达正确的是 A .S 2-的结构示意图为: B .CO 2的分子模型示意图: C .Na 2S 的电子式:D .N 2的结构式: :N≡N:4.下列分子中,每个原子最外层均满足8电子稳定结构的是A .NO 2B .SF 6C .BeCl 2D .NCl 3 5.A 、B 、C 三种短周期元素,原子序数按A 、B 、C 依次增大,A 元素原子最外层电子数是次外层电子数的2倍,B 元素原子的次外层电子数是最外电子数的2倍,C 元素原子的最外层电子数是内层电子总数的一半。
则下列说法中正确的是 A .A 元素的气态氢化物都是含极性键的非极性分子 B .由B 元素的单质分子形成的晶体熔沸点较高。
C .C 元素可以组成不同的单质,它们互为同素异形体。
D .A 、B 、C 的氧化物都能溶于水形成酸 6.在水溶液中,,YO 3n-和S 2-发生如下反应:YO 3n – +3S 2– +6H + = Y – +3S ↓+ 3H 2O ,则YO 3n-中Y 元素的化合价和原子最外层电子数分别为 A .+4、6 B .+7、7 C .+5、5 D .+5、7 7.铜有两种天然同位素6329Cu 和6529Cu ,已知铜的近似相对原子质量为63.5,估算6329Cu 的 原子百分含量为: A .20% B .25% C .50% D .75% 8.对于化学键的理解中,正确的是A .化学键是分子(或晶体)内相邻的两个或多个原子(或离子)之间强烈的作用力B .化学键存在于任何分子内C .化学键只存在于离子化合物和共价化合物中D .氢键和范德华力也是一种化学键9.既含有极性键又含有非极性键的非极性分子是 A .H 2O 2 B .Na 2O 2 C .C 2H 2 D .C 2H 5OH10.最近有人用一种称为“超酸”的化合物H(CB 11H 6Cl 6) 和C 60反应,使C 60获得一个质子,得到一种新型离子化合物[HC 60]+[CB 11H 6Cl 6]-。
原子结构知识:原子结构与化学键角度

原子结构知识:原子结构与化学键角度原子结构是化学中最基础的知识之一,它对于理解化学反应和原子间的相互作用至关重要。
本文将探讨原子结构与化学键的关系,并深入分析原子结构的组成和特性。
一、原子结构的组成原子是化学中最基本的物质,由中心的原子核和外围的电子组成。
原子核由质子和中子组成,质子带有正电荷,中子不带电荷。
而电子则带有负电荷,环绕在原子核周围的电子云中。
质子数量决定了原子的元素,即不同的元素拥有不同数量的质子。
而中子数量和电子数量可以在同一元素的不同原子中不同。
一般情况下,原子核和电子数量相等,因此原子是电中性的,即带有相同数量的正、负电荷。
二、化学键的种类原子结构的组成决定了化学键的种类,化学键是原子间的相互作用,通过共用电子或转移电子的方式实现。
1.金属键金属键是由金属原子组成的晶体中的键。
金属原子的外层电子形成电子海,所有金属离子都可以共享电子海,形成坚固的晶体结构。
由于金属的电子是松散的,因此它们可以轻松移动,这就是为什么金属通常是良好的导体的原因。
2.离子键离子键是由金属和非金属元素组成的化合物中的键。
金属原子失去一个或多个电子,变成正离子,而非金属原子则接受这些电子,成为负离子。
正、负离子之间的相互作用形成了离子键。
这种化学键通常较强,因此离子化合物具有高熔/沸点和硬度。
3.共价键共价键是由两个或多个非金属元素组成的分子中的键。
它基于由原子之间共享电子的概念。
如氢和氧气分子,水分子等。
非金属原子在它们的原子外层只有少量的电子,因此它们倾向于共享其电子,以获得一个更稳定的原子结构。
4.钢键钢键是由有机物中的碳原子组成的键。
碳原子通常形成4条共价键,这意味着它可以与其他4个原子共享电子,如氨基酸和脂肪酸中的碳原子。
它们在化学反应中发挥着重要作用。
三、原子结构与化学键的关系化学键的种类取决于原子的组成。
金属离子之间形成金属键,金属和非金属之间形成离子键,非金属元素之间则形成共价键。
共价键也可以是极性的或非极性的。
专题22 原子结构与化学键(教师版)十年(2013-2022)高考化学真题分项汇编(全国通用)

专题22原子结构与化学键1.【2022年山东卷】138O 、158O 的半衰期很短,自然界中不能稳定存在。
人工合成反应如下:16313a 828b O+He O+X →;16315m 828n O+He O+Y →。
下列说法正确的是A .X 的中子数为2B .X 、Y 互为同位素C .138O 、158O 可用作示踪原子研究化学反应历程D .自然界不存在1382O 、1582O 分子是因其化学键不稳定【答案】B【解析】根据质量守恒可知,X 微粒为62He ,Y 微粒为42He ,据此分析解题。
A .由分析可知,X 微粒为62He ,根据质量数等于质子数加中子数可知,该微粒的中子数为4,A 错误;B .由分析可知,X 微粒为62He ,Y 微粒为42He ,二者具有相同的质子数而不同的中子数的原子,故互为同位素,B 正确;C .由题干信息可知,138O 与158O 的半衰期很短,故不适宜用作示踪原子研究化学反应历程,C 错误;D .自然界中不存在1382O 与1582O 并不是其化学键不稳定,而是由于138O 与158O 的半衰期很短,很容易发生核变化,转化为气体其他原子,O=O 的键能与形成该键的核素无关,D 错误;故答案为:B 。
2.(2021·广东真题)“天问一号”着陆火星,“嫦娥五号”采回月壤。
腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。
下列有关说法正确的是A .煤油是可再生能源B .2H 燃烧过程中热能转化为化学能C .火星陨石中的20Ne 质量数为20D .月壤中的3He 与地球上的3H 互为同位素【答案】C【解析】A .煤油来源于石油,属于不可再生能源,故A 错误;B .氢气的燃烧过程放出热量,将化学能变为热能,故B 错误;C .元素符号左上角数字为质量数,所以火星陨石中的20Ne质量数为20,故C正确;D.同位素须为同种元素,3He和3H的质子数不同,不可能为同位素关系,故D错误;故选C。
原子结构与化学键

原子结构与化学键化学是研究物质性质和变化的科学领域,而原子结构和化学键则是化学中最基础的概念之一。
本文将深入探讨原子结构以及不同类型的化学键对物质性质和化学反应的影响。
一、原子结构原子是物质的基本单位,由核和围绕核轨道运动的电子组成。
核由质子和中子组成,质子带正电荷,中子带中性。
原子的质量主要由质子和中子决定,而电子则决定了原子的化学性质。
原子的结构可以以一种类似于太阳系的模型来描述,核相当于太阳,而电子则像行星围绕核的轨道上运动。
原子的主要性质与其电子的排布有关。
每个原子都有一定数量的电子壳层,其中电子数量最少的壳层为第一层,最接近核的为第一壳层;电子数量更多的壳层依次为第二层、第三层等等。
每个壳层可以容纳的电子数目有限,第一层最多容纳2个电子,第二层最多容纳8个电子,第三层也最多容纳8个电子。
因此,原子的化学性质是由其电子排布决定的。
二、化学键的类型化学键是原子之间形成的力,用于维持分子的稳定性。
根据成键方式的不同,化学键可以分为离子键、共价键和金属键三种主要类型。
1. 离子键离子键形成于具有正电荷的离子和负电荷的离子之间的相互作用。
正电荷离子中的电子从其外层壳层转移到负电荷离子的外层壳层,从而形成了离子键。
离子键通常出现在金属和非金属之间,如氯化钠(NaCl)中正离子钠和负离子氯通过离子键结合在一起。
2. 共价键共价键形成于非金属元素之间,它涉及电子共享。
在共价键中,两个或更多个原子共享其中一个或多个轨道上的电子。
共价键的形成使原子能够达到稳定的气体构型,如氢气(H2)中两个氢原子通过共享一个电子形成共价键。
3. 金属键金属键主要存在于金属元素结构中。
在金属结构中,金属原子之间通过电子云的重叠形成金属键。
电子云可以自由移动,因此金属能够导电和导热。
三、化学键对物质性质的影响化学键的类型和强度直接影响物质的性质,如密度、硬度和溶解性等。
不同类型的键会给物质带来不同的性质。
1. 离子键离子键的特点是强大的相互吸引力和高熔点。
原子结构知识:原子结构与化学键能的关系

原子结构知识:原子结构与化学键能的关系化学键是有一定能量的,那么这些能量是从哪里来的呢?原子结构与化学键能有着密切的关系,下面我们来逐步介绍。
一、原子结构原子结构由原子核和电子组成,原子核中包含着质子和中子,电子则围绕核心旋转。
原子核的质量通常是电子的几千倍,而电子却质量很小。
中子没有电荷,质子是带正电的,电子带负电。
由于原子核的正电荷和电子的负电荷数量相等,所以一个原子整体上是中性的。
原子的结构和元素的性质紧密相关。
每种原子都有一个原子数,它代表了这种原子的核子数。
二、化学键的引入了解了原子结构,我们现在来说说化学键的引入。
一个原子的电子结构与其元素的性质相关,不同元素之间的元素性质也不尽相同。
但是在自然界中,我们会发现元素往往是以某种形式结合在一起的。
例如,氢气、氧气和空气都是由分子组成的。
在化学中,当两个或更多的原子结合在一起时,它们会形成一个化合物。
原子结合在一起时,它们的电子会重新分配。
在这个过程中,原子中质子和中子没有变化,但它们的化合物可以表现出不同的性质。
化学键是将原子结合在一起的力。
通过化学键,原子可以共享电子云,原子之间就会出现化学键。
这些化学键会影响化合物的性质、形状和强度。
三、分子中的化学键在一些分子中,原子通过共享电子来结合在一起。
这些轨道以一定的几何形状排列着,形成了分子的结构。
氢分子是由两个氢原子通过共享一个电子形成的。
在这种情况下,它们围绕一个点旋转,形成了分子。
氧分子也是由两个气体原子组成的。
通常情况下,分子的结构会受到周围化合物和相互作用力的影响。
此外,原子结构会影响化合物的共价键。
四、化学键性质化学键会影响化合物性质的很多方面。
化学键对于分子的形状、化合物的强度、化合物的反应性和化合物产生的听、味、香味是有重要影响的。
化学键中的能量也很重要。
化学键的能量来自于原子中电子的周围组织。
在分子中,化学键可以稳定原子和离子的结构,因此可以防止它们彼此之间的分离。
例如,盐分子就由氯离子和钠离子组成,它们由离子键连接在一起。
高中化学《原子结构、化学键》练习题(附答案解析)

高中化学《原子结构 化学键》练习题(附答案解析)学校:___________姓名:___________班级:____________一 单选题1.化学反应的本质是( ) A .电子的转移B .能量的转化C .旧化学键断裂与新化学键生成D .质量的守恒2.下列物质中既含有共价键又含有离子键的是( ) A .CaOB .KClC .NaOHD .H 2SO 43.下列说法中不正确的是( )A .共价化合物中一定不含有离子键,离子化合物中可能含有共价键B .充电电池放电时发生的是氧化还原反应,而充电时发生的是非氧化还原反应C .离子的还原性由强到弱:S 2–>Cl –>F –D .若石墨完全转化为金刚石需吸收能量,则说明石墨比金刚石稳定 4.22589Ac (Ac 的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。
下列关于22589Ac 的说法中,正确的是( ) A .质子数为225 B .中子数为89C .核外电子数为136D .质子数与中子数之和为2255.同种元素的不同核素之间互称同位素,下列各组中互为同位素的是( ) A .D 和TB .40Ca 和40ArC .H 2O 和H 2O 2D .O 2和O 36.下列过程中化学键没有被破坏的是( ) A .水降温结冰B .水电解得到氧气与氢气C .NaCl 晶体熔化D .NaOH 溶于水7.下列说法正确的是( )A .2H 2D 2T 是氢元素的同素异形体B .2H 2D 2T 摩尔质量之比为1:2:3C .由HD T 与16O 17O 18O 能形成9种水分子D .D T 发生核聚变成为其他元素,属于化学变化8.碘酸氢钾对光敏感,实验室可用6I 2+11KClO 3+3H 2O=6KH(IO 3)2+5KCl+3Cl 2↑制备,下列说法正确的是( ) A .KClO 3中含有离子键和共价键B .KCl 的电子式为C .IO 3的空间构型是平面三角形 D .反应中每转移0.4mol 电子,生成4.48LCl 29.通过α粒子轰击金箔的实验现象,否定葡萄干面包原子模型,提出新的原子结构模型的科学家是( ) A .汤姆孙B .伦琴C .道尔顿D .卢瑟福10.与KOH 所含化学键类型相同的是( ) A .4NH ClB .2CaClC .24H SOD .2SiO11.已知氢元素有1H 2H 3H 三种核素,氯元素有35Cl 37Cl 两种核素。
高中化学 原子结构 化学键

课时24原子结构化学键知识点一原子结构【考必备·清单】1.原子的构成(1)构成原子的微粒及作用(2)微粒符号周围数字的含义[名师点拨]①原子中不一定都含有中子,如11H中没有中子。
②电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子。
(3)微粒之间的数量关系①原子中:质子数(Z)=核电荷数=核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-阳离子所带电荷数;④阴离子的核外电子数=质子数+阴离子所带电荷数。
(4)两种相对原子质量①原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的112的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
②元素的相对原子质量:该元素各种天然同位素原子所占的原子百分比算出的平均值。
如A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
2.元素、核素、同位素(1)元素、核素、同位素的关系(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素的各核素所占的原子百分数一般不变。
[名师点拨]①由于同位素的存在,核素的种数远大于元素的种类。
②不同核素可能具有相同的质子数,如21H和31H;也可能具有相同的中子数,如146C和168O;也可能具有相同的质量数,如146C和147N。
(3)常见的重要核素及其应用核素235 92U14 6C21H(D)31H(T)18 8O用途核燃料用于考古断代制氢弹示踪原子【夯基础·小题】1.在当前空气污染日益严重,人们的健康受到来自空气威胁的情况下,“空气罐头”应运而生。
16O和18O是氧元素的两种核素,下列说法正确的是()A.16O2与18O2互为同素异形体B.16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.16O与18O互为同位素解析:选D同素异形体是指同一元素形成的结构不同的单质,A错误;16O和18O质子数相同,核外电子数相同,所以两者的核外电子排布方式相同,但两种核素的中子数不同,则16O和18O互为同位素,B错误;D正确;16O 和18O都是氧原子,而化学变化中的最小微粒是原子,所以化学变化不能实现16O与18O间的转化,C错误。
原子结构与化学键的形成

原子结构与化学键的形成化学键是指原子之间由于电子的相互作用而形成的结构。
原子结构是决定化学键形成的基础,通过理解原子结构的基本原理,我们可以更好地理解化学键的形成过程和性质。
本文将从原子结构的基本组成、元素周期表和价电子的分布、化学键的种类以及化学键的形成机制四个方面来探讨原子结构与化学键的关系。
一、原子结构的基本组成原子由质子、中子和电子组成。
质子和中子位于原子核中,电子则绕着原子核运动。
质子的数量决定了原子的元素,而电子的数量则决定了原子的化学性质。
原子的质量主要由质子和中子决定,而质子和电子的数量相等,因此原子的整体电荷是中性的。
二、元素周期表和价电子的分布元素周期表按照原子核中质子的数量进行排列。
从左至右,相邻元素的原子核中质子的数量递增,同时也相应增加了电子的数量。
原子核外层电子的数量决定了元素的化学性质,这些电子被称为价电子。
根据元素周期表上的周期和族,我们可以预测一个元素的价电子数。
三、化学键的种类常见的化学键有离子键、共价键和金属键。
离子键是由正负电荷吸引而形成的,通常由金属和非金属元素组成。
共价键是由电子的共享形成的,通常由两个非金属元素共享电子形成。
金属键则是由金属元素之间的金属离子形成的。
四、化学键的形成机制离子键的形成机制是由于一个原子失去电子而形成正离子,另一个原子获得这些电子而形成负离子,正负电荷的吸引力使它们结合在一起。
共价键的形成机制是由于原子间的电子云重叠,电子通过共享在两个原子之间形成化学键。
金属键的形成机制是由于金属元素中电子的离域性,即电子几乎可以自由运动,形成金属离子之间的化学键。
总结:原子结构决定了化学键的形成。
原子由质子、中子和电子组成,元素周期表和价电子的分布决定了原子的化学性质。
化学键的种类包括离子键、共价键和金属键,其形成机制分别是电荷吸引、电子共享和电子离域。
通过深入理解原子结构与化学键的关系,我们可以更好地理解化学反应和物质性质,并应用于化学和材料科学的研究与应用中。
原子结构与化学键

电子数的 2.5 倍,Y 位于 X 的前一周期,且最外层只有一
个电子,则 X 和 Y 形成的化合物的分子式可表示为 ( )
A.XY
B.XY2
C.XY3
D.XY4
解析:由题意知 X 是 N,Y 是 H,C 正确。
知识点二 核外电子排布
2.A+、B+、C-、D、E 五种粒子(分子或离子)中,每个粒子均 有 10 个电子,已知: ①A++C-===D+E↑;②B++C-===2D。 请回答: (1)C-的电子式是__[___O____H__]-___。 (2)分别写出 A+和 D 反应、B+和 E 反应的离子方程式: _N__H_+4_+__H__2O_____N__H_3_·H__2O__+__H_+_、_H_3_O__+_+__N_H__3=_=_=_N__H_+ 4_+__H__2_O_。 (3)除 D、E 外,请再写出两种含 10 个电子的分子的分子式 _C_H__4、__N__e_(其__他__合__理__答__案__也__可__)__。
解析:因 A+、C-、D、E 均为 10 电子粒子,且 A++C-===D +E↑,则 A+为 NH+ 4 ,C-为 OH-,E 为 NH3,D 为 H2O, 进而推知 B+为 H3O+。
知识点三 离子键与共价键
知识点三 离子键与共价键
知识点三 离子键与共价键
1.化学键 使离子相结合或原子相结合的作用力。根据成键粒子和粒 子间的相互作用,可分为离子键和共价键。
2.离子键与共价键 (1)概念
①离子键:带 相反电荷 离子之间的相互作用。 ②共价键:原子间通过 共用电子对所形成的相互作用。
知识点三 离子键与共价键
(2)对比
项目 概念
离子键
共价键
新高考化学一轮复习原子结构化学键课件(77张)

12
考点 1
考点 2
考点 3
真题演练•明确考向
课时作业
一轮 ·化学
提示:(1)核素 同位素 (2)168O2 和168O3 (3)30 24 (4)7 5
13
考点 1
考点 2
考点 3
真题演练•明确考向
课时作业
一轮 ·化学
(1)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有 多少种原子。( √ ) (2)不同的核素可能具有相同的质子数,也可能质子数、中子数、质量数 均不相同。( √ ) (3)核聚变如21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学 变化。( × )
原 AZX子 核 电原外 子子核Z个中—子—[A最-外Z层个电]在子决质数定子决原数定子确元种定素类后的化学性质
4
考点 1
考点 2
考点 3
真题演练•明确考向
课时作业
一轮 ·化学
(2)微粒之间的关系 ①质ห้องสมุดไป่ตู้数(A)=__质__子__数__(Z)+__中__子__数__(N); ②原子中:质子数(Z)=核电荷数=__核__外__电__子__数__; ③阳离子的核外电子数=质子数-__阳__离__子__所__带__的__电__荷__数__; ④阴离子的核外电子数=质子数+__阴__离__子__所__带__的__电__荷__数__。
19
考点 1
考点 2
考点 3
真题演练•明确考向
课时作业
一轮 ·化学
2.由1H、2H、3H与16O、17O、18O可形成________种水分子,这些水 分子的化学性质________(填“相同”或“不相同”)。 答案:18 相同
20
高考化学原子结构化学键(精练)一轮复习(解析版)

原子结构 化学键完卷时间:50分钟可能用到的相对原子质量:Al27一、选择题(每小题只有一个正确选项,共12*5分)1.(2021·广东梅州市·高三二模)《格物探源》中提到:“天地万物皆以六十四种元质配合而成,如金银铜铁养轻淡炭等皆是元质,皆由微渺而造”,“微渺”即现代之“原子”。
下列说法错误的是A .“元质”即现代之“元素”,现在人类发现的化学元素已超过六十四种B .“养、轻、淡”即“氧、氢、氮”三种元素,均为短周期主族元素C .上文中提到的八种“元质”中,有四种金属“元质”D .“微渺”是组成物质的基本微粒,不可再分【答案】D【解析】A .由信息可知,金银铜铁养轻淡炭等皆是元质,均为元素,目前周期表中100多种元素,则现在人类发现的化学元素多于六十四种,故A 正确;B .“养、轻、淡”即“氧、氢、氮”三种元素,均为短周期主族元素,故B 正确;C .金银铜铁为金属元素,养轻淡炭均为非金属元素,八种“元质”包括四种金属“元质”和四种非金属“元质”,故C 正确;D .原子可再分,原子由质子、中子、电子构成,则“微渺”是组成物质的基本微粒,可再分,故D 错误;故选D 。
2.(2021·广东广州市·高三二模)“嫦娥五号”成功着陆月球,实现了中国首次月球无人采样返回。
月壤中的3He 可用于于核聚变,下列说法正确的是A .3He 和4He 核外电子数相等B .3He 和4He 是同种核素C .3He 和4He 中子数相等D .由3He 组成的单质为32He【答案】A【解析】A .3He 和4He 的质子数相同,核外电子数相等,故A 正确;B .3He 和4He 的质子数相同,中子数不同,是两种不同的核素,故B 错误;C .3He 和4He 的质子数相同,中子数不同,故C 错误;D .稀有气体的单质是单原子分子,故D 错误;故选A 。
3.(2021·广东肇庆市·高三三模)硼原子受α粒子(He)轰击可得碳原子和氕:1111456412B He C H +→+.其中硼原子、碳原子核外L 能层中运动的电子数目之比为A .1∶1B .2∶5C .3∶2D .3∶4【答案】D 【解析】硼原子核外L 能层中运动的电子数目为3,碳原子核外L 能层中运动的电子数目为4,二者之比为3∶4,D 项正确;故答案选D 。
高中化学-原子结构与化学键全面总结

专题六 原子结构与化学键一.原子结构原子定义:化学变化中的最小微粒。
1.原子结构和各微粒之间的数量关系(1)原子的构成(2)各微粒间的数量关系AZ X 表示质量数为A、质子数为Z 的一个原子。
①核电荷数=核内质子数=原子核外电子总数,②质量数(A)=质子数(Z)+中子数(N),③离子所带电荷数=质子数-核外电子数。
2.原子核外电子排布(1)电子层的意义表示电子离原子核平均距离的大小,电子层常常用n 表示,n 越小表示电子离原子核等越近;因为电子没有固定的运动轨迹,所以是一个概率平均距离。
(2)原子核外电子排布规律①每个电子层最多容纳2n2个电子,②最外层电子数最多不超过8(K 层为最外层电子时,最多不超过2个)1。
最外层电子排满8个(He 为2个)形成稳定结构,该结构是稀有气体元素原子结构,不易得失电子,化学性质稳定,2。
最外层电子数小于4时易失去电子,表现出金属性,3。
最外层电子数大于4时易失去电子,表现出非金属性。
(3)次外层电子数最多不超过18个。
电子式是表示物质结构的一种式子,其写法是在元素周围用“.”或“×”表示原子或离子的最外层电子,若为离子还需要用“n +”或“n -”(n 为正整数)表示离子所带电荷。
注意事项:1.离子化合物中阴、阳离子个数比不是1:1时,要注意每一个离子都与带相反电荷的离子直接相邻,2.写双原子分子的电子式时,要注意共用电子对的数目和表示方法,具体方法如下:三.化学键1.概念:使离子相结合或原子相结合的作用力。
2.分类3.离子键(1)概念:带相反电荷离子之间的相互作用,(2)成键微粒:阴、阳离子,(3)成键实质:静电作用,(4)形成条件:活泼金属与活泼非金属化合时,一般形成离子键,(5)存在:所有离子化合物中都有离子键4.共价键(1)概念:原子间通过共用电子对所形成的相互作用,(2)成键微粒:原子,(3)成键实质:原子间形成共用电子对,电子对核的静电引力与核间、电子间的静电斥力达到平衡,(4)形成条件:同种或不同种非金属元素的原子相结合时,一般形成共价键,(5)共价键的分类(6)共价键存在四.分子间作用力和氢键1.分子间作用力(1)概念:分子间存在一种把分子聚集在一起的作用力叫分子间作用力,(2)特点1。
原子的结构与化学键

原子的结构与化学键原子是构成全部物质的基本单位,其结构和化学键的形成对于物质的性质和反应过程有着重要的影响。
本文将从原子的结构和化学键的形成机制等方面进行探讨。
一、原子的结构原子由三个基本粒子组成,分别是质子、中子和电子。
质子和中子位于原子核中,而电子则绕核外运动。
质子的电荷为正电荷,中子无电荷,电子的电荷为负电荷。
原子的质量主要由质子和中子决定,而原子的化学性质则由电子决定。
原子的结构可以用核外层电子构成的壳层模型来描述,每个电子壳层包含的电子数有一定限制。
具体来说,第一壳层最多容纳2个电子,第二壳层最多容纳8个电子,第三壳层最多容纳18个电子,之后每个壳层容纳的电子数逐渐增加。
电子在壳层之间的运动受到吸引力和斥力的作用,呈现出稳定的排布。
二、化学键的形成原子之间的化学键的形成是由于原子间的电子重新分布引起的。
化学键可以分为离子键、共价键和金属键。
1.离子键离子键的形成是由于不同元素之间电子的转移所致。
当一个元素失去电子时,形成正离子;当一个元素获得电子时,形成负离子。
正离子和负离子之间的静电吸引力使它们结合在一起形成离子晶体。
例如,氯离子与钠离子之间的电子转移形成氯化钠晶体。
2.共价键共价键的形成是由于原子之间电子的共享。
共价键可以分为单共价键、双共价键和三共价键。
在单共价键中,两个原子共享一对电子;在双共价键中,两个原子共享两对电子;在三共价键中,两个原子共享三对电子。
共价键的形成使得原子能够达到稳定的电子排布。
例如,氢气分子中的两个氢原子通过共享电子形成共价键。
3.金属键金属键的形成是由于金属中自由电子的存在。
金属中的原子失去部分电子形成正离子,并释放出自由电子。
自由电子在金属中自由运动,形成电子云。
金属中的正离子和电子之间的静电吸引力形成金属键。
三、化学键的特性化学键的形成对于物质的性质和反应过程有着重要的影响。
1.离子键的特性离子键通常存在于金属和非金属的化合物中。
离子化合物具有晶体的结构,具有高熔点和良好的溶解性。
化学-原子结构与化学键
分子
极性分子
非极性分子
概念
正负电荷中心不重合
正负电荷中心重合
判断
极性键、结构不对称
非极性键或极性键、结构对称
实例
双原子
CO NO HX
叁原子(AB2) V型 H2O H2S NO2 SO2 肆原子(AB3) 三角锥型 NH3 PH3 五原子(AB4) CHCl3 CH2Cl2 CH3Cl
二 核外电子运动的特征
1 核外电子质量小,运动空间小,运动 速率大。 2 无确定的轨道,无法描述其运动轨迹。
3 无法计算电子在某一刻所在的位置, 只能指出其在核外空间某处出现的机 会多少。
电子云:描述核外电子运动特征
的图象。
电子云中的小黑点:
只是表示这一个 电子在此空间出现过的 机率。
电子云密度大的地方说明电子出现的机 会多,而电子云密度小的地方说明电子 出现的机会少。
概念辨析
离子化合物可能含共价键 离子化合物可能含极性共价键
离子化合物可能含非极性共价键
离子化合物可能含配位键
3、金属键: 金属阳离子与自由电子之间的强烈相互作用
(1)成键微粒:金属阳离子、自由电子 (2)成键对象: 金属单质
离子 共价 金属 比较1 分子间 氢键 比较2 结构 极性 电子式
试从共价键角度来分析HF 、HCl、 HBr、HI分子的稳定性由强到弱的 顺序是:
• 4、某二价阳离子含有10个电子,12个 中子,求质量数
• 5、某一价非金属阴离子含有10个电子, 10个中子,求质量数
• 6、元素R的一个原子质量数为a,其阴 离子Rn-有b个电子,求中子数。
1 某元素R的二价阴离子核外共 有a个电子,核内有b个中子, 则R原子的符号应表示为:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.(全国II卷理综,9,6分)某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63.下列叙述中错误的是A.它是副族元素B.它是第六周期元素C.它的原子核内有63个质子D.它的一种同位素的核内有89个中子1.答案:D解析:(排除法)相对原子质量为152.0,近似认为该元素的平均质量数为152,质子数为63,平均中子数为89,该元素只存在两种天然同位素,且在自然界它们的含量相近,两种同位素分子的中子数一个比89多,一个比89少,二者与89的差值的绝对值相等,D错。
要点1:质量数等于质子数和中子数之和。
要点2:两种同位素原子的质量数与平均值比较,越接近平均数的原子其原子个数百分比(丰度)越大。
2.(广东化学,1,3分)我国稀土资源丰富。
下列有关稀土元素144Sm62与150Sm的说法正确的是62A. 144Sm与15062Sm互为同位素 B. 14462Sm与15062Sm的质量数62相同C. 144Sm与15062Sm是同一种核素 D. 14462Sm与15062Sm的核外电62子数和中子数均为622.答案:A解析:质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子称为核素。
144Sm与15062Sm质量数不同,B错;14462Sm62与150Sm是不同核素,C错;14462Sm与15062Sm的中子数不同,D错。
62要点1:核素(AX):具有一定数目质子数(Z)和中子数(N=A-Z)的原Z子称为核素。
要点2:同位素:质子数(左下角Z )相同,质量数(左上角A )不同的同一元素的不同核素互称同位素。
要点3:核素的量的关系:质量数(左上角A )=质子数(左下角Z )+中子数(N)。
3.(江苏化学,2,3分)下列有关化学用语使用正确的是A. 硫原子的原子结构示意图: B .NH 4Cl 的电子式:C .原子核内有10个中子的氧原子 O 188 D .对氯甲苯的结构简式:3.答案:C【解析】A 项:所以A 项错误,B 项:4NH Cl 是由4NH +和离子构成,由于Cl -是阴离子,必须写出电子式 ;C 项:188O 表示质量数为18,质子数为8的氧原子,所以该原子核内有10个中子,D 项:该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上,对氯甲苯中的氯原子和甲基的位置应该处于相对位置。
要点1:熟记1~20号原子的原子结构结构示意图,阴离子的结构示意图与对应的原子结构示意图比较最外层电子数发生了变化,阴离子带几个单位的负电荷,最外层电子数就加上几;阳离子的结构示意图与对应的原子结构示意图比较最外层电子数发生了变化,;阳离子带几个单位的正电荷,最外层电子数就减去几。
要点2:微粒电子式正确与否的判断方法:(1)、根据化合物类型判断电子式是否正确。
①.离子化合物正负电荷的代数和为零,查看阳离子、阴离子所带电荷数是否相等,相等就有可能正确;②.阴离子和复杂的阳离子要用中括号括起来;③.非金属原子周围要符合8电子稳定结构(H、B例外)。
④.共价化合物要注意极性共价键的共用电子对要偏向呈负价的元素,非极性共价键共用电子对在中央,孤对电子不要忘。
(2)注意辨别“根”“基”的区别。
①.“根”中的原子一般都符合8电子稳定结构,“根”是带电荷的;例如:OH-、NH+4。
②.“基”中至少有一个原子是不符合8电子稳定结构,“基”是不显电性的,例如:-CH3、-OH 。
(3)、注意微粒间的排列方式。
①.离子化合物多离子微粒阴阳离子交替排列;②.共价化合物(有机物除外)多原子微粒正负价原子交替排列;③.注意:过氧离子和过氧原子团不能拆开。
要点3:核素的量的关系:质量数(左上角)=质子数(左下角)+中子数。
要点4:简单的芳香族化合物命名:1,2-邻位;1,3-间位;1,4-对位。
4.(宁夏理综,28,14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。
该反应通能量常用V 2O 5作催化剂,加V 2O 5会使图中B 点升高还是降低? ,理由是 ;(2)图中△H= KJ·mol -1;(3)V 2O 5的催化循环机理可能为:V 2O 5氧化SO 2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。
写出该催化循环机理的化学方程式 ;(4)如果反应速率υ(SO 2)为0.05 mol·L -1·min -1,则υ(O 2)= mol·L -1·min -1、υ(SO 3)= mol·L -1·min -1;(5)已知单质硫的燃烧热为296 KJ·mol -1,计算由S(s)生成3 molSO 3(g)的△H (要求计算过程)。
4.答案:(1)反应物能量、生成物能量;无,降低,因为催化剂改变了反应的历程使活化能E 降低。
(2)-198; (4) SO 2 +V 2O 5=SO 3+2VO 2 ;4VO 2+ O 2=2V 2O 5 ;(4)0.025 ;0.05 。
(5)S(s)+O 2(g) =SO 2(g) △H 1=-296 KJ·mol -1 , SO 2(g)+21O 2(g) =SO 3(g) △H 2=-99 KJ·mol -1 3 S(s)+29O 2(g)=3SO 3(g) △H=3(△H 1+△H 2)=-1185 KJ·mol -1 【详解】(1)题给已知:A→C, ΔH=-99kJ·mol -1 , A→C 是放热反应;结合图形分析,A 能量比C 能量高,A→C 是放热反应,题给已知和图形分析吻合,所以A 表示反应物能量,C 表示生成物能量。
反应热等于生成物的总能量减去反应物的总能量,反应热也等于反应物的键能总和减去生成物的键能总和,反应热和活化能E 无关;使用催化剂可以降低活化能;(2)图中表示的是2molSO 2的反应,因此△H=-99×2KJ·mol -1;(3)依题意即可写出:SO 2 +V 2O 5=SO 3+2VO 2 ;4VO 2+ O 2=2V 2O 5(4)依据速率之比等于化学计量数之比;(5)单质硫的燃烧热为296 KJ·mol -1,对应的热化学反应方程式为:S(s)+O 2(g) =SO 2(g) △H 1=-296 KJ·mol -1 , 1mol SO 2(g)氧化为1mol SO 3的ΔH=-99kJ·mol -1对应的热化学反应方程式:SO 2(g)+21O 2(g) =SO 3(g) △H 2=-99 KJ·mol -1 ;根据盖斯定律,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;1mol S(s)→ 1mol SO 3(g);对应的热化学方程式为: S(s)+23O 2(g)= SO 3(g) △H 3=△H 1+△H 2=-395 KJ·mol -1 ;由S(s)生成3 molSO 3(g)的△H 4=3△H 3=-11185 KJ·mol -1【要点1】放热反应的标志:①0<∆H ;②根据能量和反应过程对应关系图像分析:反应物能量大于生成物能量,③拆开反应物中所有化学键所消耗的能量小于形成所有生成物中的化学键所释放能量。
【要点2】催化剂的7个知识点:①催化剂在反应前后质量不变、化学性质不变;②不同的催化剂改变同一化学反应的反应速率的程度不同;③催化剂的催化机理:催化剂本身先被还原,然后被氧化成催化剂本身;或者先被氧化,再被还原成催化剂本身;④催化剂是通过改变反应的活化能来改变化学反应速率的;⑤催化剂同倍数地改变正逆反应速率,不影响平衡移动;⑥催化剂使用与否和反应热无关;⑦在能量和反应过程的对应关系图像中,反应物的能量和反应体系的最高能量的差值是活化能。
【要点3】热化学方程式计量数改变反应热发生对应的变化,计量数是原来的二倍,反应热也变成原来的二倍 。
【要点4】盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关;化学方程式叠加的同时反应热也可以同步叠加。
5.(福建理综,23,15分)短周期元素Q 、R 、T 、W 在元素周期表中的位置如右图所示 ,其中T 所处的周期序数与主族序数相等,请回答下列问题:(1)T 的原子结构示意图为_______.(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W 的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.(5)R有多种氧化物,其中甲的相对分子质量最小。
在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是________。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ 和bKJ。
又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)H5.答案:(1)(2)弱于;(3)S + 2H2SO4(浓) △3SO2↑+ 2H2O;(4)2H2O2 MnO22H2O + O2↑;(5)NaNO2;(6)(3a – 4b)KJ/mol详解:第一周期只有氢、氦两种元素,短周期元素Q、R、T、W位于元素周期表的第二、三周期,T一定在第三周期,已知T所处的周期序数与主族序数相等,T位于IIIA,最外层有3个电子,原子序数是13,T为Al,同周期相邻元素依次为硅、磷、硫,Q和硅同族,在硅元素的上一周期,Q为碳元素;R和磷同族,在磷元素的上一周期,R为氮元素,W为硫元素。
(1)T 为Al ,13号元素(2)非金属最高价氧化物对应的水化物酸性越强对应的非金属性越强,S 、C 最高价氧化物对应的水化物分别为硫酸和碳酸,酸性:硫酸强于碳酸,则可得非金属性S 强于C ,即非金属性Q 弱于W 。
(3)S 与浓H 2SO 4发生归中反应,0价硫和+6价硫之间只有+4价,硫元素都转化成SO 2 ,氢元素、氧元素化合价不变,只能以水的形式出现,S + 2H 2SO 4(浓) △3SO 2↑+ 2H 2O 。
