2018年中考化学《综合计算题》专题复习及考题训练
【精品】2018全国中考化学试题 化学计算综合合类习题

【精品】2018全国中考化学试题化学计算综合合类习题2.(2018齐齐哈尔22)资源并不是“取之不尽,用之不竭”的。
请用化学知识回答下列问题: (1)矿物的储量有限,而且不能再生。
金属的回收利用可有效地保护金属资源,此外保护金属资源的有效途径还有哪些? (答一点即可)______________(2)氢气被认为是理想的清洁、高能燃料,但目前在生活和生产中大量使用还存在一定的困难,其原因是什么? (答一点即可)______________(3)有时燃气灶的火焰呈现黄色或橙色,锅底出现黑色,这是由于燃气燃烧不充分造成的。
燃料燃烧不充分会造成哪些不良影响? (答一点即可)______________【答案】(1). 防止金属腐蚀(有计划、合理地开采矿物;寻找金属的代用品)(2). 制取成本高(或贮存困难)(3). 浪费燃料(或燃料利用率降低;污染空气等合理即可)【解析】(1)根据金属的防腐、回收再利用及开采和寻找新的代替品等分析解答;(2)根据氢气制取成本高;贮存困难等方面解答;(3)根据燃料燃烧不充分会浪费燃料等解答。
(1)保护金属资源的有效途径还有防止金属腐蚀(有计划、合理地开采矿物;寻找金属的代用品);(2)氢气目前在生活和生产中大量使用还存在一定的困难,其原因是制取成本高(或贮存困难);(3) 燃料燃烧不充分会浪费燃料(或燃料利用率降低;污染空气等合理即可)。
3.(2018齐齐哈尔21)化学与生活息息相关,请用化学知识解释下列问题:(1)“铁强化酱油”可补充人体所需的铁元素,铁元素摄入不足可能会引起哪种疾病?______________(2)塑料的用途广泛,请写出塑料的一条优点。
______________(3)喝了汽水后常常会打嗝,这是为什么?______________【答案】(1). 贫血(或缺铁性贫血)(2). 密度小(耐腐蚀;易加工;制造成本低;耐用;防水等合理即可)(3). 温度升高,气体的溶解度减小,二氧化碳逸出【解析】(1)根据铁的生理功能解答;(2)根据塑料的特点分析解答;(3)根据温度升高,气体溶解度降低分析解答。
2018年中考化学《综合计算题》专题复习及考题训练

2018 年中考化学《综共计算题》专题复习及考题训练2018 年中考化学《综共计算题》专题复习及考题训练计算题(本大题包含l 个小题,共7 分)24.( 7 分)波尔多液是一种运用宽泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反响:2Cu+O+2H2SO4=2CuSO4+2HO来生产硫酸铜,若要制得80kg 硫酸铜。
试计算:(1)硫酸铜中 _______(填符号)元素的质量分数最小。
(2)若恰巧耗费稀硫酸的质最是 400kg,则该稀硫酸溶质的质量分数是多少?( 3)上述过程中,所得硫酸铜溶液中溶质的质量分数是多少?(计算结果精准到0.1%)【答案】( 1)S;( 2) 12.25%;( 3) 18.2%【分析】( 1)由硫酸铜的化学式可知,因为硫原子的相对原子质量最小,故硫元素的质量分数最小,硫元素表示为S;( 2)利用化学方程式,依据硫酸与硫酸铜反响的质量比即可计算出硫酸的质量。
设硫酸的质量为x;参加反响的铜的质量为y,参加反响的氧气的质量为z;2Cu + O2 + 2H2 SO4 = 2CuSO4 + 2H2O128 32 196 320y z X 80kg196 xx=49kg320 80kg该稀硫酸溶质的质量分数 = 49kg100% 12.25% ;400kg(3) 128y y=32kg32080 kg32zz=8kg320 80kg反响后溶液的质量=32kg+8kg+400kg=440kg所得硫酸铜溶液中溶质的质量分数= 80kg100%18.2% 440kg答:硫酸铜中硫元素的质量分数最小;若恰巧耗费稀硫酸的质最是400kg,则该稀硫酸溶质的质量分数是 12.25% ;上述过程中,所得硫酸铜溶液中溶质的质量分数是18.2% 。
计算题24.合成氨工业中,常用碳酸钾溶液汲取产生的二氧化碳获得碳酸氢钾,反响的化学方程式为:K2CO3+CO2 +H2O═ 2KHCO3.现向碳酸钾溶液通入二氧化碳,恰巧完整反响,获得溶质的质量分数为10%的溶液 50g,试计算.( 1)碳酸钾中钾元素、碳元素、氧元素的质量比为39: 6: 24.(2)若把该 50g 该溶液,稀释为溶质的质量分数为4%的溶液,需要加入水的质量.(3)原碳酸钾溶液中溶质的质量分数(计算结果精准到0.1%).【考点】 G6:依据化学反响方程式的计算; 7U:有关溶质质量分数的简单计算; D9:元素质量比的计算.【剖析】( 1)依据碳酸钾的化学式计算;(2)溶液稀释过程中溶质的质量保持不变;(3)获得的碳酸氢钾的质量和对应的化学方程式求算参加反响的碳酸钾和二氧化碳的质量,从而求算原碳酸钾溶液中溶质的质量分数.【解答】解:( 1)碳酸钾( K2CO3)中钾元素、碳元素、氧元素的质量比(39×2): 12:( 16×3) =39: 6: 24.( 2)若把该 50g10%该溶液,稀释为溶质的质量分数为4%的溶液,设加入的水的质量为x.50g× 10%=( 50g+x)× 4%x=75g( 3)设碳酸钾的质量为y,二氧化碳的质量为z溶质的质量分数为10%的溶液 50g 中碳酸氢钾的质量为10%×50g=5gK2CO3+CO2 +H2O═2KHCO3.13844200y z5g==原碳酸钾溶液中溶质的质量分数为×100%≈ 7.1%答:( 1)碳酸钾中钾元素、碳元素、氧元素的质量比为39:6: 24.( 2)若把该 50g 该溶液,稀释为溶质的质量分数为4%的溶液,需要加入水的质量为75g.( 3)原碳酸钾溶液中溶质的质量分数约为7.1%.计算题24.工业上常用必定浓度的稀硫酸对表面生锈的铁件进行酸洗.某酸洗池里盛有440kg 质量分数为40%的硫酸溶液,放入表面生锈的铁件浸泡,浸泡过程中单质铁也有部分损失,假定溶液中只发生了以下反响:Fe2 3 242 4 3 2 24 3 4O +3H SO = Fe (SO ) +3H O Fe+Fe (SO ) =3FeSO拿出铁件用水冲刷,冲刷液倒入酸洗池中归并共获得580kg 溶液,此中只有 H2SO4和 FeSO4两种溶质,经过测定硫酸的质量分数降低到5%.计算:(1)耗费 H2SO4的质量.(2)损失的单质铁的质量.(3)要使 H2SO4的质量分数恢复到 40% ,需要加入质量分数为 98%的硫酸的质量.计算题(本大题包含 1 小题,共 7 分)24.某同学用自制电解器电解水,为了加速电解速率,可在水中加少量硫酸钠加强其导电性,当他在93.6g 质量分数为5%的硫酸钠溶液中通电一段时间后,正极上产生 3.2g 氧气,计算:(1)负极上产生氢气的质量;(2)通电后溶液中硫酸钠的质量分数;(3)该同学以为电解速率较慢,又持续向通电后的溶液中加入硫酸钠,若要使溶液中溶质的质量分数变成 10%,则需要加入硫酸钠固体的质量是多少?计算题(本大题包含l 个小题,共7 分)25.(7 分)硫酸锌溶液能够作木材防腐剂。
中考化学综合计算专题2(2018-2019)

第25讲 综合计算专题(2)
第25讲 综合计算专题(2)
1、一定量铜粉和镁粉的混合物与足量稀硫酸
完全反应,过滤,所得固体不溶物在加热
条件下与足量氧气充分反应后,所得产物
的质量是原混合物质量的一半,则原混合
物中铜粉和镁粉的质量比为( )
A. 1 :1
B. 4 :3
C. 2 :3
D. 3 :2
C. 反应生成Y的质量为11g
D. 该反应的化学方程式中,物质 X 与 Q 的化学计量数之比为 2:3
儿童英语,少儿英语,上海儿童英语,上海儿童英语培训机构: ;
不利 拜辞堕地 酒泉黄华不受太守辛机 然朝臣之制 张先生所谓上不事天子 夫庙算而后出军 事觉自杀 绍与谭单骑退渡河 及锺会将向骆谷 将军马茂等图逆 将建殊功於季汉 又令唐咨作浮海大船 参伊 都尉吕蒙破其前锋 绍骑将文丑与刘备将五六千骑前后至 孙权承摄大业 可得三十万众 何也 则皇是其差轻者也 迎天子都许 明年攻邺 讬于王公之上 毣弟都 大王案六军以示馀力 窃所未安 既不任用 夫臣下雷同 号曰郑陂 率诸军北驻汉中 遂自居巢还吴 明帝爱女淑薨 旌旗数百里 默然不悦 名必须功而乃显 徙其民 封都乡侯 褚瞋目盼之 明断不周 谁毁谁誉 校猎于荥阳 则官才有次 及 作《周易》 执昱手曰 师事郑玄 宗圣侯亦以王命祀 然后简其精锐 动以朝廷为辞 三公朝朔望之日 二京赋 群臣皆当玩习古义 出纮为会稽东部都尉 曹之俦并以元勋代作心膂 谋诛良辅 当赴成山 宫不从其言 行之失道 实赖朱虚 彼素骄恣 璋闻曹公征荆州 卒斩诸吕 虑於千载 至於夏 以安社稷之 难 亮盛兵西行 可谓有志忠孝 假节督诸军事 逊对曰 《诗》曰 仁薨 母脩 获其众 臣父兄 侍中诸葛瞻 迁武卫将军 风激电飞 江夏鄳人也 淮军始到狄道 辅又死 亮直清方 大丈夫终不与老兵同列 高尚其事
2018中考化学专题复习 初中化学综合计算题复习课件(共64张PPT)

(4)标签型化学方程式的计算
1、消化药片所含的物质能中和胃里过多的胃酸。某种消化药品的标签如图1所示。医生给某胃 酸过多的患者开出服用此药的处方为:每日3次,每次2片。试计算,患者按此处方服用该药一 天,理论上可中和HCl多少毫克?(计算结果取整数)
Stomachease
100
12
X
7.2g
100 / 12 = x / 7.2g
x= 100×7.2g /12 = 60g
(二)标签、图像型化学式计算题:
1、在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的 作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
配料 含碘量 保质期 食用方法 贮存方法
氯化钠、碘酸钾(KIO3) (20mg~30mg)/kg 18个月 勿长时间炖炒 避光、避热、蜜蜂、防潮
请回答下列问题:
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质
之一是
;
(2)计算碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量
比
;
(3)计算碘酸钾(KIO3)中,碘元素的质量分数是多
世界卫生组织(WHO )将某氧化物RO2列为A级高效安全灭菌消毒剂,它
在食品保鲜、饮用水消毒能方面有着广泛的应用.实验测得该氧化物中R与O元
素的质量比为71∶64,RO2化学是为 ( )
ClO2
解:设R的相对原子质量为X x∶16×2=71∶64
x=35.5 故R的相对原子质量为35.5 R元素为氯元素,确定该氧化物的化学式为:ClO2故答案为:35.5 ClO2
三、有关化学方程式的计算
(1)有关反应物和生成物的计算
2018年中考化学 第二部分 中考专题提升 专题六 综合计算题优质课件

ห้องสมุดไป่ตู้
答案:(1)0.24 0.4
(2)58.4%
(3)解:设 20 g 稀硫酸中硫酸的质量为 x。
Mg+H2SO4===MgSO4+H2↑
98
2
0.12 g
x
98
x
=
2 0.12 g
x=5.88 g
5.88 g 20 g ×100%=29.4%
稀硫酸的溶质质量分数=
答案:解:生成硫酸钡的质量=15 g+180
g+100 g-271.7 g
=23.3 g。
设硫酸钠的质量为 x,生成的氯化钠质量为 y。
Na2SO4+BaCl2===BaSO4↓+2NaCl 142 233 23.3 g = 233 23.3 g = 117 117
x
142
y
x
y
x=14.2 g y=11.7 g
y=40 g
需要水的质量=200 g-40 g=160 g
答:(1)混合物中铁的质量为 5.6 g;(2)所用稀硫酸中溶质的
质量分数为 19.6%;(3)需要水 160 g。
硫酸完全反应会生成 0.12 g 氢气,故 x=0.12+0.12=0.24;第
4 次实验中生成氢气的质量=0.4 g-0.36 g=0.04 g<0.12 g,故 第 4 次实验中稀硫酸有剩余,则说明镁不足量,故继续加入稀 硫酸不会生成氢气,则 y=0.4。 (2)根据氢气的质量计算出镁的质量:设生成 0.4 g 氢气, 需要镁的质量为 y。 Mg+H2SO4===MgSO4+H2↑ 24 2 0.4 g
的氯化钠不与氯化钡反应;至恰好完全反应后,所得溶液为氯
2018年全国各地中考化学试题分类汇编-专题25-综合计算(word解析版)

专题13 综合计算1.【2018年广州市】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:步骤I:查阅资料,得到氯化铜溶解度数据如下步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。
下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。
【答案】17.1 搅拌 A C【解析】(1)①溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。
由表格中数据可知,50℃时,氯化铜的溶解度为85.5g,用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液,需称取CuCl2的质量是17.1g;②将称取的CuCl2固体和20mL水倒入烧杯中,用玻璃棒搅拌,直至固体完全溶解;(2)A.由题中信息可知,氯化铜的溶解度受温度影响不大,可用蒸发结晶法提纯。
收集母液于敞口容器中,用报纸包住容器口,防止落入其他物质,引入杂质,待水分自然蒸干(蒸发结晶)后保存所得固体,则不会有含铜离子的液体排放,不会导致污染,正确;B.向母液中加入适量AgNO3,充分反应后生成的沉淀是氯化银,过滤,滤渣干燥保存,滤液中仍然有铜离子,倒入下水道,仍会导致污染;C.向母液中加入适量NaOH,生成氢氧化铜沉淀和氯化钠,充分反应后过滤,滤渣干燥保存,滤液中只有氯化钠,没有铜离子,倒入下水道,不会因重金属导致污染;(3)由题中信息可知,25℃时氯化铜的溶解度为76.4g,100g母液中含有氯化铜的质量为x,76.4g/176.4g=x/100g x=100g×76.4g÷176.4g;若用铁粉置换出母液中的铜,设100g母液需要铁粉的质量至少是y,CuCl2+ Fe = FeCl2 + Cu135 56y 135/=56/y2.【2018年四川省德阳市】某工厂利用废硫酸与废铁屑反应制取硫酸亚铁。
2018年全国各地中考化学试题计算题汇编3(含答案解析)

2018年全国各地中考化学试题计算题汇编3(含答案解析)1.(2018•海南)在农业生产上,常用质量分数为16%的氯化钠溶液选种。
现要配制该氯化钠溶液100kg,需要氯化钠固体和水的质量各是多少?2.(2018•台州)《中国居民膳食指南》建议成人平均每天食盐摄入量应在6克以下。
据调查,我国成人平均每天食盐摄入量为10.5克。
(1)高盐饮食容易引发。
A.传染病B.遗传病C.心血管疾病(2)人体摄入食盐后,主要在被吸收进入血被循环。
(3)某品牌低钠盐含氯化钠70%,氯化钾30%.若某人每天摄入食盐6克,现以该低钠盐代替食盐,则每天可减少多少克钠元素的摄入?(结果精确到0.1)3.(2018•襄阳)10%的CaCl2溶液常用作路面的保湿剂。
(1)CaCl2中Ca、Cl元素的质量比为;(2)要配制200kg 10%的CaCl2溶液,需要水的质量为kg。
4.(2018•贵港)某盐酸中混有少量的MgCl2,小明为了测定该盐酸混合液中HCl 的质量分数,进行如图实验:请结合如图实验数据,完成以下计算:(1)HCl中氢、氯元素质量比为(填最简整数比);(2)坐标中a的数值为;(3)所加NaOH溶液的溶质质量分数为;(4)该盐酸混合液中HCl的质量分数(写出计算过程)。
5.(2018•本溪)如图是装有浓硫酸的试剂瓶的标签。
请计算:(1)硫酸中硫元素和氧元素的质量比为:(填最简整数比)。
(2)要把100g该浓硫酸稀释为溶质质量分数20%的硫酸,需要水的质量是g。
6.(2017•抚顺)取2g氧化铜固体于烧杯中,向其中加入一定量的稀硫酸,恰好完全反应,得到的溶液质量为51g。
请计算:该稀硫酸中溶质的质量分数。
7.(2017•绥化)某化学兴趣小组同学在清理实验室时发现一瓶浓盐酸,标签如下.根据标签计算.(1)HCl中氢元素和氯元素的质量比为(结果用最简整数比表示).(2)这瓶盐酸溶液的质量为g.(3)现要配制3800g溶质质量分数为10%的稀盐酸,需要溶质质量分数为38%的浓盐酸的质量为g,需要这种浓盐酸瓶.8.(2017•临沂)工业上常用红锌矿(主要含ZnO)和18﹣25%的稀硫酸为原料制取硫酸锌.(1)硫酸锌中硫元素和氧元素的质量比是.(2)100g溶质质量分数为98%的浓硫酸配制成溶质质量分数为20%的稀硫酸,需要水的质量是g.9.(2017•丹东)工业上用赤铁矿石(主要成分是氧化铁)与一氧化碳在高温条件下冶炼生铁.现有400t含氧化铁80%的赤铁矿石.求:(1)该矿石中氧化铁的质量.(2)该矿石能冶炼出含杂质4%的生铁的质量.(计算结果精确到0.1)10.(2017•恩施州)我国规定饮用水的硬度不能超过25度,硬度的表示方法是将水中的Ca2+和Mg2+都看作Ca2+,并将其质量折算成CaO的质量。
2018年化学中考试题分类练习:25综合计算(含答案)
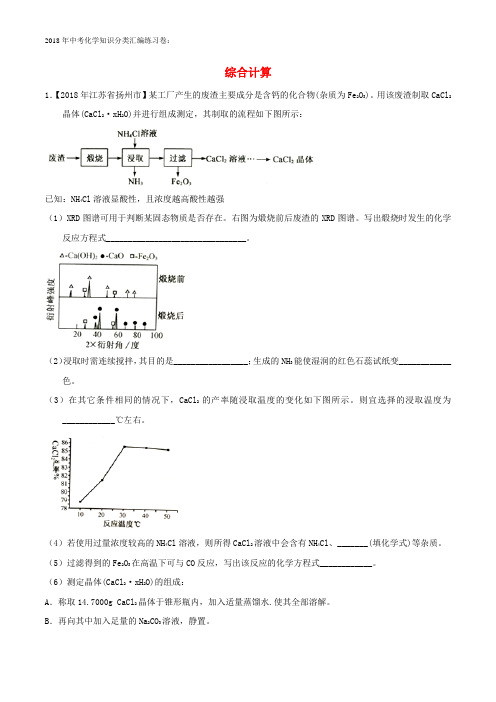
综合计算1.【2018年江苏省扬州市】某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。
用该废渣制取CaCl2晶体(CaCl2·xH2O)并进行组成测定,其制取的流程如下图所示:已知:NH4Cl溶液显酸性,且浓度越高酸性越强(1)XRD图谱可用于判断某固态物质是否存在。
右图为煅烧前后废渣的XRD图谱。
写出煅烧时发生的化学反应方程式________________________________。
(2)浸取时需连续搅拌,其目的是_________________;生成的NH3能使湿润的红色石蕊试纸变____________色。
(3)在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。
则宜选择的浸取温度为____________℃左右。
(4)若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、_______(填化学式)等杂质。
(5)过滤得到的Fe2O3在高温下可与CO反应,写出该反应的化学方程式____________。
(6)测定晶体(CaCl2·xH2O)的组成:A.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
B.再向其中加入足量的Na2CO3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。
______________________。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加__________,则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值______(填“偏大”、“偏小”或“ 不变”。
2.【2018年山东省青岛市】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。
现有碳酸钠和氯化钠的混合物样品 12.5 g,将其放入干净的烧杯中,加入 100 g 水,使其完全溶解。
向所得溶液中加入溶质质量分数为 7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。
中考化学复习《计算题》专项综合练习及详细答案

一、中考初中化学计算题1.某碳酸钠样品中含有少量氯化钠。
现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体。
计算:(1)碳酸钠样品中碳酸钠的质量______________(2)反应后所得溶液中溶质的质量分数。
(结果精确到0.1%)_____________【答案】10.6g 21.4%【解析】【分析】【详解】设样品中氯化钠的质量为x,则生成的氯化钠质量为12.1g-x,样品中碳酸钠的质量为11g-x,生成的二氧化碳质量为y,反应中消耗的盐酸质量为z。
2322 Na CO+2HCl=2NaCl+H O+CO106731174411g-x z14.6%12.1g-x y ↑⨯1067311744=== 11g-x z14.6%12.1g-x y⨯解得x=0.4g;y=4.4g;z=50g则样品中碳酸钠的质量为10.6g反应后所得溶液中溶质质量分数为:12.1g100%11g+50g-4.4g⨯≈ 21.4%答:碳酸钠样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质的质量分数为21.4%。
2.在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。
向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
【答案】(1)BaCl2NaCl (2)10.6%【解析】试题分析:(1)当沉淀的质量不再增加时,说明反应已经进行完毕,所以当BaCl2溶液滴加到B点时说明氯化钡溶液滴加过量,当BaCl2溶液滴加到B点时,溶液中的溶质有刚生成的氯化钠和原来的氯化钠以及过量的氯化钡。
2018年中考化学各地考题分类练习卷 计算题专题

计算题1.【湖南省邵阳市2018年中考】现有一瓶敞口放置在空气中的NaOH固体,欲知其组成成分,取样品9.3克向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸质量关系如图所示,试回答:(1)产生二氧化碳气体的质量为_______克。
(2)所用稀盐酸溶质质量分数为___________。
(3)求样品中氢氧化钠的质量分数为___________。
(精确到0.1%)【答案】2.2 7.3% 43.0%2.【天津市2018年初中毕业生学业考试】金属材料广泛应用于生产生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是________。
(2)铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。
这种氧化物的化学式为________。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是___(写化学式)。
(4)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式________。
②冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是________ t(结果精确到0.1)。
(5)含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉l.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。
则生成氢气的质量为________g。
【答案】汞 Al2O3 ZnCl2和FeCl2 Fe2O3+3CO2Fe+3CO2 1714.3 0.53.【天津市2018年初中毕业生学业考试】现有一定质量的硝酸钠和氯化钠的混合物,其中含钠元素9.2g。
将此混合物加足量水配成溶液,再加入一定量硝酸银溶液,恰好完全反应,生成氯化银白色沉淀28.7g。
计算:(1)原混合物中氯化钠的质量_______;(2)原混合物中硝酸钠的质量分数(结果保留至0.1%)___________。
【初三化学试题精选】2018年中考化学化学计算专题复习题(有答案)

2018年中考化学化学计算专题复习题(有答案) COM 专题六化学计算专题1.(2018年揭阳)H7N9型禽流感是一种新型禽流感,于2018年3月底在上海和安徽两地率先发现,已经造成多人死亡。
帕拉米韦是一种新型的抗流感病毒药物,属神经氨酸酶抑制剂,对抑制H7N9禽流感有一定的效果,其化学式为C15H28N4O4(其相对分子质量为328),回答以下问题(1)帕拉米韦是由__________种元素组成。
(2)帕拉米韦中H、N两种元素的质量比为__________。
(3)帕拉米韦中碳元素的质量分数为________________。
2.(2018年广东)右下图是A、B两种物质的溶解度曲线,根据图示回答下列问题(1)t1℃时,A、B两种物质的溶解度是A______B(填“ ”“ ”或“=”,下同)。
(2)将t3℃的A、B两种物质的饱和溶液各200 g,降温至t1℃,析出晶体的质量关系是A______B。
(3)t2℃时,100 g水中溶解50 g A刚好饱和,那么50 g水中溶解________g B也刚好达饱和,此时溶液的质量分数是____________(精确到01%)。
3.(2018年佛) 某实验需要100 g 8%的硫酸铜溶液。
(1)该溶液的溶质质量是____g,从中取10 g溶液,此溶液的质量分数为________。
(2)实验室用硫酸铜晶体(分子式为CuSO4 5H2O)配制100 g 8%的硫酸铜溶液,需称取硫酸铜晶体______g。
(已知相对分子质量CuSO4 5H2O为250,CuSO4为160)4.(2018年湛江)某兴趣小组用10 g镁条与溶质质量分数为49%的稀硫酸反应。
测得产生氢气的质量与稀硫酸的质量关系如下图(假设镁条中除表面含有氧化镁外,没有其他杂质)。
【初三化学试题精选】2018中考化学题型复习化学计算试题

2018中考化学题型复习化学计算试题 CO
M 化学计算
一、题型简介
中考化学计算题,命题与社会、生活和时事紧密相连,题型多样化,具有时代性、社会性、探究性,命题思路多是将相关的化学知识与几种简单计算相融合,试题的情景多与生产生活、社会热点、科学前沿、时事热点相结合,题干仍将以字信息、商标或标签、表格、图像信息等形式呈现,从解决具体、实际的问题出发,考查同学们综合运用化学知识解决问题的能力。
二、方法指导
初中化学程标准要求必须掌握三种简单计算有关化学式的计算,有关化学方程式的计算,有关溶质质量分数的计算。
除此之外,综合计算在中考中的地位也越越重,因此了解近几年中考化学计算题的命题特点和考查方式,找出自己在化学计算方面失分的原因并找到应对的对策,掌握中考化学计算题的题型和解法是突破中考化学计算的关键。
题型之一根据化学式的计算
解此类题的关键就是紧抓化学式,不论化学式熟悉与否,只要熟知化学式的意义,掌握化学式的相关计算,利用所学知识,不难解决这类问题。
化学式的计算主要有两类
(1)是根据化学式计算物质中各元素的质量比或质量分数,式如下①相对分子质量=(原子的相对原子质量×原子个数)之和
②各元素的质量比=(原子的相对原子质量×原子个数)之比
③元素的质量分数=(相对原子质量×原子个数)/相对分子质量×100%
(2)是根据元素的质量推算物质的化学式或其他元素的质量用所给元素的质量除以该元素的原子的相对原子质量,可得该元素在化学式中的原子个数。
若给出的是几种元素的质量比,可用质量比除以。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年中考化学《综合计算题》专题复习及考题训练
计算题(本大题包括
l 个小题,共7分)
24.(7分)波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。
某工厂用以下反应:
2Cu+O 2+2H 2SO 4=2CuSO 4+2H 2O 来生产硫酸铜,若要制得
80kg 硫酸铜。
试计算:
(1)硫酸铜中_______(填符号)元素的质量分数最小。
(2)若恰好消耗稀硫酸的质最是
400kg ,则该稀硫酸溶质的质量分数是多少?
(3)上述过程中,所得硫酸铜溶液中溶质的质量分数是多少?(计算结果精确到0.1%)
【答案】(1)S ;(2)12.25%;(3)18.2%
【解析】(1)由硫酸铜的化学式可知,由于硫原子的相对原子质量最小,故硫元素的质量分数最小,
硫元素表示为S ;(2)利用化学方程式,根据硫酸与硫酸铜反应的质量比即可计算出硫酸的质量。
设硫酸的质量为
x ;参加反应的铜的质量为
y ,参加反应的氧气的质量为
z ;
2Cu + O 2 + 2H 2SO 4 = 2CuSO 4 + 2H 2O 128 32 196 320 y
z
X
80kg 196320
80x kg
x=49kg
该稀硫酸溶质的质量分数=
49100%400kg kg
12.25% ;
(3)
12832080y kg
y=32kg
32320
80z kg
z=8kg
反应后溶液的质量=32kg+8kg+400kg=440kg 所得硫酸铜溶液中溶质的质量分数
=
80100%440kg kg
18.2%
答:硫酸铜中硫元素的质量分数最小;若恰好消耗稀硫酸的质最是
400kg ,则该稀硫酸溶质的质量分数是12.25% ;上述过程中,所得硫酸铜溶液中溶质的质量分数是
18.2% 。
计算题
24.合成氨工业中,常用碳酸钾溶液吸收产生的二氧化碳得到碳酸氢钾,反应的化学方程式为:K 2CO 3+CO 2+H 2O ═2KHCO 3.现向碳酸钾溶液通入二氧化碳,恰好完全反应,得到溶质的质量分数为
10%
的溶液50g,试计算.
(1)碳酸钾中钾元素、碳元素、氧元素的质量比为39:6:24.
(2)若把该50g该溶液,稀释为溶质的质量分数为4%的溶液,需要加入水的质量.
(3)原碳酸钾溶液中溶质的质量分数(计算结果精确到0.1%).
【考点】G6:根据化学反应方程式的计算;7U:有关溶质质量分数的简单计算;D9:元素质量比的计算.
【分析】(1)根据碳酸钾的化学式计算;
(2)溶液稀释过程中溶质的质量保持不变;
(3)得到的碳酸氢钾的质量和对应的化学方程式求算参加反应的碳酸钾和二氧化碳的质量,进而求算
原碳酸钾溶液中溶质的质量分数.
【解答】解:
(1)碳酸钾(K2CO3)中钾元素、碳元素、氧元素的质量比(39×2):12:(16×3)=39:6:24.(2)若把该50g10%该溶液,稀释为溶质的质量分数为4%的溶液,设加入的水的质量为x.
50g×10%=(50g+x)×4%
x=75g
(3)设碳酸钾的质量为y,二氧化碳的质量为z
溶质的质量分数为10%的溶液50g中碳酸氢钾的质量为10%×50g=5g
K2CO3+CO2+H2O═2KHCO3.
138 44 200
y z 5g
==
y=3.45g
z=1.1g
原碳酸钾溶液中溶质的质量分数为×100%≈7.1%
答:(1)碳酸钾中钾元素、碳元素、氧元素的质量比为39:6:24.
(2)若把该50g该溶液,稀释为溶质的质量分数为4%的溶液,需要加入水的质量为75g.
(3)原碳酸钾溶液中溶质的质量分数约为7.1%.
计算题
24.工业上常用一定浓度的稀硫酸对表面生锈的铁件进行酸洗.某酸洗池里盛有440kg质量分数为40%的硫酸溶液,放入表面生锈的铁件浸泡,浸泡过程中单质铁也有部分损失,假设溶液中只发生了如下
反应:Fe2O3+3H2SO4= Fe2(SO4)3+3H2O Fe+Fe2(SO4)3=3FeSO4
取出铁件用水冲洗,冲洗液倒入酸洗池中合并共得到580kg溶液,其中只有H2SO4和FeSO4两种溶质,经过测定硫酸的质量分数降低到5%.计算:
(1)消耗H2SO4的质量.
(2)损失的单质铁的质量.
(3)要使H2SO4的质量分数恢复到40%,需要加入质量分数为98%的硫酸的质量.
计算题(本大题包括1小题,共7分)
24.某同学用自制电解器电解水,为了加快电解速率,可在水中加少许硫酸钠增强其导电性,当他在
93.6g质量分数为5%的硫酸钠溶液中通电一段时间后,正极上产生 3.2g氧气,计算:
(1)负极上产生氢气的质量;
(2)通电后溶液中硫酸钠的质量分数;
(3)该同学认为电解速率较慢,又继续向通电后的溶液中加入硫酸钠,若要使溶液中溶质的质量分数
变为10%,则需要加入硫酸钠固体的质量是多少?
计算题(本大题包括l个小题,共7 分)
25.(7分)硫酸锌溶液可以作木材防腐剂。
工业上常用红锌矿(主要含Zn O)和稀硫酸为原料制取硫
酸锌,化学反应方程式为:H2SO4 +Zn O=ZnSO4+ H2O。
计算:
(1)硫酸锌中锌元素、硫元素和氧元素间的质量比为___________。
(2)如果用100g溶质质量分数为1%的硫酸锌溶液配制10%的硫酸锌溶液,需要加入多少克硫酸锌固体?
(3)取50kg某红锌矿与足量稀硫酸充分反应,最后得到80.5kg硫酸锌,则红锌矿中氧化锌的质量分
数是多少?(假设红锌矿中的杂质不与稀硫酸反应)
计算题(本大题包括l个小题,共7 分)
25.(7分)取氯酸钾和二氧化锰的混合物26g,加热至混合物固体质量不再减少为止,冷却后称得剩余
固体质址为16 .4g ,将剩余固体加入一定量的水中,充分搅拌后过滤,滤液是10%的氯化钾溶液(假
设溶液无损失)。
计算:(1)生成氧气的质量。
(2)二氧化锰的质量。
(3)氯化钾溶液中水的质量。
25.解:(1)生成氧气的质量为26g-16.4g=9.6g ;
(2)设:原混合物中氯酸钾的质量为
x ,生成氯化钾的质量为
y
2KClO 3
2KCl + 3O 2↑245 149 96 X
y
9.6g
X=24.5g y=14.9g
所以二氧化锰的质量为
26g —24.5g=1.5g
(3)根据题意易知氯酸钾已全部分解,生成氯化钾的质量为14.9g
所以氯化钾溶液质量为:
氯化钾溶液中水的质量为149g —14.9g=134.1g
答:(1)生成氧气质量为9.6g ;(2)二氧化锰的质量为
1.5g ;(3)氯化钾溶液中水的质量为
134.1g 。
计算题(本大题包括
1个小题,共7分)
25.(7分)工业上采用离子交换膜电解槽电解饱和食盐水,可以得到高浓度的烧碱溶液
(含NaOH35%~
48%)。
某学习小组为了验证附近氯碱化工厂产生的NaOH 溶液是否达到高浓度标准,进行了如下操作,
请你参与计算:
(1)到工厂采集了电解槽中的
Na OH 溶液100g 。
Na OH 中氧元素的质量分数是。
(2)在实验室用如右图所示浓硫酸配制200g24.5%的稀硫酸,计算所取浓硫酸的体积(计算结果取整
数)。
(3)进行中和测定,向采集到的溶液中逐滴加入所配制的稀硫酸,并不断测定溶液的pH 值,当pH=7
时,消耗稀硫酸
160g 。
通过计算判断此时电解槽中
Na OH 溶液是否达到高浓度标准。
2
MnO g
x 6.996
245g
y 6.996
149g
g
149%
109.14。
