酶工程实验一的标准曲线
酶工程实验

实验一淀粉酶的提取及活力测定一、实验目的淀粉酶几乎存在于所有植物中,其中以禾谷类种子的淀粉酶活性较强。
水稻萌发时淀粉酶活性最强。
水稻萌发时淀粉活性的大小与种子萌发力有关。
本实验通过对水稻萌发期淀粉酶活性测定,学习和掌握淀粉酶的测定方法,了解水稻生长与之代谢的关系。
二、原理淀粉酶能将淀粉水解成麦芽糖,由于麦芽糖能将3,5-二硝基水杨酸试剂还原成3-氨基-5-硝基水杨酸的橙红色化合物,且在一定范围内还原糖的浓度与反应液的颜色成正比,故利用比色法可求出麦芽糖的含量。
以5分钟内每克样品水解产生麦芽糖的毫克数表示酶活性的大小。
植物淀粉酶可分为α-淀粉酶和β-淀粉酶两种,其中β-淀粉酶不耐热,在温度70℃以上易钝化:而α-淀粉酶不耐酸,在pH3.6以下则发生钝化。
根据以上特性,可分别测定这两种淀粉酶的活性。
如测定α-淀粉酶和β-淀粉酶的活性,即为淀粉酶总活性。
三、实验材料、仪器及试剂1.仪器:20ml具塞试管移液管 100ml容量瓶石英砂研钵721型分光光度计离心机恒温水箱离心管2.试剂:(1)1%淀粉溶液:称1.0克可溶性淀粉,加入100ml蒸馏水煮沸。
(临用时配制)(2)pH5.6柠檬酸缓冲液:A、称取柠檬酸21.0克,溶解后定容至1000ml;B、称取柠檬酸钠29.4克,溶解后定容至1000ml;量取A液55ml与B液145ml混匀,即为pH5.6的缓冲液。
(3)0.4mol/L氢氧化钠溶液。
(4)3,5-二硝基水杨酸试剂:取1.0克3,5-二硝基水杨酸,溶于20ml 2mol/L氢氧化钠中,加入50ml蒸馏水,再加入30克酒石酸钾钠,待溶解后,用蒸馏水稀释至100ml,盖紧瓶盖,勿使二氧化碳进入。
(5)麦芽糖标准溶液:称取0.1000克麦芽糖,溶于少量蒸馏水中,然后定容至100ml,取为1mg/ml麦芽糖标准液。
实验材料:萌发水稻种子。
四、实验方法1.酶液的制备:称取去根萌发水稻种子2克(含外壳),置研钵中,加1克石英沙研磨成匀浆。
高中生物必修1优质课件 微专题二 关于酶的实验设计及曲线分析

3.底物浓度影响酶促反应速率曲线的分析
(1)底物浓度较低时,酶促反应速率与底物浓度成正比,即随底物浓度的增加而加快。 (2)当所有的酶都与底物结合后,再增加底物浓度,酶促反应速率不再加快。
4.酶浓度影响酶促反应速率曲线的分析
在有足够底物且不受其他因素影响的情况下,酶促反应速率与酶浓度成正比。 5.温度和pH共同作用对酶活性的影响
实
二 在冰水中水浴5 min 在60 ℃温水中水浴5 min 在沸水中水浴5 min
验
1与1′试管内液体混 2与2′试管内液体混合,3与3′试管内液体混合,
步三
合,摇匀
摇匀
摇匀
骤
四 在冰水中水浴数分钟 在60 ℃温水中水浴数分钟 在沸水中水浴数分钟
五
取出试管,分别滴加2滴碘液,摇匀,观察现象
实验现象
呈蓝色
无蓝色出现
呈蓝色
结论 酶发挥催化作用需要适宜的温度条件,温度过高或过低都会影响酶活性
(2)探究pH对酶活性的影响 ①实验原理:H2O2 —过—氧—化—氢—酶→ H2O+O2。 ②实验步骤
实验步骤
实验操作内容
试管1
试管2
试管3
一 注入等量过氧化氢酶溶液
2滴
2滴
2滴
二
注入不同pH的溶液 1 mL蒸馏水 1 mL盐酸 1 mL NaOH溶液
例2 取经过编号的5支试管分别加入2 mL物质的量浓度为0.5 mol/L的过氧化氢溶液, 进行如下实验,根据实验内容,下列说法正确的是
试管编号
1
2
3
4
5
加入物质 适量唾液 锈铁钉 生土豆块 熟土豆块 生土豆块+稀盐酸
实验结果 几乎无气泡 少量气泡 大量气泡 几乎无气泡 几乎无气泡
酶标仪标准曲线制作方法

酶标仪标准曲线制作方法
酶标仪标准曲线制作方法一般包括以下步骤:
1. 准备标准品溶液:选择适当的标准品(纯品或已知浓度的样品),按需稀释至一系列浓度的标准品溶液。
2. 准备反应试剂:根据实验需要,准备好酶底物、缓冲液和辅助试剂等反应试剂。
3. 操作酶标仪:打开酶标仪,设置光学路径和读取波长等参数,并进行预热和校准。
4. 建立曲线浓度组:按照实验要求和标准品的浓度,制定一系列浓度的曲线浓度组。
5. 加样:将标准品溶液和待测样品分别加入酶标板中的相应孔位。
6. 加入反应试剂:根据实验要求和试剂添加顺序,逐孔加入酶底物、缓冲液、辅助试剂等反应试剂。
注意控制反应液体积,并且在同一时间内添加相同试剂。
7. 反应:按照实验要求记录反应时间,并确保所有孔位具有相同的反应时间。
8. 停止反应:根据实验要求,在特定时间点上加入停止剂,停止反应。
9. 读取吸光度:将酶标板插入酶标仪,选择正确的读取波长,并读取各孔位的吸光度值。
10. 绘制标准曲线:将吸光度值绘制在纵坐标上,将标准品浓
度绘制在横坐标上,利用数据处理软件绘制标准曲线。
可以使用线性回归或其他拟合方法拟合吸光度和浓度之间的关系。
11. 分析和计算:根据标准曲线,通过读取各孔位的吸光度值,并利用标准曲线来计算待测样品的浓度或活性等参数。
这种方法通常用于酶标仪检测酶活性、浓度或其他相关分析。
具体操作步骤可能会根据实验的目的和要求有所变化,因此需要结合具体实验方案来进行操作。
酶分析方法(分光光度法)

SOD、CAT,SP ,GST& MDA测定标准(4ml检测体系) ✧酶提取液:Tris-HCl-EDTA (pH 8.0)提取液,由实验室冰箱放置的母液A、B和EDTA配制而成。
✧酶测定液:Tris-HCl(pH 8.0)提取液,由实验室冰箱放置的母液A、B按比例配制而成。
[1] SP 测定(考马斯亮蓝)✓考马斯亮蓝溶液配制:0.005g考马斯亮蓝+10 mL 95%乙醇+10 mL 磷酸,蒸馏水定容200 mL✓牛血清蛋白配制:100 μg/mL,0.01g 蛋白,蒸馏水定容到100 mL。
●SP含量测定0.5mL 酶液+0.5mL水+3.0mL考马斯亮蓝,595nm测定[2] SOD测定(邻苯三酚法)✓3mM邻苯三酚配制:0.038g 定容100 mL。
●邻苯三酚自氧化速率测定:0.2mL邻苯三酚+3.6mL 测定液每30s测A325,测定4次。
●酶测定:0.2mL邻苯三酚 3.3 mL 测定液+0.5mL酶液30s测A325,测定4次。
[3] CAT测定(钼酸铵法)✓10mM钼酸铵配制: 1.236g定容100mL✓10mM H2O2: 取50μL 30% H2O2定容50mL●酶测定:O2+0.5mL计时加入钼酸铵3.3mL(终止反0.2mL H应)[3] GST测定✓3mM GSH配制,已配制好✓1mM CDNB,已配制好备案:3.6mL 测定液+0.2mL CDNB+0.2mL GSH, 340nm测定对照:3.1mL 测定液+0.5mL酶液+0.2mL CDNB, 340nm测定+0.2mL GSH, 340nm测定2min.[4] MDA测定✓5% 三氯乙酸配制100mL0.6% TBA 溶液100mL2.0mL 测定液+1.0mL 三氯乙酸+0.5mL酶液+0.5mL TBA溶液,混合于沸水中15min,532、600和450nm波长下测定。
酶工程实验指导

酶工程实验指导西南农业大学农学与生物科技学院2009年3月实验一产蛋白酶菌株的分离一、实验目的学习胞外生产微生物菌种的分离选择,熟悉分离菌种的基本操作。
二、实验原理工业上常用的生产酶的微生物有许多,重要的有枯草杆菌和真菌中的曲霉等等,它们都能产生耐热的芽孢或分生孢子,分离这类菌种时可采取先进行一定的热处理杀灭其它营养细胞,提高该菌株的相对数目。
根据胞外酶能分泌到培养基的特点,采用一定的方法在培养基上形成单菌落分泌的酶形成的“水解透明圈”,可对产酶的微生物的产酶能力(活力)进行初步估计、分离高产酶的微生物。
三、试剂、仪器高压灭菌锅,天平,无菌超净工作台,培养皿(8套/组)、试管(2支/组)、三角瓶、烧杯、酵母膏,蛋白胨,NaCl、琼脂粉,奶粉三、操作步骤1、带菌土壤的热处理称取1g带菌土壤湿润后放入80℃烘箱处理30min。
2、分离选择培养基的配制,各组按下列比例配制120ml培养基:奶粉2g ,自来水50ml,装入50ml三角瓶琼脂1.8g ,NaCl 0.5g,自来水70ml,装入100ml三角瓶自来水50ml,装入50ml三角瓶取50ml烧杯一个,放入5支带帽5ml离心管,灭菌备用。
分别封口,常规灭菌(121℃、20min),灭菌后待冷却至不太烫手时混合上述液体,按无菌操作要领迅速倒平板8个,其中4个加有0.2ml不同稀释倍数(操作5)的样品液(菌悬液),迅速混合冷却形成平板,余4个平板冷却后用于涂布筛选。
3、稀释制备菌液,取5支灭菌带帽5ml离心管,各加入无菌水3.6ml备用;将热处理过的土壤放入无菌50ml烧杯中,加入无菌水10ml,搅拌后静置片刻,上层液体为微生物悬液,按下法稀释微生物悬液:在第一支试管中加入0.4ml微生物悬液,混合均匀后再取0.4ml到第二支试管中混合,从第二支试管中再取0.4ml到第三支试管中,以此类推。
4、斜面培养基配制:配制100ml LB培养基,加入1.5g琼脂粉、蛋白胨1.0g、酵母膏1.0g、NaCl、1.0g加水到100ml,调节pH=7,加热融化后,各组倒斜面培养基2 支,灭菌备用。
酶工程实验报告一(纤维素酶活力测定)

葡萄糖标准曲线制作 滤纸酶活力(FPA)的测定 羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定
D 3酶活定义
D 3.1纤维素酶:在各种酶组分的协同作用下,能降解纤维素,使之变成纤维寡糖、纤维二糖和葡萄糖的酶。
D 3.2滤纸酶活力Filterp apera ctivity (FPA)
A 2.2羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定中仪器:自动连续多档分配器、漩涡混合器试管、水浴等仪器同A 2.1
B2试剂和溶液(除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。)
B 2.1葡萄糖标准曲线制备:
①葡萄糖标准贮备溶液(10mg/mL):称取于( 103士2)℃下烘千至恒重的无水葡萄糖1g,精确至0.1mg,用水溶解并定容至100mL,
lg固体酶(或1mL液体酶),在(50士0.1)℃,指定pH条件下(酸性纤维素酶pH4.8,中性纤维素酶pH 6.0), lh水解滤纸底物,产生出相当于l mg葡萄糖的还原糖量,为1个酶活力单位,以u/g(或u/mL)表示。
D 3.3羧甲基纤维素酶活力( CMCA)
D 3.3.1还原糖法lg固体酶(或1mL液体酶),在(50士0.1)℃、指定pH条件下(酸性纤维素酶pH4 .8,中性纤维素酶pH 6.0), lh水解羧甲基纤维素钠底物,产生出相当于1 mg葡萄糖的还原糖量,为1个酶活力单位,以u/g(或u/mL)表示。简写为CMCA-DNS。
⑥以空白管(对照液)调仪器零点,在分光光度计波长540nm下,用10mm比色杯,分别测量三支样品管中样液的吸光度,取平均值。通过查标准曲线或用线性回归方程求出还原糖的含量。
D 4.3滤纸酶活力(FPA)的测定步操作流程:如表二所示:
酶工程实验报告一(纤维素酶活力测定)

精确记时:每一管加入酶液的时间要做记录,每管之间间隔的时间要合理;
避免试管进水:煮沸和用流水冲洗时;
5实验处理
A 5实验现象、数据及观察结果
A 5.1标准曲线的测量结果:如表四:
试管编号
0
1
2
3
4
5
OD(540nm)值
—
0.0595
0.2135
0.345
0.493
B 4.2滤纸条的准备:
①将待用滤纸放入(硅胶)干燥器中平衡24h:
②将水分平衡后的滤纸制成宽1cm、质量为(50士05)mg的滤纸条,折成M型备用。
B4.3操作步骤:
①取三支25mL刻度具塞试管(一支空白管,二支样品管)。实验中分为两组:pH
4.8与pH6.0。pH 4.8酶液稀释到1000倍,pH 6.0酶液稀释到5000倍。
步骤7
加入0.5mL待测酶液,
沸水浴煮沸10min
沸水浴煮沸10min9
加蒸馏水定容至25mL,混匀
步骤10
OD540nm比色
(注意:OD =(A+B)/ 2,比色前根据具体情况稀释相应的倍数。)
表二
D4.4羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定操作流程:如表三所示:
XX
XX
1、实验目的
1.1学习并了解纤维素酶的基本特性;
1.2学习酶活力的测定方法;
1.3学习还原糖的测定、标准曲线的制作及分光光度计的使用方法;
1.4学会对实验数据的处理及实验报告的撰写;
2、实验仪器、试剂和溶液:
A2仪器:
A2.1滤纸酶活力(FPA)的测定中仪器:除普通实验室仪器外,还应有:分光光度计、酸度计精度士0.01 pH、恒温水浴(50士0.l)0C、分析天平感量0.1mg、磁力搅拌器、秒表或定时钟、沸7k洛(可用800W申炉和高脚烧杯、楠夸量杯或茸楠奔器切成)、具塞刻度试管25mL。
《酶工程实验》word版

实验一过氧化氢酶米氏常数的测定一、目的了解米氏常数的意义,测定过氧化氢酶的米氏常数。
二、实验原理H2O2被过氧化氢酶分解出H2O和O2,未分解的H2O2用KMNO4在酸性环境中滴定,根据反应前后H2O2的浓度差可求出反应速度。
本实验以马铃薯提供过氧化氢酶,以1/ν~1/[S]作图求Km三、实验器材1.锥形瓶100~150ml(×6)。
2.吸管1.0ml(×2)、0.5ml(×2)、2.0ml(×2)、5ml(×2)、10.0ml(×1)。
3.温度计(0~100℃)。
4.微量滴定管5ml(×1)。
5.容量瓶1000ml(×1)。
四、实验试剂1、0.02mol/L磷酸缓冲液(Ph7.0)取磷酸二氢钾 0.68g,加0.1mol/L氢氧化钠溶液 29.1ml,用水稀释至100ml,即得。
2、酶液:称取马铃薯5g,加上述缓冲液10ml,匀浆,过滤。
3、0.02mol/L KMnO4:称取KMnO4(AR)3.2g,加蒸馏水1000ml,煮沸15min,2d后过滤,棕色瓶保存。
4、0.004mol/L KMnO4:准确称取恒重草酸钠0.2g,加250ml冷沸水及10ml浓硫酸,搅拌溶解,用0.02ml/L的KMnO4滴定至微红色,水浴,加热至65℃,继续滴定至溶液微红色并30s不褪,算出KMnO4的准确浓度稀释成0.004mol/L即可。
5、0.05 mol/L H2O2:取30% H2O223ml加入1000ml容量瓶中,加蒸馏水至刻度(约0.2mol/L),用标准KMnO4(0.004mol/L)标定其准确浓度,稀释成0.05mol/L(标定前稀释4倍,取2.0ml,加25% H2SO42.0ml,用0.004mol/LKMnO4滴定至微红色)。
6、25% H2SO4五、操作取锥形瓶6只,按下表顺序加入试剂:表一过氧化氢酶米氏常数的测定管号试剂0123450.05mol/L H2O2/ml蒸馏水/ml酶液/ml9.50.51.008.500.51.258.250.51.677.830.52.57.00.55.004.500.5先加好0.05mol/L H2O2及蒸馏水,加酶液后立即混合,依次记录各瓶的起始反应时间。
酶工程实验报告一

酶工程实验报告一一、实验目的本次酶工程实验的主要目的是通过实际操作,深入了解酶的性质、作用机制以及酶的分离纯化和活性测定方法。
同时,培养我们的实验操作技能、观察分析能力和科学思维方法,为今后从事相关领域的研究和工作打下坚实的基础。
二、实验原理酶是一种具有生物催化功能的蛋白质或 RNA 分子。
它们能够在温和的条件下高效地催化各种化学反应,具有高度的特异性和催化效率。
本实验中所涉及的酶主要是蛋白酶和淀粉酶。
蛋白酶能够水解蛋白质中的肽键,将蛋白质分解为小分子肽和氨基酸。
其活性可以通过测定水解产物的生成量或底物的消耗量来进行评估。
淀粉酶能够水解淀粉分子中的α-1,4 糖苷键,将淀粉分解为麦芽糖和葡萄糖等小分子物质。
其活性通常通过测定淀粉的水解程度来确定,常用的方法是碘量法。
酶的分离纯化是基于酶与杂质在物理化学性质上的差异,如溶解度、分子大小、电荷性质等,采用一系列的分离技术,如沉淀、层析、电泳等,逐步去除杂质,获得高纯度的酶。
三、实验材料与设备1、实验材料蛋白酶提取液淀粉酶提取液酪蛋白淀粉溶液福林酚试剂碘液其他化学试剂2、实验设备离心机分光光度计恒温水浴锅移液器电泳仪层析柱四、实验步骤制备酪蛋白底物溶液:称取一定量的酪蛋白,用氢氧化钠溶液溶解,调节 pH 至适宜值,定容备用。
设定反应体系:在试管中依次加入适量的蛋白酶提取液、酪蛋白底物溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入三氯乙酸溶液终止反应。
测定吸光度:离心去除沉淀,取上清液,加入福林酚试剂显色,在分光光度计上测定吸光度。
计算蛋白酶活性:根据标准曲线计算出反应生成的酪氨酸量,从而计算出蛋白酶的活性。
2、淀粉酶活性的测定制备淀粉溶液:称取一定量的淀粉,用缓冲液溶解,加热糊化,冷却后定容备用。
设定反应体系:在试管中依次加入适量的淀粉酶提取液、淀粉溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入碘液终止反应。
酶相关曲线

与酶相关的曲线分析 1.表示酶高效性的曲线
下列分析正确的是( A )
A.该酶催化反应的最适温度为35℃左右,最适pH为8 B.当pH为8时,影响反应速率的主要因素是底物浓度和酶浓度 C.随pH升高,该酶催化反应的最适温度也逐渐升高 D.当pH为任何一固定值时,实验结果都可以证明温度对反应速 率的影响
典例2、图中表示某酶在不同处理条件(a、b、c)下催化某反
应生成物的量和反应时间的关系,解读此图可获得的信息是(D)
A.三个处理中b是此酶促反应的最适条件 B.三个处理条件的差异不可能是酶制剂的量不同 C.三个处理条件的差异可能是反应底物的量不同 D.三个处理条件的差异可能是处理温度的不同
典例3、如图所示在不同条件下的酶促反应速率变化曲线,下列据
图叙述错误的是 ( D )
成有哪些?
量
酶的活性(pH、温度) 酶的相对含量(酶浓度、底物浓度) 反
时间
应 速
B
率
③下图中,影响A点的因素有哪些?
A
影响B点的因素有哪些?
底物浓度
A点是酶含量充足,影响因素有底物的浓度,酶的活性
B点是底物量充足,影响因素有酶的浓度,酶的活性
典例1、某同学研究温度和pH对某酶 促反应速率的影响,得到如图的曲线。
5.底物浓度影响酶促反应的曲线 达到一定浓度后不再增加,原因 是受到酶数量和酶活性的限制。
6.酶浓度影响酶促反应的曲线 在底物充足、其他条件适宜且固 定的条件下,酶促反应速率与酶 浓度成正比。
酶工程实验报告

酶工程实验报告指导老师:学号:20070830姓名:班级:生物技术班**师范大学生命科学学院07级2010-11-15生物工程实验指导(酶工程部分)实验一木瓜蛋白酶的分离纯化及酶活检测一、概述以半胱氨酸内肽酶为主(包括木瓜蛋白酶,简称PAP、木瓜蛋白酶Ω,简称CAR、木瓜凝乳蛋白酶,简称CHP和木瓜凝乳蛋白酶M,简称GEP)的木瓜蛋白酶是从植物番木瓜中分离纯化而得的一种混合酶。
这种酶广泛存在于番木瓜的根、茎、叶和果实内,其中以为成熟的果实乳汁中含量最高,约占乳汁干中的40%。
其最大的用途是在食品工业方面,防除啤酒冷藏混浊,嫩化肉类,生产调味品,烘烤面包,乳酪制品及谷类和速溶食品的蛋白质强化生产。
在动物饲料加工方面,用于鱼蛋白浓缩物和油籽饼处理,能提高氮的可溶性指数和蛋白质的可分散指数。
少量在皮革工业作软化剂、纺织工业作丝织品脱胶清洁剂和废胶卷回收报等。
在医药方面,主要用于治胃炎、消化不良以及用于肉赘摘除、伤痕处理、脱毛、清洁皮肤和新近的裂腭整形外科及制木瓜凝乳蛋白酶注射剂治疗脊骨盘脱出症等。
木瓜蛋白酶是一种巯基蛋白酶,其专一性较差,能分解比胰脏蛋白酶更多的蛋白质。
木瓜蛋白酶是单条链,有211个氨基酸残基组,相对分子量23000。
木瓜凝乳蛋白酶,相对分子量36000,约占可溶性蛋白质的45%。
溶菌酶,相对分子量2500,约占可溶性蛋白质的20%。
木瓜蛋白酶为白色、淡褐色无定型粉末或颗粒。
略溶于水、甘油,不溶于乙醚、乙醇和氯仿。
水溶液无色至淡黄色,有时呈乳白色。
最适pH为5.0~8.0,微吸湿,有硫化氰臭。
最适温度65℃,易变性失活。
木瓜蛋白酶等电点pH=9.6。
半胱氨酸、硫化物、亚硫酸盐和EDTA是木瓜蛋白酶激活剂,巯基试剂和过氧化氢是木瓜蛋白酶的抑制剂。
二、实验目的1、学习和掌握木瓜蛋白酶分离纯化的原理、方法和工艺过程,包括盐析、酶活力保护、结晶与重结晶。
2、掌握木瓜蛋白酶活力的测定方法和原理。
酶工程实验

酶工程实验实验一、纤维素酶活力测定及酶促动力学研究一、原理:酶促动力学研究酶促反应的速度及影响速度的各种因素,而米氏常数K m值等于酶促反应速度为最大速度一般时所对应的底物浓度,其值大小与酶的浓度无关,是酶促反应的特征常数。
不同酶的K m值不同,同一种酶与不同的底物反应时,其K m值也不同,K m值反映了酶和底物亲和力的强弱程度,K m值越大,表明酶和底物的亲和力越弱;K m值越小,表明酶与底物的亲和力越强。
酶的活力就是酶催化的反应速度,通常用单位时间内底物的减少或产物的增加来表示。
酶反应过程中产物的生成和时间的关系可以用进程曲线来说明,曲线的斜率就是酶反应过程中的反应速度。
从进程曲线来看,在一定时间内反应速度维持恒定,但随着时间的延长,反应速度逐渐降低,这是由多种因素造成的。
所以,为了准确表示酶的反应速度必须采用初速度,即保持恒定时的速度。
同样,不同酶浓度下的反应进程曲线也可以说明这个问题。
酶活力可以被某些物质改变,凡能降低酶的活力甚至使酶失活的物质,均称为抑制剂,分为可逆抑制和不可逆抑制两种类型。
可逆抑制包括竞争性抑制、非竞争性抑制等类型。
在有抑制剂存在的条件下,酶的一些动力学性质会发生改变,如K m,V max等,可通过作图法求得,作图法很多,最常用的就是Lineweaver-Burk作图法(即双倒数作图法)。
二、仪器和试剂1、仪器: (1)恒温水浴锅(2)电炉(3)722分光光度计(4)试管、移液管若干2、试剂: (1)DNS溶液(结晶酚、氢氧化钠、亚硫酸氢钠、酒石酸钾钠、3,5-二硝基水杨酸) (2)2.5mmol/L 葡萄糖溶液(3)0.5%羧甲基纤维素钠溶液(4)1mg/ml纤维素酶溶液(5)磷酸缓冲液pH5.8 (6)8mol/lL 脲(mL)(7)蒸馏水三、操作步骤1、标准曲线绘制: 用浓度为2.5mmol/L的葡萄糖溶液配制终浓度分别为0.05、0.1、0.15、0.2、0.25(mmol/L)葡萄糖溶液进行实验。
酶反应动力学实验数据的曲线拟合分析

酶反应动力学实验数据的曲线拟合分析学号:K071041415 姓名:高杰一、实验目的掌握酶反应动力学实验数据的统计方法;理解米氏方程中Vmax和Km的计算方法。
理解线性拟合和非线性拟合的区别。
二、实验原理利用Origin 8.0软件进行统计、线性回归和非线性回归分析。
Origin软件是美国Microcal公司推出的优秀数据分析和绘图软件。
像Windows操作系统下其他窗口软件一样,Origin采用图形化的面向对象的窗口菜单和工具栏操作,功能强大,操作简单,提供最直观的数学分析和绘图环境,在各国科技工作者中广泛使用。
三、酶动力学实验数据一个固定量的酶溶液加到含有不同底物浓度的一系列反应混合物中,初始速率可通过产物生成的进行曲线的初始斜率得到。
数据如右:四、实验内容4.1酶动力学实验数据的统计分析(反应速率的平均值和实验误差)步骤:①打开Origin 8.0②在工作表窗口(data)中输入数据③拖动鼠标选定两列实验数据A、B,用菜单Statistics→Descriptive Statistics→Statistics on Rows命令。
4.2 绘制带误差标记的散点图■拷贝A列、mean列和SD列;单击工具栏中的New worksheet(新工作表),并CTR+V黏贴数据。
■双击C(Y)列,弹出Column properpies,将Options中的Plot Designation项改为Y error,单击OK。
■选定整个工作表格,单击散点图按钮。
编辑X轴和Y轴坐标标题,定制两坐标的起点都为0。
因没有重复实验,所以直接选定A,B两列,点击绘制散点图4.3实验数据的曲线拟合4.3.1 线性拟合分析操作步骤①将Book1中的A、B列数据复制到一个新的工作表Book2。
②增加两个新列C和D列。
③双击C列标签,更改Plot Designation为X。
选定C列,右键单击,弹出快捷菜单,选择Set Column Values项,在对话框中输入1/Col(A),即A列的倒数,单击OK。
酶标准曲线实验报告

一、实验目的1. 了解酶的活性测定原理和方法。
2. 掌握酶联免疫吸附测定(ELISA)技术的基本操作步骤。
3. 通过绘制酶标准曲线,确定酶的活性浓度。
二、实验原理酶是一种生物催化剂,具有高度的专一性和高效性。
酶的活性是指酶催化一定化学反应的能力。
酶联免疫吸附测定(ELISA)是一种常用的酶活性测定方法,其原理是利用抗原抗体特异性结合的原理,通过检测酶标记的抗体与抗原的结合情况来反映酶的活性。
三、实验材料1. 试剂:酶标抗体、酶底物、底物缓冲液、封板胶、洗涤液等。
2. 仪器:酶标仪、微量移液器、移液枪、酶标板、离心机等。
四、实验步骤1. 准备工作(1)将酶标板放置在酶标仪上,预热至室温。
(2)将酶标抗体、酶底物、底物缓冲液、封板胶、洗涤液等试剂取出,放于室温。
2. 标准曲线制作(1)设置标准品浓度梯度:将酶标抗体稀释成不同浓度,分别为0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8、25.6、51.2、102.4 μg/mL。
(2)将酶标板编号,每孔加入100 μL的标准品,空白孔加入100 μL的洗涤液。
(3)将酶标板放入酶标仪,设置反应时间为30分钟,于450 nm波长下检测吸光度(A)。
(4)根据吸光度值,以标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
3. 样品测定(1)将样品稀释成适宜浓度。
(2)按照标准曲线制作步骤,进行样品的测定。
(3)根据标准曲线,计算样品的酶活性浓度。
五、实验结果与分析1. 标准曲线制作根据实验数据,绘制标准曲线,得到R²=0.998,表明标准曲线拟合良好。
2. 样品测定根据标准曲线,计算样品的酶活性浓度为X μg/mL。
六、实验结论1. 通过酶联免疫吸附测定(ELISA)技术,成功绘制了酶标准曲线,为酶活性测定提供了可靠依据。
2. 实验结果表明,该酶的活性浓度在0.1~102.4 μg/mL范围内具有良好的线性关系。
3. 该实验方法操作简便,结果准确,为后续酶活性研究提供了有力支持。
酶标仪测吸光度标准曲线

酶标仪测吸光度标准曲线一、引言随着生物技术的发展,越来越多的实验需要测定溶液中的物质浓度。
其中,酶标仪是一种常用的实验设备,通过测定吸光度来间接测定物质浓度。
在实验过程中,建立吸光度与物质浓度之间的标准曲线是必不可少的一步。
本文将详细探讨酶标仪测吸光度标准曲线的方法和步骤。
二、建立标准曲线的目的建立标准曲线的主要目的是为了将待测样品的吸光度值转化为相应的物质浓度。
通过测定一系列已知浓度的标准溶液的吸光度,并绘制吸光度与浓度之间的关系曲线,可以利用这条曲线来推断未知样品的浓度。
三、建立标准曲线的步骤3.1 准备标准溶液首先,准备一系列已知浓度的标准溶液,浓度应尽量覆盖待测样品的浓度范围。
标准溶液可以通过稀释已知浓度的物质制备,或者使用商业标准品。
确保标准溶液的稳定性和准确性。
3.2 准备工作区域在实验室里选择一个干净的、无尘的、光线充足的工作区域。
将酶标仪放置在水平台上,并连接所需的电源和电缆。
确保仪器处于正常工作状态。
3.3 设置仪器参数根据待测样品的特性,选择合适的波长和滤光片,并设置酶标仪的参数。
一般情况下,常用的波长为450 nm或490 nm。
3.4 检查光路在开始测量之前,确保酶标仪的光路是正常的。
可以使用空白溶液进行光路校准,确认仪器的零吸光度符合要求。
3.5 测量标准溶液的吸光度使用移液管将每个标准溶液分别移至相应的试管中,并放入酶标仪中进行测量。
确保每个标准溶液都有足够重复次数的测量值。
3.6 计算吸光度与浓度之间的关系将测得的吸光度值与相应的浓度值进行统计和整理。
可以采用计算机软件绘制标准曲线,也可以手工绘制,并拟合得到一个趋势线。
常用的拟合方法有线性拟合、对数拟合、多项式拟合等。
3.7 验证标准曲线的可靠性使用另外一组新的标准溶液进行测量,并根据已建立的标准曲线计算各样品的浓度。
将计算得到的浓度与实际浓度比较,判断标准曲线的可靠性。
3.8 利用标准曲线测定未知样品的浓度将待测样品的吸光度值测量并代入标准曲线,利用曲线的方程计算得到未知样品的浓度。
生物大实验2(酶工程实验)

实验一酶促反应中初速度时间范围测定一、实验目的1.了解酶促反应中初速度时间范围测定的基本原理;2.掌握酶促反应中初速度时间范围的测定方法。
二、实验原理酸性磷酸酯酶(acid phosphatase, EC 3.1.3.2)广泛分布于动植物体中,尤其是植物的种子、动物肝脏和人体的前列腺中。
它对生物体内核苷酸、磷蛋白和磷脂的代谢起着重要作用。
酸性磷酸酯酶能专一性水解磷酸单酯键。
以人工合成的对硝基苯磷酸酯(4-nitrophenyl phosphate,NPP)作底物,水解产生对硝基苯酚和磷酸。
在碱性溶液中,对硝基酚的盐离子于405nm处光吸收强烈,而底物没有这种特性。
利用产物的这种特性,可以定量的测定产物的生成量,从而求得酶的活力单位。
即通过测定单位时间内405nm处光吸收值的变化来确定酸性磷酸酯酶的活性。
酸性磷酸酯酶的一个活力单位是指在酶反应的最适条件下,每分钟生成1μmol产物所需的酶量。
要进行酶活力测定,首先要确定酶反应时间。
而酶的反应时间应该在初速度时间范围内选择。
可以通过进程曲线的制作来求出酶的初速度时间范围。
进程曲线的制作是指在酶反应的最适条件下,采用每隔一定时间测定产物生成量,以酶反应时间为横坐标,产物生成量为纵坐标绘制而成。
从进程曲线可知,在曲线起始的一段时间内为直线,其斜率代表初速度。
随着反应时间的延长,曲线趋于平坦,斜率变小,反应速度下降。
要真实反映出酶活力大小,就应在初速度时间内测定。
三、实验试剂与器材1.试剂(1)酸性磷酸酯酶原液(从绿豆芽中提取)(2)酸性磷酸酯酶液(通过原酶液稀释得到)取原酶液,用0.05mol/L、pH5.0柠檬酸盐缓冲液稀释,使进程曲线中第11号管吸光度A405在0.6~0.7之间。
(3)1.2mmol/L对硝基苯磷酸酯精确称取NPP0.4454g,加缓冲液定容至100mL。
(4)0.3mol/LNaOH溶液2.器材恒温水浴槽,可见分光光度计,试管,刻度吸管,离心机。
酶工程实验相关数据处理
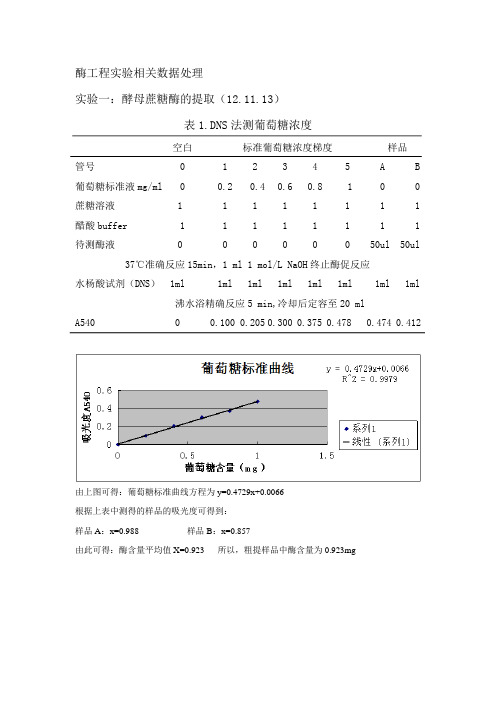
酶工程实验相关数据处理实验一:酵母蔗糖酶的提取(12.11.13)表1.DNS法测葡萄糖浓度空白标准葡萄糖浓度梯度样品管号 0 1 2 3 4 5 A B 葡萄糖标准液mg/ml 0 0.2 0.4 0.6 0.8 1 0 0 蔗糖溶液 1 1 1 1 1 1 1 1 醋酸buffer 1 1 1 1 1 1 1 1 待测酶液 0 0 0 0 0 0 50ul 50ul 37℃准确反应15min,1 ml 1 mol/L NaOH终止酶促反应水杨酸试剂(DNS) 1ml 1ml 1ml 1ml 1ml 1ml 1ml 1ml沸水浴精确反应5 min,冷却后定容至20 mlA540 0 0.100 0.205 0.300 0.375 0.478 0.474 0.412由上图可得:葡萄糖标准曲线方程为y=0.4729x+0.0066根据上表中测得的样品的吸光度可得到:样品A:x=0.988 样品B:x=0.857由此可得:酶含量平均值X=0.923 所以,粗提样品中酶含量为0.923mg实验二:蔗糖酶酶学性质研究(2012.11.14)表2.葡萄糖标准曲线绘制空白标准葡萄糖浓度梯度管号 0 1 2 3 4 5葡萄糖标准液mg/ml 0 0.2 0.4 0.6 0.8 1蔗糖溶液(ml) 1 1 1 1 1 1醋酸buffer(ml) 1 1 1 1 1 1 37℃准确反应15min,1 ml 1 mol/L NaOH终止酶促反应水杨酸试剂(DNS) 1ml 1ml 1ml 1ml 1ml 1ml 沸水浴精确反应5 min,冷却后定容至20 mlA540 0 0.088 0.176 0.297 0.402 0.452由图可知,葡萄糖标准曲线方程为:y=0.4747x-0.00151、最适pH的测定(1)待测组的加样量及加样顺序表3.pH对酶活力的影响管号 1 2 3 4 5 6 7蔗糖溶液(ml) 1 1 1 1 1 1 1不同pH缓冲液(ml) 1 1 1 1 1 1 1体系pH 2.5 3.0 4.0 5.0 6.0 7.0 8.0待测酶液 50ul 50ul 50ul 50ul 50ul 50ul 50ul37℃准确反应15min,1 ml 1 mol/L NaOH终止酶促反应水杨酸试剂(DNS) 1ml 1ml 1ml 1ml 1ml 1ml 1ml沸水浴精确反应5 min,冷却后定容至20 mlA540 0.017 0.035 0.053 0.063 0.054 0.024 0.004 (2)空白组的加样量及加样顺序空白组的加样量与待测组的相同,不同之处在于空白组先各加1ml 1 mol/L NaOH,然后进行37℃水浴,其余顺序及时间均相同。
elisa五参数标准曲线

elisa五参数标准曲线ELISA(酶联免疫吸附试验)是一种常用的生物化学分析方法,广泛应用于医学、生物学和生物技术领域。
在ELISA实验中,为了准确测量待测物的浓度,需要建立一个标准曲线来进行定量分析。
而ELISA五参数标准曲线就是一种常用的标准曲线建立方法。
ELISA五参数标准曲线是基于五个参数的非线性回归模型,用于计算待测物的浓度。
这五个参数分别是最大吸光度(ODmax)、最小吸光度(ODmin)、标准品的浓度(C)、标准品的吸光度(OD)以及待测样品的吸光度(ODx)。
通过测量标准品的吸光度和浓度,可以建立一个标准曲线,然后根据待测样品的吸光度,利用标准曲线计算出待测物的浓度。
建立ELISA五参数标准曲线的步骤如下:1. 准备标准品:选择一系列已知浓度的标准品,通常是从高到低依次稀释。
每个标准品都要进行重复测量,以获得准确的吸光度值。
2. 测量吸光度:将标准品和待测样品分别加入ELISA板中,然后使用酶标仪测量吸光度。
吸光度值反映了待测物的浓度。
3. 绘制标准曲线:将标准品的浓度(C)作为横坐标,吸光度(OD)作为纵坐标,绘制标准曲线。
通常使用对数坐标来绘制曲线,以适应各种浓度范围。
4. 计算五个参数:根据标准曲线,计算出五个参数的值。
最大吸光度(ODmax)是标准曲线的最高点,最小吸光度(ODmin)是标准曲线的最低点,标准品的浓度(C)是标准曲线上的已知浓度点,标准品的吸光度(OD)是标准曲线上对应的吸光度值,待测样品的吸光度(ODx)是待测样品在标准曲线上的吸光度值。
5. 计算待测物浓度:利用五个参数的值,根据非线性回归模型,计算出待测物的浓度。
这个计算过程可以使用计算机软件或者在线工具来完成。
ELISA五参数标准曲线的优点是可以准确计算出待测物的浓度,并且适用于各种浓度范围。
它可以通过标准曲线上的已知浓度点和吸光度值,来推算出待测样品的浓度,从而实现定量分析。
然而,建立ELISA五参数标准曲线也存在一些注意事项。
