酶工程实验
酶工程实验报告三(纤维素酶最适反应pH值的测定)

本科学生实验报告学号104120440 姓名孙永升学院—生命科学学院专业、班级10生物技术实验课程名称酶工程< 实验>教师及职称_______ 李俊俊< 讲师>开课学期2012 至2013 学年第二学期填报时间2013 年 4 月24 日云南师范大学教务处编印1、实验目的掌握酶最适pH值的测定方法及原理2、实验仪器、试剂和溶液:A 2仪器:紫外分光光度计、比色皿(3个)、恒温水浴锅(4台)、试管架(1个)、1ml移液管(1 根)、10ml移液管(1根)、玻璃棒(1根)、1000ml烧杯(1个)、500ml烧杯(2个)、1000ml容量瓶(1个)、洗耳球(1个)、标签(若干)等。
B2试剂和溶液①DNS试剂(CMCA-DNS ):称取3,5 一二硝基水杨酸(10士0.1) g,置于约600mL水中,逐渐加入氢氧化钠log,在50C水浴中(磁力)搅拌溶解,再依次加入酒石酸甲钠200 g、苯酚(重蒸)2g和无水亚硫酸钠5g,待全部溶解并澄清后,冷却至室温,用水定容至1000mL,过滤。
贮存于棕色试剂瓶中,于暗处放置7d后使用。
②乙酸-乙酸钠缓冲液,0.01mol/L③CMC-Na溶液(底物溶液)④纤维素酶液(pH4 .8和pH6 .0)。
3、实验原理及实验流程或装置示意图:A 3原理:pH值对酶反应速度有显著影响。
每一种酶都有一个特定的最适反应pH值,在此pH值下酶反应速度最快,而在此pH值两侧酶反应速度都会受到影响而放缓。
因为酶蛋白是两性电解质,具有许多可解离基团,在不同的酸碱环境中这些基团的解离状态不同,所带电荷不同,而他们的解离状态对保持酶的结构,底物与酶的结合能力以及催化能力都有重要作用。
表现酶最大活性的pH值即为该酶的最适pH值。
不同的酶其最适pH 值不同。
pH与酶活性关系的测定是在其它条件(如底物浓度、酶浓度、反应温度等)恒定的最适情况下,选用一系列变化的pH环境中进行初速度测定,其图形一般为钟形曲线。
酶工程实验
实验一考马斯亮蓝G-250测蛋白含量一、实验目的:学习常用的测定蛋白质含量的方法。
二、原理考马斯亮蓝G250(R250)具有红色和蓝色两种色调。
在酸性溶液中,其以游离态存在呈棕红色;当它与蛋白质中碱性氨基酸(特别是精氨酸)和芳香族的氨基酸残基通过疏水作用结合后变为蓝色,染料的最大吸收峰的位置由465nm变为595nm。
它染色灵敏度高,比氨基黑高3倍。
反应速度快,约在2分钟左右时间达到平衡,在室温一小时内稳定。
在0.01 ~1.0mg蛋白质范围内,蛋白质浓度与A595值成正比。
所以常用来测定蛋白质含量。
三、试剂与仪器①标准蛋白溶液(牛血清蛋白1.0mg/ml)②考马斯亮蓝溶液:考马斯亮蓝G-250 100mg溶于50mL95%乙醇中,加100mL85%磷酸混匀,配成原液。
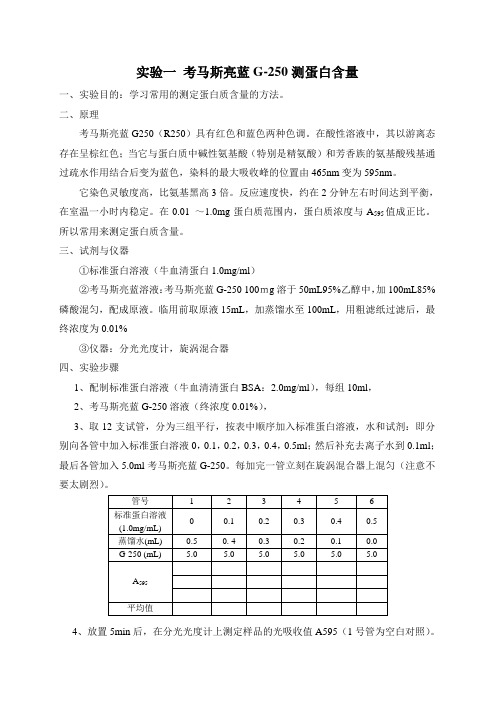
临用前取原液15mL,加蒸馏水至100mL,用粗滤纸过滤后,最终浓度为0.01%③仪器:分光光度计,旋涡混合器四、实验步骤1、配制标准蛋白溶液(牛血清清蛋白BSA:2.0mg/ml),每组10ml,2、考马斯亮蓝G-250溶液(终浓度0.01%),3、取12支试管,分为三组平行,按表中顺序加入标准蛋白溶液,水和试剂:即分别向各管中加入标准蛋白溶液0,0.1,0.2,0.3,0.4,0.5ml;然后补充去离子水到0.1ml;最后各管加入5.0ml考马斯亮蓝G-250。
每加完一管立刻在旋涡混合器上混匀(注意不要太剧烈)。
4、放置5min后,在分光光度计上测定样品的光吸收值A595(1号管为空白对照)。
5、用标准蛋白的量为横坐标,用A595为纵坐标,作标准曲线图,由此曲线,根据后续试验测出的未知样品的A595值,可查出未知样品的蛋白质含量。
6、实验结果分析:误差分析,为什么出现这样的结果,什么原因导致的?实验二3,5-二硝基水杨酸(DNS)法测定酶活力一、实验目的:学习DNS测定还原糖的方法二、实验原理:还原糖的测定是糖定量测定的基本方法。
酶工程实验报告册

酶工程实验报告册实验目的本次实验旨在通过酶工程技术,利用已知的酶催化反应,研究酶的可控性和催化效率,以此为基础进一步探讨酶工程在生物技术领域中的应用。
实验材料* 酶底物:葡萄糖溶液* 酶:葡萄糖酶* 实验器材:试管、显微镜、荧光分析仪实验步骤1. 准备实验器材和试剂,保证实验环境的洁净。
2. 将葡萄糖底物溶液放入试管中,分为十组,每组添加不同浓度的葡萄糖底物。
3. 将葡萄糖酶加入到每个试管中,调整酶的浓度。
4. 将试管放入恒温水浴中,使反应温度稳定在适宜的酶活性温度。
5. 设置实验时间,每隔一定时间取出一组试管进行荧光分析,记录反应速率。
实验结果根据实验数据得到以下结果:* 反应速率与底物浓度呈正相关关系,随着底物浓度的增加,反应速率也增加。
* 酶活性随着温度的增加呈增加趋势,但超过酶的适宜温度范围后,酶活性会急剧下降。
结果分析本实验结果表明葡萄糖酶催化反应具有高度的可控性和催化效率。
随着底物浓度的增加,酶催化反应速率增加,这可以为工业生产中的底物转化提供重要参考。
而温度对酶活性的影响也表明了酶工程中合适的条件选取的重要性,过高或过低的温度都会影响酶的活性,从而降低反应效率。
实验结论通过本次实验,我们验证了酶工程技术在酶催化反应中的重要作用。
酶工程技术不仅可以提高反应效率,还可以调控酶的活性和特异性,从而对底物进行选择性催化。
这对于工业生产和医药研发有着重要的意义。
实验心得通过本次实验,我深刻认识到酶工程技术在生物技术领域的重要性。
酶工程技术可以帮助我们解决传统催化反应过程中的瓶颈问题,提高反应的效率和选择性。
同时,酶工程技术还为制定合适的反应条件提供了理论依据,进一步推动了生物技术的发展。
总之,酶工程技术的应用前景广阔,未来可以在医药、食品、环境等多个领域中发挥重要作用。
酶工程实验指导

酶工程实验指导西南农业大学农学与生物科技学院2009年3月实验一产蛋白酶菌株的分离一、实验目的学习胞外生产微生物菌种的分离选择,熟悉分离菌种的基本操作。
二、实验原理工业上常用的生产酶的微生物有许多,重要的有枯草杆菌和真菌中的曲霉等等,它们都能产生耐热的芽孢或分生孢子,分离这类菌种时可采取先进行一定的热处理杀灭其它营养细胞,提高该菌株的相对数目。
根据胞外酶能分泌到培养基的特点,采用一定的方法在培养基上形成单菌落分泌的酶形成的“水解透明圈”,可对产酶的微生物的产酶能力(活力)进行初步估计、分离高产酶的微生物。
三、试剂、仪器高压灭菌锅,天平,无菌超净工作台,培养皿(8套/组)、试管(2支/组)、三角瓶、烧杯、酵母膏,蛋白胨,NaCl、琼脂粉,奶粉三、操作步骤1、带菌土壤的热处理称取1g带菌土壤湿润后放入80℃烘箱处理30min。
2、分离选择培养基的配制,各组按下列比例配制120ml培养基:奶粉2g ,自来水50ml,装入50ml三角瓶琼脂1.8g ,NaCl 0.5g,自来水70ml,装入100ml三角瓶自来水50ml,装入50ml三角瓶取50ml烧杯一个,放入5支带帽5ml离心管,灭菌备用。
分别封口,常规灭菌(121℃、20min),灭菌后待冷却至不太烫手时混合上述液体,按无菌操作要领迅速倒平板8个,其中4个加有0.2ml不同稀释倍数(操作5)的样品液(菌悬液),迅速混合冷却形成平板,余4个平板冷却后用于涂布筛选。
3、稀释制备菌液,取5支灭菌带帽5ml离心管,各加入无菌水3.6ml备用;将热处理过的土壤放入无菌50ml烧杯中,加入无菌水10ml,搅拌后静置片刻,上层液体为微生物悬液,按下法稀释微生物悬液:在第一支试管中加入0.4ml微生物悬液,混合均匀后再取0.4ml到第二支试管中混合,从第二支试管中再取0.4ml到第三支试管中,以此类推。
4、斜面培养基配制:配制100ml LB培养基,加入1.5g琼脂粉、蛋白胨1.0g、酵母膏1.0g、NaCl、1.0g加水到100ml,调节pH=7,加热融化后,各组倒斜面培养基2 支,灭菌备用。
酶工程实习报告

实习报告实习单位:XX生物科技有限公司实习时间:2021年6月1日至2021年8月31日实习内容:酶工程一、实习背景及目的作为一名生物技术专业的学生,我一直对酶工程领域充满兴趣。
酶工程是一门应用生物化学、微生物学和分子生物学等知识,通过现代生物技术手段对酶进行改造和应用的学科。
本次实习旨在让我深入了解酶工程的基本原理、技术方法和实际应用,提高我的实践能力和创新能力。
二、实习内容及心得1. 酶的筛选与改造在实习过程中,我参与了酶的筛选与改造项目。
首先,我们通过文献调研和实验室现有资源,选择了适合目标反应的酶。
然后,利用PCR技术对酶的基因进行克隆,并通过基因编辑技术对酶的氨基酸序列进行改造,以提高其催化活性和稳定性。
此外,我还学会了使用各种生物信息学工具对酶的三维结构进行预测和分析,为酶的改造提供理论依据。
2. 酶的表达与纯化在酶的筛选与改造过程中,我了解了酶的表达与纯化技术。
我们选用大肠杆菌作为宿主细胞,通过优化表达载体和培养条件,实现了酶的高效表达。
然后,采用凝胶过滤层析、离子交换层析和亲和层析等方法对酶进行纯化,以获得高纯度的酶制剂。
在此过程中,我掌握了各种层析技术的原理和操作技巧,并学会了使用相关设备进行实验操作。
3. 酶的应用与评价在酶的应用与评价方面,我参与了多个实际项目的研发。
例如,我们将筛选到的酶应用于生物制药、食品加工和环境保护等领域,评估其催化效果和实用性。
此外,我还参与了酶的动力学实验,通过测定酶的米氏常数(Km)和最大催化速率(Vmax),评估酶的催化性能。
这些实验让我深刻认识到酶在实际应用中的重要性和潜力。
4. 实习收获通过本次实习,我不仅掌握了酶工程的基本原理和技术方法,还提高了自己的实践能力和创新能力。
在实习过程中,我学会了查阅文献、分析实验数据和撰写实验报告。
同时,与导师和同事们的交流与合作,使我更加熟悉了实验室的运作方式和团队协作的重要性。
总之,本次实习让我在酶工程领域取得了丰硕的成果,为今后的学术研究和职业生涯奠定了基础。
酶工程实验报告一(纤维素酶活力测定)

葡萄糖标准曲线制作 滤纸酶活力(FPA)的测定 羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定
D 3酶活定义
D 3.1纤维素酶:在各种酶组分的协同作用下,能降解纤维素,使之变成纤维寡糖、纤维二糖和葡萄糖的酶。
D 3.2滤纸酶活力Filterp apera ctivity (FPA)
A 2.2羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定中仪器:自动连续多档分配器、漩涡混合器试管、水浴等仪器同A 2.1
B2试剂和溶液(除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水或去离子水或相当纯度的水。)
B 2.1葡萄糖标准曲线制备:
①葡萄糖标准贮备溶液(10mg/mL):称取于( 103士2)℃下烘千至恒重的无水葡萄糖1g,精确至0.1mg,用水溶解并定容至100mL,
lg固体酶(或1mL液体酶),在(50士0.1)℃,指定pH条件下(酸性纤维素酶pH4.8,中性纤维素酶pH 6.0), lh水解滤纸底物,产生出相当于l mg葡萄糖的还原糖量,为1个酶活力单位,以u/g(或u/mL)表示。
D 3.3羧甲基纤维素酶活力( CMCA)
D 3.3.1还原糖法lg固体酶(或1mL液体酶),在(50士0.1)℃、指定pH条件下(酸性纤维素酶pH4 .8,中性纤维素酶pH 6.0), lh水解羧甲基纤维素钠底物,产生出相当于1 mg葡萄糖的还原糖量,为1个酶活力单位,以u/g(或u/mL)表示。简写为CMCA-DNS。
⑥以空白管(对照液)调仪器零点,在分光光度计波长540nm下,用10mm比色杯,分别测量三支样品管中样液的吸光度,取平均值。通过查标准曲线或用线性回归方程求出还原糖的含量。
D 4.3滤纸酶活力(FPA)的测定步操作流程:如表二所示:
关于酶工程实验报告

一、实验目的1. 理解酶工程的基本原理和实验方法。
2. 学习酶的制备、纯化和活性测定等实验技术。
3. 掌握酶的催化特性和应用。
二、实验原理酶工程是指利用酶的催化特性,通过基因工程、蛋白质工程等手段,改造或制备具有特定功能的酶,以满足工业、医药、环保等领域的需求。
本实验通过制备、纯化和活性测定等方法,研究酶的催化特性和应用。
三、实验材料与仪器1. 实验材料:酶源(如淀粉酶、蛋白酶等)、底物(如淀粉、蛋白质等)、缓冲液、指示剂等。
2. 实验仪器:离心机、电泳仪、紫外分光光度计、酶标仪等。
四、实验步骤1. 酶的制备(1)酶源培养:将酶源接种于培养基中,在适宜条件下培养,使其大量繁殖。
(2)酶提取:将培养好的酶源进行离心分离,收集上清液。
(3)酶浓缩:采用透析、超滤等方法,去除酶液中的杂质,提高酶的浓度。
2. 酶的纯化(1)离子交换层析:根据酶的等电点,选择合适的离子交换树脂,进行酶的吸附和洗脱。
(2)凝胶过滤层析:根据酶的分子量,选择合适的凝胶过滤柱,对酶进行分离和纯化。
3. 酶的活性测定(1)酶活力单位:采用紫外分光光度法测定酶的活性。
(2)酶催化反应速率:测定酶催化底物反应的速率,计算酶的活力。
4. 酶的催化特性研究(1)温度对酶活性的影响:在不同温度下测定酶的活性,研究温度对酶活性的影响。
(2)pH对酶活性的影响:在不同pH值下测定酶的活性,研究pH对酶活性的影响。
五、实验结果与分析1. 酶的制备通过酶源培养、酶提取和酶浓缩等步骤,成功制备了酶液,酶浓度达到实验要求。
2. 酶的纯化通过离子交换层析和凝胶过滤层析,成功纯化了酶,纯度达到95%以上。
3. 酶的活性测定酶活力单位为:X U/mL;酶催化反应速率为:Y mol/min。
4. 酶的催化特性研究(1)温度对酶活性的影响:在30℃时,酶活性最高,随着温度升高,酶活性逐渐降低。
(2)pH对酶活性的影响:在pH 7.0时,酶活性最高,随着pH值的变化,酶活性逐渐降低。
酶工程实验报告一(纤维素酶活力测定)

精确记时:每一管加入酶液的时间要做记录,每管之间间隔的时间要合理;
避免试管进水:煮沸和用流水冲洗时;
5实验处理
A 5实验现象、数据及观察结果
A 5.1标准曲线的测量结果:如表四:
试管编号
0
1
2
3
4
5
OD(540nm)值
—
0.0595
0.2135
0.345
0.493
B 4.2滤纸条的准备:
①将待用滤纸放入(硅胶)干燥器中平衡24h:
②将水分平衡后的滤纸制成宽1cm、质量为(50士05)mg的滤纸条,折成M型备用。
B4.3操作步骤:
①取三支25mL刻度具塞试管(一支空白管,二支样品管)。实验中分为两组:pH
4.8与pH6.0。pH 4.8酶液稀释到1000倍,pH 6.0酶液稀释到5000倍。
步骤7
加入0.5mL待测酶液,
沸水浴煮沸10min
沸水浴煮沸10min9
加蒸馏水定容至25mL,混匀
步骤10
OD540nm比色
(注意:OD =(A+B)/ 2,比色前根据具体情况稀释相应的倍数。)
表二
D4.4羧甲基纤维素(还原糖法)酶活力(CMCA-DNS )测定操作流程:如表三所示:
XX
XX
1、实验目的
1.1学习并了解纤维素酶的基本特性;
1.2学习酶活力的测定方法;
1.3学习还原糖的测定、标准曲线的制作及分光光度计的使用方法;
1.4学会对实验数据的处理及实验报告的撰写;
2、实验仪器、试剂和溶液:
A2仪器:
A2.1滤纸酶活力(FPA)的测定中仪器:除普通实验室仪器外,还应有:分光光度计、酸度计精度士0.01 pH、恒温水浴(50士0.l)0C、分析天平感量0.1mg、磁力搅拌器、秒表或定时钟、沸7k洛(可用800W申炉和高脚烧杯、楠夸量杯或茸楠奔器切成)、具塞刻度试管25mL。
酶工程实验报告五(纤维素酶米氏常数—Km的测定)

酶工程实验报告五(纤维素酶米氏常数—Km的测定)引言在酶工程中,了解和研究酶的基本特性是非常重要的。
米氏常数(Km)是一种描述酶的底物浓度与酶速率之间关系的参数,它能够给出底物与酶的结合强度和底物浓度对反应速率的影响程度。
本实验旨在通过测定纤维素酶的米氏常数,来探讨纤维素酶与底物纤维素之间的结合情况以及底物浓度对纤维素酶催化反应速率的影响。
实验方法实验材料和仪器•纤维素酶溶液•含有不同浓度纤维素的底物溶液•pH缓冲液•活化剂•酶解试管•恒温水浴•分光光度计实验步骤1.准备一系列不同浓度的纤维素底物溶液。
2.将50 μL纤维素酶溶液加入酶解试管中。
3.加入100 μL纤维素底物溶液和150 μL pH缓冲液。
4.加入适量的活化剂,混匀试管中的液体。
5.将试管放入恒温水浴中,在37°C恒温条件下进行酶解反应。
6.设定分光光度计波长为适当的值,测定反应体系中的底物浓度随时间的变化。
7.重复以上步骤,并分别用不同浓度的纤维素底物进行实验。
实验结果通过分光光度计测定反应体系中的底物浓度随时间的变化,得到了以下数据:时间 (min) 底物浓度 (mmol/L)0 105 8.710 7.515 6.220 5.025 3.730 2.535 1.240 0.0根据实验数据,我们可以绘制底物浓度随时间的变化曲线图。
通过拟合得到的曲线,可以确定纤维素酶的米氏常数。
数据处理与分析根据实验数据,我们可以将底物浓度随时间的变化绘制成一条曲线。
通过拟合得到的曲线,可以确定纤维素酶的米氏常数。
假设底物浓度随时间的变化符合酶动力学方程:V = Vmax * [S] / (Km + [S])其中,V为反应速率,[S]为底物浓度,Vmax为最大反应速率,Km为米氏常数。
我们可以通过将实验数据代入上述方程进行拟合,得到最优的Vmax和Km的估计值。
结果与讨论通过将实验数据代入酶动力学方程进行拟合,我们得到了纤维素酶的米氏常数(Km)的估计值。
酶工程实验报告六(纤维素酶的固定化及其性质测定)

3、用注射器将上述混合液取20ml(各取四次)逐渐滴入200mlCaCl2溶液的三角瓶中
6、反应混合物物保温30min后,于各个浓度底物试管中加入3mLDNS试剂终止液,迅速振荡均匀。
(1)于游离酶对照中加入0.5 ml的酶液。
(2)于固定化酶对照中加入2.00mLCMC-Na溶液。
7、混合后将各个实验组的三支试管沸水浴5min,自来水冷却后,加蒸馏水19.5mL。摇匀,在540nm处读取OD值。
④精确记时:每一管加入酶液的时间要做记录,每管之间间隔的时间要合理;
⑤避免试管进水:煮沸和用流水冲洗时;
5、实验结果与数据处理:
5.1实验数据与结果:
表一固定化酶(3.5%)与游离酶稳定性的比较
保温时间(min)
吸光度OD540、酶活(u/g)、相对酶活(%)
固定化纤维素酶酶
游离纤维素酶酶
10 0.0375 639.04 33.63 0.0585 7586.50 65.23
②酶稳定性比较:由图三可看出在反应30min以后,游离酶的酶活稳定性保持升高到40min达最大酶活,之后酶活(相对活性)急剧下降(曲线斜率较陡曲);而固定化纤维素酶的酶活从20min后保持平缓的下降趋势(斜率较缓),即稳定性较高。
③不同浓度的海藻酸钙对固定化酶性质影响:随着海藻酸钙的浓度由:2.5%、3.5%、4.5%、5.5%升高,呈现增后减的趋势,固定化纤维素酶酶活性在3.5%达最大相对酶活性100%。
酶工程实验讲义最终稿

基本原理:
碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫 颜色的络合物,测定其在562nm处的吸收值,并与标准曲 线对比,即可计算待测蛋白的浓度。
BCA蛋白质检测流程:
考马斯亮蓝染色法测定蛋白质浓度
考马斯亮蓝在一定蛋白质浓度范围内,蛋白质和染料结合 符合比尔定律 ,因此可以通过测定染料在595nm处光吸收 的增加量得到与其结合的蛋白质量。该法简单、迅速、干 扰物质少、灵敏度高(比Lowry法灵敏4倍)。 R250中的R代表Red,偏红,(C45H44N3O7S2Na ).R250属于 慢染,脱色脱的完全,主要用于电泳染色 G250中的G就是Green,偏绿(C47H48N3O7S2Na ).G250属于 快染,脱色脱的不彻底,主要用于蛋白测定,比考马斯亮 蓝R250多二个甲基.λ max=590―610nm.
实验试剂
酸性磷酸酯酶酶液 5 mmol/L磷酸苯二钠溶液(pH5.6):精确称取磷
酸苯二钠(C6H6Na2PO4·2H2O,相对分子质量 254.10)2.54 g,加蒸馏水溶解后定容至100mL,即配 成了100 mmol/L磷酸苯二钠水溶液,密闭保存备用。 用0.2mol/L的pH5.6的乙酸盐缓冲液稀释20倍,即得 5mmol/L磷酸苯二钠溶液(pH5.6)。
0
Folin-酚稀溶液
各0.5mL 0号试管加入酶液0.5mL
35℃保温显色10min以上 0
A680
具体时间控制表
管号 1 2 3 4 5 6 7 8 9 10 11
酶液加入 时刻 (min ) 11号试管 最先加样
10
9
8
7
6
5
4
3
酶工程实验方案

酶工程实验方案一、实验目的通过本实验,学生将学会利用酶工程实验技术,熟悉酶的生产、纯化和应用过程,培养学生实验操作技能和科学研究能力,为学生今后的科研工作打下良好的基础。
二、实验原理酶工程是利用生物工程学原理和技术手段,对酶进行筛选、改造和工程应用。
酶在生产中扮演着极其重要的角色,它广泛应用于食品、医药、环保、能源、材料等领域。
酶工程实验的关键是酶的生产和纯化技术。
典型的酶工程包括:酶源的筛选、酶基因的克隆与表达、酶的纯化和酶的应用等。
三、实验内容本实验将包括以下内容:1. 酶源的筛选:选择一种具有较高酶活性的微生物菌株,进行培养、鉴定,筛选出所需酶。
2. 酶基因的克隆与表达:通过PCR技术扩增酶基因,将其克隆至适当的表达载体中,然后将其转化至表达宿主中,表达目的蛋白。
3. 酶的纯化:采用离心、柱层析、过滤等方法对表达蛋白进行酶的分离和纯化。
4. 酶的应用:将纯化的酶用于特定的生产或研究中,评价酶的性能。
四、实验步骤1. 酶源的筛选(1)选择合适的微生物菌株,进行培养并获得菌液样品。
(2)采集菌液样品,进行酶活性测试,筛选出具有较高酶活性的菌株。
2. 酶基因的克隆与表达(1)利用PCR技术扩增酶基因。
(2)将扩增出的酶基因克隆至表达载体中。
(3)转化表达载体至适当的表达宿主中,进行表达。
3. 酶的纯化(1)收集表达蛋白,进行细胞破碎,得到目的蛋白混合物。
(2)通过离心、柱层析、过滤等方法对蛋白混合物进行纯化。
4. 酶的应用(1)评价纯化酶的性能。
(2)将纯化的酶用于特定的生产或研究中。
五、实验材料和仪器1. 微生物菌株:待定2. 实验宿主:大肠杆菌等3. 载体:pET等4. 酶活性测试试剂盒5. PCR试剂盒6. 离心机、柱层析仪、过滤器等实验仪器七、实验结果1. 酶源的筛选结果:取得具有较高酶活性的微生物菌株。
2. 酶基因的克隆与表达结果:成功将酶基因克隆至表达载体中,并通过转化实现表达。
3. 酶的纯化结果:得到较纯的酶样品。
酶工程实验报告一

酶工程实验报告一一、实验目的本次酶工程实验的主要目的是通过实际操作,深入了解酶的性质、作用机制以及酶的分离纯化和活性测定方法。
同时,培养我们的实验操作技能、观察分析能力和科学思维方法,为今后从事相关领域的研究和工作打下坚实的基础。
二、实验原理酶是一种具有生物催化功能的蛋白质或 RNA 分子。
它们能够在温和的条件下高效地催化各种化学反应,具有高度的特异性和催化效率。
本实验中所涉及的酶主要是蛋白酶和淀粉酶。
蛋白酶能够水解蛋白质中的肽键,将蛋白质分解为小分子肽和氨基酸。
其活性可以通过测定水解产物的生成量或底物的消耗量来进行评估。
淀粉酶能够水解淀粉分子中的α-1,4 糖苷键,将淀粉分解为麦芽糖和葡萄糖等小分子物质。
其活性通常通过测定淀粉的水解程度来确定,常用的方法是碘量法。
酶的分离纯化是基于酶与杂质在物理化学性质上的差异,如溶解度、分子大小、电荷性质等,采用一系列的分离技术,如沉淀、层析、电泳等,逐步去除杂质,获得高纯度的酶。
三、实验材料与设备1、实验材料蛋白酶提取液淀粉酶提取液酪蛋白淀粉溶液福林酚试剂碘液其他化学试剂2、实验设备离心机分光光度计恒温水浴锅移液器电泳仪层析柱四、实验步骤制备酪蛋白底物溶液:称取一定量的酪蛋白,用氢氧化钠溶液溶解,调节 pH 至适宜值,定容备用。
设定反应体系:在试管中依次加入适量的蛋白酶提取液、酪蛋白底物溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入三氯乙酸溶液终止反应。
测定吸光度:离心去除沉淀,取上清液,加入福林酚试剂显色,在分光光度计上测定吸光度。
计算蛋白酶活性:根据标准曲线计算出反应生成的酪氨酸量,从而计算出蛋白酶的活性。
2、淀粉酶活性的测定制备淀粉溶液:称取一定量的淀粉,用缓冲液溶解,加热糊化,冷却后定容备用。
设定反应体系:在试管中依次加入适量的淀粉酶提取液、淀粉溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入碘液终止反应。
酶工程实验指导

生物工程实验指导(酶工程部分)海南师范大学生命科学学院2010-10实验一 木瓜蛋白酶的分离纯化及酶活检测一、概述以半胱氨酸内肽酶为主(包括木瓜蛋白酶,简称PAP、木瓜蛋白酶Ω, 简称CAR、木瓜凝乳蛋白酶,简称CHP和木瓜凝乳蛋白酶M,简称GEP)的木瓜蛋白酶是从植物番木瓜中分离纯化而得的一种混合酶。
这种酶广泛存在于番木瓜的根、茎、叶和果实内,其中以为成熟的果实乳汁中含量最高,约占乳汁干中的40%。
其最大的用途是在食品工业方面,防除啤酒冷藏混浊,嫩化肉类,生产调味品,烘烤面包,乳酪制品及谷类和速溶食品的蛋白质强化生产。
在动物饲料加工方面,用于鱼蛋白浓缩物和油籽饼处理,能提高氮的可溶性指数和蛋白质的可分散指数。
少量在皮革工业作软化剂、纺织工业作丝织品脱胶清洁剂和废胶卷回收报等。
在医药方面,主要用于治胃炎、消化不良以及用于肉赘摘除、伤痕处理、脱毛、清洁皮肤和新近的裂腭整形外科及制木瓜凝乳蛋白酶注射剂治疗脊骨盘脱出症等。
木瓜蛋白酶是一种巯基蛋白酶,其专一性较差,能分解比胰脏蛋白酶更多的蛋白质。
木瓜蛋白酶是单条链,有211个氨基酸残基组,相对分子量23000。
木瓜凝乳蛋白酶,相对分子量36000,约占可溶性蛋白质的45%。
溶菌酶,相对分子量2500,约占可溶性蛋白质的20%。
木瓜蛋白酶为白色、淡褐色无定型粉末或颗粒。
略溶于水、甘油,不溶于乙醚、乙醇和氯仿。
水溶液无色至淡黄色,有时呈乳白色。
最适pH为5.0~8.0,微吸湿,有硫化氰臭。
最适温度65℃,易变性失活。
木瓜蛋白酶等电点pH=9.6。
半胱氨酸、硫化物、亚硫酸盐和EDTA是木瓜蛋白酶激活剂,巯基试剂和过氧化氢是木瓜蛋白酶的抑制剂。
二、实验目的1、学习和掌握木瓜蛋白酶分离纯化的原理、方法和工艺过程,包括盐析、酶活力保护、结晶与重结晶。
2、掌握木瓜蛋白酶活力的测定方法和原理。
三、能力培养目标1、蛋白质分离纯化的工艺流程,特别是盐析操作技术的熟练掌握;2、酶活力检测方法的掌握。
酶工程实验大纲

湖北大学酶工程实验(0818800193)实验教学大纲(第2版)生命科学学院生化教研室2014年7月前言课程名称:酶工程实验实验学时:16学时适用专业:生物工程课程性质:必修一、实验课程简介酶工程是生物工程的主要内容之一,是现代酶学和生物工程学相互结合而发展起来的一门新的技术学科。
它将酶学、微生物学的基本原理与化工、发酵等工程技术有机结合起来,并随着酶学研究的迅速发展,特别是酶的广泛应用而在国民生产生活中日益发挥着越来越重要的作用。
酶工程实验课是生物工程等本科实验教学的一个重要组成部分,通过实验教学可以加强学生对酶工程基本知识和基本理论的理解,掌握现代酶学与相关技术的有关的基本的实验原理与技能。
在实验过程中要求学生自己动手,分析思考并完成实验报告。
酶工程实验性质有基础性、综合性、设计(创新)性三层次。
二、课程目的本实验课程主要根据酶工程的三大块内容即酶的生产、酶的改性与酶的应用来设计安排实验,通过这些实验内容,使学生深入理解酶工程课程的基本知识;巩固和加深所学的基本理论;掌握酶工程中基本的操作技能。
同时,通过实验培养学生独立观察、思考和分析问题、解决问题和提出问题的能力,养成实事求是、严肃认真的科学态度,以及敢于创新的开拓精神;并在实验中进一步提高学生的科学素养。
三、考核方式及成绩评定标准考核内容包括实验过程中的操作情况,实验记录及结果的准确性,实验报告的书写及结果分析,思考题的回答情况,仪器设备的使用情况及遵守实验室规章制度的情况等,根据这些方面进行成绩评判和记录,综合给出实验总成绩。
四、实验指导书及主要参考书1.魏群:生物工程技术实验指导,高等教育出版社,2002年8月。
2.禹邦超:酶工程(附实验),华中师范大学出版社,2007年8月五、实验项目实验项目一览表(可选)实验类型:演示性、验证性、综合性、设计性、其它实验一双酶法制备淀粉糖(3课时)一、实验原理目前国内外淀粉糖的生产大都采用双酶法。
酶工程实验讲义

实验一酵母蔗糖酶的提取一、原理酵母中含有丰富的蔗糖酶(EC.3.2.1.26),本实验以酵母为原料,通过超声波破碎细胞、硫酸铵沉淀等步骤,分离纯化酵母蔗糖酶。
二、实验材料、仪器和试剂1.材料活性干酵母2.仪器(1)高速离心机(2)恒温水浴锅(3)超声破碎仪3.试剂(1)1 mol/L醋酸溶液三、操作步骤1.破碎细胞取5 g干酵母,加5 g石英砂,置于预先冷却的研钵中,加30 mL去离子水,研磨30 min,在冰箱中冰冻约10 min(研磨液面上刚出现冰结为宜),重复2次。
将研磨液转移至大离心管中,12000 r/min离心15 min,弃去沉淀。
2.加热除杂蛋白将上清液转入三角瓶,用1 mol/L醋酸溶液逐滴加入,调其pH值至5.0,然后迅速放入50℃的水浴中,保温30 min。
在温育过程中,注意经常缓慢搅拌液体。
之后在冰浴中迅速冷却之,以12000 r/min的转速离心20 min,弃去沉淀。
留0.5 mL上清液为第二组分。
3.乙醇沉淀量出上清液的体积,加入等体积的95%冷乙醇溶液(预先放在-20℃低温下的时间不少于30 min),于冰浴中温和搅拌20 min。
然后以12000 r/min的转速离心25 min,小心弃去上清液,沉淀沥干。
将沉淀溶解在6 mL 0.05 mol/L Tris-HCl 缓冲液(pH值7.3)中,搅拌(5 min以上)使其完全溶解,以12000 r/min的转速离心25 min,取出0.5 mL上清液作为第三组分,剩余部分(乙醇抽提液)进行第4步操作。
用尿糖试纸进行半定量测定:在白瓷板每孔中分别滴3滴待测酶液,再加3滴含5%蔗糖的pH 4.6的醋酸缓冲液,搅匀,37℃放置10 min,浸入尿糖试纸,1 s后取出,60 s后比较颜色的深浅,与比色卡对照。
尿糖试纸的原理:尿糖试纸是将葡萄糖氧化酶和过氧化氢酶及无色的化合物固定在纸条上,制成的测试尿糖含量的酶试纸。
溶液(或尿液)中的葡萄糖在葡萄糖氧化酶的催化作用下,形成葡萄糖酸和过氧化氢;过氧化氢在过氧化氢酶的催化作用下形成水和原子氧;原子氧可将某种无色的化合物氧化成有色的化合物。
酶工程实验指导2010-1

酶工程实验指导伍红秦天莺生命科学与技术学院2010-07实验一碱性磷酸酶的分离纯化一、实验目的掌握酶分离纯化的一般步骤及相关原理,熟悉碱性磷酸酶的分离纯化的方法步骤。
二、实验原理本实验采用有机溶剂沉淀法从肝匀桨中分离纯化碱性磷酸酶(简称AKP)。
先用低浓度醋酸钠(低渗破模作用)制备肝匀浆。
醋酸镁则有保护和稳定AKP 的作用。
匀浆中加入正丁醇可使部分杂蛋白变性,释出膜中酶,过滤后,以去除杂蛋白。
含有AKP 的滤液用冷丙酮和冷乙酸进行重复分离纯化。
根据AKP 在33%的丙酮或30%的乙醇中溶解,而在50%的丙酮或60%的乙酸中不溶解的性质,用冷丙酮和冷乙醇重复分离提取,可从含有AKP 的滤液中获得较为纯净的碱性磷酸酶。
三、仪器、原料与试剂仪器:移液管、量筒、玻璃勺浆器(管)、剪刀、离心机、新华定性滤纸。
原料:新鲜兔肝试剂:1.0.5mol/L 醋酸镁溶液:107.25g 醋酸镁溶于蒸馏水中,定容至1000 m1。
2.0.1mol/L 醋酸钠溶液:8.2g 醋酸钠溶于蒸馏水中,定容至1000 m1。
3.0.0lmol/L 醋酸镁-0.01mol/L 醋酸钠溶液:准确吸取20ml0.5mol/L 醋酸镁溶液及100ml0.14mol/L 醋酸钠溶液,混匀后定容至1000 m1。
4.Tris-HCl pH8.8缓冲液:称取三羟甲基氨基甲烷12.1g,用蒸馏水溶解后定容至1000mL,即为0.1mol/LTrls 溶液。
取100m10.1mol/LTrls 溶液,加蒸馏水约780mL,再加0.1mol/L 醋酸镁溶液100m1,混匀后用1%冰醋酸调pH 为8.8,用蒸馏水定容至l000m1。
5. 正丁醇、丙酮、95%乙醇均为分析纯试剂。
四、实验操作分离纯化碱性磷酸酶的操作流程如下(以下操作均在0-4℃进行)将分离提取的硷性磷酸分装成2ml瓶,冰冻干燥保存或液体保存也可,但值。
均置于-60℃低温冰箱保存。
应用时稀释5—7倍测其Km实验二碱性磷酸酶的动力学鉴定——Km测定一、原理当温度、pH及酶浓度恒定的条件下,酶促反应的初速度随作用物浓度[S]增大而增大,但增大到一定限度时,作用物浓度再增加,则反应速度不再增加。
酶工程实验——大蒜细胞SOD的提取、SOD活力测定
实验四、五大蒜细胞SOD的提取、SOD活力测定一. 实验目的学习超氧化物歧化酶的提取与分离方法二. 实验原理超氧化物歧化酶(SOD)是一种具有抗氧化、抗衰老、抗辐射和消炎作用的药用酶。
它可催化超氧负离子(O2-)进行歧化反应,生成氧和过氧化氢:2O2-+H2==O2+H2O2。
大蒜蒜瓣和悬浮培养的大蒜细胞中含有较丰富的SOD,通过组织或细胞破碎后,可用pH7.8的磷酸缓冲液提取。
由于SOD不溶于丙酮,可用丙酮将其沉淀析出。
三. 实验方法及步骤1.组织或细胞破碎称取5g左右大蒜蒜瓣或大蒜细胞,置于研磨器中研磨,使组织或细胞破碎。
2.SOD的提取将上述破碎的组织或细胞,加入2-3倍体积的0.05mol/L,pH7.8的磷酸缓冲液,继续研磨搅拌20min,使SOD充分溶解到缓冲液中,然后用离心机在5000rpm,离心15min,弃沉淀,得提取液。
3.除杂蛋白提取液加入0.25倍体积的氯仿-乙醇混合溶剂搅拌15min,5000rpm离心15min,去杂蛋白沉淀,得粗酶液。
4.SOD的沉淀分离将上述粗酶液加入等体积的冷丙酮,搅拌15min,5000rpm离心15min,得SOD沉淀。
将SOD沉淀溶于0.05mol/L,pH7.8的磷酸缓冲液中,于55-60℃热15min,离心弃沉淀,得到SOD 酶液。
将上述提取液、粗酶液和酶液分别取样,测定各自的SOD活力。
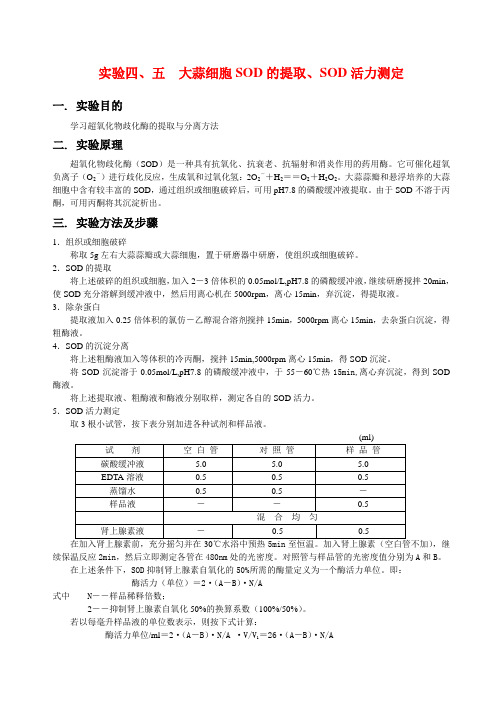
5.SOD活力测定取3根小试管,按下表分别加进各种试剂和样品液。
(ml)在加入肾上腺素前,充分摇匀并在30℃水浴中预热5min至恒温。
加入肾上腺素(空白管不加),继续保温反应2min,然后立即测定各管在480nm处的光密度。
对照管与样品管的光密度值分别为A和B。
在上述条件下,SOD抑制肾上腺素自氧化的50%所需的酶量定义为一个酶活力单位。
即:酶活力(单位)=2·(A-B)·N/A式中N――样品稀释倍数;2――抑制肾上腺素自氧化50%的换算系数(100%/50%)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5、0.05 mol/L H2O2:取30%H2O223ml加入1000ml容量瓶中,加蒸馏水至刻度(约0.2mol/L),用标准KMnO4(0.004mol/L)标定其准确浓度,稀释成0.05mol/L(标定前稀释4倍,取2.0ml,加25%H2SO42.0ml,用0.004mol/LKMnO4滴定至微红色)。
(5)从酶液中取出尼龙布,用0.5mol/L NaCl溶液(用0.1mol/L磷酸缓冲液(pH值7.2)配制),洗去多余的酶蛋白,即为尼龙固定化酶。
2、酶活力测定
A.0.2ml 木瓜蛋白酶+1.8ml激活剂+1ml酪蛋白液
B.0.2ml 木瓜蛋白酶+1.8ml激活剂+2ml 10%三氯乙酸+1ml酪蛋白液
(2)将尼龙布用3.65mol/L HCI溶液在室温下水解45min,用水洗至pH值中性(pH试纸检测)。
(3)将尼龙布用5%戊二醛溶液在室温下浸泡偶联20min。
(4)取出尼龙布,用0.1mol/L 磷酸缓冲液(pH值7.8)洗涤3次,洗去多余的戊二醛,吸干之后,加入5ml1mg/mL的木瓜蛋白酶液,在室温下固定30min。
图1产淀粉酶菌落形成的透明圈
三、材料、试剂和仪器
1、菌的来源
取不同地点的表层土壤。
2、试剂:
RBV-Starch(Sigma), NaNO3, K2HPO4, MgSO4, KCl,2 mol/L NaOH无菌水和琼脂粉等。
(3)1 mol/L醋酸溶液
(4)2 mol/L氢氧化钠溶液
(5)醋酸缓冲液(pH 4.6)
(6)5%蔗糖溶液
(7)DNS(3,5-二硝基水杨酸)试剂
2、仪器:
电子天平、离心机、分光光度计、水浴锅、电炉、研钵、试管、三角瓶、量筒、移液管。
四、操作方法
1、破碎细胞
取2 g干酵母于研钵中,加入2 g石英砂,加30 ml去离子水,研磨15 min,放入冰箱冷冻室(-20℃)冰冻约20min(研磨液面上刚出现冰结为宜)。
六、计算
分别求出各瓶的底物浓度[S]和反应速度v。
[S]=c1V1/10
式中[S]:底物物质的量浓度(mol/L);
c1:H2O2物质的量浓度(mol/L);
V1:H2O2体积(ml);
10:反应的总体积(ml);
υ:反应速度(m mol/min);
c2:KMnO4物质的量浓度(mol/L);
V2:KMnO4体积(ml);
3、酶反应
取四支试管,分别按顺序加入反应物:
试管编号
①酶液
②氢氧化钠溶液
③醋酸缓冲液
④蔗糖溶液
A(对照管)
0.5 ml
1 ml
1 ml
1 ml
B
0.5 ml
---
2 ml
1 ml
C(对照管)
0.5 ml1 ml1 ml1 mlD
0.5 ml
---
2 ml
1 ml
试管中反应物在55 ℃水浴中反应5 min(秒表计时)后,B、D管立即各加入1 ml氢氧化钠溶液(2 mol/L)终止反应,A、C管中各加入1 ml蒸馏水。
六、目的:
了解凝胶包埋法及固定化酶活测定方法。
七、原理:
海藻酸钠在遇到Ca2+时成胶,从而把酶包埋在其中。(请参考相关教材)
八、试剂与仪器
1、试剂与材料:
(8)干酵母
(9)海藻酸钠
(10)无水氯化钙
(11)5%蔗糖溶液
(12)DNS(3,5-二硝基水杨酸)试剂
2、仪器:
电子天平、分光光度计、水浴锅、电炉、烧杯、玻棒、量筒、试管、量筒、移液管、注射器(带7号针头)、纱布。
实验一过氧化氢酶米氏常数的测定
一、目的
了解米氏常数的意义,测定过氧化氢酶的米氏常数。
二、实验原理
H2O2被过氧化氢酶分解出H2O和O2,未分解的H2O2用KMNO4在酸性环境中滴定,根据反应前后H2O2的浓度差可求出反应速度。
E
H2O2--- -->2H2O+O2
2KMNO4+5H2O2------------>2MnSO4+K2SO4+5O2+8H2O
6、25% H2SO4
五、操作
取锥形瓶6只,按下表顺序加入试剂:
表一过氧化氢酶米氏常数的测定
管号
试剂
0
1
2
3
4
5
0.05mol/LH2O2/ml
蒸馏水/ml
酶液/ml
0
9.5
0.5
1.00
8.50
0.5
1.25
8.25
0.5
1.67
7.83
0.5
2.5
7.0
0.5
5.00
4.50
0.5
先加好0.05mol/LH2O2及蒸馏水,加酶液后立即混合,依次记录各瓶的起始反应时间。各瓶时间达5min时立即加2.0ml25%硫酸终止反应,充分混匀。用0.004mol/LKMnO4滴定各瓶中剩余的H2O2至微红色,记录消耗的KMnO4体积。
五、结果计算
1、酶活力单位的定义:
本实验中,蔗糖酶的活力单位指在55℃条件下,每1 min催化底物转化为1 mg还原糖的酶量。
2、酶活计算:
粗酶的计算酶活(组分一):
纯化后酶的计算酶活(组分二):
3、总酶活的计算:
总酶活1(组分一,粗酶):计算酶活×稀释倍数
总酶活2(组分二,纯化后酶):计算酶活×稀释倍数
C. 固定化酶一张(剪碎)+2.0ml激活剂+1ml酪蛋白液
取三支试管按上述加入反应液,37℃反应15min,A、C+2ml 10%三氯乙酸。
三支试管过滤上清液到另三支试管中,以B管作空白,测试管A、C吸光值(280nm,紫外)
五、结果计算
1.酶活定义:每15min增加0.001个消光值所需酶量为1个酶活单位。
十、结果计算
5、酶活力单位的定义:
本实验中,蔗糖酶的活力单位指在37℃条件下,每1 min催化得到1 mg还原糖所需酶量。
6、酶活计算:
1 g固化酶酶活:
十一、思考题
1、海藻酸钙包埋法中钙起什么作用?与豆腐制作中Ca2+的作用有何关系?
2、除了凝胶包埋法,还有哪些包埋方法?其原理是什么?
实验四尼龙固定化木瓜蛋白酶
四、实验试剂
1、0.02mol/L磷酸缓冲液(Ph7.0)
取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液 29.1ml,用水稀释至100ml,即得。
2、酶液:称取马铃薯5g,加上述缓冲液10ml,匀浆,过滤。
3、0.02mol/L KMnO4:称取KMnO4(AR)3.2g,加蒸馏水1000ml,煮沸15min,2d后过滤,棕色瓶保存。
将反应液定容至20 ml,取0.5 ml稀释至5 ml,得D液。
取2支试管,分别加入反应物:
试管编号
反应液
DNS试剂
1
0.5 mlD
0.5 ml
2(空白)
0.5 ml 蒸馏水
0.5 ml
试管中反应物在沸水浴中反应5 min,然后冷却。加入4 ml蒸馏水。将各试管摇匀,用空白管溶液调零点,测定它们的吸光度值A540。
二、原理
产淀粉酶的菌株能分泌淀粉酶到菌落周围的培养基中,从而水解培养基中的淀粉,由于使用的是经活性染料标记的带颜色的淀粉(本实验为RBV-淀粉,呈鲜艳的紫红色),当其被淀粉酶作用后便形成可溶,且较易扩散的小分水解物,从而在该菌落周围形成颜色较浅的透明圈。而透明圈直径与菌落直径之比则可反应菌落分泌淀粉酶能力的高低。本方法有快速、简单易行等优点。
(10)激活剂:用0.1mol/L磷酸缓冲液(pH值7.2)配制,含20mmol/L半胱氨酸、1mmol/LEDTA的混合液。
(11)0.5%酪蛋白溶液:用0.1mol/L磷酸缓冲液(pH值7.2)配制。
(12)10%三氯乙酸(TCA)溶液。
四、操作步骤
1、固定化酶的制备
(1)每组取5块尼龙布洗净、晾干,浸入含18.6%CaCl2溶液10s,再浸入18.6%水的甲醇溶液中,轻轻搅拌5min以上至尼龙发粘。取出后用水洗涤,用滤纸吸干。
4、酶催化产物检测
取5支试管,分别加入反应物:
试管编号
反应液
DNS试剂
1
0.5 ml A
0.5 ml
2
0.5 ml B
0.5 ml
3
0.5 ml C
0.5 ml
4
0.5 ml D
0.5 ml
5(空白)
0.5 ml 蒸馏水
0.5 ml
试管中反应物在沸水浴中反应5 min,然后冷却。加入4 ml蒸馏水。将各试管摇匀,用空白管溶液(5号管)调零点,测定它们的吸光度值A540。
以1/υ对1/[S]作图求出Km。
实验二酵母蔗糖酶的部分纯化与酶活测定
一、目的:
了解酶的纯化方法。
二、原理:
酵母中含有丰富的蔗糖酶(EC.3.2.1.26),本实验以酵母为原料,通过破碎细胞方式得到粗酶,并用热变性法除杂蛋白纯化。(请参考相关教材)
三、试剂与仪器
1、试剂与材料:
(1)干酵母
(2)石英砂
取出冷冻酵母,再研磨5 min后,在5000 r/min条件下离心12 min,小心取出上清液(组分一)并量出体积V1,分别取0.5 ml上清液到试管A、B中,余者倒入三角瓶。
