2019年高一化学竞赛试卷
(2019)全国高中生化学竞赛(初赛)试题及答案

评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。
2有效数字错误,扣0.5分,但每大题只扣1次。
3单位不写或表达错误,扣0.5分,但每大题只扣1次。
4只要求1个答案、而给出多个答案,其中有错误的,不得分。
5方程式不配平不得分。
6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。
第1题 (20分)1-1 Lewis 酸和Lewis 碱可以形成酸碱复合物。
根据下列两个反应式判断反应中所涉及Lewis酸的酸性强弱,并由强到弱排序。
F 4Si -N(CH 3)3 + BF 3 → F 3B -N(CH 3)3 + SiF 4 ;F 3B -N(CH 3)3 + BCl 3 → Cl 3B -N(CH 3)3 + BF 3BCl 3 > BF 3 > SiF 4 顺序错误不给分 (2分) 1-2 (1) 分别画出BF 3和N(CH 3)3的分子构型,指出中心原子的杂化轨道类型。
BFFF分子构型为平面三角形,不画成平面形不给分 (0.5分)sp 2(0.5分)H 3C33分子构型为三角锥形, 不画成三角锥形不给分 (0.5分)sp 3(0.5分)(2) 分别画出F 3B -N(CH 3)3 和F 4Si -N(CH 3)3的分子构型,并指出分子中Si 和B 的杂化轨道类型。
CH 3H 3C H 3CFB FF B :sp 3 (1分)+ (1分)CH 3H 3C H 3CFSi FFFSi ,sp 3d (1分)+ (1分)1-3 将BCl 3分别通入吡啶和水中,会发生两种不同类型的反应。
写出这两种反应的化学方程式。
BCl 3 + 3H 2O = B(OH)3+ 3HCl 不配平不给分 (1分) BCl 3 + C 5H 5N = Cl 3B-NC 5H 5或BCl 3 +N=Cl 3N(1分)1-4 BeCl 2是共价分子,可以以单体、二聚体和多聚体形式存在。
分别画出它们的结构简式,并指出Be 的杂化轨道类型。
当湖高级中学2019级高一化学竞赛选拔试卷

当湖高级中学2019级高一化学竞赛选拔试卷 相对原子质量: H-1 C-12 O-16 Na-23 Mg-24 Si-28 S-32 Cl-35.5Al-27 K-39 Fe-56 Cu-64 Zn-65 Br-80 Ag-108一.选择题(每一小题都只有一个符合题意的选项,请选出后把相应的选项在答题卡上涂黑。
每一小题2分,共42分)1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是A .NOB .O 3C .COD .CO 22.下列反应中,水作还原剂的A .2Na + 2H 2O = 2NaOH + H 2↑B .Cl 2 + H 2O = HCl + HClOC .2F 2 + 2H 2O = 4HF + O 2D .SO 2 + H 2O = H 2SO 33..焰色反应是指A .可燃物在燃烧时所显示的火焰颜色B .所有元素在灼烧时都有焰色反应C .多种金属或它们的化合物灼烧时所显示的火焰颜色D .焰色反应是一种化学变化4.相同质量的SO 2和SO 3它们之间的关系是A .所含硫原子的物质的量之比为1:1B .氧原子的物质的量之比为3:2C .氧元素的质量比为2:3D .硫元素的质量比为5:45.在两个容积相同的容器中,一个盛有HCl 气体,另一个盛有H 2和Cl 2的混合气体。
在同温同压下,两容器内的气体一定具有相同的A .原子数B . 密度C . 质量D . 质子数6.在同温度、同体积和同质量的下列气体中,气体压强最小的是A .CO 2B .CH 4C .H 2D .CO7.依照阿佛加德罗定律,下列叙述正确的是A .同温同压下两种气体的体积之比等于摩尔质量之比B .同温同压下两种气体的物质的量之比等于密度之比C .同温同压下两种气体的摩尔质量之比等于密度之比D .同温同体积下两种气体的物质的量之比等于质量之比8.做焰色反应时,使用的铂丝每次都要用试剂洗净,这种试剂指的是A .NaOH 溶液B .碳酸钠溶液C .稀盐酸D .硫酸溶液9.将2.3g 钠放入47.7g 水中,反应完毕,溶质的质量分数是A.大于8%B.等于8%C.小于8%D.大于4%而小于8%10.为方便某些化学计算,有人将98%的浓H 2SO 4表示成下列形式,其中合理的是A .H 2SO 4·910H 2OB .H 2SO 4·H 2OC .H 2SO 4·SO 3D .SO 3·910H 2O11.为除去混在氯化钾中的少量硫酸钾和氯化钙杂质,需进行下列六项操作:① 加水溶解; ② 加热蒸发结晶; ③ 加入过量氯化钡溶液; ④ 加入过量盐酸; ⑤ 加入过量碳酸钾溶液; ⑥ 过滤。
2019-2020年高中化学竞赛高一组竞赛试题

2019-2020年高中化学竞赛高一组竞赛试题(1)求A的分子式:(2)1体积A和足量H2O反应得4体积气体(同温、同压),请写出反第4题(6 分)气体中有下列平衡:N2O4(g) 2NO2(g) 。
在27°C,105Pa条件下气体混合物的平均分子量为76.7。
求N第5题(9 分)甲烷(CH4)与氯气(Cl2)光照下反应生成CH3Cl, CH2Cl2, CHCl3等。
请回答下列问题。
(1)写出CH(3)请指出CH2Cl2分子中各原子的化合价。
a 气体(4) 请指出CHCl第6题(7 分)一带有两个负电荷的錸(Re)的双核络合物,是由两个錸和八个氯(Cl )构成。
具有反磁性。
请回答下列问题以便确定其结构。
(2)Cl处在第几周期,有几个价电子?(4)若每个Cl 与Re 形成一个化学键,并且分子中的价电子全部配对成第7题( 14 分)某课外小组模拟工业流程 设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO2的化学方程式:(4)盛有Na23式是:CO32O== NaNO222已知:NO2可被NaOH溶液完全吸收,而NO不能被吸收,但当NO2与NO按一定的比例混合时,可被NaOH溶液完全吸收,则此时NO2与242第8题(15 分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:22SO 42(SO 4)32O (2)将所得含有Mn 2+、Fe 3+、Cu 2+、Al 3+、Zn 2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO 2和Zn 。
b 、操作②中加入适量X 的作用是什么;X 的首选物的化学式是:c 、操作③中所加碳酸盐的化学式是 (3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图。
2019年高中化学竞赛初选考题
2019年高中化学竞赛初选考题胡征善一、写化学方程式[(1)和(4)题写离子方程式](10分)(1)已知:φ°(Ni3+/Ni2+)>φ°(Cl2/Cl—)。
则Ni2O3溶于盐酸(2)在Pd(PPh3)4和Ag2O的共同作用下,五氟苯硼酸C6F5B(OH)2与碘苯反应生成碘化银和联苯类化合物(用结构简式表示)(3)四氢硼钠是有机化学中一种特效还原剂。
遇水剧烈反应生成一种气体和盐(4)白磷P4有剧毒,硫酸铜溶液可解毒,反应生成很难溶解的Cu3P和磷酸(5)NaBH4与氯化镍(摩尔比2︰1)在水溶液中反应,可得到两种硼化物:硼化镍和硼酸(摩尔比1︰3)二、(8分)某金属氯化物的浓溶液A呈黄褐色,加水稀释过程中溶液颜色逐渐变成绿色,最后变为蓝色溶液B。
向B(aq)中加入NaOH(aq)生成蓝色沉淀C。
在C 中加入浓氨水,生成深蓝色溶液D。
向D的浓溶液中通入SO2,会析出白色沉淀E,E中Cu、S、N原子个数比为1︰1︰1。
结构分析显示E呈反磁性,其晶体中有呈三角锥型和正四面体型的物种。
E与足量10mol·dm—3的硫酸混合微热,生成沉淀F、气体G和溶液H。
(1)写出A~H的化学式。
(2)写出D与SO2的微酸性溶液反应的离子方程式。
(3)写出E与10 mol·dm—3的硫酸反应的离子方程式。
三、(10分)C60是碳原子簇C2x(x=12、13、14……)中重要的一种。
的球体中有______条棱边,共有32个面,(1)C分别有___个____边形和___个____边形。
每个C原子采用sp2.28杂化,碳碳键长有两种145 pm和138 pm。
已知C—C键长154 pm,C=C键长134 pm。
据此可认为C60分子中有___个C=C。
因此可发生_______、________反应(填反应类型)。
(2)C60可发生多种周环反应。
例如:①在甲苯中与Br—CH(COOEt)2反应生成,则Br—CH(COOEt)2在反应中形成的中间体是_______________________。
2019年全国高中学生化学竞赛试题9页

2019年全国中学生化学竞赛初赛试题一、(6分)物质M是一种日常生活中不可缺少的调味品.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图甲所示(部分产物已略去):(1)(1分)写出用惰性电极电解M溶液的离子方程式。
(2)(1分)若A是一种酸性氧化物,且可用于制造玻璃,则G的化学式是。
(3)(1分)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是(4)(1分)若A是一种盐,A溶液与B溶液混合产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,则由A转化成E的离子方程式是。
(5)(2分)若A是一种溶液,只可能含有H+,NH4+,Mg2+,Fe3+,Al3+,CO32-,SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图乙所示.由此可知,该溶液中肯定含有的离子:,其浓度之比为。
二、(8分)有五种摩尔质量均为44g/mol的化合物甲、乙、丙、丁、戊,均由短周期元素组成.对甲的捕获在降低温室气体排放中具有重要的作用.乙为烃,等物质的量的乙与丁充分燃烧产物为甲与水,且生成水的质量前者是后者的2倍,丙在一定条件下分解获得两种单质,两单质放电时反应生成A,A遇空气变成红棕色气体B.戊是一种极不稳定的物质,在1180℃以下不存在.科学家用质谱仪在工业制硅的反应产物中证实了其存在。
(1)(2分)丁的分子式,甲的电子式。
(2)(1分)若生成戊的反应中氧化产物与还原产物为同一物质,写出生成戊的化学方程式。
(3)(1分)把铁和铜混和物放入一定量B通入水后形成的稀溶液中,反应后过滤,滤出的固体物质投入盐酸中无气体放出,则滤液中一定含有的溶质是。
(4)(2分)将0.2mol乙完全燃烧后生成的气体全部缓慢通入300mL某浓度的NaOH溶液中,气体完全被吸收,溶液中NaOH无剩余,则NaOH溶液的浓度为。
(若有定值则写具体数值,无定值则写范围).(5)(2分)将等物质的量A、B的混合物溶于NaOH溶液中得到只含有一种溶质的溶液,此溶质的化学式为,计简单实验方案证明溶液中含有此溶质。
2019年广西高中学生化学竞赛试题高一
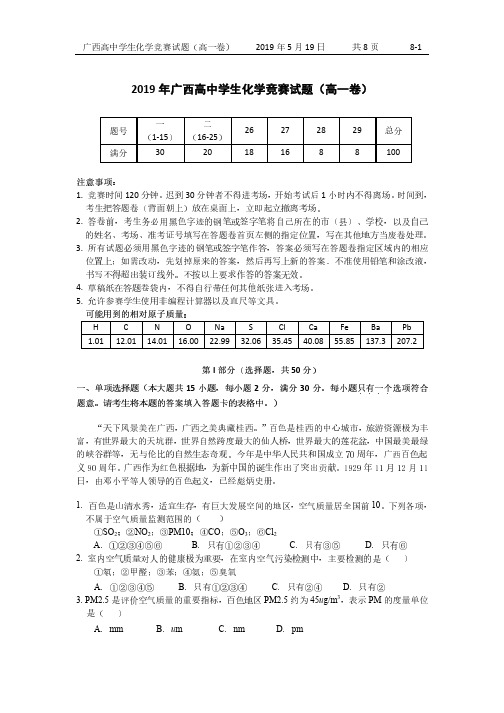
2019年广西高中学生化学竞赛试题(高一卷)题号 一 (1-15) 二 (16-25)26 27 28 29 总分 满分3020181688100注意事项:1. 竞赛时间120分钟。
迟到30分钟者不得进考场,开始考试后1小时内不得离场。
时间到,考生把答题卷(背面朝上)放在桌面上,立即起立撤离考场。
2. 答卷前,考生务必用黑色字迹的钢笔或签字笔将自己所在的市(县)、学校,以及自己的姓名、考场、准考证号填写在答题卷首页左侧的指定位置,写在其他地方当废卷处理。
3. 所有试题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案。
不准使用铅笔和涂改液,书写不得超出装订线外。
不按以上要求作答的答案无效。
4. 草稿纸在答题卷袋内,不得自行带任何其他纸张进入考场。
5. 允许参赛学生使用非编程计算器以及直尺等文具。
可能用到的相对原子质量:H C N O Na S Cl Ca Fe Ba Pb 1.01 12.0114.0116.0022.9932.0635.4540.0855.85137.3207.2第I 部分(选择题,共50分)一、单项选择题(本大题共15小题,每小题2分,满分30分。
每小题只有一个....选项符合题意。
请考生将本题的答案填入答题卡的表格中。
)“天下风景美在广西,广西之美典藏桂西。
”百色是桂西的中心城市,旅游资源极为丰富,有世界最大的天坑群,世界自然跨度最大的仙人桥,世界最大的莲花盆,中国最美最绿的峡谷群等,无与伦比的自然生态奇观。
今年是中华人民共和国成立70周年,广西百色起义90周年。
广西作为红色根据地,为新中国的诞生作出了突出贡献。
1929年11月12月11日,由邓小平等人领导的百色起义,已经彪炳史册。
1.百色是山清水秀,适宜生存,有巨大发展空间的地区,空气质量居全国前10。
下列各项,不属于空气质量监测范围的( )SO ①2;NO ②2;PM10③;CO ④;⑤O 3;Cl ⑥2A .①②③④⑤⑥B .只有 ①②③④C .只有③⑤D .只有⑥ 2. 室内空气质量对人的健康极为重要,在室内空气污染检测中,主要检测的是( )①氡;②甲醛;③苯;④氨;⑤臭氧 A .①②③④⑤ B .只有 ①②③④ C .只有②④ D .只有②3. PM2.5是评价空气质量的重要指标,百色地区PM2.5约为45u g/m 3,表示PM 的度量单位是( )A .mmB .u mC .nmD .pm4. 百色市澄碧河水库位于城东北7公里处,水质澄清,故名澄碧湖。
2019年温州市第九届“小科学家摇篮杯”高一化学竞赛试卷含答案(word版)

2019 年温州市第九届“小科学家摇篮杯”高一化学竞赛试卷(考试时间:2 小时;满分:150 分)考生须知:1.全卷分试题卷和答题卷两部分。
试题共有五大题,29小题。
满分150 分,考试时间120min。
2.本卷答案必须做在答题卷相应位置上,做.在.试.题.卷.上.无.效.,考.后.只.交.答.题.卷.。
必须在答题卷第Ⅰ卷(选择题,共 78 分)一、选择题(本题包括 10 个小题,每小题 3 分,共 30 分;每小题只有一个选项符合题意。
)1.化学与生活、生产、社会息息相关。
下列有关说法不正确的是A.古成语“刀耕火耨”,其化学原理是以灰肥田,并可以有效降低土壤的酸度B.宋·王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜C.《本草纲目》中“凡酸坏之酒,比可蒸烧”,“以烧酒复烧二次……价值数倍也”用到的实验方法是蒸馏D.葛洪在《抱朴子内篇》中说“丹砂(HgS)烧之成水银,积变又还成丹砂”是古代炼丹家对该可逆反应的简单概括。
2.下列表示正确的是A.重晶石的分子式:BaSO4B.H2O2的电子式:C.S2-的结构示意图:D.比例模型可表示CH4,也可表示CCl4分子3.下列有关物质的用途叙述正确的是A.钠钾合金用于快中子反应堆的热交换剂B.氢氧化铁胶体可做净水剂、消毒剂C.晶体硅可用于制作光导纤维D.石灰石是制作水泥、玻璃、晶体硅的材料4.下列说法在一定条件下可以实现的是①酸性氧化物与碱反应②没有水生成,也没有沉淀和气体生成的复分解反应③弱酸与盐溶液反应可生成强酸④两种酸溶液充分反应后的溶液呈中性⑤有单质参加的非氧化还原反应⑥两种含氧化合物反应的产物有气体A.①②③④⑤⑥B.③④⑤⑥C.①②③⑤D.②④⑤⑥5.研究表明CO 与N2O 在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为:①N2O+Fe+=N2+FeO+(慢)②FeO++CO=CO2+Fe+(快)。
下列说法正确的是A.反应①是氧化还原反应,反应②是非氧化还原反应B.两步反应均为放热反应,总反应的化学反应速率由反应②决定C.Fe+使反应的活化能减小,FeO+是中间产物D.若转移1mol e-,则消耗11.2L N2O第 5 题图6.在自然界有很多金属常以硫化矿形式存在,如ZnS,CuS,PbS 和FeS2等,受雨水和空气中氧的作用,地表层矿物缓慢发生转化,矿物的地球化学行为可为找矿提供有益提示,如铅矾、铁帽等。
2019年全国高中学生化学竞赛(省级赛区)试题

2019年全国高中学生化学竞赛(省级赛区)试题第一题(9 分)用α 粒子撞击铋-209 合成了砹-211。
所得样品中砹-211 的浓度<10-8mol/L ,砹-211 同位素半衰期较长,足以用它来研究砹的化学性质。
1 .写出合成砹的核反应方程式。
2.已知室温下用CCl4萃取I2的分配系数为c I2(CCl4)/c I2(H2O)=84,预计用CCl4萃取AtI 的分配系数c AtI(CCl4)/c AtI(H2O)84(填>,<或=);理由是。
3.已知I2+I-I3-的平衡常数K=800,可推断AtI +I -AtI 2-的平衡常数K 800(填>,<或=);依据是。
4.在AtI 中加入I2和I-的混合溶液,滴加AgNO3溶液,发现所得沉淀中只有AgI 而没有共沉淀的AgAt (如果有AgAt ,必然会被共沉淀),然而在上述产物中加入Pb(IO3)2却发现有砹的共沉淀。
写出有关化学方程式,解释上述实验现象。
5.已知室温下ICH 2COOH 的pK a=3.12,由此可推断AtCH 2COOH 的pK a 3.12;理由是。
第二题(12 分)为纪念1905 年爱因斯坦连续发表 6 篇论文导致物理学大变革100 周年,今年被定为国际物理年。
本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。
1 .左上图是热电效应之一的图解。
给出图中所有英文单词(或词组)及物理学符号200 字(包括标点符号等)的说明文。
2.右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。
图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如铁。
按如上结构图写出这种热电晶体的化学式。
给出计算过程。
提示:晶胞的6个面的原子数相同。
设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大?第三题(10 分)等摩尔的丙酮和过氧化氢混合,在盐酸催化下生成白色粉末A 和水,反应进行完全,产物分子总数是反应物分子总数的2/3。
2019年辽宁省高中化学竞赛试题及参考答案

2019年辽宁省高中学生化学竞赛(时间 90分钟,共100分)1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn 相 相 相 相 相 相一、选择题(本题包括11小题,每小题只有一个选项符合题意。
1-6题每小题2分,7-11题每小题3分,共27分。
)1.能源是人类生存和发展的基础。
下列能源的开发和利用过程中不涉及...化学反应的是( ) A .太阳能热水器B .火力发电C .发动机中燃料燃烧D .中国古代制陶A . 0.1 mol·L -1H 2SO 4溶液:Mg 2+、K +、Cl -、NO 3-B . 0.1 mol·L -1NaAlO 2溶液:Na +、NH 4+、H +、SO 42-C . 0.1 mol·L -1Na 2SO 3溶液:Ba 2+、K +、ClO -、OH -D . 0.1 mol·L -1Ba(OH)2溶液:NH 4+、Na +、Cl -、HCO 3- 3.设N A 为阿伏加德罗常数的值,下列叙述正确的是( ) A .1 mol 18O 中含有的中子数为9N AB .常温下,32 g 含有少量臭氧的氧气中含有的氧原子数为2N AC .若1 mol 氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为N AD .78 g 过氧化钠固体中所含阴、阳离子总数为4N A4.啤酒花含有具有独特香气和风味的三种萜类化合物,其结构简式如下图所示。
2019年高一化学竞赛试卷

2019年高一化学竞赛试卷(考试时间:2小时;满分:150分)注意:1. 将答案写在答题卷上,写在试卷上无效,考试结束只上交答题卷。
2. 考生开始答题前,请先将答题卷上密封线内的项目填写完整。
第Ⅰ卷(选择题,共78分)一、选择题(本题包括10个小题,每小题3分,共30分;每小题只有一个选项符合题意。
) 1. 下列说法准确的是A.明矾水解时产生具有吸附性的胶体粒子,能够用于饮用水的杀菌消毒 B.通入过多的空气,能够使燃料充分燃烧,同时提升热量的利用率C.道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究持续更新人们对原子结构的理解 D.水泥、玻璃、青花瓷、红宝石、玛瑙、分子筛都属于硅酸盐工业产品 2. 下列化学用语表述准确的是 A.NaCl的电子式:B.S2―的离子结构示意图: D.质子数为53、中子数为78的碘原子:131 53IC.次氯酸的结构式:H-Cl-O A.SiO2与干冰的晶体结构相似3.我国科学家制得了SiO2超分子纳米管,微观结构如图。
下列叙述准确的是 B.SiO2耐腐蚀,不与任何酸反应 C.SiO2属于酸性氧化物D.光纤主要成分是SiO2,具有导电性 4.下列说法准确的是A.高炉炼铁中焦炭直接还原化合态的铁B.钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属C.元素分析仪是一种可用于确定化学反应速率的比色分析仪器D.12C可用于考古断代B.制备S2Cl2的反应是化合反应,不是氧化还原反应C.S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl D.S2Br2与S2Cl2结构相似,沸点:S2Br20有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图所示,现将3molNH3和2molCO2通入容器中,移动活塞至体积V为3L,用铆钉固定在A、B点。
发生合成尿素的总反应如下:CO2(g) + 2NH3(g)CO(NH2)2(S) + H2O(g)第6 / 8页Ⅱ. 室温下,0.1mol·L的二元酸H2A溶液中,溶液体系可能存在的含A微粒(H2A、HA-、A2-)所占物质的量分数(δ)随pH变化的关系如图所示,请回答下列问题。
2019年北京市高中学生化学竞赛试卷(高中一年级)

2019年北京市高中学生化学竞赛试卷(高中一年级)·竞赛时间2小时。
迟到超过30分钟者不得进场。
开赛后1小时内不得离场。
时间到,把试卷(背面向上)放在桌面上,立即离场。
·竞赛答案全部写在试卷指定位置上,使用黑色或蓝色圆珠笔、签字笔、钢笔答题,使用红色或铅笔答题者,试卷作废无效。
·姓名、准考证号和所属区、县、学校必须填写在答题纸指定位置,写在其他处者按废卷处理。
·允许使用非编程计算器及直尺等文具。
·试卷按密封线封装。
题中可能用到的元素相对原子质量如下:第1题 单选择题(18分)1.炼金废水中所含CN -有剧毒,其性质与卤素离子相似,还原性介于I -与Br -之间,HCN 为弱酸。
下列说法不正确的是 ( C )A .CN -可以和稀硫酸反应生成HCNB .CN -可被Cl 2氧化成(CN)2C .在水溶液中(CN)2可被F -还原 D .HCN 的电子式为 2.镁及其化合物一般无毒(或低毒),且镁电池放电时电压高而平稳,使镁电池越来越成为人们研制绿色原电池的关注焦点。
其中一种镁电池的反应式为:x M g +Mo 3S 4 Mg x Mo 3S 4,在镁原电池放电时,下列说法错误..的是 ( B )A.Mo3S4发生还原反应B.正极反应式为:Mo3S4+2x e-== Mo3S42-C.Mg2+向正极迁移D.负极反应式为:x Mg-2x e-== x Mg2+3.14 g铜、银合金与足量的某浓度的硝酸完全反应,将生成的气体与1.12 L(标准情况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( A) A.3.2 g B.1.6 gC.9.6 g D.6.4 g位于A、B、C、D四种元素中间,如右图所示,A、B、C、D四种元素的原子序数之和不可能是( C)A.4Z B.4Z+10C.4Z+5 D.4Z+145.在标准状况下,将CO2和CO的混合气体(密度是H2的16倍)充满一盛有足量Na2O2的密闭容器中(容积为22.4 L),用间断的电火花引发至充分反应。
2019年广西高中学生化学竞赛试题高一

广西高中学生化学竞赛试题(高一卷)2019年5月19日共8页8-1 2019年广西高中学生化学竞赛试题(高一卷)题号一(1-15)二(16-25)26 27 28 29 总分满分30 20 18 16 8 8 100注意事项:1. 竞赛时间120分钟。
迟到30分钟者不得进考场,开始考试后1小时内不得离场。
时间到,考生把答题卷(背面朝上)放在桌面上,立即起立撤离考场。
2. 答卷前,考生务必用黑色字迹的钢笔或签字笔将自己所在的市(县)、学校,以及自己的姓名、考场、准考证号填写在答题卷首页左侧的指定位置,写在其他地方当废卷处理。
3. 所有试题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷指定区域内的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案。
不准使用铅笔和涂改液,书写不得超出装订线外。
不按以上要求作答的答案无效。
4. 草稿纸在答题卷袋内,不得自行带任何其他纸张进入考场。
5.允许参赛学生使用非编程计算器以及直尺等文具。
可能用到的相对原子质量:H C N O Na S Cl Ca Fe Ba Pb1.0112.0114.0116.0022.9932.0635.4540.0855.85137.3 207.2第I部分(选择题,共50分)一、单项选择题(本大题共15小题,每小题2分,满分30分。
每小题只有一个....选项符合题意。
请考生将本题的答案填入答题卡的表格中。
)“天下风景美在广西,广西之美典藏桂西。
”百色是桂西的中心城市,旅游资源极为丰富,有世界最大的天坑群,世界自然跨度最大的仙人桥,世界最大的莲花盆,中国最美最绿的峡谷群等,无与伦比的自然生态奇观。
今年是中华人民共和国成立70周年,广西百色起义90周年。
广西作为红色根据地,为新中国的诞生作出了突出贡献。
1929年11月12月11日,由邓小平等人领导的百色起义,已经彪炳史册。
1.百色是山清水秀,适宜生存,有巨大发展空间的地区,空气质量居全国前10。
2019年府谷中学高一化学竞赛试题

2019年府谷中学高一化学竞赛试题考生须知:⒈本卷分试题和答题卷两部分,满分100分,考试时间60分钟。
⒉本卷答案必须做在答题页上,做在试题卷上无效,考后只交答题页,写明班级、姓名。
一.选择题(本题包括20小题,每小题3分,共60分。
每小题只有一个选项符合题意) 1.下列变化一定属于化学变化的是()⑥工业制O2⑦白磷转化为红磷⑧久置浓硝酸变黄⑨16O与18O间的相互转化A.②③④⑦⑧⑨B.③④⑤⑦⑧C.②③⑥⑦⑨D.④⑤⑥⑧2.镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是()A.镭的金属性比钙弱B.单质能与水反应生成H2C.镭在化合物中呈+2价D.碳酸镭难溶于水3.化学与能源开发、环境保护、资源利用、食品安全等密切相关。
下列说法正确是() A.明矾与水反应可以产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒B.PM2.5是指大气中直径小于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成的混合物具有丁达尔效应C.安装煤炭燃烧过程中的“固硫”装置,主要是为了提高煤的利用率D.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用4.下列关于“实验安全”的说法不正确的是()A.药品柜的同一层不可存放浓硝酸和浓氨水B.实验室电器设备引起火灾,应迅速用水灭火C.实验剩余的钠单质应该放回到保存钠的试剂瓶中D.铝制品不宜用于盛放酸、碱溶液,也不能用具有强酸性或强碱性的洗涤剂来洗涤5.下列物质中不能用化合反应的方法制得的是()①SiO2②H2SiO3③Fe(OH)3④Al(OH)3 ⑤FeCl2⑥CaSiO3A.①③B.②④C.②③④⑤D.②④⑥6.下列关于物质的分类说法正确的是()A.在熔化状态下能导电的化合物一定是离子化合物B.根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸C.CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、MgO为碱性氧化物D.Na2O的水溶液能导电,所以Na2O是电解质7.下列方程式正确的是()A.FeSO4酸性溶液暴露在空气中: 4Fe2++O2+4H+4Fe3++2H2OB.过量石灰水与碳酸氢钙反应:Ca2++2HCO-3+2OH-===CaCO3↓+CO2-3+2H2O C.H182O中投入Na2O2固体:2H182O+2Na2O2===4OH-+4Na++18O2↑D.亚硫酸氢铵与足量氢氧化钠溶液反应:NH+4+OH-=== NH3↑+H2O8.下列操作能达到实验目的的是()图1 图2 图3 图4A.用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体B.用图2所示装置制取少量纯净的CO2气体C.用图3装置可制得金属锰D.用图4验证NaHCO3和Na2CO3热稳定性9.下列各组离子一定能大量共存的是()A.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、I-B.在强碱性溶液中:Na+、K+、AlO2-、CO32-C.在无色透明的溶液中:NH4+、Fe3+、SO42-、NO3-D.在强酸性溶液中:K+、Fe2+、Cl-、NO3-10.第七周期为不完全周期,若将来发现把这一周期元素全部排满,则下列有关第七周期元素的推论可能正确..的是()A.第七周期排满时有32种元素,全部是金属元素B.第七周期排满时最后一种单质性质稳定,较难发生化学反应C.第七周期第ⅦA族元素的原子序数为117,是一种非金属D.第七周期第ⅢA族元素的氢氧化物与Al(OH)3具有相似的化学性质11.韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019年高一化学竞赛试卷
(考试时间:2小时;满分:150分)
注意:1. 将答案写在答题卷上,写在试卷上无效,考试结束只上交
答题卷。
2. 考生开始答题前,请先将答题卷上密封线内的项目填写完整。
第Ⅰ卷(选择题,共78分)
一、选择题(本题包括10个小题,每小题3分,共30分;每小题只
有一个选项符合题意。
) 1. 下列说法准确的是
A.明矾水解时产生具有吸附性的胶体粒子,能够用于饮用水的杀菌消
毒 B.通入过多的空气,能够使燃料充分燃烧,同时提升热量的利用
率
C.道尔顿、汤姆生、卢瑟福、玻尔等科学家的研究持续更新人们对原
子结构的理解 D.水泥、玻璃、青花瓷、红宝石、玛瑙、分子筛都属
于硅酸盐工业产品 2. 下列化学用语表述准确的是 A.NaCl的电子式:
B.S2―的离子结构示意图: D.质子数为53、中子数为78的碘原子:131 53I
C.次氯酸的结构式:H-Cl-O A.SiO2与干冰的晶体结构相似
3.我国科学家制得了SiO2超分子纳米管,微观结构如图。
下列叙述
准确的是 B.SiO2耐腐蚀,不与任何酸反应 C.SiO2属于酸性氧化物D.光纤主要成分是SiO2,具有导电性 4.下列说法准确的是
A.高炉炼铁中焦炭直接还原化合态的铁
B.钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属
C.元素分析仪是一种可用于确定化学反应速率的比色分析仪器
D.12C可用于考古断代B.制备S2Cl2的反应是化合反应,不是氧化
还原反应
C.S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl D.S2Br2与S2Cl2结构相似,沸点:S2Br20
有体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如图所示,现将3molNH3和2molCO2通入容器中,移动活塞
至体积V为3L,用铆钉固定在A、B点。
发生合成尿素的总反应如下:CO2(g) + 2NH3(g)CO(NH2)2(S) + H2O(g)
第6 / 8页
Ⅱ. 室温下,0.1mol·L的二元酸H2A溶液中,溶液体系可能存在的含A微粒(H2A、HA-、A2-)所占物质的量分数(δ)随pH变化的关系如图所示,请回答下列问题。
(1)H2A的电离方程式为。
(2)经计算Ka(HA-。
(3)等物质的量浓度的NaHA和Na2A溶液等体积混合,混合溶液中各离子浓度从大到小
排列顺序为▲。
26. (7分)O3 可由臭氧发生器(原理如图)电解稀硫酸
制得。
(1)图中阴极为▲(填“A”或“B”),其电极反
应式为▲。
(2)若C处通入O 2 ,则A极的电极反应式为▲。
(3)若C处不通入O2 ,D、E处分别收集到xL和有yL气体(标准情况),则E处收集
的气体中O 3所占的体积分数为▲(忽略 O 3 的分解)。
四、实验题(包括2小题,共19分) 27. (9分)Ⅰ. 已知:
Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O。
某同学探究影响
硫代硫酸钠与稀硫酸反
(1)实验①、②可探究▲对反应速率的影响,所以V3 (2)实验①、③可探究▲对反应速率的影响,所以V4
Ⅱ. 利用反应:I2+2Na2S2O3=Na2S4O6+2NaI能够定量测定市售硫代硫
酸钠(Mr=158)的纯度,现在
称取Wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥
形瓶中,加入指示剂,用含有I2为amol·L-1的碘水滴定,消耗碘水bmL。
(1)滴定前能够选择▲做指示剂。
(2)对于该滴定实验的相关操作或误差分析准确的是▲。
A.滴定前,应对滴定管、锥形瓶实行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得
的纯度将会偏小 D.滴定前仰视读数而滴定结束时俯视读数,则所测
得的纯度将会偏小(3)样品中硫代硫酸钠纯度的表达式为▲。
28. (10分)三氯化六氨合钴([Co(NH3)6]Cl3,橙黄色晶体)是一种
重要的钴配合物,通常不溶于冷水和醇,微溶于盐酸,易溶于氢氧化
钠溶液,实验室制取该物质的化学方程式、大致流
第7 / 8页
程和简易装置如下所示:
4CoCl2·6H2O+4NH4Cl+20NH3+O2
4[Co(NH3)6]Cl3+26H2O
(提示:反应中容易生成的副产物有:[Co(NH3)5Cl]Cl2、
[Co(NH3)5(H2O)]Cl3等)
(1)活性炭的作用是。
(2)操作Ⅰ的名称是▲。
(3)为尽可能减少副产物的生成,在充分保证反应物足量的前提下,
本实验必须严格控制的
反应条件是▲。
(4)检查装置B的气密性的方法是。
(5)粗产品后续处理时,先将粗产品溶于沸水,趁热过滤,除去活性
碳等杂质,再在冰水浴
条件下往滤液中加入适量浓盐酸,即有大量晶体析出,加入浓盐酸的
目的是▲。
(6)为洗涤[Co(NH3)6]Cl3产品,下列方法中合适的是▲ (选填编号)。
A . 先用冰水洗,后用冷盐酸洗
C. 先用冷盐酸洗,后用乙醇洗
五、计算题(包括小题,共6分)
29. 钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的
应用。
完成下列计算:(1)钠-钾合金可在核反应堆中用作热交换液。
5.05 g钠-钾合金溶于200 mL水生成0.075 mol
氢气。
①溶液中氢氧根离子的物质的量浓度为·L-1(忽略溶液体积变化)。
②该钠-钾合金的化学式为
(2)氢氧化钠溶液处理铝土矿并过滤,得到含偏铝酸钠的溶液。
向该
溶液中通入二氧化碳,
↓+Na2CO3
有下列反应:2NaAlO2+CO2+3H2O=2Al(OH)3
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),则生成的Al(OH)3和Na2CO3的物质的量之比为▲。
B. 先用冷水洗,后用乙醇洗
D. 先用氢氧化钠溶液洗,后用冷水洗。
