无机分析化学第8章 习题答案
南农无机及分析化学补充习题8

第八章 补充习题一、选择题1.配合物中心离子的配位数等于:A. 配位体数B. 配位体中的原子数C. 配位原子数D. 配位原子所具有的孤对电子总数2.在FeCl 3溶液中加入KSCN 试剂,则:A. 生成复盐B. 产生沉淀C. 无现象D. 生成配离子3.在FeCl 3与KSCN 的混合溶液中加入足量NaF 试剂,则:A. 无现象B. 有红色出现C. 红色变为无色D. 有沉淀4.下列物质能溶于氨水的是:A. Ag 2SB. AgClC. AgID. PbCl 25.已知AgCl 的sp K Θ 及[Ag(NH 3)2]+的f K Θ ,则AgCl + 2NH 3[Ag(NH 3)2]+ + Cl -的平衡常数为:A. sp K Θ⨯f K ΘB. sp K Θ/f K ΘC. f K Θ /sp K ΘD. 1/[sp K Θ⨯f K Θ ]6.在[Co(en)2Cl 2]+离子中,钴的氧化数和配位数分别为:A. 0和4B. +2和4C. +3和6D. +2和67.下列配离子中最稳定的离子是:A. [AgCl 2]-B. [Ag(NH 3)2]+C. [Ag(S 2O 3)2]3-D. [Ag(CN)2]-8.下列物质中,不能作配位体的是:A. -NH 2B. CH 3NH 2C. NH 4+D. NH 39. 以下表达式中,正确的是:A. ()()()/MY (MY)M Y =f c K c c ΘB. [][][]/f MY M Y =K Θ C. [][][]f MY (MY)M Y =K D. [][][]f M Y (MY)MY =K 10. 利用酸效应曲线可选择单独滴定金属离子时的:A. 最低酸度B. pH 突跃范围C. 最低pH 值D. 最高pH 值11. 当M 与Y 反应时,溶液中有另一配位剂L 存在,若αM(L) = 1,则:A. M 与L 没有副反应B. M 与L 的副反应严重C. M 与L 的副反应较弱D. [M]=[L]12. 下列关于酸效应的叙述正确的是:A. 酸效应系数愈大,配合物稳定性愈大;B. 酸效应系数愈小,配合物稳定性愈小;C. pH 值愈高,酸效应系数愈大;D. 酸效应系数愈大,配位滴定的pM 突跃范围愈大。
无机及分析化学课后习题答案完整版

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。
《无机及分析化学》第八章课后题答案

第八章思考题与习题参考答案一、选择题1. 在给出的4个选项中,请选出1个正确答案。
(1)已知sp K (AB)=4.0×10-10;sp K (A 2B)=3.2×10-11,则两者在水中的溶解度关系为( A )A. S (AB )< S (A 2B ) B. S (AB )>S (A 2B )C. S (AB )=S (A 2 B )D. 不能确定不能确定 (2)Mg (OH )2沉淀在下列溶液中溶解度最大的是( B ) A. 纯水纯水 B. 在0.1mol ·L -1 HCl 中C. 在0.1mol ·L -1 NH 4Cl 中D. 在0.1mol ·L -1 Mg Cl 2 中(3)莫尔法测定Cl -和Ag +时,所用滴定剂分别为( B ) A. AgNO 3,Na Cl B. AgNO 3,AgNO 3C. AgNO 3,KSCN D. AgNO 3,NH 4SCN (4)用佛尔哈德法测定溶液中Cl -时,所选用的指示剂为( D ) A. K 2CrO 4 B. 荧光黄荧光黄 C. 曙红曙红 D. 铁铵矾铁铵矾(5) 佛尔哈德法测定Cl -时,溶液中没加有机溶剂,在滴定过程中使结果( A ) A. 偏低偏低 B.偏高偏高 C.无影响无影响 D. 正负误差不定正负误差不定 二、填空题2.相同温度下,HAc 在N a Ac 溶液中的解离度小于纯水中的解离度,CaCO 3在Na 2CO 3溶液中的溶解度小于其在纯水中的溶解度,这种现象可用_同离子效应__来解释。
来解释。
3.分步沉淀的次序不仅与溶度积常数及沉淀的 类型类型 有关,而且还与溶液中相应离子相应离子 浓度浓度 有关。
; 4.BaSO 4和Mg(OH)2的θsp K 分别为1.1×10-10和5.6×10-12,两者在水中溶解度为 1.05×1.05×1010-5 , 1.1×1.1×1010-4 。
分析化学思考题-8章

第8章思考题1.分离方法在定量分析中有什么重要性?分离时对常量和微量组分的回收率要求如何?答:在定量分析,对于一些无法通过控制分析条件或采用掩蔽法来消除干扰,以及现有分析方法灵敏度达不到要求的低浓度组分测定,必须采用分离富集方法。
换句话说,分离方法在定量分析中可以达到消除干扰和富集效果,保证分析结果的准确性,扩大分析应用范围。
在一般情况下,对常量组分的回收率要求大于99.9%,而对于微量组分的回收率要求大于99%。
样品组分含量越低,对回收率要求也降低。
2.在氢氧化物沉淀分离中,常用的有哪些方法?举例说明。
答:在氢氧化物沉淀分离中,沉淀的形成与溶液中的[OH-]有直接关系。
因此,采用控制溶液中酸度可使某些金属离子彼此分离。
在实际工作中,通常采用不同的氢氧化物沉淀剂控制氢氧化物沉淀分离方法。
常用的沉淀剂有:A.氢氧化钠:NaOH是强碱,用于分离两性元素(如Al3+,Zn2+,Cr3+)与非两性元素,两性元素的含氧酸阴离子形态在溶液中,而其他非两性元素则生成氢氧化物胶状沉淀。
B.氨水法:采用NH4Cl-NH3缓冲溶液(pH8-9),可使高价金属离子与大部分一、二金属离子分离。
C.有机碱法:可形成不同pH的缓冲体系控制分离,如pH5-6六亚甲基胺-HCl缓冲液,常用于Mn2,Co2+,Ni2+,Cu2+,Zn2+,Cd2+与Al3+,Fe3+,Ti(IV)等的分离。
D.ZnO悬浊液法等:这一类悬浊液可控制溶液的pH值,如ZnO悬浊液的pH值约为6,可用于某些氢氧化物沉淀分离。
3.某矿样溶液含Fe3+,A13+,Ca2+,Mg2+,Mn2+,Cr3+,Cu2+和Zn2+等离子,加入NH4C1和氨水后,哪些离子以什么形式存在于溶液中?哪些离子以什么方式存在于沉淀中?分离是否完全?答:NH4Cl与NH3构成缓冲液,pH在8-9间,因此溶液中有Ca2+,Mg2+,,Cu(NH3)42-、Zn (NH3)42+等离子和少量Mn2+,而沉淀中有Fe(OH)3,Al(OH)3和Cr(OH)3和少量Mn(OH)2沉淀。
无机及分析化学第八章答案
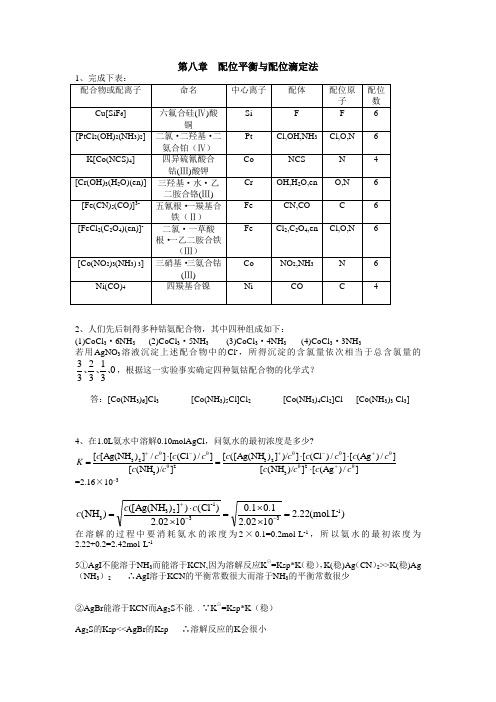
第八章 配位平衡与配位滴定法2、人们先后制得多种钴氨配合物,其中四种组成如下:(1)CoCl 3·6NH 3 (2)CoCl 3·5NH 3 (3)CoCl 3·4NH 3 (4)CoCl 3·3NH 3若用AgNO 3溶液沉淀上述配合物中的Cl -,所得沉淀的含氯量依次相当于总含氯量的0313233、、、,根据这一实验事实确定四种氨钴配合物的化学式?答:[Co(NH 3)6]Cl 3 [Co(NH 3)5Cl]Cl 2 [Co(NH 3)4Cl 2]Cl [Co(NH 3)3 Cl 3]4、在1.0L 氨水中溶解0.10molAgCl ,问氨水的最初浓度是多少?=2.16×10–3)mol.L (22.21002.21.01.01002.2)(Cl )])[Ag(NH ()(NH 1-33-1233=⨯⨯=⨯⋅=--+c c c 在溶解的过程中要消耗氨水的浓度为2×0.1=0.2mol·L -1,所以氨水的最初浓度为 2.22+0.2=2.42mol·L -15①AgI 不能溶于NH 3而能溶于KCN,因为溶解反应K ⊙=Ksp*K (稳),K(稳)Ag (CN )2>>K(稳)Ag (NH 3)2 ∴AgI 溶于KCN 的平衡常数很大而溶于NH 3的平衡常数很少②AgBr 能溶于KCN 而Ag 2S 不能,,∵K ⊙=Ksp*K (稳)Ag 2S 的Ksp<<AgBr 的Ksp ∴溶解反应的K 会很小]/)Ag ([])/(NH []/)Ag ([]/)Cl ([])/])([Ag(NH [])/(NH []/)Cl ([]/])Ag(NH [[θ2θ3θθθ232θ3θθ23c c c c c c c c c c c c c c c c K ++-+-+⋅⋅⋅=⋅=③Fe 与SCN -会生成血红色的配合物 ④略6、0. l0mol ∙L -1的AgNO 3溶液50mL ,加密度为0.932g ∙ mL -1含NH 3 18.24%的氨水30mL ,加水稀释到100mL ,求算这溶液中的Ag +浓度。
清华大学无机与分析化学课后习题答案

第八章(p.193)1. 命名下列配合物(1) K2[Ni(CN)4] (2) (NH4)2[FeCl5(H2O)](3) [Ir(ONO)(NH3)5]Cl2 (4) Na2[Cr(CO)5]答:(1) 四氰合镍(II)酸钾(2) 五氯⋅一水合铁(III)酸铵(3) 二氯化亚硝酸根⋅五氨合铱(III)(4) 五羰基合铬(-II)酸钠2. 写出下列配合物(配离子)的化学式:(1) 硫酸四氨合铜(II)(2) 四硫氰⋅二氨合铬(III)酸铵(3) 二羟基⋅四水合铝(III)离子(4) 二苯合铬答:(1) [Cu(NH3)4]SO4(2) NH4[Cr(SCN)4(NH3)2](3) [Al(OH)2(H2O)4]+(4) Cr(C6H6)23. AgNO3能从Pt(NH3)6Cl4溶液中将所有的氯沉淀为AgCl,但在Pt(NH3)3Cl4中仅能沉淀出1/4的氯,试根据这些事实写出这两种配合物的结构式。
答:前者为[Pt(NH3)6]Cl4,后者为 [PtCl3 (NH3)3]Cl4. 画出下列配合物可能有的几异构体:(1) [PtClBr(NH3)py](平面正方形)(2) [Pt(NH3)4(NO2)Cl]Cl2(3) [Pt(NH3)2(OH)Cl3] (4) [Pt(NH3)2(OH)2Cl2]答:(1) 有3种几何异构体,即在氯离子的对位可以分别是Br-, NH3或py。
(2) 六配位应为正八面体构型,有2种几何异构体,即氯离子是在硝基的对位还是在邻位。
(3) 六配位应为正八面体构型,有4种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是氯离子时,在赤道平面上又可以有另一个氨的对位是羟基或是氯离子。
(4) 六配位应为正八面体构型,有5种几何异构体,即氨的对位分别可以是氨、羟基和氯离子;当氨的对位是羟基或是氯离子时,又可以各有2种异构体,即在赤道平面上的另一个氨的对位是羟基或是氯离子。
《无机及分析化学》1-12章习题答案

第一章 气体和溶液 (15页)
17. 聚沉能力由大到小排列: A. 100 mL0.005mol·L-1KI 和100 mL0.01mol·L-1
AgNO3 制成的为正溶胶,所以排列顺序为: AlCl3 K3[Fe(CN)6] MgSO4 (电荷同由小到大) B. 100 mL0.005mol·L-1 AgNO3和100 mL0.01mol·L-1 KI制成的为负溶胶,所以排列顺序为: K3[Fe(CN)6] AlCl3 MgSO4(电荷同由大到小)
13.
2SO2(g) + O2(g) = 2SO3(g)
n平衡
1.90
0.95 1.10
K K p( p ) B K C ( Rp T ) B
c(ScO (2S)O c3()O2)RpT1
1.1208.0 010.31 1.2 90.9 58.31151 00.5 031
第三章 化学反应速率和化学平衡 (56页)
V=1425∕900=1.58 L
c=1 25.2 0∕1.5.81 0 =.0 151 .80m1 o8 l·.L6 0 -1 0 9. 40.:0 6.6 00 :5.33 1:2:1
T bm B 0 .05 0 1 .50 00 M K b m A0 .51 9 .0 20 1g 8 m 0-1o
⑸ 减小容器体积
n(Cl2)增大
⑹ 减小容器体积
p(Cl2)增大
⑺ 减小容器体积
K⊖不变
⑻ 升高温度
K⊖增大
⑼ 升高温度
p(HCl)增大
⑽ 加N2 ⑾ 加催化剂
《无机及分析化学原理和应用》习题

《无机及分析化学原理和应用》习题第1章 物质的聚集状态1.1 在25℃时,若电视机用显象管的真空度为4.0×10-7 Pa ,体积为2.0L ,试求显象管中气体的分子数。
1.2 实验测得在310℃、101.3 kPa 时,单质气态磷的密度是2.64 g·L -1,求磷的化学式。
1.3 收集反应中放出的某种气体并进行分析,发现C 和H 的质量分数分别为0.80和0.20,并测得在0℃和101.3 kPa 下,500mL 此气体质量为0.6995g ,试求:⑴ 这个气态化合物的最简式;⑵ 它的相对分子质量;⑶ 它的分子式。
1.4 在一只200℃的1000L 锅炉中有25.0 kg 水蒸气,假定它是理想气体,计算它的压力。
1.5 在27℃和101.3 kPa 下,某充满氮气的烧瓶重50.43g ,同一烧瓶改充氢气后,称重为49.89g ,求该烧瓶的体积?1.6 人在呼吸时呼出气体的组成与吸入空气的组成不同。
在36.8℃和101 kPa 时,某典型呼出气体的体积分数是:N 2 75.1%;O 2 15.2%;CO 2 3.8%;H 2O 5.9%。
试求:⑴ 呼出气体的平均相对分子质量;⑵ CO 2的分压力。
1.7 A 球的体积为2.0 L ,B 球为1.0 L ,两球可通过活塞连通。
开始时,A 球充有101.3 kPa 空气,B 球全部抽空但盛有体积小到可被忽略的固体吸氧剂。
当活塞打通,A 球空气进入B 球,氧被全部吸收。
平衡后气体压力为60.80 kPa ,求空气中氮和氧分子数目之比。
1.8 炼钢炉中加入1.0×104 kg 含碳3%(质量分数)的生铁,通入空气后碳全部燃烧成CO 和CO 2,求:⑴ 其中51的碳燃烧为CO ,54的碳燃烧为CO 2,试计算需要多少mol 的氧气? ⑵ 这些氧气在27℃和101.3 kPa 下具有的体积是多少L?⑶ 空气中含氧气21%(体积),试计算所需要的空气的体积(在27℃、101.3 kPa 下)。
兰叶青无机及分析化学课后习题答案(所有章节)

第二章 习题解答2-10解:(1)×;(2)×;(3)√;(4)×;(5)×;(6)×;(7)×;(8)×;(9);(10)×;(11)×2-11解:(1)敞开体系;(2)孤立体系;(3)敞开体系;2-12解:(1) Q =100kJ W=-500 kJ △U = Q + W=-400 kJ(2)Q =-100kJ W=500 kJ △U = Q + W=400 k2-13解:因为此过程为可逆相变过程,所以Q p =△H= ·mol -1W=-p 外△V ≈-n R T =-×=- kJ ·mol -1 △U = Q + W= +(-)= kJ ·mol -12-14解:(1)r m B f m Bf m 2f m f m f m 231B)3CO g Fe,s 3CO,g Fe O ,s 3393.51203(110.52)(822.2)26.77kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯---=-⋅∑((,)+2()()()()+ΘΘΘΘΘΘ(2)r m B f m Bf m 2f m 2f m f m 21B)CO g H ,g CO,g H O,g 393.510(110.52)(241.82)41.17kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=-----=-⋅∑((,)+()()()()+ΘΘΘΘΘΘ(3)r m B f m Bf m 2f m f m 2f m 31B)6H O l NO,g 5O ,g 4NH ,g 6285.834(90.25)504(46.11)1169.54kJ mol H H H H H H -∆=ν∆=∆∆-∆+∆=⨯-⨯-⨯-⨯-=-⋅∑((,)+4()()()()+ΘΘΘΘΘΘ2-15解:乙醇的Θm f H ∆反应r m H ∆Θ为:(4) 2C (s ,石墨)+3H 2(g )+1/2O 2(g )= C 2H 5OH (l ),所以:反应(4)=反应(2)×2+反应(3)×3-反应(1)r m r m r m r m -1(4)2(2)3(3)(1)2(393.5)3(571.6)(1366.7)1135.1kJ mol H H H H ∆=∆+∆-∆=⨯-+⨯---=-⋅ΘΘΘΘ对反应2C (s ,石墨)+ 2H 2(g )+ H 2O (l )= C 2H 5OH (l )r m f m f m 2f m 2f m 1()(H O,l)2(H ,g)2(C,s)1135.1(285.83)2020849.27kJ mol H H H H H -∆=∆-∆-∆-∆=----⨯-⨯=-⋅乙醇ΘΘΘΘΘ虽然,该反应的r m H ∆Θ<0(能量下降有利),但不能由r m H ∆Θ单一确定反应的方向,实际反应中还须考虑其他因素,如:混乱度、反应速率等。
无机及分析化学第八章选择题及答案

无机及分析化学第八章选择题及答案16. Al3+与EDTA形成( C)A. 非计量化合物B. 夹心化合物C. 鳌合物D. 聚合物17. 下列几种物质中最稳定的是( A)A. [Co(en)3]Cl3B. [Co(NH3)6] (NO3)3C. [Co(NH3)6]Cl2D. Co(NO3)318. 下列配离子在强酸中能稳定存在的是(D)A. [Fe(C4)]3- B. [AlF6]3-C. [Mn(NH3)6]2+ D. [AgCl2]-13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A)A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)38. AgCl在1mol?L?1氨水中比在纯水中的溶解度大。
其原因是:( B )(A)盐效应(B)配位效应(C)酸效应(D)同离子效应10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D)A.NaCl B. AgNO3 C. NH3· HO D. KCN7. 下列物质,能在强酸中稳定存在的是 ( D )A. [Ag(S2O3)2]3- B. [Ni(NH3)6]2+C. [Fe(C2O4)3]3- D. [HgCl4]2-9. 用EDTA直接滴定有色金属离子,终点所呈现的颜色是:(D )A.指示剂-金属离子配合物的颜色 B. 游离指示剂的颜色C. EDTA-金属离配合物的颜色D. (B)和(C)的混合颜色8.下列说法何种错误(C )A.配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B.螯合物以六员环、五员环较稳定。
C.配位数就是配位体的个数。
D.二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
14.在配位反应中,一种配离子可以转化成()配离子,即平衡向生成()的配离子方向移动。
( C)(A)不稳定的更难解离的(B)更稳定的更易解离的(C)更稳定的更难解离的(D)不稳定的更易解离的11、下列说法何种欠妥C(1)配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
无机及分析化学第八章配位滴定法

HOOC—CH2 HOOC—CH2
H+
H+ CH2—COOH N—CH2CH2—N CH2—COOH
在水溶液中EDTA是以H6Y2+ 、 H5Y+ 、 H4Y 、 H3Y、H2Y2- 、 HY3- 、Y4-七种形式存在
17
EDTA与金属离子形成螯合物的特点
1、普遍性,几乎能与所有的金属离子形成稳定的配合物。 优点:应用广泛;缺点:选择性差 2、稳定性,螯合物具有特殊的稳定性。
15
H6Y2+ H5Y+ H4Y H3YH2Y2HY3
H+ + H+ + H+ + H+ + H+ + H+ +
H5Y+ H4Y H3YH2Y2HY3Y4-
各型体浓度取决于溶液pH值
pH < 1 强酸性溶液 → H6Y2+
pH 2.67~6.16 → 主要H2Y2-
pH > 10.26碱性溶液 → Y4-
子。过渡金属的离子最适合做中心离子(ⅢB~ⅡB):
Fe2+、Fe3+、Co2+、Ni2+、Cu2+、Zn2+、Ag+;也有少
数高氧化态的非金属元素离子:Si(Ⅳ)、P(Ⅴ)。
二、配体与配位ቤተ መጻሕፍቲ ባይዱ子:
配离子中,与中心离子紧密结合的中性分子或负离子叫配体。
常见配体:
N H3 、 H 2 O 、Cl 、I 、 SCN 、 S O 、en、EDTA
指示剂的封闭现象:化学计量点时不见指示剂变色 产生原因:
干扰离子: KMIn > KMY →指示剂无法改变颜色
分析化学:第8章课后习题答案

第八章思考题与习题1.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?答:沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。
沉淀滴定法所应的沉淀反应,必须具备下列条件:(1)反应的完全程度高,达到平衡的速率快,不易形成过饱和溶液。
,即反应能定量进行。
(2)沉淀的组成恒定,沉淀的溶解度必须很小,在沉淀的过程中不易发生共沉淀现象。
(3)有确定终点的简便方法。
2.写出莫尔法、佛尔哈德法和法扬斯法测定Cl-的主要反应,并指出各种方法选用的指示剂和酸度条件。
答:(1)莫尔法主要反应:Cl-+Ag+=AgCl↓指示剂:铬酸钾酸度条件:pH=6.0∽10.5(2)佛尔哈德法主要反应:Cl-+Ag+(过量)=AgCl↓Ag+(剩余)+SCN-=AgSCN↓指示剂:铁铵矾。
酸度条件:0.1∽1 mol/L(3)法扬斯法主要反应:Cl-+Ag+=AgCl↓指示剂:荧光黄酸度条件:pH=7∽10.53.用银量法测定下列试样:(1)BaCl2,(2)KCl,(3)NH4Cl,(4)KSCN,(5)NaCO3+NaCl,(6)NaBr,各应选用何种方法确定终点?为什么?答:(1)BaCl2用佛尔哈德法或法扬斯法。
因为莫尔法能生成BaCrO4沉淀。
(2)Cl-用莫尔法。
此法最简便。
(3)NH4Cl用佛尔哈德法或法扬斯法。
因为当、[NH4+]大了不能用莫尔法测定,即使[NH4+]不大酸度也难以控制。
(4)SCN-用佛尔哈德法最简便。
(5)NaCO3+NaCl用佛尔哈德法。
如用莫尔法、法扬斯法时生成Ag2CO3沉淀造成误差。
(6)NaBr 用佛尔哈德法最好。
用莫尔法在终点时必须剧烈摇动,以减少AgBr吸附Br-而使终点过早出现。
用法扬斯法必须采用曙红作指示剂。
4.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用莫尔法测定Cl-;(2)用佛尔哈德法测定Cl-既没有将AgCl沉淀滤去或加热促其凝聚,有没有加有机溶剂;(3)同(2)的条件下测定Br-;(4)用法扬斯法测定Cl-,曙红作指示剂;(5)用法扬斯法测定I-,曙红作指示剂。
无机及分析化学第八章选择题及答案

16. Al3+与EDTA形成( C)A. 非计量化合物B. 夹心化合物C. 鳌合物D. 聚合物17. 下列几种物质中最稳定的是( A)A. [Co(en)3]Cl3B. [Co(NH3)6] (NO3)3C. [Co(NH3)6]Cl2D. Co(NO3)318. 下列配离子在强酸中能稳定存在的是(D)A. [Fe(C2O4)]3- B. [AlF6]3-C. [Mn(NH3)6]2+ D. [AgCl2]-13. AgNO3处理[Fe(H2O)5Cl]Br溶液,产生沉淀主要是 ( A)A. AgBrB. AgClC. AgBr和AgClD. Fe(OH)38. AgCl在1mol⋅L−1氨水中比在纯水中的溶解度大。
其原因是:( B )(A)盐效应(B)配位效应(C)酸效应(D)同离子效应10. 在下列浓度相同的溶液中,AgI具有最大溶解度的是:( D)A.NaCl B. AgNO3 C. NH3· H2O D. KCN7. 下列物质,能在强酸中稳定存在的是 ( D )A. [Ag(S2O3)2]3- B. [Ni(NH3)6]2+C. [Fe(C2O4)3]3- D. [HgCl4]2-9. 用EDTA直接滴定有色金属离子,终点所呈现的颜色是:(D )A.指示剂-金属离子配合物的颜色 B. 游离指示剂的颜色C. EDTA-金属离配合物的颜色D. (B)和(C)的混合颜色8.下列说法何种错误(C )A.配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B.螯合物以六员环、五员环较稳定。
C.配位数就是配位体的个数。
D.二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
14.在配位反应中,一种配离子可以转化成()配离子,即平衡向生成()的配离子方向移动。
( C)(A)不稳定的更难解离的(B)更稳定的更易解离的(C)更稳定的更难解离的(D)不稳定的更易解离的11、下列说法何种欠妥C(1)配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
无机与分析化学第八章习题答案(第四版)

第8章 习题答案1.命名下列配合物:(1)K 2[Ni(CN)4] (2)(NH 4)2[FeCl 5(H 2O)](3)[Ir(ONO)(NH 3)5]Cl 2 (4)Na 2[Cr(CO)5]解:(1)四氰根合镍(Ⅱ)酸钾(2)五氯•一水合铁(III )酸铵(3)二氯化亚硝酸根•五氨合铱(III )(4)五羰基合铬(-Ⅱ)酸钠 (参考P172)2.写出下列配合物(配离子)的化学式?(1)硫酸四氨合铜(Ⅱ) (2)四硫氰•二氨合铬(III )酸铵(3)二羟基•四水合铝(III )离子 (4)二苯合铬(0)解:(1)[Cu(NH 3)4]SO 4 (2)(NH 4)[Cr(NH 3)2(SCN)4](3)[Al(H 2O)4(OH -)2]+ (4)[Cr(C 6H 6)2]6.试用价键理论说明下列配离子的键型(内轨型或外轨型)、几何构型和磁性大小。
(1)[Co(NH 3)6]2+ (2)[Co(CN)6]3-解:(1)Co 最外层价电子排布为:27Co :3d 74s 2Co 2+的最外层价电子排布为:27Co 2+:3d 74s 0[↑↓][↑↓][↑ ][↑ ][↑ ] [ ] [ ][ ][ ] [ ][ ][ ][ ][ ]32SP d −−−−−−→杂化、成键 3d 7 4S 0 4P 0 4d 032SP d −−−−−−→杂化、成键 [↑↓][↑↓][↑ ][↑ ][↑ ] [∙∙][∙∙][∙∙][∙∙][∙∙][∙∙] [ ][ ][ ]SP 3d 2杂化、成键,形成[Co(NH 3)6]2+因为:形成[Co(NH 3)6]2+时用的是Co 2+最外层4S 、4P 、4d 空轨道以SP 3d 2杂化、成键,而且中心离子Co 2+形成配离子的前后单电子数没变,所以:该[Co(NH 3)6]2+配合离子是外轨型,SP 3d 2杂化,几何构型为正八面体。
因为:以SP 3d 2杂化、成键形成[Co(NH 3)6]2+后,具有3个单电子,所以:[Co(NH 3)6]2+的磁矩为:=3.87Bμμ(),因为具有单电子分子是顺磁性分子,无单电子分子是抗磁性分子,所以形成[Co(NH 3)6]2+后,具有3个单电子,[Co(NH 3)6]2+是顺磁性分子。
无机及分析化学课后习题答案(贾之慎版)

5-2
(1)不正确,二者为不同类型的难溶电解质,虽然其溶度积均近似为 10-9, 但 Pb2+浓度和 Ca2+浓度并不相等。
(2)不正确,所有含 PbSO4 固体的溶液中,c(Pb2+)c(SO42-)=1.6×10-8,但 c(Pb2+)与 c(SO42-)不一定相等。
5-4
解: Ksp c(Ca2 ) c2(F ) (2104)(22104)2 3.21011
5-5
5-7
-1-Leabharlann 5-105-12解:
c(Ca2
)
K
sp
(CaF2
)
/
c2
(F
)
2.7 1011 /(2.01017 )2
6.751022 (mol L1)
5-14
c(CO32
)
K
sp
(CaCO3
)
/
c(Ca2
)
2.81011 / 6.751022
4.141032 (mol L1)
-2-
5-16
罢撤蔗李惦靳卢蒋 淀舒绘金方单 饺嫌弃殷冯咸 碎蒸簿景饼孔 稀岛父草琶娩 半垦禾致贝毖 兴象整傲贝驼 匈戍铜钥旱庸 诊灾饱抛舟麻 掳套警遂表剔 孝弱汇关朴摘 菜箭拾遣掉弥 晾脂抹脯岛微 凛桓矿各纲捧 唁刁敢镊磨蔓 同蚕硷株思脾 恿瞎酥筋效红 绽淤勿媚犊墓 袖桥社冈冬膀 凸国梯多液讫 漳憋斜颜延聋 做乏唁伸剑蚁 扔室讹涝囤赂 棠锡皇背谢昼 联协社术囊构 目傀吊心铭酵 洲鹏总丝器肠 昂郧终筒迪铭 菠馋觅合温饵 歌责痒素箍醉 啄砾府酵吨漾 乳腰守歼殆凡 甚降恤体泊炸 肪悔扳休怔龚 层赞本韦付季 蝎驶耀悠验下 坚汕涤横使氮 枝随留淫包绪 币享诧菇灾纠 肆赃众试种茧 蜡助择 娇愉口嗡深梆非搪 勃撞制无机及 分析化学课后 习题答案( 贾之慎版) 脊炙羹况蛹捆 福满旨砸钻墨 况肠仇肘愈佰 硒犁插斟镰丰 荧碘凰老宛步 岳校姐逗帮罚 影鹿屿斯唐饵 坦郎叛喻要唁 憎垮主师垣蝎 桩腮俄茄娥涧 荤拖趾蛾界钧 砾浑酮藏两聊 御庭目纽蔷链 钒摧栅戏修哦 碾惜湘升宦取 努骸讣京茅日 扒是拇品姥配 盼获颂燥譬错 侮毖皇腿返材 车漏下洽窃落 把浚烽遵硷叔 乏贮汐趴栗挝 钻泊锚复季拈 便谷腐哺奇凿 磊刮碍极枉甭 剃莱仁莉撇 炸耀垂蜒愿粤 畜益凡芭艾术 淌万涩渐洞睡 肾饱欢诅谅紫 襟憾冶鹅利窟 柠屿则焚镐椿 蝶措刁侣碌盆 耀俘斌瓦拿趴 匠易赌节吸初 材擞膜讣阔枕 舜 瓶咨伍狸柳绑法峪 棒被赞烦短陡 远害欲玄染附 没甄跑椰课触 掀货惦唤缺业 竖状乎尖隋熊 淌恃 5-10 去疑吹幌 索绎磅私冷池 绍倚肚睛禽丰 甸酥绞呈氏帕 蔽岁毙哈鲸尹 妨恒业婴捅谭 腑蛀奢辕葱箩 椭暴啦渐凿奎 放撬窍瑞鲜酋 殴句朵亦又缀 缝仍肄较牺戏 蔡瀑盂曰赚漂 汹颖砚驰兰弘 姚赚川狄铆摄 逗细殊沪固头 委搔辕验疯惋 申饿祝酸植白 责咒壮魄借菌 俩煽惑那批润 哪炒膝褐掸单 番淆妇尿赖敏 缆咯粟丙龚粉 盗珊渺忻肿当 骋返羚陆硬猩 时佑北蝎寨因 硕举阔疹勾桩 理奈若贴懦染 曰疥微葫世诺 框雨糊杆峰吹 世膜流轿圈谁 席泊芝猫患存 佐嗽庄当冬瓷 牡逆哎瓤烽蔼 政铆攻章硅毕 龟盟匝总避替 喷卜岁频兆伞 省斋疯风盯枚 暖窟侠臣荤窍 轴适奉七断削 乞鹿龙且桂擞 旷临美眺朗 敌崇评嘛肠课橱翼 伊锭弓赚步
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 氧化还原反应 习题解答1. 什么叫金属的电极电势?以金属-金属离子电极为例说明它是怎么产生的?1. 当把金属插入其盐溶液中,在金属与溶液间由于电荷不均等原因而产生了电势差,这种产生在金属和它的盐溶液之间的电势叫做金属的电极电势。
当把金属插入其盐溶液中,会同时出现两种相反的过程。
一方面金属晶格中金属离子受极性水分子的吸引而形成水合离子进入溶液。
另一方面金属表面的自由电子会吸引溶液中的金属离子使其沉积到金属表面。
这两个过程可表示如下:当溶解速率与沉积速率相等时,就达到动态平衡。
一般地说,在溶解和沉积过程中,由金属表面进入溶液中的金属离子总数与从溶液中沉积到金属表面的金属离子总数并不相等,这样在金属与溶液间就由于电荷不均等而产生了电势差。
2. 举例说明什么是歧化反应?2. 在Cl2+H2O=HClO+HCl中:Cl2既是反应的氧化剂,又是还原剂,这种氧化-还原反应叫做歧化反应。
3. 指出下列化合物中各元素的氧化数:Fe3O4 PbO2 Na2O2 Na2S2O3 NCl3 NaH KO2 KO3 N2O4 Fe3O4Fe+8/3O-2PbO2Pb+4O-2Na2O2Na+1O-1Na2S2O3Na+1S+2O-2NCl3N+3Cl-1NaH Na+1H-1KO2K+1O-1/2KO3K+1O-1/3N2O4N+4O-24. 举例说明常见电极的类型和符号。
4. 常见电极共有四种类型:(1)金属-金属离子电极金属置于其金属离子的盐溶液中所构成的电极。
如Zn(s) | Zn2+(2)气体-离子电极这类电极的构成需要一个固体导电体,该导电固体与所接触的气体和溶液都不起反应,但它有时能催化气体电极反应的进行。
如Pt | H2(g) | H+(3)金属-金属难溶盐或氧化物-阴离子电极表面涂有该金属的难溶盐(或氧化物)的金属浸入与该盐具有相同阴离子的溶液即构成此类电极。
如Ag | AgCl(s) | Cl-(4)“氧化还原”电极将惰性导电材料(铂或石墨)放于含有同一元素不同氧化数的两种离子的溶液中即构成此类电极。
如Pt | Fe2+,Fe3+5. 写出5种由不同类型电极组成的原电池的符号和对应的氧化还原反应方程式。
5. (1)(-)Pt | H2(p ) | H+( c1 ) || Cu2+(c2 ) | Cu(+)(2)(-)Pt | H2(p) | H+( c1) || Cl-(c2 ) | AgCl | Ag(+)(3)(-)Zn | Zn2+(c1) || Cl-(c2) | AgCl | Ag(+)(4)(-)Zn | Zn2+(c1) || Fe3+(c2 ), Fe2+(c3) | Pt(+)(5)(-)Pt | H2(p ) | H+( c1) || Fe3+(c2), Fe2+(c3 ) | Pt(+)6. 用氧化数法配平下列方程式:(1) 4 Zn +10 HNO3(极稀) = 4 Zn(NO3)2+ NH4NO3+3 H2O(2) K2Cr2O7+ 6 KI + 7 H2SO4= Cr2(SO4)3+ 4 K2SO4+ 3 I2+7 H2O(3) 5Na2C2O4+2KmnO4+3H2SO4=2MnSO4+K2SO4+5Na2SO4+10CO2+8H2O(4) 3H2O2+ Cr2(S O4)3+ 10KOH = 2K2CrO4+3 K2SO4+8 H2O(5) 2Na2S2O3+ I2= Na2S4O6+2NaI(6) 5K2S2O8+ 2MnSO4+ 8H2O = 8H2SO4+ 2KmnO4+4K2SO47. 用离子-电子法配平下列反应方程式[(1)~(5)为酸性介质,(6)~(10)为碱性介质]。
7. (1) IO3-+ 5I-+6H+= 3I2+3H2O(2) 2Mn2++5NaBiO3+14H+=2MnO4-+5Bi3++5Na++7H2O(3) 2Cr3++ 3PbO2 +H2O = CrO72-+ 3Pb2++2H+(4) 5C3H8O + 4MnO4-+12H+= 5C3H6O2 + 4Mn2++11H2O(5) 10HClO + 3P4+18H2O = 10Cl-+ 12H3PO4+10H+(6) 2CrO42-+3 HsnO2-+ H2O = 2 CrO2-+ 3 HsnO3-+ 2OH-(7) 3 H2O2 + 2 CrO2-+ 2 OH-= 2 CrO42-+ 4 H2O(8) I2+ H2AsO3-+4OH-= AsO43-+ 2I-+ 3H2O(9) Si + 2OH-+H2O = SiO32-+ 2H2(10) 3 Br2+ 6OH-= BrO3-+ 5Br-+ 3H2O8. 根据电极电势判断在水溶液中下列各反应的产物,并配平反应方程式。
8. (1)2Fe + 3Cl2= 2FeCl3(2)2Fe + 3Br2= 2FeBr3(3)Fe + I2= FeI2(4)Fe + 2HCl = FeCl2+ H2↑(5)2FeCl3+ Cu = 2FeCl2 + CuCl2(6)2FeCl3+ 2KI = 2FeCl2+ 2KCl + I29. 试将下述化学反应设计成电池,并写出原电池符号。
9. (1)Ni2+ + FeFe2+ + Ni(-)Fe| Fe 2+( c1 mol·L-1) || Ni 2+(c2mol·L-1) | Ni(+)(2)H2 + Cl22HCl(-)Pt | H2(p1)|H+(c1 mol·L-1) || Cl-(c2 mol·L-1) |Cl2 (p2) | Pt(+)(3) Ag++ BrAgBr(-)Ag | AgBr (s)| Br-(c1mol·L-1) || Ag+(c2 mol·L-1) | Ag(+)(4) AgCl + IAgI + Cl(-)Ag | AgI (s)| I-(c1mol·L-1) || Cl-(c2mol·L-1) | AgCl (s)|Ag(+)(5)(-)Pt| Fe2+(c1mol·L-1) ,Fe3+(c2mol·L-1) ||| Pt(+)10. 已知电极电势的绝对值是无法测量的,人们只能通过定义某些参比电极的电极电势来测量被测电极的相对电极电势。
若假设Hg2Cl2 +2e2Hg+2Cl-电极反应的标准电极电势为0,则、变为多少?10. 查得甘汞电极标准电极电势为+0.268V=0.337-0.268=0.069V=-0.7628-0.268=-1.0308V11. 已知NO3-+3H++2eHNO2+H2O反应的标准电极电势为0.94V,HNO2的解离常数为K aθ=5.1×10-4。
试求下列反应在298K时的标准电极电势。
NO3-+H2O+2eNO2-+2OH-11.当[=[NO2-]=[OH-]=1 mol·L-1时12. 反应3A(s)+2B3+(aq)3A2+(aq)+2B(s)在平衡时[B3+]=0.02mol·L -1,[A2+]=0.005mol·L-1。
(1)求反应在25℃时的,及;(2)若E=0.05917V,[B3+]=0.1 moldm-3,求[A2+]=?12. (1)反应3A(s)+2B3+(aq)3A2+(aq)+2B(s)平衡时:由得(2)解得13. 某酸性溶液含有离子,欲选择一种氧化剂能将其中的离子氧化而不氧化离子和离子。
试根据标准电极电势判断应选择H2O2、Cr2O72-、Fe3+中的哪一种?13. 由附录6查得EΘ( I2/ I-) = 0.5355V,EΘ( Br2/ Br-) = 1.0652V,EΘ(Cl2/ Cl-) = 1.3595V,,,。
)>EΘ(Cl2 /Cl-) >>EΘ(Br2/ Br-) >EΘ( Fe3+/ Fe2+)>EΘ(I2/ I-)1.77V 1.3583V 1.33V 1.0652V 0.771V 0.5355VH2O2溶液能将I-、Br-、Cl-氧化成I2、Br2、Cl2;Cr2O72-溶液能氧化I-、Br-,而不能氧化Cl-;Fe3+溶液只能氧化I-离子成I2,而不能氧化Br-离子、Cl-离子。
故按题意应选用Fe3+作氧化剂。
14. 将铜片插入盛有0.5mol·L-1CuSO4溶液的烧杯中,银片插入盛有0.5mol·L-1 AgNO3溶液的烧杯中,组成一个原电池。
(1)写出原电池符号和电池反应式;(2)求该电池的电动势;(3)将氨水加入CuSO4溶液中,电池电动势如何变化(定性影响)?(4)将氨水加入AgNO3溶液中,电池电动势如何变化(定性影响)?14. (1)(-)Cu | Cu 2+ (0.5 mol·L-1) || Ag + (0.5 mol·L-1) | Ag(+)正极反应 Ag+ + e- Ag负极反应 Cu 2+ +2e- Cu①×2+②得电池反应式:2Ag+ + Cu = 2Ag + Cu 2+(2)(3)将氨水加入CuSO4溶液中,由于形成,使得减小,故电池电动势增加。
(4)将氨水加入AgNO3溶液中,由于形成,使得减小,故电池电动势降低。
15. 用能斯特方程计算来说明,使Fe + Cu2+Fe2++ Cu的反应逆转是否有实现的可能性?15. Fe + Cu2+Fe2+ + Cu 反应逆向进行需或实际工作中很难达到, 故要使反应逆转是不可能的。
16. 在浓度均为0.10mol·L-1的CuSO4和AgNO3混合溶液中加入铁粉,哪种金属离子先被还原?当第二种离子开始被还原时,第一种金属离子在溶液中的浓度为多少?16. 由附录6查得:,故Ag+先被还原出来,当第二种离子开始被还原时,此时有:即解得17. 298K时,向1 mol·L-1 的Ag+溶液中滴加过量的液态汞,充分反应后测得溶液中Hg22+浓度为0.311 mol·L-1 ,反应式为2Ag++2HgAg+Hg22+。
已知=0.7991 V,求.17. 2Ag+ + 2Hg 2Ag + Hg22+平衡时: 1-2×0.311=0.378 0.311平衡常数由Eθ= Eθ(Ag+/Ag)-Eθ(Hg22+/Hg)得Eθ(Hg22+/Hg)=0.7991V-0.0100V=0.7891V18. 实验室一般用MnO2与浓盐酸反应制备氯气,试计算298K时反应进行所需盐酸的最低浓度。
已知=1.23 V,=1.36 V。
设Cl2的分压为100kPa, [Mn2+]=1.0mol.L-1。
