Gabriel反应
取代反应 gabriel(盖布瑞尔)合成法

取代反应 gabriel(盖布瑞尔)合成法一、简介1.1 取代反应 gabriel合成法概述取代反应 gabriel合成法是一种重要的有机合成方法,利用将碱金属halogen化物与带有活性亚胺基的化合物反应,通过置换反应形成相应的胺化合物。
这种方法在有机合成中得到了广泛的应用,特别是在合成生物活性物质和医药化合物方面表现出了独特的优势。
1.2 历史及发展取代反应 gabriel合成法最早由德国化学家Siegmund Gabriel于1887年提出,并在随后的发展中得到了不断的完善和改进。
随着有机合成化学领域的不断深入研究,取代反应gabriel合成法的反应条件、反应机理和反应范围得到了进一步的明确和扩展,为其在有机化学领域的应用奠定了坚实的基础。
二、反应机理2.1 反应的基本步骤取代反应 gabriel合成法的基本步骤包括:Step 1:亚胺基化合物和碱金属halogen化物的反应,生成带有活性亚胺基的化合物;Step 2:生成的带有活性亚胺基的化合物与想要引入的基团进行置换反应,生成相应的胺化合物。
2.2 反应的机理和影响因素取代反应 gabriel合成法的反应机理受多种因素影响,主要包括反应物的结构、反应条件、溶剂和催化剂等。
在合成过程中需要充分考虑这些因素的影响,以保证反应的高效性和产物的纯度。
三、反应条件和优化3.1 反应条件取代反应 gabriel合成法的反应条件包括反应温度、反应时间、溶剂选择、催化剂的使用等。
在进行反应条件的选择时,需要根据所需产物的结构和反应物的性质进行合理的优化,以获得最佳的反应效果。
3.2 反应优化为了获得高产率和产物纯度的胺化合物,需要对取代反应 gabriel合成法的反应条件进行优化。
通过调整反应温度、溶剂比例和催化剂种类等方面的参数,可以有效地提高反应的效率和选择性,从而获得理想的产物。
四、应用领域和前景4.1 在有机合成中的应用取代反应gabriel合成法已经在有机合成化学领域得到了广泛的应用,特别是在合成生物活性物质和医药化合物方面发挥了重要作用。
有机人名反应大全.

索引:Arbuzov反应Arndt-Eister反应Baeyer-Villiger 氧化Beckmann 重排Birch 还原Bischler-Napieralski 合成法Bouveault-Blanc还原Bucherer 反应Cannizzaro 反应Chichibabin 反应Claisen 酯缩合反应Claisen-Schmidt 反应Clemmensen 还原Combes 合成法Cope 重排Cope 消除反应Curtius 反应Dakin 反应Darzens 反应Demjanov 重排Dieckmann 缩合反应Elbs 反应Eschweiler-Clarke 反应Favorskii 反应Favorskii 重排Friedel-Crafts烷基化反应Friedel-Crafts酰基化反应Fries 重排Gabriel 合成法Gattermann 反应Gattermann-Koch 反应Gomberg-Bachmann 反应Hantzsch 合成法Haworth 反应Hell-V olhard-Zelinski 反应Hinsberg 反应Hofmann 烷基化Hofmann 消除反应Hofmann 重排(降解)Houben-Hoesch 反应Hunsdiecker 反应Kiliani 氰化增碳法Knoevenagel 反应Knorr 反应Koble 反应Koble-Schmitt 反应Leuckart 反应Lossen反应Mannich 反应Meerwein-Ponndorf 反应Meerwein-Ponndorf 反应Michael 加成反应Norrish I和II 型裂解反应Oppenauer 氧化Paal-Knorr 反应Pictet-Spengler 合成法Pschorr 反应Reformatsky 反应Reimer-Tiemann 反应Reppe 合成法Robinson 缩环反应Rosenmund 还原Ruff 递降反应Sandmeyer 反应Schiemann 反应Schmidt反应Skraup 合成法Sommelet-Hauser 反应Stephen 还原Stevens 重排Strecker 氨基酸合成法Tiffeneau-Demjanov 重排Ullmann反应Vilsmeier 反应Wagner-Meerwein 重排Wacker 反应Williamson 合成法Wittig 反应Wittig-Horner 反应Wohl 递降反应Wolff-Kishner-黄鸣龙反应Yurév 反应Zeisel 甲氧基测定法Arbuzov(加成)反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
大学有机化学人名反应机理汇总

3.Baeyer----Villiger 反应拜耳-维立格氧化重排反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4.Beckmann 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
9.Claisen 酯缩合反应含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
乙酸乙酯的α-氢酸性很弱(pK a-24.5),而乙醇钠又是一个相对较弱的碱(乙醇的pK a~15.9),因此,乙酸乙酯与乙醇钠作用所形成的负离子在平衡体系是很少的。
100种有机化学人名反应

C6H5-NH2 + 2FeCl3 + 2H2O。
当某些盐(FeCl2、FeCl3、FeSO4、CaCl2等)存在时,所用酸无论是过量还是少量,甚
至在中性溶液中都能够进行这种还原。此方法适用于绝大部分各种不同结构的芳香族化
合物,有时也用来还原脂肪族硝基化合物。
4.
Beckmann重排
CH3 CHO
CrO2Cl2
芳醛。
如果分子中有多个甲基,只可氧
化一个,这是本反应的特征。
27. Favorskii重排
α-卤代酮用碱处理,消除卤素重排得羧酸:
X-CH2-COR + NaOH R-CH2-COOH + NaX环状α-卤代酮也可得到羧酸,
O
R
OC2H5 H5C2O R
13. Chichibabin胺化反应
含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,
生成氨基衍生物。产率一般为
50%~
100%。
H2O
NaNH2溶剂
105-110℃, 66-76%
N N NHNa
有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及
制备醛酮类且产率很高。
OO
OH OH
OH OH
RCHO +R'CHO
+Pb(AcO)4
Pb(AcO)4
+
+
RHC CHR'
R2C CR' RR' R'
COORC CH
药明康德Level 2题目-烃化反应

是非题:1.采用卤代烷对醇进行烷基化反应,氟代烷活性最高,碘代烷活性最低。
()2.碱性条件下,烷氧负离子进攻环氧化合物开环,主要受电性控制,进攻发生在取代较多的碳原子上。
()3.由于酚负离子亲核性比烷氧基负离子弱,以卤代烷为烷基化剂,酚的烷基化反应较醇难以进行,需要采用更强的碱。
()4.邻羟基苯甲酸与对羟基苯甲酸相比,由于邻羟基苯甲酸含有分子内氢键,酚羟基酸性更强,烃化反应更容易进行。
()5.硫酸二甲酯是一种常用的甲基化试剂,由于硫酸二甲酯含有两个甲基,可以甲基化两个当量的醇。
()6.硫酸二甲酯活性较碘甲烷弱,一般只能用于甲基化醇,不能用于甲基化酚。
()7.羧酸比酚更容易被重氮甲烷甲基化。
()8.DCC不仅可以用于酸和醇缩合,也可用于酚和醇缩合生成醚。
()9.Mitsunobu反应用于手性醇对酚的烷基化反应中,手性醇的构型会发生反转。
()10.醇在碱性条件下与芳基卤代物发生亲核取代反应,碘代芳烃活性最低,氟代芳烃活性最高。
()11.Cu催化的芳基卤化物与芳香胺的偶联反应中,碘代芳烃活性最低,氟代芳烃活性最高。
()12.Chan-Lam偶联是铜催化下的硼酸或硼酯与胺,酚或醇等的反应,和Suzuki反应类似,Chan-Lam偶联对氧气比较敏感,需要在惰性气体保护下进行,但对水不敏感,加水一般可以促进反应。
()13.Friedel-Crafts烷基化反应中,伯卤代烷由于位阻最小,反应活性也最高。
()14.Friedel-Crafts烷基化反应中,氟代烷反应活性最高,碘代烷活性最低。
()15.三氯化铝是Friedel-Crafts反应中最常用的催化剂,但一般不适用于催化富电子杂环如呋喃或吡咯的烷基化。
( )16.叔卤代烷由于在碱性条件下易消除,一般不适用于活泼亚甲基化合物的烷基化。
( )17.酮的α位碳在碱性条件下拔氢,在动力学控制条件下易于生成取代基少的烯醇负离子。
( )18.由于醛在碱性条件下易发生羟醛缩合,对醛的α位烷基化可以采用烯胺烷基化的间接方法。
Gabriel反应

Gabriel synthesisFrom Wikipedia, the free encyclopediaThe Gabriel synthesis is named for the German chemist Siegmund Gabriel. Traditionally, it is a chemical reaction that transforms primary alkyl halides into primary amines using potassium phthalimide.The Gabriel reaction has since been generalized to include the alkylation of sulfonamides and imides, followed by deprotection, to obtain amines.The utility of the method is based on the fact that the alkylation of ammonia is an unselective and inefficient route to amines in the laboratory (on an industrial scale, the alkylation of ammonia is, however, widely employed). The conjugate base of ammonia, sodium amide (NaNH2), is more basic than it is nucleophilic. In fact, sodium amide is used to deliberately obtain the dehydrohalogenation product.Traditional Gabriel synthesisIn this method, the sodium or potassium salt of phthalimide is N-alkylated with a primary alkyl halide to give the corresponding N-alkylphthalimide. The reaction fails with most secondary alkyl halides:Upon workup by acidic hydrolysis the primary amine is liberated as the amine salt. Alternatively the workup may be via the Ing-Manske procedure, involving reaction with aqueous or ethanolic hydrazine at reflux. This produces a precipitate of phthalhydrazide along with the primary amine. The first technique often produces bad yields or side products; separation of phtalhydrazide can be unpleasant. For these reasons, other methods for liberating the amine from the phthalimide exist. Even with the use of the hydrazinolysis method, the Gabriel method suffers from relatively harsh conditions.Alternative Gabriel reagentsMany alternative reagents have been developed to complement the use of phthalimides. Most such reagents, e.g. the sodium salt of saccharin, are electronically similar to the phthalimide salts. In terms of their advantages, some such alternative reagents hydrolyze more readily, extend thereactivity to secondary alkyl halides, and allow the production of secondary amines.。
有机人名反应大全

索引:Arbuzov反应Arndt-Eister反应Baeyer-Villiger 氧化Beckmann 重排Birch 还原Bischler-Napieralski 合成法Bouveault-Blanc还原Bucherer 反应Cannizzaro 反应Chichibabin 反应Claisen 酯缩合反应Claisen-Schmidt 反应Clemmensen 还原Combes 合成法Cope 重排Cope 消除反应Curtius 反应Dakin 反应Darzens 反应Demjanov 重排Dieckmann 缩合反应Elbs 反应Eschweiler-Clarke 反应Favorskii 反应Favorskii 重排Friedel-Crafts烷基化反应Friedel-Crafts酰基化反应Fries 重排Gabriel 合成法Gattermann 反应Gattermann-Koch 反应Gomberg-Bachmann 反应Hantzsch 合成法Haworth 反应Hell-V olhard-Zelinski 反应Hinsberg 反应Hofmann 烷基化Hofmann 消除反应Hofmann 重排(降解)Houben-Hoesch 反应Hunsdiecker 反应Kiliani 氰化增碳法Knoevenagel 反应Knorr 反应Koble 反应Koble-Schmitt 反应Leuckart 反应Lossen反应Mannich 反应Meerwein-Ponndorf 反应Meerwein-Ponndorf 反应Michael 加成反应Norrish I和II 型裂解反应Oppenauer 氧化Paal-Knorr 反应Pictet-Spengler 合成法Pschorr 反应Reformatsky 反应Reimer-Tiemann 反应Reppe 合成法Robinson 缩环反应Rosenmund 还原Ruff 递降反应Sandmeyer 反应Schiemann 反应Schmidt反应Skraup 合成法Sommelet-Hauser 反应Stephen 还原Stevens 重排Strecker 氨基酸合成法Tiffeneau-Demjanov 重排Ullmann反应Vilsmeier 反应Wagner-Meerwein 重排Wacker 反应Williamson 合成法Wittig 反应Wittig-Horner 反应Wohl 递降反应Wolff-Kishner-黄鸣龙反应Yurév 反应Zeisel 甲氧基测定法Arbuzov(加成)反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
药物合成反应本科复习题
2015年药物合成反应复习题一、名词解释35=15 41.化学试剂DMSO:二甲基亚砜,分子式为CH32SO2.化学试剂DMF:N,N-二甲基甲酰胺3.化学试剂THF:四氢呋喃4.化学试剂NBS:N-溴代丁二酰亚胺/N-溴代琥珀酰亚胺,溴化剂,具有高度的选择性,只进攻弱的C—H键即与双键或苯环相连的α-H;5.化学试剂 DMAP:4-二甲氨基吡啶,是一种超强亲核的酰化作用催化剂6.化学试剂DCC:二环己基碳二亚胺,通常作为反应脱水剂7.化学试剂 MCPBA:间氯过氧苯甲酸,用于环化反应和Baeyer-Villiger氧化反应8.Bz2O2引发剂:过氧苯甲酰,是一种常用的自由基聚合反应的引发剂;9.释电子基:能增加相邻基团电子云密度的基团;10.吸电子基:能减少相邻基团电子云密度的基团;11.活性亚甲基:邻位连有羰基或其他强吸电子基的亚甲基结构;12.质子酸:水溶液中能电离出质子的酸;13.Lewis酸:含有空轨道、能够接受外来电子对的分子或离子;14.亲核反应:负性基团首先进攻的反应;15.亲电反应:正性基团首先进攻的反应;16.马氏规则:当发生亲电加成反应时,亲电试剂中的正电基团总是加在取代最少的碳原子上,而负电基团则会加在取代最多的碳原子上;17.卤化反应:有机化合物分子中建立碳—卤键的反应;18.烃基化反应:有机分子中氢原子被烃基取代的反应;19.Williamson反应:卤代烃和醇在碱的存在下生成醚的反应;20.Gabriel反应:邻苯二甲酰亚胺和卤代烃在碱性条件下反应,然后肼解得伯胺的反应;21.Leuckart还原反应:用甲酸及其铵盐对醛酮进行还原烃化反应22.Fridel-Crafts烷基化反应:在三氯化铝的催化下,卤代烷和芳烃反应在环上引入烃基的反应;23.酰化反应:有机物分子中氢原子被酰基取代的反应;24.Fridel-Crafts酰基化反应:酰氯、酸酐等酰化剂在Lewis酸或质子酸催化下,对芳烃进行亲电取代生成芳酮的反应;25.缩合反应:两个或多个有机化合物分子通过反应形成一个新的较大分子的反应,或同一分子发生分子内的反应形成新分子的反应;26.Reformatsky反应:醛或酮和α-卤代酸酯在锌的作用下生成β-羟基酯的反应;27.Mannich反应:具有活性氢的化合物与甲醛、胺进行缩合生产氨甲基衍生物的反应;28.Michael反应:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化下发生加成缩合,生成β-羰烷基化合物的反应;29.Wittig反应:醛或酮与含磷试剂反应,使羰基氧被亚甲基取代成烯烃的反应;30.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成β-芳基丙烯酸类化合物的反应;31.Darzen环氧化反应:醛或酮与α-卤代酸酯在碱催化下缩合生成αβ-环氧羧酸酯的反应;32.Diels-Alder反应:1,3-丁烯和乙烯衍生物在加热情况下生成环己烯骨架的反应;33.Beckmann重排反应:醛肟或酮肟在酸性催化剂作用下重排成取代酰胺的反应;34.重排反应:指在同一分子内,某一原子或基团从一个原子迁移至另一个原子而形成新分子的反应;35.Hofmann重排反应:氮原子无其他取代基的酰胺在次卤酸作用下脱羧生成伯胺的反应;36.Lindlar还原剂:钯吸附在硫酸钡温和氢化催化剂;37.Birch还原反应:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应;38.Clemmensen还原反应:锌汞齐盐酸反应将羰基还原成亚甲基的反应;39.Wolff-黄鸣龙还原反应:肼在碱性条件下还原羰基成亚甲基的反应;40.Collins氧化剂:三氧化铬吡啶复合物的二氯甲烷溶液;41.Jones氧化剂:三氧化铬硫酸的丙酮溶液;42.CAN氧化剂:硝酸铈铵氧化剂43.逆合成分析法:也称为反合成分析,即由靶分子出发,用逆向切断、连接、重排和官能团互换、添加、除去等方法,将其变换成若干中间产物或原料,然后重复上述分析,直到中间体变换成所有价廉易得的合成子等价试剂为止;44. 极性反转45.合成子:是指组成靶分子或中间体骨架的各个单元结构的活性形式;根据形成碳碳键的需要,合成子可以是离子形式,也可以是自由基或周环反应所需的中性分子;二、简答题35=15 41.卤化反应的机理主要包括哪几种答:卤化反应的机理主要包括亲电加成、亲电取代、亲核取代以及自由基反应;2.醇的卤置换反应常见的卤化剂有哪些3.答:氢卤酸、含磷卤化物、含硫卤化物常用卤化剂:卤素、N-卤代酰胺、次卤酸酯、次卤酸、卤化氢等;4.什么是马氏规则5.答:马氏规则:当发生亲电加成反应时,亲电试剂中的正电基团总是加在连氢最多取代最少的碳原子上,而负电基团则会加在连氢最少取代最多的碳原子上; 6.烯烃和卤素加成反应属于什么类型的反应什么样的基团优先加成7.答:亲电加成反应;正离子优先进攻;8.次氯酸和烯烃进行亲电加成反应时,卤素加到哪个碳原子上,为什么答:卤素加在含氢较多的碳原子上,因为次卤酸中卤原子带正电性;9.按照马氏法则,卤化氢对烯烃加成,氢和卤素分别加到双键的哪个碳上答:氢加到含氢较多的双键碳上;而卤素加到取代较多的碳原子上;10.光照或高温条件下,溴化氢对烯烃的加成是什么类型的反应结果如何11.答:自由基加成;溴倾向于加在含氢较多的烯烃碳原子上,属反马氏规则;12.芳烃的卤化反应属于什么类型的反应为什么需Lewis酸催化13.答:亲电取代反应;因为在Lewis酸的作用下卤素分子发生极化,产生卤素正离子;14.碱催化酮的α卤取代,易产生什么产物为什么15.答:α-多取代产物,反应不停留在α-单取代阶段,易在同一个α位上继续进行反应,直至所有α-氢原子都被取代为止;因为卤素取代后,吸电子基有利于α-氢质子的脱去,促进烯醇氧负离子的生成及其卤代反应;16.醇羟基烃化反应主要有哪几种烃化剂答:卤代烃、芳基磺酸酯、环氧乙烷、烯烃、其他烃化剂如CF3SO2OR等; 17.酚羟基烃化反应主要有哪几种烃化剂为什么水杨酸用碘甲烷烃化仅得到水杨酸甲酯18.答:卤代烃、硫酸二甲酯、重氮甲烷、烷氧磷盐;因为酚羟基上的氢和羧基中的羰基氧形成分子内氢键;19.付-克烃基化反应属于什么类型的反应为什么会出现烃基的多取代20.答:亲电取代反应;因为烃基是给电子基团使苯环上的电子云密度增大,当苯环上连有一个烃基时,将有利于继续烃化而得到多烃基衍生物;21.醇的酰化常采用的酰化剂有哪些答:羧酸、羧酸酯、酸酐、酰氯、酰胺等;22.为什么经常采用混合酸酐作为酰化剂混合酸酐参与醇酰化反应得到什么样的酯答:因为单一酸酐种类较少,应用上有局限性,而混合酸酐易制备且酰化能力较单一酸酐强,所以更具实用价值,应用更广泛;混合酸酐参与酰化反应时酸性弱的酰基参与酰化作用;23.付-克酰基化反应属什么类型的反应为什么不发生多取代24.答:亲电取代反应;酰基是吸电子基团,使苯环上电子云密度降低,难以进一步反应;25.1,3,5-三甲苯酰化属于什么反应为什么可以发生二取代答:付-克酰基化反应;因为均三甲苯中存在三个供电子基团,不仅可以抵消酰基的吸电子效应,而且由于立体位阻使得羰基不能与苯环共轭,从而显现不出酰基对苯环的钝化作用,可以发生二取代;26.醇醛缩合属于什么类型的反应为什么易脱水成α,β不饱和的羰基化合物答:亲核加成;由于生成的双键和羰基共轭稳定,易脱水成α,β不饱和的羰基化合物;27.Diels-Alder反应属于什么类型的反应什么样的反应物对反应有利28.答:4+2环加成分子协同反应;双烯体电子云密度高有利,亲双烯体电子云密度低有利;29.重排反应根据机理分哪几类答:亲核重排、亲电重排、自由基重排三类;30.Pinacol重排反应按反应机理属于什么重排反应反应中芳基和烷基哪个优先迁移31.答:亲核重排;芳基比烷基优先;32.Beckmann重排属于什么类型的反应中间体是什么33.答:亲核重排;中间体是亚胺;34.Hofmann重排属于什么类型的反应中间体是什么35.答:亲核重排;中间体是异氰酸酯;36.Claisen重排属于什么类型的反应反应物是什么37.答:3,3-σ迁移重排反应;反应物是烯丙基芳基醚;38.Cope重排属于什么类型的反应反应物是什么答:3,3-σ迁移重排反应;反应物是1,5-二烯;39.“CrO3Py2-CH2Cl2”是什么试剂参与什么反应40.答:Collins试剂;参与醇的氧化和烯丙位亚甲基的氧化;41.“CrO3-H2SO4-丙酮”是什么试剂参与什么反应42.答: Jones试剂;参与仲醇的氧化;43.活性MnO2是什么试剂主要参与什么反应44.答:温和性氧化剂;主要用于苄醇的氧化;45.什么是均相催化氢化反应与非均相催化氢化有何不同46.答:均相催化氢化反应是催化剂溶解在溶剂中的催化反应;与非均相催化氢化不同的是以分子的形式参与反应, 所需摩尔量少;47.什么是Lindlar催化剂有何特点48.答:Lindlar催化剂是金属钯吸附在硫酸钡上并加入少量抑制剂醋酸铅或喹啉而成的催化剂;特点是选择性还原炔烃为顺式烯烃;49.Clemmensen和黄鸣龙反应的条件有什么异同答:不同点:Clemmensen反应在酸性介质中进行而黄鸣龙反应在碱性介质中进行;相同点:都是把羰基还原成亚甲基;50.Collins氧化剂和Jones氧化剂有何异同答:相同点:都是三氧化铬作为氧化剂;不同点:Collins是三氧化铬吡啶复合物的二氯甲烷溶液,而Jones氧化剂是三氧化铬硫酸的丙酮溶液;51.Claisen重排和Cope重排有何异同答:相同点:两者均为3,3- σ迁移重排反应;不同点:Claisen重排的反应物是烯丙醚,而Cope重排的反应物是1,5-二烯;反应属于什么类型反应产物是什么用钠和醇在液氨中将芳香环还原成1,4-环己二烯的有机还原反应;34. 什么是催化转移氢化有何特点催化转移氢化属于非均相催化氢化,是在催化剂的作用下有机化合物作为供氢体加成到有机化合物的不饱和基团上的反应;其特点是在金属催化剂存在下,用有机化合物作为供氢体以代替气态氢作为反应氢源;35. Sandmeyer反应属于什么类型反应是何种化合物的转化反应芳香重氮盐化合物的卤置换反应;三、反应机理题28=161.写出苯乙烯与氯气反应的碳正离子反应机理;2.写出次卤酸和烯烃的桥型正离子反应机理;3.写出溴乙烷对苯的烷基化反应机理;EtBr AlCl3Et AlCl3BrEtEtHH Et4.写出三氯化铝催化酰氯对苯的酰化反应机理;5.写出羧酸与胺脱水生成酰胺的反应机理;6.写出下列转化的反应机理;7.写出下列转变的反应机理;Ph3P CH2CH3COCH3H3C CH3CCH2 8.写出下列转变的反应机理;O ClCH2COOC2H5t-BuOK/t-BuOHCHCOOC2H5O9.写出下列转化的反应机理;10.写出下列转化的反应机理;四、合成题45=201. 以间氯硝基苯为起始原料合成FCl ;2. 以苯为起始原料合成;3.2;4. 以甲苯为起始原料合成COOHBr;5. 以乙酰乙酸乙酯为起始原料合成CH 32CH 2C 6H 56. 以乙酰乙酸乙酯为起始原料合成CH 3CH 2CH 2CHCOOH CH 3; 7. 以丙二酸二乙酯和1,4-二溴丁烷为起始原料合成COOC 2H 5;8. 以苯和丁二酸酐为起始原料合成O;9. 以1,4-二甲苯和丁二酸酐为起始原料合成CH 3CH 3;10. 以环己酮和吗啡啉为起始原料合成; 11. 以环己酮和α卤代酸乙酯为起始原料合成CHO;12. 以环己酮和α氰基乙酸为起始原料合成CH 2COOH;13. 以1,3-丁二烯和丙烯醛为起始原料合成CH 3;14. 以1,3-丁二烯和丙烯醛为起始原料合成HOOC HOOCCOOH;五、完成反应215第一章1.I2/AcOAg/Et2OIOAc2. PhHC CH2NBS/H2OPhCH(OH)CH2Br3.OH1molBr2/CS20~5 o CHO Br4. N NH2220~50o C NBrNH25.Ph(CH2)4COPh NBS/CCl4PhBr(CH2)2COPh6. CH3CH32mol Br2/hv125C, 2hCH2BrCH2Br7. COCH3Br2/cat.AlCl3/Et2OoCOCH2Br8. HO(CH2)6OH KI/PPA100~120C, 5h I(CH2)6I9.CH3CH2C(CH3)2OH gas HClCH3CH2C(CH3)2Cl10. O2N CO2H5,0.5h O2N COCl1. Br22. Br23. SbF34. NaI5.1. NaNO2/HCl,2. HPF6或HBF46.1. NaNO2/HCl,2. HPF6或HBF4第二章1. Ph2CHOCH2CH2NMe22.3. HO OHBrPhCH2Cl/(CH3)2CO/KI/K2CO3BrBnO OBn4. HOOCOHOH2N2OCH3OCH3COOCH35.CH2NHCH3HC CCH2Cl6. H2N CONHHCHO/MeOH/H2/NiN CH3H2NOC7. COCH3HCOONH4180~185CNH29.ClEtOH3oClEt10.CH2(CO2Et)2Cl NaOEt CH(CO2Et)2 1. EtBr2.Me2SO43. ClCH2CH2Ph4. i-PrOH5. n-BuBr6. CH3I7. PhCH2Br 8.ClCH23NCH32第三章1. i-PrOH O OCOOMeMeOOCTi(OPr-i)470o C,3hO OCOOPr-ii-PrOOC2.H 3CCH 3CH 3COCl (C 2H 5)3COHAgCN/HMPA30minH 3C CH 3CH 3COOCEt 33. HOCH 2OHAc 2O/PyAcOCH 2OAc4.5.COClCH 3CH 3CF 3SO 3HCH 3H 3CCOCH 36. (CH 2)2COCl3O7.8. NHO50%NaOH/CHCl 3NHOCHO9.10.1. AlCl 32.AlCl 3PhCO2O5.AcCl6.NHCH32第四章49.2CH3CHO5%NaOH15~18C CH3CH(OH)CH2CHO52.CHOH3CO2KCN/EtOHCHCOH3COOCH3OH54.Zn BrCH2COOEt OEt2O OHCH2COOEt55.RMgX HCHORCH2OH56. OC4H9MgXC4H9(CH2)2OH57.COCH3H3COHCHO/(CH3)2NH.HClOCH3COCH2CH2N(CH3)259.CH3CH3O3r.t.CH3CH3CH2CH2OH60.H3CO COCH2CH2COOCH3Ph3P CH2CH3SOCH3o.63.CHO CH2(COOH)2CHCHCOOH65.COCH3(H3C)2HCH2C ClCH2COOC2H5i-PrONao66. NO220o C NO2Diels-Alder50.CHOO2N PhCOCH3H2SO4/HOAcCHCHCOPhO2N53. 2C6H5CHO NaCN/EtOH/H2OpH 7~8,PhCH(OH)COPhCH3COCH3CH2(CN)2/H2NCH2CH2COOH/PhHCN62.H3COH3CO CHOCH3NO2AcONH4/AcOH22o C, 3h H3CO CHCHNO2H3CO64. CHO(PhCH2CO)2OPhCH2COONaC CPhPhH65. HCHO/HCOOH第五章68. MeOHOH0.4mol/L SnCl4/CH2Cl2O70. PhHC CPhOHOHCH3HCl(g)oPh COCHPhCH373.CH3OCH2CH2CONH22CH3OCH2CH2NHCOOMe69.PhOH OHPhH2SO4/Et2Or.t., 3hOPhPh第六章75. ArCH2CH3CAN/HNO390C, 70min ArCOCH376.CH3CH3Na2Cr2O7/H2OoCOOHCOOH78.OHHO CrO3/H2SO4/H2O/CH2Cl2-5~0C , 2hOO79. H2CrO4/Et2O/H2O/MnCl225CO80.OHOHDMAP/HCrO3ClCHOOH81. CH NOHKMnO4NCOPh82.CHO Ag2O/THF/H2O25CCOOH83. OKMnO4/KOH0CCOOHO84. OHOOC(CH2)4COOH85. OAcPhCO3H/PhH0COOAc86. CH3I2/AcOAg/AcOH/H2OCH3OHOH87.CH2PhCN/H2O2/K2CO3/CH3OHO碱性条件88. KMnO4/冠醚/PhHr.t.OCOOH89.42<50C, 4hCOOHCOOH91.1) 1.5molO3/CH2Cl2, -70o C2) Me2S, 0o CCHOCHO94. NH过量MnO2/PhH81CN92.CH2CH2MeO OMe105C ,18hCHCHMeO OMe93.H3C CH3DDQo异构第七章95. H3CO CHCHCOOHH2/5%Pd-CNaH2PO2CH2CH2COOHH3CO96. COOHCOOHNH2NH2/K3Fe(CN)3HOOCCH2CH2COOH97. CHCHCNNaBH4/BiCl395%乙醇CH2CH2CN101. Ph C PhOAlCl3/LiAlH4/Et2OPh2CH2102.OHCON(CH3)2/HCOOHN(CH3)2103. PhHC CHCOOEt LiAlH4-AlCl3/Et2O CHCHCH2OH104.COORO2NNaBH4/AlCl3(CH3OCH2CH2)2OO2N CH2OH105. CH3(CH2)10COOEtNa/EtOH/Tol.CH3(CH2)10CH2OH Bouveault-Blanc107.(CH3)3CCOOH(CH3)3CCH2OH98. NH2CH3Li/NH3/EtOHNH2CH399.OH(CH 2)5CH 3OZn-Hg/HClOH(CH 2)6CH 3106.MeCNMe CH 2NH 2。
Gabriel反应
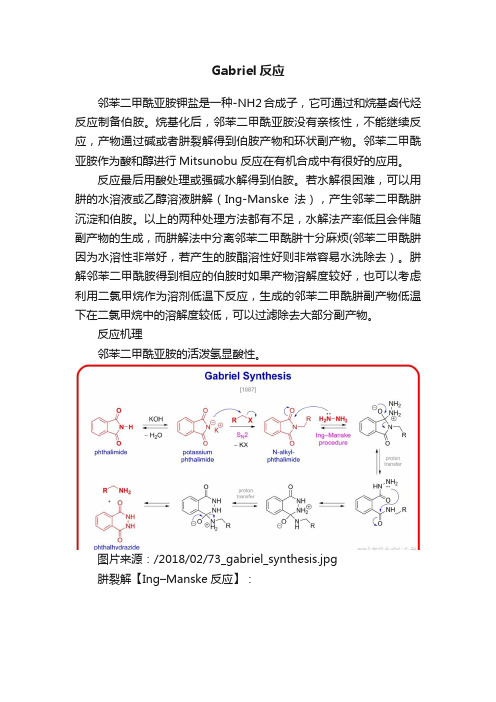
Gabriel反应邻苯二甲酰亚胺钾盐是一种-NH2合成子,它可通过和烷基卤代烃反应制备伯胺。
烷基化后,邻苯二甲酰亚胺没有亲核性,不能继续反应,产物通过碱或者肼裂解得到伯胺产物和环状副产物。
邻苯二甲酰亚胺作为酸和醇进行Mitsunobu反应在有机合成中有很好的应用。
反应最后用酸处理或强碱水解得到伯胺。
若水解很困难,可以用肼的水溶液或乙醇溶液肼解(Ing-Manske法),产生邻苯二甲酰肼沉淀和伯胺。
以上的两种处理方法都有不足,水解法产率低且会伴随副产物的生成,而肼解法中分离邻苯二甲酰肼十分麻烦(邻苯二甲酰肼因为水溶性非常好,若产生的胺酯溶性好则非常容易水洗除去)。
肼解邻苯二甲酰胺得到相应的伯胺时如果产物溶解度较好,也可以考虑利用二氯甲烷作为溶剂低温下反应,生成的邻苯二甲酰肼副产物低温下在二氯甲烷中的溶解度较低,可以过滤除去大部分副产物。
反应机理邻苯二甲酰亚胺的活泼氢显酸性。
图片来源:/2018/02/73_gabriel_synthesis.jpg肼裂解【Ing–Manske反应】:水解:反应实例【J. Am. Chem. Soc. 1950, 72, 2786-2788】【Synthesis, 1995, 756-758】【Tetrahedron Asymmetry 2003, 14, 1167-1170】【Synthesis, 2004, 208-212】参考资料一、Name Reactions (A Collection of Detailed Reaction Mechanisms), Jie Jack Li, Gabriel synthesis,page 272-273.二、Organic Chemistry Portal:/namedreactions/gabriel-synthesis.shtm。
100种有机化学人名反应(有机化学)

1. ArndtEistert反应醛、酮与重氮甲烷反应失去氮并重排成多一个CH2基的相应羰基化合物这个反应对于环酮的扩环反应很重要。
OCH2N2O-CH2NNN2重排O2. BaeyerVilliger氧化应用过氧酸使酮氧化成酯。
反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。
如由樟脑生成内酯OCH3CH3CH3OOCH3CH3H2SO5有时反应能生成二或多过氧化物但环状酮转变为内酯能得到单一的预期产物。
合适的酸为过硫酸Caro’s 酸、过氧苯甲酸、三氟过氧乙酸。
除环酮外无环的脂肪、芳香酮也可发生此反应。
二酮生成酸酐类、α、β不饱和酮得到烯醇酯类。
3. Bechamp还原可用于工业制备在铁、亚铁盐和稀酸的作用下芳香族硝基化合物能还原成相应的芳香胺。
C6H5-NO2 2Fe 6HCl C6H5-NH2 2FeCl3 2H2O。
当某些盐FeCl2、FeCl3、FeSO4、CaCl2等存在时所用酸无论是过量还是少量甚至在中性溶液中都能够进行这种还原。
此方法适用于绝大部分各种不同结构的芳香族化合物有时也用来还原脂肪族硝基化合物。
4. Beckmann重排醛肟、酮肟用酸或路易斯酸处理后最终产物得酰胺类。
单酮肟重排仅得一种酰胺混酮肟重排得两种混合酰胺。
但一般质子化羟基的裂解和基团R的转移是从相反的位置同时进行的。
NOHRRRNHRONRROHRNHRO 无论酯酮肟和芳酮肟都会发生此反应。
环酮肟重排得内酰胺这在工业生产上很重要利用此反应可帮助决定异构酮肟的结构。
5. Beyer喹啉类合成法芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl2存在下反应生成喹啉类化合物。
NH2NHRRHNRRRCHORCOCH3HCl H2这是对Doebner-Miller喹啉合成法的改进。
Doebner-Miller合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
NH2NHCH3HNCH3 H2CH3O2CH3CHO 6. Blanc氯甲基化反应芳香族化合物苯、萘、蒽、菲、联苯及衍生物在ZnCl2或NH4Cl、AlCl3、SnCl4、H2SO4、H3PO4 存在下用甲醛和极浓盐酸处理发生芳香化合物的氯甲基化反应。
gabriel—colman重排反应的应用研究

一、引言Gabriel-Colman重排反应是有机合成中重要的一类反应,主要用于合成无取代胺。
它是通过排除反应原料中的卤素基团,从而在胺分子中引入取代基。
近年来,该反应在药物合成、材料科学等领域得到了广泛应用,并取得了一系列突破性的进展。
本文将就Gabriel-Colman重排反应的原理、应用与研究进行全面探讨。
二、Gabriel-Colman重排反应的原理Gabriel-Colman重排反应是通过将叔胺与α-溴酰胺在碱的作用下反应,生成无取代胺的反应。
这个反应在许多情况下比其他方法更温和、更高效。
由于叔胺的取代基通常很容易脱除,所以该反应还拥有广泛的适用性。
从机理上分析,Gabriel-Colman重排反应主要包括以下步骤:首先是碱的作用下,叔胺与α-溴酰胺发生缩合反应,生成中间体;接着是消除反应,脱除α-溴酰胺,生成无取代胺。
这样一来,就使得Gabriel-Colman重排反应成为一种有效且可控的方法,用于在无取代胺分子中引入各种取代基。
Gabriel-Colman重排反应在有机合成领域有着广泛的应用,特别是在药物合成领域。
以目前的研究来看,它已经被成功应用于许多药物的合成中,如抗癌药物、抗生素等。
作为一个重要的反应,它为药物的研发与合成提供了有效的手段,有望在未来有更广泛的应用。
Gabriel-Colman重排反应在材料科学领域也有着重要的应用价值。
通过该反应合成的无取代胺可被进一步改性,用于制备具有特定功能的聚合物或材料。
Gabriel-Colman重排反应不仅在有机合成领域有重要应用价值,同时也在材料科学领域有着广阔的应用前景。
四、个人观点与理解作为一个研究人员,我个人对Gabriel-Colman重排反应的应用前景充满信心。
该反应的高效性、可控性以及广泛的适用性,使得它在有机合成和材料科学领域有着巨大的应用潜力。
我相信随着对该反应机理的深入理解和技术手段的不断提高,Gabriel-Colman重排反应将会在未来得到更广泛的应用。
有机人名反应

Oppenaue氧化欧芬脑尔氧化法:在异丙醇铝或叔丁醇铝存在下,仲醇和丙酮反应,仲醇氧化成酮,丙酮转化成还原成醇。
Pinacol重排频哪醇重排,相当于碳正离子重排。
Williamson合成法威廉姆逊合成法卤代烃和醇钠作用生成醚的方法。
Friedel-Crafts反应傅克反应(烷基化,酰基化)但苯环上连有吸电子基团如硝基等时,不能发生反应。
Haloform reaction卤仿反应:乙醛、甲基酮、乙醇和α-碳上连有甲基的仲醇与次卤酸盐反应生成卤仿和少一个碳的羧酸。
Aldol condensation羟醛缩合:两分子含有α-氢的醛在酸或碱催化下,相互结合形成β-羟基醛的反应。
Claisen-Schmidt反应克莱森-许密特反应:由芳香醛和含有α-氢的脂肪醛或酮进行交叉羟醛缩合生成α,β-不饱和醛或酮的反应。
Mannich反应曼尼希反应:含有α-活泼氢的酮与甲醛及胺反应,可以在酮的α位引入一个胺甲基。
Clemmensen还原法克莱门森还原法:醛、酮与锌汞齐和浓盐酸回流反应,羰基被还原成亚甲基黄鸣龙还原法:醛、酮在肼、氢氧化钠(或氢氧化钾)的水溶液中,与二缩乙二醇回流反应,被还原成亚甲基。
Meerwein-Ponndorf还原麦尔外因-彭杜尔夫还原:在异丙醇铝-异丙醇的作用下,醛、酮可悲还原成醇,异丙醇转化成丙酮。
Cannizzaro反应:康尼查罗反应:无α-氢的醛在浓碱作用下发生分子间反应,一分子醛被还原成醇,另一分子醛被氧化成酸。
Benzoin缩合反应:安息香缩合反应:芳醛在氰基负离子催化下,生成α-羟基酮的反应。
Wittig反应魏悌希反应:醛、酮与磷叶立德反应生成烯烃的反应。
Gattermann-Koch反应:盖特曼-柯赫反应:在催化剂无水氯化铝和氯化亚铜存在下,芳烃与氯化氢和一氧化碳混合气体作用,生成芳醛的反应。
Michael加成:麦克尔加成:α,β-不饱和醛或酮和亲核的碳负离子进行的1,4-共轭加成反应。
药物合成反应综合习题与答案-1

《药物合成反应》综合习题与答案(答案附后)一、判断题。
1.Gabriel反应能得到纯净伯胺。
2.DCC为缩合试剂。
3.亚甲基上连有给电子基团时,使亚甲基上氢原子的活性增大,该亚甲基被称为活性亚甲基。
4.酰化试剂一般提供酰化反应的正电中心,表现在羰基的碳原子上。
5.SN1反应的典型特征是生成构型反转的产物。
6.Friedel-Crafts烷基化底物中苯环上存在给电子基团,会促进反应的发生。
7.还原反应是有机分子中减少氢的反应。
8.药物合成反应主要研究反应类型、反应机理、影响因素和应用特点。
9.Lewis碱常被用于Friedel-Crafts反应的催化剂。
10.亲核反应、亲电反应最主要的区别是反应要进攻的活性中心的电荷不同。
二、选择题。
1. 本门课主要的研究内容是A. 研究药物的毒性反应B. 研究药物的生物活性C. 研究药物合成及修饰方法D. 研究药物的剂型改造2.下列碳正离子稳定性最强的是。
A. RCH2+B. H3C+C. R2CH+D. R3C+3.以下有关Friedel-Crafts烷基化反应的影响因素正确的是。
A.底物芳环上存在吸电子基团,有助于反应的发生B.底物芳环上存在给电子基团,有助于反应的发生C.质子酸的催化活性强于Lewis酸D. Friedel-Crafts反应的催化剂只能是Lewis酸4.不同的卤化磷对羧羟基卤置换反应活性顺序正确的是。
A. PCl5 > PCl3 > POCl3B. PCl5 > POCl3 > PCl3C. PCl3 > PCl5 > POCl3D. POCl3 > PCl5 > PCl35.化学制药工业的特点不包括。
A. 药物的化学结构一般都较为复杂,需经过多步化学反应才能得到产品B. 质量要求严格, 符合GMP要求C. 生产技术复杂,工艺流程长,所需设备种类多,生产成本高D. 新药创制周期短、耗资多6.下列化合物最易发生卤取代反应的是。
GABRIEL反应

GABRIEL反应
Gabriel反应是一种脂质的有机合成反应,比如用于合成甾醇类或α,β-不饱和醇等
物质。
Gabriel反应是通过加热有机碱和晶体醋酸酯,以芳烃作为相对应反应物,在磺酸
盐或丙酮溶剂中进行高温有机反应而形成一种极性和有机物质。
一般情况下,Gabriel反应是将有机碱和醋酸酯用强碱(如三乙基碳酸钠等)和磺酸
盐(如丙磺酸)在苯溶剂中加入大量溶剂,然后使其混合,再将系统加热到摄氏140到
190度之间,加热时间一般30分钟到2小时不等。
当反应温度超过190度时,产物的稳定性会下降,结果副产物的形成会提高;反应温度太低时,产物形成速度则过慢。
反应过程中,核烷基方式(C-N)结合会断裂,给活性羟基(-OH)及取代甲酸基(-OR)发生攻击,形成直链、循环或环状高级醇,并释放一些水分子。
Gabriel反应可以提
供优良的产率,通常可以同时得到多种甜蜜的醇,可以使用多种芳烃或芳烃衍生物。
Gabriel反应可以用来合成多种化合物,在医药、农药及染料等行业中都有广泛应用,大部分医药中重要的有机底物,如兴奋剂,抗菌药,用于镇痛,呼吸系统抗炎症药,裂解
脂肪类油脂等,都是通过Gabriel反应可以得到的。
由于Gabriel反应可以得到多种甜蜜的醇,也有其一些缺点。
例如,Gabriel反应产
物结构复杂,需要进行新的衍生反应才能获得目标物质;另外,反应条件涉及加热,因此
反应产物可能会挥发,干扰反应结果。
