绝热节流过程
绝热节流系数表达式

绝热节流系数表达式
绝热节流系数表达式是一种用来描述物质在不同温度和压力下从一个容器到另一个容器的节流过程的表达式。
其中,“绝热”指的是该过程不改变气体的总能量,也就是说,所有的热能都是在容器内部传递的,而不是从一个容器流向另一个容器。
绝热节流系数表达式的格式如下:
Q = C * (T2/T1)^(γ - 1)/(γ - 1),
其中,Q表示从一个容器到另一个容器的物质流量,C 表示一个常数,T1和T2分别表示两个容器的温度,而γ则表示气体比容。
这项表达式用来计算物质在它们之间的节流过程是很有用的,因为它可以帮助我们计算出在特定温度和压力下,物质从一个容器到另一个容器的流量。
该表达式的意义在于,它可以用来表示物质在不同压力和温度下从一个容器到另一个容器的流量变化情况,从而可以更好地控制容器中物质的流动。
此外,绝热节流系数表达式还可用于计算热能效率。
例如,当物质从一个容器到另一个容器时,我们可以使用该表达式来计算出物质流动过程中所消耗的热能,从而确定热能的效率。
因此,绝热节流系数表达式是一种非常有用的工具,它可以帮助我们更好地控制物质从一个容器到另一个容器的流量,并计算出物质流动过程中所消耗的热能,从而确定热能的效率。
绝热稳定流动的基本方程

第一节绝热稳定流动的基本方程一、绝热稳定流动工程中气体和蒸汽在管道内的流动可以视为稳定流动,为了简化起见,可以认为垂直于管道轴向的任一截面上的各种热力参数、热力学参数都相同,气体参数只沿管道轴向(气流流动方向)发生变化,称为一维稳定流动。
此外,气体在喷管或扩压管内的流动时间较短,与外界几乎没有热量交换,可以认为是绝热流动.因此,气体在喷管或扩压管内的流动为一维绝热稳定流动。
二、绝热稳定流动基本方程研究气体和蒸汽的一维稳定流动主要有三个基本方程.即连续性方程、绝热稳定流动能量方程和定熵过程方程.1、连续性方程在一维稳定流动的流道中,去截面1-1、2—2、······根据质量守恒定律,可导出一个基本关系式。
在稳定流动通道内任一固定点上的参数不随时间的改变而改变,各截面处质量流量都相等。
即(7—1)式中——各截面处的质量流量,kg/s;——各截面处的截面积,;——各截面处的气体流速,m/s;——各截面处的气体比体积,;对于微元稳定流动过程,对上式微分可得(7—2)式(7-1)、式(7—2)为稳定流动连续性方程。
它适用于任何工质的可逆与不可逆的稳定流动过程。
2、绝热稳定流动能量方程由能量守恒定律可知,气体和蒸汽的稳定流动过程必须符合稳定流动能量方程,即气体和蒸汽在管道内流动时,一般情况下,由绝热流动时,,因此上式可简化为(7—3)对于微元绝热稳定流动过程,可写成(7—4)式(7—3)、式(7—4)为绝热稳定流动能量方程。
说明气体和蒸汽在绝热稳定流动过程中,其动能的增加等于焓的减少。
它适用于任何工质的可逆与不可逆绝热稳定流动过程。
3、定熵过程方程气体在管道内进行的绝热流动过程,若是可逆的,就是定熵过程。
气体的状态参数变化符合理想气体定熵过程方程式,即(7—5)对于微元可逆绝热流动过程,可写成(7—6)式(7—5),式(7-6)只适用用于比热容为定值(即k为定值)的理想气体的可逆绝热流动过程。
气体绝热节流

什么?
h
1 cp
T
v T
p
v
h hBiblioteka h0 0 0– 取决于节流前的气体状态
– 理想气体
dh
cpdT
T
v T
p
vdp
v v T T
pv RT
T不变 T降低 T增加
获得低温的方法--绝热节流
• 微分节流效应
– 三种情况的内在机理
dh du d pv 0
即du d ( pv)
– 只有低于上转化温度后,节流才降温
获得低温的方法--绝热节流
• 转化温度与转化 曲线
– 实践证明,当 p pmax 时出现一条转化温度 的曲线。
– 如节流前气体状态在 区间p 内pm,ax,则Tin"v节 T流后Tin' v产 生制冷效果。
获得低温的方法--绝热节流
思考题: • 微分节流效应、积分节流效应、等温节流
u u动 u势
– 节流后v 增加,du势 ,0但d(pv)不定
– 因此,du动 du势 也d不( p确v)定
获得低温的方法--绝热节流
• 积分节流效应:压力变化一定时,温度变化的量
T
p2 p1
hdp
h (
p2
p1)
hp
获得低温的方法--绝热节流
• 等温节流效应:
hT h1 h0
– 节流后等压升温到节 流前的温度所需的热 量
– 也即节流的制冷量, 但并非是节流装置制 冷
– 谁提供了制冷能力?
为何会制冷?
获得低温的方法--绝热节流
• 转化温度与转化曲线
– h 0 对应的温度为转化温度 Tinv
气体绝热节流膨胀制冷

1、绝热节流过程节流是高压流体气体、液体或气液混合物)在稳定流动中,遇到缩口或调节阀门等阻力元件时由于局部阻力产生,压力显著下降的过程。
节流膨胀过程由于没有外功输出,而且工程上节流过程进行得很快,流体与外界的热交换量可忽略,近似作为绝热过程来处理。
根据稳定流动能量方程:δq=dh+δw(2.1)得出绝热节流前后流体的比焓值不变,由于节流时流体内部存在摩擦阻力损耗,所以它是一个典型的不可逆过程,节流后的熵必定增大。
绝热节流后,流体的温度如何变化对不同特性的流体而言是不同的。
对于任何处于气液两相区的单一物质,节流后温度总是降低的。
这是由于在两相区饱和温度和饱和压力是一一对应的,饱和温度随压力的降低而降低。
对于理想气体,焓是温度的单值函数,所以绝热节流后焓值不变,温度也不变。
对于实际气体,焓是温度和压力的函数,经过绝热节流后,温度降低、升高和不变3种情况都可能出现。
这一温度变化现象称为焦耳-汤姆逊效应,简称J-T效应。
2、实际气体的节流效应实际气体节流时,温度随微小压降而产生的变化定义为微分节流效应,也称为焦耳-汤姆逊系数:αh=(ɑT/ɑp)2.2)αh>0表示节流后温度降低,αh<0表示节流后温度升高。
当压降(P2-P1)为一有限数值时,整个节流过程产生的温度变化叫做积分节流效应:ΔTh=T2-T1=ƒp2p1αhdp(2.3)理论上,可以使用热力学基本关系式推算出αh的表达式进行分析。
有焓的特性可知:dh=cpdT-[T(αv/aT)p-v]dp(2.4)由于焓值不变,dh=0,将上式移项整理可得:αh=(αT/αp)h=1/cp[T(αv/αT)p-v](2.5)由式(2.3)可知,微分节流效应的正负取决于T(αv/aT)p和v的差值。
若这一差值大于0,则αh>0节流时温度降低;若等于0则αh=0,节流时温度不变;若小于0则αh<0,节流时温度升高。
从物理实质出发,可以用气体节流过程中的能量转化关系来解释着三种情况的出现,由于节流前后气体的焓值不变,所以节流前后内能的变化等于进出推动功的差值:u2-u1=p1v1-p2v2气体的内能包括内动能和内位能两部分,而气体温度是降低、升高、还是不变,仅取决于气体内动能是减小、增大、还是不变。
《物理化学第4版》第一章-8 节流过程ppt课件

W2= - p2(V2) 在压缩和膨胀时体系净功的变化应该是
两个功的代数和。 W=p1V1- p2 V2
W=W1+W2=p1V1-p2V2
即 U2 U1 p1V1 p2V2
移项 U2 p2V2 U1 p1V1
H2=H1
节流过程是等焓过程。 T变而H不变:实际气体的H 不只是T 的函数。
实际气体的焓不仅是温度的函数,还是 压力p的函数,即 H= f(T,p)。
实际气体分子间有相互作用力,使得分子间 的势能对热力学能有贡献,即U=f(T,V)。
等温过程,实际气体的dU、dH不等于零。
3.焦-汤系数
JT
def
dT dp
H
JT 称为焦-汤系数(Joule-
Thomson coefficient),它表示经节流
过程后,气体温度随压力的变化率。
因为节流过程的dp<0 , 所以:
若 J-T<0,则节流后 温度升高?降低?不变? J-T>0, 节流后 温度升高?降低?不变? J-T=0, 节流后 温度升高?降低?不变?
用于制冷设备的实际气体,其J-T>0,例如氨气。
低压低温气体
p ,则T
节流过程(管内有
填充物)
冰
箱
从
外
冰
侧
箱
向
内
环
吸
境
热
放
热
高压高温气体
电冰箱工作原理示意图
T1
Q T2
由环境付出电功
§1-8 实际气体的焓和热力学能
实际气体的热力学能 U=f (T, V)
实际气体的焓
H=f (T, p)
气体的节流过程和绝热膨胀过程[1]
![气体的节流过程和绝热膨胀过程[1]](https://img.taocdn.com/s3/m/d41e8913d1f34693dbef3eac.png)
绵阳师范学院本科生毕业论文(设计)题目气体的绝热膨胀和节流过程探讨专业物理学院部物理与电子工程学院学号 04姓名李飞指导教师廖碧涛讲师答辩时间 2011年5月论文工作时间: 2010 年 11 月至 2011 年 05 月气体的绝热膨胀过程和节流过程探讨学生: 李飞指导教师: 廖碧涛摘要:目前低温技术越来越受到人们的关注,低温制冷技术已经广泛应用于气象,军事,航空航天,低温电子技术,低温医学领域等。
气体的绝热膨胀和节流过程是获得低温的两种途径。
在绝热的条件下高压气体经过多孔塞或节流阀流到低压一边的稳定流动过程称为节流过程。
测量气体在多孔塞或节流阀两边的温度表明,在节流过程前后,气体的温度发生了变化,这效应称为焦耳-汤姆逊效应,简称焦-汤效应。
这是焦耳和汤姆逊在1852年用多孔塞实验研究气体内能时发现的。
绝热膨胀是指与外界没有热量交换,但气体对外界做功,气体膨胀。
根据热力学第一定律,可证明这是等熵过程,在这个过程中气体体积增大,压强降低,因而温度降低。
所以绝热膨胀经常用于降低气体的温度,起到冷冻的效应。
本篇文章主要是对理想气体和范德瓦耳斯气体在节流过程和绝热膨胀两种过程中热力学特征以及各状态函数变化的研究,得出各状态参量的变化情况。
加深对节流过程和绝热膨胀过程的理解和认识。
节流过程和绝热膨胀过程制冷都有着各自的优点和缺点,将节流过程和绝热膨胀过程结合使用可以充分弥补各自的缺点,发挥优点,达到极好的制冷效果,获得低至1K的低温。
目前节流过程和绝热膨胀过程被广泛运用与化工生产中。
关键词低温;绝热膨胀;节流过程;焦耳一汤姆孙效应The Insulation the Expansion Process and inThe Throttling process toUndergraduate: Li feiSupervisor: Liao BitaoAbstract:At present technology has been getting refrigeration technology is widely applied to meteorological, military, the cooler the air space and technology, medicine, etc. low temperatures.Of hot gas expands and throttling process is a low temperature two ways.In the insulation of high pressure gas after the plug or throttling the valve to the stability of the low side of the current process is called the throttling process. the gas or throttling the valve in the plug on the temperature that, in the throttling process, the temperature of the gas has changed, the effect is called joule - thompson, short dark - soup joule and effect. thompson is in the membrane in the plug experimental research on the gas can find. insulation expansion is from outside world and no calories But gas to do work, expansion of gases. according to law of thermodynamics to the first, but that this is the process of entropy, volume of gas, lower pressure and temperature is lower. therefore, the insulation is often used for lowering the temperature of the gas, to freeze effect. this article is in an ideal gas and vande gas in the throttling process and the insulation the expansion process thermodynamics characteristics and the condition function That the state the throttling process and the insulation. the expansion process of refrigeration have their respective advantages and disadvantages, will the throttling process and the insulation the expansion process can be used for their faults and virtues, a chilling effect, the low temperatures. in addition, 1k in temperatures constant concern and to explore technology, The throttling process and the insulation the expansion process was widely used and chemical production.Key words:Temperatures;Insulation expansion;The throttling process Joule and tom effect.目录引言 (1)1节流过程和绝热膨胀过程 (1)节流过程 (1)节流过程的定义及特征 (1)焦耳-汤姆逊效应 (2)绝热膨胀过程 (4)绝热膨胀的定义 (4)绝热膨胀的特征 (5)2理想气体的绝热膨胀和节流过程 (6)理想气体的绝热膨胀过程 (6)理想气体的节流过程 (8)3范德瓦尔斯气体的绝热膨胀和节流过程 (8)范德瓦耳斯气体的绝热膨胀 (8)范德瓦耳斯气体的节流过程 (9)4绝热膨胀与节流过程的比较和应用 (11)绝热膨胀与节流过程的比较 (11)两种过程获得低温的优缺点 (11)绝热膨胀和节流过程的应用 (12)结束语......................................................................12参考文献 (13)致谢 (14)引言低温制冷技术在已经在各领域的到广泛应用;有研究表明,寿命与环境温度的关系非常密切,如青蛙生活在2℃的水中的寿命,比它在21℃的水中高出960倍。
物理化学 02章_热力学第一定律(三)

因为 所以
p1V1 p2V2 K
p2V2 p1V1 nR(T2 T1) W= 1 1
绝热功的求算 (2)绝热状态变化过程的功
W U CV dT
T1
T2
= CV (T2 T1)
(设CV 与T 无关)
因为计算过程中未引入其它限制条件,所以
该公式适用于定组成封闭系统的一般绝热过程, 不一定是可逆过程。
Th
D(p4 ,V4 , TC )
C (p3 ,V3 , TC )
环境对系统所作的功如
O
Tc
DA曲线下的面积所示。
a
d
b
c
V
Carnot 循环
过程4:绝热可逆压缩
p
A(p1 ,V1 , Th ) B(p2 ,V2 , Th )
D( p4 ,V4 , TC ) A( p1,V1, Th )
Th
D(p4 ,V4 , TC )
表示经节流过程后,气体温度随压 力的变化率。
J-T是系统的强度性质。因为节流过程的 dp 0 ,
所以当:
J-T >0 J-T <0 J-T =0
经节流膨胀后,气体温度降低。 经节流膨胀后,气体温度升高。 经节流膨胀后,气体温度不变。
转化温度(inversion temperature)
Qc ' Tc W Th Tc
式中W表示环境对系统所作的功。
热泵
热泵的工作原理与致冷机相仿。
把热量从低温物体传到高温物体,使高温物体
温度更高。
热泵的工作效率等于:向高温物体输送的热与
电动机所做的功的比值。
热泵与致冷机的工作物质是氨、溴化锂(氟
气体节流过程和绝热膨胀过程
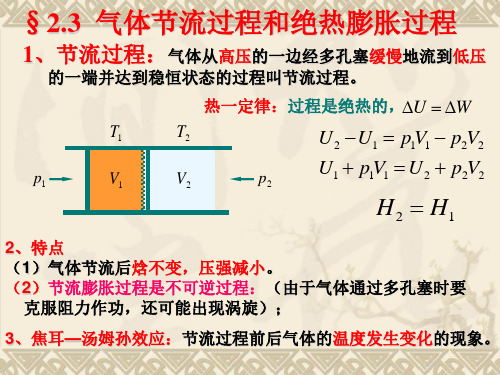
T
1
T p
H
T p
H
T H
p
H p
T
1 Cp
T
V T
p
V
对理想气体, V nR,求得 0,即理想气体节流后温
度不变。 T p p
对实际气体(如范氏气体), 的正负取决T、p取值,用实际 气体进行节流过程可获得低温。
T p
H
V Cp
T
1
T 1 0 温度不变
pdV
dH dH=Vdp+TdS
dU TdS
dU=-pdV+TdS
V A,P,m,q电荷量 p ,E,0, 电动势 12
二、绝热去磁致冷效应
忽略磁介质体积变化, 则有 dG SdT 0md ,
三、 气体自由膨胀后的温度变化
W 0 Q 0 ΔU 0 气体自由膨胀后内能不变。
dU
CV dT
T
p T
V
pdV
T ?? V U
T V
U
1 CV
T
p T
V
p
p CV
T
1
理想气体 T 0 自由膨胀后温度不变。 V U
范氏气体
p
n2a V2
V
nb
nRT
2a RT b 0 T 0
温度降低 焦耳— 汤姆逊正效应 温度升高 焦耳— 汤姆逊负效应 温度不变 焦耳— 汤姆逊零效应
(3)在某个温度 Ti 时,实际气体的 0 ,它在节流过程中的
行为与理想气体一样。对不很稠密的范德瓦耳斯气体,
Ti 2a RT 时, 0 ,Ti称为转换温度,一般情况下,这
T V
U
n2a CVV 2
0
工程热力学绝热节流
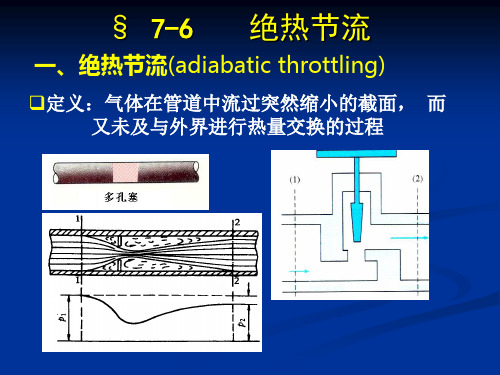
绝热节流前后参数的变化
(1) 对理想气体 1 p1h1c1
p2 h2c2
2
温度不变
焓不变
压力下降
p h c
比容增加
熵增加 注:理想气体的焓 变,温度不一定不变 绝热节流温度效应 热效应 零效应 冷效应
温度升高
温度不变
温度降低
温度效应只与气体的性质有关,与其状态无关
<0 >0 =0
产生热效应 产生冷效应 产生零效应
v T v 0 T p
v v T p T
T2 T1
转回温度(inversion temperature) —节流后温度不变的状态的温度
把气体的状态方程代入μJ表达 式即可求得不同压力下的转回 温度曲线,转回曲线(inversion curve)。 例如 理想气体转回温度为一直线; 实际气体,如用范氏方程
(3)焦耳-汤姆逊系数 (Joule-Thomson coefficient)
v 据 dh c p dT T v dp T p v T v T T p 令 dh 0 J cp p h
2a b a p 2 v b RgT 代入μJ可得 Ti Rgb 1 v v RgTi b RgTib a p 2 1 1 3 或 b 2a 2a
若令p=0,得
Ti ,max
焦耳-汤姆逊系数(也称节流微分效应)
节流 dp 0 v dT 取决于T v T p
焓的热力学 微分方程式 绝热节流过程 中焓变为零
v T( )p v T j ( ) h T p cp
气体节流膨胀和绝热膨胀的原理

心得报告题目:气体节流膨胀和绝热膨胀的原理在气体分离和液化设备中,气体节流膨胀和绝热膨胀是目前获得低温的主要方法。
一、节流过程的热力学特性工程热力学中认为,当气体在管道中流动,在遇到缩口和节流阀门时,由于局部阻力,使其压力显著下降,体积迅速膨胀,这种现象叫做“节流膨胀”。
气体经节流后,流速加大,气体内能和流动功将发生变化,又由于过程的时间较短,来不及与外界进行热量交换,一般可近似的认为节流过程是一个绝热过程,且不对外做功,气体的温度将发生一定变化。
大家知道焓(enthalpy)是某一状态下气体内能和流动功之和(H=U+PV),可以通过焓的这一定义,推导出气体在节流阀前的内能与流动功之和等于节流阀后的内能与流动功之和,也就是节流前后气体的焓值不变。
因为理想气体的焓值只是温度的函数,根据这一结论将十分清楚的告诉我们,理想气流体节流前后温度是不变的,因此对理想气体的节流研究是没有什么意义的。
由于实际气体的焓值是温度和压力的函数,那么实际气体的节流将与理想气体节流不同,实际气体节流后温度变化会有三种情况,即降温、升温、温度不变。
通常把低温液化气体节流后温度发生变化的这一现象,称之为“焦耳一汤姆逊效应” (Joule-Thomson effect )。
根据焓的定义和节流前后气体焓值不变的这一过程特性,可以得出气体节流前后内能变化等于气体流动功的变化,其关系式如下:u 1-u 2=P 2v 2-P 1v 1式中 u 1:节流前气体内能P 1:节流前气体压力v 1:节流前气体比容u 2:节流后气体内能P 2:节流后气体压力 V 2:节流后气体比容而气体的内能又由气体的内位能和内动能组成,因此气体节流功这三者的变化关系,其关系式如下:式中 T 1:节流前气体的温度u 1:节流前气体的位能T 2:节流后气体的温度u 2:节流后气体的位能C v :气体等容比热A :热功当量因为气体节流后,压力总是降低的,即比容增大,因此气体的内位能也将增大,也就是s s u u 12-为正值。
空调制冷循环的工作过程

空调制冷循环分为4个过程
1.压缩过程
蒸发器出来的低温低压的制冷剂气体,进人压缩机后被压缩成高温高压的气体。
在逆卡诺循环上是点1至点2的过程。
此时压缩机所做的功转化成制冷剂气体的内能,使之温度升高、压力增高,在热力学上称之为绝热过程。
2.冷凝过程
从压缩机出来的高温高压的制冷剂气体,进入冷凝器后,经冷却风扇的热交换作用,降低了温度,并凝结成液态制冷剂。
制冷剂液化时所放出的热量由冷却风将热量排到室外。
液化时制冷剂温度降低但压力不变,在热力学上称之为等压过程。
3.节流过程
从冷凝器出来的低温高压的制冷剂液体,流经又细又长的毛细管后,压力将大大下降,温度也略有降低,流量也减少了。
因此被称为节流过程。
节流的目的是为了降低制冷剂的压力,从而获得较低的蒸发温度。
4.蒸发过程
从毛细管出来的低温低压的制冷剂液体,进入蒸发器后经室内风扇的热交换作用,吸收了热量,从而由液态蒸发成气态。
这吸收的热量变成了制冷剂的潜热,虽然温度上升不大,但内能增加很多。
由于压缩机的做功,使制冷剂不断地在液态-气态间转变,从而不断地把室内的热量转移到室外去,因此制冷剂起到“搬运工”的作用。
从这个意义上说,空调器制冷的原理就是不断把室内热量移到室外去,从而使室内温度降下来。
理想气体绝热节流

理想气体绝热节流
理想气体绝热节流是指稳态稳流的流体快速流过狭窄断面,来不及与外界换热也没有功量的传递的过程。
绝热节流前后焓相等,即能量数量相等,理想气体在绝热节流前后的温度是不变的。
实验发现,实际气体节流前后的温度一般会发生变化,这种现象叫焦耳-汤姆逊效应(简称焦-汤效应),造成这种现象的原因是因为实际气体的焓值不仅是温度的函数,而且也是压力的函数。
在实际的工程应用中,由于气体经过阀门等流阻元件时,流速大时间短,来不及与外界进行热交换,可近似地作为绝热过程来处理,称为绝热节流。
理想气体的绝热节流过程在工程热力学中也有广泛的应用。
如果你想了解更多关于理想气体绝热节流的信息,可以继续向我提问。
节流过程
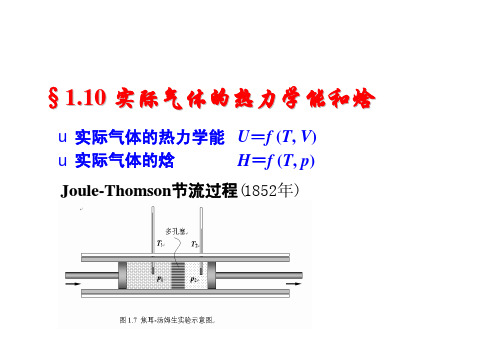
选µJ-T 的值大的气体为工作介质。 氟利昂 氨(从环保角度考虑)
定压过程的气体通过多孔塞进入右侧后变为体积vt变而h不变
§1.10 实际气体的热力学能和焓
u实际气体的热力学能 U=f (T, V) u实际气体的焓 H=f (T, p) Joule-Thomson节流过程(1852年)
Sy(1) 左:定压过程
Sy(2) 右:定压过程
设在左侧为V1的气体,通过多孔塞进入右侧 后变为体积V2。即左侧△V= V1,右侧△V= V2。 则:W1= - p1(- V1)= p1V1, 右:W2= - p2(V2) W=p1V1- p2 V2
W=p1V1- p2 V2
绝热过程 ∆U=W U2-U1=p1V1- p2V2 U2+p2V2=U1+p1V1 H2=H1 定焓过程
T变而H不变:真实气体的H 不只是T 的函数。
实际气体的焓 H=f (T, p) :
常温下,压力不是很大时,大多数气体节流膨胀 后降温:
p ↓, 则T ↓
用途?
( H2 , He, Ne 例外 )
p ↓, 则T ↓
T1Qຫໍສະໝຸດ T2由环境付出电功
●J-T系数
µ J -T def ∂ T ∂p H
在等焓的条件下,节流过程中温度随压力的变化率。 因 dp<0,如 µJ-T<0, 流体节流后温度: 上升 µ J-T>0, 流体节流后温度: 下降 µ J-T=0, 流体节流后温度: 不变
ch.2-3 气体的节流过程和绝热膨胀过程

运行结果:
v = 0. .500/(.267e12*T-.225e15)*(-.174e11+.599e9*T^(1/2)) .500/(.267e12*T-.225e15)*(-.174e11-.599e9*T^(1/2))
有三个根。
③ 将合理的解代入范德瓦尔斯方 程,求 p-T 关系,并绘图。
T S S C p p T T p
V VT 利用麦氏关系,有 T T 0 Cp p S C p T p
T T V VT 0 Cp p S C p T p
二、绝热膨胀过程
如果把绝热膨胀过程近似看作是准静态的,则过程 中气体的熵保持不变。因此,绝热膨胀过程也称为等熵过 程。 S S dS 由 dT dp 0
T p
p T
可得
T S p S p T
可改写为
或
U2-U1=p1V1-p2V2 U2+p2V2=U1+p1V1
H2 = H1
(2.3.1)
上式说明,气体在节流前后的两个状态的焓值相等。 要注意的是,尽管气体的流动足够缓慢,节流过程也不能 认为是无摩擦的准静态过程。由于气体经历的是一系列的 非平衡态,焓是没有定义的。所以,(2.3.1)式只表示节流 过程的初态和终态的焓值,并非指整个节流过程中焓值不 变。
② 令焦耳-汤姆逊系数等于零,求体积v。 (ex44332)
v=vpa(solve('-.481e-1/(-8.31*T/(v-.386e-4)^2+.270/v^3)*(8.31*T/(v.386e-4)+v* (-8.31*T/(v-.386e-4)^2+.270/v^3))=0','v'),3)
ch.2-3 气体的节流过程和绝热膨胀过程

二、绝热膨胀过程
如果把绝热膨胀过程近似看作是准静态的,则过程 中气体的熵保持不变。因此,绝热膨胀过程也称为等熵过 程。 S S dS 由 dT dp 0
T p
p T
可得
T S p S p T
可改写为
或
U2-U1=p1V1-p2V2 U2+p2V2=U1+p1V1
H2 = H1
(2.3.1)
上式说明,气体在节流前后的两个状态的焓值相等。 要注意的是,尽管气体的流动足够缓慢,节流过程也不能 认为是无摩擦的准静态过程。由于气体经历的是一系列的 非平衡态,焓是没有定义的。所以,(2.3.1)式只表示节流 过程的初态和终态的焓值,并非指整个节流过程中焓值不 变。
● 程序(ex4433)
① 计算焦耳-汤姆逊系数的表达式(ex44331)
syms R T a b v p dp_dT dp_dv Cp ; p=R*T/(v-b)-a/v^2; dp_dT=diff(p,T); dp_dv=diff(p,v); mu=-1/Cp/dp_dv*(T*dp_dT+v*dp_dv); a=0.1350; b=0.03868e-3; %取N2气的修正系数值 R=8.31; Cp=5*R/2; mu=vpa(subs(mu),3) 运行结果: mu=-.481e-1/(-8.31*T/(v-.387e-4)^2+.270/v^3)*(8.31*T/(v-.387e-4)+v*(8.31*T/ (v-.387e-4)^2+.270/v^3))
R p 可求得 T V v b
RT a p 2 v b v
RT 2a p 3 2 v V T (v b)
第六章 气体与蒸汽的流动(绝热节流过程)

p1h1c1 1
p2h2c2 2
绝热节流过程前后的焓相等, 但整个过程绝不是定焓过程。
h
在缩孔附近,流速 ,焓
c
绝热流动的能量方程式
q
h wt
h2
h1
1 2
(c22
c12 )
g(z2
z1) ws
h2
h1
1 2
(c22
c12 )
通常情况下,节流前后流速差别不大,即c2 = c1 h2 h1
M=1 dA=0 临界截面
M>1 dA>0 渐扩
M<1 M>1 dA<0 dA>0 渐缩渐扩
注:扩压管dc<0,故不同音速下的形状与喷管相反
喷管和扩压管流速变化与截面变化的关系
流动状态
M<1
管道种类
渐缩渐扩扩喷管 M<1转M>1
M>1 渐缩渐扩扩压管
M>1转M<1
喷管 dc>0 dp<0
1
2
dA 0 A
(1)绝热节流后蒸汽的温度; (2)节流过程的熵变; (3)节流的有效能损失,并将其表示在T-S图上; (4)由于节流使技术功减少了多少?
例题
4、理想气体从初态1(p1,t1)进行不同过程到相同终压p2,一过程为经过喷 管的不可逆绝热膨胀过程,另一过程为经过节流阀的绝热节流过程。若 p1>p2>p0,T1>T0(p0、T0为环境压力与温度),试在T-s图上表示此两 过程,并根据图比较两过程作功能力损失的大小。
证明:理想气体微分节流系数μJ =0.
pv RT
v RT p
( v T
)p
R p
工程热力学试卷与答案

一、是非判断:是在()内画“+”号,非在()内画“—”号,每题1分,共10分1、热力系是指所有参与热力过程的物体群()。
2、绝热闭口系的熵增就是孤立系的熵增()。
3、状态方程是描述状态参数之间关系的方程()。
4、平衡状态是指在没有外界作用的条件下,热力系宏观性质不随时间变化的状态()。
5、通用气体常数对实际气体和理想气体都是一个不变的常数()。
6、工质经过不可逆过程的熵变必然等于经历可逆过程的熵变()。
7、理想气体的热力学能、焓和熵都仅仅是温度的单值函数()。
8、理想气体绝热节流后温度不变()。
9、在φ=1时,干球温度t湿球温度tw 和露点温度td不相等()。
10、任何动力循环,循环净功w0总等于循环净热量q0,即总有w0=q0()。
二、选择填空:每题1分,共10分1、绝热系与外界没有()交换。
A、热量B、物质C、功2、在所列的压力中哪个不是状态参数().A、绝对压力B、分压力C、表压力3、功损来自于().A、不等温传热B、物质交换C、运动摩擦4、不可逆损失来源于()。
A、运动摩擦B、不等温传热C、任何耗散效应5、干度χ的取值可以是().A、χ=1B、χ>1C、χ〈16、渐缩喷管出口气体的流速是()。
A、M〈1B、M〉1C、M=17、不可逆循环的熵产必然是()。
A、等于零B、大于零C、小于零8、卡诺热机效率比实际热机效率()。
A、小B、二者相等C、大9、制冷系数ε可以是()。
A、大于1B、等于1C、小于110、供热系数ζ可以是()。
A、大于1B、等于1C、小于1三、指出下列各对概念之间主要的区别每题2分,共10分1、理想气体与实际气体2、定容比热与容积比热3、可逆过程与不可逆过程4、熵流与熵产5、饱和湿蒸气与饱和湿空气四、某容器被一刚性壁分成两部分,在容器的不同部位安装有压力表,如下图所示。
压力表B上的读数为75kPa,压力表C上的读数为0.11MPa。
如果大气压力为97kPa,试确定压力表A上的读数及容器两部分内空气的绝对压力。
5 绝热,节流,反应进度

Porous plug (throttle valve)
过程特点: 气体(p1, V1)
节流
气体(p2, V2)
p1
p1, V1
p2
p1
p2, V2
p2
U W p1V1 p2V2
即
p1 (0 V1 ) p2 (V2 0)
U2 U1 p1V1 p2V2 U2 p2V2 U1 p1V1 H1 H 2
(3) 值与B的选择无关而与方程式的写法有关
注:通常所说的反应热均指 =1mol时反应 系统吸收或放出的热量
二、反应热 (Heat of reaction)
定义:在等温且无非体积功的条件下,反 应系统吸收或放出的热量。
等容反应: 等压反应:
U rU m H r H m
(5) 在p~V图上,同一点处 p 的绝热线比等温线更陡。 所以:
等T,r Q=0,r
Wr ,Q0 Wr ,T
2. 过程方程
dU δ Q δ W
若Q=0 若W’=0
V1
V2
V
dU 外dV dU pdV nRT CV dT dV V
CV nR dT dV T V
CV dln{T } nRdln{ V}
CV dln{T} (CV Cp )dln{ V}
dln{T } (1 )dln{ V}
若 =const.
Cp CV
绝热指数
dln{T } dln{ V 1}
dln{TV 1} 0
H 为非理气物质求 p 提供了一种方法。 T
§2-7 第一定律对于化学反应的应用——热化学 (Thermochemistry) 热化学:反应热的测量与计算 反应热与反应进行的多少有关 一、化学反应进度 (Extent of reaction) 任意反应写作 0 BB
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、绝热节流过程
节流是高压流体气体、液体或气液混合物)在稳定流动中,遇到缩口或调节阀门等阻力元件时由于局部阻力产生,压力显著下降的过程。
节流膨胀过程由于没有外功输出,而且工程上节流过程进行得很快,流体与外界的热交换量可忽略,近似作为绝热过程来处理。
根据稳定流动能量方程:
δq=dh+δw(2.1)
得出绝热节流前后流体的比焓值不变,由于节流时流体内部存在摩擦阻力损耗,所以它是一个典型的不可逆过程,节流后的熵必定增大。
绝热节流后,流体的温度如何变化对不同特性的流体而言是不同的。
对于任何处于气液两相区的单一物质,节流后温度总是降低的。
这是由于在两相区饱和温度和饱和压力是一一对应的,饱和温度随压力的降低而降低。
对于理想气体,焓是温度的单值函数,所以绝热节流后焓值不变,温度也不变。
对于实际气体,焓是温度和压力的函数,经过绝热节流后,温度降低、升高和不变3种情况都可能出现。
这一温度变化现象称为焦耳-汤姆逊效应,简称J-T效应。
2、实际气体的节流效应
实际气体节流时,温度随微小压降而产生的变化定义为微分节流效应,也称为焦耳-汤姆
逊系数:
αh=(ɑT/ɑp)2.2)
αh>0表示节流后温度降低,αh<0表示节流后温度升高。
当压降(P2-P1)
为一有限数值时,整个节流过程产生的温度变化叫做积分节流效应:
ΔTh=T2-T1= p2p1αhdp(2.3)
理论上,可以使用热力学基本关系式推算出αh的表达式进行分析。
有焓的特性可知:
dh=cpdT-[T(αv/aT)p-v]dp(2.4)
由于焓值不变,dh=0,将上式移项整理可得:
αh=(αT/αp)h=1/cp[T(αv/αT)p-v](2.5)
由式(2.3)可知,微分节流效应的正负取决于T(αv/aT)p和v的差值。
若这一差值大于0,则αh>0节流时温度降低;若等于0则αh=0,节流时温度不变;若小于0则αh<0,节流时温度升高。
从物理实质出发,可以用气体节流过程中的能量转化关系来解释着三种情况的出现,由于节流前后气体的焓值不变,所以节流前后内能的变化等于进出推动功的差值:
u2-u1=p1v1-p2v2
气体的内能包括内动能和内位能两部分,而气体温度是降低、升高、还是不变,仅取决于气体内动
能是减小、增大、还是不变。
因气体节流后压力总是降低,比容增大,其内位能总是增大的。
由于实际气体与玻义耳定律存在偏差,在某个温度下节流后,pv值的变化可能有以下3种情况:
①p1v1
②p1v1=p2v2时u2=u1即节流后内能不变。
此时,内位能的增加等于内动能的减少,节流后气体温度仍然降低。
③p1v1>p2v2时u2>u1即节流后内能增大。
此时,若内能的增加小于内位能的增加,则内动能是减小的,温度仍是降低;若内能的增加大于内位能的增加,则内动能必然要增大,温度要上升。
由以上分析可知,在一定压力下,气体具有某一温度时,节流后满足
p1v1>p2v2且pv值的减少量恰好补足了内位能的增量,这时节流前后温度不变,即微分节流效应等于0,这个温度称为转化温度,以Tinv表示。
转化温度的计算和变化关系可根据式(2.5),令αh=0得到。
下面利用范得瓦尔方程予以分析。
2a/9Rb(2±)
将范德瓦尔方程p=RT/v-b-a/v2在等压下对Ti求导得出(αv/αT)p后代入式(2.5)得:
Αh=(αv/αT)h=(1/cp)(2a(1-b/v)2-RbT)/(RT-2a/v(1-b/v)2)(2.6)
当αh=0时,气体温度即为转化温度。
与范德瓦尔方程联立求解得:
Tinv=2a/9Rb(2±√1-(3b2/a)p)2(2.7)
式(2.7)表示的转化温度和压力的函数关系在坤图上为一连续曲线,称为转化曲线。
如图2.11所示,虚线是按式(2.7)计算得到,实线是通过实验得到。
二者的差别是由范德瓦尔方程在定量上的不准确引起的。
转化曲线存在一个最大转化压力pmax。
当p>pmax时,不存在转化温度;当p=pmax时,只有一个转化温度;当p0,节流后产生冷效应。
从式(2.7)和图2.11中还可以得出p=0对应气体的最大转化温度Tmax。
表2.5列出了多种气体的最大转化温度。
对于大多数气体,如02,N2,,CO,空气等,最大转化温度都高
于环境温度,故在环境温度下可以利用焦耳-汤姆逊效应来降温。
而Ne,H2,He 的最大转化温度比室温低,不能单独用焦耳-汤姆逊效应降温,必须通过预冷或其他膨胀机来降低节流前的温度,节流后才会产生冷效应。
